Анодная защита от коррозии кузова автомобиля: Катодная защита автомобиля от коррозии своими руками 🦈 avtoshark.com
Содержание
Защита от коррозии кузова (катодная защита).
Защита от коррозии кузова (катодная защита).
Теория и практика установки на автомобиль магниевых жертвенных анодов. Они разрушаются, а кузов перестает ржаветь.
Коррозия – основной враг металлоконструкций. Рассмотрим применение электрохимической протекторной защиты.
Наиболее применима в настоящий момент защита методом «оцинковки». Однако этот способ при ремонте сложно применим и дорогостоящ,
и вообще не применим к готовым покрашенным конструкциям. Интерес вызвал катодно-протекторный способ защиты с «жертвенными» анодами.
К готовой конструкции прикрепляем эти аноды и коррозируют они, а конструкция перестаёт ржаветь. Способ издавна применяют в судостроении.
Сначала немного теории:
Коррозия ни что иное как электрохимическая реакция на поверхности металлоконструкции. Электрохимическая защита, должна создать
Электрохимическая защита, должна создать
на поверхности защищаемой конструкции электрический потенциал препятствующий этой реакции. Оптимальный защитный потенциал для
металлоконструкции из низколегированной стали 0,85В при выходе из диапазона от 0,75 до 1,05В, начинается коррозия
(ориентировочная плотность тока защиты 0,04А/м2), повышение потенциала выше 1,05В приведет к отслоению лакокрасочного покрытия.
По сути, управляем направление движения электронов. Необходимо обеспечит направление от «жертвенного» анода к защищаемой
металлоконструкции.
Из чего сделать «жертвенный» анод? Рассмотрим электрохимический ряд активности доступных металлов:
- Следовательно:
- Медные детали на металлоконструкции недопустимы (например медные трубки тормозных магистралей)! Сдвигают электрический потенциал конструкции в положительную область и
«жертвенным» анодом становится сама металлоконструкция.
- Цинк – хороший вариант при покрытии большими площадями, но из-за небольшой разницы в электрохимическом потенциале с железом
плохо применим в качестве «жертвенного» анода в протекторной защите на воздухе. Т.е. хорош в качестве покрытия, но слаб для точечного
применения. - Остаётся алюминий и магний. (Получается, что алюминиевые силовые конструкции, например вытяжные заклёпки, не стоит применять
в стальных металлоконструкциях в агрессивных средах.) Магний значительно активнее и следовательно более предпочтителен для
«жертвенного» анода.
- электростамеска
- ножовка по металлу
- дрель
Инструменты:
- магниевый анод для водогрейных котлов (продаётся в магазинах сантехники)
- резиновые прокладки для водопроводных кранов
- самозасверливающиеся саморезы по металлу
Материалы:
-
Материалы, которые будем использовать:
-
Нарезаем магниевый анод дольками по 5-6 мм и сверлим отверстие под саморез.

-
Собираем комплекты «жертвенных» анодов из расчета 6 на один борт.
-
Устанавливаем аноды под порогами автомобиля:
-
Прошел год:
Насколько снизилась коррозия сказать сложно, но через год эксплуатации аноды частично разрушились (похоже еще год выдержат и под замену):
Порядок выполнения работ:
Ссылки по теме
- Электрохимический ряд активности металлов.
- Катодная защита.
- Схемы размещения протекторов ‘Анодъ’ на автотранспорте.
Комментарии к статье:
Гость2019-02-25 17:16:19саморез не смог защититьГость2019-02-25 17:16:39Саморез проржавелАдмин2019-03-10 09:58:16Согласен, саморез поржавел. Но если посмотреть внимательно, только та чать, что закручена в полость (за резинкой). Головка самореза чистая, значит защищает там где есть контакт жидкости между магнием и сталью.Гость2019-03-20 04:34:08Крепитесь анод без резинки так крепят на лодках и катерах и будет Вам счастье.Гость2020-11-07 21:51:12Нельзя использовать стальной саморез!Админ2020-12-03 08:27:41Интересно, а какие саморезы еще бывают:)
Но если посмотреть внимательно, только та чать, что закручена в полость (за резинкой). Головка самореза чистая, значит защищает там где есть контакт жидкости между магнием и сталью.Гость2019-03-20 04:34:08Крепитесь анод без резинки так крепят на лодках и катерах и будет Вам счастье.Гость2020-11-07 21:51:12Нельзя использовать стальной саморез!Админ2020-12-03 08:27:41Интересно, а какие саморезы еще бывают:)
В. В. Бородин «Защита автомобиля от коррозии электрохимическим способом»
Оглавление
1.
Механизм
корозии корпуса автомобиля.
2.
Корозия
автомобиля во время эксплуатации и
пассивные методы борьбы с ней.
3.
Корозия
автомобиля на открытой стоянке.
4.
Корозия
автомобиля при хранении в гараже.
5.
Корозия
движущегося автомобиля.
6.
Протекторная
защита от корозии.
7.
Электрохимическая
защита от корозии.
8.
Устройство
для электрохимической защиты кузова
автомобиля от корозии.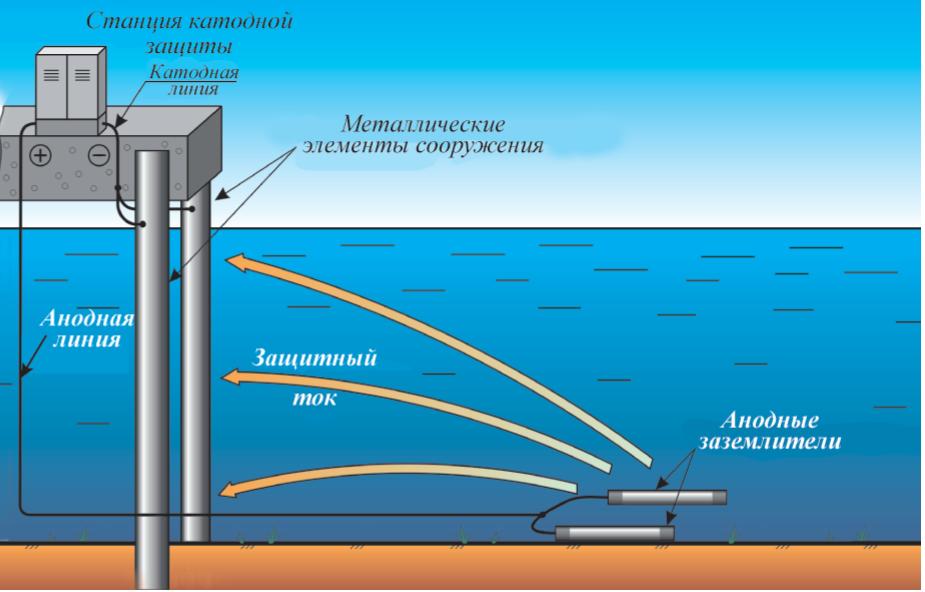
9.
Правила
установки и эксплуатации устройства.
10.
Электрохимическая
защита.
11.
Защита
поврежденных в результате аварии частей
кузова.
12.
Заключение
Приложения.
13.
Приложение 1.
Скрытые полости автомобиля.
14.
Приложение 2.
Использование защитных покрытий для
предотвращения корозии кузова автомобиля.
Прежде чем пытаться
защититься от коррозии, необходимо
ответить на вопрос о том, что же такое
коррозия металла. В обиходе коррозией
называют появление ржавчины на поверхности
металла. Каковы же основные механизмы
появления ржавчины?
Необходимо
признать, что до настоящего времени
полного ответа на этот вопрос нет, а
результаты проводимых исследований
показывают, что процесс коррозии является
очень сложным, поскольку на его протекание
оказывает влияние большое число факторов
— химический состав металла среда, в
которой он находится температура
давление наличие газов и т. д. По этой
д. По этой
причине в книге изложены только самые
начальные сведения из теории коррозии,
знание которых необходимо для правильной
защиты корпуса автомобиля. Более полное
представление о механизмах коррозии
читатель может почерпнуть из рекомендуемой
литературы.
Коррозия железа (а именно
этот процесс мы будем рассматривать в
дальнейшем) осуществляется, если
дополнительно имеются, по крайней мере,
еще две составляющие электролит, с
которым граничит железо, и другой
проводник, также граничащий с электролитом.
Электролитом в обычных условиях является
дождевая вода атмосферная влага снег,
дорожная грязь. Вторым, по отношению к
кузову автомобиля проводником чаще
всего является поверхность земли,
атмосфера, какой либо другой внешний
проводник, расположенный вблизи
автомобиля. Два проводника (которые в
данном случае называются электродами)
погруженные в электролит образуют так
называемый гальванический элемент.
Основное свойство гальванического
элемента состоит в том, что если электроды
выполнены из различных металлов, то
такой элемент является источником
напряжения. При этом положительный,
При этом положительный,
электрод называется анодом отрицательный
— катодом.
Проделайте простой
эксперимент. В стакане теплой воды
растворите ложку поваренной соли и
опустите две пластины — одну медную
другую стальную. Простейший источник
напряжения готов. С помощью вольтметра
можно легко убедиться в том, что
гальванический элемент создает небольшое
менее полувольта напряжение. Если вы
продолжите эксперимент несколько дней,
то заметите как на поверхности стали
начнет появляться ржавчина
Этот простой
эксперимент наглядно демонстрирует
механизм коррозии металла. Объяснение
этого механизма состоит в следующем.
Из
курса физики известно, что проводники
характеризуются способностью отдавать
электроны во внешнюю среду. Наглядно
можно представить, что каждый проводник
окружен облаком из электронов, которые
под действием тепловой энергия вылетают
из него, а затем, если им ничто не мешает,
под действием электрических сил
возвращаются в проводник. Если металл
поместить в электролит, то положительные
ионы металла (т. е. те атомы металла,
е. те атомы металла,
электроны которых находятся во внешней
среде) начнут переходить в электролит.
В результате этого металл приобретает
некоторый потенциал, который может быть
измерен. На практике потенциал металла
определяют по отношению к специальному
стандартному электроду потенциал
которого принимается равным нулю.
Полученная разность потенциалов между
стандартным электродом и металлом
получила название стандартного
электродного потенциала (СЭП).
Ниже
приведены стандартные электродные
потенциалы некоторых металлов,
расположенные в порядке снижения их
активности, т.е. чем более отрицательным
является СЭП
тем выше активность металла.
Стандартные
электродные потенциалы металлов, В
Магний | -2,38 | Танталл | -0,34 |
Алюминий | -1,66 | Никель | -0,24 |
Марганец | -1,18 | Молибден | -0,2 |
Хром | -0,91 | Свинец | -0,13 |
Цинк | -0,76 | Медь | 0,34 |
Железо | -0,44 | Серебро | 0,8 |
Кадмий | -0,4 |
|
|
Наибольший интерес
представляет процесс коррозии железа
в электролите при наличии менее активного
металла.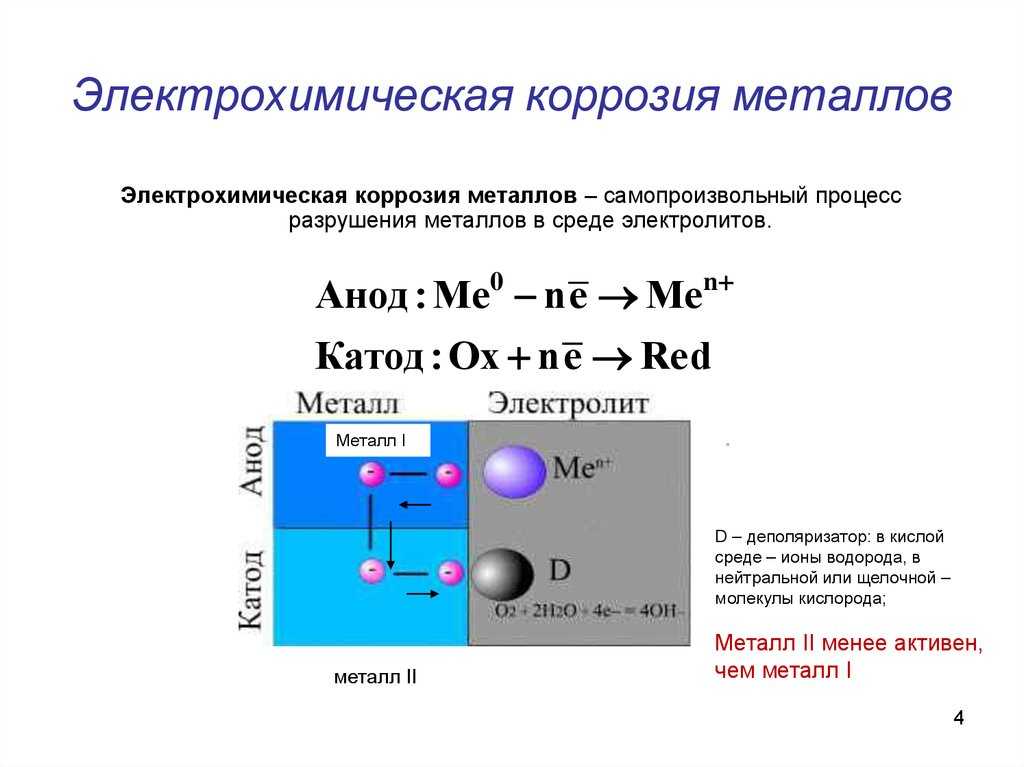 В этом случае железо как более
В этом случае железо как более
активный металл является анодом
а менее активный — катодом. В гальванической
паре всегда корродирует более активный
металл — анод.
Коррозия анода
сопровождается двумя видами реакций —
окислительной на аноде и восстановительной
на катоде. В дальнейшем для определенности
в качестве анода рассмотрим железо
(Fe), однако все результаты относительно
его коррозии справедливы, по крайней
мере
качественно для любого ранее названного
металла.
Окислительная реакция может
быть представлена как процесс
при котором атомы железа отдают два
электрона и вследствие этого превращаются
в положительно заряженные ионы железа
(Fе2+),
которые переходят в раствор электролита
в месте контакта его с анодом. Указанные
два электрона сообщают аноду отрицательный
заряд и тем самым вызывают ток по
направлению к катоду, где соединяются
с положительными ионами. Одновременно
положительные ионы анода соединяются
с отрицательно заряженными гидроксильными
группами (ОН
), которые
всегда присутствуют в растворе
электролита.
Схематически реакция
на аноде может быть записана в следующем
виде:
Fe + 20Н—
= Fe2+
+ 2е + 20Н— =
Fe(OH)2
+ 2е.
Под действием
ионов железа на катоде возникают ионы
водорода (Н+),
с которыми и соединяются электроны
анода. Схематически этот процесс
описывается в следующем виде:
Н+
+ 2е = 2Н = Н2
т.е. на катоде
происходит выделение водорода.
Если
анодная и катодная реакции объединяются,
они приводят к общей реакции коррозии
Fе + 2Н20
= Fе(ОН)2
+ Н2
Таким образом,
железо в сочетании с водой и менее
активным металлом переходит в гидроокись
железа, которая в обиходе и называется
ржавчиной.
Наличие в воде дополнительной
соли приводит к повышению проводимости
электролита и, как следствие, к увеличению
скорости окисления анода. При этом
дополнительно образуются хлорное железо
и раствор соляной кислоты. Вот такие
Вот такие
условия создают автолюбителям каждую
зиму наши дорожники. Впрочем, кислотные
дожди, которые выпадают с осадками,
также не способствуют долголетию
автомобиля.
Важной характеристикой
коррозии является скорость коррозии,
которая определяется как глубина
проникновения коррозии в металл в
единицу времени. Для железа наиболее
характерным является значение скорости
коррозии в пределах 0,05—0,02 нм/год. Из
приведенных значений скорости коррозии
следует, что при нарушении лакокрасочного
покрытия за 5 лет эксплуатации автомобиля
толщина металла может уменьшиться на
0,25—1 мм, т е., по сути дела, если не
предусмотреть специальных мер защиты,
металл проржавеет, что называется,
насквозь.
Описанный механизм коррозии
указывает также на основные пути борьбы
с этим явлением. Кардинальный путь
состоит в устранении катода или
электролита, однако, этот способ и
наименее пригоден, поскольку автомобиль
не может быть изолирован от окружающей
среды и, в частности, от поверхности
земли. Остаются два пути — изолировать
металл от электролита с помощью покрытия
или превратить корпус автомобиля из
анода в катод.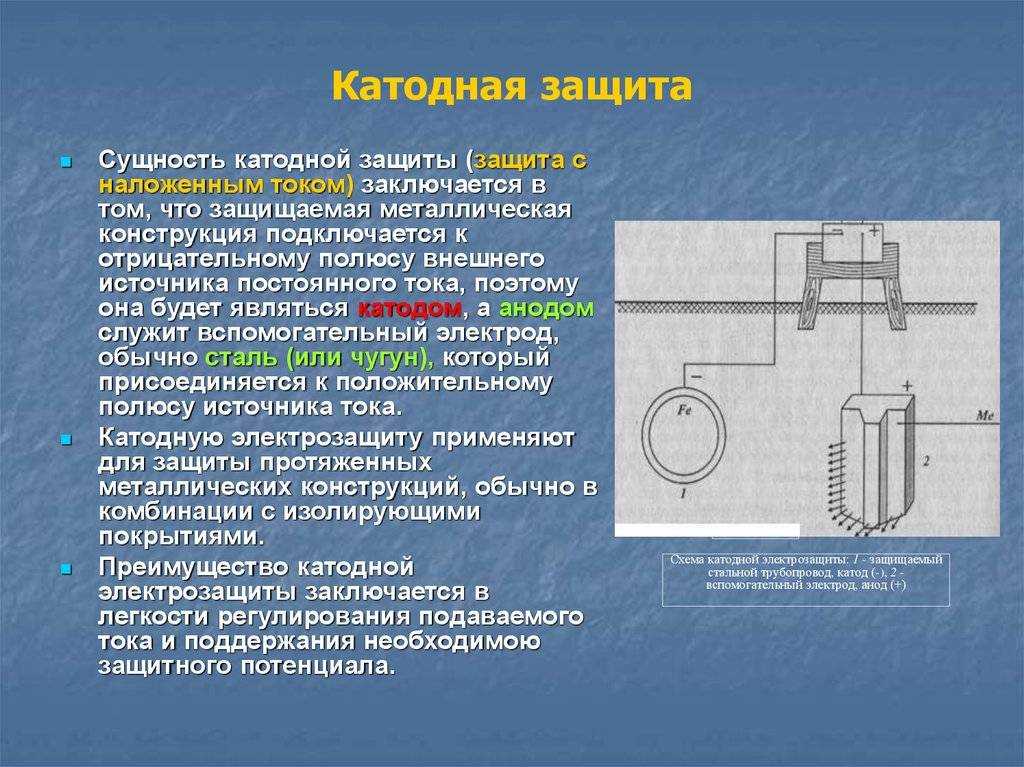
Первый способ известен
всем автолюбителям и широко используется
на практике, однако он не прекращает
коррозии как таковой, а только защищает
металл от ржавления. При нарушении
лакокрасочного покрытия коррозия
начинается разъедать металл, а повторное
нанесение покрытия сопряжено с большими
временными и материальными затратами
(прил. 1, 2).
Наиболее уязвимыми частями
корпуса автомобиля при этом являются
скрытые полости и щели, такие, как пороги,
внутренние балки, лонжероны, стойки,
внутренние поверхности дверей, потолок,
да практически весь корпус автомобиля
(см.
прил. 1). Сложная форма скрытых щелей и
полостей затрудняет, а чаще делает
невозможным качественную подготовку
поверхности под окраску и саму окраску,
а внутренние напряжения изогнутого в
этих местах металла способствуют его
интенсивной коррозии. В этих условиях
срок службы кузова легкового автомобиля
до выхода его из строя составляет 6
лет.
Вместе с тем, не отрицая важности
регулярного восстановления лакокрасочного
покрытия, автор обращает внимание на
принципиально иной метод защиты корпуса
автомобиля от коррозии, а именно, полное
прекращение самого процесса коррозии
путем изменения потенциала корпуса.
Этот метод в литературе называется
катодной защитой.
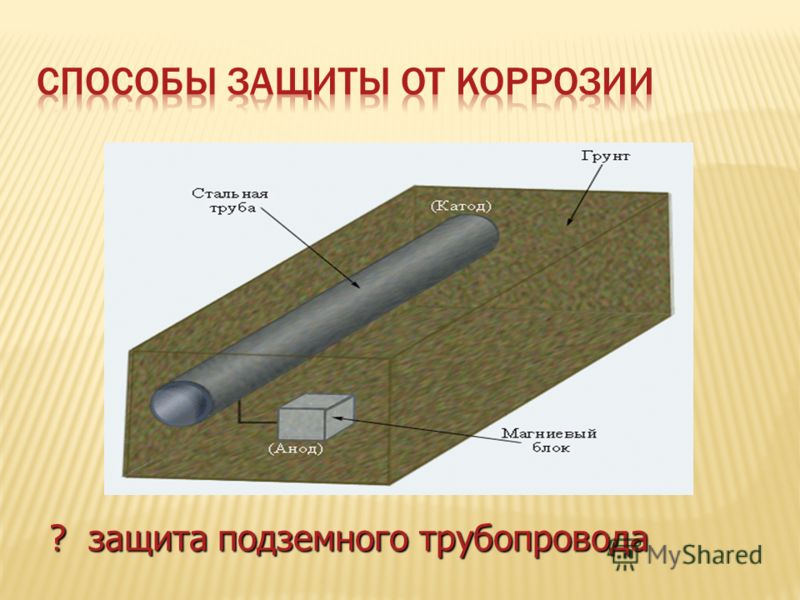
Катодная защита
металлов основана на том, что скорость
коррозии пропорциональна активности
металлов, образующих гальваническую
пару. В обычных условиях корпус автомобиля
является анодом и поэтому корродирует.
Если же изменить потенциал корпуса
относительно внешней среды либо с
помощью внешнего источника напряжения
либо приведя в контакт с более активным
металлом, то сам корпус автомобиля
станет катодом и корродировать вообще
не будет (по крайней мере
скорость коррозии уменьшится в сотни
раз), а разрушаться станет анод. В
соответствии со способом изменения
потенциала защищаемого металла различают
протекторную и электрохимическую
защиту. Однако прежде чем рассматривать
методы защиты, целесообразно описать
особенности коррозии автомобиля в
различных условиях его эксплуатации.
Гальваническая коррозия и перекрестное загрязнение
Использование разнородных металлов в автомобильной промышленности вызывало озабоченность с момента ее зарождения, когда производитель автомобилей прикрепил алюминиевую фурнитуру к стальному кузову только для того, чтобы потом увидеть, как она подвергается коррозии.
Хотя у меня есть большой интерес к металлам, я хотел бы заявить, что я не химик, инженер, металлург или профессор. Я мастер по ремонту после столкновений, у меня есть мастерская по ремонту после столкновений, и я проявляю большой интерес к большинству технических вещей. В старших классах двумя моими любимыми предметами были геометрия и химия. Как оказалось, оба эти предмета играют заметную роль в устранении столкновений.
Независимо от того, вызывали у вас когда-либо интерес те же самые темы или нет, я думаю, вы согласитесь со мной, что если мы поймем, как и почему что-то работает или было разработано для работы, мы добьемся большего успеха, когда дело дойдет до ремонта. И я думаю, вы обнаружите, что эта общая философия применима к большинству ситуаций, связанных с ремонтом автомобилей. Если мы потратим всего несколько минут на то, чтобы диагностировать ситуацию и понять, почему что-то происходит именно так, как оно есть, мы уменьшим нашу подверженность неудачам и сделаем эти несколько минут диагностического анализа вполне оправданными.
Так что имейте в виду, что комментарии, наблюдения и замечания, которые следуют, принадлежат человеку с 44-летним практическим ежедневным опытом и достаточным любопытством, чтобы исследовать и вникать в технические аспекты моих наблюдений. Это то, что может произойти, когда уровень гормонов снижается, и секс или мысли о сексе перестают занимать большую часть вашего умственного процесса, а алкоголь также остается лишь далеким воспоминанием (29 лет в декабре прошлого года). Разум свободен вникать в важные жизненные вопросы… например, в гальваническую коррозию.
Что это за чертовщина?
Гальваническая коррозия, иногда ошибочно называемая электролизом, является результатом реакции по меньшей мере между двумя разнородными металлами, находящимися в электрическом контакте друг с другом в присутствии электролита. Проявлением этого является белая порошкообразная коррозия, которая образуется на поверхности алюминиевой детали в месте ее контакта со стальной деталью. Это обычно приводит к образованию пузырей на краске и портит алюминий. Многие другие металлы подвержены гальванической коррозии, но в нашей промышленности основными металлами, поражаемыми этой болезнью, являются алюминий, цинк и магний.
Это обычно приводит к образованию пузырей на краске и портит алюминий. Многие другие металлы подвержены гальванической коррозии, но в нашей промышленности основными металлами, поражаемыми этой болезнью, являются алюминий, цинк и магний.
Хорошим примером гальванической коррозии является то, что произошло в 1970-х годах, когда Ford Motor Company производила бамперы из хромированной стали с привинченными к ним алюминиевыми усилениями. Затем Ford прикрутил сборку болтами к рогам рамы своего автомобиля, используя прокладки из жесткой бумаги в качестве изоляторов между усилением и кронштейнами рамы. У вас был электрический контакт между внешней лицевой планкой и алюминиевой арматурой. Более того, после первого крушения ремонтники, в том числе и я, смотрели на эти жесткие бумажные изоляторы и думали: «Эти ребята такие дешевые, они не могут дать нам даже настоящих металлических прокладок!» а затем выбросил их в мусорный контейнер, потому что бампер идеально подходил без бумажных прокладок. Мы думали, что они все равно промокнут. Но, выбросив эти бумажные прокладки, мы создали электрический контакт между рамой и алюминиевой арматурой.
Мы думали, что они все равно промокнут. Но, выбросив эти бумажные прокладки, мы создали электрический контакт между рамой и алюминиевой арматурой.
Итак… что такое электрический контакт? Это когда два разнородных металла вступают в физический контакт друг с другом (плотный), позволяя ионам перемещаться между металлами. Чтобы заставить их реагировать друг с другом, вам нужен электролит.
Где взять электролит? Ну, тебе не нужно идти за ним. Мать-природа поставляет его в виде дождя и дорожных брызг. Человек немного улучшает его, добавляя антиобледенители или дорожную соль, которая обеспечивает еще лучший проводник для этих ионов.
Итак, конечным результатом ситуации с Фордом было то, что мы создали элемент гальванической коррозии, или… аккумулятор! Прямо там, на передней части вашего дорожного воина, вы использовали аккумулятор вместо бампера. Ух ты!
Были ли ОЭ настолько тупыми? Честно говоря, в этом случае мы, ремонтники, значительно помогли им на пути к коррозии, сняв эти бумажные изоляторы. Но тогда оказывается, что разные металлы по-разному реагируют на алюминий в отношении гальванической коррозии. Хромированный бампер и болты бампера с кадмиевым покрытием практически не реагировали на алюминиевое усиление бампера — в отличие от рамы автомобиля (без этих бумажных прокладок), которая была в основном сырой, голой сталью и болтами без покрытия. Никто из нас понятия не имел! Я видел последствия той «батарейки для бампера»
Но тогда оказывается, что разные металлы по-разному реагируют на алюминий в отношении гальванической коррозии. Хромированный бампер и болты бампера с кадмиевым покрытием практически не реагировали на алюминиевое усиление бампера — в отличие от рамы автомобиля (без этих бумажных прокладок), которая была в основном сырой, голой сталью и болтами без покрытия. Никто из нас понятия не имел! Я видел последствия той «батарейки для бампера»
несколько раз в последующие годы и думал: «Эти придурки лучше переосмыслить использование
этого мягкого алюминия для усиления бампера».
Теперь, когда у меня больше опыта и я немного лучше разбираюсь в вещах, усиление алюминиевого бампера серии 7000 было бы достаточно прочным, если бы мы просто поместили эти маленькие бумажные изоляторы обратно между усилением и рамой и не позволили эффектам гальванической коррозии поставить под угрозу силы у него было более чем достаточно. Это сработало бы так, как задумано, и это восходит к тому, чтобы потратить время на то, чтобы понять, почему все так, а не иначе.
Металлы реагируют по-разному
На рис. 2 показано сжатое расположение металлов в гальваническом ряду. Как вы увидите, металлы на нижнем конце называются «защищенными». Это катоды гальванического коррозионного элемента или батареи. Металлы в самом конце, золото и платина, считаются «самыми благородными». Платина и золото не подвержены коррозии. Вот почему в интересах безопасности компоненты чувствительных самолетов и приборов для космических путешествий изготавливаются из золота и платины.
Рисунок 2. Расположение металлов в гальваническом ряду | |
| ЗАКОРРЖЕННЫЙ КОНЕЦ
| Теоретически любой из этих металлов и сплавов будет подвергаться коррозии, обеспечивая защиту любому другому металлу, расположенному ниже в этой серии, если оба они электрически соединены. На практике, однако, размер в этом отношении намного эффективнее. |
| Анодный или менее благородный
| |
Магний | |
Цинк | |
Алюминий | |
Кадмий | |
Сталь | |
Свинец | |
Олово | |
Никель | |
Латунь | |
Бронза | |
Медь | |
Никель-медные сплавы | |
Нержавеющая сталь (пассивная) | |
Серебро | |
Золото | |
Платина | |
| ЗАЩИЩЕННЫЙ КОНЕЦ
| |
| Катодный или самый благородный
| |
Верхний конец называется корродированным концом. Это анод нашей батареи, и металлы на этом конце ряда «менее благородны». Чем ближе один из этих металлов к другому в ряду, тем менее реактивным он будет. Чем дальше, тем реактивнее. Например, когда сталь крепится к алюминию в присутствии электролита, алюминий является анодным по отношению к стали и будет подвергаться коррозии намного быстрее, чем сам по себе в электролите. Однако сталь, катодная по отношению к алюминию, будет подвергаться коррозии гораздо медленнее, чем сама по себе в электролите. Интересно, что алюминий защищает сталь.
Это анод нашей батареи, и металлы на этом конце ряда «менее благородны». Чем ближе один из этих металлов к другому в ряду, тем менее реактивным он будет. Чем дальше, тем реактивнее. Например, когда сталь крепится к алюминию в присутствии электролита, алюминий является анодным по отношению к стали и будет подвергаться коррозии намного быстрее, чем сам по себе в электролите. Однако сталь, катодная по отношению к алюминию, будет подвергаться коррозии гораздо медленнее, чем сама по себе в электролите. Интересно, что алюминий защищает сталь.
Вот почему цинк с его анодными, защитными и расходуемыми свойствами при нанесении на сталь и стальные крепежные детали широко используется для покрытия стали.
Эй, может быть, вы не работаете с автомобилями с интенсивным использованием алюминия, поэтому вы думаете: «Какое это имеет отношение ко мне?» Но есть несколько автомобилей, F-150, 250 и 350, а также Buick, Suburban, Escalade, Toyota и т. д., у которых есть капоты, люки, крышки багажника, крылья, щиты и т. д., сделанные на болтах. из алюминия, и все они подвержены гальванической коррозии при неправильном обращении. Так что привыкайте к алюминию, потому что мы увидим его гораздо больше. Чем больше алюминия поступает на рынок, тем более экономически целесообразным будет его использование, потому что его переработка обходится в несколько раз дешевле, чем выплавка в первоначальном виде.
д., сделанные на болтах. из алюминия, и все они подвержены гальванической коррозии при неправильном обращении. Так что привыкайте к алюминию, потому что мы увидим его гораздо больше. Чем больше алюминия поступает на рынок, тем более экономически целесообразным будет его использование, потому что его переработка обходится в несколько раз дешевле, чем выплавка в первоначальном виде.
Избегайте неблагоприятных отношений
Вам необходимо избегать большого катодного отношения по сравнению с маленьким анодным отношением. О чем я говорю? Примером этого является фиксатор спинки заднего сиденья в старом Volkswagen Beetle. Это были примерно два квадратных дюйма литого алюминия, прикрученные к стальной машине. Большой неблагоприятный коэффициент и гальваническая коррозия зашкаливали. На боковой стенке задней четверти большинства автомобилей VW Beetles (см. рис. 1) можно обнаружить нечетко выглядящий кусок алюминия с ямками.
Вот как это может проявиться на современном автомобиле. Я недавно снял капот с Ford Escape и заметил, что область под петлей капота не была окрашена, но везде на нижней стороне капота было окрашено . Место, где стальная петля капота (везде окрашенная) крепилась болтами к алюминиевому капоту, было голым алюминием. Окрашивая только шарнир из катодной стали, производители пытаются предотвратить неблагоприятное соотношение. Таким образом, анодная площадь больше, чем там, где шарнир из катодной стали может иметь монтажную царапину на контактной поверхности. Если оригинальное оборудование покрасило область крепления петли, и это покрытие было повреждено в процессе установки, большое неблагоприятное соотношение
Я недавно снял капот с Ford Escape и заметил, что область под петлей капота не была окрашена, но везде на нижней стороне капота было окрашено . Место, где стальная петля капота (везде окрашенная) крепилась болтами к алюминиевому капоту, было голым алюминием. Окрашивая только шарнир из катодной стали, производители пытаются предотвратить неблагоприятное соотношение. Таким образом, анодная площадь больше, чем там, где шарнир из катодной стали может иметь монтажную царапину на контактной поверхности. Если оригинальное оборудование покрасило область крепления петли, и это покрытие было повреждено в процессе установки, большое неблагоприятное соотношение
будет присутствовать в небольшой поцарапанной области, вызывая сильную гальваническую коррозию.
При соединении болтами разнородных металлов или даже одинаковых алюминиевых металлов с алюминиевым корпусом всегда используйте катодные болты, а не анодные. Другими словами, вы будете использовать стальные болты. Эти болты, скорее всего, будут покрыты Dacromet (см. рис. 3) , которое представляет собой специальное покрытие, наносимое на стальные болты различными производителями оборудования по лицензии Dacromet. Покрытия следует всегда осматривать, чтобы обнаружить повреждение защитного покрытия при снятии болта. Эти покрытия не подлежат ремонту, а застежка, которая имеет покрытие и изоляцию и рекомендуется заменять OE каждый раз при ее снятии, должна быть заменена. При установке деталей с помощью этих болтов используйте оригинальные болты для сборки и, когда вы закончите, замените их новыми болтами. Будьте в курсе. Если завод идет на эти дополнительные усилия и расходы, вы должны знать, что на это есть серьезные причины.
рис. 3) , которое представляет собой специальное покрытие, наносимое на стальные болты различными производителями оборудования по лицензии Dacromet. Покрытия следует всегда осматривать, чтобы обнаружить повреждение защитного покрытия при снятии болта. Эти покрытия не подлежат ремонту, а застежка, которая имеет покрытие и изоляцию и рекомендуется заменять OE каждый раз при ее снятии, должна быть заменена. При установке деталей с помощью этих болтов используйте оригинальные болты для сборки и, когда вы закончите, замените их новыми болтами. Будьте в курсе. Если завод идет на эти дополнительные усилия и расходы, вы должны знать, что на это есть серьезные причины.
Перекрестное загрязнение
Остерегайтесь попадания шлифовальной и шлифовальной пыли из алюминия на стальные автомобили или детали и наоборот. Это проще, чем вы думаете. Все, что вам нужно сделать, это взять шлифовальную машину, которую вы только что использовали на стальном автомобиле, и использовать ее с тем же куском наждачной бумаги на алюминии. Это перекрестное загрязнение, результатом которого может быть гальваническая коррозия. Наиболее вероятным результатом являются пузыри в отделке. Будьте особенно осторожны при работе с голым алюминием. Большинство программ сертификации оригинального оборудования требуют отдельных помещений для работы с алюминием. Также может потребоваться другой набор инструментов. Перед началом протрите механические шлифовальные машины влажной тканью. Не сдувайте инструменты или шлифовальную пыль вокруг алюминиевых транспортных средств или автомобилей с алюминиевыми деталями, потому что они парят в воздухе. Вместо этого используйте вакуум. Немного здравого смысла и осторожности могут предотвратить проблемы, которые впоследствии могут дорого обойтись.
Это перекрестное загрязнение, результатом которого может быть гальваническая коррозия. Наиболее вероятным результатом являются пузыри в отделке. Будьте особенно осторожны при работе с голым алюминием. Большинство программ сертификации оригинального оборудования требуют отдельных помещений для работы с алюминием. Также может потребоваться другой набор инструментов. Перед началом протрите механические шлифовальные машины влажной тканью. Не сдувайте инструменты или шлифовальную пыль вокруг алюминиевых транспортных средств или автомобилей с алюминиевыми деталями, потому что они парят в воздухе. Вместо этого используйте вакуум. Немного здравого смысла и осторожности могут предотвратить проблемы, которые впоследствии могут дорого обойтись.
Оксид алюминия и анодирование
Оксид алюминия представляет собой естественное окисление, которое почти мгновенно образуется на чистом алюминии. В большинстве случаев он защищает алюминиевую поверхность от дальнейшей коррозии. Шлифование или проволочная щетка (щеткой из нержавеющей стали) удалят его. Его необходимо удалить перед грунтованием или сваркой. Это второй по твердости материал в мире после алмаза, а его температура плавления составляет более 3700 градусов по Фаренгейту. Алюминий плавится при температуре около 1200 градусов по Фаренгейту, поэтому это вызывает проблемы при сварке, если он находится в месте сварки. Удалите его проволочной щеткой из нержавеющей стали непосредственно перед сваркой и отшлифуйте голый алюминий непосредственно перед покраской.
Шлифование или проволочная щетка (щеткой из нержавеющей стали) удалят его. Его необходимо удалить перед грунтованием или сваркой. Это второй по твердости материал в мире после алмаза, а его температура плавления составляет более 3700 градусов по Фаренгейту. Алюминий плавится при температуре около 1200 градусов по Фаренгейту, поэтому это вызывает проблемы при сварке, если он находится в месте сварки. Удалите его проволочной щеткой из нержавеющей стали непосредственно перед сваркой и отшлифуйте голый алюминий непосредственно перед покраской.
И будьте осторожны: оксид алюминия
обычно невидим.
Анодирование — это процесс, используемый для защиты алюминия от коррозии, и фактически представляет собой искусственное осаждение оксида алюминия. Он намного толще природного оксида алюминия, используется в качестве декоративного покрытия на молдингах и отделке, а также может действовать как электрический изолятор.
Антифриз в виде электролита
Конечно… подумайте об этом. У вас есть замкнутая система охлаждения под давлением в современном автомобиле.
У вас есть замкнутая система охлаждения под давлением в современном автомобиле.
В двигателе/системе охлаждения обнаружены разнородные металлы. Посмотрим… у нас чугунный блок двигателя с алюминиевым радиатором. Они не соприкасаются друг с другом, но находятся в замкнутой системе под давлением, заполненной электролитом. Ох уж этот электролит (антифриз), который мы все так долго считали само собой разумеющимся. У каждого OEM-производителя есть определенный антифриз, который он использует для предотвращения коррозии. Когда вы работаете с системой охлаждения и удаляете антифриз, попросите дилера отправить вам антифриз на замену, чтобы вы не только защищали систему охлаждения, но и гарантийные обязательства владельца автомобиля и себя.
Эффект лазаньи Это хорошо известный сценарий, который заставляет затылков чесать жены и голодные мужья голодных мужей. Что ж, вы правы. Жена создала батарею из стальной кастрюли и алюминиевой фольги, а соленая лазанья была электролитом, где она соприкасалась с покрывающей фольгой. |
Писатель Майк Уэст, бывший редактор BodyShop Business, был владельцем магазина более 30 лет и техническим специалистом более 40 лет, прежде чем закрыть свой магазин в Сиэтле, штат Вашингтон, и выйти на пенсию.
Выбор читателей — Защита от коррозии
На вопрос ответил: Lee Amaradio Jr.
Когда я начал эту статью, я был удивлен, как мало я знал о надлежащих методах защиты от коррозии.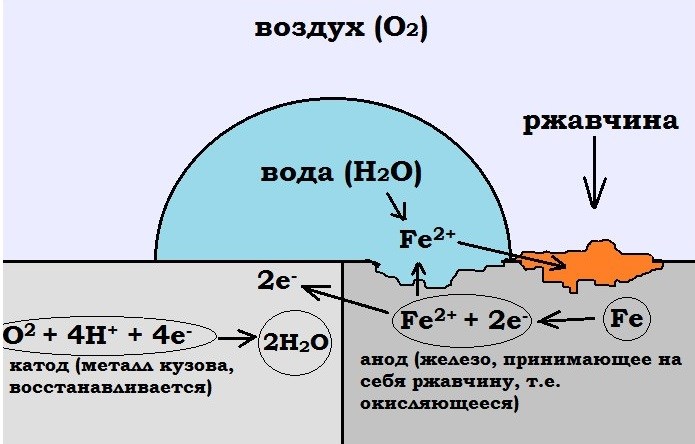 По мере того, как мои исследования продолжались, я был разочарован, когда понял, что, как владелец магазина почти 30 лет, я никогда особо не беспокоился об этом. Я понимаю все о грунтовке для сварки, герметике и грунтовке, но мои исследования показали, что защита от коррозии — это гораздо больше.
По мере того, как мои исследования продолжались, я был разочарован, когда понял, что, как владелец магазина почти 30 лет, я никогда особо не беспокоился об этом. Я понимаю все о грунтовке для сварки, герметике и грунтовке, но мои исследования показали, что защита от коррозии — это гораздо больше.
Важный процесс
А как насчет всех тех панелей, которые мы шлифуем, а затем свариваем? Когда любой металл склеен вместе, необходимо использовать какой-либо тип покрытия, чтобы покрыть и герметизировать весь открытый металл и сварные швы. Производители используют для этого E-coat и подвергают большинство автомобилей процессу погружения, который гарантирует отсутствие открытого металла, подверженного коррозии. Это означает, что у нас никогда не должно быть частично оголенного металла где-либо на транспортном средстве. OEM-производители прилагают столько усилий для защиты от коррозии, что для нас это должно быть не менее важным. Если мы думаем, что делаем качественный ремонт, но сокращаем процесс защиты от коррозии, мы обманываем себя и потребителя.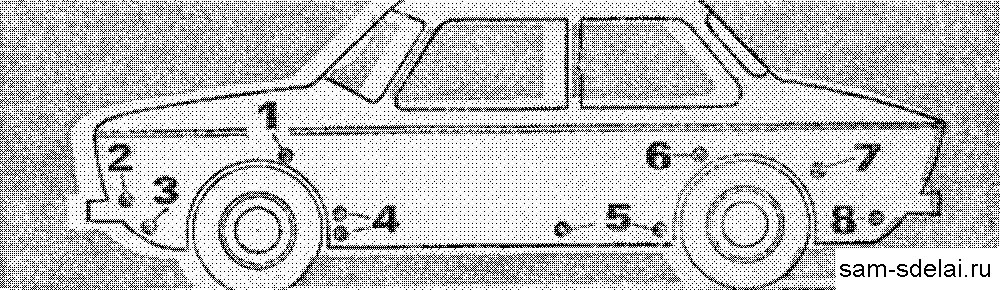
Насколько важна для мастерских защита от коррозии? Это может зависеть от того, где расположены эти магазины. Это может быть не так важно для магазинов Западного побережья, расположенных в регионах с довольно хорошей погодой круглый год, в то время как для магазинов, расположенных в регионах с не очень хорошей погодой, это может быть очень важно, и поэтому они вынуждены учитывать это в расчетах. долговечность ремонта. Когда на Востоке заменяют боковую панель или коромысло, защита от коррозии имеет большое значение при гарантийном ремонте.
Большинство OEM-производителей требуют, чтобы использовались антикоррозийные продукты определенных марок. Если мы отремонтируем автомобиль, используя все необходимые процедуры защиты от коррозии, и автомобиль вернется с проблемой ржавчины, будем ли мы нести ответственность или производитель? Да, и это дает нам еще больше причин для самообразования, чтобы мы точно знали, что требуется.
Что касается защиты от коррозии, то страховые компании не будут оплачивать какие-либо счета, особенно когда мы взимаем плату за защиту от коррозии по нашим оценкам, не указывая подробностей того, за что мы взимаем плату.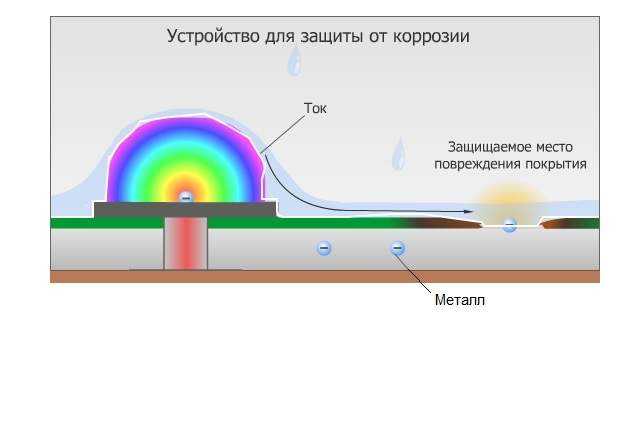 Ремонтник — это тот, кто в конечном итоге дает гарантию на все, потому что гарантия распространяется на человека, который выполнил ремонт, и это включает в себя склеивание панелей. Даже если мы следуем всем рекомендациям производителя в отношении коррозии, мы несем за это ответственность.
Ремонтник — это тот, кто в конечном итоге дает гарантию на все, потому что гарантия распространяется на человека, который выполнил ремонт, и это включает в себя склеивание панелей. Даже если мы следуем всем рекомендациям производителя в отношении коррозии, мы несем за это ответственность.
По мере того, как автомобили становятся все более высокотехнологичными, а стоимость их ремонта растет, наш общий процесс ремонта должен также включать детальный и стандартизированный процесс защиты от коррозии. Это выходит далеко за рамки простого использования грунтовки и герметика для сварки. Наш процесс защиты от коррозии должен демонстрировать понимание всего процесса, как это указано производителем. Мы должны знать, когда не следует повторно приваривать сменную панель, потому что производитель требует заклепки вместо сварных швов, которые использовались изначально.
Некоторые производители рекомендуют не использовать грунтовку для сквозного сварного шва, поскольку она нарушает целостность сварного шва; вместо этого они предлагают использовать самопротравливающую грунтовку. Хотя многие OEM-производители имеют разные мнения о том, как это должно быть сделано, все они рекомендуют процедуру и конкретные продукты, которые необходимо использовать для защиты от коррозии их автомобилей.
Хотя многие OEM-производители имеют разные мнения о том, как это должно быть сделано, все они рекомендуют процедуру и конкретные продукты, которые необходимо использовать для защиты от коррозии их автомобилей.
ALLDATA (www.alldata.com) — отличный веб-сайт, на котором можно узнать, какова точная процедура ремонта для большинства замен панели, рекомендованная производителем. Этот веб-сайт содержит большинство требований производителя по защите от коррозии.
Даже в тех случаях, когда данные производителя недоступны, мы все равно обязаны давать гарантию на то, что мы делаем. Я связался с Марком Торресом из I-CAR и не мог поверить, сколько технической информации о защите от коррозии он прислал мне с веб-сайта I-CAR. С таким количеством доступной информации у нас действительно нет оправдания тому, чтобы не заниматься самообразованием. Но помните: производитель автомобиля по-прежнему является отправной точкой.
Если мы думаем, что делаем качественный ремонт, но сокращаем процесс защиты от коррозии, мы обманываем себя и потребителя.
Склеивание панелей в настоящее время является общепринятым методом замены ранее сваренных деталей. BMW использует соединение панелей заклепками, Jaguar использует соединение заклепками, а Mercedes использует заклепки вместо предыдущих сварных швов. Поскольку всем производителям требуется что-то свое, каждый ремонт, требующий сменной панели без болтового крепления, должен быть изучен.
Груз ответственности
Если вы думаете, что с помощью небольшого количества герметика и грунтовки вы сорветесь с крючка, вы ошибаетесь. Я лично наблюдал, как Калифорнийское бюро автомобильного ремонта (BAR) зашло в мою мастерскую и использовало фонарики и зеркала, чтобы увидеть, использовался ли антикоррозийный воск внутри замененной панели коромысла. Они также посмотрели на каждый внутренний сварной шов, чтобы увидеть, не были ли они обнажены. Поэтому, когда мы берем полчаса за работу и 10 долларов за защиту от коррозии, мы берем на себя ответственность за любую коррозию, которая имеет место. Мы обязаны убедиться, что каждый сварной шов защищен изнутри и снаружи. С нашей стороны было бы неплохо уточнить, что мы защищаем, и дать на это гарантию с ограничением по времени, освобождая нас от любой необоснованной ответственности.
Мы обязаны убедиться, что каждый сварной шов защищен изнутри и снаружи. С нашей стороны было бы неплохо уточнить, что мы защищаем, и дать на это гарантию с ограничением по времени, освобождая нас от любой необоснованной ответственности.
Когда мы взимаем X долларов за защиту от коррозии, мы соглашаемся убедиться, что коромысло покрыто воском изнутри, а все сварные швы на боковой панели, задней панели кузова и днище защищены от коррозии.
Помните, мы взимаем плату за защиту от коррозии, и без подробностей о том, что мы взимаем за защиту и на какой срок, мы берем на себя огромную ответственность за очень небольшие деньги.
Увеличить прибыль
Итак, что нам теперь делать? Я думаю, что все магазины должны учить своих техников тому, что требуется для защиты от коррозии, и объяснять ответственность, связанную с тем, что какая-либо из процедур не выполняется. Я думаю, что мы рассматриваем защиту от коррозии как включенный пункт, когда это не так. Мы могли бы стать более прибыльными, если бы точно перечисляли то, что мы делаем, и взимали плату за каждую процедуру и каждый материал отдельно. Я знаю, что работа по повторной герметизации и герметизации включена в большинство замен панелей, но материалы и все другие необходимые процедуры не включены.
Мы могли бы стать более прибыльными, если бы точно перечисляли то, что мы делаем, и взимали плату за каждую процедуру и каждый материал отдельно. Я знаю, что работа по повторной герметизации и герметизации включена в большинство замен панелей, но материалы и все другие необходимые процедуры не включены.
Я знаю, что БАР смотрит на вещи иначе, чем мы. Помните, если вы указали это в своей смете, то вы должны это сделать. С чем-то, что является такой серой областью, как защита от коррозии, мы все можем оказаться в ответственности.
Необходимо провести исследование и выяснить, какая информация доступна от производителя транспортного средства, а если ничего нет, то обратиться к стандартам I-CAR по защите от коррозии. Мы больше не можем просто использовать герметик и грунтовку и говорить, что добавили необходимую защиту от коррозии для завершения надлежащего ремонта. Когда речь заходит о защите от коррозии, доступно так много информации, что здесь я лишь касаюсь поверхности. И, надеюсь, я посеял семена для каждого из нас, чтобы убедиться, что мы применяем все, что требуется.
Поскольку защита от коррозии не рассматривается как вопрос безопасности (хотя могла бы быть), многие хорошие мастерские и техники ограничиваются минимальными затратами. Мы должны думать о потребителе и о продукте, который мы ему доставляем. Не возвращаем ли мы им что-то, что со временем выйдет из строя? Уменьшаем ли мы ценность их автомобиля? В большинстве случаев открытый металл ржавеет намного быстрее, чем вы можете себе представить.
Мы обязаны обеспечить правильную защиту от коррозии перед нашими клиентами, и мы обязаны сделать так, чтобы применение любых продуктов для защиты от коррозии приносило прибыль и ограничивало нашу ответственность.
Писатель Ли Амарадио-младший является президентом и основателем компании Faith Quality Auto Body Inc. в Мурриете, Калифорния. валовые продажи. В бизнесе с 1979 года Ли объясняет свой успех отличной командой высококлассных специалистов, поддерживающих его. Ли говорит, что он «видит почерк на стене» и считает, что «настало время вернуть нашу отрасль, пока не стало слишком поздно». С ним можно связаться по адресу [email protected].
С ним можно связаться по адресу [email protected].
Условия защиты от коррозии • E-coat: электроосаждаемый грунт, наносимый на металлические детали во время сборки автомобиля и изготовления запасных частей для предотвращения коррозии. Это основной способ защиты от коррозии, используемый OEM-производителями. • Коррозия: Химическая реакция воздуха, влаги или коррозионных материалов на металлической поверхности, также называемая ржавчиной или окислением. •Гальваническая коррозия: Коррозия, вызванная контактом разнородных металлов в присутствии влаги. • Защита: покрытие; защищать, оберегать, оберегать; «покрытие», чтобы защитить от повреждений. •Защита: для защиты от разрушения или повреждения; чтобы не повредить. |

 Возьмите стальную форму для выпечки с остатками лазаньи, накройте ее алюминиевой фольгой и поместите в холодильник на несколько дней. Муж проголодался, достает лазанью и ставит ее на столешницу, думая о приятных мыслях. Как только он тянется к фольге и оттягивает ее, он замечает в ней дыры. Глядя на лазанью, он замечает на ней черные точки и начинает думать: «Возможно, это понравится соседским лающим собакам». Что случилось?
Возьмите стальную форму для выпечки с остатками лазаньи, накройте ее алюминиевой фольгой и поместите в холодильник на несколько дней. Муж проголодался, достает лазанью и ставит ее на столешницу, думая о приятных мыслях. Как только он тянется к фольге и оттягивает ее, он замечает в ней дыры. Глядя на лазанью, он замечает на ней черные точки и начинает думать: «Возможно, это понравится соседским лающим собакам». Что случилось?