Чем отличается химическая коррозия от электрохимической коррозии: Электрохимическая коррозия и химическая: определение и защита
Содержание
8.2.2. Электрохимическая коррозия
Электрохимическая
коррозия металла происходит в
средах, имеющих ионную проводимость (в
расплавах и растворах электролитов) и
отличается от химической механизмом
протекания.
Особенность
электрохимической коррозии заключается
в том, что две сопряженные реакции —
окисление металла и восстановление
окислителя осуществляются на различных
участках поверхности металлов Процессы
электрохимической коррозии подобны
процессам, протекающим в гальванических
элементах. Но, поскольку в коррозионном
элементе анод и катод непосредственно
соприкасаются друг с другом, то он
является короткозамкнутым (т.е. отсутствует
внешняя цепь).
Электрохимическая
коррозия может протекать:
в электролитах — водные растворы солей,
кислот, щелочей, морская вода;в атмосфере любого влажного газа;
в почве.
Особым
видом электрохимической коррозии
следует считать коррозию за счет внешнего
электрического тока. В качестве примеров
В качестве примеров
подобного рода разрушений можно привести
коррозию трубопроводов с токопроводящими
жидкостями, подземных металлических
сооружений.
МЕХАНИЗМ
ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
Коррозия
металла в растворах электролитов
протекает через анодное окисление
металла
и
катодное восстановление окислителя
(деполяризатора D)
Схема
коррозионного гальванического элемента
может быть представлена следующим
образом:
Важнейшими
деполяризаторами, вызывающими коррозию,
являются растворенный кислород (O2)
и ионы водорода (H+).
Коррозия с участием кислорода протекает
с его поглощением, и ее называют коррозией
с кислородной деполяризацией.
в
кислой среде (рН < 7)
в
нейтральных и основных средах (рН > 7)
Коррозия с участием ионов водорода
сопровождается выделением водорода,
и ее называют коррозией с водородной
деполяризацией.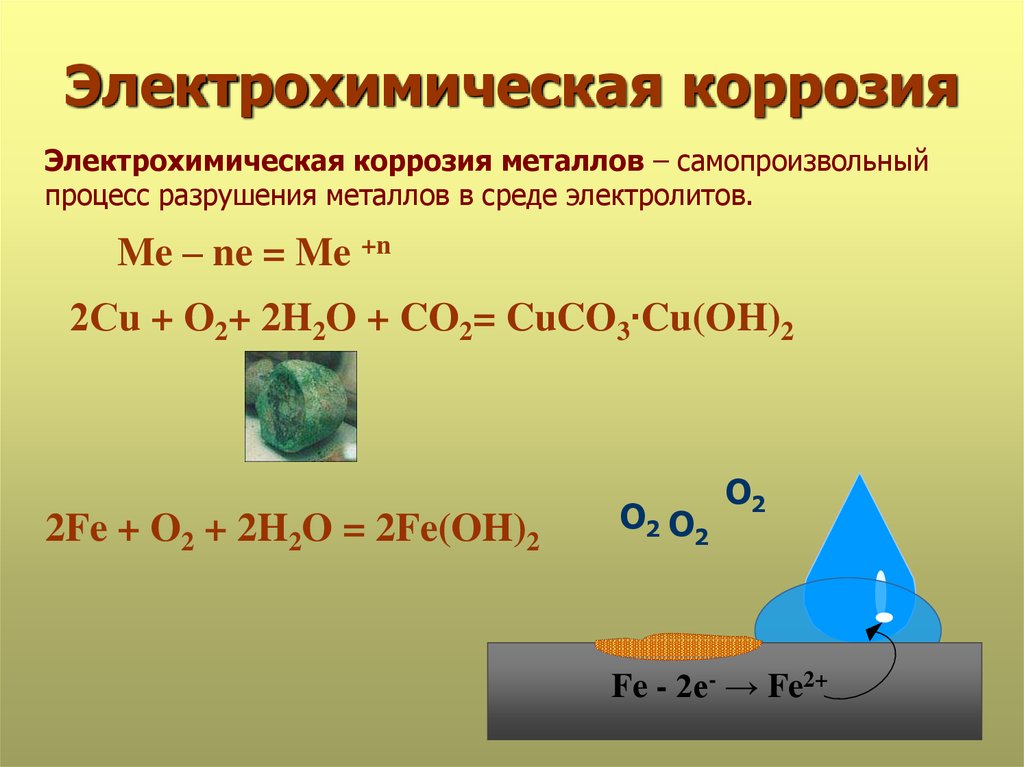
в
кислой среде (рН < 7)
в
нейтральных и основных средах (рН > 7)
Кроме
электрохимических реакций при коррозии
обычно протекают вторичные химические
реакции, например, взаимодействие ионов
металла с гидроксид-ионами, концентрация
которых повышается в результате катодных
реакций:
Men+
+ nOH— = Me(OH)n
ТЕРМОДИНАМИКА
ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
Возможность
коррозии с водородной и кислородной
деполяризацией может быть установлена
с помощью формулы, связывающей энергию
Гиббса и напряжение гальванического
элемента.
Коррозия
возможна, если G <
0, т.е.
>
0.
Так
как напряжение равно разности потенциалов
окислителя и восстановителя
,
то
коррозия возможна при условии, что
потенциал окислителя положительнее
потенциала металла:
ок.
> Me/Men+
Для
определения возможности коррозии
металла в средах различного характера
пользуются диаграммой Пурбэ, показывающей
зависимость потенциалов водородного
и кислородного электродов от рН среды
(рис.7.4). Указанные зависимости базируются
на уравнении Нернста для водородного
и кислородного электродов:
h3/2H+
= -0,059· pH (при p(H2) = 101 кПа)
OH—/O2
= 1,23 — 0,059· pH (при p(O2) = 101 кПа)
Представленная
диаграмма характеризуется наличием
трех областей.
Если потенциал металла (область 1)
отрицательнее потенциала водородного
электрода (Me/Men+
< h3/2H+),
то возможна коррозия как с поглощением
кислорода, так и с выделением водорода.
К таким металлам относятся щелочные и
щелочноземельные металлы, алюминий,
цинк и др.Если потенциал металла положительнее
потенциала водородного электрода и
отрицательнее потенциала кислородного
электрода (Me/Men+
< OH—/O2)
(область 2), то коррозия возможна с
поглощением кислорода и невозможна с
выделением водорода. Потенциалы многих
Потенциалы многих
металлов лежат в области 2 (Cd, Ni, Sn и др.).Если потенциал металла положительнее
потенциала кислородного электрода
(Me/Men+
>OH—/O2)
(область 3), то коррозия металла невозможна.
Потенциал золота, например, Au/Au3+
= +1,5 В, в отсутствии комплексообразователя
во всей области рН положительнее
потенциала кислородного электрода.
Поэтому золото с поглощением O2
и выделением H2 корродировать не
может.
Таким
образом, при контакте металла с раствором
электролита в атмосферных условиях
большинство металлов может корродировать
с поглощением кислорода, и лишь некоторые
металлы — с выделением водорода.
Коррозия металлов
Коррозия металлов
Коррозией называется разрушение металлов и сплавов под действием окружающей среды. Подавляющее большинство металлов, применяемых в технике, в различной степени подвержено коррозии.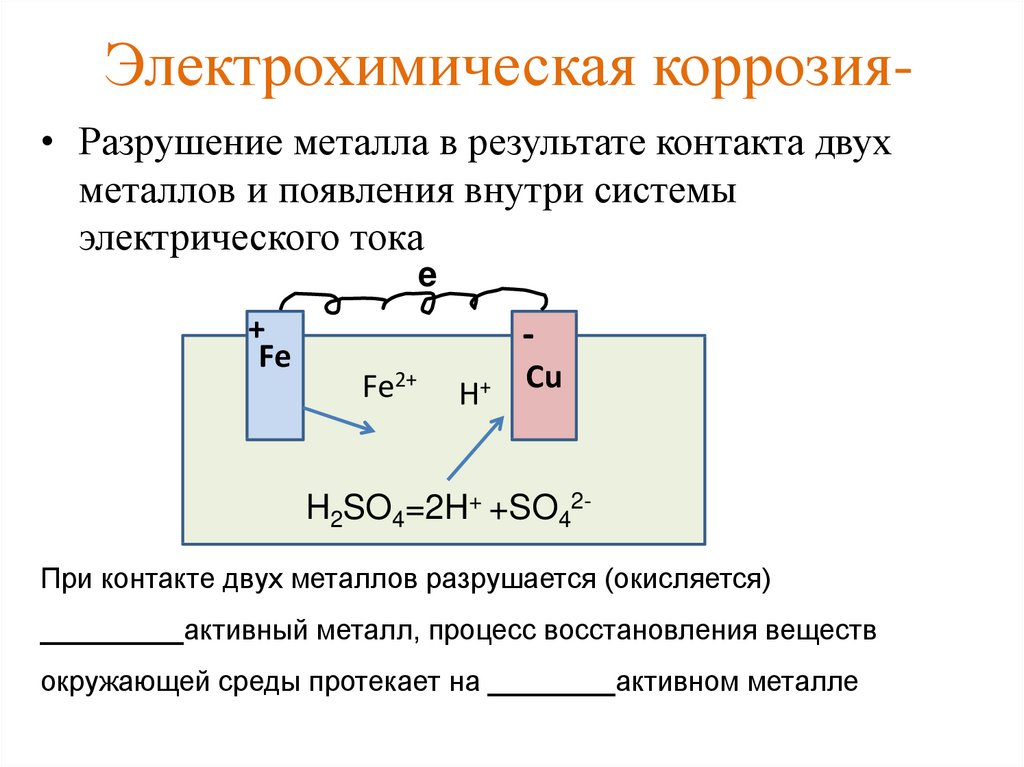
Коррозия обычно начинается с поверхности и затем распространяется в глубину металла, вследствие чего ухудшаются его механические свойства. Среда, в которой протекают коррозионные процессы, оказывает большое влияние на их характер, в связи с чем различают два основных вида коррозии: химическую и электрохимическую.
Химическая коррозия возникает в результате воздействия на металлы жидкостей, сухих газов, которые не являются проводниками электрического тока (бензин, масла, смолы, газы и т. п.). При химической коррозии на поверхности металлов образуются пленки окислов. Такие пленки некоторых металлов (алюминий, хром, молибден) обладают высокой прочностью и предохраняют металл от разрушения. Пленки окислов железа и других черных металлов непрочны. Местные разрушения этих пленок окислов и являются причиной дальнейшего протекания коррозии, проникающей в металл на большую глубину.
Рекламные предложения на основе ваших интересов:
Дополнительные материалы по теме:
Окисление металлов при повышенных температурах с образованием на их поверхности окалины является типичным видом химической коррозии.
Электрохимическая коррозия является результатом воздействия на металлы различных электролитов — кислот, щелочей, растворов солей и воды с растворенными в ней газами и примесями. Все эти жидкости, являются хорошими проводниками тока.
Одним из наиболее распространенных видов электрохимической коррозии является атмосферная коррозия металлов, сущность которой заключается в следующем. Из физики известно, что пластинки, изготовленные из разнородных металлов и соединенные между собой, при погружении в электролит образуют гальванические пары. При этом металл, обладающий более высоким электрическим потенциалом, будет являться катодом, а металл с более низким потенциалом — анодом.
В промышленности наибольшее применение имеют сплавы, а не чистые металлы. Состав сплавов не является однородным. Например, перлитная сталь состоит из зерен феррита и цементита и других примесей, в результате чего получается множество гальванических пар, в которых зерна феррита являются катодом, а зерна цементита — анодом.
При соприкосновении с влажным воздухом на поверхности стали появляется влага в виде водяной пленки, которая является в данном случае электролитом. При. этом появляются токи, являющиеся основной причиной коррозии металла. Следовательно, электрохимическая коррозия отличается от химической тем, что при ней происходят электрохимические процессы вследствие возникновения токов.
Защита металлов от коррозии. Коррозия металлов причиняет огромные убытки народному хозяйству. Основными металлами в машиностроении и в других отраслях народного хозяйства являются черные, т. е. сталь и чугун. Они обладают слабой стойкостью против коррозии, вследствие чего выходит из строя большое количество деталей из черных металлов.
Металлические изделия защищают от коррозии различными способами: металлическим и неметаллическим покрытием, созданием на их поверхности окисных пленок и легированием металлов и сплавов.
Для защиты металлов и сплавов от коррозии неметаллическими покрытиями поверхность изделия окрашивают различными красками, покрывают лаками и пр.
Легирование металлов и сплавов осуществляют введением хрома, никеля, алюминия, кремния и других элементов, повышающих сопротивление коррозии.
—
Коррозией металлов называется их разрушение вследствие химического или электрохимического взаимодействия с коррозионной средой.
Виды коррозии. Коррозия металлов и сплавов начинается с их поверхности и постепенно распространяется в глубь материала. При этом внешний вид металлов изменяется: они теряют блеск, их поверхность становится неровной, изъеденной. Часто коррозия металлов сопровождается снижением их механической прочности, твердости и другими явлениями. Примером коррозии металлов может служить ржавление железа под воздействием влажного воздуха, в результате чего на поверхности металлов образуется бурый слой ржавчины.
В зависимости от состояния коррозионной среды, вида металла и условий их взаимодействия на поверхности металла образуются различные химические соединения, так называемые продукты коррозии. Они могут быть в виде пленок и наростов с плотной и рыхлой структурой, прочно приставших к поверхности металла или легко удаляемых с него.
Они могут быть в виде пленок и наростов с плотной и рыхлой структурой, прочно приставших к поверхности металла или легко удаляемых с него.
Пленки, особенно если они плотные (беспористые), могут тормозить дальнейший процесс коррозии, а в некоторых случаях надежно защищать металл от разрушения. Например, пленка, образовавшаяся на алюминии при воздействии кислорода воздуха, защищает его от дальнейшей коррозии. При образовании защитной пленки металл теряет способность к химическим взаимодействиям с окружающей средой, т. е. переходит в пассивное состояние. Но достаточно удалить защитную пленку и коррозия металла начинается снова.
Рис. 1. Виды коррозии:
а — сплошная (равномерная) коррозия, б — местная, в — межкристал-лнтная; 1 — металл, 2, 3 — продукты коррозии, 4 — трещины
В зависимости от характера протекания коррозионного процесса, состояния коррозионной среды, природы металла и действующих на него напряжений (изгибающих, сжимающих, ударных, растягивающих) наиболее часто встречаются три вида коррозии: сплошная, местная и межкристаллитная.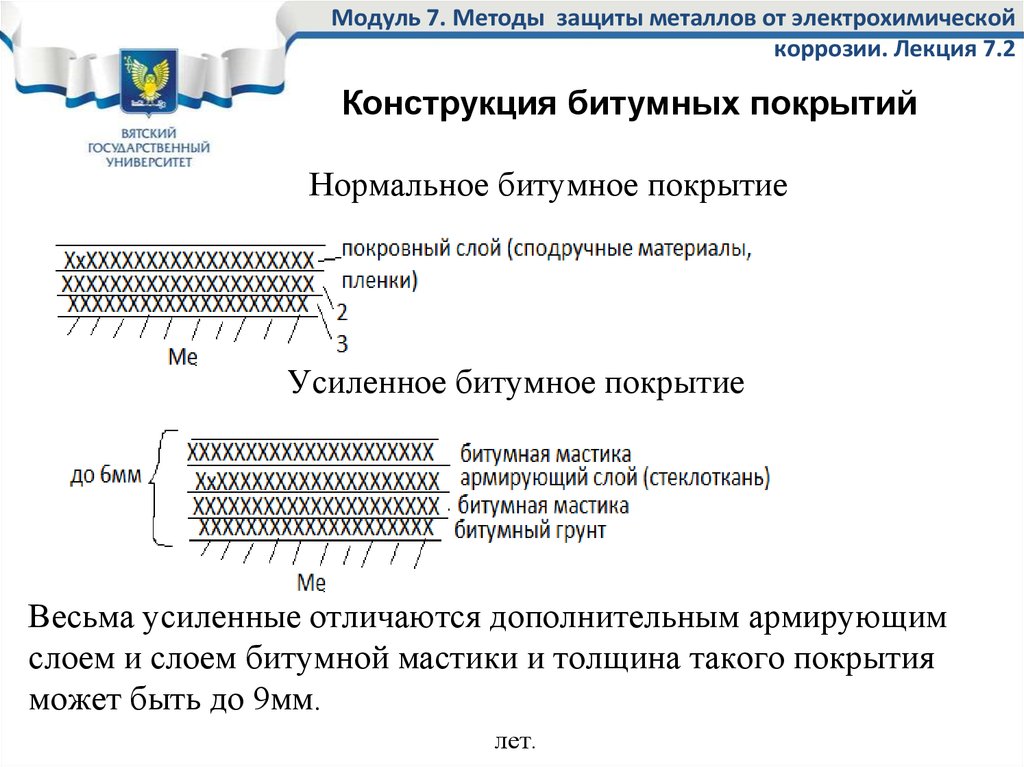
Сплошная коррозия, охватывающая всю поверхность металла, подразделяется на равномерную и неравномерную.
Равномерная коррозия протекает с одинаковой скоростью по всей поверхности металла, а неравномерная протекает с неодинаковой скоростью на различных участках поверхности металла.
Равномерная коррозия происходит в большинстве случаев на открытом воздухе.
При коррозии этого вида металл разрушается равномерно по всей поверхности конструкции или аппарата. Если с поверхности металла удалить слой ржавчины, то можно увидеть, что его поверхность стала шероховатой. При более длительном воздействии воздуха углубления в металле увеличиваются.
Местная коррозия — это коррозия, охватывающая отдельные участки поверхности металла. Такая коррозия подразделяется на подповерхностную, точечную, сквозную и коррозию пятнами.
Местная коррозия возникает при наличии в металле загрязнений (шлаков и др.), внутренних напряжений, вследствие вмятин, наклепа; при грубой структуре и неоднородности поверхности металла; неравномерном действии коррозионной среды; при неравномерной аэрации поверхности металла.
Коррозия вследствие неравномерной аэрации часто возникает на тех участках металла, которые менее доступны воздействию кислорода, чем остальная поверхность. Такими участками являются царапины, раковины, заклепочные швы конструкций и т. п.
Местная коррозия на отдельных участках металла резко снижает его механическую прочность, что приводит к преждевременному разрушению оборудования и металлических конструкций, нарушению герметичности емкостей и трубопроводов.
Межкристаллитная коррозия распространяется по границам кристаллов-зерен, составляющих металл, и нарушает между ними связь. Это вызывает снижение механической прочности материала. Особенностью коррозионного разрушения этого вида является то, что коррозия распространяется глубоко внутрь металла, не изменяя внешнего вида металлической конструкции. Межкристаллитная коррозия чаще всего поражает конструкции, изготовленные из нержавеющей стали и алюминиевых сплавов. Разрушение конструкции происходит внезапно в результате резкого падения прочности металла или сплава.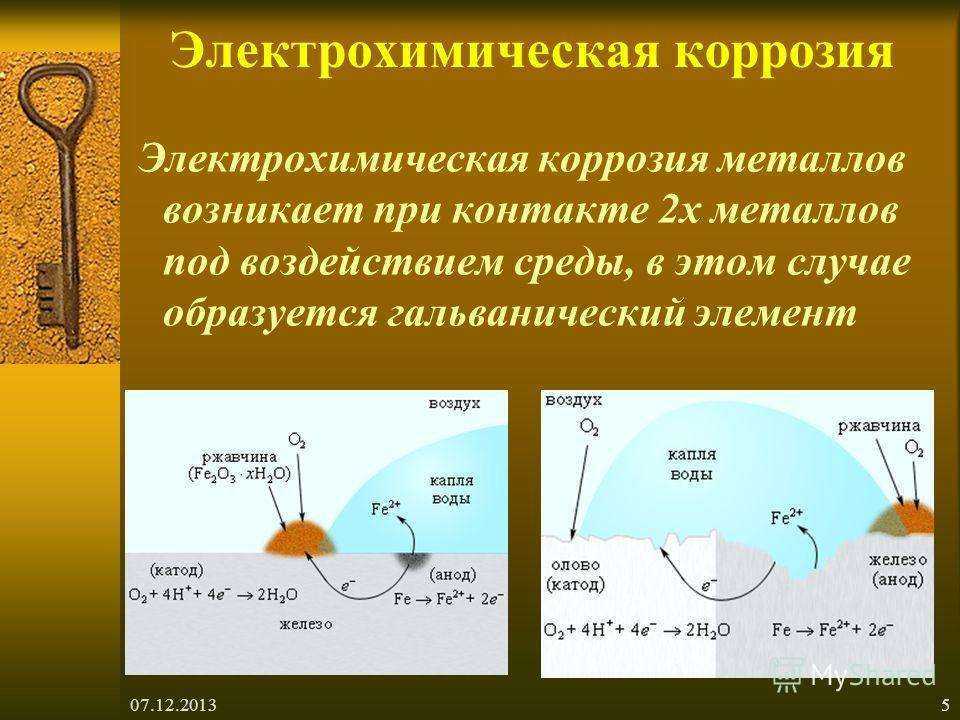
Межкристаллитная коррозия обычно возникает в зоне сварных швов. Это объясняется тем, что при термической обработке нержавеющих сталей (высокохромистых) при высокой температуре — (1000—1110 °С) и последующем относительно быстром охлаждении происходят изменения состава металла по границам кристаллов за счет образования карбидов, т. е. соединений железа с углеродом, обладающих меньшей устойчивостью к коррозионным средам по сравнению с хромом.
Склонность алюминиевых сплавов к межкристаллитной коррозии объясняется образованием по границам зерен соединений менее коррозионностойких, чем основная часть зерен металла.
Часто можно наблюдать, что металл одновременно подвергнут нескольким видам коррозии. Равномерная коррозия, например, сопровождается местной и т. д.
Типы коррозии. В зависимости от вида коррозионной среды коррозия металла может происходить химическим или электрохимическим путем.
Химическая коррозия возникает при действии на металлы сухих газов при высоких температурах или жидких неэлектролитов (жидкостей, не проводящих электрический ток). К химической коррозии относится также разрушение металла кислородом сухого воздуха и другими газами (углекислым, сернистым) при отсутствии паров воды.
К химической коррозии относится также разрушение металла кислородом сухого воздуха и другими газами (углекислым, сернистым) при отсутствии паров воды.
При химической коррозии происходит взаимодействие коррозионной среды с поверхностью металла, в результате которого продукты коррозии (пленки, окислы, окалина) образуются непосредственно на том участке поверхности металла, где происходит его разрушение.
Электрохимическая коррозия возникает при взаимодействии металла с жидкой коррозионной средой (растворами электролитов, т. е. жидкостями, проводящими электрический ток), влажными газами, расплавленными солями и щелочами. Электролитами служат растворы кислот, солей или щелочей. При электрохимической коррозии разрушение металла связано с возникновением и перетеканием электрического тока с одних участков металла на другие.
Чтобы понять сущность электрохимической коррозии, рассмотрим некоторые явления, лежащие в основе этого процесса. Если в сосуд с разбавленной серной кислотой опустить два разнородных металла, например медь и цинк, и соединить их проводником, то по нему потечет электрический ток.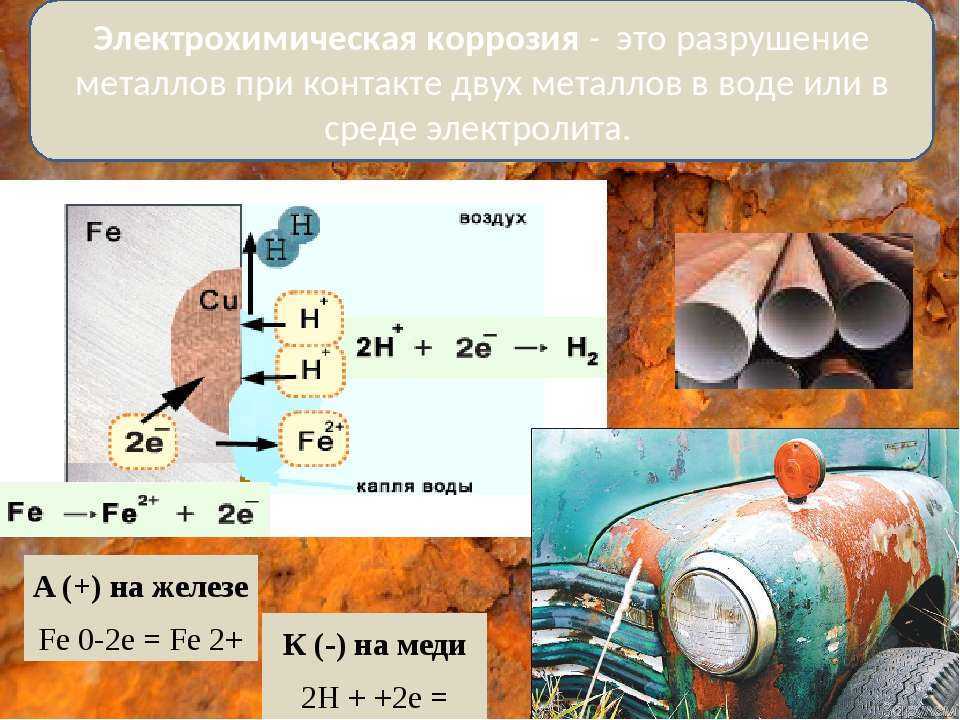 Полученный источник тока называется гальваническим элементом.
Полученный источник тока называется гальваническим элементом.
Возникновение электрического тока в гальваническом элементе объясняется следующим. В растворе серной кислоты (электролите) молекулы вещества распадаются на части, которые называются ионами. Ионы каждого химического вещества несут определенный химический заряд: положительный (катион) или отрицательный (анион).
При погружении цинковой пластинки в электролит между кислотой и металлом возникает взаимодействие, в результате которого цинк постепенно-переходит в раствор. При этом каждый атом цинка оставляет-на металлической пластинке два электрона, а сам становится в растворе положительным ионом.
Цинковая пластинка, обогащаясь электронами, приобретает отрицательный электрический заряд. Слой электролита, непосредственно прилегающий к пластинке, заряжается при этом положительно. Между пластинкой и раствором кислоты возникает разность потенциалов (электрических зарядов).
Освободившиеся на цинковой пластинке (аноде) электроны текут по внешнему проводнику к медной пластинке (катоду). Электрическая цепь’ замыкается через электролит, в котором ионы переносят ток. В результате работы гальванического элемента цинковая пластинка (анод) постепенно разрушается.
Электрическая цепь’ замыкается через электролит, в котором ионы переносят ток. В результате работы гальванического элемента цинковая пластинка (анод) постепенно разрушается.
Электрохимическая коррозия металла напоминает постепенное растворение анода гальванического элемента.
При эксплуатации химического оборудования под действием электролита происходит разрушение металла в результате образования гальванических элементов. Например, в химическом аппарате, изготовленном из нескольких различных металлов, при действии электролита у мест сопряжения этих металлов создаются условия для возникновения гальванического элемента, в результате работы которого металл разрушается и переходит в раствор.
В отличие от обычного гальванического элемента, где электроды соединены проводником, в гальваническом элементе, возникающем при коррозии химической аппаратуры, электроды соединены между собой непосредственно.
При изготовлении металлических аппаратов и строи, тельных конструкций всегда учитывают возможность возникновения электрохимической коррозии от соединения различных металлов.
Недопустимо, например, соединять без изолирующих прокладок алюминий с медными сплавами или с нержавеющими сталями.
Причиной возникновения электрохимической коррозии в металлическом аппарате или конструкции может служить также физическая неоднородность металла. Например, коррозия часто возникает в местах расположения сварных и заклепочных швов. Это объясняется тем, что при сварке металла в результате его нагревания на сравнительно небольшом участке происходит изменение структуры металла. При действии коррозионной среды этот участок по отношению к основному металлу конструкции становится анодом и начинает разрушаться. Такой же процесс возникает, если в конструкции есть заклепочные швы: заклепки становятся анодами по отношению к основному металлу и образуют с ним гальванический элемент.
Очень часто металл разрушается в результате возникновения на его поверхности микрогальваноэлементов, что происходит из-за его химической или физической неоднородности. Например, цинк, применяемый для различных технических целей, в своем составе содержит ряд примесей различных металлов и в том числе медь. Так как-растворимость меди в цинке ограничена, то при содержании ее в цинке выше определенной нормы медь выделяется в виде отдельных мелких включений. В результате этого на поверхности цинка возникают мельчайшие, невидимые глазу гальваноэлементы, в которых катодами являются частицы меди, а анодами — цинк. При работе микроэлемента цинк переходит в электролит, что в конечном счете приводит к полному разрушению цинковой пластинки.
Так как-растворимость меди в цинке ограничена, то при содержании ее в цинке выше определенной нормы медь выделяется в виде отдельных мелких включений. В результате этого на поверхности цинка возникают мельчайшие, невидимые глазу гальваноэлементы, в которых катодами являются частицы меди, а анодами — цинк. При работе микроэлемента цинк переходит в электролит, что в конечном счете приводит к полному разрушению цинковой пластинки.
Обычно конструкционная сталь, из которой изготовляют химическую аппаратуру, технологические и строительные конструкции, также отличается химической неоднородностью. Эта неоднородность обусловливает низкую коррозионную стойкость стали в коррозионных средах и вызывает необходимость в осуществлении мероприятий по защите оборудования и конструкций от коррозии.
Коррозионная стойкость. Не все металлы и сплавы в одинаковой степени разрушаются коррозионными средами. Одни разрушаются быстрей, другие в тех же условиях оказываются устойчивыми к действию коррозии в течение длительного времени. Однако нет металлов совершенно не подвергающихся коррозии. Например, одним из наиболее устойчивых металлов является платина, но и она при погружении в смесь азотной и соляной кислот разрушается. Алюминий устойчив к воздействию крепкой азотной кислоты (поэтому его используют для изготовления цистерн и хранилищ под азотную кислоту), но если в алюминиевые аппараты залить соляную кислоту или щелочные растворы, то они очень быстро разрушат этот металл.
Однако нет металлов совершенно не подвергающихся коррозии. Например, одним из наиболее устойчивых металлов является платина, но и она при погружении в смесь азотной и соляной кислот разрушается. Алюминий устойчив к воздействию крепкой азотной кислоты (поэтому его используют для изготовления цистерн и хранилищ под азотную кислоту), но если в алюминиевые аппараты залить соляную кислоту или щелочные растворы, то они очень быстро разрушат этот металл.
Способность металла сопротивляться коррозионному воздействию среды, называется коррозионной стойкостью. Она определяется качественно и количественно (скоростью коррозии в данных условиях, группой или баллом >по принятой шкале).
Одним из основных методов испытания металла на коррозионную стойкость является массовый метод. При испытании этим методом определяют разность массы образца металла до и после коррозии. Результаты испытаний относят к единице поверхности металла (м2, см2) и единице времени (час, сутки, год и т. д.). Таким образом, коррозионные потери могут быть выражены в г/см2-ч\ г/м2-день и т. д. Однако массовый метод не учитывает плотности металла. В результате этого при одной и той же потере массы для разных металлов уменьшение сечения металла будет (различным.
д. Однако массовый метод не учитывает плотности металла. В результате этого при одной и той же потере массы для разных металлов уменьшение сечения металла будет (различным.
При коррозии, сосредоточенной на небольших участках металла, массовый метод неприменим. В этом случае глубину проникновения коррозии определяют с помощью специальных методов.
Для более точного определения коррозионной стойкости металла полученные данные массового метода приводят к показателю, который характеризует уменьшение толщины металла (проникновение коррозии в глубину металла), например в мм/год.
Коррозия Терминология — E’s — AMPP
упругая деформация — изменение размеров материала при приложении напряжения в области упругости. После снятия упругого напряжения материал возвращается к своим первоначальным размерам без какой-либо остаточной деформации.
эластичность — свойство материала, которое позволяет ему восстанавливать свои первоначальные размеры после деформации под действием напряжения ниже его предела упругости.
предел упругости — максимальное напряжение, которому может быть подвергнут материал без сохранения какой-либо остаточной деформации после снятия напряжения.
электрические помехи — любые электрические помехи на металлической конструкции, находящейся в контакте с электролитом, вызванные блуждающими токами.
электрическая изоляция — состояние электрической изоляции от других металлических конструкций или окружающей среды.
электрохимическая проводимость — величина, обратная электрохимическому импедансу, DI/DE.
электрохимическая ячейка — (1) электрохимическая реакция, включающая две полуреакции, одна из которых включает окисление реагента (продукта), а другая — восстановление продукта (реагента).( Равновесный потенциал электрохимической ячейки можно рассчитать по изменению свободной энергии для всей электрохимической реакции Равновесный потенциал электрохимической ячейки можно измерить, разделив полуреакции окисления и восстановления на отдельные отсеки и измерение напряжения, возникающего между ними в условиях, когда между ними практически не проходит заряд. ) [термодинамическое использование] (2) Электрохимическая система, состоящая из анода и катода, находящихся в металлическом контакте и погруженных в электролит. (Анод и катод могут быть из разных металлов или из разных областей на одной и той же металлической поверхности.) [общее использование]
) [термодинамическое использование] (2) Электрохимическая система, состоящая из анода и катода, находящихся в металлическом контакте и погруженных в электролит. (Анод и катод могут быть из разных металлов или из разных областей на одной и той же металлической поверхности.) [общее использование]
потенциал электрохимической коррозии — см. коррозионный потенциал .
электрохимический эквивалент — масса элемента или группы элементов, окисленных или восстановленных со 100-процентной эффективностью при прохождении единичного количества заряда, такого как Фарадей (96485 кулонов), ампер-час или кулон.
электрохимический импеданс — частотно-зависимый комплексный коэффициент пропорциональности, DI/DE, между приложенным потенциалом (или током) и ответным током (или потенциалом) в гальваническом элементе. Этот коэффициент становится импедансом, когда возмущение и отклик связаны линейно (значение фактора не зависит от величины возмущения), а отклик вызван только возмущением. Значение может быть связано со скоростью коррозии, когда измерение производится при коррозионный потенциал.
Значение может быть связано со скоростью коррозии, когда измерение производится при коррозионный потенциал.
электрохимический шум — колебания потенциала или тока, или того и другого, возникающие в результате неконтролируемых изменений в процессе коррозии.
электрохимический потенциал — частная производная полной электрохимической свободной энергии системы по количеству молей компонента в растворе, когда все другие факторы постоянны. (Аналогично химическому потенциалу компонента, за исключением того, что он включает как электрический, так и химический вклады в свободную энергию.)
электрод — материал, который проводит электроны, используется для установления контакта с электролитом и через который ток передается к электролиту или от него.
потенциал электрода — потенциал электрода в электролите, измеренный относительно электрода сравнения.
электрокинетический потенциал — разность потенциалов в растворе, вызванная остаточным несбалансированным распределением заряда в соседнем растворе, образующим двойной слой. (Электрокинетический потенциал отличается от электродного потенциала тем, что он возникает исключительно в фазе раствора. Этот потенциал представляет собой обратимую работу, необходимую для переноса единичного заряда из бесконечности в растворе к рассматриваемой границе раздела, но не через границу раздела. .) [также известный как дзета-потенциал ]
(Электрокинетический потенциал отличается от электродного потенциала тем, что он возникает исключительно в фазе раствора. Этот потенциал представляет собой обратимую работу, необходимую для переноса единичного заряда из бесконечности в растворе к рассматриваемой границе раздела, но не через границу раздела. .) [также известный как дзета-потенциал ]
электролиз — производство химических изменений электролита током, протекающим через электрохимическую ячейку.
электролит — химическое вещество, содержащее ионы, мигрирующие в электрическом поле.
электролитическая коррозия — неподходящий термин, но иногда неправильно используемый для обозначения гальванической коррозии , коррозия рассеянного тока или любой формы электрохимической коррозии.
электролитическая очистка — процесс удаления грязи, окалины или продуктов коррозии с поверхности металла путем воздействия на металл в качестве электрода электрического тока в электролитической ванне.
серия электродвижущих сил — список элементов, упорядоченных в соответствии с их стандартными электродными потенциалами, знак положительный для элементов, потенциалы которых более благородны, чем водород, такие как золото, и отрицательный для элементов, более активных, чем водород, таких как цинк. путать с гальванический ряд ]
электроосмос — миграция воды через полупроницаемую мембрану в результате разности потенциалов, вызванной протеканием электрического заряда через мембрану.
эллипсометрия — оптический метод, при котором плоскополяризованный свет фокусируется на поверхности, а отраженный луч анализируется для определения фазового сдвига компонентов света, чтобы получить информацию о свойствах пленок, которые могут присутствовать на поверхности. поверхность.
охрупчивание — снижение пластичности или ударной вязкости, или того и другого, материала (обычно металла или сплава).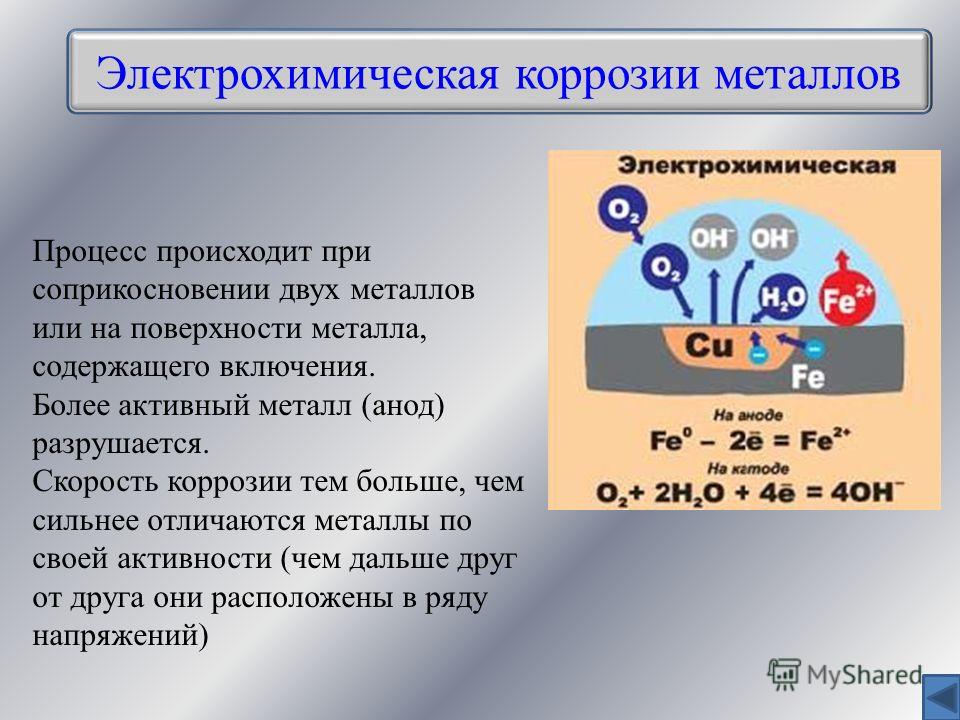
ЭДС серии — см. электродвижущая сила серии .
эмаль — (1) краска, которая при высыхании образует твердую глянцевую поверхность. (2) покрытие, характеризующееся способностью образовывать гладкую прочную пленку.
концевой эффект — более быстрая потеря материала анода на конце анода по сравнению с другими поверхностями анода в результате более высокой плотности тока.
предел выносливости — максимальное напряжение, которое может выдержать материал в течение бесконечно большого числа циклов усталости.
окружающая среда — окружающая среда или условия (физические, химические, механические), в которых существует материал.
растрескивание под воздействием окружающей среды — растрескивание материала, причинным фактором которого является взаимодействие с окружающей средой в сочетании с напряжением растяжения, часто приводящее к хрупкому разрушению пластичного материала. [также известный как экологический крекинг ] Обсуждение — Экологический крекинг — это общий термин, который включает в себя термины, перечисленные ниже. Определения этих терминов приведены в другом месте в этом документе: щелочное растрескивание , хлоридное коррозионное растрескивание , коррозионная усталость , водородное охрупчивание , водородное растрескивание (ступенчатое растрескивание) , водородное растрескивание , растрескивание жидким металлом , коррозионное растрескивание под напряжением , сульфидное растрескивание под напряжением . Обсуждение — Следующие термины использовались в прошлом в связи с растрескиванием под действием окружающей среды, но в настоящее время устарели и не должны использоваться: щелочная хрупкость , замедленное растрескивание сезонное растрескивание , статическая усталость , сульфидное коррозионное растрескивание , сульфидное коррозионное растрескивание под напряжением .
[также известный как экологический крекинг ] Обсуждение — Экологический крекинг — это общий термин, который включает в себя термины, перечисленные ниже. Определения этих терминов приведены в другом месте в этом документе: щелочное растрескивание , хлоридное коррозионное растрескивание , коррозионная усталость , водородное охрупчивание , водородное растрескивание (ступенчатое растрескивание) , водородное растрескивание , растрескивание жидким металлом , коррозионное растрескивание под напряжением , сульфидное растрескивание под напряжением . Обсуждение — Следующие термины использовались в прошлом в связи с растрескиванием под действием окружающей среды, но в настоящее время устарели и не должны использоваться: щелочная хрупкость , замедленное растрескивание сезонное растрескивание , статическая усталость , сульфидное коррозионное растрескивание , сульфидное коррозионное растрескивание под напряжением .
экологический крекинг — см. экологический крекинг .
эпоксидная смола — тип смолы, образованной реакцией алифатических или ароматических полиолов (например, бисфенола) с эпихлоргидрином и характеризующейся наличием реакционноспособных оксирановых концевых групп.
равновесный потенциал — потенциал электрода в электролите, при котором прямая скорость данной реакции точно равна скорости обратной. (Равновесный потенциал может быть определен только в отношении конкретной электрохимической реакции.) [также известный как обратимый потенциал ]
эрозия — прогрессирующая потеря материала с твердой поверхности в результате механического взаимодействия между этой поверхностью и жидкостью, многокомпонентной жидкостью или твердыми частицами, переносимыми с жидкостью.
эрозия-коррозия — сочетание эрозии и коррозии в присутствии движущейся агрессивной жидкости или материала, движущегося через жидкость, приводящее к ускоренной потере материала.
плотность тока обмена — скорость переноса заряда на единицу площади при достижении электродом динамического равновесия (при его обратимом потенциале) в растворе; то есть скорость анодного переноса заряда (окисления) точно равна скорости катодного переноса заряда (восстановления).
расслаивающая коррозия — подповерхностная коррозия, идущая латерально от мест зарождения вдоль плоскостей, параллельных поверхности, с образованием продуктов коррозии, оттесняющих металл от тела материала, что приводит к появлению слоистости, напоминающей страницы книги.
внешняя цепь — провода, соединители, измерительные устройства, источники тока и т. д., которые используются для создания или измерения желаемых электрических условий внутри гальванического элемента. Это часть клетки, через которую проходят электроны.
Приборы для испытаний на электрохимическую коррозию Gamry Instruments
Gamry находится в авангарде электрохимических испытаний на коррозию с момента нашего основания в 1981 году. Наши клиенты говорят нам, что простота использования и сокращение времени сбора данных являются наиболее важными характеристиками для их исследований.
Наши клиенты говорят нам, что простота использования и сокращение времени сбора данных являются наиболее важными характеристиками для их исследований.
Гамры Преимущества
Гамри Экспертиза
рекомендуемые
Электрохимическая коррозия Вопросы и ответы
Преимущества Gamry
Исследователи, стремящиеся к высокой производительности или выбору материалов, ищут простые в использовании и надежные системы, которые дадут им правильный ответ. Gamry уже давно известна как лидер рынка, когда речь идет о приборах для испытаний на коррозию. Выполнение тестирования ASTM очень просто благодаря нашему стандартному списку экспериментов: сопротивление поляризации, потенциодинамический анализ, циклическая поляризация и т. д. Наш мастер последовательности позволяет объединить эксперименты, нажать кнопку «Пуск» и вернуться к ним, когда закончите.
Все потенциостаты Gamry электрически изолированы, что позволяет проводить эксперименты на заземленных элементах, таких как автоклавы. Высокие напряжения соответствия обеспечивают достаточную мощность при работе с резистивными электролитами.
Наше аналитическое программное обеспечение позволяет легко обрабатывать данные, составлять отчеты и строить диаграммы. Легко сравнивайте результаты или экспортируйте данные для обработки в другой программе.
Gamry Expertise
Gamry Instruments производит недорогие электрически изолированные потенциостаты для испытаний на коррозию с 19 лет.89. У нас есть самая полная библиотека методов электрохимической коррозии, включая разработанные/эксклюзивные эксперименты Gamry.
Мы также готовы поделиться своим опытом с нашими клиентами. Существуют примечания по применению, которые имеют отношение к специалистам по коррозии и инженерам. У нас также есть специалисты по электрохимии, с которыми можно связаться по электронной почте или по телефону, которые разбираются в испытаниях на коррозию и могут указать вам правильное направление.
Если вы новичок в исследованиях коррозии и, в частности, в электрохимических испытаниях на коррозию, вы можете начать с краткого ознакомления с нашими рекомендациями по применению методов коррозии постоянным током и подумать о том, чтобы записаться на краткий курс, подобный тому, который преподается в Университете штата Пенсильвания каждый год. летом. Для тех, кто уже знаком с процессом электрохимической коррозии, ознакомьтесь с нашими рекомендациями по применению, посвященными спектроскопии электрохимического импеданса, и рассмотрите возможность замены Rp/Ec Trend на EFM Trend.
летом. Для тех, кто уже знаком с процессом электрохимической коррозии, ознакомьтесь с нашими рекомендациями по применению, посвященными спектроскопии электрохимического импеданса, и рассмотрите возможность замены Rp/Ec Trend на EFM Trend.
Рекомендуется
Рекомендуемые системы:
Стандартные ASTM G 59, G 61, F 746 или F 2129 Тестирование — интерфейс 1010B, 1010E или 5000E (одно- или многоканальные настройки в зависимости от потребности в пропускной способности), многопортовый, два Satur Электроды сравнения (один резервный). Gamry рекомендует электрохимический мультиплексор ECM8, если требуется повышенная пропускная способность по более низкой цене. Обратите внимание, что мультиплексор запускает эксперименты последовательно, а не одновременно. Для очень устойчивых к коррозии систем (очень низкая скорость коррозии) Gamry рекомендует Reference 600+ из-за его слаботочных характеристик (минимальный диапазон полной шкалы 60 пА).
Если вы планируете проводить эксперименты с электрохимическим импедансом, вам идеально подойдут Interface 1010E, Reference 600+, Reference 3000 и Reference 3000AE.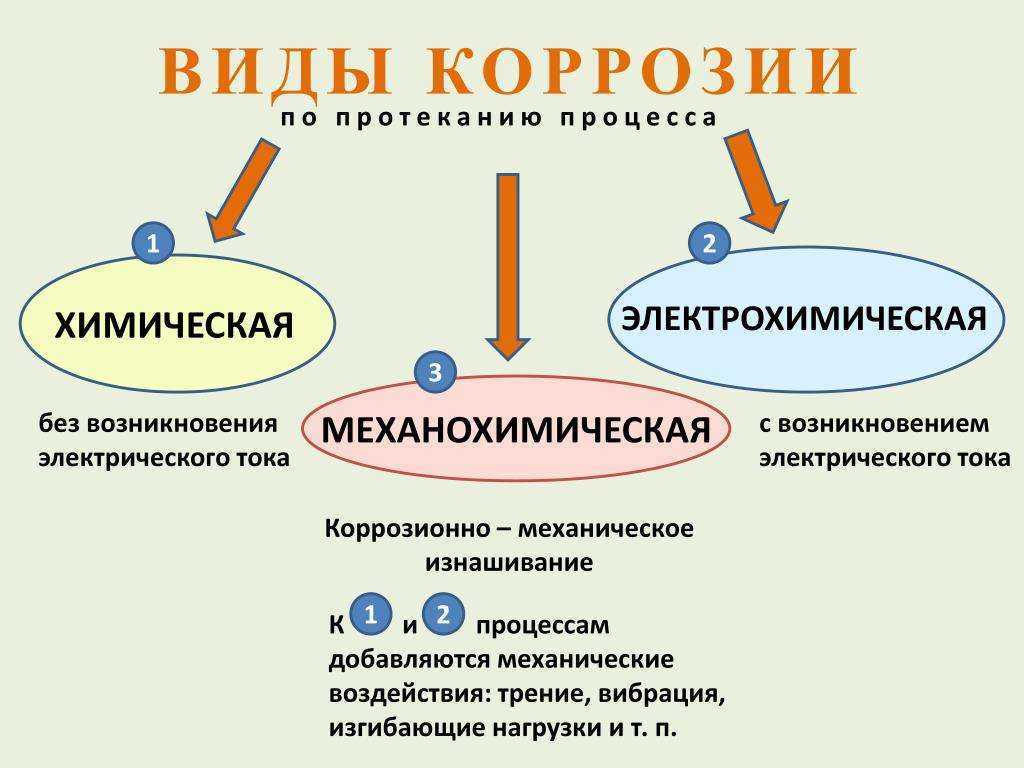
Критическая температура точечной коррозии — Любой из вышеупомянутых приборов может проводить эксперименты с критической температурой точечной коррозии, но вам также потребуется контроллер температуры TDC4 (или аналогичный), FlexCell, нагревательный кожух, двигатель мешалки и комплект мешалки.
Электрохимическая коррозия Вопросы и ответы
Что такое электрохимическая коррозия?
В большинстве случаев коррозия металлов происходит в результате электрохимических реакций на границе раздела между металлом и раствором электролита.
Коррозия – это химический процесс, при котором материалы портятся как часть процесса окисления. Коррозия обычно возникает, когда металл находится под нагрузкой или в анаэробной или безвоздушной среде. Ионы металлов растворяются и поглощаются деполяризатором, обычно кислородом.
Почему коррозия является электрохимическим процессом?
Коррозия является электрохимическим процессом, поскольку это процесс, при котором электроны перемещаются из одного участка поверхности металла в другой через среду, благоприятную для ионов. Жидкость в той или иной форме обычно действует как электролит, химически реагирующий с металлическими поверхностями.
Жидкость в той или иной форме обычно действует как электролит, химически реагирующий с металлическими поверхностями.
Коррозия обычно происходит со скоростью, определяемой равновесием между противоположными электрохимическими реакциями. Самая медленная химическая реакция между ионами определяет скорость возникновения коррозии. Это происходит из-за тенденции металлов возвращаться в свое естественное состояние, в виде оксида или руды.
Одной из реакций является анодная реакция, при которой металл окисляется, высвобождая электроны в металл.
В чем разница между химической и электрохимической коррозией?
Химическая коррозия возникает во влажных условиях, таких как присутствие электролита или влаги. Электрохимическая коррозия происходит при электрохимическом воздействии агрессивной среды на поверхность металла. Электрохимическая коррозия обычно протекает быстрее, чем химическая. Как правило, это более распространенное и более серьезное заболевание.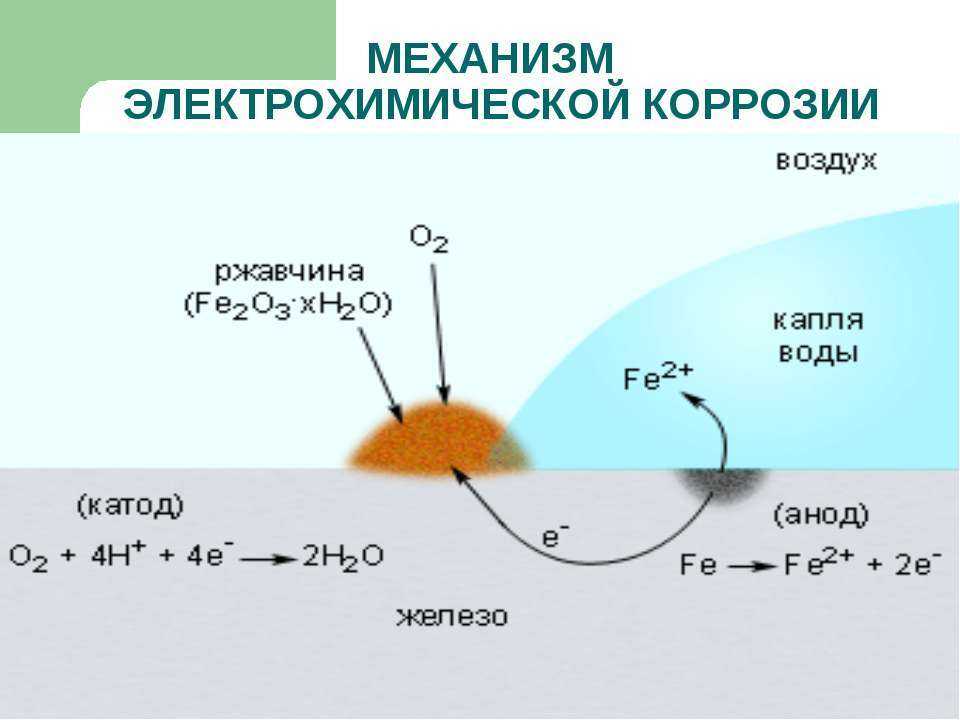
Какие четыре условия необходимы для возникновения электрохимической коррозии?
Для электрохимической коррозии необходимы четыре элемента: анод, катод, электролит и путь обратного тока.
Анодные и катодные реакции
Анод- Электрод, на котором гальванические реакции генерируют электроны. Отрицательные ионы разряжаются — образуются положительные ионы. Коррозия происходит на аноде.
Катод- Электрод, принимающий электроны — положительные ионы разряжаются, образуются отрицательные ионы. Катод защищен от коррозии.
В большинстве случаев коррозия металлов происходит в результате электрохимических реакций на границе раздела между металлом и раствором электролита.
Электролит — проводник, по которому проходит ток. Электролиты включают водные растворы или другие жидкости.
Потенциал металла является средством, с помощью которого анодные и катодные реакции поддерживаются в равновесии.
