Что такое электрохимическая и химическая коррозия: Химическая коррозия
Содержание
2.2 Электрохимическая коррозия металлов
Под электрохимической
коррозией подразумевают процесс
взаимодействия металлов с электролитами
в виде водных растворов, реже с неводными
электролитами, например, с некоторыми
органическими электропроводными
соединениями или безводными расплавами
солей при повышенных температурах.
Делится на электрокоррозию и
гальванокоррозию. Из указанных
разновидностей рассмотрим лишь
гальванокоррозию.
2.2.1 Электрохимическая
гальванокоррозия. Электрохимическая
коррозия – наиболее распространенный
вид коррозии металлов. Примером
коррозионных процессов электрохимического
характера является разрушение деталей
машин, приборов и различных металлических
конструкций в почвенных, грунтовых,
речных и морских водах, в атмосфере под
адсорбированными пленками влаги, в
технических растворах.
Растворенный
кислород и ионы водорода – важнейшие
окислители, вызывающие электрохимическую
коррозию металлов.
Рассмотрим схему
этого процесса. Сложность его заключается
в том, что на одной и той же поверхности
происходят одновременно два процесса,
противоположные по своему химическому
смыслу: окисление металла и восстановление
окислителя. Оба процесса должны протекать
сопряженно, чтобы сохранялось равенство
числа электронов, отдаваемых металлом
и присоединяющихся к окислителю в
единицу времени. Только в этом случае
может наступить стационарное состояние.
Итак, процессы
электрохимической коррозии протекают
по законам электрохимической кинетики,
когда общая реакция взаимодействия
может быть разделена на следующие, в
значительной степени самостоятельные,
электродные процессы:
– анодный
процесс
– переход металла в раствор в виде ионов
(в водных растворах, обычно гидратированных)
с оставлением эквивалентного количества
электронов в металле:
Ме
0
– nē
→ Ме
n+
– катодный
процесс
– ассимиляция появившихся в металле
избыточных электронов деполяризаторами.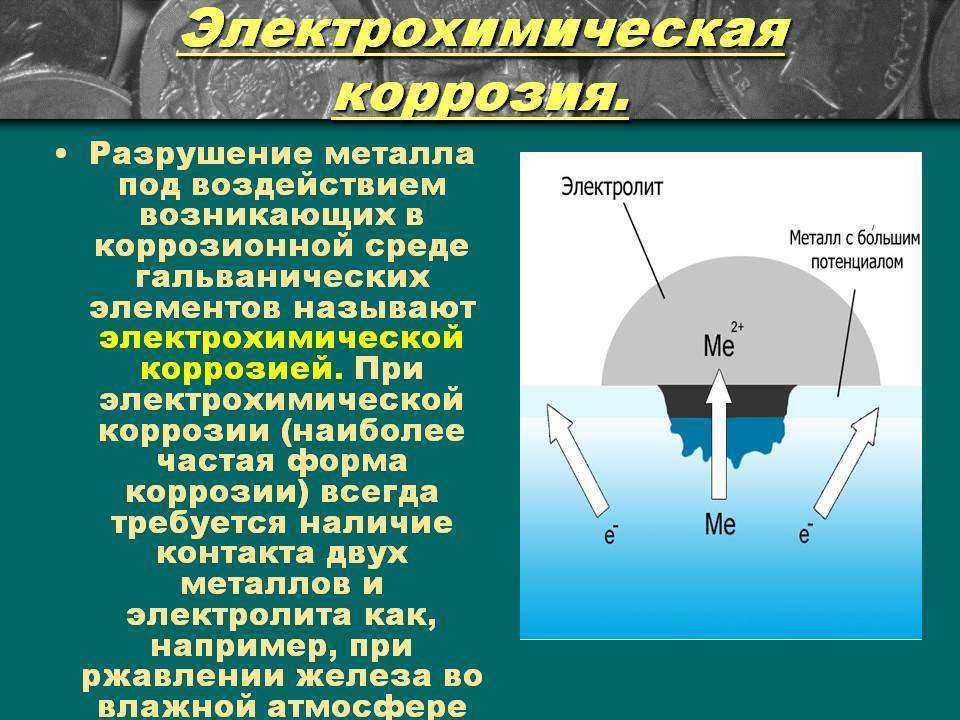
Различают коррозию
с водородной и кислородной (или
окислительной) деполяризацией. При
наличии в растворе газообразного
кислорода и невозможностью протекания
процесса коррозии с водородной
деполяризацией основную роль деполяризатора
исполняет кислород. Коррозионные
процессы, у которых катодная деполяризация
осуществляется растворенным в электролите
кислородом, называют процессами коррозии
металлов с кислородной деполяризацией.
Это наиболее распространенный тип
коррозии металла в воде, в нейтральных
и даже в слабокислых солевых растворах,
в морской воде, в земле, в атмосфере
воздуха.
Общая схема
кислородной деполяризации сводится к
восстановлению молекулярного кислорода
до иона гидроокисла:
O
+ 4ē +2H2O
→ 4OH—.
В случае водородной
деполяризации на катоде протекает
процесс восстановления ионов водорода,
находящихся в среде:
2Н++
2ē + → Н2.
Выбор
того или иного способа определяется
его эффективностью, а также экономической
целесообразностью.
2.3.1
Легирование металла –
эффективный (хотя обычно дорогой) метод
повышения коррозионной стойкости
металлов. При легировании
в состав сплава обычно вводят компоненты,
вызывающие пассивирование
металла. В качестве таких компонентов
применяются хром, никель, вольфрам и
др.
Основное
средство защиты металлов
от газовой коррозии –
легирование
такими компонентами, которые
улучшают свойства защитных пленок,
образующихся при окислении
металла. Для стали такими элементами
являются хром, алюминий,
кремний. Эти элементы при высоких
температурах окисляются
энергичнее, чем железо, и образуют при
этом плотные защитные
пленки оксидов.
2.3.2 Защитные
покрытия. Слои,
искусственно создаваемые на поверхности
металлических изделий и сооружений для
предохранения их от коррозии, называются
защитными покрытиями. Выбор
Выбор
вида покрытия зависит
от условий, в которых используется
металл.
Широко распространенным
способом защиты металлов от коррозии
является покрытие их слоем других
металлов. Покрывающие металлы сами
корродируют с малой скоростью, так как
покрываются плотной оксидной пленкой.
В
зависимости от величины электродного
потенциала защищаемого металла и
покрытия, различают катодные и анодные
покрытия.
Катодное покрытие
– металл покрытия менее активен, чем
защищаемый металл. Например, олово
хорошо покрывает железо и достаточно
стойко против действия разбавленных
растворов кислот. В случае механического
повреждения такого покрытия возникает
гальваническая пара, в которой электроны
переходят от железа к олову; анодом
здесь является железо, а катодом олово.
В этом случае разрушается железо, а
олово остается без изменений (рисунок
5).
Анодное покрытие
– покрытие более активным металлом.
Например, покрытие железа цинком (рисунок
4). При механическом повреждении цинкового
При механическом повреждении цинкового
покрытия возникает гальваническая
пара, в которой железо служит катодом,
а анодом – цинк. Электроны переходят
от цинка к железу, цинк разрушается, а
железо остается защищенным до тех пор,
пока не разрушится весь цинк. На основании
вышеизложенного можно сделать вывод о
том, что более надежным является анодное
покрытие.
а)б)
1
– раствор; 2
– покрытие; 3
–
основной
материал; 4
–
пора
Рисунок 4 – Схема коррозии металла в
кислом
растворе при нарушении анодного а) и
катодного б) покрытия
К
ряду покрытий, получаемых химической
обработкой металла, относятся
защитные покрытия, образующиеся
непосредственно на поверхности
металла. Образование на поверхности
металлических изделий
защитных оксидных пленок носит в технике
общее название оксидирование.
Неметаллические
защитные покрытия могут быть как
неорганическими,
так и органическими. Защитное действие
Защитное действие
этих покрытий сводится
в основном к изоляции металла от
окружающей среды. В качестве
неорганических покрытий могут быть
неорганические эмали, оксиды металлов,
соединения хрома, фосфора и др. К
органическим
относятся
лакокрасочные покрытия, покрытия
смолами, пластмассами, полимерными
пленками, резиной.
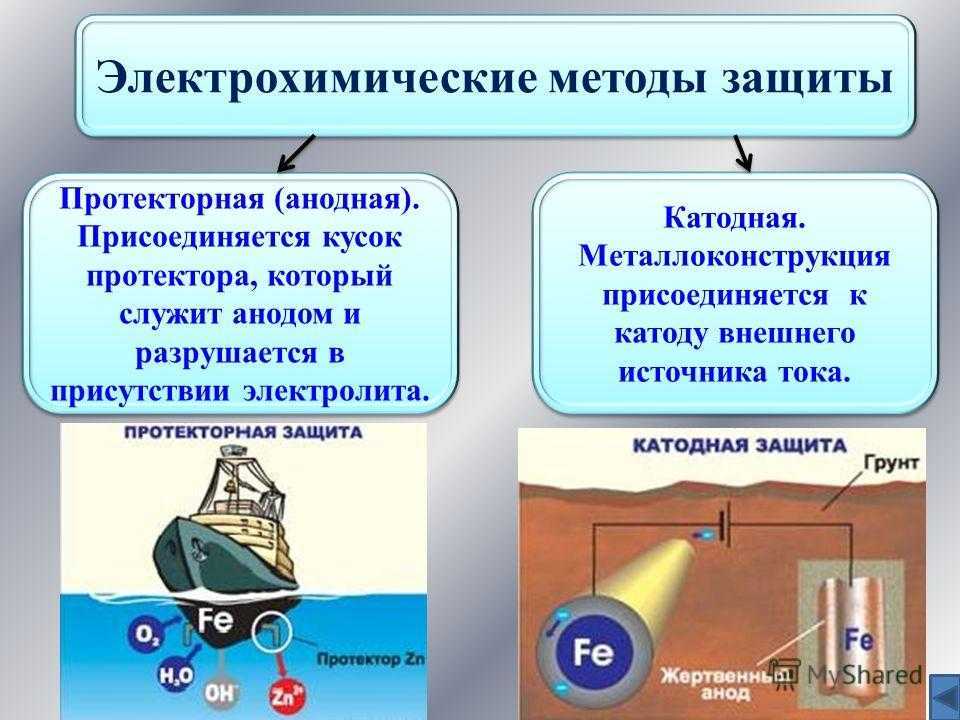
2.3.3 Электрохимические
методы защиты. Методы
электрохимической защиты основаны на
изменении потенциала защищаемого
металла и не связаны с изоляцией металла
от коррозионной среды. К ним относятся
катодная защита, называемая также
электрозащитой, и протекторная (или
анодная) защита.
Катодная защита
заключается в том, что защищаемая
конструкция А
(рисунок 5), находящаяся в среде электролита
(например, в почвенной воде), присоединяется
к катоду внешнего источника электричества
В.
Защищаемая
конструкция становится катодом. В ту
же агрессивную среду помещают кусок
старого металла Б
(рельс, балка), присоединяемый к аноду
внешнего источника электричества. В
В
процессе коррозии этот кусок старого
металла становится анодом и разрушается.
Протекторная
защита
отличается
от катодной защиты тем, что для ее
осуществления используется специальный
анод – протектор,
в качестве
которого применяют металл более активный,
чем металл защищаемой конструкции
(алюминий, цинк). Протектор Б
(рисунок 6)
соединяют с защищаемой конструкцией А
проводником
электрического тока В.
В процессе
коррозии протектор служит анодом и
разрушается, тем самым предохраняя от
разрушения защищаемую конструкцию.
Рисунок 5 – Схема катодной
Рисунок 6 – Схема анодной
защиты
(протекторной) защиты
2.3.4 Изменение
свойств коррозионной
среды. Изменение
свойств коррозионной среды
пригодно
для случаев, когда защищаемое изделие
эксплуатируется в ограниченном объеме
жидкости.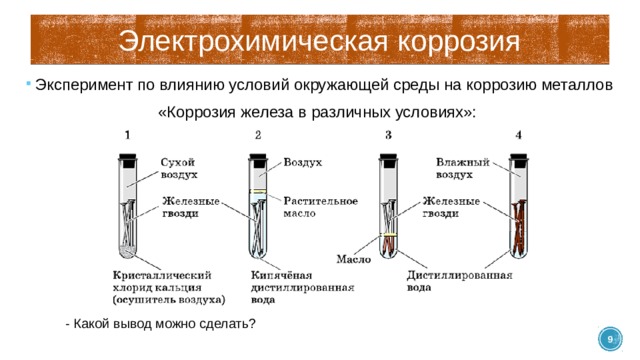 Один из методов состоит в
Один из методов состоит в
удалении из раствора, в котором
эксплуатируется защищаемая деталь,
растворенного кислорода (деаэрация).
В качестве примера можно привести
освобождение воды, идущей на питание
паровых котлов, от растворенного в ней
кислорода, что достигается, например,
при фильтровании воды через слой железных
стружек.
Для замедления
коррозии металлических изделий в
агрессивную среду вводят вещества,
называемые ингибиторами (или
замедлителями) коррозии.
Это имеет большое значение в тех случаях,
когда металл необходимо защищать от
разъедания кислотами.
В зависимости
от вида коррозии, природы металла и
раствора применяются различные
ингибиторы, действие которых специфично.
2.3.5 Создание
рациональных конструкций. Выбор
материалов и их сочетаний
для данной машины, конечно, диктуется
технической и экономической
целесообразностью, но должен обеспечивать
ее коррозионную устойчивость. Конструктор
должен предусмотреть рациональные
формы машины, допускающие быструю
очистку от грязи; машина
не должна иметь мест скопления влаги,
которая является возбудителем
коррозии.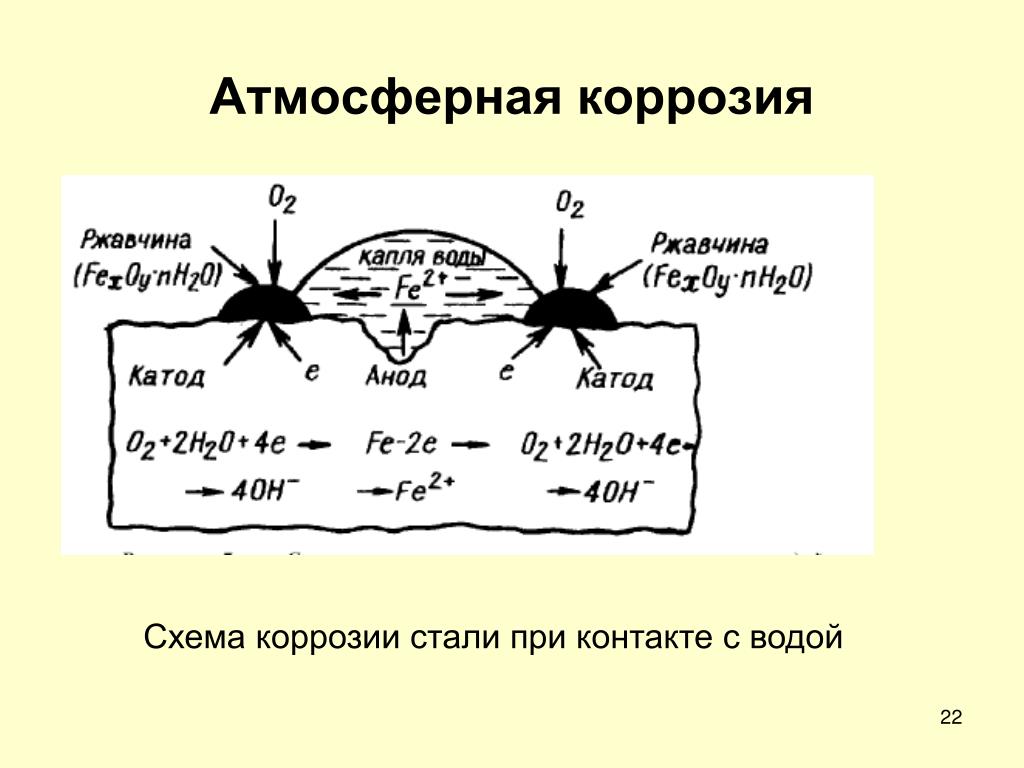
Коррозия и виды коррозии — Металл
Коррозия и виды коррозии — Металл
Термин коррозия происходит от латинского «corrosio», что означает разъедать, разрушать. Этот термин характеризует как процесс разрушения, так и результат.
Среда, в которой металл подвергается коррозии (коррозирует) называется коррозионной или агрессивной средой.
В случае с металлами, говоря об их коррозии, имеют в виду нежелательный процесс взаимодействия металла со средой. Физико-химическая сущность изменений, которые претерпевает металл при коррозии является окисление металла.
Любой коррозионный процесс является многостадийным:
- Необходим подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- Взаимодействие среды с металлом.
- Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
Коррозионный процесс является самопроизвольным, следовательно G=G-G (G и G относятся к начальному и конечному состоянию соответственно). Если G>G то G<0, т.е. коррозионный процесс возможен; G>0 коррозионный процесс невозможен; G=0 система металл-продукт находится в равновесии. То есть можно сказать, что первопричиной коррозии металла является термодинамическая неустойчивость металлов в заданной среде.
Если G>G то G<0, т.е. коррозионный процесс возможен; G>0 коррозионный процесс невозможен; G=0 система металл-продукт находится в равновесии. То есть можно сказать, что первопричиной коррозии металла является термодинамическая неустойчивость металлов в заданной среде.
1. Классификация коррозионных процессов.
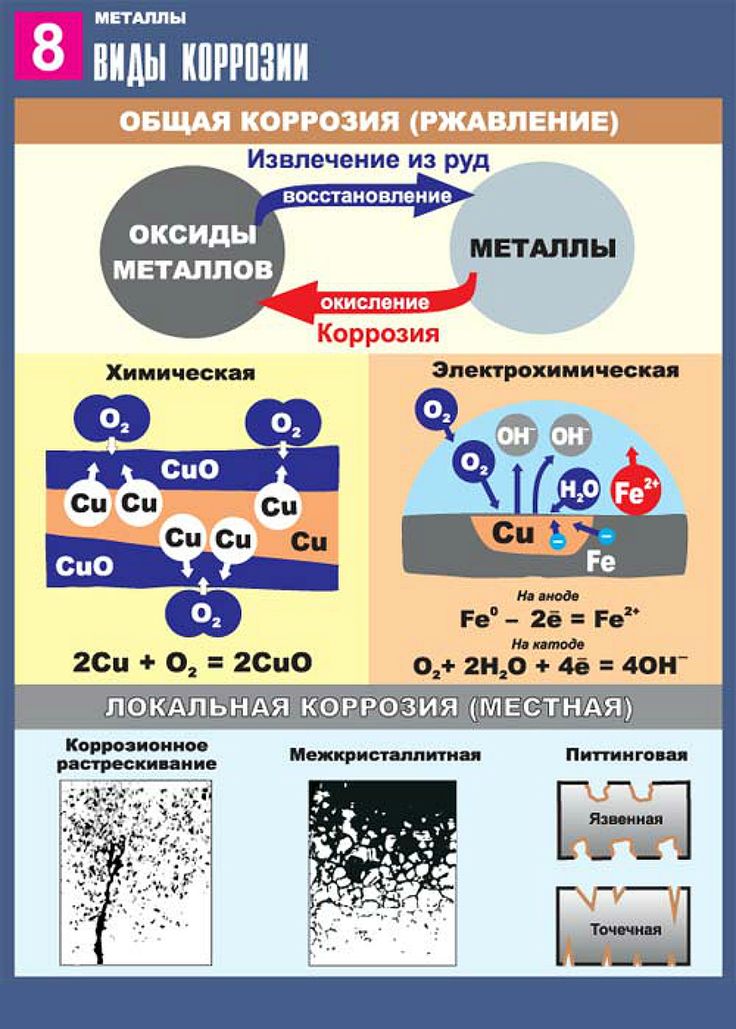
- По механизму процесса различают химическую и электрохимическую коррозию металла.Химическая коррозия — это взаимодействие металлов с коррозионной средой, при котором окисляется металл и восстанавливается окислительные компоненты коррозионной среды протекают в одном акте. Так протекает окисление большинства металлов в газовых средах содержащих окислитель (например, окисление в воздухе при повышении температуры).Электрохимическая коррозия — это взаимодействие металла с коррозионной средой, при котором ионизация атомов металла и восстановление окислительной компоненты среды происходит не водном акте, и их скорости зависят от электродного потенциала металла. По такому процессу протекают, например, взаимодействие металла с кислотами.

- По характеру коррозионного разрушения.Общая или сплошная коррозия при которой коррозирует вся поверхность металла. Она соответственно делится на равномерную (1а), не равномерную (1б) и избирательную (1в), при которой коррозионный процесс распространяется преимущественно по какой-либо структурной составляющей сплава.Местная коррозия при которой коррозируют определенные участки металла:
- коррозия язвами — коррозионные разрушения в виде отдельных средних и больших пятен (коррозия латуни в морской воде)
- межкристаллическая коррозия при ней процесс коррозии распространяется по границе металл-сплав (алюминий сплавляется с хромоникелем) и другие виды коррозии.
- По условиям протекания процесса.
- Газовая коррозия — это коррозия в газовой среде при высоких температурах. (жидкий металл, при горячей прокатке, штамповке и др.)
- Атмосферная коррозия — это коррозия металла в естественной атмосфере или атмосфере цеха (ржавление кровли, коррозия обшивки самолета).
- Жидкостная коррозия — это коррозия в жидких средах: как в растворах электролитов, так и в растворах не электролитов.
- Подземная коррозия — это коррозия металла в почве
- Структурная коррозия — коррозия из-за структурной неоднородности металла.
- Микробиологическая коррозия — результат действия бактерий
- Коррозия внешним током — воздействие внешнего источника тока (анодное или катодное заземление)
- Коррозия блуждающими токами — прохождение тока по непредусмотренным путям по проекту.
- Контактная коррозия — сопряжение разнородных электрохимических металлов в электропроводящей среде.
- Коррозия под напряжением — одновременное воздействие коррозионной среды и механического напряжения.
1.2 Показатель скорости коррозии.
Для установления скорости коррозии металла в данной среде обычно ведут наблюдения за изменением во времени какой-либо характеристики, объективно отражающей изменение свойства металла.
Чаще всего в коррозионной практике используют следующие показатели.
- Показатель изменения массы — изменение массы образца в результате коррозии отнесенный к единице поверхности металла S и к единице времени (например, г/м ч) в зависимости от условий коррозии различают:
- отрицательный показатель изменения массы
- положительный показатель изменения массы
- Объемный показатель коррозииПрименительно к электрохимической коррозии когда процесс катодной деполяризации осуществляется за счет разряда ионов водорода, например, по схеме 2Н + 2е = Н, или ионизация молекул кислорода О + 4е +2НО = 4ОН; вводятся соответственно кислородный (К ) и водородный (К ) показатель соответственно.Водородный показатель коррозии — это объем выделившегося Н в процессе коррозии, отнесенный к Su .
Кислородный показатель коррозии — это объем поглощенного в процессе О , отнесенный к Su .
- Показатель сопротивления.Изменение электрического сопротивления образца металла за определенное время испытаний также может быть использован в качестве показания коррозии (К).
 КR = ( R/Ro)100% за время t
КR = ( R/Ro)100% за время tгде Ro и R электрическое сопротивление образца соответственно до и после коррозии.
У этого способа есть некоторый недостаток толщина металла во все время испытаний должна быть одинаковой и по этой причине чаще всего определяют удельное сопротивление, т.е. изменение электрического сопротивления на единицу площади образца (см, мм) при длине равной единице. Этот метод имеет ограничения применения (для листового металла не более 3мм). Наиболее точные данные получают для проволочных образцов. Этот метод не пригоден для сварных соединений.
- Механический показатель коррозии.Изменение какого-либо свойства металла за время коррозии . Сравнительно часто пользуются изменением предела прочности.Глубина коррозионного разрушения может быть средней или максимальной. Глубинный показатель коррозии можно использовать для характеристики как равномерной., так и неравномерной коррозии (в том числе и местной) металлов. Он удобен для сравнения скорости коррозии металла с различными плотностями.
 Переход от массового, токового и объемного к глубинному возможен при равномерной коррозии.
Переход от массового, токового и объемного к глубинному возможен при равномерной коррозии.
2. Электрохимическая коррозия.
Электрохимическая коррозия является наиболее распространенным типом коррозии металлов. По электрохимическому механизму коррозируют металлы в контакте с растворами электролитов (морская вода, растворы кислот, щелочей, солей) . В обычных атмосферных условиях и в земле металлы коррозируют также по электрохимическому механизму , т.к. на их поверхности имеются капли влаги с растворенными компонентами воздуха и земли. Электрохимическая коррозия является гетерогенным и многостадийным процессом. Ее причиной является термодинамическая неустойчивость металлов в данной коррозионной среде.
Термодинамика электрохимической коррозии металлов.
Стремлением металлов переходить из металлического состояния в ионное для различных металлов различно. Вероятность такого перехода зависит также от природы коррозионной среды. Такую вероятность можно выразить уменьшением свободной энергии при протекании реакции перехода в заданной среде при определенных условиях.

Следовательно, для электрохимического растворения металла необходимо присутствие в растворе окислителя (деполяризатора, который бы осуществлял катодную реакцию ассимиляции электронов), обратимый окислительно-восстановительный потенциал которого положительнее обратимого потенциала металла в данных условиях.
Катодные процессы при электрохимической коррозии могут осуществляться различными веществами.
- ионами
- молекулами
- оксидами и гидрооксидами (как правило малорастворимыми продуктами коррозии, образованными на поверхности металлов)
- органическими соединениями
В коррозионной практике в качестве окислителей-деполяризаторов, осуществляющих коррозию, выступают ионы водорода и молекулы растворенного в электролите кислорода.
При увеличении активности ионов металла (повышение концентрации ионов металла в растворе), потенциал анода возрастает, что приводит к торможению растворения металла. Понижение активности металла, напротив, способствует растворению металла.
 В ходе коррозионного процесса изменяются не только свойства металлической поверхности, но и контактирующего раствора (изменение концентрации отдельных его компонентов). При уменьшении, например, концентрации деполяризатора, у катодной зоны может оказаться, что катодная реакция деполяризации термодинамически невозможна.
В ходе коррозионного процесса изменяются не только свойства металлической поверхности, но и контактирующего раствора (изменение концентрации отдельных его компонентов). При уменьшении, например, концентрации деполяризатора, у катодной зоны может оказаться, что катодная реакция деполяризации термодинамически невозможна.Гомогенные и гетерогенные пути электрохимической коррозии.
Причину коррозии металлов в растворах, не содержащих одноименных ионов, объясняет теория необратимых потенциалов. Эта теория рассматривает поверхность металлов как однородную, гомогенную. Основной и единственной причиной растворения (коррозии) таких металлов является термодинамическая возможность протекания анодного и катодного актов. Скорость растворения (коррозии) будет определяться кинетическими факторами. Но гомогенную поверхность металлов можно рассматривать как предельный случай, который может быть реализован, например, в жидких металлах. (ртуть и амальгамы металлов). Для твердых металлов такое допущение будет ошибочным, хотя бы потому что различные атомы сплава (и чистого металла) занимают различное положение в кристаллической решетке.
 Наиболее сильное отклонение от гомогенной конструкции будет наблюдаться при наличии в металле инородных включений, интерметаллидов, границ зерен и т.д. В этом случае, разумеется, поверхность является гетерогенной. Установлено, что даже при наличии на поверхности металла неоднородностей в целом поверхность остается эквипотенциальной.
Наиболее сильное отклонение от гомогенной конструкции будет наблюдаться при наличии в металле инородных включений, интерметаллидов, границ зерен и т.д. В этом случае, разумеется, поверхность является гетерогенной. Установлено, что даже при наличии на поверхности металла неоднородностей в целом поверхность остается эквипотенциальной.Таким образом, неоднородность поверхностей сплава не может являться основной причиной общей коррозии металла. Наиболее существенной в подобных случаях является ионизация растворения анодной составляющей вблизи катодной составляющей, это возможно, если на поверхности металлической конструкции возникают гальванические элементы. Рассмотрим некоторые из них:
а) неоднородность металлической фазы, обусловленная неоднородностью сплава, а также в результате микро и макровключений.
б) неоднородность поверхности металла в следствие наличия границ блоков и зерен кристаллов, выход дислокаций на поверхность, анизотропность кристаллов.
в), г) неоднородность защитных пленок на поверхности за счет микро и макропор пленки (в), за счет неравномерного образования на поверхности вторичных продуктов коррозии (г) и др.
Мы рассмотрели два крайних механизма саморастворения металлов: равномерное растворение идеально гомогенной поверхности и растворения (в основном локальное) микроэлементов при пространственном разделении катодных и анодных зон (процессов).
В общем случае, необходимо считаться с возможностью протекания на анодных участках наряду с основными анодными процессами катодных процессов, на катодных же участках могут протекать с пониженной скоростью анодные процессы растворения.
Можно сделать вывод, что нет оснований противопоставлять «гомогенный» и «гетерогенный» пути протекания коррозионных процессов. Правильнее будет их рассматривать как факторы, взаимно дополняющие друг друга. Основной же причиной коррозии металлов остается по-прежнему термодинамическая вероятность протекания в данных условиях на металле анодных процессов ионизации металла и сопряженного с ним катодного процесса деполяризации.
Анодные процессы при электрохимической коррозии металлов.
Термодинамические основы.

Для протекания коррозионного процесса существенным является состояние форма соединения , в котором находится катион металла в растворе. Ионизация металла с последующим переходом в раствор простых компонентов металла представляет лишь одно из возможных направлений анодных процессов. Форма их конкретного состояния во многом определяется как природой металла и контактирующей с ним средой , так и направлением и величиной поляризующего тока (или электродного потенциала). Переходя в раствор, коррозирующий металл вступает в связь либо с растворителем, либо с компонентами раствора. При этом могут образовываться простые и комплексные соединения с различной растворимостью и с различной адгезией к поверхности металла. При высоких положительных значениях потенциала на аноде возможен процесс окисления воды с выделением кислорода. В зависимости от того, какие процессы или их сочетания протекают на аноде, они могут в значительной мере (а иногда и полностью) контролировать суммарный процесс коррозии.

Причины анодного растворения металлов.
Простейшими анодными реакциями являются такие , в результате которых образуются растворимые гидратированные и комплексные катионы,. которые отводятся от анода путем диффузии, миграции (перенос за счет электрического поля) или конвекции.
Полярные молекулы жидкости электростатически взаимодействуют с заряженными ионами, образуют сольватные (в случае воды-гидратные) комплексы. Обладающие значительно меньшим запасом энергии чем ионы в кристаллической решетки металла. Величину этого понижения можно оценить, исходя из соображений предложенных Борном. Полный электрический заряд в вакууме обладает энергией, равной потенциальной энергии. Для определения величины энергии заряда представим, что проводящая сфера радиусом r имеет заряд q. Внесение еще одной части заряда dq в сферу должно быть встречено отталкивающими силами df=qdq/r. Поистине огромное уменьшение энергии иона в водном растворе указывает на устойчивость такого состояния в нем.
 Таким образом, причиной перехода атомов металла с поверхности и их ионизация является электростатическое взаимодействие (сольватация) ионов металла с полярными молекулами растворителя.
Таким образом, причиной перехода атомов металла с поверхности и их ионизация является электростатическое взаимодействие (сольватация) ионов металла с полярными молекулами растворителя.Анодная пассивность металлов.
При значительном торможении анодной реакции ионизации металла скорость коррозионного процесса может понизится на несколько порядков. Такое состояние металла принято называть анодной пассивностью. Пассивность можно определить следующим образом: пассивность — состояние повышенной коррозионной устойчивости металла или сплава (в условиях, когда термодинамически он является реакционно способным), Вызванное преимущественным торможением анодного процесса т.е. может произойти так, что в реальных условиях скорость коррозии «активных» элементов оказывается весьма незначительной в следствии наступления пассивного состояния. Например, титан расположенный левее цинка, и хром, расположенный рядом с цинком, в следствии наступления пассивности оказываются более коррозионностойкими в большинстве водных сред, чем цинк.
 На склонность к пассивному состоянию влияет природа системы металл-раствор. Наибольшую склонность к переходу в пассивное состояние проявляют Ti,Ni,Al,Mg,Fe,Co и др.
На склонность к пассивному состоянию влияет природа системы металл-раствор. Наибольшую склонность к переходу в пассивное состояние проявляют Ti,Ni,Al,Mg,Fe,Co и др.Наступление пассивного состояния приводит к значительному изменению формы анодной поляризационной кривой. Кривая может быть разбита на несколько характерных участков:
Но начиная с В становится возможным процесс образования защитного слоя (фазового или адсорбционного), скорость которого растет при смещении потенциала в положительную сторону. Это приводит к торможению анодного растворения (BD). В точке D, соответствующей потенциалу ( потенциал начала пассивации) скорость образования защитного слоя равна скорости его растворения. Далее идет рост защитного слоя, экранирующего поверхность, скорость анодного растворения резко понижается (DE). В точке Е, соответствующей потенциалу полной пассивации металл оказывается в пассивном состоянии. На участке EF (область пассивного состояния) скорость анодного процесса не зависит от потенциала, а определяется скоростью химического растворения защитной пленки.
 Ток соответствующий области пассивного состояния, называется током пассивного состояния (i ). Положительнее F возможна ( -потенциал перепассивации) новая ветвь активного растворения с образованием катионов более высокой валентности.
Ток соответствующий области пассивного состояния, называется током пассивного состояния (i ). Положительнее F возможна ( -потенциал перепассивации) новая ветвь активного растворения с образованием катионов более высокой валентности.При высоких положительных потенциалах возможен локализованный пробой оксидной пленки — металл начинает растворятся по типу питтинга (PP’) называют потенциалом питтингообразования.
Металл запассивированный в данной среде, может сохраняться в пассивном состоянии некоторое время в непассивирующей среде.
3. Деполяризация.
При наличии в растворе газообразного кислорода и не возможностью протекания процесса коррозии с водородной деполяризацией основную роль деполяризатора исполняет кислород коррозионные процессы, у которых катодная деполяризация осуществляется растворенным в электролите кислородом, называют процессами коррозии металлов с кислородной деполяризацией. Это наиболее распространенный тип коррозии металла в воде, в нейтральных и даже в слабокислых солевых растворах, в морской воде, в земле, в атмосфере воздуха.
Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой Р=0,21 атм. Следовательно, при определении термодинамической возможности протекания коррозионного процесса с кислородной деполяризацией следует производить учитывая реальное парциальное давление кислорода в воздухе (см. табл.). Т.к. значения (V ) очень положительны, то условия соблюдаются в очень многих случаях. В следующей таблице приведены значения ЭДС и изменения изобарно-изотермических потенциалов коррозионных процессов с кислородной деполяризацией:
Изучение восстановления кислорода на неблагородных металлах (а именно они представляют наибольший интерес с точки зрения коррозии) затрудняется тем, что при катодной поляризации электрода металл может иметь потенциал более положительный, чем равновесный и, следовательно, подвергается окислению (ионизации).
При катодной поляризации в определенном интервале потенциалов будут происходить одновременно два процесса восстановление кислорода и окисление металла. Окисление металла прекратится когда потенциал металла будет равен или станет отрицательнее равновесного потенциала металла. Эти обстоятельства затрудняют изучение процессов кислородной деполяризации.
Окисление металла прекратится когда потенциал металла будет равен или станет отрицательнее равновесного потенциала металла. Эти обстоятельства затрудняют изучение процессов кислородной деполяризации.
Список используемой литературы
1. Исаев «Коррозия металлов»
2. Жук «Курс коррозии и защиты металлов»
+7 800 201-25-58
+7 495 198-17-23
+7 495 767-10-42
[email protected]
Спасибо! Ваше сообщение успешно отправлено!
Компания*
Номер телефона*
ФИО*
Электронная почта*
Загрузить файл
Интересующая услуга
Своими словами
Коррозия: Химическое окисление | Plant Engineering
В предыдущем выпуске обсуждалось, как коррозионная ячейка, содержащая анод, катод, электролит и металлический канал, необходима для возникновения электрохимической коррозии. Были также обсуждены наиболее распространенные формы и их эффекты, такие как гальваническая, щелевая и точечная. По этому вопросу мы обсудим химическое окисление, которое в промышленности часто называют химической коррозией или кислотной коррозией, и объясним его наиболее распространенные формы.
По этому вопросу мы обсудим химическое окисление, которое в промышленности часто называют химической коррозией или кислотной коррозией, и объясним его наиболее распространенные формы.
Химическое окисление
Химическое окисление, в отличие от электрохимического, может происходить при недостатке кислорода и не требует наличия сложной ячейки. Химическое окисление вызывается веществом, это вещество можно отнести к категории кислот или щелочей. Общее правило заключается в том, что чем более кислотным является вещество, тем более оно коррозионно-активно, а чем более щелочным является менее коррозионно-активное 6 .
Уровень кислотности или щелочности вещества обычно измеряется его рН. рН определяется как «отрицательный десятичный логарифм активности ионов водорода в растворе» 7 . Согласно этому определению, чем выше рН вещества, тем оно более щелочное, чем ниже рН, тем оно более кислое. В таблице 2 представлены значения pH обычных веществ.
Сложность защиты от химического воздействия заключается в том, что кислоты могут превращаться в пары, перемещаться на поверхность металла, быстро вступать в реакцию с влагой и вызывать коррозию металла. Кислоты, такие как азотная, могут не только испаряться и перемещаться по воздуху, но также могут проникать в органические материалы, такие как покрытия, и разрушать металл позади них. Щелочи также могут вызывать коррозию в правильной среде. Гипохлорит натрия представляет собой промышленную соль, которая является сильнощелочной, но чрезвычайно коррозионной. Важно отметить, что, хотя окисляющая соль может быть щелочной, при определенных обстоятельствах она может быть очень коррозионной. Наиболее распространенными формами химического окисления являются коррозия бетона, тепловая коррозия и микробная коррозия.
Коррозия бетона
Коррозия бетона может происходить двумя путями: через арматурные стержни и из-за химического воздействия. Коррозия бетона через арматурные стержни является формой электрохимической коррозии из-за влаги, которая проникает к стержням через бетон, поскольку он очень пористый. Химическая, однако, представляет собой гораздо более сложную форму, она атакует либо выщелачивая гидроксид кальция, либо проникая в него. Бетон представляет собой сильнощелочной строительный материал, который в основном состоит из гидратированного силиката кальция, матрицы цементного теста. Кальций – это элемент, который часто «вымывается» из бетона, ослабляя его.
Химическая, однако, представляет собой гораздо более сложную форму, она атакует либо выщелачивая гидроксид кальция, либо проникая в него. Бетон представляет собой сильнощелочной строительный материал, который в основном состоит из гидратированного силиката кальция, матрицы цементного теста. Кальций – это элемент, который часто «вымывается» из бетона, ослабляя его.
Когда кислота, такая как серная кислота, воздействует на бетон, в результате происходит ухудшение или полное растворение матрицы цементного теста. Это разрушение ослабляет бетон и придает ему вид «края» или «обнаженного бетона», о котором часто сообщается в отчетах об отказах. На бетон также может воздействовать углекислый газ в воздухе в результате процесса, называемого карбонизацией. В этом процессе диоксид углерода реагирует с гидроксидом кальция с образованием карбоната кальция. Этот процесс уменьшает толщину бетона, а также снижает pH, что позволяет легко инициировать электрохимическую коррозию при наличии арматурных стержней.
Микробная коррозия
Микробная коррозия вызывается микроорганизмами, бактериями не только металлов, но и бетона, пластика и других материалов. Эта форма химической коррозии может возникать при наличии кислорода из-за аэробных бактерий и при недостатке кислорода из-за анаэробных бактерий. Наиболее распространенный тип микробной коррозии вызывается Acidithiobacillus, где бактерии действуют как сульфид-редуцирующий агент, который производит серную кислоту, разрушающую поверхность. Другие бактерии в присутствии кислорода могут фактически окислять железо до оксида железа. Бактериальная коррозия также может способствовать электрохимической коррозии за счет повышения концентрации кислорода и образования точечной коррозии 9.0009 10 . Микробная коррозия является предметом, который в настоящее время подвергается большому количеству исследований. Бактерии, которые могут расти и разъедать как в соленой, так и в пресной воде, а также бактерии, которые могут использовать водород, образующийся в процессе электрохимической коррозии, что устраняет потребность в кислороде.
Тепловая коррозия
Тепловая коррозия, также известная как высокотемпературная коррозия, представляет собой разрушение металла в результате образования накипи солей и других соединений из горячих газов. Как следует из названия, эта форма химической коррозии возникает в средах с высокими температурами, например, в тракте горячего газа в газовой турбине. Распространенной последовательностью тепловой коррозии является последовательность науглероживания – пыления – зеленой гнили. Эта последовательность начинается, когда высокие температуры находятся в присутствии соединений углерода, которые вызывают увеличение содержания углерода в металле (обычно это сплав хрома и никеля) на поверхности. В результате происходит затвердевание поверхности металла, что приводит к охрупчиванию, растрескиванию и, в конечном итоге, выходу из строя. Дальнейшее воздействие этой среды с высоким содержанием углерода приводит к образованию карбидов в структуре металла и распаду их на графит. Этот графит действует как катализатор разложения местного монооксида углерода на углерод и кислород. Этот второй этап известен как напыление металла. Третья стадия происходит только в том случае, если металл, как указано выше, представляет собой хромоникелевый сплав. Это довольно катастрофическая форма коррозии, когда происходит быстрый цикл между науглероживанием и выделением оксидов на поверхности металла. Обычно это приводит к зеленоватому остатку оксида хрома и значительной потере металла 9.0009 11 . Эта последняя стадия известна как зеленая гниль. Все эти стадии могут протекать в диапазоне температур от 572 o F до 1922 o F 11 .
Этот графит действует как катализатор разложения местного монооксида углерода на углерод и кислород. Этот второй этап известен как напыление металла. Третья стадия происходит только в том случае, если металл, как указано выше, представляет собой хромоникелевый сплав. Это довольно катастрофическая форма коррозии, когда происходит быстрый цикл между науглероживанием и выделением оксидов на поверхности металла. Обычно это приводит к зеленоватому остатку оксида хрома и значительной потере металла 9.0009 11 . Эта последняя стадия известна как зеленая гниль. Все эти стадии могут протекать в диапазоне температур от 572 o F до 1922 o F 11 .
В заключение, термины «электрохимическая коррозия» и «химическое окисление» являются всего лишь механизмами деградации материалов из-за реакции с окружающей средой. Технологии защиты от коррозии разрабатываются и развиваются каждый день из-за того, что мы до сих пор не до конца понимаем, почему некоторые материалы подвергаются коррозии. Промышленная среда становится все более и более агрессивной, что требует развития и этих технологий защиты от коррозии. Некоторые из этих методов включают разработку коррозионно-стойких металлов, таких как супердуплексная нержавеющая сталь, технологии контроля окружающей среды, такие как использование химических ингибиторов, барьеров, таких как покрытия и эпоксидные смолы, катодную защиту и модификацию изготовления, чтобы избежать, скажем, щелей, ведущих к щелевая коррозия.
Промышленная среда становится все более и более агрессивной, что требует развития и этих технологий защиты от коррозии. Некоторые из этих методов включают разработку коррозионно-стойких металлов, таких как супердуплексная нержавеющая сталь, технологии контроля окружающей среды, такие как использование химических ингибиторов, барьеров, таких как покрытия и эпоксидные смолы, катодную защиту и модификацию изготовления, чтобы избежать, скажем, щелей, ведущих к щелевая коррозия.
Все эти различные формы коррозии всегда можно проследить до одного из двух основных типов механизмов: электрохимического и химического окисления. Обсуждаемые здесь формы наиболее часто встречаются в отрасли. Коррозия представляет собой очень широкую и серьезную проблему в современной промышленности, приводящую к потере производительности на предприятиях, а иногда и к трагедиям. Не только металлы подвержены коррозии, пластмассы, бетон и широкий спектр материалов разлагаются из-за реакций с окружающей средой.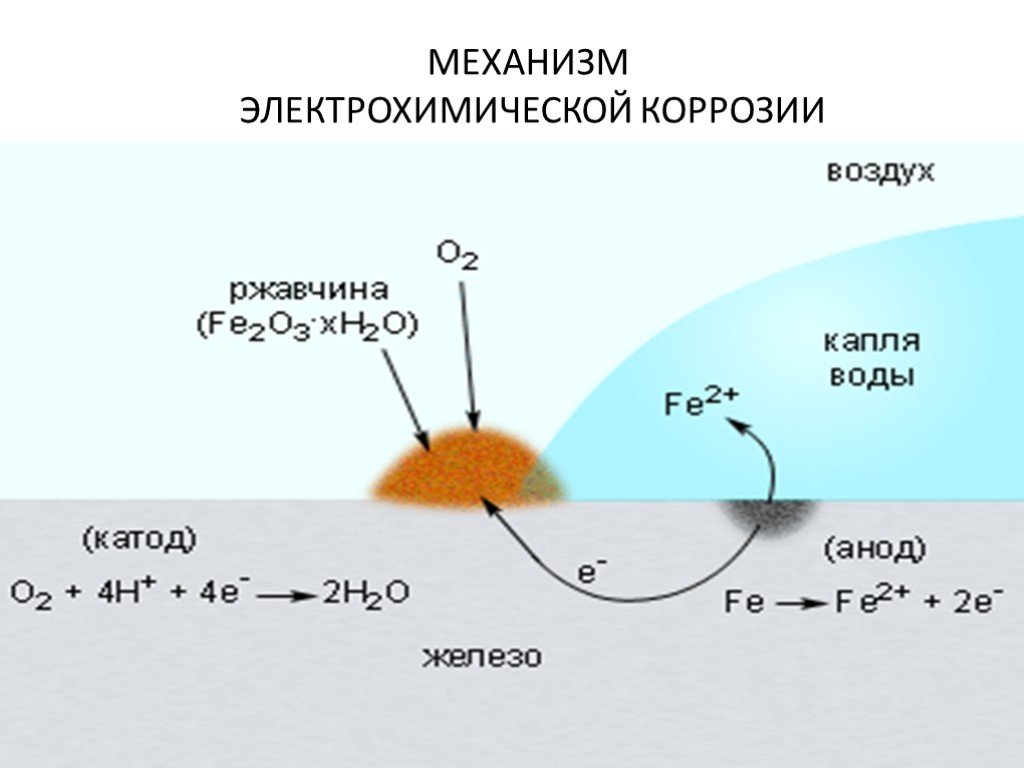 Коррозия — это непрерывный жизненный цикл нашего оборудования и материалов, непрерывный жизненный цикл нашего промышленного мира.
Коррозия — это непрерывный жизненный цикл нашего оборудования и материалов, непрерывный жизненный цикл нашего промышленного мира.
См. также Коррозия: электрохимическая
6 Мунгер, Чарльз. Предотвращение коррозии с помощью защитных покрытий, Глава 1, Коррозионная ячейка. Национальная ассоциация инженеров по коррозии, стр. 21, 1984
7 Томпсон, Нил. «Хронология расщелины». Коррозия-Доктора. 28 декабря 2010 г.
8 Мангер, Чарльз. Предотвращение коррозии с помощью защитных покрытий, Глава 1, Коррозионная ячейка. Национальная ассоциация инженеров по коррозии, стр. 28, 1984
9 Ник Милослав. Сборник химической терминологии ИЮПАК. Международный союз теоретической и прикладной химии, 2005.
10 Schwermer, C.U., G. Lavik, R.M.M. Abed, B. Dunsmore, T.G. Ferdelman, P. Stoodley, A. Gieseke и D. de Beer. Влияние нитратов на структуру и функции бактериальных биопленочных сообществ в трубопроводах, используемых для закачки морской воды в нефтяные месторождения. Прикладная и экологическая микробиология, 2008.
Прикладная и экологическая микробиология, 2008.
11 К.М. Чун, Дж.Д. Мамфорд и Т.А. О механизме коррозии металла от пыли, Раманараянан. (без даты)
Есть ли у вас опыт и знания по темам, упомянутым в этом содержании? Вам следует подумать о том, чтобы внести свой вклад в нашу редакционную команду CFE Media и получить признание, которого вы и ваша компания заслуживаете. Нажмите здесь, чтобы начать этот процесс.
ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). (Журнальная статья)
ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). (Журнальная статья) | ОСТИ.GOV
перейти к основному содержанию
- Полная запись
- Другое связанное исследование
- Авторов:
Вурхис, Дж.
 Д.
Д.
- Дата публикации:
- Исследовательская организация:
- Стэнфордский университет, Калифорния
- Организация-спонсор:
- USDOE
- Идентификатор ОСТИ:
- 4688749
- Номер АНБ:
- НСА-26-018154
- Тип ресурса:
- Журнальная статья
- Название журнала:
- Дж. Электрохим. соц. 119: № 2, 219–22 (февраль 1972 г.).
- Дополнительная информация журнала:
- Другая информация: ориг.
 Дата поступления: 31 декабря 1972 г.
Дата поступления: 31 декабря 1972 г.
- Страна публикации:
- Страна неизвестна/код недоступен
- Язык:
- Английский
- Тема:
- N50110* — Металлы, керамика и другие материалы — Керамика и металлокерамика — Коррозия, эрозия и поверхностные явления; АНОДЫ; ЦЕРИЯ СУЛЬФАТЫ; КОРРОЗИЯ; ФЕРРИЦИАНИДЫ; СЕРНАЯ КИСЛОТА; КАРБИДЫ ВОЛЬФРАМА; ВОЛЬТАМЕТРИЯ; КАРБИДЫ ВОЛЬФРАМА/коррозия сульфатом церия или феррицианидом в серной кислоте; КАРБИДЫ ВОЛЬФРАМА/коррозия серной кислотой, потенциостатико-кулонометрические исследования на аноде; СЕРНАЯ КИСЛОТА/коррозионное воздействие на карбид вольфрама, потенциостатико-кулонометрические исследования; ФЕРРИЦИАНИДЫ/Коррозионное воздействие на карбид вольфрама в серной кислоте, потенциостатически-кулонометрические исследования; СУЛЬФАТЫ ЦЕРИЯ/коррозионное воздействие на карбид вольфрама в серной кислоте, потенциостатико-кулонометрические исследования на
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Voorhies, J D. ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). . Страна неизвестна/Код недоступен: N. p., 1972.
ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). . Страна неизвестна/Код недоступен: N. p., 1972.
Веб. дои: 10.1149/1.2404164.
Копировать в буфер обмена
Voorhies, J D. ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). . Страна неизвестна/код недоступен. https://doi.org/10.1149/1.2404164
Копировать в буфер обмена
Вурхис, Дж. Д., 1972.
«ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC)». Страна неизвестна/код недоступен. https://doi.org/10.1149/1.2404164.
Копировать в буфер обмена
@статья{osti_4688749,
title = {ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC).},
автор = {Вурхис, Дж.
