Что такое электрохимическая и химическая коррозия: Химическая коррозия
Содержание
Коррозия металлов
Коррозия – это самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Различают два вида коррозии – химическую и электрохимическую. Химическая коррозия обусловлена взаимодействием металлов с веществами, содержащимися в окружающей среде. В производственных условиях такими веществами, помимо О2, являются SO2, CO2, H2S, NH3 и др.
Химическую коррозию, обусловленную взаимодействием металлов с газами, называют газовой. Основной вклад в газовую коррозию металла вносит кислород воздуха. Различные металлы обладают различной устойчивостью по отношению к О2. Некоторые металлы (Al, Cr, Zn, Pb, Sn) образуют на воздухе плотные пленки оксидов, не разрушающиеся при изгибе или нагревании. Такие пленки защищают металл от дальнейшего доступа к нему газов и жидкостей, и процесс коррозии резко замедляется. Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования. Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
Такие пленки защищают металл от дальнейшего доступа к нему газов и жидкостей, и процесс коррозии резко замедляется. Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования. Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
Процесс химической коррозии Fe схематически можно представить следующими уравнениями:
2Fe + O2=2FeO
4Fe + 3O2 = 2Fe2O3
3Fe + 2O2 =FeO · Fe2O3
4Fe + 3O2 +6H2O=4Fe(OH)3
Fe(OH)3=t H2O+FeOOH (ржавчина)
Однако наибольший вред приносит не химическая, а электрохимическая коррозия, связанная с переходом электронов от одних участков металла к другим. Химическая коррозия сопровождает электрохимическую и усиливает ее.
Сущность электрохимической коррозии
Металлы обычно содержат примеси других металлов и неметаллов. При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода, а атомы менее активного – роль катода.
На катоде идет процесс восстановления молекул О2 в нейтральной и щелочной средах, или ионов Н+ – в кислой среде.
На аноде происходит окисление атомов металла, из которых состоит анод, с образованием катионов Men+.
Последние переходят в электролит (растворение анода) и соединяются с ионами ОН–, с образованием гидроксида Me(OH)n и других продуктов. Называемых ржавчиной. В результате металл, играющий роль анода, разрушается.
Называемых ржавчиной. В результате металл, играющий роль анода, разрушается.
Скорость электрохимической коррозии тем больше, чем дальше друг от друга расположены металлы в ряду напряжений, и чем выше температура окружающей среды.
Чистые металлы устойчивы к коррозии. Однако, так ка абсолютно чистым металлов нет, а также вследствие того, что гальваническая пара может быть образована отдельными участками одного и того же металла, находящимися в различных условиях (под разными электролитами или под одним и тем же электролитом разной концентрации), то электрохимическая коррозия имеет место всегда при соприкосновении металла с электролитом (атмосферной влагой).
Роль катода при электрохимической коррозии могут выполнять не только менее активные металлы, но и примеси неметаллов, способных принимать электроны.
Коррозия – процесс поверхностный и при отсутствии трещин внутри металла развиваться не может. Поэтому одним из способов защиты от коррозии является нанесение на поверхность металла металлических и неметаллических покрытий.
В качестве металлических покрытий используются пленки Au, Ag, Ni, Cr, Zn и других металлов, которые мало подвергаются коррозии из-за своей индифферентности или по причине образования прочных оксидных пленок. Некоторые из этих металлов (Au, Ag, Ni, Cr), помимо защитной, выполняют и эстетическую – придают изделиям приятный внешний вид.
Различают два вида металлических покрытий – анодное и катодное. Покрытие называется
- анодным, если оно изготовлено из металла более активного, чем защищаемый;
- катодным, если изготовлено из менее активного металла.
Примером анодных покрытий для изделий из железа являются пленки из Cr, Zn, примером катодных – пленки из Ni, Sn, Ag, Au. Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Неметаллические покрытия также делятся на два вида: неорганические и органические. В качестве органических покрытий используются пленки лаков, красок, пластмасс, резины, битума, в качестве неорганических – эмали.
Протекторная защита заключается в соединении защищаемого изделия проводником с протектором – пластиной из более активного металла (Al, Mg, Zn). В процессе коррозии протектор служит анодом и разрушается, предохраняя от коррозии металлическое изделие или конструкцию.
Электрохимическая (катодная) защита заключается в соединении защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Анодом служит вспомогательный, обычно стальной, электрод (кусок металла), который и разрушается в процессе коррозии.
Автор: Метельский А.В.
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
Процесс коррозии железа. Химическая коррозия, электрохимическая коррозия, элетрокоррозия
Процесс коррозии железа чаще всего сводится к его окислению кислородом воздуха или кислотами, содержащимися в растворах, и превращению его в оксиды. Коррозия металлов (ржавление) вызывается окислительно-восстановительными реакциями, протекающими на границе металла и окружающей среды. В зависимости от механизма возникновения, различают такие виды коррозии железа, как: химическая, электрохимическая и электрическая.
Процесс химической коррозии железа
Окислительно-восстановительные реакции в данном случае проходят через переход электронов на окислитель. В процессе коррозии такого типа кислород воздуха взаимодействует с поверхностью железа. При этом образуется оксидная пленка, которая называется ржавчиной:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
В отличие от плотно прилегающих оксидных пленок, которые образуются в процессе коррозии на щелочных металлах, алюминии, цинке, рыхлая оксидная пленка на железе свободно пропускает к поверхности металла кислород воздуха, а также другие газы и пары воды. Это способствует дальнейшей коррозии железа.
Это способствует дальнейшей коррозии железа.
Процесс электрохимической коррозии
Этот вид коррозии проходит в среде, которая проводит электрический ток. Металл в грунте подвергается, преимущественно, электрохимической коррозии. Процесс коррозии такого типа – это результат химических реакций с участием компонентов окружающей среды. Также электрохимическая коррозия возникает в случае контакта металлов, находящихся в ряду напряжений на некотором расстоянии друг от друга, в результате чего возникает гальваническая пара катод-анод.
Атмосферный и грунтовый процесс коррозии выражается схемой:
Fe + O2 + H2O → Fe2O3 · xH2O
В результате образуется ржавчина различной расцветки, что обусловлено тем, что образуются различные окислы железа. Какое именно вещество образуется в процессе коррозии железа, зависит от давления кислорода, влажности воздуха, температуры, длительности процесса, состава железного сплава, состояния поверхности изделия и т. д. Скорость разрушения разных металлов различна.
д. Скорость разрушения разных металлов различна.
Процесс коррозии металла в растворах электролитов – это результат работы большого количества микроскопических гальванических элементов, у которых в качестве катода выступают примеси в металле, а в качестве анода – сам металл. В результате чего возникают микроскопические гальванические элементы.
Также атомы железа на разных участках имеют различную способность отдавать электроны (окисляться). Участки металла, на котором протекает этот процесс, выступают в роли анода. Остальные участки – катодные, на которых происходят процессы восстановления воды и кислорода:
H2O + 2e– = 2OH– + H2↑
O2 + 2H2O + 4e– = 4OH–
Результат – из ионов железа (II) и гидроксид-ионов образуется гидроксид железа (II). Далее идет его окисление до гидроксида железа (III) – основного компонента ржавчины:
Fe2+ + 2OH– = Fe(OH)2
Fe(OH)2 + O2 + H2O → Fe2O3 · xH2O
Для того чтобы гальванический элемент работал, необходимо наличие двух металлов различной химической активности и среды, которая проводит электрический ток, – электролита.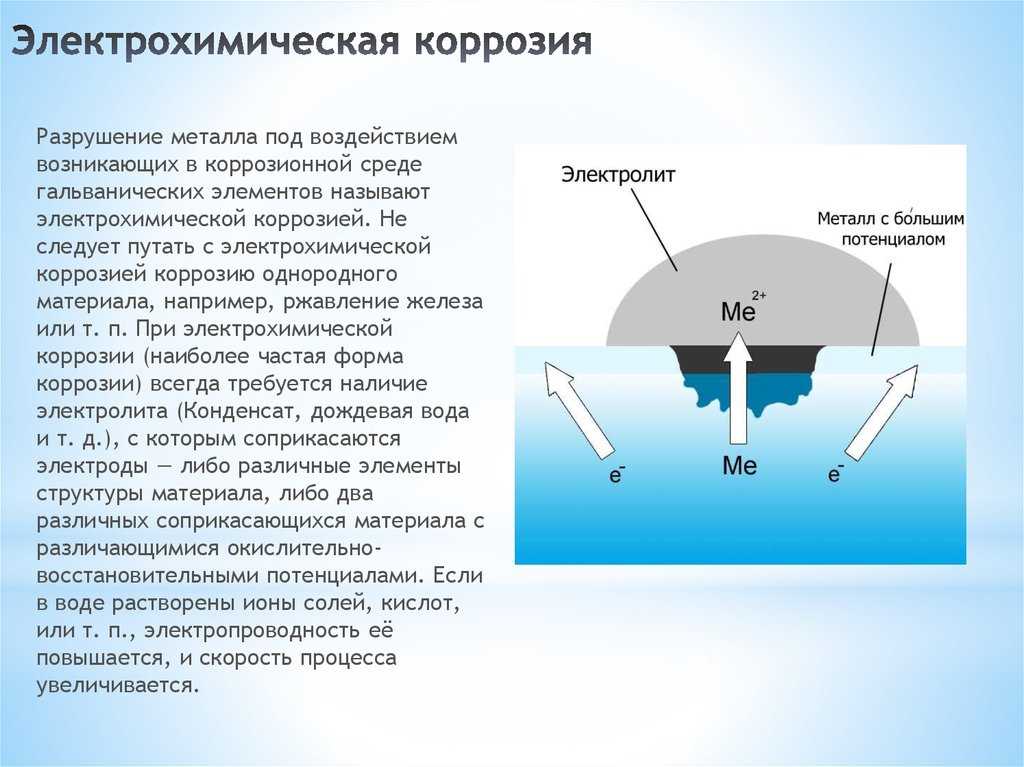 При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
Процесс электрической коррозии
Такой вид разрушения металлических подземных конструкций, кабелей и сооружений могут вызывать блуждающие токи, исходящие от трамваев, метро, электрических железных дорог и различных электроустановок с постоянным током.
Ток с металлических конструкций выходит в грунт в виде положительных ионов металла – происходит электролиз металла. Участок выхода токов – это анодные зоны. Именно в них и протекают активные процессы электрической коррозии железа. Блуждающие токи могут достигать 300 А и действовать в радиусе нескольких десятков километров.
Блуждающими токами, исходящими от источников переменного тока, вызывается слабая коррозия подземных стальных конструкций, и сильная – конструкций из цветных металлов. Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Химическая коррозия — Концепция — Химическое видео от Brightstorm
Химическая коррозия возникает в результате окисления металла. Это процесс возвращения металлов в их естественное состояние, которое является рудой. Большинство металлов образуют тонкое оксидное покрытие, которое защищает внутренние атомы. Защитное покрытие часто наносится для защиты металла от кислорода и влаги.
коррозия
В этом разделе давайте продолжим и обсудим коррозию, которая относится к более широкому разделу электрохимии. Поэтому всякий раз, когда вы слышите слова «электрохимия», вы должны немедленно задуматься об окислительно-восстановительных реакциях и вспомнить, откуда исходит поток электронов. поэтому помните, что окисление — это потеря электронов, а восстановление — это приобретение электронов, и что они происходят вместе в паре, и поэтому у вас будет один вид, который окисляет, и один вид, который восстанавливается.
Итак, коррозия, в основном, связана с окислением металла, что опять-таки знакомо нам, и поэтому мы знаем, что это обмен электронами. Таким образом, металл окисляется восстановителем. Итак, процесс возвращения металлов в их естественное состояние, то есть в руду, происходит при коррозии. Таким образом, он превращается из красивого, блестящего и красивого в довольно ржавый и отвратительный. Так что очевидно, что в естественном рудном состоянии он не так привлекателен, как в блестящем металлическом состоянии.
Итак, поскольку мы знаем, что большинство металлов реагируют в окружающей среде с кислородом, как нам избежать коррозии или замедлить ее? Таким образом, большинство металлов образуют тонкое оксидное покрытие, которое защищает внутренние атомы от коррозии. Таким образом, вы можете получить некоторую начальную коррозию снаружи, а затем в какой-то момент они образуют эту оксидную пленку, которая замедляет процесс коррозии. Например, алюминий является популярным. Алюминий в изобилии присутствует в окружающей среде, поэтому он легко теряет электроны и должен легко окисляться кислородом. И все же алюминий используется для создания множества крупных конструкций, таких как самолеты и тому подобное. Таким образом, он образует слой оксида алюминия Al2O3, который предотвращает его дальнейшую коррозию. И другие подобные металлы делают то же самое. Никель и хром и на самом деле немало других.
И все же алюминий используется для создания множества крупных конструкций, таких как самолеты и тому подобное. Таким образом, он образует слой оксида алюминия Al2O3, который предотвращает его дальнейшую коррозию. И другие подобные металлы делают то же самое. Никель и хром и на самом деле немало других.
Итак, как я уже сказал, защитное покрытие часто образуется металлами само по себе, или его можно наносить для защиты металла от кислорода и влаги. Вы также можете использовать процесс, называемый легированием металлов. И один из наиболее распространенных процессов, который используется в нашей среде для защиты некоторых металлов, называется катодной защитой, и он работает для стальных резервуаров и труб, которые закопаны под землю, и поэтому вы в основном используете другой металл, который обеспечивает электроны легче, чем сталь или железо. В этом случае мы могли бы сказать, магний, и он связан с проводом и с трубопроводом, который нужно защитить. Таким образом, в основном, поскольку магний будет давать электроны легче, чем железо, он будет окисляться первым и, следовательно, защищать железо. Таким образом, в основном, он предотвращает окисление до определенного времени. Очевидно, что в какой-то момент магний закончится, и провода придется заменить.
Таким образом, в основном, он предотвращает окисление до определенного времени. Очевидно, что в какой-то момент магний закончится, и провода придется заменить.
Это коррозия.
Коррозия: Химическое окисление | Plant Engineering
В предыдущем выпуске обсуждалось, как коррозионная ячейка, содержащая анод, катод, электролит и металлический канал, необходима для возникновения электрохимической коррозии. Были также обсуждены наиболее распространенные формы и их эффекты, такие как гальваническая, щелевая и точечная. По этому вопросу мы обсудим химическое окисление, которое в промышленности часто называют химической коррозией или кислотной коррозией, и объясним его наиболее распространенные формы.
Химическое окисление
Химическое окисление, в отличие от электрохимического, может происходить при недостатке кислорода и не требует наличия сложной ячейки. Химическое окисление вызывается веществом, это вещество можно отнести к категории кислот или щелочей. Общее правило состоит в том, что чем более кислое вещество, тем более оно коррозионно, а чем более щелочным, тем менее коррозионно 6 .
Общее правило состоит в том, что чем более кислое вещество, тем более оно коррозионно, а чем более щелочным, тем менее коррозионно 6 .
Уровень кислотности или щелочности вещества обычно измеряется его рН. рН определяется как «отрицательный десятичный логарифм активности ионов водорода в растворе» 7 . Согласно этому определению, чем выше рН вещества, тем оно более щелочное, чем ниже рН, тем оно более кислое. В таблице 2 представлены значения pH обычных веществ.
Сложность защиты от химического воздействия заключается в том, что кислоты могут превращаться в пары, перемещаться на поверхность металла, быстро вступать в реакцию с влагой и вызывать коррозию металла. Кислоты, такие как азотная, могут не только испаряться и перемещаться по воздуху, но также могут проникать в органические материалы, такие как покрытия, и разрушать металл позади них. Щелочи также могут вызывать коррозию в правильной среде. Гипохлорит натрия представляет собой промышленную соль, которая является сильнощелочной, но чрезвычайно коррозионной. Важно отметить, что, хотя окисляющая соль может быть щелочной, при определенных обстоятельствах она может быть очень коррозионной. Наиболее распространенными формами химического окисления являются коррозия бетона, тепловая коррозия и микробная коррозия.
Важно отметить, что, хотя окисляющая соль может быть щелочной, при определенных обстоятельствах она может быть очень коррозионной. Наиболее распространенными формами химического окисления являются коррозия бетона, тепловая коррозия и микробная коррозия.
Коррозия бетона
Коррозия бетона может происходить двумя путями: через арматуру и химическое воздействие. Коррозия бетона через арматурные стержни является формой электрохимической коррозии из-за влаги, которая проникает к стержням через бетон, поскольку он очень пористый. Химическая, однако, представляет собой гораздо более сложную форму, она атакует либо выщелачивая гидроксид кальция, либо проникая в него. Бетон представляет собой сильнощелочной строительный материал, который в основном состоит из гидратированного силиката кальция, матрицы цементного теста. Кальций – это элемент, который часто «вымывается» из бетона, ослабляя его.
Когда кислота, такая как серная кислота, воздействует на бетон, в результате происходит ухудшение или полное растворение матрицы цементного теста. Это разрушение ослабляет бетон и придает ему вид «края» или «обнаженного бетона», о котором часто сообщается в отчетах об отказах. На бетон также может воздействовать углекислый газ в воздухе в результате процесса, называемого карбонизацией. В этом процессе диоксид углерода реагирует с гидроксидом кальция с образованием карбоната кальция. Этот процесс уменьшает толщину бетона, а также снижает pH, что позволяет легко инициировать электрохимическую коррозию при наличии арматурных стержней.
Это разрушение ослабляет бетон и придает ему вид «края» или «обнаженного бетона», о котором часто сообщается в отчетах об отказах. На бетон также может воздействовать углекислый газ в воздухе в результате процесса, называемого карбонизацией. В этом процессе диоксид углерода реагирует с гидроксидом кальция с образованием карбоната кальция. Этот процесс уменьшает толщину бетона, а также снижает pH, что позволяет легко инициировать электрохимическую коррозию при наличии арматурных стержней.
Микробная коррозия
Микробная коррозия вызывается микроорганизмами, бактериями не только металлов, но и бетона, пластика и других материалов. Эта форма химической коррозии может возникать при наличии кислорода из-за аэробных бактерий и при недостатке кислорода из-за анаэробных бактерий. Наиболее распространенный тип микробной коррозии вызывается Acidithiobacillus, где бактерии действуют как сульфид-редуцирующий агент, который производит серную кислоту, разрушающую поверхность. Другие бактерии в присутствии кислорода могут фактически окислять железо до оксида железа. Бактериальная коррозия также может способствовать электрохимической коррозии за счет повышения концентрации кислорода и образования точечной коррозии 9.0027 10 . Микробная коррозия является предметом, который в настоящее время подвергается большому количеству исследований. Бактерии, которые могут расти и разъедать как в соленой, так и в пресной воде, а также бактерии, которые могут использовать водород, образующийся в процессе электрохимической коррозии, что устраняет потребность в кислороде.
Другие бактерии в присутствии кислорода могут фактически окислять железо до оксида железа. Бактериальная коррозия также может способствовать электрохимической коррозии за счет повышения концентрации кислорода и образования точечной коррозии 9.0027 10 . Микробная коррозия является предметом, который в настоящее время подвергается большому количеству исследований. Бактерии, которые могут расти и разъедать как в соленой, так и в пресной воде, а также бактерии, которые могут использовать водород, образующийся в процессе электрохимической коррозии, что устраняет потребность в кислороде.
Тепловая коррозия
Тепловая коррозия, также известная как высокотемпературная коррозия, представляет собой разрушение металла в результате образования накипи солей и других соединений из горячих газов. Как следует из названия, эта форма химической коррозии возникает в средах с высокими температурами, например, в тракте горячего газа в газовой турбине. Распространенной последовательностью тепловой коррозии является последовательность науглероживания – пыления – зеленой гнили. Эта последовательность начинается, когда высокие температуры находятся в присутствии соединений углерода, которые вызывают увеличение содержания углерода в металле (обычно это сплав хрома и никеля) на поверхности. В результате происходит затвердевание поверхности металла, что приводит к охрупчиванию, растрескиванию и, в конечном итоге, выходу из строя. Дальнейшее воздействие этой среды с высоким содержанием углерода приводит к образованию карбидов в структуре металла и распаду их на графит. Этот графит действует как катализатор разложения местного монооксида углерода на углерод и кислород. Этот второй этап известен как напыление металла. Третья стадия происходит только в том случае, если металл, как указано выше, представляет собой хромоникелевый сплав. Это довольно катастрофическая форма коррозии, когда происходит быстрый цикл между науглероживанием и выделением оксидов на поверхности металла. Обычно это приводит к зеленоватому остатку оксида хрома и значительной потере металла 9.0027 11 .
Эта последовательность начинается, когда высокие температуры находятся в присутствии соединений углерода, которые вызывают увеличение содержания углерода в металле (обычно это сплав хрома и никеля) на поверхности. В результате происходит затвердевание поверхности металла, что приводит к охрупчиванию, растрескиванию и, в конечном итоге, выходу из строя. Дальнейшее воздействие этой среды с высоким содержанием углерода приводит к образованию карбидов в структуре металла и распаду их на графит. Этот графит действует как катализатор разложения местного монооксида углерода на углерод и кислород. Этот второй этап известен как напыление металла. Третья стадия происходит только в том случае, если металл, как указано выше, представляет собой хромоникелевый сплав. Это довольно катастрофическая форма коррозии, когда происходит быстрый цикл между науглероживанием и выделением оксидов на поверхности металла. Обычно это приводит к зеленоватому остатку оксида хрома и значительной потере металла 9.0027 11 . Эта последняя стадия известна как зеленая гниль. Все эти стадии могут происходить в диапазоне температур от 572 o F до 1922 o F 11 .
Эта последняя стадия известна как зеленая гниль. Все эти стадии могут происходить в диапазоне температур от 572 o F до 1922 o F 11 .
В заключение, термины «электрохимическая коррозия» и «химическое окисление» являются всего лишь механизмами деградации материалов из-за реакции с окружающей средой. Технологии защиты от коррозии разрабатываются и развиваются каждый день из-за того, что мы до сих пор не до конца понимаем, почему некоторые материалы подвергаются коррозии. Промышленная среда становится все более и более агрессивной, что требует развития и этих технологий защиты от коррозии. Некоторые из этих методов включают разработку коррозионно-стойких металлов, таких как супердуплексная нержавеющая сталь, технологии контроля окружающей среды, такие как использование химических ингибиторов, барьеров, таких как покрытия и эпоксидные смолы, катодную защиту и модификацию изготовления, чтобы избежать, скажем, щелей, ведущих к щелевая коррозия.
Все эти различные формы коррозии всегда можно проследить до одного из двух основных типов механизмов: электрохимического и химического окисления. Обсуждаемые здесь формы наиболее часто встречаются в отрасли. Коррозия представляет собой очень широкую и серьезную проблему в современной промышленности, приводящую к потере производительности на предприятиях, а иногда и к трагедиям. Не только металлы подвержены коррозии, пластмассы, бетон и широкий спектр материалов разлагаются из-за реакций с окружающей средой. Коррозия — это непрерывный жизненный цикл нашего оборудования и материалов, непрерывный жизненный цикл нашего промышленного мира.
Обсуждаемые здесь формы наиболее часто встречаются в отрасли. Коррозия представляет собой очень широкую и серьезную проблему в современной промышленности, приводящую к потере производительности на предприятиях, а иногда и к трагедиям. Не только металлы подвержены коррозии, пластмассы, бетон и широкий спектр материалов разлагаются из-за реакций с окружающей средой. Коррозия — это непрерывный жизненный цикл нашего оборудования и материалов, непрерывный жизненный цикл нашего промышленного мира.
См. также Коррозия: электрохимическая
6 Мунгер, Чарльз. Предотвращение коррозии с помощью защитных покрытий, Глава 1, Коррозионная ячейка. Национальная ассоциация инженеров по коррозии, стр. 21, 1984
7 Томпсон, Нил. «Хронология расщелины». Коррозия-Доктора. 28 декабря 2010 г.
8 Мангер, Чарльз. Предотвращение коррозии с помощью защитных покрытий, Глава 1, Коррозионная ячейка. Национальная ассоциация инженеров по коррозии, стр.
