Cu характеристика элемента: Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов / Справочник :: Бингоскул
Содержание
Общая характеристика d-элементов » HimEge.ru
Понятие
переходный элемент
обычно используется для обозначения любого элемента с валентными d- или f-электронами. Эти элементы занимают в периодической таблице переходное положение между электроположительными s-элементами и электроотрицательными p-элементами.
d-Элементы принято называть главными переходными элементами. Их атомы характеризуются внутренней застройкой d-подоболочек. Дело в том, что s-орбиталь их внешней оболочки обычно заполнена уже до того, как начинается заполнение d-орбиталей в предшествующей электронной оболочке. Это означает, что каждый новый электрон, добавляемый в электронную оболочку очередного d-элемента, в соответствии с принципом заполнения, попадает не на внешнюю оболочку, а на предшествующую ей внутреннюю подоболочку. Химические свойства этих элементов определяются участием в реакциях электронов обеих указанных оболочек.
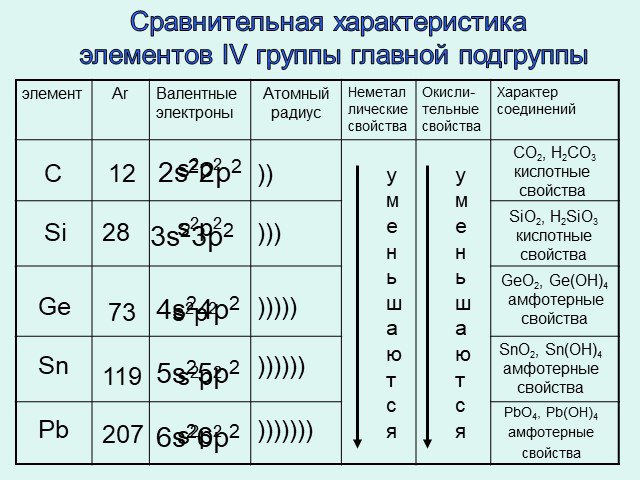
d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно. Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей.
Орбиталь 4s заполняется раньше, чем орбиталь 3d,
потому что имеет меньшую энергию (правило Клечковского).
Следует, однако, отметить существование двух аномалий. Хром и медь имеют на своих 4s-орбиталях всего по одному электрону. Дело в том, что
полузаполненные или полностью заполненные подоболочки обладают большей устойчивостью, чем частично заполненные подоболочки.
В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов. Аналогичная аномалия наблюдается у серебра.
Аналогичная аномалия наблюдается у серебра.
Все d-элементы являются металлами.
Электронные конфигурации элементов четвертого периода от скандия до цинка:
Хром находится в 4-м периоде, в VI группе, в побочной подгруппе. Это металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. CrO — типичный основный оксид, Cr
2
O
3
— амфотерный оксид, CrO
3
— типичный кислотный оксид со свойствами сильного окислителя, т. е. рост степени окисления сопровождается усилением кислотных свойств.
Железо находится в 4-м периоде, в VIII группе, в побочной подгруппе. Железо — металл средней активности, в своих соединениях проявляет наиболее характерные степени окисления +2 и +3. Известны также соединения железа, в которых оно проявляет степень окисления +6, которые являются сильными окислителями. FeO проявляет основные, а Fe
Известны также соединения железа, в которых оно проявляет степень окисления +6, которые являются сильными окислителями. FeO проявляет основные, а Fe
2
O
3
— амфотерные с преобладанием основных свойств.
Медь находится в 4-м периоде, в I группе, в побочной подгруппе. Ее наиболее устойчивые степени окисления +2 и +1. В ряду напряжений металлов медь находится после водорода, ее химическая активность не очень велика. Оксиды меди: Cu2O CuO. Последний и гидроксид меди Cu(OH)2 проявляют амфотерные свойства с преобладанием основных.
Цинк находится в 4-м периоде, во II-группе, в побочной подгруппе. Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2. Оксид и гидроксид цинка являются амфотерными.
Микроэлементы. Общая информация
Химические элементы в свободном состоянии и в виде множества химических соединений входят в состав всех клеток и тканей человеческого организма. Они являются строительным материалом, важнейшими катализаторами различных биохимических реакций, непременными и незаменимыми участниками процессов роста и развития организма, обмена веществ, адаптации к меняющимся условиям окружающей среды.
Они являются строительным материалом, важнейшими катализаторами различных биохимических реакций, непременными и незаменимыми участниками процессов роста и развития организма, обмена веществ, адаптации к меняющимся условиям окружающей среды.
Физиологическое действие различных элементов зависит от их дозы. Поэтому токсичные элементы (мышьяк, ртуть, сурьма, кадмий и др.) при низких концентрациях могут действовать на организм как лекарство (оказывая тем самым саногенетическое воздействие), тогда как натрий, калий, кальций, железо, магний и ряд других элементов в высоких концентрациях могут обладать выраженным токсическим эффектом.
Для осуществления жизненно важных функций у каждого элемента существует оптимальный диапазон концентраций. При дефиците или избыточном накоплении элементов в организме могут происходить серьезные изменения, обуславливающие нарушение активности прямо или косвенно зависящих от них ферментов.
В организме химические элементы находятся преимущественно в виде соединений, избыточное образование или распад которых может приводить к нарушению так называемого металло-лигандного гомеостаза, а в дальнейшем и к развитию патологических изменений. Элементы – металлы и лиганды (например, глутаминовая, аспарагиновая, липоевая, аскорбиновая кислоты) могут выступать в качестве активаторов или ингибиторов различных ферментов, что обусловливает их существенную роль в развитии и терапии различных заболеваний.
Элементы – металлы и лиганды (например, глутаминовая, аспарагиновая, липоевая, аскорбиновая кислоты) могут выступать в качестве активаторов или ингибиторов различных ферментов, что обусловливает их существенную роль в развитии и терапии различных заболеваний.
Для систематизации сведений о содержании и физиологической роли химических элементов в организме в последние десятилетия был предложен ряд классификаций. Не рассматривая их подробно, остановимся лишь на некоторых принципиальных моментах.
Один из принципов классификации – разделение химических элементов на группы, в зависимости от уровня их содержания в организме человека.
Первую группу такой классификации составляют «макроэлементы», концентрация которых в организме превышает 0,01%. К ним относятся O, C, H, N, Ca, P, K, Na, S, Cl, Mg. В абсолютных значениях (из расчета на среднюю массу тела человека в 70 кг), величины содержания этих элементов колеблются в пределах от сорока с лиш ним кг (кислород) до нескольких г (магний).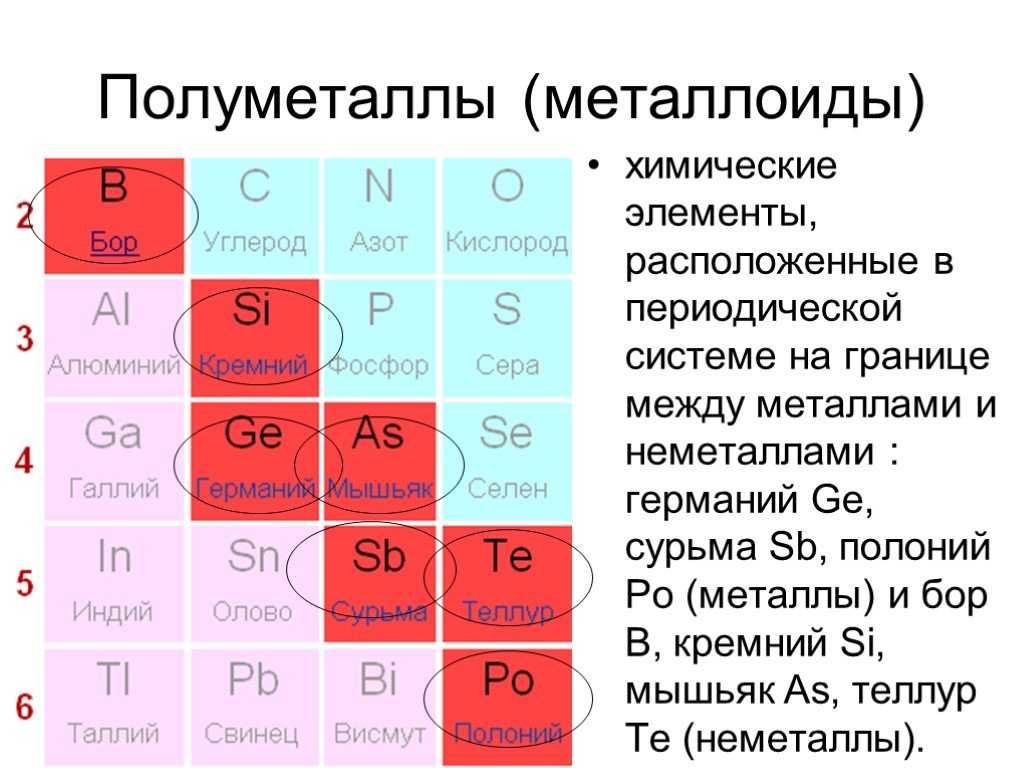 Некоторые элементы этой группы называют «органогенами» (O, H, С, N, P, S) в связи с их ведущей ролью в формировании структуры тканей и органов.
Некоторые элементы этой группы называют «органогенами» (O, H, С, N, P, S) в связи с их ведущей ролью в формировании структуры тканей и органов.
Вторую группу составляют «микроэлементы» (концентрация от 0,00001% до 0,01%). В эту группу входят: Fe, Zn, F, Sr, Mo, Cu, Br, Si, Cs, I, Mn, Al, Pb, Cd, B, Rb. Эти элементы содержатся в организме в концентрациях от сотен мг до нескольких г. Однако, несмотря на малое содержание, микроэлементы не случайные ингредиенты биосубстратов живого организма, а компоненты сложной физиологической системы, участвующей в регулировании жизненных функций организма на всех этапах его развития.
В третью группу включены «ультрамикроэлементы», концентрация которых ниже 0,000001%. Это Se, Co, V, Cr, As, Ni, Li, Ba, Ti, Ag, Sn, Be, Ga, Ge, Hg, Sc, Zr, Bi, Sb, U, Th, Rh. Содержание этих элементов в теле человека измеряется в мг и мкг. На данный момент установлено важнейшее значение для организма многих элементов из этой группы, таких как, селен, кобальт, хром и др.
В основе другой классификации лежат представления о физиологической роли химических элементов в организме. Согласно такой классификации макроэлементы, составляющие основную массу клеток и тканей, являются “структурными” элементами. К «эссенциальным» (жизненно-необходимым) микроэлементам относят Fe, I, Cu, Zn, Co, Cr, Mo, Se, Mn, к “условно-эссенциальным” – As, B, Br, F, Li, Ni, Si, V. Жизненная необходимость или эссенциальность (от англ. essential – “необходимый”), является важнейшим для жизнедеятельности живых организмов свойством химических элементов. Химический элемент считается эссенциальным, если при его отсутствии или недостаточном поступлении в организм нарушается нормальная жизнедеятельность, прекращается развитие, становится невозможной репродукция. Восполнение недостающего количества такого элемента устраняет клинические проявления его дефицита и возвращает организму жизнеспособность.
К “токсичным” элементам отнесены Al, Cd, Pb, Hg, Be, Ba, Bi, Tl, к “потенциально-токсичным” – Ag, Au, In, Ge, Rb, Ti, Te, U, W, Sn, Zr и др. Результатом воздействия этих элементов на организм является развитие синдромов интоксикаций (токсикопатий).
Результатом воздействия этих элементов на организм является развитие синдромов интоксикаций (токсикопатий).
Оценка элементного статуса человека является основным вопросом определения влияния на здоровье человека дефицита, избытка или нарушения тканевого перераспределения макро- и микроэлементов. Определение элементного состава биосред используется:
- при мониторинге состояния здоровья, оценке уровня работоспособности и эффективности лечения;
- при формировании групп риска по гипо- и гиперэлементозам;
- при подборе рациональной диеты как здоровому, так и больному человеку;
- в скрининг-диагностических исследованиях больших групп населения;
- при картировании территорий по нозологическим и системным формам патологии у детей и других возрастных групп населения;
- при оценке взаимозависимости многосторонних связей цепи “человек–среда обитания”;
- при составлении карт экологического природного и техногенного неблагополучия регионов;
- при изучении воздействия на организм вредных привычек;
- экспертно-криминалистических исследованиях (идентификация личности в судебной медицине, метод выбора в подтверждение исследований по молекуле ДНК и генному коду).

Методы определения микроэлементов в биосубстратах Масс-спектрометрия с индуктивно связанной аргоновой плазмой (ИСП-МС), атомно-абсорбционная спектрофотометрия с электротермической атомизацией (ААС-ЭТА).
Условия взятия и хранения материала для исследования
Взятие и подготовка крови для получения плазмы и сыворотки проводится по общепринятым методикам. Если при заборе проб используют перчатки, то они должны быть не опудренные и не содержать латекса (напр., нитриловые). Кровь может быть получена из локтевой вены или из пальцев рук (капиллярная). Объем отобранной крови должен составлять не менее 1 мл. Образцы сыворотки или плазмы крови хранятся в обычном холодильнике до 3–5 сут (от 0 до 4 °С) либо замораживаются (до -18 °С), либо лиофилизуются, или высушиваются в сушильном шкафу (для длительного хранения). Для длительного хранения образцы помещаются в одноразовые полипропиленовые пробирки с герметичными крышками.
Взятие биологических образцов крови и мочи проводят в соответствии с МУК 4.1.1482-08, МУК 4.1.1483-08.
Периодические свойства элементов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 617
Элементы в периодической таблице расположены в порядке возрастания атомного номера. Все эти элементы демонстрируют несколько другие тенденции, и мы можем использовать периодический закон и формирование таблицы, чтобы предсказать их химические, физические и атомные свойства. Понимание этих тенденций достигается путем анализа электронной конфигурации элементов; все элементы предпочитают формирование октета и приобретают или теряют электроны, чтобы сформировать эту стабильную конфигурацию. {-9{-12}\, м\).
{-9{-12}\, м\).
Рисунок \(\PageIndex{1}\): (слева) ковалентные радиусы, (в центре) ионные радиусы, (справа) металлические радиусы. Предоставлено Джессикой Торнтон (UCD)
Чтобы объяснить эту тенденцию, необходимо понять концепцию скрининга и проникновения. Проникновение обычно известно как расстояние, на котором находится электрон от ядра. Экранирование определяется как концепция внутренних электронов, блокирующих внешние электроны от ядерного заряда. В рамках этой концепции мы предполагаем, что между внешними электронами нет экранирования и что внутренние электроны экранируют внешние электроны от общего положительного заряда ядра. Чтобы понять степень экранирования и проникновения внутрь атома, ученые придумали эффективный заряд ядра, \(Z_{eff}\). Уравнение для расчета эффективного заряда ядра показано ниже.
\[Z_{eff}= Z — S\]
В уравнении S представляет количество внутренних электронов, которые экранируют внешние электроны. Студенты могут легко найти S, используя атомный номер благородного газа, который на один период выше элемента. Например, S, который мы будем использовать для хлора, будет равен 10 (атомный номер неона). Z — общее количество электронов в атоме. Поскольку мы знаем, что нейтральный атом имеет одинаковое количество протонов и электронов, мы можем использовать атомный номер для определения Z. Например, у хлора значение Z будет равно 17 (атомный номер хлора). Продолжая использовать хлор в качестве примера, 10 внутренних электронов (S) будут экранировать положительный заряд десяти протонов. Поэтому был бы и эффективный ядерный заряд 17-10 или +7. Эффективный заряд ядра показывает, что ядро притягивает внешние электроны с зарядом +7, и поэтому внешние электроны притягиваются ближе к ядру, а атомные радиусы меньше. Подводя итог, можно сказать, что чем больше заряд ядра, тем сильнее притяжение ядра к внешним электронам и тем меньше атомные радиусы. Напротив, чем меньше заряд ядра, тем меньше притяжение ядра к внешним электронам и тем больше атомный радиус. Кроме того, с увеличением атомного номера увеличивается и эффективный заряд ядра.
Например, S, который мы будем использовать для хлора, будет равен 10 (атомный номер неона). Z — общее количество электронов в атоме. Поскольку мы знаем, что нейтральный атом имеет одинаковое количество протонов и электронов, мы можем использовать атомный номер для определения Z. Например, у хлора значение Z будет равно 17 (атомный номер хлора). Продолжая использовать хлор в качестве примера, 10 внутренних электронов (S) будут экранировать положительный заряд десяти протонов. Поэтому был бы и эффективный ядерный заряд 17-10 или +7. Эффективный заряд ядра показывает, что ядро притягивает внешние электроны с зарядом +7, и поэтому внешние электроны притягиваются ближе к ядру, а атомные радиусы меньше. Подводя итог, можно сказать, что чем больше заряд ядра, тем сильнее притяжение ядра к внешним электронам и тем меньше атомные радиусы. Напротив, чем меньше заряд ядра, тем меньше притяжение ядра к внешним электронам и тем больше атомный радиус. Кроме того, с увеличением атомного номера увеличивается и эффективный заряд ядра. На рис. 3 показано влияние эффективного заряда ядра на атомные радиусы.
На рис. 3 показано влияние эффективного заряда ядра на атомные радиусы.
Рисунок \(\PageIndex{2}\): Предоставлено Джессикой Торнтон (UCD)
Теперь мы готовы описать тренд атомного радиуса в периодической таблице. Атомный номер увеличивается слева направо по периоду, а затем и эффективный заряд ядра. Следовательно, двигаясь слева направо по периоду, ядро оказывает большее притяжение на внешние электроны, и атомные радиусы уменьшаются. Двигаясь вниз по таблице Менделеева, количество заполненных электронных оболочек увеличивается. В группе валентные электроны сохраняют одинаковый эффективный ядерный заряд, но теперь орбитали находятся дальше от ядра. Следовательно, ядро меньше притягивает внешние электроны, а атомные радиусы больше.
Рисунок \(\PageIndex{3}\): Предоставлено Джессикой Торнтон (UCD)
Теперь мы можем использовать эту концепцию для объяснения различий атомных радиусов катионов и анионов. Катион – это атом, потерявший один из своих внешних электронов. Катионы имеют меньший радиус, чем атом, из которого они образовались. С потерей электрона положительный ядерный заряд вытесняет отрицательный заряд, создаваемый электронами. Поэтому положительное ядро сильнее притягивает электроны, а радиус меньше. Анион – это атом, получивший внешний электрон. Анионы имеют больший радиус, чем атом, из которого они образовались. Присоединение электрона не изменяет заряд ядра, но добавление электрона вызывает уменьшение эффективного заряда ядра. Поэтому электроны удерживаются более свободно, а атомный радиус увеличивается.
С потерей электрона положительный ядерный заряд вытесняет отрицательный заряд, создаваемый электронами. Поэтому положительное ядро сильнее притягивает электроны, а радиус меньше. Анион – это атом, получивший внешний электрон. Анионы имеют больший радиус, чем атом, из которого они образовались. Присоединение электрона не изменяет заряд ядра, но добавление электрона вызывает уменьшение эффективного заряда ядра. Поэтому электроны удерживаются более свободно, а атомный радиус увеличивается.
Рисунок \(\PageIndex{4}\): Предоставлено Джессикой Торнтон (UCD)
Энергия ионизации (потенциал ионизации)
Для выталкивания электрона из атома требуется достаточно энергии, чтобы преодолеть магнитное притяжение положительного заряда ядра. Следовательно, энергия ионизации (I.E. или I) — это энергия, необходимая для полного удаления электрона из газообразного атома или иона. Энергия ионизации всегда положительна.
Рисунок \(\PageIndex{5}\): предоставлено Джессикой Торнтон (UCD)
Энергия, необходимая для удаления одного валентного электрона, представляет собой энергию первой ионизации, энергия второй ионизации — это энергия, необходимая для удаления второго валентного электрона, скоро. 9{-}}\]
9{-}}\]
Энергии ионизации увеличиваются по сравнению с высоким эффективным зарядом. Самые высокие энергии ионизации имеют благородные газы, потому что все они имеют высокий эффективный заряд из-за образования октетов и требуют большого количества энергии для разрушения этой стабильной конфигурации. Наибольшее количество требуемой энергии приходится на элементы в правом верхнем углу. Кроме того, элементы в левом углу имеют низкую энергию ионизации, потому что потеря электрона позволяет им иметь конфигурацию благородного газа. Следовательно, требуется меньше энергии, чтобы удалить один из их валентных электронов
| Элемент | 1-й | 2-й | 3-й | 4-й | 5-й | 6-й | 7-й |
|---|---|---|---|---|---|---|---|
| На | 496 | 4562 | |||||
| мг | 738 | 1451 | 7733 | ||||
| Ал | 577 | 1817 | 2745 | 11580 | |||
| Si | 786 | 1577 | 3232 | 4356 | 16090 | ||
| Р | 1060 | 1903 | 2912 | 4957 | 6274 | 21270 | |
| С | 999,6 | 2251 | 3361 | 4564 | 7013 | 8496 | 27110 |
| Класс | 1256 | 2297 | 3822 | 5158 | 6542 | 9362 | 11020 |
| Ар | 1520 | 2666 | 3931 | 5771 | 7238 | 8781 | 12000 |
Это энергии ионизации для элементов периода три.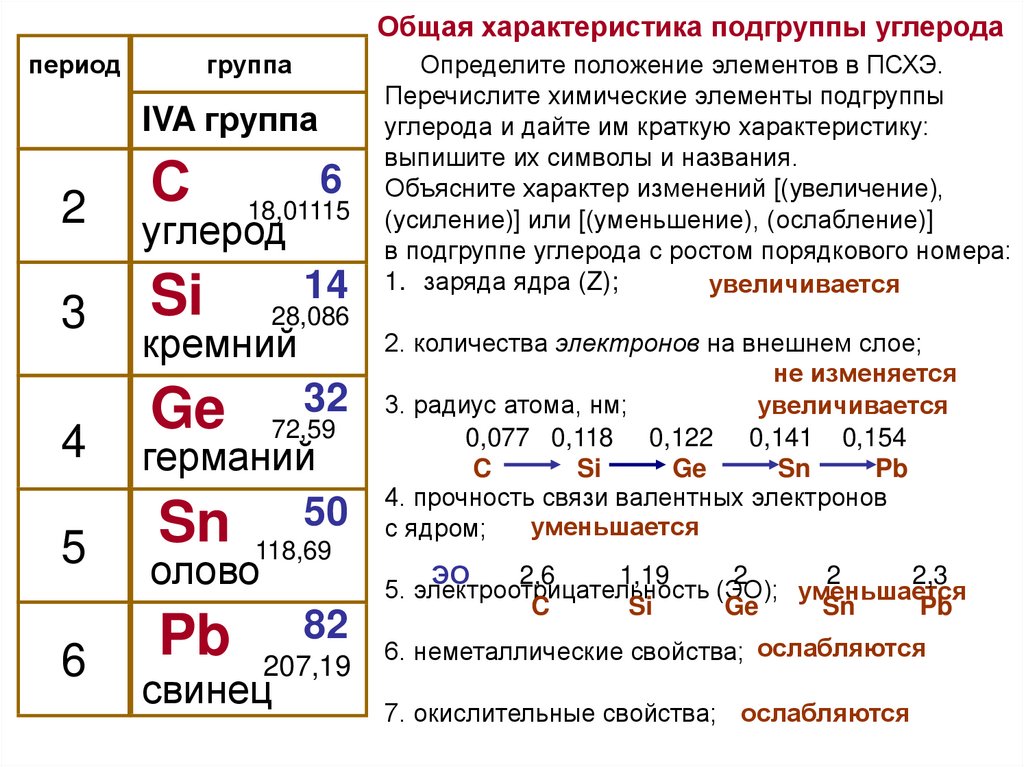 Обратите внимание, как Na после второго ИЭ, Mg в третьем ИЭ, Al в четвертом ИЭ и т. д., все имеют огромное увеличение энергии по сравнению с исходным. Это происходит из-за того, что исходная конфигурация находилась в стабильном формировании октета; поэтому для ионизации требуется гораздо большее количество энергии.
Обратите внимание, как Na после второго ИЭ, Mg в третьем ИЭ, Al в четвертом ИЭ и т. д., все имеют огромное увеличение энергии по сравнению с исходным. Это происходит из-за того, что исходная конфигурация находилась в стабильном формировании октета; поэтому для ионизации требуется гораздо большее количество энергии.
Энергия ионизации увеличивается слева направо по периоду и увеличивается по группе. Когда вы поднимаетесь вверх по группе, энергия ионизации увеличивается, потому что меньше электронов экранирует внешние электроны от притяжения ядра. Следовательно, требуется больше энергии, чтобы обойти ядро и удалить электрон. По мере того, как мы перемещаемся по периодической таблице слева направо, энергия ионизации увеличивается из-за увеличения эффективного заряда ядра. Это связано с тем, что чем больше эффективный заряд ядра, тем сильнее ядро удерживает электрон и тем больше энергии требуется, чтобы освободить электрон.
Рисунок \(\PageIndex{6}\): Предоставлено Джессикой Торнтон (UCD)
Энергия ионизации является лишь общим правилом. Бывают случаи, когда эта тенденция не оправдывается. Обычно это можно объяснить их электронной конфигурацией. Например, магний имеет более высокую энергию ионизации, чем алюминий. Магний имеет электронную конфигурацию [Ne]3s2. Магний имеет высокую энергию ионизации, потому что он имеет заполненную 3s-орбиталь, и ему требуется большее количество энергии, чтобы забрать электрон с заполненной орбитали. 9{-}} \]
Бывают случаи, когда эта тенденция не оправдывается. Обычно это можно объяснить их электронной конфигурацией. Например, магний имеет более высокую энергию ионизации, чем алюминий. Магний имеет электронную конфигурацию [Ne]3s2. Магний имеет высокую энергию ионизации, потому что он имеет заполненную 3s-орбиталь, и ему требуется большее количество энергии, чтобы забрать электрон с заполненной орбитали. 9{-}} \]
Труднее придумать тренды, описывающие сродство к электрону. Как правило, элементы в правой части периодической таблицы имеют большое отрицательное сродство к электрону. Сродство к электрону станет менее отрицательным по мере продвижения от вершины к основанию периодической таблицы. Однако азот, кислород и фтор не следуют этой тенденции. Электронная конфигурация благородных газов будет близка к нулю, потому что они не будут легко получать электроны.
Рисунок \(\PageIndex{7}\): Предоставлено Джессикой Торнтон (UCD)
Электроотрицательность
Электроотрицательность — это способность атома конкурировать за электроны в связи. Чем выше электроотрицательность, тем больше его способность приобретать электроны в связи. Электроотрицательность будет важна, когда мы позже будем определять полярные и неполярные молекулы. Электроотрицательность связана с энергией ионизации и сродством к электрону. Электроны с низкими энергиями ионизации имеют низкую электроотрицательность, потому что их ядра не оказывают сильного притяжения на электроны. Элементы с высокой энергией ионизации имеют высокую электроотрицательность из-за сильного притяжения, оказываемого положительным ядром на отрицательные электроны. Поэтому электроотрицательность увеличивается снизу вверх и слева направо.
Чем выше электроотрицательность, тем больше его способность приобретать электроны в связи. Электроотрицательность будет важна, когда мы позже будем определять полярные и неполярные молекулы. Электроотрицательность связана с энергией ионизации и сродством к электрону. Электроны с низкими энергиями ионизации имеют низкую электроотрицательность, потому что их ядра не оказывают сильного притяжения на электроны. Элементы с высокой энергией ионизации имеют высокую электроотрицательность из-за сильного притяжения, оказываемого положительным ядром на отрицательные электроны. Поэтому электроотрицательность увеличивается снизу вверх и слева направо.
Рисунок \(\PageIndex{8}\): Предоставлено Джессией Торнтон (UCD)
Металлический символ
Металлический символ используется для определения химических свойств, которыми обладают металлические элементы. Как правило, металлы имеют тенденцию терять электроны с образованием катионов. Неметаллы имеют тенденцию приобретать электроны для образования анионов. Они также обладают высоким окислительным потенциалом, поэтому легко окисляются и являются сильными восстановителями. Металлы также образуют основные оксиды; чем более основной оксид, тем выше металлический характер.
Они также обладают высоким окислительным потенциалом, поэтому легко окисляются и являются сильными восстановителями. Металлы также образуют основные оксиды; чем более основной оксид, тем выше металлический характер.
Рисунок \(\PageIndex{9}\): Предоставлено Джессикой Торнтон (UCD)
По мере перемещения по таблице слева направо металлический характер уменьшается, потому что элементы легко принимают электроны для заполнения своих валентных оболочек. Поэтому эти элементы приобретают неметаллический характер, образуя анионы. По мере продвижения вверх по таблице металлический характер уменьшается из-за большего притяжения, которое ядро оказывает на внешние электроны. Это большее притяжение затрудняет атомам потерю электронов и образование катионов.
Другие тенденции
Температуры плавления: Тенденции изменения температур плавления и молекулярной массы бинарных углерод-галогенных соединений и галогеноводородов обусловлены межмолекулярными силами. Плавление разрушает расположение атомов в твердом теле, поэтому количество тепла, необходимое для плавления, зависит от силы притяжения между атомами. Эта сила притяжения увеличивается по мере увеличения числа электронов. Увеличение количества электронов увеличивает связь.
Эта сила притяжения увеличивается по мере увеличения числа электронов. Увеличение количества электронов увеличивает связь.
Пример: точка плавления HF должна составлять примерно -145 °C, исходя из температур плавления HCl, HBr и HI, но наблюдаемое значение составляет -83,6 °C.
Тепло- и электропроводность регулярно меняется в течение периода. Точки плавления могут увеличиваться постепенно или достигать пика внутри группы, а затем изменяться в обратном направлении.
Пример: Элементы третьего периода Na, Mg и Al являются хорошими проводниками тепла и электричества, в то время как Si является лишь хорошим проводником, а неметаллы P, S, Cl и Ar являются плохими проводниками.
Окислительно-восстановительный потенциал
Окислительный потенциал
Окисление — это реакция, которая приводит к потере электрона. Потенциал окисления следует той же тенденции, что и энергия ионизации. Это потому, что чем меньше энергия ионизации, тем легче удалить электрон. (например) 9-\]
(например) 9-\]
Использование в знании периодических свойств элементов
- Предсказание большего или меньшего размера атома и радиального распределения в нейтральных атомах и ионах
- Измерение и сравнение энергии ионизации
- Сравнение сродства к электрону и электроотрицательности
- Прогнозирование окислительно-восстановительного потенциала
- Сравнение металлического характера с другими элементами; его способность образовывать катионы
- Прогнозирование того, какая реакция может произойти или не произойти в зависимости от тенденций
- Определение большего клеточного потенциала (суммы потенциалов окисления и восстановления) между реакциями
- Проведение химических реакций согласно направлениям
Сводка периодических тенденций
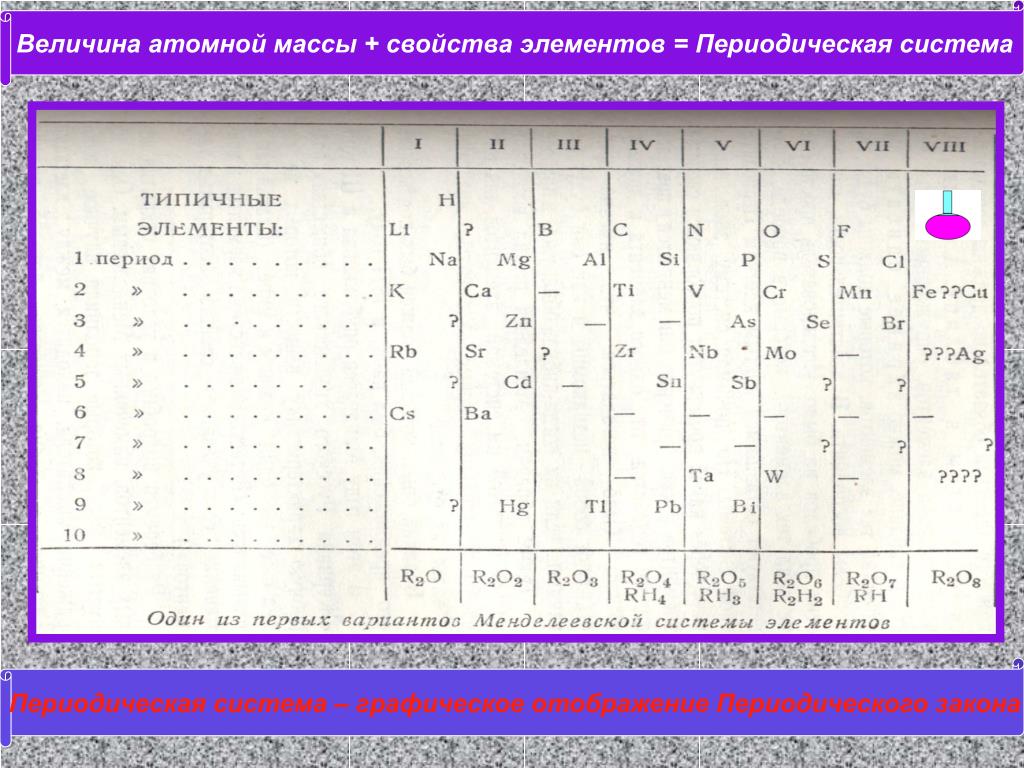
Периодическая таблица элементов классифицирует одинаковые элементы вместе. Дмитрий Менделеев, русский ученый, первым создал общепринятое расположение элементов в 1869 году. Менделеев считал, что, когда элементы расположены в порядке увеличения атомной массы, периодически повторяются определенные наборы свойств. Хотя большинство современных периодических таблиц состоят из восемнадцати групп (столбцов) элементов, в исходной периодической таблице Менделеева элементы были организованы в восемь групп и двенадцать периодов (строк).
Менделеев считал, что, когда элементы расположены в порядке увеличения атомной массы, периодически повторяются определенные наборы свойств. Хотя большинство современных периодических таблиц состоят из восемнадцати групп (столбцов) элементов, в исходной периодической таблице Менделеева элементы были организованы в восемь групп и двенадцать периодов (строк).
Рисунок \(\PageIndex{10}\): Предоставлено Википедией за размещение этого изображения в открытом доступе
В периодической таблице элементы со схожими свойствами находятся в одних и тех же группах (по вертикали). Слева направо атомный номер (z) элементов увеличивается от одного периода к другому (по горизонтали). Группы пронумерованы в верхней части каждого столбца, а точки слева от каждой строки. Основными групповыми элементами являются группы с 1, 2 и с 13 по 18. Эти группы содержат наиболее распространенные в природе элементы и являются наиболее важными для жизни. Элементы, отмеченные светло-розовым цветом в приведенной выше таблице, известны как переходные металлы. Два ряда элементов, начиная с z = 58, иногда называют внутренними переходными металлами, и они были извлечены и помещены в нижнюю часть таблицы, потому что они сделали бы таблицу слишком широкой, если бы они оставались непрерывными. 14 элементов, следующих за лантаном (z=57), называются лантаноидами, а 14 следующих за актинием (z=89) называются актинидами.
Два ряда элементов, начиная с z = 58, иногда называют внутренними переходными металлами, и они были извлечены и помещены в нижнюю часть таблицы, потому что они сделали бы таблицу слишком широкой, если бы они оставались непрерывными. 14 элементов, следующих за лантаном (z=57), называются лантаноидами, а 14 следующих за актинием (z=89) называются актинидами.
Элементы периодической таблицы можно разделить на две широкие категории: металлы и неметаллы. Большинство металлов являются хорошими проводниками тепла и электричества, пластичны и пластичны, имеют температуру плавления от умеренной до высокой. Как правило, неметаллы не проводят тепло и электричество, являются непластичными твердыми телами и многие из них представляют собой газы при комнатной температуре. Как показано в таблице выше, металлы и неметаллы в периодической таблице часто разделены ступенчатой диагональной линией, и несколько элементов рядом с этой линией часто называют металлоидами (Si, Ge, As, Sb, Te и At). Металлоиды — это элементы, которые выглядят как металлы и в некотором роде ведут себя как металлы, но также обладают некоторыми неметаллическими свойствами.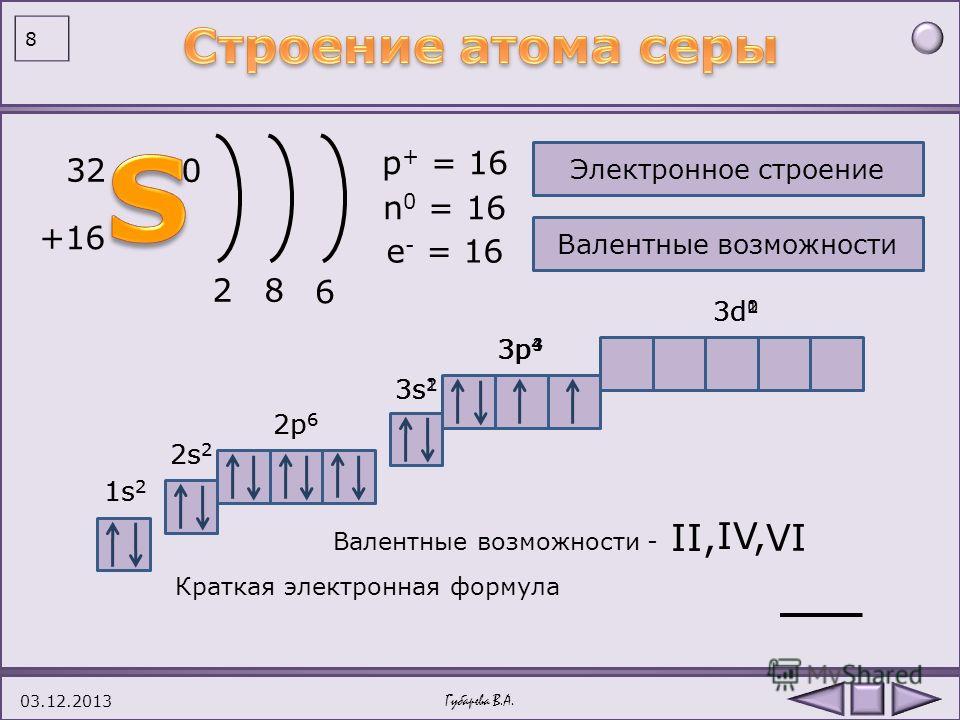 Группа в самом дальнем правом углу таблицы, выделенная оранжевым цветом, известна как благородные газы. Благородные газы относятся к особой группе неметаллов.
Группа в самом дальнем правом углу таблицы, выделенная оранжевым цветом, известна как благородные газы. Благородные газы относятся к особой группе неметаллов.
Щелочные металлы/щелочноземельные металлы
Щелочные металлы относятся к группе 1 периодической таблицы и состоят из лития, натрия, рубидия, цезия и франция. Эти металлы очень реакционноспособны и образуют ионные соединения (когда неметалл и металл объединяются), а также многие другие соединения. Все щелочные металлы имеют заряд +1 и имеют самый большой размер атома, чем любой другой элемент в каждый из соответствующих периодов.
Щелочноземельные металлы относятся к группе 2 и состоят из бериллия, магния, кальция, стронция, бария и радия. В отличие от щелочных металлов, земные металлы имеют меньший размер атома и не так реакционноспособны. Эти металлы также могут образовывать ионные и другие соединения и иметь заряд +2.
Переходные металлы
Переходные металлы находятся в группах от IIIB до XIIB в периодической таблице. Эти металлы образуют положительно заряженные ионы, очень тверды и имеют очень высокие температуры плавления и кипения. Переходные металлы также являются хорошими проводниками электричества и пластичны.
Эти металлы образуют положительно заряженные ионы, очень тверды и имеют очень высокие температуры плавления и кипения. Переходные металлы также являются хорошими проводниками электричества и пластичны.
Лантаниды и актиниды
Лантаниды (показаны в строке ** на приведенной выше диаграмме) и актиниды (показаны в строке * на приведенной выше диаграмме) образуют блок из двух строк, которые размещаются в нижней части периодической таблицы для пробелов. Они также считаются переходными металлами. Лантаниды образуют верхний ряд этого блока и представляют собой очень мягкие металлы с высокими температурами кипения и плавления. Актиниды образуют нижний ряд и являются радиоактивными. Они также образуют соединения с большинством неметаллов. Чтобы узнать, почему у этих элементов есть отдельный раздел, посетите страницу электронных конфигураций.
Металлоиды
Как упоминалось во введении, металлоиды расположены вдоль лестницы, отделяющей металлы от неметаллов в периодической таблице. Бор, кремний, германий, мышьяк, сурьма и теллур обладают свойствами металлов и неметаллов. Например, кремний имеет металлический блеск, но является хрупким и неэффективным проводником электричества, как неметалл. Поскольку металлоиды обладают сочетанием как металлических, так и неметаллических характеристик, они являются промежуточными проводниками электричества или «полупроводниками».
Бор, кремний, германий, мышьяк, сурьма и теллур обладают свойствами металлов и неметаллов. Например, кремний имеет металлический блеск, но является хрупким и неэффективным проводником электричества, как неметалл. Поскольку металлоиды обладают сочетанием как металлических, так и неметаллических характеристик, они являются промежуточными проводниками электричества или «полупроводниками».
Галогены
Галогены состоят из пяти неметаллических элементов: фтора, хлора, брома, йода и астата. Они расположены в 17 группе периодической таблицы и имеют заряд -1. Термин «галоген» означает «солеобразующий», а соединения, содержащие один из галогенов, являются солями. Физические свойства галогенов значительно различаются, поскольку они могут существовать в твердом, жидком и газообразном состояниях при комнатной температуре. Однако в целом галогены очень реакционноспособны, особенно с щелочными и земельными металлами групп 1 и 2, с которыми они образуют ионные соединения.
Благородные газы
Благородные газы относятся к группе 18 (иногда называемой группой O) периодической таблицы элементов. Благородные газы имеют очень низкие температуры кипения и плавления, и все они являются газами при комнатной температуре. Они также очень нереактивны, поскольку уже имеют полную валентную оболочку с 8 электронами. Следовательно, инертные газы имеют небольшую склонность терять или приобретать электроны.
Благородные газы имеют очень низкие температуры кипения и плавления, и все они являются газами при комнатной температуре. Они также очень нереактивны, поскольку уже имеют полную валентную оболочку с 8 электронами. Следовательно, инертные газы имеют небольшую склонность терять или приобретать электроны.
Полезные соотношения из периодической таблицы
Периодическая таблица элементов полезна для определения зарядов простых одноатомных ионов. Элементы главной группы, относящиеся к группам 1, 2 и 13-18, образуют ионы, они теряют такое же количество электронов, как и соответствующий номер группы, к которой они относятся. Например, атомы K (группа 1) теряют один электрон и становятся K + и атомы Mg (группа 2) теряют два электрона с образованием Mg 2 + . Другие элементы основной группы, находящиеся в группе 13 и выше, образуют более одного возможного иона.
Элементы групп 3-12 называются переходными элементами или переходными металлами. Подобно элементам основной группы, описанным выше, переходные металлы образуют положительные ионы, но из-за их способности образовывать более двух или более ионов с разным зарядом связь между номером группы и зарядом отсутствует.
Подобно элементам основной группы, описанным выше, переходные металлы образуют положительные ионы, но из-за их способности образовывать более двух или более ионов с разным зарядом связь между номером группы и зарядом отсутствует.
Упражнение \(\PageIndex{1}\)
Расположите эти элементы в порядке убывания атомного размера: Na, C, Sr, Cu, Fr
- Ответ
Fr, Sr, Cu, Na, C
Упражнение \(\PageIndex{1}\)
Расположите эти элементы в порядке возрастания отрицательной EA: Ba, F, Si, Ca, O
- Ответ
Ba, Ca, Si, O, F
Упражнение \(\PageIndex{1}\)
Расположите эти элементы по возрастанию металлического характера: Li, S, Ag, Cs, Ge
- Ответ
Li, S, Ge, Ag, Cs
Упражнение \(\PageIndex{1}\)
Какая реакция, по вашему мнению, будет иметь больший клеточный потенциал?
- \(\ce{2Na(тв) + Cl2(г)→ 2NaCl(тв) или 2Cs(тв) +Cl2(г) → 2RbCl(тв)\)
- \(\ce{2Na(тв) + Cl2(г)→ 2NaCl(тв) или Be(тв) + Cl2(г) → BeCl2(тв)}\)
- Ответить
Второе уравнение
Первое уравнение
Упражнение \(\PageIndex{1}\)
Какое уравнение вы ожидаете получить?
- \(\ce{I2(s) + 2Br(aq) → Br2(l) + 2I(aq)}\)
- \(\ce{Cl2(г) + 2I (водн.
 ) → I2(т) + 2Cl(водн.)}\)
) → I2(т) + 2Cl(водн.)}\)
- Ответить
5. А) Да
Б) №
Проблемы
*Выделите ответ:_____ для просмотра ответов.
1. Элементом, являющимся примером металлоида, является (a) S; (б) цинк; (в) Ге; (г) Ре; (e) ни один из этих
Ответ: (c) Ge
2. В периодической таблице вертикальные (вверх и вниз) столбцы называются (a) периодами; (б) переходы; (c) семьи/группы; (г) металлоиды; д) ни один из них.
Ответ: (c) семьи/группы
3. Почему благородные газы инертны (неактивны)?
Ответ: Благородные газы инертны, потому что они уже имеют полную валентную электронную оболочку и мало склонны приобретать или терять электроны.
4. Как называются соединения, содержащие галоген?
Ответ: Соли
5. Лантаниды и актиниды: (а) щелочноземельные металлы; б) переходные металлы; (в) металлоиды; (г) щелочные металлы; (e) ничего из перечисленного
Ответ: (b) переходные металлы
Ссылки
- Cotton, F.
 A.; Уилкинсон, Г. (1988). Передовая неорганическая химия (5-е изд.). Нью-Йорк: Уайли. ISBN 0-471-84997p. 1385.
A.; Уилкинсон, Г. (1988). Передовая неорганическая химия (5-е изд.). Нью-Йорк: Уайли. ISBN 0-471-84997p. 1385. - Хатчинсон, Джон. «Журнал химического образования». Исследования по разработке концепции в области химии (2007 г.). Распечатать. Внешние ссылки
- Джолли, Уильям Л. (1991). Современная неорганическая химия (2-е изд.). Нью-Йорк: Макгроу-Хилл. ISBN 0-07-112651-1.
- Петруччи, Ральф Х. Общая химия. 9-е изд. Нью-Джерси: Пирсон Прентис Холл, 2005.
.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
- Щелочноземельный
- Щелочноземельные металлы
- щелочные металлы
- атомных радиуса
- Атомный радиус
- ковалентный радиус
- Эффективный ядерный заряд
- Электронное сродство
- электроотрицательность
- Галогены
- Энергия ионизации
- потенциал ионизации
- металлический символ
- Металлоиды
- Благородные газы
- Потенциал окисления
- периодическая таблица
- Периодические тренды
- Окислительно-восстановительные потенциалы
- Потенциал восстановления
- переходные металлы
О компании Copper — Copper Alliance
От электропроводности и теплопроводности до антимикробных свойств, медь является чрезвычайно универсальным металлом с долгой историей улучшения нашей жизни.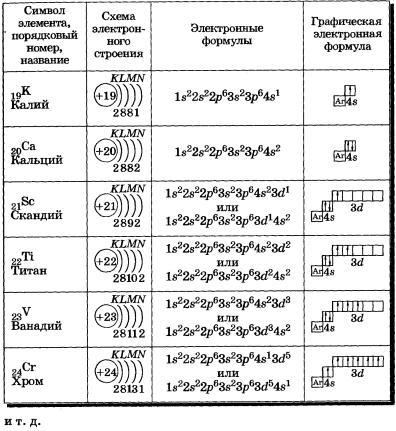
Факты о меди
Хотя свойства меди в повседневной жизни используются по-разному, вот некоторые из наиболее примечательных фактов о меди:
- Медь — это химический элемент с символом Cu. Атомный номер: 29. Атомный вес: 63,546 AMU (атомная единица массы).
- Медь происходит от латинского слова cuprum, что означает «с острова Кипр».
- Медь — древнейший металл человека, которому более 10 000 лет. Медный кулон, обнаруженный на территории современного северного Ирака, датируется примерно 8700 г. до н.э.
- У египтян было так много применений меди, что они использовали символ анкха для обозначения меди в своей системе иероглифов. Медь также олицетворяла вечную жизнь в их культуре.
- Физические свойства меди — одна из ее самых уникальных особенностей. Помимо золота, медь — единственный металл, имеющий естественный цвет. Другие металлы либо серые, либо белые.
- Медь может быть переработана без потери свойств, что делает ее логичным выбором в эпоху глобального устойчивого развития.

- В настоящее время используется более 400 медных сплавов. Латунь — это сплав меди и цинка, а бронза — сплав меди, олова, алюминия, кремния и бериллия.
- Медь жизненно важна для здоровья людей, животных и растений и является неотъемлемой частью рациона человека. К продуктам, богатым медью, относятся сушеные бобы, миндаль, брокколи, шоколад, чеснок, соевые бобы, горох, продукты из цельной пшеницы и морепродукты.
- Медь максимизирует производительность продуктов, которые ее содержат, помогая экономить энергию, CO 2 , деньги и жизни.
- Медь вносит жизненно важный положительный вклад в развитие человечества и на протяжении веков улучшала качество нашей жизни.
Хотите узнать больше о свойствах и использовании меди?
Дополнительную информацию содержит Всемирная книга фактов о меди, подготовленная нашим партнером International Copper Study Group (ICSG).
Дополнительные ресурсы
60 веков меди
60 Веков Меди предназначен для тех, кто интересуется общей историей добычи меди, развитием процессов металлообработки и использованием меди на протяжении последних шести тысяч лет.

 ) → I2(т) + 2Cl(водн.)}\)
) → I2(т) + 2Cl(водн.)}\) A.; Уилкинсон, Г. (1988). Передовая неорганическая химия (5-е изд.). Нью-Йорк: Уайли. ISBN 0-471-84997p. 1385.
A.; Уилкинсон, Г. (1988). Передовая неорганическая химия (5-е изд.). Нью-Йорк: Уайли. ISBN 0-471-84997p. 1385.