Cu химический элемент это: Copper (Cu) — Медь
Содержание
Химические свойства металлов — с чем реагируют? Свойства и таблица
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур.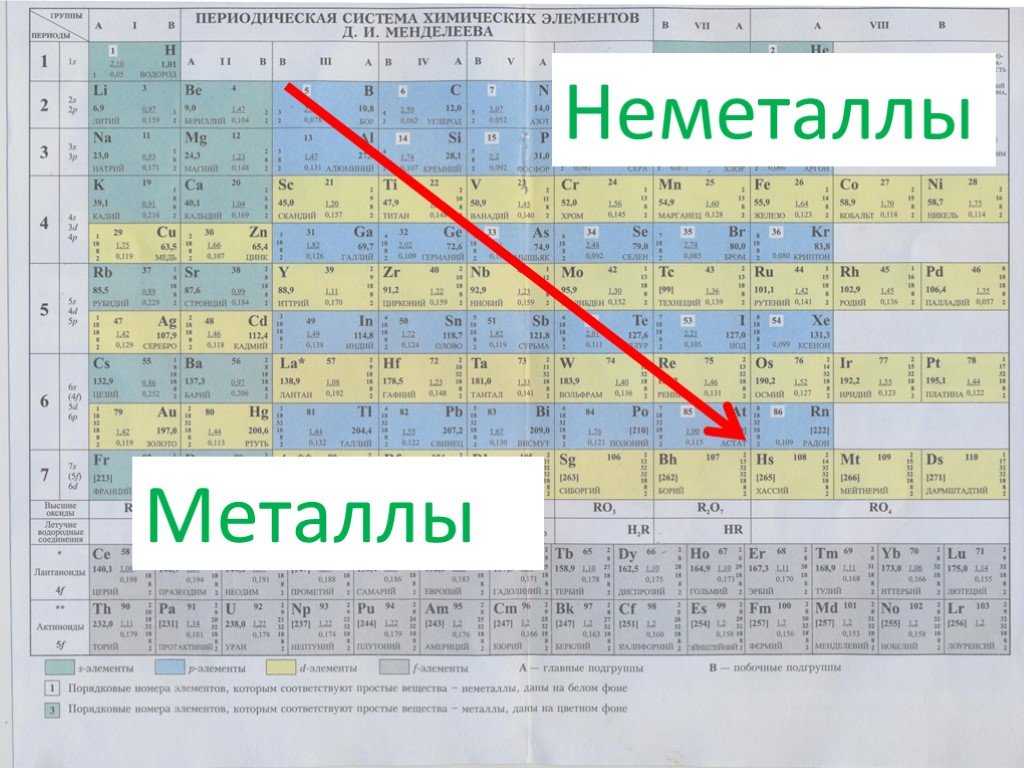 Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.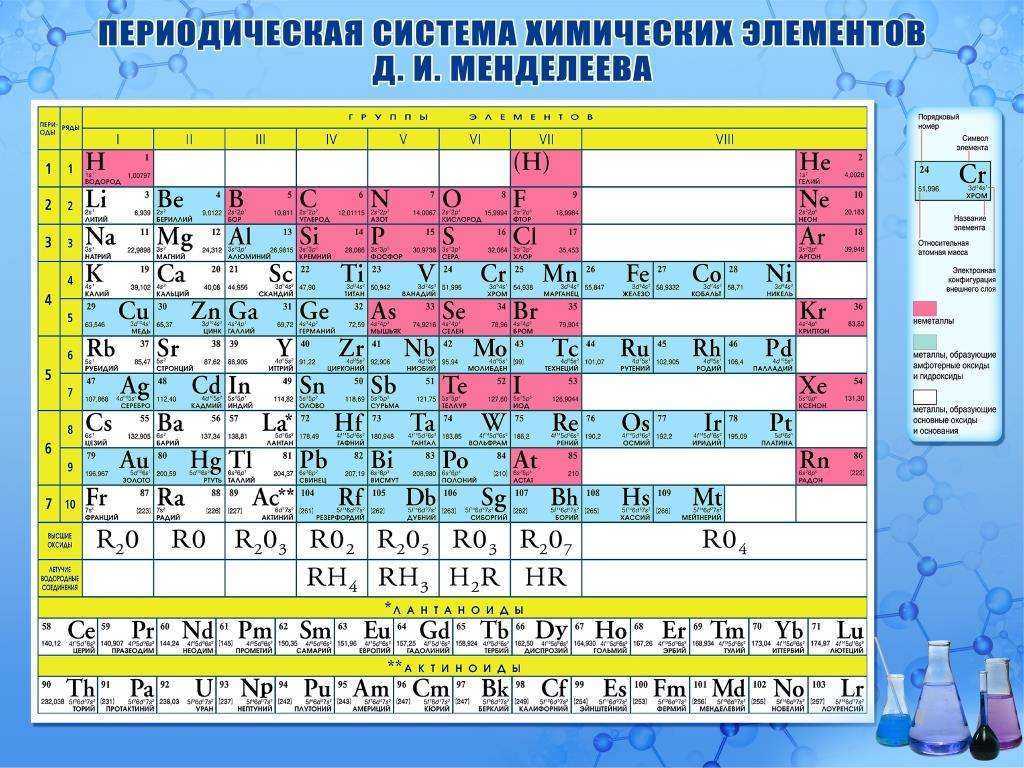
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Медь (Cu, Cuprum) — влияние на организм, польза и вред, описание
История меди
Медь называют одним из первых металлов, которые человек освоил в древности и пользуется им до сегодняшнего дня. Добыча меди была доступной, потому что руду необходимо было плавить при сравнительно невысокой температуре. Первой рудой, из которой стали добывать медь, была малахитовая руда (calorizator). Каменный век в истории человечества сменился именно медным, когда предметы быта, орудия труда и оружие из меди получили самое широкое распространение.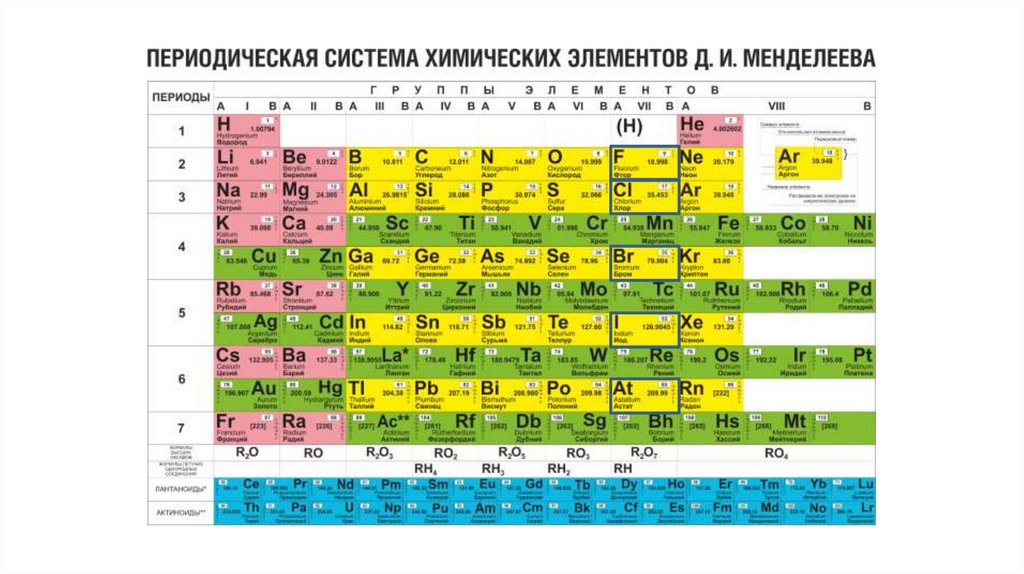
Общая характеристика меди
Медь является элементом XI группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 29 и атомную массу 63,546. Принятое обозначение – Cu (от латинского Cuprum).
Нахождение в природе
Медь достаточно широко представлена в земной коре, в осадочных породах, в водах морских и пресных водоёмах, в сланцах. Распространена как в виде соединений, так и в самостоятельном варианте.
Физические и химические свойства
Медь является пластичным, так называемым переходным металлом, имеет золотисто-розовый цвет. При контакте с воздухом на поверхности меди образуется оксидная плёнка, придающая металлу желтовато-красный оттенок. Известны основные сплавы меди – с цинком (латунь), с оловом (бронза), с никелем (мельхиор).
Суточная потребность в меди
Потребность в меди у взрослого человека составляет 2 мг в день (около 0,035 мг/ 1 кг веса).
Продукты питания богатые медью
Медь – один из самых важных микроэлементов для организма, поэтому продукты питания, богатые медью, должны быть в рационе каждого.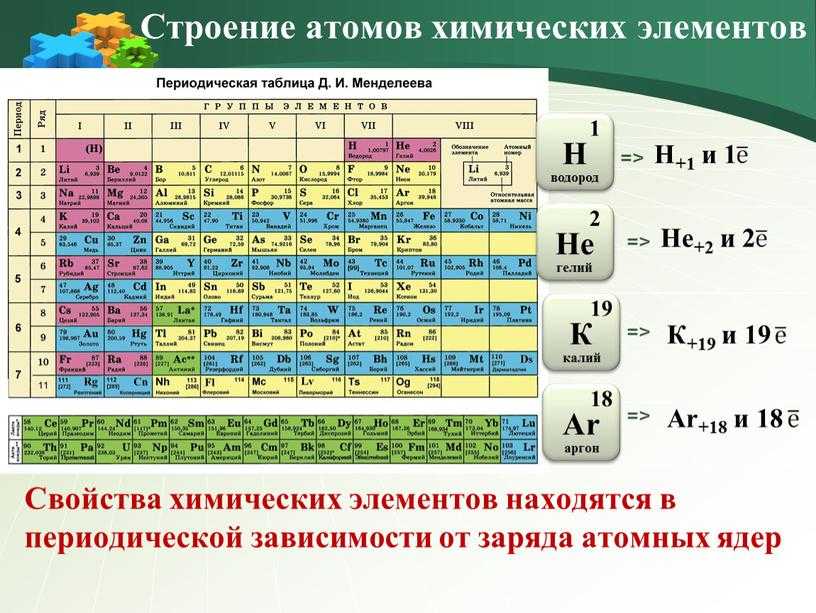 Это:
Это:
- орехи, злаки, бобовые
- рыба, морепродукты
- крупы (особенно рис и гречка), макаронные изделия, ржаной хлеб
- говяжья печень, сырой яичный желток
- кисломолочные продукты
- овощи, фрукты, ягоды и зелень
- питьевая вода.
Признаки нехватки меди
Признаками недостаточного количества меди в организме служат: анемия и ухудшение дыхания, потеря аппетита, расстройства желудка, нервозность, депрессивные состояния, быстрая утомляемость, нарушения пигментации кожи и волос, ломкость и выпадение волос, сыпи на кожных покровах, частые инфекции. Возможны внутренние кровотечения.
Признаки избытка меди
Переизбыток меди характеризуется бессонницей, нарушениями мозговой активности, эпилепсией, проблемами с менструальным циклом.
Взаимодействия с другими
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента.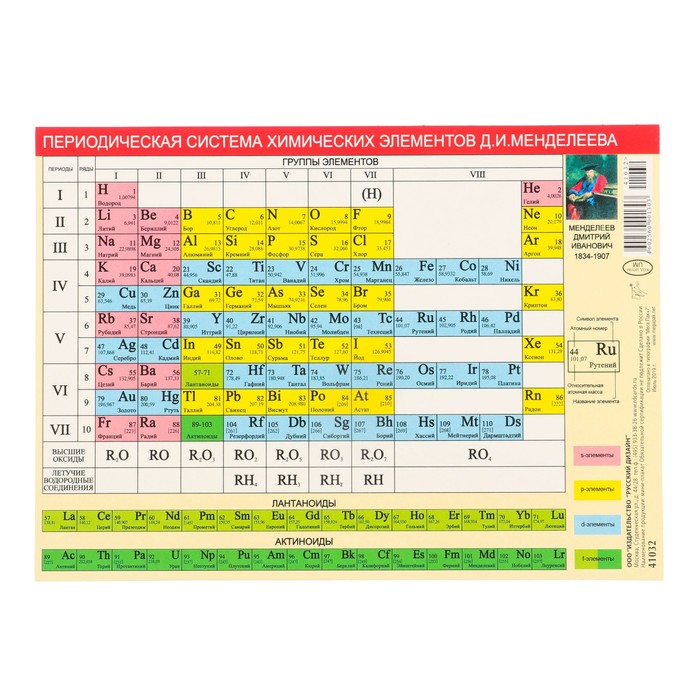
Применение меди в жизни
Медь имеет огромное значение в народном хозяйстве, её основное применение – электротехника, но металл широко используется для чеканки монет, часто – в произведениях искусства. Медь также используется в медицине, архитектуре и строительстве.
Полезные свойства меди и его влияние на организм
Требуется для превращения железа организма в гемоглобин. Делает возможным использование аминокислоты тирозин, позволяя ей проявлять свое действие как фактору пигментации волос и кожи. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь также участвует в процессах роста и размножения. Принимает участие в образовании коллагена и эластина и синтезе эндорфинов – гормонов «счастья».
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
Медь (Cu) — Периодическая таблица
Из Википедии, свободной энциклопедии Медь — это химический элемент с символом Cu (от латинского: cuprum) и атомным номером 29. пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет. пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет.Подробнее в Википедии | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Медь в таблице Менделеева | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbol | Cu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number | 29 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | 11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Element category | Переходный металл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Фаза при STP 13 Density | 8.96 g/cm 3 | Atomic weight | 63.5463 u | Melting point | 1357.77 K | 1084.  62 °C 62 °C 1984.316 °F Boiling point | 2835 K | 2561,85 ° C 4643,33 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||
Атомные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity (SACLEANG SCALING) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity (Pauling Scale).0014 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron affinity | 119.235 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, 0, +1, +2, +3, +4 (a mildly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Электронная конфигурация | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration (Shorthand) | [AR] 3d 10 4 4s) | . 0014 0014 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovered | -9000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovered by | Middle East | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chemical element: Copper (Cu)
Химический элемент: Медь (Cu)
- Метрическая система
- Калькулятор даты
- Калькулятор заработной платы
- Молекулярный вес
- Дискуссионный форум
| Atomic Number: | 29 | |
| Element Symbol: | Cu | |
| Element Name: | Copper | |
| Atomic Weight: | 63. 546 546 | |
| Group Number: | 11 | |
| Group Name: | Coinage metal | |
| Period Number: | 4 | |
| Block: | d-block | |
| Конфигурация основного состояния: | [Ar] 3d10 4s | |
| Уровень основного состояния: | 2S1/2 | 0466 | Solid |
| Bond Length: | 255. 6 6 | |
| Atomic Radius Empirical: | 135 | |
| Atomic Radius Calculated: | 145 | |
| Covalent Radius Empirical : | 138 | |
| Радиус Вандера-Ваальса: | 140 | |
| Сродство к электрону: 1 9 804 69 9 04 4 6 | ||
| First Ionization Energy: | 745.5 | |
| Pauling Electronegativity: | 1.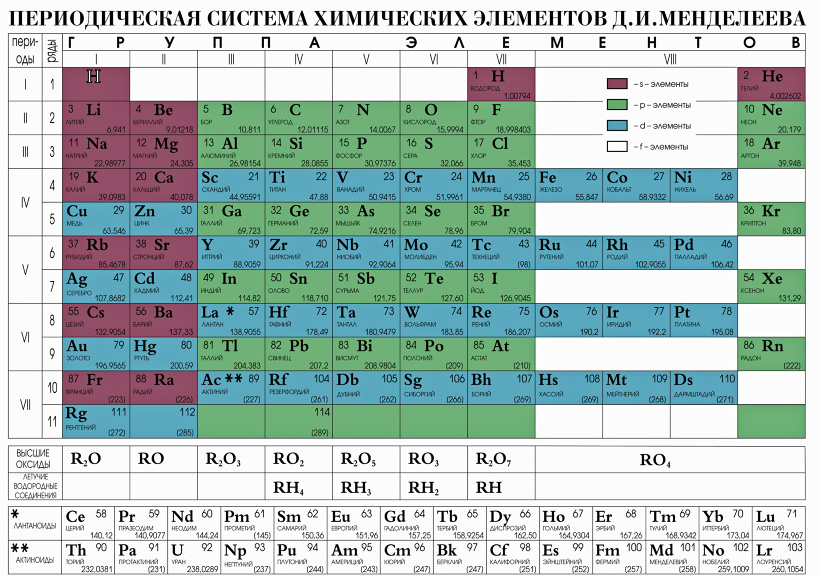 90 90 | |
| Sanderson Electronegativity: | 1.98 | |
| Allred Rochow Electronegativity: | 1.75 | |
| Малликен Джаффе Электроотрицательность: | 1,49 | |
| Плотность твердого вещества: | 8920 | |
| Molar Volume: | 7.11 | |
| Velocity Of Sound: | 3570 | |
| Youngs Modulus: | 130 | |
| Rigidity Modulus: | 48 | |
| Bulk Modulus: | 140 | |
| Poissons Ratio: | 0. 34 34 | |
| Mineral Hardness: | 3.0 | |
| Brinell Hardness: | 874 | |
| Vickers Hardness: | 369 | |
| Electrical Resistivity: | 1.7 | |
| Reflectivity: | 90 | |
| Температура плавления: | 1084,62 | |
| Температура кипения: | 2927 | 400 |
| Coefficient Of Linear Expansion: | 16. 5 5 | |
| Enthalpy Of Fusion: | 13.1 | |
| Enthalpy Of Vaporization: | 300 | |
| Энтальпия атмизации: | 338 | |
| Наиболее распространенные числа окисления: | 2 | |
| Color: | Copper, metallic | |
| Classification: | Metallic | |
| Discovered By: | Known since ancient times | |
| Discovered At: | not known | |
| Происхождение названия: | От латинского слова cuprum, означающего остров Кипр |
Рассчитайте молекулярную массу меди или
молекулярная масса Cu.

 0005
0005