Электрохимическая коррозия что такое: Электрохимическая коррозия
Содержание
Электрохимическая коррозия | Материаловедение
Электрохимическая коррозия — это разрушение металла в результате взаимодействия с раствором электролита, при котором окислительный и восстановительный процессы протекают не в одном акте и на разных участках металла — анодном и катодном. Электрохимическая коррозия сопровождается протеканием электрического тока. К этому виду коррозии относятся атмосферная, подземная, морская и др.
Электролиты — это химические соединения, которые в растворе полностью или частично диссоциируют на катионы и анионы( NaCl = Na+ + Сl—). Наличие положительно и отрицательно заряженных ионов придает растворам электролитов электропроводность. Диссоциация может происходить только в растворителях, молекулы которых полярны, например в воде. Молекулы воды являются диполями и электростатически взаимодействуют с ионами растворенною вещества, образуя гидратированные катионы и анионы. При гидратации иона выделяется энергия гидратации. При погружении металла в раствор электролита его поверхность заряжается. Если энергия гидратации ионов металла больше энергии химической связи атомов в решетке металла, то ионы металла переходят в раствор, а на поверхности металла остается эквивалентное количество электронов. Поверхность металла заряжается отрицательно и к ней притягиваются положительно заряженные ионы из раствора (рисунок 1 а). Если энергии химической связи атомов в решетке металла больше энергии гидратации ионов, то катионы раствора могут забирать электроны с поверхности металла. Поверхность металла заряжается положительно и к ней притягиваются отрицательно заряженные ионы из раствора (рисунок 1 б). В результате на границе раздела металл-электролит образуется двойной электрический слой (ДЭС), который характеризуется электродным потенциалом.
При погружении металла в раствор электролита его поверхность заряжается. Если энергия гидратации ионов металла больше энергии химической связи атомов в решетке металла, то ионы металла переходят в раствор, а на поверхности металла остается эквивалентное количество электронов. Поверхность металла заряжается отрицательно и к ней притягиваются положительно заряженные ионы из раствора (рисунок 1 а). Если энергии химической связи атомов в решетке металла больше энергии гидратации ионов, то катионы раствора могут забирать электроны с поверхности металла. Поверхность металла заряжается положительно и к ней притягиваются отрицательно заряженные ионы из раствора (рисунок 1 б). В результате на границе раздела металл-электролит образуется двойной электрический слой (ДЭС), который характеризуется электродным потенциалом.
Рисунок 1 — схема строения двойного электрического слоя
Электродный потенциал — разность потенциалов в ДЭС между металлом и раствором.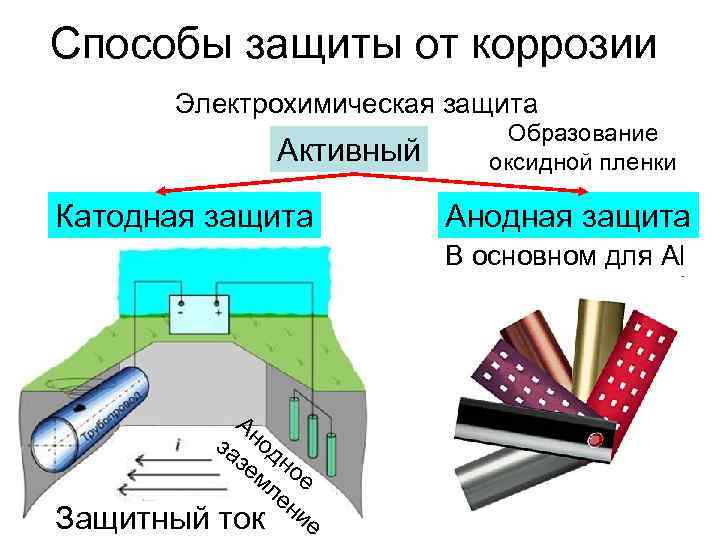 С течением времени процессы перехода ионов металла в раствор и адсорбции ионов раствора на поверхности уравновешиваются и значение электродного потенциала металла становится постоянным. Абсолютное значение электродных потенциалов определить невозможно, поэтому их измеряют относительно электродов сравнения. Основным электродом сравнения, потенциал которого условно принят за ноль, является стандартный водородный электрод, потенциал которого характеризует процесс 1/2Н2 — е— = Н+. Чем отрицательнее потенциал металла, тем выше его восстановительные свойства и склонность к коррозии — см. таблица 1. Металлы, имеющие потенциал меньше чем водород, будут окисляться водородом и кислородом. Металлы, у которых потенциал больше, чем у водорода, но меньше чем у кислорода, будут окисляться только кислородом. Те металлы, у которых потенциал больше, чем у кислорода, корродировать не будут (Au, Pt).
С течением времени процессы перехода ионов металла в раствор и адсорбции ионов раствора на поверхности уравновешиваются и значение электродного потенциала металла становится постоянным. Абсолютное значение электродных потенциалов определить невозможно, поэтому их измеряют относительно электродов сравнения. Основным электродом сравнения, потенциал которого условно принят за ноль, является стандартный водородный электрод, потенциал которого характеризует процесс 1/2Н2 — е— = Н+. Чем отрицательнее потенциал металла, тем выше его восстановительные свойства и склонность к коррозии — см. таблица 1. Металлы, имеющие потенциал меньше чем водород, будут окисляться водородом и кислородом. Металлы, у которых потенциал больше, чем у водорода, но меньше чем у кислорода, будут окисляться только кислородом. Те металлы, у которых потенциал больше, чем у кислорода, корродировать не будут (Au, Pt).
Таблица 1 — Электродные потенциалы
Механизм электрохимической коррозии.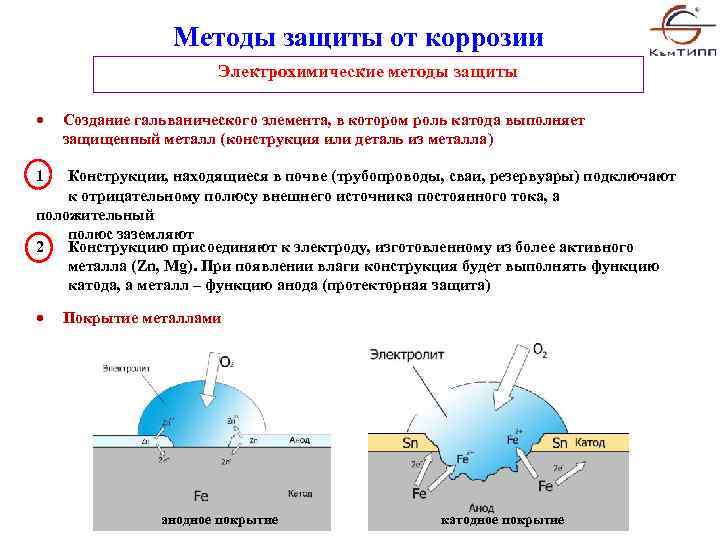 Электрохимическая коррозия возникает в результате работы множества короткозамкнутых гальванических элементов, образующихся вследствие химической и энергетической неоднородности металла (сплава). На рисунке 2 представлена схема коррозии стали со структурой феррит-цементит в растворе кислоты. На аноде — участке поверхности с более отрицательным потенциалом (феррит) происходит окисление железа и переход ионов в раствор, где они гидратируются:
Электрохимическая коррозия возникает в результате работы множества короткозамкнутых гальванических элементов, образующихся вследствие химической и энергетической неоднородности металла (сплава). На рисунке 2 представлена схема коррозии стали со структурой феррит-цементит в растворе кислоты. На аноде — участке поверхности с более отрицательным потенциалом (феррит) происходит окисление железа и переход ионов в раствор, где они гидратируются:
Fe — 2е— = Fe2+
Анод при этом заряжается отрицательно. На катоде — участке поверхности с более положительным потенциалом (цементит) происходит восстановление ионов и молекул раствора, например:
2H++2e— = H2
O2+4H++4e— = 2H2O
O2+2H2O+4e— = 4OH—
Катод при этом заряжается положительно. Катодами могут быть не только зерна цементита, но и включения металлов с более положительным потенциалом или различных неметаллов. Наличие электронной проводимости у металла и ионной у раствора электролита позволяет анодным и катодным процессам протекать на различных участках поверхности металла. Между анодом и катодом протекает электрический ток — образуется замкнутый гальванический элемент.
Наличие электронной проводимости у металла и ионной у раствора электролита позволяет анодным и катодным процессам протекать на различных участках поверхности металла. Между анодом и катодом протекает электрический ток — образуется замкнутый гальванический элемент.
Рисунок 2 — схема электрохимической коррозии стали в кислоте
| На нашем сайте Вы можете заказать решениe заданий по всем разделам материаловедения. |
Коррозия металлов, электрохимическая коррозия. Ржавчина
Окисление железа. Ржавчина
Ржавчина — это сложное вещество, образованное при химической реакции воды и железа.
Уже при влажности воздуха 50% поверхность железа покрывается слоем воды толщиной в 15 молекул. Коррозия усиливается в присутствии ионов хлора Cl—, которые способствуют растворению ржавчины и переходу её в раствор в виде химического соединения [Fe(H2O)2Cl4].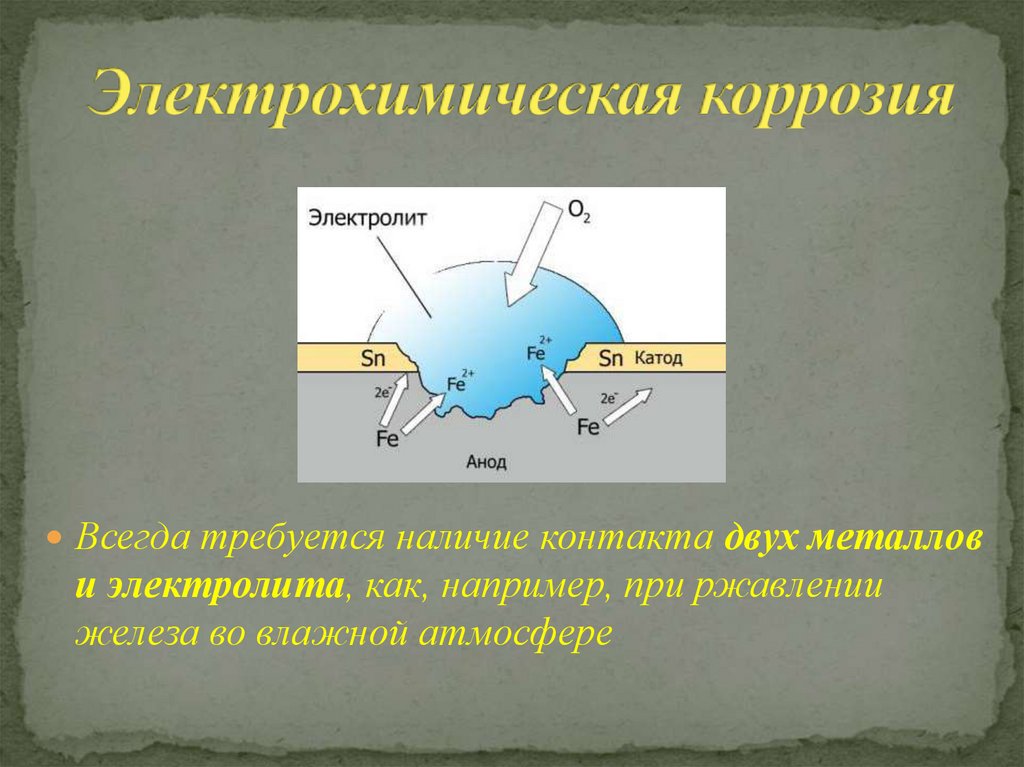 В качестве ингибиторов коррозии (веществ, замедляющиех корродирование металла), используют раствор NaNO2, глицерин, амины (бутил-амин) и их соли.
В качестве ингибиторов коррозии (веществ, замедляющиех корродирование металла), используют раствор NaNO2, глицерин, амины (бутил-амин) и их соли.
Белый осадок Fe(OH)2 гидроксида железа II, присутствующее в растворе ржавичны, на воздухе быстро окисляется, превращаясь в жёлто-коричневый гидроксид железа(III). В отличие от Fe(OH)2, новый гидроксид железа (III) Fe(OH)3, который являетсфя амфотерным, хотя его кислотные свойства выражены намного слабее основных; он растворяется только в концентрированных щелочах при нагревании:
Fe(OH)3+3КОН→ K3[Fe(OH)6].
При окислении железа промежуточным продуктом реакции является грязно-зелёный осадок гидроксида, содержащего Fe (II) и Fe (III).
Интересным, но неприятным свойством ржавчины является то, что она занимает намного больший объём, чем занимало железо. Это может вызвать катастрофические последствия: хотя с виду ржавчина кажется рыхлой и мягкой, при её росте развиваются гигантские усилия. Когда в Лондоне по проекту Кристофера Рена в 1675—1710 гг. строили грандиозный собор Святого Павла, каменные блоки колокольни для прочности соединили железными скобами, которые были уложены в желобки, выдолбленные в камне. За сотни лет скобы проржавели, увеличились в объёме и стали поднимать каменную кладку, отчего колокольню перекосило. Инженеры подсчитали: давление, развиваемое ржавчиной, настолько велико, что приподняло бы даже двухкилометровый слой камней! Пришлось разобрать кладку и вставить в желобки новые скобы из нержавеющей стали.
Когда в Лондоне по проекту Кристофера Рена в 1675—1710 гг. строили грандиозный собор Святого Павла, каменные блоки колокольни для прочности соединили железными скобами, которые были уложены в желобки, выдолбленные в камне. За сотни лет скобы проржавели, увеличились в объёме и стали поднимать каменную кладку, отчего колокольню перекосило. Инженеры подсчитали: давление, развиваемое ржавчиной, настолько велико, что приподняло бы даже двухкилометровый слой камней! Пришлось разобрать кладку и вставить в желобки новые скобы из нержавеющей стали.
Скорость окисления железа (появление ржавчины) очень сильно зависит от обшей поверхности соприкосновения металла и воздуха. Так, обычный гвоздь, даже если он сильно нагрет, не скоро превращается в окалину. Мелкие опилки при сильном нагреве быстро сгорают, а при внесении в пламя — вспыхивают в виде искр. Химическим способом — восстановлением оксидов железа водородом — можно получить ещё более мелкий порошок железа; его называют пирофорным. Он вспыхивает на воздухе уже при обычной температуре. Пирофорными могут быть и многие другие металлы в мелкораздробленном состоянии, а также оксид FeO.
Он вспыхивает на воздухе уже при обычной температуре. Пирофорными могут быть и многие другие металлы в мелкораздробленном состоянии, а также оксид FeO.
Коррозия металлов
Коррозия металлов — (от латинского corrodere — грызть) процессы, происходящие в результате химического воздействия окружающей среды, в результате которых происходит их разрушение.
От этого процесса отличается другой процесс — эрозия металлов, представляющий собой разрушение их поверхности под механическим воздействием среды.
Коррозия металлов означает разъедание, — начинается также на их поверхности. Происходит химическое взаимодействие с окружающей средой. Это процесс является самопроизвольным, а также является следствием окислительно-восстановительных реакций с компонентами окружающей среды.
В результате разрушения металла образуются продукты его окисления, а именно: оксиды, гидроксиды, иногда просто происходит его растворение в среде до ионного состояния.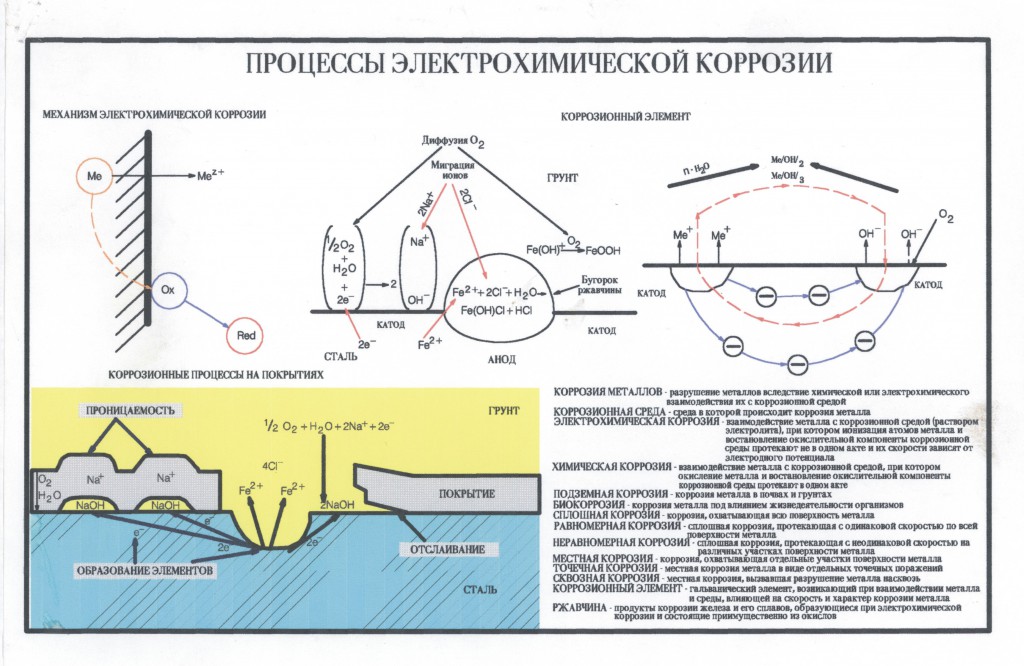 Такое превращение сопровождается существенным изменением свойств.
Такое превращение сопровождается существенным изменением свойств.
Известны различные виды коррозии металлов. Одним из основных её видов является химическая, которую иногда ещё называют газовой коррозия, так как иногда она происходит под воздействием газообразных компонентов из окружающей среды при высоких температурах. Химическая коррозия может происходить и под воздействием некоторых агрессивных жидкостей. Основным этого процесса является то, что она происходит без возникновения в системе электрического тока. Ей подвергаются детали и узлы машин, работающих в атмосфере кислорода при высоких температурах, например турбинные двигатели, ракетные двигатели и некоторые другие, а также подвергаются детали узлы оборудования химического производства.
Другим распространённым видом разрушения металлов яввляется электрохимическая коррозия — поверхностное разрушение в среде электролита с возникновением в системе электрического тока. Электрохимическая коррозия — разрушение в атмосфере, на почве, водоёмах, грунтах.
Электрохимическая коррозия — разрушение в атмосфере, на почве, водоёмах, грунтах.
Характер разрушения поверхности металла может быть различным и зависит от свойств этого металла и условиях протекания процесса. Теперь остановимся подробнее на электрохимической коррозии.
Виды коррозии
Виды коррозии:равномернаянеравномернаяизбирательнаяпятнамиточечнаярастрескивающаямежкристаллитная
К основным видам наблюдаемой коррозии относятся:
Электрохимическая коррозия протекает интенсивнее, если в катод вкраплён металл, менее активный, чем корродирующий. Например, если корродирует сталь (а сталь — это сплав железа и углерода в котором частично образуется карбид железа) роль таких участков играет карбид железа (FeC).
Атмосферная коррозия
— протекает во влажном воздухе при обычной температуре. Поверхность металла покрывается плёнкой влаги, содержащей растворённый кислород. Интенсивность разрушения металла возрастает с ростом влажности воздуха, а также содержанием в нём газообразных оксидов углерода, серы, при наличии в металле шероховатостей, трещин облегчающих конденсацию влаги.
Интенсивность разрушения металла возрастает с ростом влажности воздуха, а также содержанием в нём газообразных оксидов углерода, серы, при наличии в металле шероховатостей, трещин облегчающих конденсацию влаги.
Почвенная коррозия
— её подвержены трубопроводы, кабели, подземные сооружения. В этом случае металлы соприкасаются с влагой почвы, содержащей растворённый кислород. Во влажной почве, с повышенной кислотностью трубопроводы разрушаются в течение полугода после их укладки (конечно, если не принять меры по их защите).
Электрическая коррозия
— происходит под действием блуждающих токов, возникающих от посторонних источников (линии электропередач,электрические железные дороги, различные электроустановки, работающие на постоянном электрическом токе). Блуждающие токи вызывают разрушение газопроводов, нефтепроводов,электрокабелей, различных сооружений. Под действием электрического тока на находящихся на земле металлических предметах появляются участки входа и выхода электронов — катоды и аноды. На анодных участках наблюдается наиболее интенсивное разрушение.
На анодных участках наблюдается наиболее интенсивное разрушение.
— наиболее распространённый видом разрушения металлов. Примером электрохимической коррозии является, например, разрушение деталей машин, приборов и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, в атмосфере, под пленками влаги, в технических растворах, под действием смазочно-охлаждающих жидкостей и т.д. Как уже было отмечено, электрохимическая коррозия протекает на поверхности металлов под действием электрических токов, то есть происходят окислительно-восстановительные химические реакции, характеризующиеся отдачей электронов и их переносом, так как образуются катодные и анодные участки. Образованию катодов и анодов способствуют химическая неоднородность металлов (примеси и включения), наличие участков остаточной деформации, неоднородность покрывающих металл защитных плёнок и т.д. Наиболее часто в образовании данного вида разрушения металла участвуют не один фактор, а несколько. Когда метал начинает корродировать, он превращается в многоэлектронный гальванический элемент.
Когда метал начинает корродировать, он превращается в многоэлектронный гальванический элемент.
Например, рассмотрим что происходит, если медь Cu контактирует с железом Fe в среде электролита. Такая система представляет собой гальванический элемент, где железо — анод («+»), а медь — катод. Железо отдает электроны меди и переходит в раствор в виде ионов. Ионы водорода движутся к меди, где разряжаются. Катод постепенно становится более отрицательным, в конце-концов становится равным потенциалу анода и коррозия замедляется.
Как раз на эту тему можно провести опыт в домашних условиях. Нам потребуется три стакана с раствором поваренной соли (пищевая соль), 3 железных гвоздя, кусочек цинка и медная проволока (без изоляции). Итак, приступим. Первый гвоздь опустите в стакан с раствором соли. Ко второму гвоздю прикрутите медную проволоку, а к третьему — кусочек цинка. Затем опустите каждый гвоздь в свой стакан с раствором соли (их было 3) и оставьте их на 2-3 суток.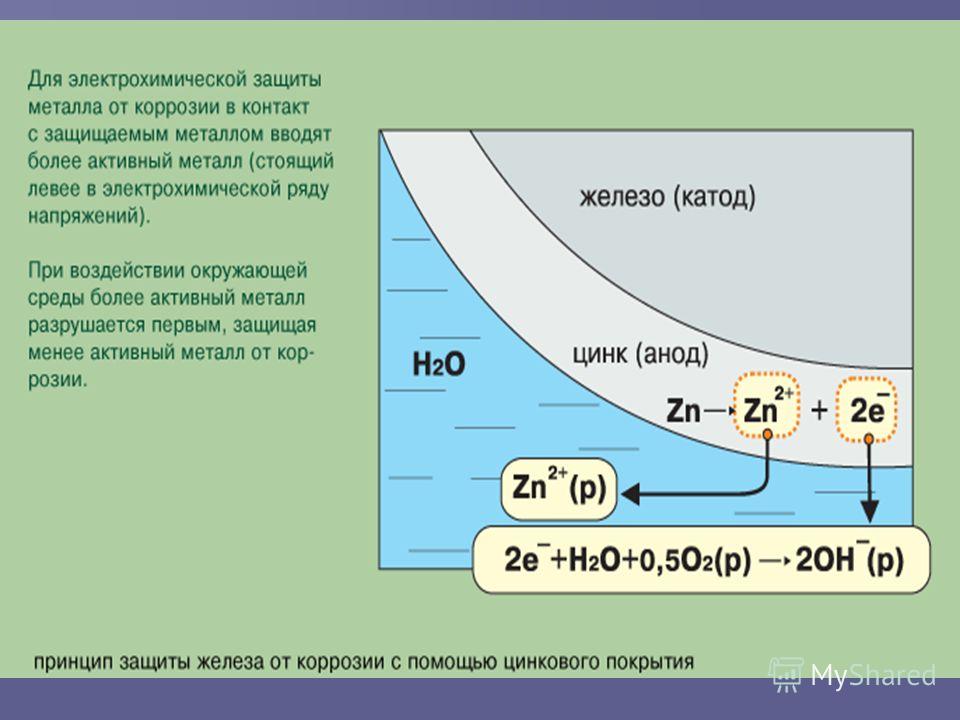
Что происходит: все наши гвозди будут иметь следы ржавчины (коррозии). В самом худшем состоянии будет тот гвоздь, который находился в растворе вместе с медной проволокой, а меньше всего корродировал тот, который привязан к цинку! Объяснение: все металлы обладают разной способностью отдавать электроны. Сравнить их в этой способности можно, ознакомившись с рядом напряжений металлов:
Li← K← Rb← Cs← Ba← Ca← Na← Mg← Al← Mn← Cr← Zn← Fe← Cd← Co← Ni← Sn← Pb← h3← Cu← Ag← Hg← Pt← Au
Те металлы, которые в ряду напряжений находятся левее (например Zn — цинк находится левее Fe — железа), легче отдают свои электроны, чем металл справа (например Cu — медь правее Fe — железа). А значит, как только оба металла попадают в электролит (проводник тока- раствор соли), то сразу образуют гальваническую пару. Более активный металл (стоящий левее) заряжается положительно, а менее активный — отрицательно.
Вернёмся к нашему опыту: тоже самое произошло и в наших стаканах с растворами. Железо (Fe) стоит левее, чем медь (Cu), поэтому оно заряжается положительно, при этом быстро окисляясь. В стакане с цинком — цинк (Zn) — более активный, чем железо. Поэтому, пока весь цинк не поржавеет, железо не разрушится (чем часто пользуются в технических целях).
Железо (Fe) стоит левее, чем медь (Cu), поэтому оно заряжается положительно, при этом быстро окисляясь. В стакане с цинком — цинк (Zn) — более активный, чем железо. Поэтому, пока весь цинк не поржавеет, железо не разрушится (чем часто пользуются в технических целях).
Коррозия как электрохимический процесс
Коррозия как электрохимический процесс
Кусок оголенного железа, оставленный снаружи, где он подвергается воздействию влаги, быстро заржавеет. Это произойдет еще быстрее, если влага представляет собой соленую воду. Скорость коррозии увеличивается за счет электрохимического процесса, в котором капля воды становится гальваническим элементом при контакте с металлом, окисляя железо. Рассматривая набросок капли воды (после Эббинга), окисляющееся железо поставляет электроны на край капли для восстановления кислорода из воздуха. Поверхность железа внутри капли действует как анод для процесса Fe(s) -> + Fe 2+ (водн. Электроны могут двигаться через металлическое железо наружу капли, где O 2 (g) + 2H 2 O(l) + 4e — -> 4OH — (водн.) Внутри капли ионы гидроксида могут двигаться внутрь, чтобы реагировать с ионами железа (II), перемещающимися из области окисления. Гидроксид железа(II) осаждается. Fe 2+ (водн.) + 2OH — (водн.) -> Fe(OH) 2 (тв.) Затем в результате окисления осадка быстро образуется ржавчина . 4Fe(OH) 2 (т) + O 2 (ж) -> 2Fe 2 O 3 H 2 O(т) + 2H 2 Ржавление незащищенного железа в присутствии воздуха и воды в таком случае неизбежно, так как оно обусловлено электрохимическим процессом. Однако другие электрохимические процессы могут обеспечить некоторую защиту от коррозии. Магниевые стержни можно использовать для защиты подземных стальных труб с помощью процесса, называемого катодной защитой.
| Индекс Окисление/ Electrochemistry Concepts Справочник EBBING | ||
| Вернуться |
Подземные стальные трубы обладают прочностью для транспортировки жидкостей под высоким давлением, но они уязвимы для коррозии, вызванной электрохимическими процессами. Меру защиты можно обеспечить, вбив магниевый стержень в землю рядом с трубой и обеспечив электрическое соединение с трубой. Поскольку магний имеет стандартный потенциал -2,38 вольта по сравнению с -0,41 вольта для железа, он может действовать как анод гальванического элемента, а стальная труба — как катод. Mg(s) -> + Mg 2+ (водн.) + 2e — в то время как стальная труба как катод будет защищена реакцией O 2 (г) + 2H 2 O(ж) + 4e — -> 4OH — (водн.). | Индекс Окисление/ Принципы электрохимии Ссылка Эббинг | |
9 | Вернуться назад |
Коррозия — электрохимическая
Коррозия — электрохимическая
| Коррозия и ухудшение состояния окружающей среды |
| ||||||||||||||
| Электрохимический Процессы · схема иллюстрирует электрохимическую реакцию, происходящую на поверхности | |||||||||||||||
