Электрохимическая коррозия что такое: Механизм электрохимической коррозии металлов — УТТП
Содержание
4.4 Механизм электрохимической коррозии
Электрохимическая
коррозия возникает в результате работы
множества коротко замкнутых гальванических
элементов, образующихся вследствие
неоднородности металла. На рисунке 16
показана схема электрохимической
коррозии доэвтектоидной углеродистой
стали в структуре, которой присутствуют
две фазы: феррит и цементит, в растворе
кислоты. Выделим микрогальванический
элемент, включающий зерно феррита Fе и
палочку цементита Fе3С.
Электрод, на котором идет процесс
окисления, называется анодом. Анодный
процесс заключается в переходе железа
в раствор, при этом эквивалентное
количество электронов остается в
металле.
Рисунок
16 — Схема электрохимической коррозии
стали в растворе
кислоты
Освободившийся
электрон переходит с одной фазы на
другую т.е. с феррита на цементит. Ион
железа гидратируется. В общей форме
В общей форме
анодный процесс можно записать так:
Me
— ne—→
Men+
· nH2O
Катодный
процесс заключается в восстановлении
ионов раствора. Поэтому и электрод, на
котором идет процесс восстановления,
называется катодом.
Примеры
катодных процессов:
восстановление
ионов водорода в кислой среде:
2Н+
+ 2е—→Н2;
восстановление
растворенного кислорода в кислой среде:
O2
+
4H+
+
4e—→
2H2O
восстановление
растворенного кислорода в нейтральной
или щелочной среде:
O2
+
2H2O
+ 4e—→
4OH—
Наличие
электронной проводимости у металла и
ионной проводимости у раствора электролита
позволяет анодным и катодным процессам
протекать раздельно на различных
участках поверхности металла.
Коррозионный
микроэлемент на поверхности металла
образуется вследствие наличия
металлических и неметаллических макро-
и микровключений, многофазности структур,
неоднородности защитных пленок и других
причин. Коррозионный микроэлемент
является коротко замкнутым элементом.
Равновесные
потенциалы электродов определялись в
условиях отсутствия в цепи тока. При
прохождении электрического тока
потенциалы электродов изменяются т.е.
потенциал анодных участков смещается
в положительную сторону, а катодных —
в отрицательную, что приводит к уменьшению
разности потенциалов. Это явление
называется поляризацией.
На
рисунке 17 показана схема изменения
потенциала катода и анода после замыкания
цепи гальванической пары. По оси ординат
отложен потенциал электродов.
По
оси абсцисс отложено время
до замыкания τ1
и
после замыкания цепи.
На
схеме приняты обозначения: φa°;
φк°
— начальные значения потенциалов анода
и катода до замыкания цепи; φa;
φк
—значения потенциалов анода и катода
после замыкания цепи; Е°; Е
—
разность потенциалов
до и после замыкания цепи; ΔЕа;
ΔEк
—
смещения потенциалов
Рисунок
17 — Схема изменения потенциалов катода
и анода
после
замыкания цепи
анода
и катода, называемые соответственно
анодной и катодной поляризацией.
В
результате поляризации потенциал анода
становится положительнее, потенциал
катода — отрицательнее, уменьшается
разность потенциалов между электродами.
Поляризация, с позиции защиты металлов
от коррозии, — явление полезное.
Поляризация снижает величину коррозионного
тока и, следовательно, снижает скорость
коррозионных процессов. С целью защиты
металлоконструкций от коррозии в каждом
конкретном случае необходимо принять
меры, способствующие поляризации. Термин
«поляризация» употребляется не только
для характеристики величины изменения
потенциала электродов в вольтах, но и
самого явления, приводящего к изменению
коррозионных процессов.
Анодная
поляризация, или торможение анодного
процесса, вызывается рядом причин. При
определенных условиях на поверхности
металла образуется пассивная защитная
пленка из оксидов металла, которая и
способствует торможению анодного
процесса,
вызывая анодную поляризацию. Если выход
ионов металла в раствор не поспевает
за отводом электронов, отрицательный
заряд на поверхности металла уменьшается
и потенциал металла сдвигается в
положительную сторону, вызывая анодную
поляризацию. Если скорость диффузии
Если скорость диффузии
ионов металла в раствор электролита
незначительна, то это приводит к повышению
концентрации ионов в при-анодной зоне
и к торможению анодного процесса.
Катодная
поляризация, или торможение катодного
процесса, происходит в основном по двум
причинам. Одна из причин заключается в
недостаточной скорости подвода катионов
или молекул раствора к катодной
поверхности и отвода продуктов
восстановления от катода в раствор. В
результате концентрация электронов
повысится, и потенциал катода станет
более отрицательным. Другой причиной
катодной поляризации может быть малая
скорость восстановления катионов или
молекул раствора, что приводит к повышению
плотности электронов и смещению
потенциала катода в отрицательную
сторону.
Электрохимическая коррозия | Материаловедение
Электрохимическая коррозия — это разрушение металла в результате взаимодействия с раствором электролита, при котором окислительный и восстановительный процессы протекают не в одном акте и на разных участках металла — анодном и катодном. Электрохимическая коррозия сопровождается протеканием электрического тока. К этому виду коррозии относятся атмосферная, подземная, морская и др.
Электрохимическая коррозия сопровождается протеканием электрического тока. К этому виду коррозии относятся атмосферная, подземная, морская и др.
Электролиты — это химические соединения, которые в растворе полностью или частично диссоциируют на катионы и анионы( NaCl = Na+ + Сl—). Наличие положительно и отрицательно заряженных ионов придает растворам электролитов электропроводность. Диссоциация может происходить только в растворителях, молекулы которых полярны, например в воде. Молекулы воды являются диполями и электростатически взаимодействуют с ионами растворенною вещества, образуя гидратированные катионы и анионы. При гидратации иона выделяется энергия гидратации. При погружении металла в раствор электролита его поверхность заряжается. Если энергия гидратации ионов металла больше энергии химической связи атомов в решетке металла, то ионы металла переходят в раствор, а на поверхности металла остается эквивалентное количество электронов. Поверхность металла заряжается отрицательно и к ней притягиваются положительно заряженные ионы из раствора (рисунок 1 а). Если энергии химической связи атомов в решетке металла больше энергии гидратации ионов, то катионы раствора могут забирать электроны с поверхности металла. Поверхность металла заряжается положительно и к ней притягиваются отрицательно заряженные ионы из раствора (рисунок 1 б). В результате на границе раздела металл-электролит образуется двойной электрический слой (ДЭС), который характеризуется электродным потенциалом.
Если энергии химической связи атомов в решетке металла больше энергии гидратации ионов, то катионы раствора могут забирать электроны с поверхности металла. Поверхность металла заряжается положительно и к ней притягиваются отрицательно заряженные ионы из раствора (рисунок 1 б). В результате на границе раздела металл-электролит образуется двойной электрический слой (ДЭС), который характеризуется электродным потенциалом.
Рисунок 1 — схема строения двойного электрического слоя
Электродный потенциал — разность потенциалов в ДЭС между металлом и раствором. С течением времени процессы перехода ионов металла в раствор и адсорбции ионов раствора на поверхности уравновешиваются и значение электродного потенциала металла становится постоянным. Абсолютное значение электродных потенциалов определить невозможно, поэтому их измеряют относительно электродов сравнения. Основным электродом сравнения, потенциал которого условно принят за ноль, является стандартный водородный электрод, потенциал которого характеризует процесс 1/2Н2 — е— = Н+.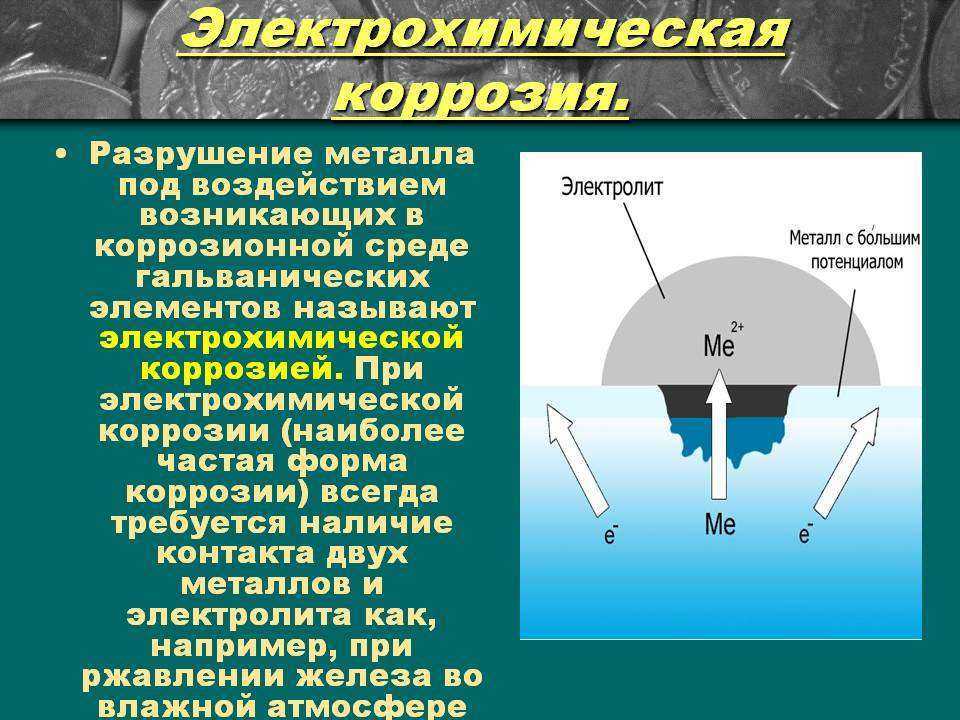 Чем отрицательнее потенциал металла, тем выше его восстановительные свойства и склонность к коррозии — см. таблица 1. Металлы, имеющие потенциал меньше чем водород, будут окисляться водородом и кислородом. Металлы, у которых потенциал больше, чем у водорода, но меньше чем у кислорода, будут окисляться только кислородом. Те металлы, у которых потенциал больше, чем у кислорода, корродировать не будут (Au, Pt).
Чем отрицательнее потенциал металла, тем выше его восстановительные свойства и склонность к коррозии — см. таблица 1. Металлы, имеющие потенциал меньше чем водород, будут окисляться водородом и кислородом. Металлы, у которых потенциал больше, чем у водорода, но меньше чем у кислорода, будут окисляться только кислородом. Те металлы, у которых потенциал больше, чем у кислорода, корродировать не будут (Au, Pt).
Таблица 1 — Электродные потенциалы
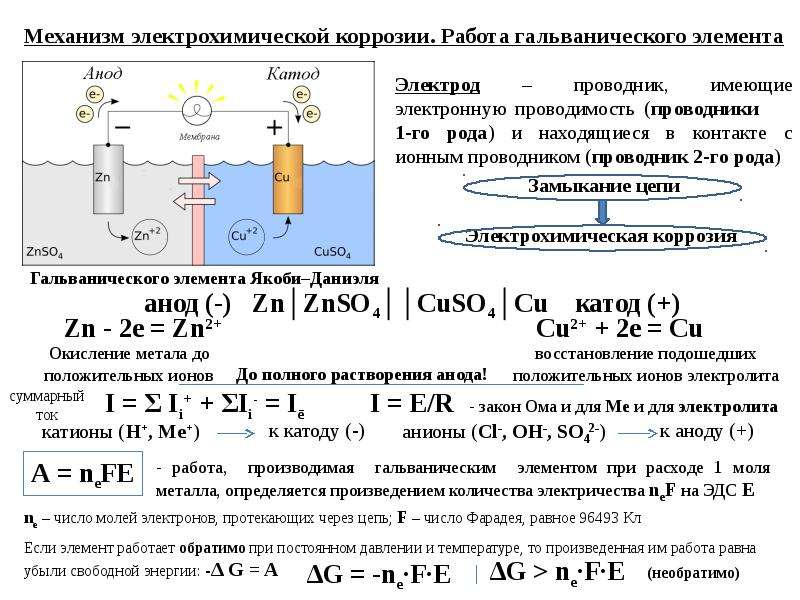
Механизм электрохимической коррозии. Электрохимическая коррозия возникает в результате работы множества короткозамкнутых гальванических элементов, образующихся вследствие химической и энергетической неоднородности металла (сплава). На рисунке 2 представлена схема коррозии стали со структурой феррит-цементит в растворе кислоты. На аноде — участке поверхности с более отрицательным потенциалом (феррит) происходит окисление железа и переход ионов в раствор, где они гидратируются:
Fe — 2е— = Fe2+
Анод при этом заряжается отрицательно. На катоде — участке поверхности с более положительным потенциалом (цементит) происходит восстановление ионов и молекул раствора, например:
На катоде — участке поверхности с более положительным потенциалом (цементит) происходит восстановление ионов и молекул раствора, например:
2H++2e— = H2
O2+4H++4e— = 2H2O
O2+2H2O+4e— = 4OH—
Катод при этом заряжается положительно. Катодами могут быть не только зерна цементита, но и включения металлов с более положительным потенциалом или различных неметаллов. Наличие электронной проводимости у металла и ионной у раствора электролита позволяет анодным и катодным процессам протекать на различных участках поверхности металла. Между анодом и катодом протекает электрический ток — образуется замкнутый гальванический элемент.
Рисунок 2 — схема электрохимической коррозии стали в кислоте
На нашем сайте Вы можете заказать решениe заданий по всем разделам материаловедения. |
Электрохимические испытания на коррозию | Испытательные лаборатории IMR
ЭЛЕКТРОХИМИЧЕСКИЕ КОРРОЗИОННЫЕ ИСПЫТАНИЯ
Испытание на электрохимическую коррозию – это метод, используемый для оценки коррозионной стойкости металла или сплава путем измерения его электрохимического поведения в коррозионной среде. Он включает воздействие на испытуемый образец агрессивного раствора при мониторинге его электрохимической активности. Обычно это делается путем погружения образца в раствор и измерения потенциала и тока между образцом и электродом (электродом сравнения), помещенным в тот же раствор.
Тестирование проводится с помощью контролируемой электрохимической реакции между двумя материалами или между открытой поверхностью и окружающей средой. Подача напряжения в испытательную установку быстро ускоряет воздействие испытательного раствора на материал. Следовательно, целевые растворы электролитов можно использовать для моделирования долгосрочных условий, а также для прогнозирования и характеристики коррозионных свойств металлических материалов и компонентов.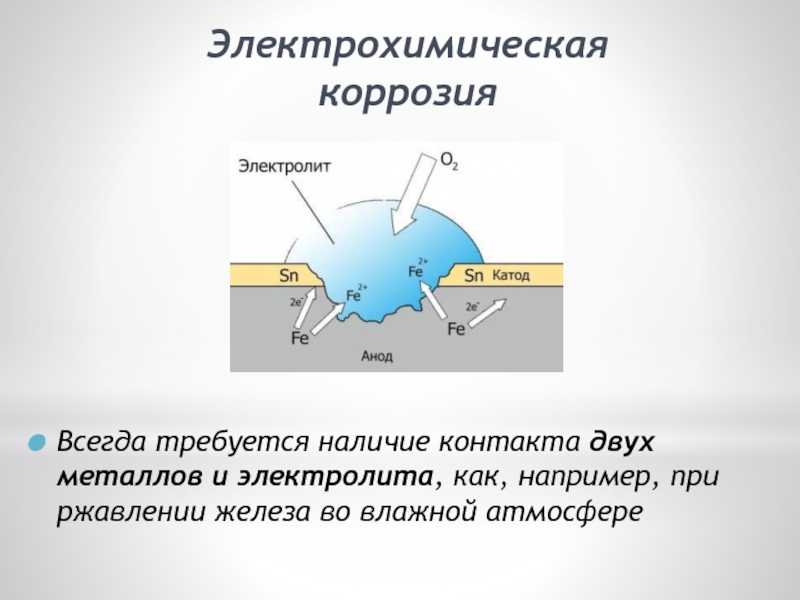
ПРИМЕНЕНИЕ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
Анализ медицинских изделий : определение восприимчивости к щелевой коррозии
Сравнение сырья: проверка характеристик коррозии
Оценка эффектов: исследование пассивации или поверхностных модификаций коррозионного поведения 9001 7 Измерить эффекты обработки: оценить и сравнить коррозионные свойства
Оценка комбинаций биметаллов: проверка на гальваническую коррозию
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ИСПЫТАНИЙ НА КОРРОЗИЮ
Циклические потенциодинамические измерения поляризации (ASTM F2129)
- Используется для определения коррозионного поведения металла или сплава в растворе. Он включает сканирование потенциала рабочего электрода в диапазоне потенциалов и обратно к начальному потенциалу с постоянной скоростью сканирования при измерении результирующего тока. Полученные данные можно использовать для определения потенциала коррозии, плотности тока коррозии и потенциала пассивации материала.
 Кривые поляризации, полученные в результате испытания, также могут предоставить информацию о кинетике реакции коррозии и скорости коррозии металла. CPP особенно полезен для изучения локальных явлений коррозии, таких как питтинг и коррозионное растрескивание под напряжением.
Кривые поляризации, полученные в результате испытания, также могут предоставить информацию о кинетике реакции коррозии и скорости коррозии металла. CPP особенно полезен для изучения локальных явлений коррозии, таких как питтинг и коррозионное растрескивание под напряжением.
Коррозионная чувствительность сплавов железа, никеля, кобальта (G61)
- Испытание включает измерение потенциала образца металла или сплава в коррозионном растворе через различные промежутки времени в течение определенного периода времени. Его осуществляют путем погружения образца испытуемого сплава в раствор, содержащий заданную концентрацию серной кислоты и сульфата железа. Затем потенциал образца измеряется через равные промежутки времени в течение определенного периода времени, обычно от 24 до 72 часов. Измеренные значения потенциала используются для расчета скорости коррозии сплава. Испытание G61 полезно для оценки коррозионной стойкости сплавов в условиях, которые имитируют условия, встречающиеся в промышленных условиях, особенно при наличии растворов серной кислоты.
 Испытание часто используется для определения склонности сплавов к межкристаллитной коррозии, точечной коррозии и коррозионному растрескиванию под напряжением. Тест G61 широко используется в аэрокосмической, химической и нефтегазовой промышленности для оценки коррозионной стойкости сплавов в тех случаях, когда они подвергаются воздействию агрессивных сред. Испытание также можно использовать для оценки эффективности ингибиторов коррозии и других обработок в предотвращении коррозии этих сплавов.
Испытание часто используется для определения склонности сплавов к межкристаллитной коррозии, точечной коррозии и коррозионному растрескиванию под напряжением. Тест G61 широко используется в аэрокосмической, химической и нефтегазовой промышленности для оценки коррозионной стойкости сплавов в тех случаях, когда они подвергаются воздействию агрессивных сред. Испытание также можно использовать для оценки эффективности ингибиторов коррозии и других обработок в предотвращении коррозии этих сплавов.
Гальваническая коррозия (ASTMG71)
- В этом испытании два металлических образца помещаются в контакт, как правило, в держатель, который поддерживает контакт между двумя металлами. Затем образцы погружают в раствор электролита и измеряют скорость коррозии анода, наблюдая за потерей веса образца или используя электрохимические методы, такие как потенциодинамическая поляризация или спектроскопия электрохимического импеданса. Испытание можно использовать для оценки относительной устойчивости к гальванической коррозии различных комбинаций металлов и для определения влияния факторов окружающей среды, таких как температура и рН, на скорость гальванической коррозии.
 Испытание также позволяет оценить эффективность покрытий или других видов обработки в снижении гальванической коррозии между разнородными металлами.
Испытание также позволяет оценить эффективность покрытий или других видов обработки в снижении гальванической коррозии между разнородными металлами.
Гальваническая коррозия медицинских имплантатов (F3044)
- F3044 — это метод испытания ASTM для оценки гальванической коррозии металлических медицинских имплантатов при контакте с другими металлическими компонентами в организме. Испытание имитирует физиологические условия в организме и оценивает возможность выхода из строя медицинских имплантатов, вызванного коррозией. Гальваническая коррозия возникает, когда разнородные металлы в организме создают электрохимическую ячейку, приводящую к ускоренной коррозии одного металла. F3044 включает погружение имплантата в искусственную жидкость организма и измерение электрического потенциала между металлическими компонентами имплантата для расчета гальванического тока и скорости коррозии. Важно убедиться, что медицинские имплантаты устойчивы к коррозии, чтобы предотвратить осложнения.

Сопротивление линейной поляризации (ASTM G59)
- LPR — это неразрушающий метод, используемый для измерения скорости коррозии металлических материалов. Метод LPR основан на измерении поляризационного сопротивления поверхности металла в агрессивной среде. При испытании LPR к металлическому образцу в агрессивном растворе прикладывают небольшой потенциал (напряжение) и измеряют результирующий ток. Анализируя текущую реакцию металла, метод LPR может определить сопротивление поляризации, которое пропорционально скорости коррозии материала. Метод LPR — это быстрый и надежный метод, который можно использовать для оценки коррозионной стойкости различных металлических материалов в различных средах, включая водные растворы, морскую воду и различные промышленные технологические жидкости. Его также можно использовать для оценки эффективности ингибиторов коррозии и покрытий. Метод испытаний LPR широко используется в таких отраслях, как аэрокосмическая, автомобильная и нефтегазовая, где коррозионная стойкость имеет решающее значение для производительности и надежности компонентов.
 Он также используется при оценке и выборе металлических материалов для использования в строительстве, инфраструктуре и других областях, где важна коррозионная стойкость.
Он также используется при оценке и выборе металлических материалов для использования в строительстве, инфраструктуре и других областях, где важна коррозионная стойкость.
Анализ коррозионного разрушения
Испытания на удаление цинка
Испытания на электрохимическую коррозию
Растрескивание под воздействием окружающей среды (ESC)
Оценка формикарной (муравьиной) коррозии
Общая и точечная коррозия
Тепловое и жидкостное старение
Тестирование нитрата ртути
Тестирование пассивации Медицинские компоненты
Потенциодинамическая коррозия
Испытание медных сплавов на остаточные и сборочные нагрузки
Сенсибилизирующие испытания
Коррозионное растрескивание под напряжением (SCC)
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ Часто задаваемые вопросы
Что такое электрохимическая коррозия?
Испытания на электрохимическую коррозию — это метод, используемый для оценки коррозионной стойкости металлических материалов в данной среде. Этот метод включает измерение электрохимических свойств материала для определения его восприимчивости к коррозии.
Этот метод включает измерение электрохимических свойств материала для определения его восприимчивости к коррозии.
Какие существуют типы методов испытаний на электрохимическую коррозию?
Существуют различные типы методов испытаний на электрохимическую коррозию, включая сопротивление линейной поляризации (LPR), циклическую потенциодинамическую поляризацию (CPP), испытания на гальваническую коррозию, испытания на критическую температуру точечной коррозии (CPT) и другие.
Каковы преимущества испытаний на электрохимическую коррозию?
Электрохимические испытания на коррозию представляют собой быстрый, неразрушающий и точный метод оценки коррозионной стойкости металлических материалов. Он также обладает высокой воспроизводимостью, что позволяет получать последовательные и надежные результаты.
Какие типы материалов можно испытывать с помощью электрохимических испытаний на коррозию?
Испытания на электрохимическую коррозию можно использовать для оценки коррозионной стойкости широкого спектра металлических материалов, включая сплавы, стали и цветные металлы.
Какие факторы влияют на скорость коррозии материала в конкретной среде?
На скорость коррозии материала влияют такие факторы, как химический состав материала, характер окружающей среды (например, pH, температура, влажность) и присутствие других веществ (например, примеси, растворенные газы) .
Сколько времени занимает испытание на электрохимическую коррозию?
Продолжительность испытаний на электрохимическую коррозию зависит от конкретного метода испытаний и испытываемого материала. Некоторые тесты могут занять несколько часов, в то время как другие могут занять несколько недель или месяцев.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
МЕТОДЫ ИСПЫТАНИЙ ASTM
- ASTM G59 : Стандартный метод испытаний для проведения потенциодинамических измерений сопротивления поляризации
- ASTM G85 : Стандартная практика испытаний модифицированного солевого тумана (тумана)
- ASTM G59 : Стандартный метод испытаний для проведения циклических потенциодинамических поляризационных измерений для локализованной коррозии сплавов на основе железа, никеля или кобальта 9003 8
- ASTM G69 : Стандартный метод испытаний для измерения потенциала коррозии алюминиевых сплавов
- ASTM G71 : Стандартное руководство по проведению и оценке испытаний на гальваническую коррозию в электролитах
- ASTM G150 : Стандартный метод испытаний для электрохимических испытаний нержавеющей стали и родственных сплавов при критической температуре точечной коррозии
СООТВЕТСТВУЮЩИЕ АККРЕДИТАЦИИ
Щелкните здесь, чтобы просмотреть полный список аккредитаций и сертификатов для всех центров тестирования IMR.
Большие проблемы в исследованиях электрохимической коррозии
Коррозия — это процесс деградации или разрушения материала в результате химической реакции между материалом и окружающей средой. Это незаменимая область исследований в области материаловедения и инженерии, поскольку коррозионная стойкость характеризует стабильность или долговечность материала, что является одним из наиболее важных характеристик материала при применении.
По сравнению с другими материалами металлы относительно активны и, вероятно, подвержены коррозии. Таким образом, исследования коррозии в основном касаются механизма повреждения и поведения различных металлов, включая черные и цветные, монокристаллы или нанокристаллы, литые или кованые, а также конструкционные или функциональные сплавы. Он естественным образом развился в различные отрасли на основе сплава (Shreir et al., 1994), такие как коррозия стали, коррозия алюминиевого сплава, коррозия никелевого сплава и т. д. Состав и микроструктура всегда являются наиболее решающими факторами в определении коррозионной стойкости. сплав. В этом аспекте критическим вопросом, который необходимо решить, является то, как на процесс коррозии влияют фазовый состав матрицы, сегрегированный легирующий элемент, структура решетки, кристаллический дефект, ориентация кристаллов, размер зерна, состав вторичной фазы, распределение интерметаллических частиц, пористость, микроструктура. плотность трещин, уровень примесей и состояние поверхности.
сплав. В этом аспекте критическим вопросом, который необходимо решить, является то, как на процесс коррозии влияют фазовый состав матрицы, сегрегированный легирующий элемент, структура решетки, кристаллический дефект, ориентация кристаллов, размер зерна, состав вторичной фазы, распределение интерметаллических частиц, пористость, микроструктура. плотность трещин, уровень примесей и состояние поверхности.
Другим важным аспектом исследования коррозии является сложное влияние факторов окружающей среды на коррозию. Чувствительность коррозионного поведения к факторам окружающей среды привела к различной степени и формам повреждения металлов в различных условиях эксплуатации (Cramer and Covino, 2006). В зависимости от среды, которой подвергаются металлы, коррозию можно легко разделить на различные типы, такие как водная или неводная коррозия, коррозия окружающей среды или высокотемпературная коррозия, кислотная или щелочная коррозия и т. д. В естественной среде атмосферная коррозия, морская вода коррозия и подземная коррозия обычно по-разному воздействуют на металлы. Различные проблемы с коррозией, связанные с условиями обслуживания, также часто возникают в химической, нефтегазовой, трубопроводной, гражданской, автомобильной, аэрокосмической, военной, ядерной и медицинской отраслях. Поскольку большинство факторов окружающей среды, таких как температура, давление, химический состав, концентрация компонентов, значение pH, электрическая или теплопроводность, вязкость и т. д., могут прямо или косвенно взаимодействовать и постоянно или непостоянно влиять на процесс коррозии, прогнозирование долгосрочных коррозионное поведение довольно сложно. Выявление ключевого влияющего фактора и понимание его влияния на кинетику коррозии должно быть предметом исследования в этом аспекте.
Различные проблемы с коррозией, связанные с условиями обслуживания, также часто возникают в химической, нефтегазовой, трубопроводной, гражданской, автомобильной, аэрокосмической, военной, ядерной и медицинской отраслях. Поскольку большинство факторов окружающей среды, таких как температура, давление, химический состав, концентрация компонентов, значение pH, электрическая или теплопроводность, вязкость и т. д., могут прямо или косвенно взаимодействовать и постоянно или непостоянно влиять на процесс коррозии, прогнозирование долгосрочных коррозионное поведение довольно сложно. Выявление ключевого влияющего фактора и понимание его влияния на кинетику коррозии должно быть предметом исследования в этом аспекте.
В основе исследований коррозии лежит изучение механизма реакции материала с окружающей средой. Именно фундаментальное понимание подробных реакционных процессов, процедур и стадий, а также факторов, влияющих на них, лежит в основе науки о коррозии. Большинство проблем с коррозией в окружающей среде можно отнести к электрохимическим реакциям (Kaesche, 2003), поскольку влага и водная жидкость широко распространены в естественной среде, а электрохимическая реакция обычно протекает быстрее, чем реакции окисления-восстановления в условиях окружающей среды. Коррозионное разрушение, вызванное напряжением, во многих случаях является результатом сложных взаимодействий между напряжением и электрохимическими реакциями; напряжение резко облегчает электрохимический процесс, а последнее резко усиливает повреждающее действие первого. Даже при высоких температурах коррозию расплавленной соли также можно описать как электрохимический процесс. Таким образом, электрохимия является одним из наиболее актуальных предметов исследования коррозии (Mansfeld and Bertocci, 2005). Чтобы получить представление об основной области науки о коррозии, следует уделить первоочередное внимание изучению подробных электрохимических механизмов и созданию моделей интерфейса металл-электролит.
Коррозионное разрушение, вызванное напряжением, во многих случаях является результатом сложных взаимодействий между напряжением и электрохимическими реакциями; напряжение резко облегчает электрохимический процесс, а последнее резко усиливает повреждающее действие первого. Даже при высоких температурах коррозию расплавленной соли также можно описать как электрохимический процесс. Таким образом, электрохимия является одним из наиболее актуальных предметов исследования коррозии (Mansfeld and Bertocci, 2005). Чтобы получить представление об основной области науки о коррозии, следует уделить первоочередное внимание изучению подробных электрохимических механизмов и созданию моделей интерфейса металл-электролит.
Изучив основные аспекты и суть науки о коррозии, никогда не следует забывать, что конечной целью исследований коррозии является минимизация коррозионного повреждения. В связи с этим большой интерес представляют все методы, способные препятствовать реакции металла с окружающей средой и эффективно замедлять коррозионный процесс. Фактически, катодная защита (Baeckmann et al., 1997), покрытие (Swaraj, 1996), обработка/модификация поверхности (Biestek and Weber, 1976) и ингибитор (Braford, 19).93) методы, которые замедляют коррозию с помощью различных механизмов, имеют долгую историю успешного уменьшения коррозионного повреждения на практике. Они создали важное продолжение науки о коррозии, которая более или менее пересекается с наукой о поверхностях и покрытиях, технологиями и инженерией. Хотя технологические инновации являются центральной темой в этой области, очень желательны научные прорывы. Инновации в предотвращении коррозии часто появляются, когда новые идеи, методы и результаты других дисциплин внедряются в эту прикладную область исследований коррозии.
Фактически, катодная защита (Baeckmann et al., 1997), покрытие (Swaraj, 1996), обработка/модификация поверхности (Biestek and Weber, 1976) и ингибитор (Braford, 19).93) методы, которые замедляют коррозию с помощью различных механизмов, имеют долгую историю успешного уменьшения коррозионного повреждения на практике. Они создали важное продолжение науки о коррозии, которая более или менее пересекается с наукой о поверхностях и покрытиях, технологиями и инженерией. Хотя технологические инновации являются центральной темой в этой области, очень желательны научные прорывы. Инновации в предотвращении коррозии часто появляются, когда новые идеи, методы и результаты других дисциплин внедряются в эту прикладную область исследований коррозии.
Из приведенного выше краткого введения можно выделить следующие основные характеристики, которые практически отличают исследования коррозии от других дисциплин материаловедения и техники:
(1) Коррозия возникает в сложной системе, на которую одновременно воздействуют факторы окружающей среды и металлургические параметры. . Эти взаимодействующие факторы чрезвычайно усложняют коррозионную систему. Таким образом, невозможно четко определить ключевой влияющий фактор и этап, определяющий скорость, которые управляют фундаментальной кинетикой процесса коррозии. Следовательно, многие коррозионные явления не поддаются теоретическому объяснению. Исследования коррозии в некоторых случаях должны опираться на значительный объем эмпирических знаний.
. Эти взаимодействующие факторы чрезвычайно усложняют коррозионную систему. Таким образом, невозможно четко определить ключевой влияющий фактор и этап, определяющий скорость, которые управляют фундаментальной кинетикой процесса коррозии. Следовательно, многие коррозионные явления не поддаются теоретическому объяснению. Исследования коррозии в некоторых случаях должны опираться на значительный объем эмпирических знаний.
(2) Коррозия — процесс, чувствительный ко времени. Поскольку большинство факторов окружающей среды могут заметно меняться со временем, коррозионные характеристики металла могут быть невероятно разными на разных стадиях. Даже в коррозионной системе с постоянными факторами внешней среды и строго контролируемыми начальными и граничными условиями состояние корродирующей поверхности может меняться во времени за счет растворения металла или отложения продуктов коррозии. Следовательно, различные параметры окружающей среды в сочетании со сложным влиянием факторов окружающей среды делают теоретическое предсказание коррозии чрезвычайно трудным.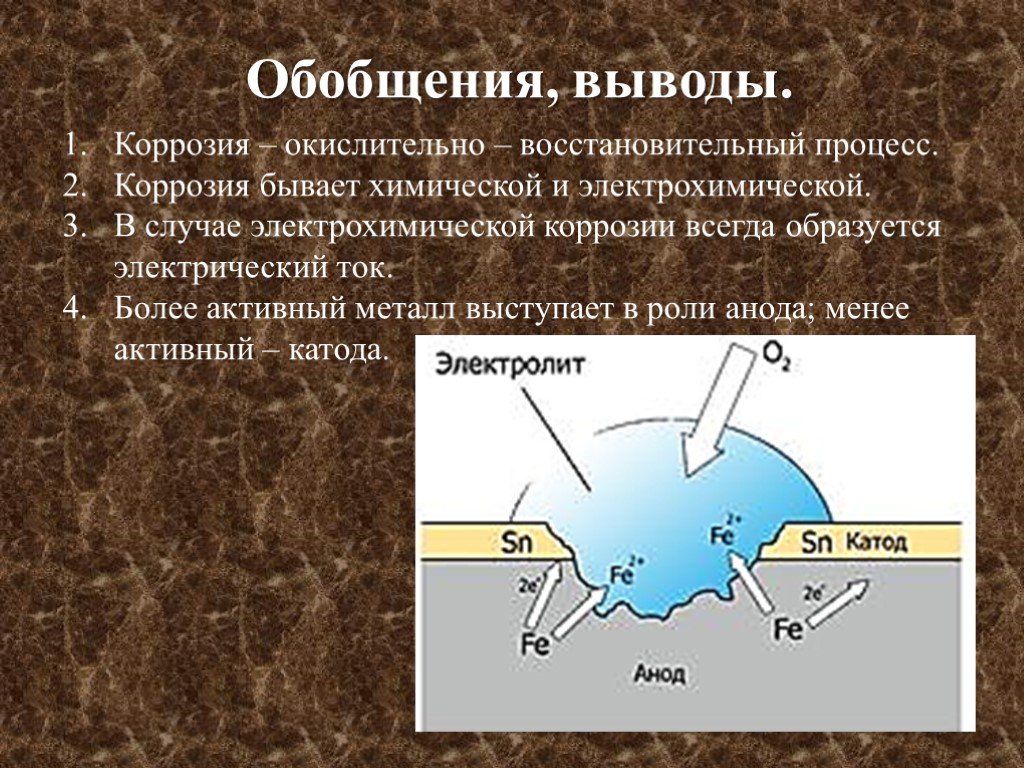
(3) Отсутствуют методы с высоким разрешением in situ для выявления механизма коррозии. Из-за зависимости коррозии от условий окружающей среды измерения ex situ могут не дать существенной информации о процессе коррозии или могут исказить эту информацию. В настоящее время большинство передовых инструментов, обычно используемых для характеристики микроструктуры и состава поверхности металла на наноуровне, должны работать в высоком вакууме, или требуют тщательной предварительной обработки/подготовки образца, или требуют добавления некоторых вспомогательных частиц для провоцируют дополнительные реакции в коррозионной системе. Они не могут производить настоящие in situ возникает из-за ненарушенной коррозионной поверхности в агрессивных средах. Ожидается, что некоторые новые появляющиеся методы с высоким разрешением in situ , например, специально разработанная электролитная ячейка, которая может быть установлена в SEM или TEM, станут доступными для большинства исследователей коррозии при изучении микроструктуры и состава корродирующей поверхности в жидкие среды.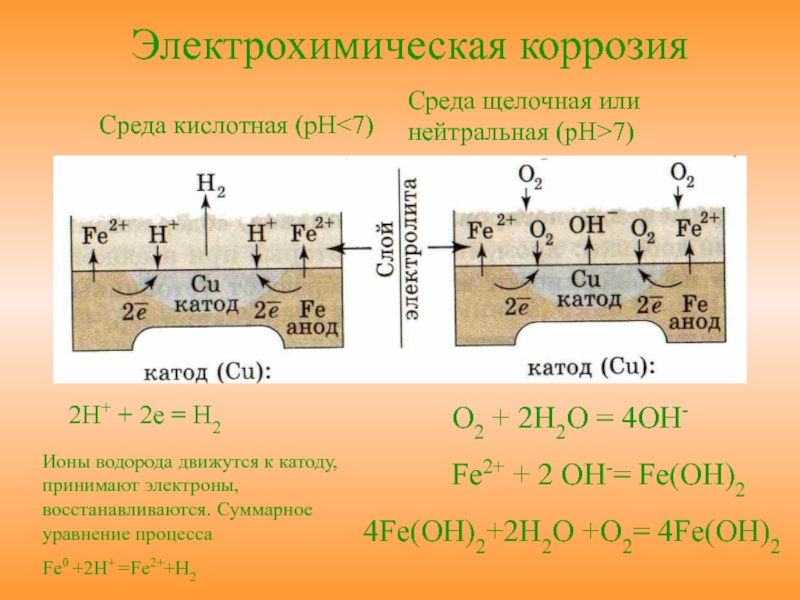
Помимо этих основных характеристик исследования коррозии и вытекающих из этого трудностей, существует множество сложных вопросов, требующих решения, некоторые из которых стали серьезными препятствиями, критически препятствующими дальнейшему развитию науки о коррозии. Успешное решение этих критических проблем может значительно продвинуть эту область. Например, следующие темы особенно сложны и могут заинтересовать исследователей, занимающихся коррозионной наукой.
(1) Коррозия метастабильных металлов: в то время как наука о материалах распространяется на нанотехнологии и метастабильные микроструктуры, такие как аморфные и нанокристаллические сплавы, современные принципы коррозии, основанные на традиционных кристаллических металлах, начинают сталкиваться с новыми проблемами. Понимание реакции коррозии на поверхности, состоящей из чрезвычайно высокой плотности дефектов, является новой областью в науке о коррозии. Чтобы расширить и углубить знания о коррозии и обеспечить практическое применение инновационных материалов, в первую очередь необходимо решить задачу разработки новых теорий коррозии для высокоактивированной металлической поверхности.
(2) Коррозия и защита передовых технических металлов: по мере роста спроса на материалы с некоторыми весьма желаемыми свойствами несколько сплавов, которые изначально считались непригодными для некоторых применений, теперь попадают в короткий список кандидатов. Например, сплавы Mg изначально были слишком активны, чтобы быть популярными конструкционными материалами, но теперь высокое соотношение прочности и веса делает их привлекательными в автомобильной промышленности в качестве материалов-кандидатов для автомобилей следующего поколения. Эти типы материалов обычно имеют коррозионное поведение, отличное от традиционных сплавов, и существующие знания и технологии защиты от коррозии и защиты не могут быть непосредственно применены к ним. Важно и сложно продолжать дальнейшее развитие существующих принципов и методов коррозии для покрытия этих передовых технических сплавов.
(3) Подробный механизм влияния наноструктуры на коррозию: коррозионная стойкость сплава в основном определяется его поверхностными «слабыми местами». Эти активные центры на поверхности фактически представляют собой кристаллические дефекты, такие как дислокации, двойники, границы зерен, границы раздела фаз, сегрегированные легирующие элементы, осажденные интерметаллиды или примесные включения. Понимание деталей коррозионной реакции в этих местах, очевидно, является неизбежным шагом в решении центральной проблемы науки о коррозии. К сожалению, эти дефекты обычно находятся в наномасштабе. Выявить механизм микрокоррозии в этих дефектных участках до получения 9 высокого разрешения — большая проблема.0164 in situ экспериментальных методов освоены учеными-коррозионистами.
Эти активные центры на поверхности фактически представляют собой кристаллические дефекты, такие как дислокации, двойники, границы зерен, границы раздела фаз, сегрегированные легирующие элементы, осажденные интерметаллиды или примесные включения. Понимание деталей коррозионной реакции в этих местах, очевидно, является неизбежным шагом в решении центральной проблемы науки о коррозии. К сожалению, эти дефекты обычно находятся в наномасштабе. Выявить механизм микрокоррозии в этих дефектных участках до получения 9 высокого разрешения — большая проблема.0164 in situ экспериментальных методов освоены учеными-коррозионистами.
(4) Механизм коррозии и технология предотвращения коррозии в экстремальных условиях: к экстремальным условиям относятся чрезвычайно сильные помехи электрических и магнитных полей, облучения, давления, температуры и т. д. Коррозионные повреждения в этих суровых условиях обнаружены в ядерной, аэрокосмической , газовая / нефтяная и химическая промышленность. Однако до того, как исследователи получат in situ методы, специально разработанные для этих экстремальных условий, их понимание этого вида коррозии не может быть таким всеобъемлющим, как понимание коррозии окружающей среды. Кроме того, из-за суровых условий эксплуатации и ограниченности промышленных методов эксплуатации в этих отраслях отчаянно не хватает экономически эффективных мер по предотвращению коррозии. Поскольку этот вид коррозии может в конечном итоге угрожать общественной безопасности, ученый-коррозионист обязан принять вызов, чтобы улучшить понимание коррозии в экстремальных условиях и разработать более эффективные методы предотвращения.
Кроме того, из-за суровых условий эксплуатации и ограниченности промышленных методов эксплуатации в этих отраслях отчаянно не хватает экономически эффективных мер по предотвращению коррозии. Поскольку этот вид коррозии может в конечном итоге угрожать общественной безопасности, ученый-коррозионист обязан принять вызов, чтобы улучшить понимание коррозии в экстремальных условиях и разработать более эффективные методы предотвращения.
(5) Понимание, мониторинг и моделирование коррозии in vivo : человеческое тело представляет собой сложную самоподдерживающуюся коррозионную систему. Коррозия in vivo представляет собой процесс биодеградации, происходящий в очень хорошо контролируемой окружающей среде. Измерения коррозии на месте или мониторинг в режиме реального времени без нарушения физиологических реакций внутри человеческого тела затруднены. Сложное влияние физиологических реакций и компонентов жидкости организма на коррозию является еще одним препятствием для понимания in vivo механизм коррозии. Также маловероятно точное моделирование реальной среды in vivo путем имитации жидкости организма и физиологических реакций в лаборатории. Таким образом, исследование механизма биоразложения и процесса коррозии in vivo в лаборатории останется сложной задачей в исследованиях коррозии.
Также маловероятно точное моделирование реальной среды in vivo путем имитации жидкости организма и физиологических реакций в лаборатории. Таким образом, исследование механизма биоразложения и процесса коррозии in vivo в лаборатории останется сложной задачей в исследованиях коррозии.
(6) Прогнозирование коррозии в реальных условиях: в естественной среде условия спонтанной коррозии не контролируются. Более того, существует множество изменений факторов окружающей среды, которые могут влиять на коррозию, что в значительной степени усложняет коррозионный процесс. Хуже того, неизбежная жизненная деятельность в реальном мире также может влиять на процесс коррозии, что делает поведение коррозии почти непредсказуемым. Например, микробио/бактерии, колонизирующие канализационные системы, образование биопленки на морской инфраструктуре, загрязнение воздуха автомобильными выхлопами и загрязнение почвы/подземных вод бытовыми отходами могут неожиданно ускорить коррозию открытых объектов. . Непредвиденная коррозия инфраструктуры под землей, в бетоне или в воде при определенных обстоятельствах может привести к катастрофе. Чтобы снизить риск, прогнозирование коррозионных характеристик в естественных условиях считается большой проблемой в исследованиях коррозии. В этом аспекте создание долгосрочной базы данных о коррозии является важной задачей, а компьютерное моделирование может стать подходом, который может привести к прорыву в прогнозировании коррозии.
. Непредвиденная коррозия инфраструктуры под землей, в бетоне или в воде при определенных обстоятельствах может привести к катастрофе. Чтобы снизить риск, прогнозирование коррозионных характеристик в естественных условиях считается большой проблемой в исследованиях коррозии. В этом аспекте создание долгосрочной базы данных о коррозии является важной задачей, а компьютерное моделирование может стать подходом, который может привести к прорыву в прогнозировании коррозии.
(7) Механизм перехода состояния поверхности: начало пассивации, возникновение питтинга и разрушение поверхностной пленки являются примерами перехода состояния поверхности. Таких поверхностных изменений на практике гораздо больше. Переход от исходной поверхности к новому стационарному состоянию является переходным процессом. Новое состояние обычно зависит от начальных условий поверхности, которые в конечном итоге могут повлиять на общее коррозионное повреждение. Например, разрыв первоначально сформированной пленки может в значительной степени повлиять на характер роста пленки на более поздней стадии; распределение точечной коррозии на поверхности металла на ранней стадии будет влиять на конечную морфологию коррозии; исходная чистота поверхности стали иногда может определять пассивность стали. Очень интересно узнать, как, когда и где внезапно начинается переход. Предсказать появление перехода на металлической поверхности сложно, но это сложная цель, которую необходимо решить при исследовании коррозии.
Очень интересно узнать, как, когда и где внезапно начинается переход. Предсказать появление перехода на металлической поверхности сложно, но это сложная цель, которую необходимо решить при исследовании коррозии.
(8) Разработка антикоррозионных функциональных покрытий: покрытия могут полностью изменить свойства поверхности металла, что открывает множество новых областей применения металлов. Улучшенная коррозионная стойкость или защитная способность традиционно являются важным требованием для разработки покрытий в технике предотвращения коррозии. Вообще говоря, коррозионная стойкость покрытия зависит от стабильности материала покрытия, целостности и толщины слоя покрытия и адгезии покрытия к металлам. Это также зависит от того, как покрытие реагирует на температуру, нагрузку и истирание в процессе эксплуатации. Антикоррозионное покрытие обычно представляет собой компромисс многих требований. Если новое покрытие может быть электро- или теплоизолирующим или проводящим, противоскользящим или самовыделяющим смазку, супергидрофобным или гидрофильным, избирательно адсорбирующим и поглощающим определенные виды и т. д., оно найдет гораздо более широкое применение. себя, а также значительно расширить применение металлических компонентов/деталей в промышленности. Однако у такого покрытия будет слишком много противоречивых требований, чтобы идти на компромисс. Его изобретение и разработка не только сложны, но и интересны.
д., оно найдет гораздо более широкое применение. себя, а также значительно расширить применение металлических компонентов/деталей в промышленности. Однако у такого покрытия будет слишком много противоречивых требований, чтобы идти на компромисс. Его изобретение и разработка не только сложны, но и интересны.
Таким образом, коррозия как процесс разрушения материала, вызванный реакцией материала с окружающей его средой, интенсивно и всесторонне исследовалась. Много достижений было сделано в отношении состава сплава и влияния микроструктуры, влияния факторов окружающей среды, механизма коррозии и методов защиты. Однако детальный механизм коррозии in situ под влиянием множества различных факторов не был всесторонне раскрыт из-за отсутствия 9 высокого разрешения.0164 in situ методы. В настоящее время самая большая трудность в исследованиях коррозии состоит в том, чтобы получить глубокое понимание процесса разложения in situ на коррозионной поверхности, скрытой коррозионной средой. Вокруг этого есть по крайней мере восемь больших проблем на передовых рубежах исследований коррозии. Оспаривание этих актуальных тем может привести к прорыву в области науки о коррозии.
Вокруг этого есть по крайней мере восемь больших проблем на передовых рубежах исследований коррозии. Оспаривание этих актуальных тем может привести к прорыву в области науки о коррозии.
Бекманн В., Швенк В. и Принц В. (1997). Справочник по катодной защите от коррозии , 3-е изд. Хьюстон, Техас: Издательство Gulf Professional.
Бистек, Т., и Вебер, Дж. (1976). Электролитические и химические конверсионные покрытия . Редхилл: Portcullis Press Limited.
Брафорд, С.А. (1993). Защита от коррозии . Лондон: Ван Рейнхольд.
Крамер, С. Д., и Ковино, Б. С. младший (редакторы) (2006). Справочник по ASM, том 13C: Коррозия: окружающая среда и промышленность . Парк материалов, Огайо: ASTM International.
Каеше, Х. (2003). Коррозия металлов, физико-химические основы и современные проблемы . Берлин: Спрингер.
Мансфельд Ф. и Берточчи У. (ред.) (2005 г.). Коррозионные испытания и стандарты , 2-е изд. Западный Коншохокен, Пенсильвания: ASTM International.
