Электрохимическая защита: Электрохимическая защита
Содержание
Электрохимическая защита технологических трубопроводов
При укладке в траншею изолированного трубопровода и его последующей засыпке изоляционное покрытие может быть повреждено, а в процессе эксплуатации трубопровода оно постепенно стареет (теряет свои диэлектрические свойства, водоустойчивость, адгезию). Поэтому при всех способах прокладки, кроме надземной, трубопроводы подлежат комплексной защите от коррозии защитными покрытиями и средствами электрохимической защиты (ЭХЗ) независимо от коррозионной активности грунта.
К средствам ЭХЗ относятся катодная, протекторная и электродренажная защиты.
Защита от почвенной коррозии осуществляется катодной поляризацией трубопроводов. Если катодная поляризация производится с помощью внешнего источника постоянного тока, то такая защита называется катодной, если же поляризация осуществляется присоединением защищаемого трубопровода к металлу, имеющему более отрицательный потенциал, то такая защита называется протекторной.
Катодная защита
Принципиальная схема катодной защиты показана на рисунке.
Источником постоянного тока является станция катодной защиты 3, где с помощью выпрямителей переменный ток от вдольтрассовой ЛЭП 1, поступающий через трансформаторный пункт 2, преобразуется в постоянный.
Отрицательным полюсом источник с помощью соединительного провода 4 подключен к защищаемому трубопроводу 6, а положительным — к анодному заземлению 5. При включении источника тока электрическая цепь замыкается через почвенный электролит.
Принципиальная схема катодной защиты
1 — ЛЭП; 2 — трансформаторный пункт; 3 — станция катодной защиты; 4 — соединительный провод; 5 — анодное заземление; 6 — трубопровод
Принцип действия катодной защиты следующий. Под воздействием приложенного электрического поля источника начинается движение полусвободных валентных электронов в направлении «анодное заземление — источник тока— защищаемое сооружение». Теряя электроны, атомы металла анодного заземления переходят в виде ион-атомов в раствор электролита, т.е. анодное заземление разрушается. Ион-атомы подвергаются гидратации и отводятся в глубь раствора. У защищаемого же сооружения вследствие работы источника постоянного тока наблюдается избыток свободных электронов, т.е. создаются условия для протекания реакций кислородной и водородной деполяризации, характерных для катода.
Ион-атомы подвергаются гидратации и отводятся в глубь раствора. У защищаемого же сооружения вследствие работы источника постоянного тока наблюдается избыток свободных электронов, т.е. создаются условия для протекания реакций кислородной и водородной деполяризации, характерных для катода.
Подземные коммуникации нефтебаз защищают катодными установками с различными типами анодных заземлений. Необходимая сила защитного тока катодной установки определяется по формуле
Jдр=j3·F3·K0
где j3 — необходимая величина защитной плотности тока; F3 — суммарная поверхность контакта подземных сооружений с грунтом; К0 — коэффициент оголенности коммуникаций, величина которого определяется в зависимости от переходного сопротивления изоляционного покрытия Rnep и удельного электросопротивления грунта рг по графику, приведенному на рисунке ниже.
Необходимая величина защитной плотности тока выбирается в зависимости от характеристики грунтов площадки нефтебазы в соответствии с таблицей ниже.
Протекторная защита
Принцип действия протекторной защиты аналогичен работе гальванического элемента.
Два электрода: трубопровод 1 и протектор 2, изготовленный из более электроотрицательного металла, чем сталь, опущены в почвенный электролит и соединены проводом 3. Так как материал протектора является более электроотрицательным, то под действием разности потенциалов происходит направленное движение электронов от протектора к трубопроводу по проводнику 3. Одновременно ион-атомы материала протектора переходят в раствор, что приводит к его разрушению. Сила тока при этом контролируется с помощью контрольно-измерительной колонки 4.
Зависимость коэффициентов оголенности подземных трубопроводов от переходного сопротивления изоляционного покрытия для грунтов удельным сопротивлением, Ом-м
1 — 100; 2 — 50; 3 — 30; 4 — 10; 5 — 5
Зависимость защитной плотности тока от характеристики грунтов
Тип грунта | рп Омм | А, А/м2 |
Влажный глинистый грунт: | ||
— pH >8 | 15 | 0,033 |
pH = 6-8 | 15 | 0,160 |
— с примесью песка | 15 | 0,187 |
Влажный торф (pH <8) | 15 | 0,160 |
Увлажненный песок | 50 | 0,170 |
Сухой глинистый грунт | 100 | 0,008 |
Принципиальная схема протекторной защиты
1 — трубопровод; 2 — протектор; 3 — соединительный провод; 4 — контрольно-измерительная колонка
Таким образом, разрушение металла все равно имеет место. Но не трубопровода, а протектора.
Но не трубопровода, а протектора.
Теоретически для защиты стальных сооружений от коррозии могут быть использованы все металлы, расположенные в электрохимическом ряду напряжений левее железа, так как они более электроотрицательны. Практически же протекторы изготавливаются только из материалов, удовлетворяющих следующим требованиям:
- разность потенциалов материала протектора и железа (стали) должна быть как можно больше;
- ток, получаемый при электрохимическом растворении единицы массы протектора (токоотдача), должен быть максимальным;
- отношение массы протектора, израсходованной на создание защитного тока, к общей потере массы протектора (коэффициент использования) должно быть наибольшим.
Данным требованиям в наибольшей степени удовлетворяют сплавы на основе магния, цинка и алюминия.
Протекторную защиту осуществляют сосредоточенными и протяженными протекторами. В первом случае удельное электросопротивление грунта должно быть не более 50 Ом-м, во втором — не более 500 Ом·м.
Электродренажная защита трубопроводов
Метод защиты трубопроводов от разрушения блуждающими токами, предусматривающий их отвод (дренаж) с защищаемого сооружения на сооружение — источник блуждающих токов либо специальное заземление, называется электродренажной защитой.
Применяют прямой, поляризованный и усиленный дренажи.
Принципиальные схемы электродренажной защиты
а — прямой дренаж; б —поляризованный дренаж; в — усиленный дренаж
Прямой электрический дренаж — это дренажное устройство двусторонней проводимости. Схема прямого электрического дренажа включает: реостат К, рубильник К, плавкий предохранитель Пр и сигнальное реле С. Сила тока в цепи «трубопровод — рельс* регулируется реостатом. Если величина тока превысит допустимую величину, то плавкий предохранитель сгорит, ток потечет по обмотке реле, при включении которого включается звуковой или световой сигнал.
Прямой электрический дренаж применяется в тех случаях, когда потенциал трубопровода постоянно выше потенциала рельсовой сети, куда отводятся блуждающие токи. В противном случае дренаж превратится в канал для натекания блуждающих токов на трубопровод.
В противном случае дренаж превратится в канал для натекания блуждающих токов на трубопровод.
Поляризованный электрический дренаж — это дренажное устройство, обладающее односторонней проводимостью. От прямого дренажа поляризованный отличается наличием элемента односторонней проводимости (вентильный элемент) ВЭ. При поляризованном дренаже ток протекает только от трубопровода к рельсу, что исключает натекание блуждающих токов на трубопровод по дренажному проводу.
Усиленный дренаж применяется в тех случаях, когда нужно не только отводить блуждающие токи с трубопровода, но и обеспечить на нем необходимую величину защитного потенциала. Усиленный дренаж представляет собой обычную катодную станцию, подключенную отрицательным полюсом к защищаемому сооружению, а положительным — не к анодному заземлению, а к рельсам электрифицированного транспорта.
За счет такой схемы подключения обеспечивается: вопервых, поляризованный дренаж (за счет работы вентильных элементов в схеме СКЗ), а во-вторых, катодная станция удерживает необходимый защитный потенциал трубопровода.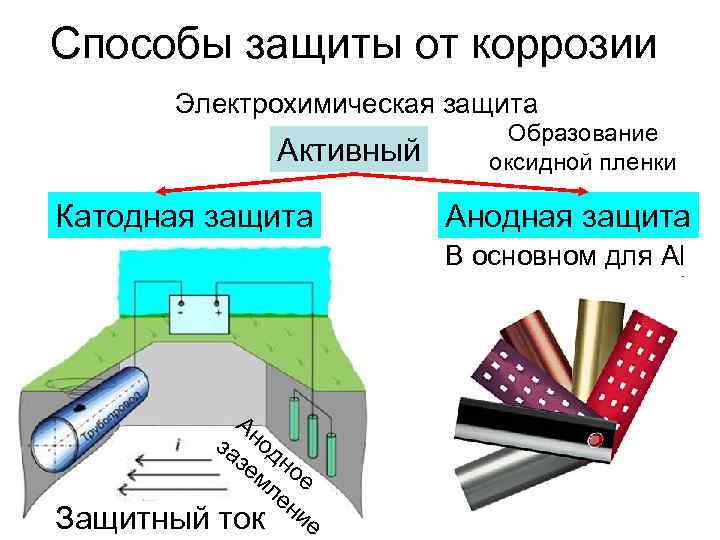
После ввода трубопровода в эксплуатацию производится регулировка параметров работы системы их защиты от коррозии. При необходимости с учетом фактического положения дел могут вводиться в эксплуатацию дополнительные станции катодной и дренажной защиты, а также протекторные установки.
Электрохимическая защита — принцип действия
- Вы здесь:
- Защитные краски
- Статьи и новости
- Статьи
Электрохимическая защита
Принцип действия электрохимической защиты заключается в катодной поляризации металлической конструкции до уровня «защитного» потенциала, под которым понимается потенциал наиболее анодных участков. При этом на защищаемой поверхности будут протекать только катодные процессы. Механизм электрохимической зашиты может быть упрощенно представлен следующим образом.
При этом на защищаемой поверхности будут протекать только катодные процессы. Механизм электрохимической зашиты может быть упрощенно представлен следующим образом.
Металл, погруженный в электролит, представляет собой многоэлектронную систему, состоящую из множества пространственно разделенных и электрически замкнутых между собой анодных и катодных участков (рис. 1.1,а). Это объясняется тем, что металл имеет электрохимически гетерогенную структуру, обусловленную химической природой металла, состоянием его поверхности, различными внешними воздействиями. Схематически эту поверхность можно представить (рис.1.1,б) в виде одного общего анода и одного общего катода, соединенных электрически. Коррозия происходит вследствие ионизации металла на анодном участке.
Если к погруженному в электролит металлу присоединить другой металл с более отрицательным потенциалом, чем потенциал анодной реакции, то вследствие катодной поляризации потенциалы анодных и катодных участков защищаемого металла выравниваются и металл становится общим катодом. В этой новой гальванической паре растворяется присоединенный металл с низким электродным потенциалом, т.е. новый анод, при этом исключаются условия для перехода ионов защищаемого металла в раствор и коррозионный процесс прекращается (рис.1.1,в). Эта принципиальная схема катодной зашиты с расходуемыми анодами. По такой схеме работают и составы для холодного цинкования.
В этой новой гальванической паре растворяется присоединенный металл с низким электродным потенциалом, т.е. новый анод, при этом исключаются условия для перехода ионов защищаемого металла в раствор и коррозионный процесс прекращается (рис.1.1,в). Эта принципиальная схема катодной зашиты с расходуемыми анодами. По такой схеме работают и составы для холодного цинкования.
Электрический ток, необходимый для защиты, может быть получен не только от работы гальванической пары, но и от внешнего источника тока. Защищаемая металлоконструкция присоединяется в этом случае к отрицательному полюсу источника постоянного тока, а к положительному полюсу присоединяется анод, изготовленный, как правило, из малорас творимого материала (рис.1.1,г). Такая защита называется катодной защитой наложенным током.
При использовании электрохимической катодной защиты двух указанных видов (с расходуемыми анодами и наложенным током) достигается эффективная защита, как от общей коррозии, так и специфических видов коррозионных разрушений (коррозионное растрескивание, контактная, питтинговая, межкристаллитная, селективная и др. ).
).
Критерием электрохимической защиты является потенциал металла или величина смещения потенциала от его стационарного значения. Эти величины позволяют судить о скорости коррозии и степени защиты. Существуют минимальные и максимальные критерии защиты. Под минимальными понимают минимально допустимые значения потенциала или смещения потенциала, при которых коррозия прекращается или уменьшается до допустимых пределов. Максимальные критерии защиты вводятся для того, чтобы избежать водородного охрупчивания высокопрочных металлов, перезащиты алюминиевых сплавов, разрушения лакокрасочных покрытий при выделении газообразного водорода и других, негативных последствий.
На рис.1.1 и 1.2 показаны зависимости скорости коррозии в морской воде углеродистой стали и алюминиевого сплава от величины потенциала. На рис. 1.2 видно резкое усиление коррозии алюминиевого сплава вследствие разрушения оксидной пленки при повышении рН вследствие катодной поляризации. Оптимальная величина защитного смещения потенциала в морской воде составляет для корпусных углеродистых сталей 150-200 мВ, для алюминиевых сплавов 200-400 мВ зависимости от химического состава сплава.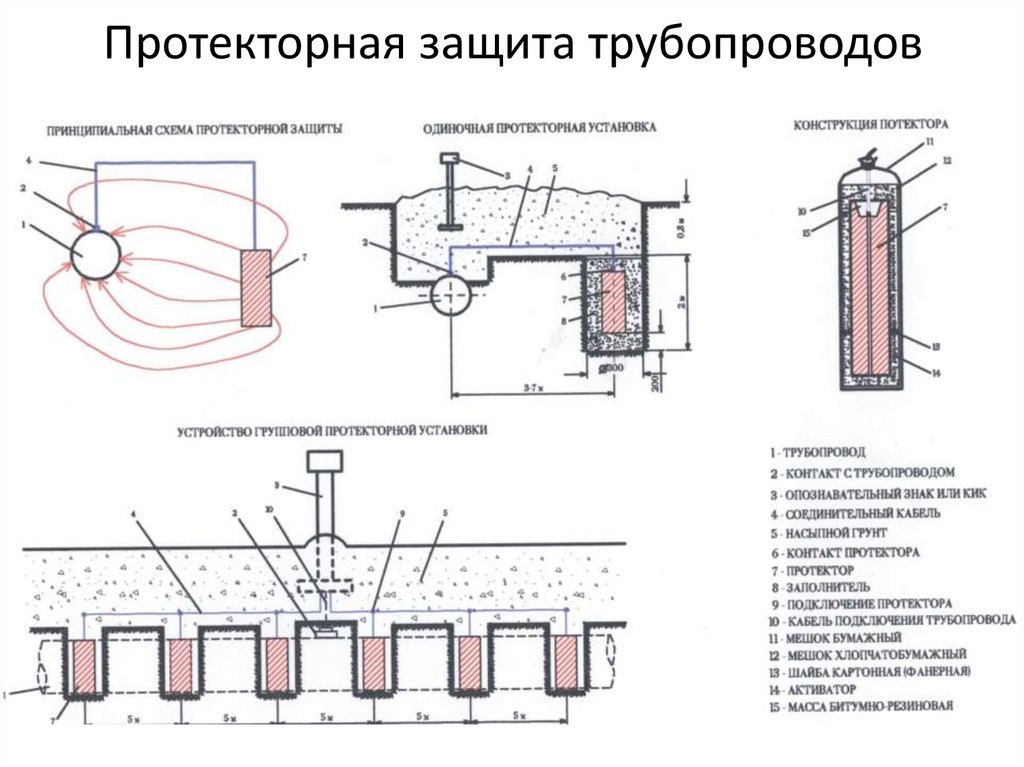
Морская катодная защита 101: что это такое и как это работает
Ричард Бакстер и Джим Бриттон
Как сталь подвергается коррозии в воде?
Чтобы понять катодную защиту, вы должны сначала понять, как возникает коррозия. Для возникновения коррозии должны присутствовать три вещи:
1. Два разнородных металла
2. Электролит (вода с любым типом соли или растворенных в ней солей)
3. Металлическая (проводящая) дорожка между разнородными металлами
Два разнородных металла могут быть совершенно разными сплавами, такими как сталь и алюминий, но, скорее всего, это микроскопические или макроскопические металлургические различия на поверхности одного куска стали. В этом случае будем рассматривать свободнокорродирующую сталь, которая неоднородна.
При соблюдении вышеуказанных условий в более активных центрах происходит следующая реакция: (два иона железа плюс четыре свободных электрона).
2Fe => 2Fe ++ + 4е —
Свободные электроны проходят через металл к менее активным местам, где происходит следующая реакция: (газообразный кислород превращается в ион кислорода — путем соединения с четырьмя свободными электронами — который соединяется с водой с образованием гидроксильных ионов).
O 2 + 4e — + 2H 2 0 => 4 OH —
Рекомбинация этих ионов на активной поверхности приводит к следующей реакции, которая дает продукт коррозии железа: гидроксид железа железо соединяется с кислородом и водой с образованием гидроксида железа).
2Fe + O 2 + 2H 2 O => 2Fe (OH) 2
Эта реакция чаще описывается как «ток тока через воду от анода (более активного участка) к катоду ( менее активный сайт).
Как катодная защита останавливает коррозию?
Катодная защита предотвращает коррозию путем преобразования всех анодных (активных) участков на поверхности металла в катодные (пассивные) участки за счет подачи электрического тока (или свободных электронов) из альтернативного источника.
Обычно это гальванические аноды, которые более активны, чем сталь. Эту практику также называют жертвенной системой, поскольку гальванические аноды жертвуют собой, чтобы защитить конструкционную сталь или трубопровод от коррозии.
В случае алюминиевых анодов реакция на поверхности алюминия: (четыре иона алюминия плюс двенадцать свободных электронов)
4Al => 4AL +++ + 12 e —
и на поверхности стали : (газообразный кислород превращается в ионы кислорода, которые соединяются с водой с образованием ионов гидроксила).
3O 2 + 12e — + 6H 2 0 => 12OH —
Пока ток (свободные электроны) поступает к катоду (стали) быстрее, чем поступает кислород, коррозия не происходит. происходить.
Рисунок 1: Система расходуемых анодов в морской воде
Основные соображения при проектировании систем расходуемых анодов
Электрический ток, который проходит через анод, регулируется законом Ома, а именно:
I=E/R
I= Ток в амперах
E= Разность потенциалов между анодом и катодом в вольтах
R= Общее сопротивление цепи в Омах но по мере уменьшения разности потенциалов из-за влияния тока, протекающего на катод, ток постепенно уменьшается из-за поляризации катода.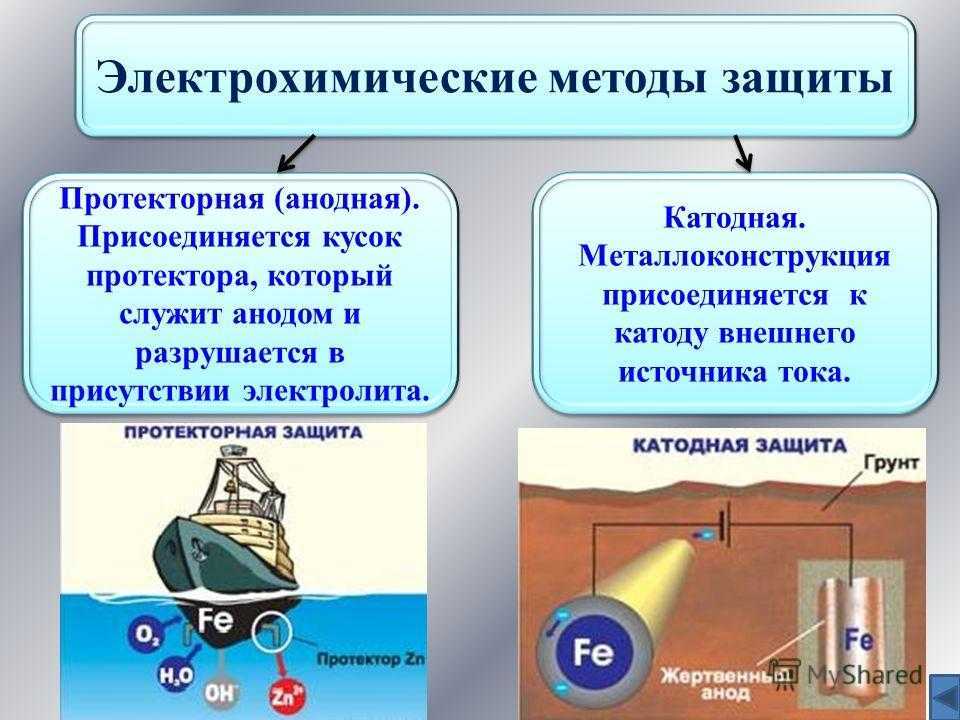 Сопротивление цепи включает в себя как водную дорожку, так и металлическую дорожку, которая включает в себя любой кабель в цепи. Доминирующей величиной здесь является сопротивление анода морской воде.
Сопротивление цепи включает в себя как водную дорожку, так и металлическую дорожку, которая включает в себя любой кабель в цепи. Доминирующей величиной здесь является сопротивление анода морской воде.
Для большинства применений сопротивление металла настолько мало по сравнению с сопротивлением воде, что им можно пренебречь (хотя это неверно для салазок или длинных трубопроводов, защищенных с обоих концов). Как правило, длинные тонкие аноды имеют меньшее сопротивление, чем короткие толстые аноды. Они будут разряжать больше тока, но не так долго.
Таким образом, разработчик катодной защиты должен выбрать размер анодов таким образом, чтобы они имели правильную форму и площадь поверхности для отвода тока, достаточного для защиты конструкции, и достаточный вес, чтобы продержаться желаемый срок службы при отводе этого тока.
Общее практическое правило:
Длина анода определяет, какой ток может производить анод и, следовательно, сколько квадратных футов стали можно защитить.
 Поперечное сечение (вес) определяет, как долго анод может поддерживать этот уровень защиты.
Поперечное сечение (вес) определяет, как долго анод может поддерживать этот уровень защиты.
Системы катодной защиты с импульсным током (анодные системы ICCP)
Из-за больших токов, характерных для многих систем морской воды, нередко используются системы с импульсным током, в которых используются аноды типа (аноды ICCP), которые нелегко растворяются в ионы металлов. Это вызывает альтернативную реакцию: окисление растворенных ионов хлора.
2Cl — => Cl 2 + 2e —
Питание подается от внешнего блока питания постоянного тока.
Рис. 2: Система катодной защиты с импульсным током в морской воде
Как узнать, достаточно ли у нас катодной защиты?
Мы можем убедиться, что ток достаточен, измерив потенциал стали относительно стандартного электрода сравнения, обычно серебра/хлорида серебра (Ag/AgCl sw.), но иногда цинка (sw.).
Подача электрического тока на любой металл смещает его нормальный потенциал в отрицательном направлении. История показала, что если сталь получает ток, достаточный для смещения потенциала до (-) 0,800 В по сравнению с серебром/хлоридом серебра (Ag/AgCl), коррозия практически прекращается.
История показала, что если сталь получает ток, достаточный для смещения потенциала до (-) 0,800 В по сравнению с серебром/хлоридом серебра (Ag/AgCl), коррозия практически прекращается.
Из-за характера образующихся пленок минимальный (-0,800 В) потенциал редко бывает оптимальным, поэтому разработчики стараются достичь потенциала между (-) 0,950 В и (-) 1,000 В по сравнению с Ag/AgCl sw.
Рис. 3. Защищенные и незащищенные конструкции, подтвержденные потенциалом катодной защиты
Обзор принципов защиты от коррозии и катодной защиты с электрохимической точки зрения | Journal of Petroleum Technology
Skip Nav Destination
01 сентября 1962 г.
Гленн А. Марш
J Pet Technol 14 (09): 967–972.
Номер бумаги:
SPE-390-PA
https://doi.org/10.2118/390-PA
История статьи
Опубликовано в Интернете:
01 сентября 1962 г.
Получено:
01 сентября 1962 г.
Принято:
01 сентября 1962 г.
- Разделенный экран
PDF
Цитировать
- Посмотреть эту цитату
- Добавить в менеджер цитирования
Делиться
- Твиттер
- MailTo
Получить разрешения
Поиск по сайту
Цитирование
Марш, Гленн А.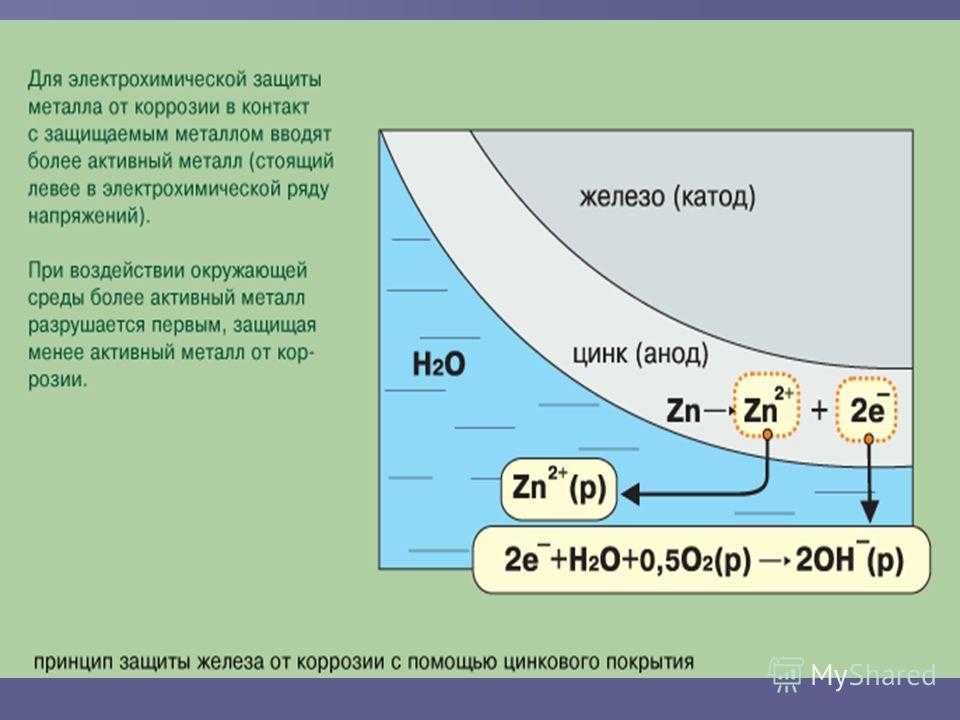 . «Обзор принципов защиты от коррозии и катодной защиты с электрохимической точки зрения». J Pet Technol 14 (1962): 967–972. doi: https://doi.org/10.2118/390-PA
. «Обзор принципов защиты от коррозии и катодной защиты с электрохимической точки зрения». J Pet Technol 14 (1962): 967–972. doi: https://doi.org/10.2118/390-PA
Скачать файл цитаты:
- Ris (Zotero)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- Конечная примечание
- РефВоркс
- Бибтекс
панель инструментов поиска
Расширенный поиск
Реферат
Коррозия стали в водной среде протекает по электрохимическому процессу, обычно контролируемому скоростью катодной реакции. В диапазоне рН от 5,0 до 9.0, катодная реакция обычно представляет собой восстановление растворенного кислорода. Электроны, расходуемые в катодной реакции, поставляются анодной реакцией. Электронный ток, протекающий от анодных к катодным областям, «ток коррозии», можно рассчитать по скорости коррозии.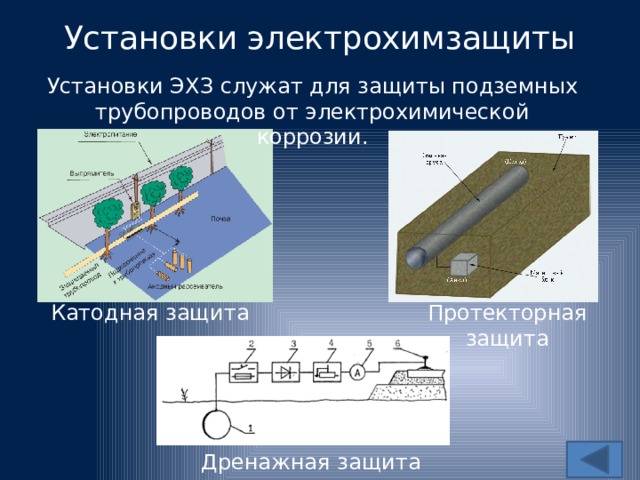 При катодной защите необходимо подавать достаточный ток, чтобы «удовлетворить» катодную реакцию. Эта величина тока обычно примерно на 20 % превышает ток коррозии. Анодная и катодная области могут быть микроскопическими по размеру и практически накладываться друг на друга, или они могут быть физически разделены расстояниями до многих футов. Катодная защита применима к обоим наборам условий при условии непрерывного электролита и благоприятной геометрии. Для максимальной эффективности ток катодной защиты должен быть направлен на катодные участки системы, а не на анодные или корродирующие участки, как можно было бы ожидать. Перед применением катодной защиты следует найти способ минимизировать или подавить катодную реакцию, например, путем удаления растворенного кислорода. Катодная защита обычно достигается, когда потенциал конструкции снижается до –0,85 В относительно электрода сравнения Cu-Cu SO4. Могут быть случаи, когда катодная реакция обеспечивается бактериальной активностью, и в этом случае для достижения защиты может потребоваться снижение потенциала структуры/воды более чем на -0,85 В.
При катодной защите необходимо подавать достаточный ток, чтобы «удовлетворить» катодную реакцию. Эта величина тока обычно примерно на 20 % превышает ток коррозии. Анодная и катодная области могут быть микроскопическими по размеру и практически накладываться друг на друга, или они могут быть физически разделены расстояниями до многих футов. Катодная защита применима к обоим наборам условий при условии непрерывного электролита и благоприятной геометрии. Для максимальной эффективности ток катодной защиты должен быть направлен на катодные участки системы, а не на анодные или корродирующие участки, как можно было бы ожидать. Перед применением катодной защиты следует найти способ минимизировать или подавить катодную реакцию, например, путем удаления растворенного кислорода. Катодная защита обычно достигается, когда потенциал конструкции снижается до –0,85 В относительно электрода сравнения Cu-Cu SO4. Могут быть случаи, когда катодная реакция обеспечивается бактериальной активностью, и в этом случае для достижения защиты может потребоваться снижение потенциала структуры/воды более чем на -0,85 В. Потенциал, необходимый для защиты, представляет собой потенциал холостого хода анодных областей. В стабильной системе можно использовать коррозионные зонды, чтобы определить, достигнута ли катодная защита. Там, где это возможно, обычно следует использовать систему с подаваемым током, потому что такая система более гибкая, чем система с расходуемым анодом.
Потенциал, необходимый для защиты, представляет собой потенциал холостого хода анодных областей. В стабильной системе можно использовать коррозионные зонды, чтобы определить, достигнута ли катодная защита. Там, где это возможно, обычно следует использовать систему с подаваемым током, потому что такая система более гибкая, чем система с расходуемым анодом.
Введение
Как внешняя, так и внутренняя коррозия часто поражают системы вторичной регенерации воды. Внешне проблема заключается в коррозии подземной трубы; как только происходят утечки, почва, вероятно, загрязняется рассолом, что, в свою очередь, делает проблему коррозии еще более серьезной. Внутренней проблемой является коррозия нагревателей водоподготовительного оборудования, фильтров и т. д., а также коррозия внутри самих водораспределительных линий. Фактическая потеря металла может быть не такой серьезной, как закупорка, возникающая в результате накопления продуктов коррозии. Катодная защита имеет место в борьбе с внешней и внутренней коррозией в системах впрыска воды. С одной стороны, применения катодной защиты от внешней коррозии многочисленны. Процедуры хорошо известны, поэтому здесь они подробно обсуждаться не будут. Однако многое из того, что будет сказано, в принципе относится к катодной защите от внешней коррозии. С другой стороны, применение катодной защиты от внутренней коррозии менее очевидно и не так хорошо разработано. Целью данной статьи является обсуждение теории или принципов катодной защиты, поскольку они могут применяться внутри системы нагнетания воды. Для достижения этой цели будет рассмотрена природа водной коррозии и обсуждена взаимосвязь между коррозией и катодной защитой. Ключевая роль катодной реакции в коррозионном процессе будет подчеркнута потому, что в каком-то смысле изучение водной коррозии и катодной защиты — это изучение того, что происходит в катодной части коррозионных ячеек. Электрохимическая точка зрения будет использоваться повсюду. Слишком часто даже в технической литературе катодная защита обсуждается на языке инженера-электрика.
С одной стороны, применения катодной защиты от внешней коррозии многочисленны. Процедуры хорошо известны, поэтому здесь они подробно обсуждаться не будут. Однако многое из того, что будет сказано, в принципе относится к катодной защите от внешней коррозии. С другой стороны, применение катодной защиты от внутренней коррозии менее очевидно и не так хорошо разработано. Целью данной статьи является обсуждение теории или принципов катодной защиты, поскольку они могут применяться внутри системы нагнетания воды. Для достижения этой цели будет рассмотрена природа водной коррозии и обсуждена взаимосвязь между коррозией и катодной защитой. Ключевая роль катодной реакции в коррозионном процессе будет подчеркнута потому, что в каком-то смысле изучение водной коррозии и катодной защиты — это изучение того, что происходит в катодной части коррозионных ячеек. Электрохимическая точка зрения будет использоваться повсюду. Слишком часто даже в технической литературе катодная защита обсуждается на языке инженера-электрика.
