Физ свойства меди: Физические свойства меди
Содержание
Медь. Описание, свойства, происхождение и применение металла
Самородная медь размером около 4 см
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
- Структура
- Свойства
- Запасы и добыча
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
СТРУКТУРА
Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура – кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками “медной зелени” (малахит), “медной сини” (азурит), фосфатов меди и других продуктов её вторичного изменения.
Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками “медной зелени” (малахит), “медной сини” (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА
Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
ЗАПАСЫ И ДОБЫЧА
Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
ПРОИСХОЖДЕНИЕ
Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).
Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).
Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.
Наиболее известные месторождения самородной меди – Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
ПРИМЕНЕНИЕ
Браслеты из меди
Из-за низкого удельного сопротивления, медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.
Другое полезное качество меди — высокая теплопроводность.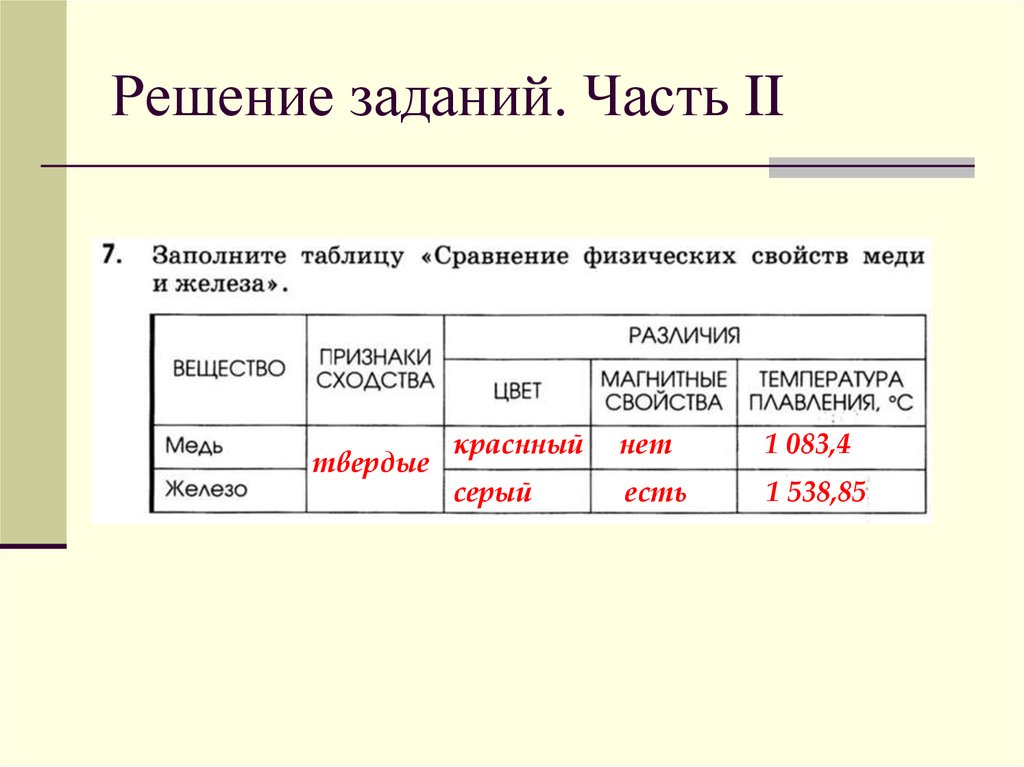 Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы.
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Медь (англ. Copper) – Cu
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.1
ФИЗИЧЕСКИЕ СВОЙСТВА
ОПТИЧЕСКИЕ СВОЙСТВА
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
Интересные статьи:
Физико-химические свойства меди обеспечивают ей широкое применение во всех отраслях промышленности.
Медь широко использовалась человеком с древних времен. Данный металл залегает в недрах земной коры в виде крупных самородков и часто применяется в чистом виде. Благодаря физико-химическим свойствам меди и простоте в обработке, она нашла применение во многих отраслях промышленности как сырье для производства готовых изделий, так и в качестве компонента, входящего в состав многих сплавов.
Физические свойства меди
Физические свойства меди приведены в таблице:
| № поз. | Наименование физического свойства | Значение физического свойства |
|---|---|---|
| 1 | Агрегатное состояние элемента | Твердый, при плавлении – жидкий |
| 2 | Оттенок | Желто-красный, красноватый, в зависимости от вида руды |
| 3 | Показатель пластичности, влияющий на ковку металла | Повышенная пластичность, ковка производится без изменения прочностных свойств |
| 4 | Значение твердости вещества | До 2,5 по шкале Мооса |
| 5 | Наличие металлического блеска | Да |
| 6 | t плавления, оС | От 1050 до 1150 |
| 7 | t кипения, оС | От 2500 до 2600 |
| 8 | Удельный вес элемента, кг/м3 | 8890 |
| 9 | Показатель теплопроводности, Вт/(м*оС) | 390 |
| 10 | Показатель удельного электросопротивления, Ом*мм2/м, при температуре 20 оС | 0,0172, металл обладает повышенной электропроводимостью, сопротивление материала минимальное |
| 11 | Наличие запаха | Нет |
| 12 | Растворимость в водной среде | Нет |
| 13 | Магнитные свойства | Отсутствуют |
| 14 | Металлический звон | Ярков выраженный |
| 15 | Температурное расширение материала | 0,00000017 |
| 16 | Предел прочности на растяжение, кгс/мм2 | 22 |
| 17 | Модуль упругости, МПа | 0,7 – 2 * 105 |
Из таблицы видно, что физико-химические свойства меди позволяют применять металл при изготовлении сердечников кабелей для нужд электротехнической промышленности. Отсутствие магнитных свойств обеспечивает широкое применение для производства деталей высокоточных приборов.
Отсутствие магнитных свойств обеспечивает широкое применение для производства деталей высокоточных приборов.
Химические свойства меди
Медь расположена на 29 позиции в таблице Менделеева с маркировкой Cu, принадлежит к 4-му периоду. Относится к той же группе, что и благородные металлы. Элемент обладает следующими химическими свойствами:
- Не подвержен коррозии в водной среде. При наличии в атмосфере высокой концентрации СО2 окисляется с образованием зеленоватой пленки (патины) по всей поверхности.
- При нагревании до 350-400оС вступает в связь с кислородом, образуя оксид.
- Высокая активность при взаимодействии с галогенами.
- Аморфное состояние при контакте с углеродом и азотом.
- Свойства меди не позволяют обеспечить пайку с алюминием и железом без специального припоя.
- При контакте с концентрированной серной кислотой выделяется соль – сульфат и молекулы очищенной меди.
- При соединении с оксидом углерода, метаном или аммиаком происходит восстановительная реакция.

- Играет роль катализатора при получении чистого Fe при взаимодействии с солями элемента.
Помимо чистой меди, в промышленности применяются такие химические соединения, как соли (металл с кислотным остатком), а также вещества на основе аммиака.
Помимо электротехнической промышленности, медь широко используется при производстве трубок для холодильных установок, по которым движется фреон или другой хладагент. Также из данного металла изготавливаются дорогие кровли, отличающиеся повышенной долговечностью и элементы трубопроводов для обустройства отопления, водоснабжения.
Физические/химические свойства меди | Chemdemos
Используйте эту демонстрацию, чтобы сравнить физические и химические свойства материи. Химические свойства основаны на способности или неспособности вещества производить новые вещества. Пластичность, цвет, блеск, тепло- и электропроводность меди контрастируют с ее способностью реагировать с концентрированной азотной кислотой и нитратом серебра.
Примечания к учебному плану
Эту демонстрацию следует использовать в начале вводного курса химии, когда вводятся и сопоставляются понятия физических и химических свойств. Позвольте около 15 минут для этой демонстрации.
Время выполнения
Для этого проекта требуется один день выполнения.
Обсуждение
- Свойства вещества, которые можно наблюдать, не пытаясь превратить это вещество в другое вещество, являются физическими свойствами. Если исследование свойства связано с попыткой превратить вещество в другое вещество, это свойство является химическим свойством.
- Уравнение реакции азотной кислоты с медью: Cu(s) + 4HNO 3 ==> Cu(NO 3 ) 2 (водн.) + 2NO 2 (г) + 2H 2 O(ж)
- Уравнение реакции меди с раствором нитрата серебра: Cu (тв) + 2AgNO 3 (водн.) ==>2Ag(тв) + Cu(NO 3 ) 2 (водн.)
Материалы зажим для изолированной колбы
Процедура
- Используйте большой кусок медной фольги, чтобы продемонстрировать цвет, блеск и пластичность меди.

- Закрепите медную фольгу в зажиме, включите питание прибора для измерения проводимости и прикоснитесь медью к обоим электродам прибора одновременно. Аппарат должен загореться. Отключите питание аппарата.
- Оберните фольгой зонд термометра нониусного термометра и плотно зажмите его рукой. Дисплей будет регистрировать повышение температуры, поскольку тепло вашего тела проходит через медную фольгу в датчик. Дисплей монитора компьютера можно проецировать в большинстве классных комнат.
- Налейте в чашку Петри раствор нитрата серебра в количестве, достаточном, чтобы покрыть находящийся в нем маленький кусочек меди. Перейдите к части демонстрации с азотной кислотой, чтобы она некоторое время реагировала, а затем вернитесь к этой реакции. Через несколько минут на меди образуются яркие серебряные иглы. Для этой части демонстрации настоятельно рекомендуется проекция.
- Капните несколько капель концентрированной азотной кислоты на небольшой кусочек меди в колбе Флоренции.
 Немедленно замените пробку. Азотная кислота и медь будут реагировать с образованием темно-бордового газообразного диоксида азота. Проекция усиливает эту часть демонстрации.
Немедленно замените пробку. Азотная кислота и медь будут реагировать с образованием темно-бордового газообразного диоксида азота. Проекция усиливает эту часть демонстрации.
Меры предосторожности
- Убедитесь, что медная фольга не касается металлической части зажима, используемого при демонстрации электропроводности. Электроды аппарата проводимости находятся под напряжением 120 В переменного тока. Будьте осторожны, не прикасайтесь к ним при включенном питании.
- Азотная кислота обладает высокой коррозионной активностью. При попадании на кожу немедленно промойте водой с мылом. В случае разлива азотной кислоты закройте азотную кислоту предоставленным карбонатом натрия и при необходимости эвакуируйте помещение.
- Водный раствор нитрата серебра является сильным окислителем. При попадании на кожу немедленно смойте его водой с мылом.
Темы:
Медь
Зона данных | Открытие | Факты | Внешний вид и характеристики | Использование | Изобилие и изотопы | Ссылки
29
Cu
63,55
Химический элемент медь относится к переходным металлам. Оно известно с древних времен. Его первооткрыватель и дата открытия неизвестны.
Оно известно с древних времен. Его первооткрыватель и дата открытия неизвестны.
Зона данных
| Классификация: | Медь является переходным металлом |
| Цвет: | оранжево-красный |
| Атомный вес: | 63.546 |
| Состояние: | твердый |
| Температура плавления: | 1084,62 или С, 1357,77 К |
| Точка кипения: | 2560 или С, 2833 К |
| Электроны: | 29 |
| Протоны: | 29 |
| Нейтроны в наиболее распространенном изотопе: | 34 |
| Электронные оболочки: | 2,8,18,1 |
| Электронная конфигурация: | [Ар] 3d 10 4s 1 |
| Плотность @ 20 или C: | 8,96 г/см 3 |
Соединения, радиусы, проводимости»>Показать больше, в том числе: Теплота, Энергия, Окисление, Реакции,
Соединения, Радиусы, Проводимости
| Атомный объем: | 7,1 см 3 /моль |
| Структура: | fcc: гранецентрированный куб |
| Твердость: | 3,0 месяца |
| Удельная теплоемкость | 0,38 Дж г -1 К -1 |
| Теплота плавления | 13,050 кДж моль -1 |
| Теплота распыления | 338 кДж моль -1 |
| Теплота парообразования | 300,30 кДж моль -1 |
| 1 ст энергия ионизации | 745,4 кДж моль -1 |
| 2 -й энергия ионизации | 1957,9 кДж моль -1 |
| 3 rd энергия ионизации | 3553,5 кДж моль -1 |
| Сродство к электрону | 118,5 кДж моль -1 |
| Минимальная степень окисления | 0 |
Мин. общее окисление нет. общее окисление нет. | 0 |
| Максимальная степень окисления | 4 |
| Макс. общее окисление нет. | 2 |
| Электроотрицательность (шкала Полинга) | 1,95 |
| Объем поляризуемости | 6,7 Å 3 |
| Реакция с воздухом | мягкий, вес/вт ⇒ CuO, Cu 2 O |
| Реакция с 15 М HNO 3 | мягкий, ⇒ Cu(№ 3 ) 2 , № x |
| Реакция с 6 М HCl | нет |
| Реакция с 6 М раствором NaOH | – |
| Оксид(ы) | CuO, Cu 2 O (куприт) |
| Гидрид(ы) | CuH |
| Хлорид(ы) | CuCl, CuCl 2 |
| Атомный радиус | 135 вечера |
| Ионный радиус (1+ ион) | 91 час |
| Ионный радиус (2+ ион) | 87 вечера |
| Ионный радиус (3+ ион) | 68 вечера |
| Ионный радиус (1-ион) | – |
| Ионный радиус (2-ионный) | – |
| Ионный радиус (3-ионный) | – |
| Теплопроводность | 401 Вт·м -1 К -1 |
| Электропроводность | 60,7 x 10 6 S m -1 |
| Температура замерзания/плавления: | 1084,62 или С, 1357,77 К |
Самородок природной самородной меди с вкраплениями медных минералов
Открытие меди
Доктор Дуг Стюарт
химическая реакция его руд.
Хотя можно найти лишь небольшое количество самородной меди, ее было достаточно, чтобы наши предки открыли этот металл и начали его использовать.
Медь используется людьми уже десять тысяч лет. Бусы из самородной меди, датируемые восьмым тысячелетием до нашей эры, были найдены в Турции. (1)
Тигли и шлаки, найденные в Европе, свидетельствуют о том, что выплавка меди (получение металла из ее руд) происходила в пятом тысячелетии до нашей эры.
Добыча и выплавка меди были обычным явлением к 4500 г. до н.э. на Балканах – в Болгарии, Греции, Сербии и Турции. (2), (3)
Медный век находится между неолитом (каменным) и бронзовым веками. Это происходило в разное время в разных культурах, когда люди начали использовать медные орудия наряду с каменными.
За медным веком последовал бронзовый век, когда люди узнали, что при добавлении олова в медь образуется более твердый металл, который к тому же легче отливается. Опять же, это произошло в разное время в разных местах мира.
Слово «медь» происходит от латинского слова «cuprum», означающего «металл Кипра», потому что средиземноморский остров Кипр был древним источником добычи меди.
Символ элемента Cu также происходит от слова «медь».
Соединения меди горят характерным зеленым пламенем. Это хлорид меди (I).
Металлическая медь извлекается из кислого раствора нитрата меди.
Verdigris (коррозия меди) на украшениях крыши.
Внешний вид и характеристики
Вредное воздействие:
Медь необходима всем растениям и животным. Однако избыток меди токсичен.
Приготовление кислой пищи в медных кастрюлях может вызвать отравление. Медная посуда должна быть облицована для предотвращения попадания внутрь ядовитой зелени (соединений, образующихся при коррозии меди).
Характеристики:
Медь — красновато-оранжевый мягкий металл с ярким металлическим блеском.
Он податлив, пластичен и является отличным проводником тепла и электричества — только серебро имеет более высокую электропроводность, чем медь.
Медные поверхности, подвергающиеся воздействию воздуха, постепенно тускнеют и приобретают тусклый коричневатый цвет.
Если присутствуют вода и воздух, медь будет медленно подвергаться коррозии, образуя карбонатную медь, часто встречающуюся на крышах и статуях.
Использование меди
Благодаря своей превосходной электропроводности медь чаще всего используется в электрическом оборудовании, таком как электропроводка и двигатели.
Из-за медленной коррозии медь используется для кровли, водосточных желобов и водосточных желобов на зданиях.
Также используется в сантехнике, посуде и кухонной утвари.
Коммерчески важные сплавы, такие как латунь и бронза, производятся из меди и других металлов.
Оружейные металлы и американские монеты представляют собой медные сплавы.
Сульфат меди используется в качестве фунгицида и альгицида в реках, озерах и прудах.
Оксид меди в растворе Фелинга широко используется в тестах на наличие моносахаридов (простых сахаров).
Изобилие и изотопы
Изобилие в земной коре: 60 частей на миллион по весу, 19 частей на миллион по молям
Изобилие в Солнечной системе: 700 частей на миллиард по весу, 10 частей на миллиард по молям
Стоимость в чистом виде: $9,76 за 100 г
Стоимость, оптом: $0,66 за 100 г
Источник: Медь иногда встречается в самородном виде (т. е. в виде несвязанного металла), а также содержится во многих минералах, таких как оксид; куприт (Cu 2 O), карбонаты; малахит (Cu 2 CO 3 (OH) 2 ) и азурит (Cu 2 (CO 3 ) 2 (OH) 2 ) и сульфиды; халькопирит (CuFeS 2 ) и борнит (Cu 5 FeS 4 ).
Большая часть медной руды добывается или извлекается в виде сульфидов меди. Затем медь получают плавкой и выщелачиванием. Наконец, полученная неочищенная медь очищается электролизом с нанесением покрытия на катоды из чистой меди.
Изотопы: Медь имеет 24 изотопа, периоды полураспада которых известны, с массовыми числами от 57 до 80. Встречающаяся в природе медь представляет собой смесь двух ее стабильных изотопов, 63 Cu и 65 Cu с естественным содержанием 69,2% и 30,8% соответственно.
Ссылки
- Эндрю Джонс, Доисторическая Европа: теория и практика, 2008, стр. 195. Издательство Блэквелл.
- Дуглас Уитфилд Бейли, Балканская предыстория: исключение, включение и идентичность, 2000, стр. 210. Рутледж.
- Шарунас Милисаускас, Предыстория Европы, 2003, стр. 207. Клювер Академик/Пленум.
- Саул С. Хаубен, Происхождение названий элементов, J. Chem. Образовательная, 1933, 10 (4), стр. 227.
Процитировать эту страницу
Для онлайн-ссылки скопируйте и вставьте один из следующих элементов:



 Немедленно замените пробку. Азотная кислота и медь будут реагировать с образованием темно-бордового газообразного диоксида азота. Проекция усиливает эту часть демонстрации.
Немедленно замените пробку. Азотная кислота и медь будут реагировать с образованием темно-бордового газообразного диоксида азота. Проекция усиливает эту часть демонстрации.