Физические свойства меди таблица 8 класс: Сравните физические свойства меди и серы
Содержание
Предмет химии. Вещества — ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
Часть 1
1. Химия изучает:
— вещества
— их строения
— их свойства
2. Вещество это —
то, из чего состоят физические тела.
3. Признаки, по которым одни вещества отличаются от других,
— это свойства, например: агрегатное состояние, цвет, запах, плотность и т.д.
4. Существует взаимосвязь: свойство вещества — применение вещества.
Например, для стекла:
1) Прозрачное — оконные стекла
2) изготовление хрусталя
3) витражное стекло
5. Вещества состоят из молекул, которые, в свою очередь, образованы из атомов. Определенный вид атомов называют химическим элементом. Всего известно 120 химический элементов.
6. Химический элемент существует в трех формах.
Химический элемент существует в трех формах.
Часть 2
1. Установите соответсвие между понятием и примером.
2. Вычеркните лишнее:
колба, приборка, химический стакан, мензурка, ступка, мерный цилиндр, кристаллизатор.
Укажите признак, общий для оставшихся объектов.
Химическая посуда из стекла
3. Составьте задание, аналогичное предыдущему.
Вычеркните лишнее — приборка, мерная колба, цилиндр, штатив.
4. Заполните таблицу «Физические свойства вещества». В качестве примеров опишите вещества, используемые на кухне.
5. Укажите прилагательные, которые характеризуют свойства воды.
1) жидкая
2) пластичная
3) бесцветная
4) прозрачная
5) ароматная
6) электропроводная
Ответ: 1, 3, 4
6. Заполните таблицу «Сравнение физических свойств газообразных веществ».
Заполните таблицу «Сравнение физических свойств газообразных веществ».
7. Заполните таблицу «Сравнение физических свойств меди и железа».
8. Составьте кроссворд о свойствах и применении какого-либо вещества (по своему выбору).
9. На примере химического элемента водорода укажите правильную последовательность (1-2-3) перечисленных понятий от единичного к общему. Конкретизируте ее, используя слова и рисунки моделей частиц.
3) Вещество — это то, из чего состоят физические тела.
1) Атом — это химически неделимая частица.
2) Молекула — это наименьшая частица вещества.
10. Выражения, являющиеся синонимами понятия «химический элемент».
1) вид одинаковых атомов
2) вид одинаковых молекул
3) вид атомов, имеющих одинаковые свойства
4) простые вещества
5) названия видов атомов
Ответ: 1, 3
11.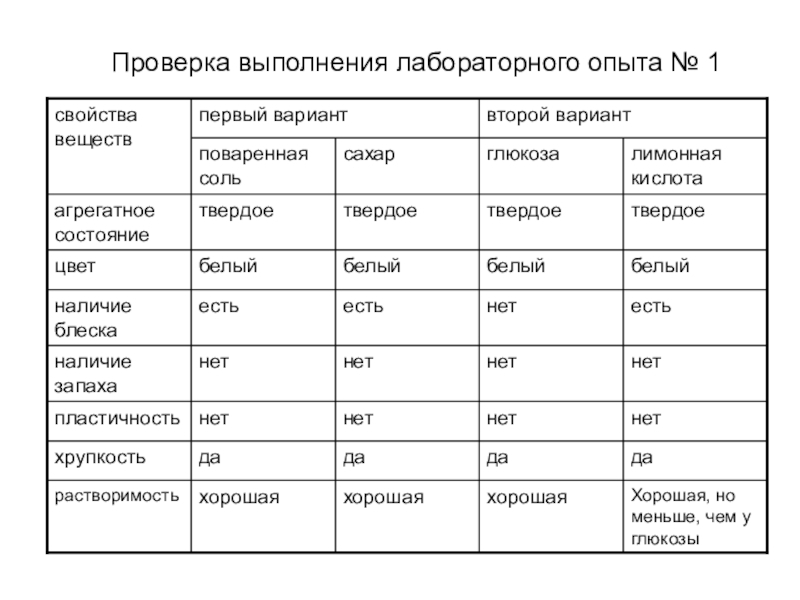 Установите соответствие между формой существования химического элемента и рисунками моделей частиц.
Установите соответствие между формой существования химического элемента и рисунками моделей частиц.
12. Проанализируйте рисунки и впишите пропущенные слова.
На рисунках изображено две молекулы сложных веществ, образованных из двух химических элементов.
13. Отметьте фразы, в которых говорится о сере как о химическом элементе. Из букв, соответствующих правильным ответам, вы составите название химического элемента, соединения которого используют для обеззараживания воды: хлор.
В тех фразах, которые вы не выбрали, речь идет о сере как о простом вещества.
Физические свойства металлов и общее применение металлической связи в таблице (9 класс, химия)
4.2
Средняя оценка: 4.2
Всего получено оценок: 350.
4.2
Средняя оценка: 4.2
Всего получено оценок: 350.
Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.
Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.
Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.
Рис. 1. Электрохимический ряд напряжений металлов.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
Рис. 2. Виды кристаллических решёток.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства | Особенности | Примеры | Применение |
Металлический блеск | Способность отражать солнечный свет | Наиболее блестящими металлами являются Hg, Ag, Pd | Изготовление зеркал |
Плотность | Лёгкие – имеют плотность меньше 5 г/см3 | Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см3 | Изготовление облицовки, деталей самолётов |
Тяжёлые – имеют плотность больше 5 г/см3 | Sn, Fe, Zn, Au, Pb, Hg. | Использование в сплавах | |
Пластичность | Способность изменять форму без разрушений (можно раскатать в тонкую фольгу) | Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn | Формовка, сгибание труб, изготовление проволоки |
Твёрдость | Мягкие – режутся ножом | Na, K, In | Изготовление мыла, стекла, удобрений |
Твёрдые – сравнимы по твёрдости с алмазом | Самый твёрдый – хром, режет стекло | Изготовление несущих конструкций | |
Температура плавления | Легкоплавкие – температура плавления ниже 1000°С | Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C) | Производство радиотехники, жести |
Тугоплавкие – температура плавления выше 1000°С | Cr (1890°С), Mo (2620°С), V (1900°С). | Изготовление ламп накаливания | |
Теплопроводность | Способность передавать тепло другим телам | Лучше всего проводят ток и тепло Ag, Cu, Au, Al | Приготовление пищи в металлической посуде |
Электропроводность | Способность проводить электрический ток за счёт свободных электронов | Передача электричества по проводам |
Рис. 3. Примеры применения металлов.
Что мы узнали?
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Лидия Маслова
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 350.
А какая ваша оценка?
BS 2871 Медные трубы Таблица X, Y и Z
Медь, используемая в производстве труб, представляет собой раскисленную фосфором медь Cu-DHP, определенную британским стандартом BS. 6017: 1981. Это также соответствует обозначению ISO Cu-DHP.
Минимальное содержание меди составляет 99,85% , а остаточное содержание фосфора составляет от 0,013 до 0,050% . Эта раскисленная медь не подвержена влиянию восстановительной атмосферы и, следовательно, хорошо подходит для сварки и пайки. Плотность меди 8,9 г/см 3 . его температура плавления составляет 1083 o C , а его коэффициент линейного расширения составляет 16,8 x 10 -6 на o C (в пределах 20 o C — 100 или C ).
Плотность меди 8,9 г/см 3 . его температура плавления составляет 1083 o C , а его коэффициент линейного расширения составляет 16,8 x 10 -6 на o C (в пределах 20 o C — 100 или C ).
Внимание! — этот стандарт заменен на EN 1057 — Медные трубы для воды и газа в сантехнических и отопительных целях
Для полной таблицы с таблицей Z — поверните экран!
| Ном. Диаметр (мм) | Внешний диаметр (мм) | Стол X Полутвердая светлая калибровочная трубка | Стол Y Полутвердая отожженная трубка 90 048 | Стол Z Жесткотянутая тонкостенная труба | |||
|---|---|---|---|---|---|---|---|
| Толщина (мм) | Максимальное рабочее давление (Н/мм 2 ) | Толщина 9 0005 (мм) | Максимальное рабочее давление (Н/мм 2 ) | Толщина (мм) | Максимальное рабочее давление (Н /мм 2 ) | ||
| 6 | 6 | 0,6 | 13,3 | 0,8 | 14,4 | 0,5 | 11,3 |
| 8 | 8 | 0,6 | 9,7 | 0,8 | 10,5 | 0,5 | 9,8 |
| 10 | 10 | 0,6 | 7,7 | 0,8 | 8,2 | 0,5 | 7,8 |
| 12 | 12 | 0,6 | 6,3 9 0113 | 0,8 | 6,7 | 0,5 | 6,4 |
| 15 | 15 | 0,7 | 5,8 | 1 | 6,7 | 0,5 | 5 |
| 18 | 18 | 0,8 | 5,6 | 1 | 5,5 | 0,6 | |
| 22 | 22 | 0,9 | 5,1 | 1,2 | 5,7 | 0,6 | 4. 1 1 |
| 28 | 28 | 0,9 | 4 | 1,2 | 4,2 | 0 .6 | 3,2 |
| 35 | 35 | 1,2 | 4,2 | 1,5 | 4,1 | 0,7 | 3 |
| 42 9 0113 | 42 | 1,2 | 3,5 | 1,5 | 3,4 | 0,8 | 2,8 | 54 | 54 | 1,2 | 2,7 | 2 | 3,6 | 0,9 | 2,5 |
| 67 | 67 | 1,2 | 2 | 2 | 2,8 | 1 | 2 |
| 76,1 | 76,2 | 1,5 | 2 | 2,5 | 1,2 | 1,9 | |
| 108 | 108,1 | 1,7 | 2,5 | 2,2 | 1,2 | 1,7 | |
| 133 | 133,4 | 1,4 | 1,5 | 1,6 | |||
| 159 | 159,4 | 2 | 1,5 | 1,5 | |||
- 1 Н/мм 90 012 2 = 10 6 Па = 1 МПа = 10 бар = 1,020×10 5 кп/м 2 = 102,0 м H 2 O = 9,869 атм = 145,0 фунт/дюйм 9001 2 2 )
- ASTM B88 — Бесшовные медные водопроводные трубы — Медные трубы для рабочего давления типа K, L и M 9
Физические и химические свойства элементов группы 1
Элементы группы 1:
Эти элементы известны как щелочных металлов.

Физические свойства элементов группы 1
1. В таблице приведены некоторые свойства элементов группы 1.
Элемент Число протонов Число нуклонов Плотность (г см -3 ) Твердость (по Бринеллю) Температура плавления (°C) Температура кипения (°C) Атомный радиус (нм) Электро
отрицательность900 43
Литий 3 7 0,53 0,06 181 1347 0,15 1,0 Натрий 90 113 11 23 0,97 0,07 98 886 0,19 0 .9 Калий 19 39 0,86 0,04 64 774 0,23 0,8 Рубидий 37 85 1,53 0,03 39 688 0,25 0,8 900 43
Цезий 55 133 1,87 0,02 28 678 0,2 6 0,7 Франций 87 223 2,40 ? 27 677 0,29 0,7 2.
 Общие физические свойства элементов 1 группы:
Общие физические свойства элементов 1 группы: - Щелочные металлы представляют собой серые твердые вещества с блестящими серебристыми поверхностями при свежем разрезе.
- Эти поверхности становятся матовыми при воздействии воздуха.
- Это связано с тем, что щелочные металлы очень реакционноспособны. Они быстро реагируют с кислородом и водяным паром в воздухе при воздействии.
- Щелочные металлы являются мягкими твердыми телами и могут быть легко разрезаны.
- Щелочные металлы имеют имеет низкую плотность по сравнению с тяжелыми металлами, такими как железо и медь.
- Щелочные металлы являются хорошими проводниками тепла и электричества.
- Щелочные металлы имеют низкую температуру плавления и температуру кипения по сравнению с тяжелыми металлами, такими как медь и железо.
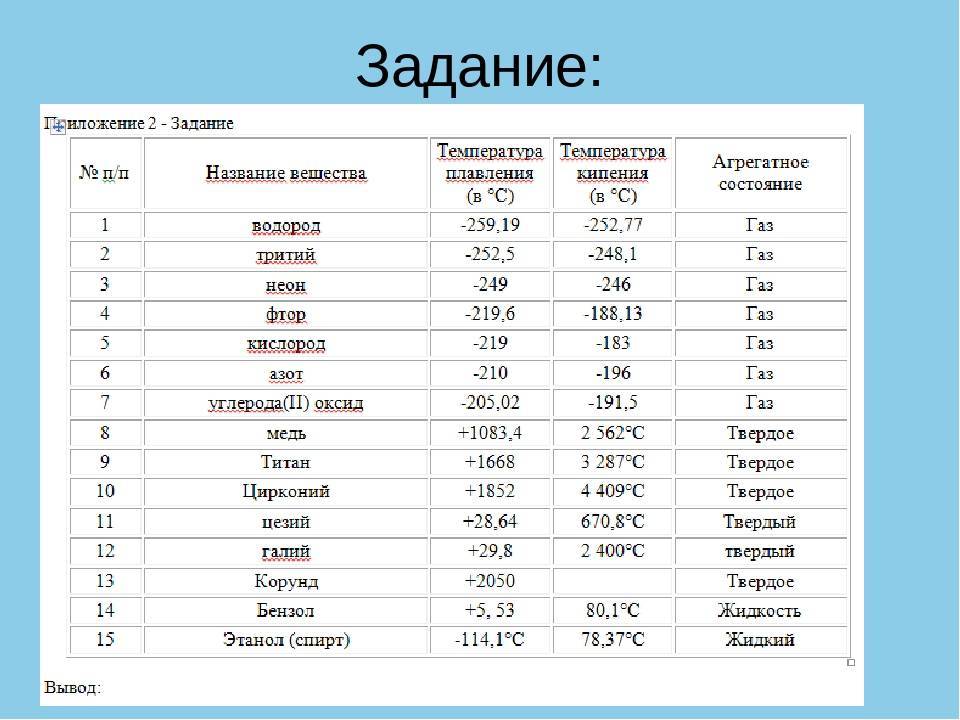
В таблице сравниваются температуры плавления и кипения калия (щелочного металла) и меди (тяжелого металла).
Элемент Калий Медь Температура плавления (°C) 64 1083 9 0043
Температура кипения (°C) 774 2567 3 Тенденция изменения физических свойств
Физические свойства элементов изменяются постепенно при переходе в группу 1 , как показано в табл.Элементы группы 1 Тенденция изменения физических свойств Атомный радиус (атомный размер) щелочных металлов постепенно увеличивается вниз по группе. Причина:
количество оболочек занятых электронами увеличивается на вниз по группе.
Хотя щелочные металлы имеют низкую плотность, плотность постепенно увеличивается вниз по группе. Например:
Литий, натрий и калий менее плотны, чем вода. Таким образом, эти металлы плавают на поверхности воды.
Рубидий, цезий и франций плотнее воды. Таким образом, эти металлы тонут в воде.Металлическая связь означает химическую связь, которая удерживает атомы вместе в металле.
Хотя щелочные металлы имеют низкие температуры плавления и кипения, температуры плавления и кипения постепенно уменьшаются вниз по группе. Причина:
По мере увеличения размера атома вниз по группе металлическая связь между атомами щелочных металлов становится слабее. Следовательно, требуется меньше тепловой энергии для преодоления более слабой металлической связи при плавлении или кипении при движении вниз по группе.
Щелочные металлы становятся мягче вниз по группе. Люди также спрашивают
- Что такое периодическая таблица элементов?
- Физические и химические свойства элементов 18 группы
- Физические и химические свойства элементов 17 группы
- Что вы подразумеваете под переходными металлами?
- Для чего нужна классификация элементов?
- Современная периодическая таблица и ее значение
- Как Менделеев составил периодическую таблицу?
- Периодические тенденции в свойствах элементов
- Что такое валентность и атомный радиус?
- Что такое металлические и неметаллические свойства?
Химические Свойства элементов группы 1
1. Таблица показывает электронное расположение щелочных металлов.
Элемент Расположение электронов Литий 2.  1
190 064
Натрий 2.8.1 Калий 2.8.8.1 Рубидий 2.8.18.8.1 Цезий 2.8.18.18.8.1 Франк ium 2.8.18.32.18.8.1 2. Аналогичные химические свойства
- Все щелочные металлы обладают сходными химическими свойствами.
- Это потому, что все атомы щелочных металлов имеют один валентный электрон.
3. Реактивность
Щелочные металлы очень реакционноспособны.
Хотя щелочные металлы обладают сходными химическими свойствами, они отличаются реакционной способностью.
Реакционная способность щелочных металлов увеличивается при переходе в группу 1. или октетное расположение электронов).более легкий атом щелочного металла высвобождает свой единственный валентный электрон, более реактивный является щелочным металлом.

Объяснение:
Повышение реакционной способности щелочных металлов по группе 1 можно объяснить следующим образом.- Все щелочные металлы имеют один валентный электрон.
- Каждый атом щелочного металла высвобождает один валентный электрон во время химической реакции для достижения стабильный дуплет или октет расположение электронов. Следовательно, образуется ион с зарядом +1.
- При движении вниз по группе 1 атомный размер щелочных металлов увеличивается .
- Одновалентный электрон становится дальше от ядра и экранируется более внутренними оболочками, содержащими электроны.
- Это означает, что эффективный заряд ядра воспринимается одновалентным электроном уменьшается на при спуске по группе.
- Это приводит к тому, что силы притяжения между ядром и одновалентным электроном становятся слабее, поэтому одиночный валентный слабее притягивается ядром.

- Следовательно, один валентный электрон может быть легче высвобожден при движении вниз по группе.
- В результате реакционная способность щелочных металлов увеличивается вниз по группе.
4. В качестве восстановителей
- Восстановители являются хорошими донорами электронов в химических реакциях.
- Щелочные металлы являются хорошими восстановителями , потому что одновалентный электрон в атоме каждого щелочного металла может быть легко высвобожден для достижения стабильного электронного расположения благородного газа (хорошего донора электронов).
- Прочность щелочных металлов как восстановителей повышается при понижении группы 1.
- Это происходит потому, что одновалентный электрон щелочных металлов становится намного легче высвобождаться при движении вниз по группе.

5. Электроположительность
- (a) Определение:
Электроположительность элемента является мерой способности атома отдавать электроны с образованием положительного иона.- Щелочные металлы очень электроположительны.
- Это связано с тем, что атом каждого щелочного металла может легко высвобождать свой единственный валентный электрон, образуя положительный ион.
- Однако электроположительность щелочных металлов увеличивается при движении вниз по группе 1.
Это можно объяснить следующим образом:
- 3 атомный размер щелочных металлов увеличивает от лития до франций.
- одновалентных электрона в самой внешней занятой оболочке становятся дальше от ядра и экранирован большим количеством внутренних оболочек, содержащих электроны.

- Таким образом, силы притяжения между ядром и одновалентным электроном ослабевают при спуске по Группе 1.
- Это приводит к тому, что одновалентный электрон легче высвобождается при спуске по Группе 1.
- В результате, электроположительность щелочных металлов увеличивается при движении вниз по группе.
6. Элементы группы 1 проявляют сходные химические свойства в своих реакциях с
- водой с выделением газообразного водорода и образованием гидроксида металла.
- кислород для получения оксидов металлов.
- хлор для производства хлорида металла.
- бром для производства бромида металла.
7. Для прогнозирования свойств рубидия, цезия и франция
- Рубидий, цезий и франций расположены ниже калия в группе 1 Периодической таблицы.
- Следовательно, ожидается, что рубидий, цезий и франций будут реагировать с водой, кислородом, хлором или бромом аналогично калию, но эти реакции более энергичны (более реактивны) , чем калий.
- Например:
8. Растворимость солей щелочных металлов
- Карбонатные, нитратные, хлоридные, сульфатные, бромидные и йодидные соли щелочных металлов белые твердые вещества.
- Эти соли растворимы в воде. Они растворяются в воде, образуя бесцветные растворы.
9. Меры предосторожности при обращении с элементами группы 1
- Щелочные металлы очень реакционноспособны.
- Щелочные металлы при воздействии на них могут реагировать с кислородом и водяным паром в воздухе.
- Следовательно, щелочные металлы, такие как литий, натрий и калий, должны храниться в парафиновом масле, тогда как рубидий и цезий хранятся в герметичных стеклянных пробирках.
 Это необходимо для предотвращения их реакции с кислородом и водяным паром в воздухе.
Это необходимо для предотвращения их реакции с кислородом и водяным паром в воздухе. - Следующие меры предосторожности необходимо соблюдать при работе с щелочными металлами.
- Не держите высокореакционноспособные щелочные металлы голыми руками.
- Во время эксперимента надевайте защитные очки и перчатки .
Химические свойства элементов 1 группы Опыт 1
Цель: Исследовать химические свойства металлов 1 группы в их реакциях с водой и кислородом.
Постановка задачи: Как металлы группы 1 реагируют с водой и кислородом?А. Реакции щелочных металлов с водой
Гипотеза: При понижении группы 1 щелочные металлы становятся более активными в реакциях с водой.
Переменные:
(a) Управляемая переменная: Различные типы щелочных металлов
(b) Реагирующая переменная: Реакционная способность щелочных металлов
(c) Управляемые переменные: Вода, размер щелочных металлов
Рабочее определение: Щелочной металл, который более энергично и быстро реагирует с водой, является более реакционноспособным металлом. Материалы: Маленькие кусочки лития, натрия и калия, дистиллированная вода, красная лакмусовая бумага и фильтровальная бумага.
Материалы: Маленькие кусочки лития, натрия и калия, дистиллированная вода, красная лакмусовая бумага и фильтровальная бумага.
Аппаратура: Поилки, небольшой нож и щипцы.
Меры предосторожности:
Не прикасайтесь голыми руками к чрезвычайно химически активным щелочным металлам.
Всегда надевайте защитные очки и перчатки.
Процедура:
A. Маленький кусочек лития вырезается ножом.- Масло с поверхности лития удаляют, прокатывая его по кусочку фильтровальной бумаги.
- Затем литий медленно помещают на поверхность воды в желобе с помощью щипцов, как показано на рисунке.
- Все происходящие изменения записываются.
- Когда реакция прекратится, образовавшийся раствор проверяют красной лакмусовой бумажкой.
- Шаги с 1 по 5 повторяются с использованием натрия и калия соответственно для замены лития.
Наблюдения:
Щелочной металл Наблюдение 900 64
Литий Литий движется медленно по поверхности воды с тихим шипящим звуком.  Образуется бесцветный раствор , который окрашивает красную лакмусовую бумагу в синий цвет .
Образуется бесцветный раствор , который окрашивает красную лакмусовую бумагу в синий цвет .Натрий Натрий плавится, превращаясь в маленькую сферу, движется быстро и случайным образом на поверхности воды с шипящим звуком. Образуется бесцветный раствор , который окрашивает красную лакмусовую бумагу в синий цвет . Калий Калий плавится, превращаясь в маленькую сферу, горит сиреневым пламенем, перемещается очень быстро и случайным образом по поверхности воды с шипением и хлопком. Образуется бесцветный раствор , который окрашивает красную лакмусовую бумагу в синий цвет . Обсуждение:
- Щелочные металлы шипят и толкают по поверхности воды, как судно на воздушной подушке.
 Это из-за выделения газообразного водорода , когда они реагируют с водой.
Это из-за выделения газообразного водорода , когда они реагируют с водой. - Литий, натрий и калий реагируют с водой с образованием бесцветного газа («шипящий» звук) и щелочного раствора (гидроксид металла), который окрашивает красную лакмусовую бумажку в синий цвет. Следовательно, литий, натрий и калий обладают сходными химическими свойствами.
- Наблюдения также показывают, что реакционная способность щелочных металлов в их реакциях с водой возрастает от лития → натрия → калия.
- Щелочные металлы реагируют с водой с образованием раствора гидроксида металла (щелочного раствора) и газообразного водорода.
B. Реакции щелочных металлов с кислородом
Гипотеза: При понижении группы 1 щелочные металлы становятся более активными в своих реакциях с кислородом.
Переменные:
(a) Управляемая переменная: Различные типы щелочных металлов
(b) Отвечающая переменная: Реакционная способность щелочных металлов
(c) Управляемые переменные: Газообразный кислород, размер щелочных металлов
Рабочее определение: Щелочь металл, который горит быстрее и энергичнее в кислороде, является более реакционноспособным металлом.
Материалы: Маленькие кусочки лития, натрия и калия, фильтровальная бумага, красная лакмусовая бумага и три газовых баллона, наполненных
газообразным кислородом.
Аппаратура: Пинцет, ложка для газового баллончика, маленький нож и горелка Бунзена.
Процедура:- С помощью ножа вырезается небольшой кусочек лития.
- Масло с поверхности лития удаляют, раскатывая его на кусочке фильтровальной бумаги.
- Затем литий нагревают в газовой ложке до тех пор, пока он не начнет гореть.
- Затем ложку газового баллона с горящим литием быстро опускают в газовый баллон, наполненный газообразным кислородом, как показано на рисунке.
- Происходящие изменения записываются.
- Когда реакция прекратится, в газовый сосуд наливают 10 см3 дистиллированной воды и хорошо встряхивают.
- Образовавшийся раствор проверяют красной лакмусовой бумажкой.
- Шаги с 1 по 7 повторяются с использованием натрия и калия соответственно для замены лития.

Наблюдения:
Щелочной металл Наблюдение Литий Литий горит медленно красным пламенем с выделением белого дыма, который при охлаждении до комнатной температуры становится белым твердым веществом . Белое твердое вещество растворяется в воде с образованием бесцветного раствора . Этот раствор окрашивает красную лакмусовую бумажку в синий цвет. Натрий Натрий горит быстро и ярко с желтым пламенем и выделяет белый дым, который становится белое твердое вещество при охлаждении до комнатной температуры. Белое твердое вещество растворяется в воде с образованием бесцветного раствора . Этот раствор окрашивает красную лакмусовую бумажку в синий цвет. 
Калий Калий горит очень быстро и ярко с сиреневым пламенем и выделяет белый дым, который превращается в белое твердое вещество 9003 4 при охлаждении до комнатной температуры. Белое твердое вещество растворяется в воде с образованием бесцветного раствора . Этот раствор окрашивает красную лакмусовую бумажку в синий цвет. Обсуждение:
- Литий, натрий и калий сгорают в кислороде соответственно с образованием белых паров , которые затем превращаются в белое твердое вещество (оксид металла). Белое твердое вещество растворяется в воде с образованием щелочного раствора (гидроксида металла). Следовательно, можно сделать вывод, что эти щелочные металлы обладают сходными химическими свойствами.
- Из яркости пламени и скорости горения можно сделать вывод, что реакционная способность щелочных металлов в их реакциях с газообразным кислородом увеличивается из лития → натрия → калия.

- Все щелочные металлы реагируют с газообразным кислородом при нагревании с образованием белых твердых оксидов металлов.
- Образовавшиеся белые твердые оксиды металлов растворяются в воде с образованием щелочных растворов гидроксидов металлов.
Вывод:
Щелочные металлы проявляют аналогичные химические свойства в своих реакциях с водой или газообразным кислородом. реакционная способность щелочных металлов увеличивает вниз по группе 1. Следовательно, можно принять предложенную гипотезу.Химические свойства элементов 1 группы Опыт 2
Цель: Исследовать химические свойства металлов 1 группы в их реакциях с хлором и бромом.
Постановка задачи: Как металлы группы 1 реагируют с хлором и бромом?
Гипотеза: При понижении группы 1 щелочные металлы становятся более активными в своих реакциях с хлором или бромом.
Переменные:
(a) Управляемая переменная: Различные типы щелочных металлов
(b) Отвечающая переменная: Реакционная способность щелочных металлов
(c) Управляемые переменные: Хлор и бром, размер щелочных металлов
Рабочее определение: Щелочной металл, который более энергично и быстро реагирует с газообразным хлором или бромом, является более реакционноспособным металлом.
Материалы: Маленькие кусочки лития, натрия и калия, фильтровальная бумага, три газовых баллона, наполненных газообразным хлором, и три газовых баллона, наполненных парами брома.
Аппаратура: Горелка Бунзена, щипцы, ложка для газового баллона и маленький нож.
Меры безопасности:
Газообразный хлор и пары брома ядовиты. При работе с этими галогенами надевайте перчатки и защитные очки.
Процедура:- С помощью ножа вырезается небольшой кусочек лития.

- Масло с поверхности лития удаляют, прокатывая его по кусочку фильтровальной бумаги.
- Затем литий нагревают в газовой ложке до тех пор, пока он не начнет гореть.
- Затем ложку газового баллона с горящим литием быстро опускают в газовый баллон, наполненный газообразным хлором, как показано на рисунке.
- Происходящие изменения записываются.
- Шаги с 1 по 5 повторяются с использованием натрия и калия соответственно для замены лития.
- Повторяются шаги с 1 по 6 с использованием паров брома вместо газообразного хлора.
Наблюдения:
Щелочной металл Наблюдение 90 064
Газообразный хлор Пары брома Литий Литий горит медленно с красное пламя и высвобождает белых дыма , которые становятся белое твердое вещество в конце реакции. 
Литий горит медленно красным пламенем и выделяет белые пары , которые в конце реакции превращаются в белое твердое вещество . Красновато-коричневые пары брома обесцвечиваются. Натрий Натрий горит быстро и ярко с желтым пламенем и выделяет белый дым который превращается в белое твердое вещество в конце реакции. Натрий горит быстро и ярко желтым пламенем и выделяет белый дым , который в конце реакции становится белым твердым веществом . Красновато-коричневые пары брома обесцвечиваются.
Калий Калий горит очень быстро и ярко сиреневым пламенем и освобождает белые пары , которые в конце реакции превращаются в белое твердое вещество . 

 Самый тяжёлый – осмий с плотностью 22,5 г/см3
Самый тяжёлый – осмий с плотностью 22,5 г/см3 Наиболее тугоплавкий – вольфрам (3420°С)
Наиболее тугоплавкий – вольфрам (3420°С)