Формула латуни химическая: Формула латуни в химии
Содержание
Латунь формула химическая сплава — Мастерок
Содержание
- Свойства
- Как влияют легирующие присадки
- Маркировка
- Сферы применения латуни
- Маркировка латуни
- Марка
- Состав латуни
- Виды латуни
- Производство латуни, виды и свойства
- Применение латуни
Латунь – высокотемпературное соединение расплавов меди и цинка. Для придания расплаву различных свойств, в зависимости от направленности применения латуни, при её выплавке добавляют различные присадки. Известно, что сплав меди и олова именуют бронзой, но олово может служить присадкой и при выплавке латуни. От количественного преобладания в медном сплаве цинка или олова и зависит его название: больше олова – бронза, больше цинка – латунь. Свойства последнего сплава определяются присадками, добавляемыми в расплав гораздо меньшими количествами – это такие вещества, как металлы: железо, свинец и никель, и неметаллы: кремний и фосфор.
Хотя цинк и был получен в виде металла только в шестнадцатом веке, но латунь получали ещё до начала современного летоисчисления, при плавлении добавляя в расплав меди богатую цинковую руду – галмей (смесь цинкового шпата с формулой ZnCO 3 и кремнекислого цинка). Запатентован же способ получения латуни был английским металлургом в конце семнадцатого века. А уже в девятнадцатом веке в Западной части России и Европе посредством латуни фальсифицировали золотые украшения.
Запатентован же способ получения латуни был английским металлургом в конце семнадцатого века. А уже в девятнадцатом веке в Западной части России и Европе посредством латуни фальсифицировали золотые украшения.
Свойства
От меди латунь унаследовала значительный удельный вес, в зависимости от содержания основного компонента в латуни, её плотность колеблется от 8,3 до 8,7 тонны на кубический метр. Вообще, многие физические свойства латуни как сплава зависят от соотношения его компонентов не только основных, но и добавляемых в небольших количествах – легирующих.
Пожалуй, более или менее стабильной характеристикой является удельная теплоёмкость, её показатель при комнатной температуре 380 Дж/(кг*К), что означает – для нагрева металла весом один килограмм на один градус Кельвина потребуется 380 Джоулей теплоты. Удельное электрическое сопротивление меняется от 0,025 до 0,108 Ом*кв. мм/м. Температура плавления латуни также меняется в широких пределах, от 870 до 990 градусов Цельсия. Медь – более тугоплавкий металл, чем цинк, поэтому меньшие значения относятся к сплавам с более высоким содержанием цинка.
Медь – более тугоплавкий металл, чем цинк, поэтому меньшие значения относятся к сплавам с более высоким содержанием цинка.
Латунь хорошо поддаётся контактной сварке, но не сваривается плавлением, её легко прокатывать. Для защиты металла от окисления на воздухе, его поверхность покрывают лаком, предотвращая почернение, хотя стойкость к воздействию атмосферы у латуни выше, чем у меди. У латуни золотистый цвет и она хорошо поддаётся полировке. Добавки в сплав висмута и свинца уменьшают его сминаемость в нагретом состоянии, но улучшают поведение сплава при обработке режущим инструментом.
Содержание в сплаве цинка определяет такие важные свойства, как прочность и пластичность – эти два, казалось бы, взаимоисключающие понятия. Если цинка добавляется до тридцати процентов, то вместе с этим растут характеристики прочности и пластичности. После этого порога пластичность начинает снижаться, а прочность продолжает расти до отметки 45%, затем снижается, как и пластичность.
Многие марки латуни хорошо поддаются обработке давлением как при низких температурах, так и в нагретом состоянии, за исключением температуры от 300 до 700 градусов, которая является зоной хрупкости и в этом интервале температур сплав не деформируют. Улучшение механических и химических характеристик латуней, в их состав дополнительно включают легирующие присадки.
Как влияют легирующие присадки
Легирующая – это присадка к сплаву, изменяющая его состав и, как следствие, придающая ему какие-то новые свойства, или повышающая или снижающая уже имеющиеся свойства. Для снижения потерь металла с поверхности расплава, в него добавляют алюминий образующаяся при этом оксидная плёнка, и выполняет защитную роль. Чтобы увеличить прочность и улучшить антикоррозионные качества, в сплав добавляют магний, отдельной позицией или вместе с алюминием и железом. Причём на плотность металла присадки практически не влияют.
Добавка в расплав никеля исключает проявления отрицательных моментов в части окислительных процессов. Улучшить пластичность, ковкость сплава и условия его резки удаётся введением в состав латуни такой присадки, как свинец. Кремний в сочетании со свинцом улучшает скольжение до такой степени, что легированный этой присадкой сплав вполне может использоваться на равных с оловянной бронзой. При этом кремний, добавленный без других присадок, конкретно повышает твёрдость и прочность латуни. Если металл планируют использовать на корабле, к нему присаживают олово, придающее стойкость к солёной воде.
Улучшить пластичность, ковкость сплава и условия его резки удаётся введением в состав латуни такой присадки, как свинец. Кремний в сочетании со свинцом улучшает скольжение до такой степени, что легированный этой присадкой сплав вполне может использоваться на равных с оловянной бронзой. При этом кремний, добавленный без других присадок, конкретно повышает твёрдость и прочность латуни. Если металл планируют использовать на корабле, к нему присаживают олово, придающее стойкость к солёной воде.
Маркировка
В маркировке металла придерживаются определённых правил, изложенных в государственных стандартах – ГОСТ. Обозначается сплав начальной буквой – Л, затем идут начальные буквы присадок сплава с цифрами, указывающими на количество присадки. Маркированная деформируемая латунь за первой буквой включает цифры – сколько меди в составе: Л 70.
Если деформируемая латунь ещё и легированная, в обозначение вносятся начальная буква присадок, и число в процентах: ЛАН 60-1-1, это меди 60%, алюминия 1% и никеля 1%. Содержание цинка в таком сплаве вычисляют разницей, в этом 100 – (60+1+1) = 38%. Латуни для литья маркируются по-другому: количественные значения компонентов сплава вносятся сразу после их первых букв. Так, в изделии ЛЦ 40 Мц 1 цинка 40%, марганца 1%.
Содержание цинка в таком сплаве вычисляют разницей, в этом 100 – (60+1+1) = 38%. Латуни для литья маркируются по-другому: количественные значения компонентов сплава вносятся сразу после их первых букв. Так, в изделии ЛЦ 40 Мц 1 цинка 40%, марганца 1%.
Сферы применения латуни
Во всём мире потребление цинка для производства этого сплава оценивается в два миллиона тонн, причём половина этого количества представлена ломом цинковых изделий. Латунь для технических целей получают, сплавливая примерно равные количества меди и цинка. Все латунные изделия можно подразделить на три основных вида, определяющих направления их применения:
- деформируемые – содержат цинка менее десяти процентов, их второе название томпак, он обладает хорошей пластичностью, не подвержен коррозии и хорошо скользит по металлу. У него прекрасная свариваемость со сталью и отличный цветовой оттенок – под золото;
- литейные – их название говорит об основном направлении применения, производство предметов способом литья, состоят они на 50–80% из меди.
 Сплав устойчив к коррозии, не деформируется при трении о другие металлы, очень прочный и нехрупкий. В расплаве его несложно заливать в формы любой конфигурации;
Сплав устойчив к коррозии, не деформируется при трении о другие металлы, очень прочный и нехрупкий. В расплаве его несложно заливать в формы любой конфигурации; - автоматные – это сплавы с присадкой свинца, такое сочетание даёт возможность выходу из-под резца дискретной стружки, что очень важно при обработке изделий в автоматизированном положении – снижается износ деталей станка и возрастает скорость обработки.
Один из самых востребованных металлов во всём мире – это латунь. Применение этого сплава затрагивает практически все отрасли народного хозяйства. Простые сплавы с добавкой цинка в пределах 20% используют для изготовления деталей машин и механизмов, теплообменных аппаратов.
На изготовление штампованных предметов идут сплавы с включением цинка до 40%, а если такие сплавы легированы присадками, их применяют в судостроении и машиностроении, самолётостроении и строительстве, в часовой промышленности и т. д. Из томпака делают предметы художественного назначения, различную бижутерию и другие атрибуты, в том числе знаки воинского различия.
Литейная латунь является материалом для изготовления деталей, работающих в условиях агрессивной среды. Из автоматной изготавливают метизы – шурупы, в том числе и саморезные, гайки с болтами и шпильки. Сплав немагнитный, его используют там, где это свойство востребовано, например, для изготовления деталей компасов. Повышенная теплоёмкость обусловливает его применение в тепловых приборах, так самовары издавна изготавливали из латуни. Церковная утварь – это ещё одна сфера применения этого золотистого сплава.
В ювелирном деле латунь ценится не меньше, чем благородные металлы, которые ею имитируются при изготовлении украшений и бижутерии. Специалисты разделяют латунные изделия на три группы:
- со средним содержанием цинка, жёлтого цвета;
- золотистого цвета, с незначительным количеством цинка;
- зелёного цвета, с большим количеством цинка в составе сплава.
Наиболее приближенный к окраске золота цвет латунь имеет при пятнадцати процентах цинка и присадке алюминия в количестве 5%. Зачастую этим свойством пользуются нечестные люди, подделывая золотые украшения, хотя плотности золота и подделки несопоставимы. Чистят латунные изделия щавелевой кислотой.
Зачастую этим свойством пользуются нечестные люди, подделывая золотые украшения, хотя плотности золота и подделки несопоставимы. Чистят латунные изделия щавелевой кислотой.
Маркировка латуни
Марка
Все двухкомпонентные латуни хорошо обрабатываются давлением. Их поставляют в виде труб и трубок разной формы сечения, листов, полос, ленты, проволоки и прутков различного профиля.
Латунные изделия с большим внутренним напряжением (например, нагартованные) подвержены растрескиванию. При длительном хранении на воздухе на них образуются продольные и поперечные трещины. Чтобы избежать этого, перед длительным хранением необходимо снять внутреннее напряжение, проведя низкотемпературный отжиг при 200-300 C.
Количество марок многокомпонентных латуней больше, чем двухкомпонентных.
Марку этих латуней составляют следующим образом:
– первой, как в простых латунях, ставится буква Л;
– вслед за ней – ряд букв, указывающих, какие легирующие элементы, кроме цинка, входят в эту латунь;
– затем через дефисы следуют цифры, первая из которых характеризует среднее содержание меди в процентах, а последующие – каждого из легирующих элементов в той же последовательности, как и в буквенной части марки.
Порядок букв и цифр устанавливается по содержанию соответствующего элемента: сначала идет тот элемент, которого больше, а далее по нисходящей. Содержание цинка определяется по разности от 100%.
Например: марка ЛАЖМц66-6-3-2 расшифровывается так: латунь, в которой содержится 66 % Cu, 6 %Al, 3 % Fe и 2 % Mn. Цинка в ней 100-(66+6+3+2)=23 %.
Основными легирующими элементами в многокомпонентных латунях являются алюминий, железо, марганец, свинец, кремний, никель. Они по-разному влияют на свойства латуней:
Марганец повышает прочность и коррозионную стойкость, особенно в сочетании с алюминием, оловом и железом.
Олово повышает прочность и сильно повышает сопротивление коррозии в морской воде. Латуни, содержащие олово, часто называют морскими латунями.
Никель повышает прочность и коррозионную стойкость в различных средах.
Свинец ухудшает механические свойства, но улучшает обрабатываемость резанием. Им легируют (1-2 %) латуни, которые подвергаются механической обработке на станках-автоматах. Поэтому эти латуни называют автоматными.
Поэтому эти латуни называют автоматными.
Кремний ухудшает твердость, прочность. При совместном легировании кремнием и свинцом повышаются антифрикционные свойства латуни и она может служить заменителем более дорогих, например оловянных бронз, применяющихся в подшипниках скольжения.
Применение специальных латуней:
ЛАЖ60-1-1 – Трубы, прутки
ЛЖМц59-1-1 – Полосы, прутки, трубы, проволока
ЛЦ40С – Арматура, втулки, сепараторы шариковых и роликовых подшипников и др.
ЛЦ40Мц3Ж – Сложные по конфигурации детали, арматура, гребные винты и их лопасти и др.
Латунь является самым древним сплавом, так как её изготовление берёт корни ещё со времён Римской империи. В то время она была первым металлом по ценности после серебра и золота. Благодаря своему составу она обладает привлекательным внешним видом и в то же время высокой прочностью. Приятный глазу золотисто-желтоватый цвет даёт медь, а добавление цинка и других компонентов делает её крепким материалом.
Состав латуни
В формуле латуни всегда будут неизменными два компонента — это медь и цинк. Медь является природным ресурсом, цинк добывают путём вторичной переработки мусора. В готовом материале масса цинка держится в пределах от 5 до 50%.
Медь имеет номер 29 в таблице Менделеева, обладает высокой пластичностью, имеет красивый желтовато-золотистый цвет. При взаимодействии с открытым воздухом на металле появляется оксидная плёнка, из-за которой медь становится красной.
Цинк, находящийся под номером 30 в таблице Менделеева, является хрупким металлом и обладает светлым голубым цветом, при появлении оксидной плёнки — темнеет.
Медно-цинковый сплав разделяют на однофазный и двухфазный:
- Однофазный сплав имеет в составе около 30% цинка. Это обычный состав, который отличается пластичностью и в то же время твёрдостью. Если процент цинка увеличивается то пластичность снижается в то время, как твёрдость латуни возрастает.
 После достижения цинка отметки в 40% показатель твёрдости сразу падает. Однофазная латунь относится к пластичным сплавам и поддаётся обработке как при пониженных температурах, так и при повышенных, однако, при температуре 400С появляется хрупкая зона.
После достижения цинка отметки в 40% показатель твёрдости сразу падает. Однофазная латунь относится к пластичным сплавам и поддаётся обработке как при пониженных температурах, так и при повышенных, однако, при температуре 400С появляется хрупкая зона. - Двухфазный сплав состоит на 30−50% из цинка и имеет примеси других металлов в пределах 10%. Это технический или специальный сплав. Не отличается пластичностью, лишь при нагревании свыше 700С приобретает пластичные свойства.
Виды латуни
Латунь бывает простая и специальная:
- Простая — в составе имеет всего два компонента, медь и цинк. Маркируется буквой «Л» и цифрами. Цифры в маркировке говорят о процентном соотношении меди к общей массе сплава. Исходя из этого понятно, что сплав, маркированный «Л68», имеет в составе 68% меди и 32% цинка.
- Специальная — состоит не только из меди и цинка, в неё добавлены и другие металлы, которые меняют свойства сплава в зависимости от своих характеристик. Маркировка этого материала несёт информацию о процентном соотношении меди к цинку и к другим элементам, которые называются легирующими.
 К примеру, маркировка «ЛА70−3» свидетельствует о том, что в составе использовано 70% меди, 3% алюминия и 27% цинка. В специальной латуни дополнительными металлами могут выступать:
К примеру, маркировка «ЛА70−3» свидетельствует о том, что в составе использовано 70% меди, 3% алюминия и 27% цинка. В специальной латуни дополнительными металлами могут выступать:
- Олово.
- Свинец.
- Железо.
- Марганец.
- Никель.
- Кремний.
- Алюминий.
Производство латуни, виды и свойства
Латунь производят при высоких температурах в специальных глиняных ёмкостях. При изготовлении сплава необходимо учитывать, что часть цинка испаряется.
Сплав делится на несколько видов:
- Томпак — это сплав, в составе которого присутствует не более 13% цинка. Томпак отличается повышенной эластичностью, высокой устойчивостью к ржавчине и стиранию. Используют этот вид латуни при сварке с нержавейкой для получения ценного сплава, из которого в дальнейшем изготовляют медали, фурнитуру, бижутерию, художественные изделия и инструменты.
- Полутомпак — это сплав, в составе которого цинк варьируется в пределах 10−20%.
 Сфера применения полутомпака аналогична томпаку, но он является менее ценным сплавом.
Сфера применения полутомпака аналогична томпаку, но он является менее ценным сплавом. - Литейная латунь — это сплав, имеющий в составе 50−80% меди, а также примеси иных металлов. Благодаря текучим свойствам используется в изготовлении полуфабрикатов и фасонных изделий методом литья. Обладает низкими показателями распада материалов, устойчив к трению и ржавчине также обладает прекрасными механическими свойствами. Литейную латунь применяют в производстве втулок, фрагментов арматуры, гаек, подшипников и иных фитингов устойчивых к ржавчине.
- Автоматная латунь — это сплав, имеющий в составе свинец, в процентном соотношении не превышающий отметки в 0,8%. Свинец позволяет увеличить скорость обработки изделий за счёт образования короткой стружки. Он выпускается в виде листов, лент и прутков, в дальнейшем из них вытачивают детали часовых механизмов, метизы и гайки.
Достаточно часто латунь путают с бронзой, а многие даже считают, что это один и тот же материал — это в корне неверно. Отличить эти два металла можно и в домашних условиях, для этого необходимо пройти следующий алгоритм действий:
Отличить эти два металла можно и в домашних условиях, для этого необходимо пройти следующий алгоритм действий:
- Хорошо почистить оба материала и рассмотреть их на солнечном свете. Цвет бронзы будет уходить в красный цвет, а латунь в жёлтый, иногда даже в белый.
- Поместив изделие в ёмкость с водой, можно провести анализ на плотность. Молярная масса латуни находится в диапазоне 8350−8750 кг/м.куб, если масса выше, то это бронза.
Применение латуни
Этот медно-цинковый материал податлив и вязок, благодаря этим качествам его активно используют в ковке, машиностроении и других сферах. Под ударами наковальни или молотка латунь принимает любую форму. В зависимости от сферы применения латуни состав сплава в процентном соотношении меняется в соответствии со следующей маркировкой:
- Л80, Л85, Л90, Л96 — элементы приборов, химические и теплотехнические механизмы, змеевики и прочее.
- Л68 — штампованные детали.
- Л70 — пиноль для химической промышленности.

- Л60 — штуцера толстостенные, датели машин и гайки.
- Л63 — элементы для автомобильной промышленности, конденсаторные трубки.
- ЛАЖ60−1−1 — запчасти для морских судов.
- ЛА77−2 — конденсаторные приборы для морских судов.
- ЛАН59−3−2 — элементы химической аппаратуры, морских судов и электромашин.
- ЛН65−5 — трубы конденсаторные и манометрические.
- ЛЖМа59−1−1 — запчасти для самолётов и морских судов, вкладыши подшипников.
- ЛМц58−2 — метизы, гайки, арматура.
- ЛО90−1, ЛО62−1, ЛО70−1, ЛО06−1 — конденсаторные трубы для теплотехнического оборудования.
- ЛМцА57−1−1 — элементы и запчасти для речных и морских судов.
- ЛС74−3, ЛС63−3 — втулки и часовые механизмы.
- ЛК80−3 — коррозионностойкие изделия.
- ЛАНКМц75−2−2,5−0,5−0,5 — пружины и манометрические трубы.
- ЛМш68−0,05 — конденсаторные коллекторы.
Латунь остаётся наиболее востребованным и популярным сплавом, какой бы ни был её состав. При соблюдении технологии производства он не будет ржаветь, чернеть и окисляться.
При соблюдении технологии производства он не будет ржаветь, чернеть и окисляться.
Химический состав
Химические свойства
Возможные степени окисления
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к
диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или
комплексах (например, [Cu(Nh4)2]+). Её соединения бесцветны. Более устойчива степень окисления +2,
которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со
степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11h21)23−,
полученных в 1994 году.
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не
вступает в реакцию с водой и разбавленной соляной кислотой. Переводится враствор
Переводится враствор
кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется
концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами,
халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
2Cu + h3O + CO2 + O2 à Cu2CO3(OH)2↓
Реагирует с концентрированной холодной серной кислотой:
Cu + h3SO1 àCuO + SO2 ↑ + h3O
С концентрированной горячей серной кислотой:
Cu + 2h3SO4 à CuSO4 + SO2 ↑ + 2h3O
- В электротехнике
- Теплообмен
- Для производства труб
- Сплавы
- Сплавы на основе меди
- Сплавы, в которых медь значима
- Ювелирные сплавы
- Соединения меди
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C:
0,01724-0,0180 мкОм·м), медь широко применяется в электротехнике для изготовления силовых и других
кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою
Медные провода, в свою
очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых
трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую
проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость
почти на 10 %.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных
теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известныерадиаторы
охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные
трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во
внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и
холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих
В ряде стран трубы из меди являются основным материалом, применяемым для этих
целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США,
Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р
52318-2005, а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того,
трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для
транспортировки жидкостей и пара.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко
распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими
названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель,
висмут и другие металлы. Например, в состав пушечной бронзы, использовавшейся для изготовления
Например, в состав пушечной бронзы, использовавшейся для изготовления
артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк;
рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на
изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой
пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др.
(а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически
чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют
механических свойств при термической обработке, и их механические свойства и износостойкость
определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов
Модуль упругости медных сплавов
(900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент
трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих
сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред
(медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента
трения практически одинакова у всех медных сплавов, тогда как механические свойства и
износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно,
от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав
(мельхиор) используются для чеканки разменной монеты. Медноникелевые сплавы, в том числе и так
называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов
отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с
возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости. Медь
Медь
является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов
Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения
разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до
жидкостных ракетных двигателей.
Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к
деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим
воздействиям.
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой
для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных
гальванических элементов и батарей.
Формула Меди структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: Cu
Молекулярная масса: 63,546
Медь — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
История
Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий. В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришел на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.
Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий. В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришел на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век. Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди. На Кипре уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.
На смену бронзовому веку относительно орудий труда пришёл железный век. Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди. На Кипре уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г. ). С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике.
). С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике.
Нахождение в природе
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно. Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси). Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси). Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет. Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота. Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4. Медь обладает высокой тепло и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м[15]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком. Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие. Атомная плотность меди (N0) = 8,52*1028(атом/м³).
Тот же механизм отвечает за характерный цвет золота. Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4. Медь обладает высокой тепло и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м[15]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком. Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие. Атомная плотность меди (N0) = 8,52*1028(атом/м³).
Изотопы меди
Природная медь состоит из двух стабильных изотопов — 63Cu и 65Cu с распространённостью 69,1 и 30,9 атомных процентов соответственно. Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа.
Получение
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырье содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°. Затем обожженный концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём. Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди. Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди. Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
Химические свойства
Возможные степени окисления
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
- На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины)
- Реагирует с концентрированной холодной серной кислотой
- С концентрированной горячей серной кислотой
- С безводной горячей серной кислотой
- C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха
- С концентрированной азотной кислотой
- С разбавленной азотной кислотой
- С «царской водкой»
- С концентрированной горячей соляной кислотой
- C разбавленной хлороводородной кислотой в присутствии кислорода
- С газообразным хлороводородом при 500—600 °C
- С бромоводородом
- Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода
- Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов
- Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C
- Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре
- При 300—400 °C реагирует с серой и селеном
- С концентрированной соляной кислотой и хлоратом калия
Соединения меди(I)
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства. Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов. Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют. В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]— устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I). Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I).
Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства. Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов. Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют. В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]— устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I). Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I).
Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет: Гидроксид меди (II) носит преимущественно основный характер и только в концентрированной щелочи частично растворяется с образованием синего гидроксокомплекса. Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, при которой образуется так называемый реактив Швейцера (растворитель целлюлозы). Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску. Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга). Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, при которой образуется так называемый реактив Швейцера (растворитель целлюлозы). Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску. Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга). Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Аналитическая химия меди
Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
- Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этом сульфид меди выпадает в далее взвешиваемый осадок.
- В растворах, при отсутствии мешающих ионов, медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими и спектральными методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C: 0,01724-0,0180 мкОм·м/), медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %.
Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Для производства труб
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005[18], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы на основе меди
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель, висмут и другие металлы. Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия.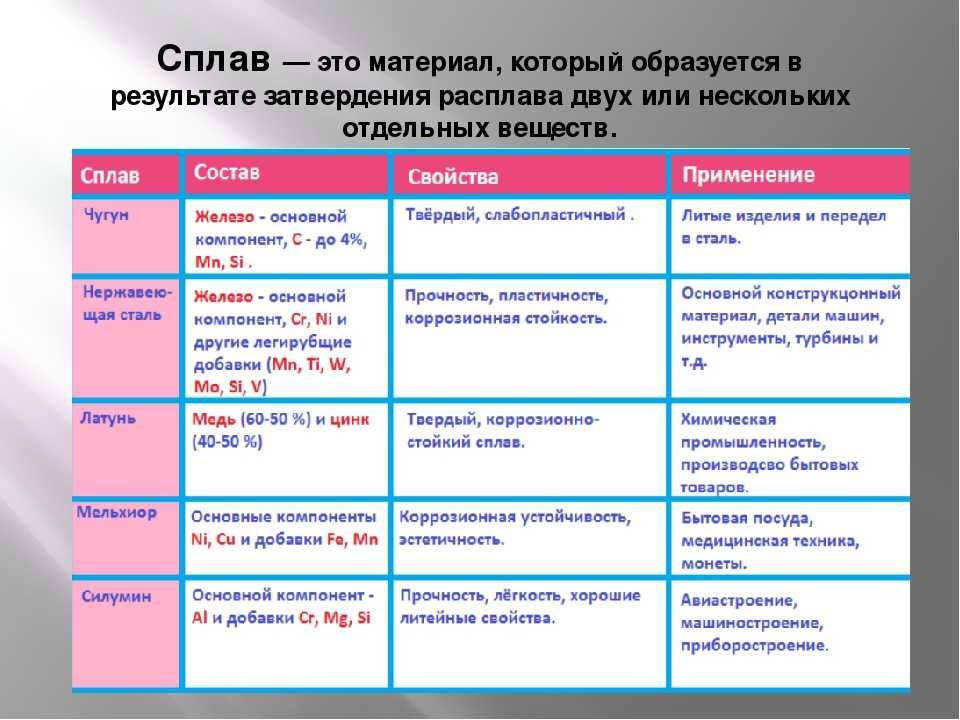 Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры.
Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[19]. Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости. Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[19]. Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости. Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Сплавы, в которых медь значима
Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %. Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006. Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека. Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 510 и 578 нм.
Стоимость
В январе 2008 года, впервые за всю историю, на Лондонской бирже металлов цены на медь превысили 8000 долларов США за тонну. В начале июля цены возросли до 8940 долларов за тонну, что стало абсолютным рекордом начиная с 1979 года — момента начала ведения торгов на ЛБМ. Цена достигла пика в почти 10,2 тыс. долл. в феврале 2011 г. На 2011 год стоимость меди составляет около $8900 за тонну. Вследствие торможения мировой экономики цена на большинство видов сырья упала, и стоимость 1 тонны меди на 1 сентября 2016 не превышает $4700.
В начале июля цены возросли до 8940 долларов за тонну, что стало абсолютным рекордом начиная с 1979 года — момента начала ведения торгов на ЛБМ. Цена достигла пика в почти 10,2 тыс. долл. в феврале 2011 г. На 2011 год стоимость меди составляет около $8900 за тонну. Вследствие торможения мировой экономики цена на большинство видов сырья упала, и стоимость 1 тонны меди на 1 сентября 2016 не превышает $4700.
Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных. Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день. При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день. При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 1 мг/л (СанПиН 2.1.4.1074-01), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка». В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта. Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Было признано, что медь не является причиной расстройств пищеварительного тракта. Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»).
Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»).
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет. Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:
Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет. Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:
| Компания | Тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 |
| Уралэлектромедь | 351 | 37 |
| Русская медная компания | 166 | 18 |
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское». Мировое производство меди в 2007 году составляло 15,4 млн т, а в 2008 году — 15,7 млн т. Лидерами производства были:
- Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.
 ),
), - США (1,170/1,310),
- Перу (1,190/1,220),
- КНР (0,946/1,000),
- Австралия (0,870/0,850),
- Россия (0,740/0,750),
- Индонезия (0,797/0,650),
- Канада (0,589/0,590),
- Замбия (0,520/0,560),
- Казахстан (0,407/0,460),
- Польша (0,452/0,430),
- Мексика (0,347/0,270).
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия. Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается, что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Современные способы добычи
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили. 90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди. Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили. 90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди. Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига. После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки — 1450 °C. С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине. Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование).
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки — 1450 °C. С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине. Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования. Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования. Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Влияние на экологию
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в кратере медного рудника.
Самое токсичное озеро в мире — Беркли Пит — образовалось в кратере медного рудника.
Интересные факты
- Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 см по сторонам и 0,5 мм толщиной. Данная монета ходила по всему западному побережью Южной Америки, в том числе и в государстве Инков.
- В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких».
- Инструменты, изготовленные из меди и её сплавов, не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства).
- В организме взрослого человека содержится до 80 мг меди.
- Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными размерами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов.
Формулы состава твердорастворных сплавов, полученные из химико-ближних порядков
Реферат
Твердые растворы являются основой для большинства промышленных сплавов. Однако связи между характерными для них ближними порядками и химическим составом не установлены. В настоящей работе параметр Коули α сочетается с нашей моделью кластер плюс атом клея для точного определения химических единиц бинарных сплавов твердого раствора гранецентрированного кубического типа. Химическая единица несет информацию об атомной структуре и химическом составе, что объясняет преобладающие промышленные сплавы. Например, химические единицы в Cu 68,9 Zn 31.1 сплав с α 1 =-0,137 сформулированы как [Zn-Cu 10 Zn 2 ] Zn 2 CU 2 и [Zn-Cu Zn 2 ]Zn 3 Cu 1 , с 64,0–70,0 мас.% Cu, что соответствует наиболее широко используемой патронной латуни C26000 (68,5–71,5 Cu). Эта работа отвечает на давний вопрос о происхождении состава промышленных сплавов на основе твердых растворов, прослеживая молекулярные химические единицы, участвующие в химическом ближнем упорядочении в твердых растворах.
Однако связи между характерными для них ближними порядками и химическим составом не установлены. В настоящей работе параметр Коули α сочетается с нашей моделью кластер плюс атом клея для точного определения химических единиц бинарных сплавов твердого раствора гранецентрированного кубического типа. Химическая единица несет информацию об атомной структуре и химическом составе, что объясняет преобладающие промышленные сплавы. Например, химические единицы в Cu 68,9 Zn 31.1 сплав с α 1 =-0,137 сформулированы как [Zn-Cu 10 Zn 2 ] Zn 2 CU 2 и [Zn-Cu Zn 2 ]Zn 3 Cu 1 , с 64,0–70,0 мас.% Cu, что соответствует наиболее широко используемой патронной латуни C26000 (68,5–71,5 Cu). Эта работа отвечает на давний вопрос о происхождении состава промышленных сплавов на основе твердых растворов, прослеживая молекулярные химические единицы, участвующие в химическом ближнем упорядочении в твердых растворах.
Введение
В одном из ранних обзоров твердых растворов 1925 года Бруни 1 поднял предварительный вопрос: продолжает ли химическая молекула существовать в кристаллическом состоянии? Этот вопрос в настоящее время выглядит довольно наивным, но ответ на него должен быть дан в его время, так как большинство металлов основаны на твердых растворах и все они имеют определенный химический состав, как и любое молекулярное вещество, химия которого заключена в молекулярной структуре. Первые результаты рентгеновских анализов по Брэггу 2 ответил на этот вопрос отрицательно, утверждая, что внутри строения кристалла существуют только атомы, а молекула исчезает в решетке. Однако структурное происхождение химических составов промышленных сплавов остается открытым. Ключ к пониманию тайны состава должен лежать в структуре твердых растворов, которая была горячей темой в начале двадцатого века. Брэгг и Уильямс были одними из первых, кто предложил статистическую модель, которая рассматривает порядок и беспорядок в твердых растворах как совместное явление дальнего действия 3 . Затем эта модель была расширена Бете 4 до более сложной теории, предполагающей короткодействующее взаимодействие в ближайшем окружении. Дальний и ближний порядок хорошо объединены в параметрах α i Коули 5 ближнего порядка, выражающих взаимодействие данного атома A с атомами i -й оболочки атомов, окружающих его :
Затем эта модель была расширена Бете 4 до более сложной теории, предполагающей короткодействующее взаимодействие в ближайшем окружении. Дальний и ближний порядок хорошо объединены в параметрах α i Коули 5 ближнего порядка, выражающих взаимодействие данного атома A с атомами i -й оболочки атомов, окружающих его :
$$\alpha_{{\text{i}}} = 1 — \frac{{n_{i}}}{{m_{B} c_{i} }}$$
(1)
где n i – число атомов B среди c i атомов i -й оболочки, а m B – доля атомов B в молях A Бинарный сплав –Б. Уравнения для параметра дальнего порядка Брэгга и Вильямса получаются при рассмотрении предельного случая i очень большим. С тех пор хорошо известно, что ближний порядок является основной структурной особенностью твердых растворов.
В попытке исследовать происхождение состава, подразумеваемое такими упорядоченными и неупорядоченными локальными структурами, наша команда занималась разработкой так называемой модели «кластер плюс атом клея» 6,7,8 , которая упрощает любую порядок диапазона в локальную единицу, охватывающую кластер ближайшего соседа плюс несколько атомов клея следующего соседа, выраженную в форме формулы кластера как [кластер] (атомы клея). Эта структурная единица, демонстрирующая нейтральность заряда и среднюю плотность после осцилляции Фриделя 9 , во многом напоминает химические молекулы и в дальнейшем называется «химической единицей» 7 . Единственное отличие от общепринятого понятия молекулы заключается в способе разделения химических звеньев: вместо относительно слабых межмолекулярных сил между молекулами здесь химические звенья связаны химической связью. Анализируя многие промышленные сплавы, мы показали, что все популярные сплавы основаны на простых формулах кластер плюс атом клея, например [Zn-Cu 12 ]Zn 4 для Cu-30Zn, [Ni-Fe 12 ]Cr 2 (Ni,Nb,Ti) для мартенситностареющей нержавеющей стали Custom465 и т. д. 7 .
Эта структурная единица, демонстрирующая нейтральность заряда и среднюю плотность после осцилляции Фриделя 9 , во многом напоминает химические молекулы и в дальнейшем называется «химической единицей» 7 . Единственное отличие от общепринятого понятия молекулы заключается в способе разделения химических звеньев: вместо относительно слабых межмолекулярных сил между молекулами здесь химические звенья связаны химической связью. Анализируя многие промышленные сплавы, мы показали, что все популярные сплавы основаны на простых формулах кластер плюс атом клея, например [Zn-Cu 12 ]Zn 4 для Cu-30Zn, [Ni-Fe 12 ]Cr 2 (Ni,Nb,Ti) для мартенситностареющей нержавеющей стали Custom465 и т. д. 7 .
Однако, несмотря на доказанную способность модели «кластер плюс атом клея» интерпретировать происхождение состава сплавов, существует очевидный разрыв между идеализированными формулами (например, ближайшие соседи всегда полностью заняты атомами растворителя, такими как [Zn-Cu 12 ]Zn 4 ) и реальный химический ближний порядок (ближайшие соседи всегда смешанно-заселенные), который можно измерить, например, с помощью параметра α и . Параметр α и описывает статистическое отклонение от среднего состава сплава в каждой оболочке повторного циферблата. Отклонение состава проявляется наиболее заметно у первого и второго ближайших соседей, что полностью согласуется с картиной модели кластер плюс атом клея, которая также охватывает тот же радиальный диапазон. Настоящая работа является нашей первой попыткой восполнить пробел, показав, как связаны измеряемые параметры α i , в рамках модели кластер плюс атом клея, к построению формул состава типичных бинарных сплавов твердых растворов с гранецентрированной кубической (ГЦК) структурой.
Параметр α и описывает статистическое отклонение от среднего состава сплава в каждой оболочке повторного циферблата. Отклонение состава проявляется наиболее заметно у первого и второго ближайших соседей, что полностью согласуется с картиной модели кластер плюс атом клея, которая также охватывает тот же радиальный диапазон. Настоящая работа является нашей первой попыткой восполнить пробел, показав, как связаны измеряемые параметры α i , в рамках модели кластер плюс атом клея, к построению формул состава типичных бинарных сплавов твердых растворов с гранецентрированной кубической (ГЦК) структурой.
Теоретические методы
Сначала мы кратко рассмотрим основы, которые приводят к химическим единицам, как подробно описано в ссылке 7 . Ближний порядок формируется за счет экранирования заряда вокруг любого данного атома, что создает колебательное распределение электронной плотности, а именно осцилляции Фриделя 9{{3}}\), ощущаемый электронами на радиальном расстоянии r , периодически затухает в третьей степени r , где k F волновой вектор Ферми. Это колебательное поведение электронов, в свою очередь, вызывает такое же колебание атомной плотности г ( r ) в реальном пространстве, которое заметно в коротком диапазоне r , особенно в ближайших и следующих за ближайшими окрестностях. Местная химическая единица определяется с использованием расстояния отсечки нейтрального заряда, равного 1,76·9.0005 λ Fr , λ Fr = π/ k F ближайший кластер Фриделя-борна, который заключает в себе несколько атомов, граничащих с длиной волны по Фриделю. Для структуры FCC ее модель кластера плюс атома клея показана на рис. 1b, кластер представляет собой кубооктаэдр с координационным числом 12, а оболочка атома клея в соседней окрестности представляет собой октаэдр с координацией 6. Твердый раствор тогда рассматривается как случайная упаковка таких единиц, как схематично показано на рис. 1a. Химическая единица бинарной системы A–B выражается в форме кластерной формулы как [AM 12 ] A x B Y , где M 12 = B N 1 A 12- N 1 Относится к среднему среднему атомам ближайшего награда и Integer.
Это колебательное поведение электронов, в свою очередь, вызывает такое же колебание атомной плотности г ( r ) в реальном пространстве, которое заметно в коротком диапазоне r , особенно в ближайших и следующих за ближайшими окрестностях. Местная химическая единица определяется с использованием расстояния отсечки нейтрального заряда, равного 1,76·9.0005 λ Fr , λ Fr = π/ k F ближайший кластер Фриделя-борна, который заключает в себе несколько атомов, граничащих с длиной волны по Фриделю. Для структуры FCC ее модель кластера плюс атома клея показана на рис. 1b, кластер представляет собой кубооктаэдр с координационным числом 12, а оболочка атома клея в соседней окрестности представляет собой октаэдр с координацией 6. Твердый раствор тогда рассматривается как случайная упаковка таких единиц, как схематично показано на рис. 1a. Химическая единица бинарной системы A–B выражается в форме кластерной формулы как [AM 12 ] A x B Y , где M 12 = B N 1 A 12- N 1 Относится к среднему среднему атомам ближайшего награда и Integer. x + y представляет количество атомов клея с 0 < x + Y <6.
x + y представляет количество атомов клея с 0 < x + Y <6.
Рисунок 1
( A ) Схематическая диаграмма краткосрочного порядка и распределения распределения на расстройство долгосрочного распределения. растворенных атомов в бинарных сплавах твердых растворов. ( 9{3} $$
(2)
, где R A/M и R B/M соответственно соответственно R A и R B Over \ (R_{M} = (n_{1} \cdot R_{B} + (12 — n_{1} ) \cdot R_{A} )/12\). Обычно принимаются радиусы атомов Гольдшмидта. Когда R A = R B , x + y = 3, что означает 16-атомную кластерную формулу растворителя, равного или радиального твердого раствора ГЦК [А–Б 12 ](А,В) 3 .
Как показано в ссылках 7,14,15 , составы широко используемых промышленных сплавов, таких как сплавы меди, сплавы алюминия, нержавеющие стали и суперсплавы на основе никеля, близки к предсказаниям модели, подтверждая наличие простых химических единиц. в металлических сплавах и общность кластерного формулизма. Наша недавняя работа 16 показывает, что модель также применима к высокоэнтропийным сплавам после соответствующей элементной классификации. Аналогично можно рассматривать и твердые растворы гексагонального типа с закрытой упаковкой, поскольку они имеют такое же координационное число, равное 12 (ближайший кластер — сдвоенный октаэдр), и также являются плотно упакованными. Объемно-центрированную кубическую структуру с ромбододекаэдрическим кластером с координационным числом 14 и неплотной упаковкой следует рассматривать отдельно, работа над которой продолжается.
в металлических сплавах и общность кластерного формулизма. Наша недавняя работа 16 показывает, что модель также применима к высокоэнтропийным сплавам после соответствующей элементной классификации. Аналогично можно рассматривать и твердые растворы гексагонального типа с закрытой упаковкой, поскольку они имеют такое же координационное число, равное 12 (ближайший кластер — сдвоенный октаэдр), и также являются плотно упакованными. Объемно-центрированную кубическую структуру с ромбододекаэдрическим кластером с координационным числом 14 и неплотной упаковкой следует рассматривать отдельно, работа над которой продолжается.
Теперь мы показываем две основные процедуры в направлении построения химической единицы с формулой [A- B N 1 A C 1- N 1 ] A x B Y ] A x B Y ] A x Y ] x Y ] A x 1 ] x B 1 ] A x B 1 ] B 1 ] B 1 ] с использованием параметра ближнего порядка α 1 .
- (1)
Определение ближайших атомов с помощью α 1
Для данного сплава с известной атомной долей В m B и координационным числом c 1 число атомов В в ближайшей оболочке, 0 8,0 0 1 900 полученное непосредственно с использованием измеренного значения α 1 по уравнению (1):
$$n_{1} = m_{B} \cdot c_{1} \cdot \left( {1 — \alpha_{1} } \right)$$
(3)
п 1 значение должно быть аппроксимировано ближайшим целым числом. Когда параметр ближнего порядка α 1 отрицателен, целое число представляет собой округление n 1 , поскольку атомы B имеют тенденцию к обогащению в ближайшей соседней оболочке из-за режима притяжения между центральный атом А и соседние атомы В. В качестве альтернативы, когда α 1 положительно, целое число представляет собой сокращение n 1 .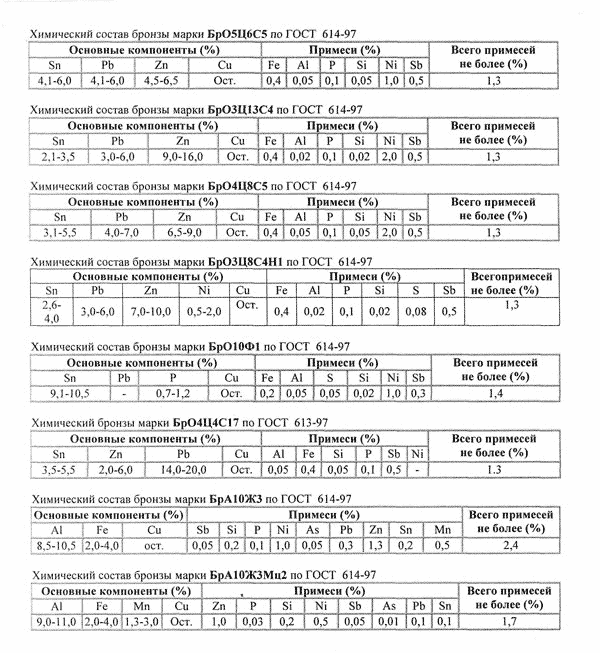
- (2)
Расчет атомов клея следующего соседа по уравнению. (2)
Путем введения в формулу. (2) атомные отношения R A/M и R B/M , установлена связь между x и y . Это соотношение должно согласовываться и с составом сплава, т.е.0005 г ) = м Б . Для FCC решение ( x , y ) также ограничено 0 < x + y < 6. получают два набора близких целых чисел, так что измеренный состав сплава находится между двумя химическими единицами.
Эти процедуры будут подробно описаны при анализе типичных примеров популярных бинарных медных сплавов в следующем.
Примеры бинарных сплавов Cu
Сплав Cu-30Zn
Хотя промышленные бинарные сплавы Cu-Zn охватывают диапазон цинка до ~ 40 % масс., Cu-30Zn или патронная латунь является наиболее широко используемой маркой. Параметры α и , достигающие нескольких десятков оболочек, точно измерены в монокристалле Cu 68,9 Zn 31,1 методом упругой дифракции нейтронов с использованием изотопа 65 30036 30036 Cu 30039 3009 На протяжении всей статьи число в нижнем индексе после элемента указывает на атомную долю или процентное содержание, а число перед элементом представляет собой весовой процент. Измеренное α 1 = − 0,137 указывает на то, что элемент в центре кластера имеет тенденцию быть ближайшим соседом другого элемента, что согласуется с отрицательной энтальпией смешения (Δ H Cu-Zn = − 6 кДж /моль) 18 . В соответствии с общей кластерной формулой бинарных ГЦК твердых растворов [A-M 12 ]A x B y , растворенный Zn расположен в центре кластера и ближайший к нему c 1 = 12 атомов, обогащенных в растворителе Cu, что приводит к кластерной формуле [Zn-Cu N 1 Zn 12- N 1 ] Zn x CU Y = [ Zn-M 12 ]Zn x Cu y , где M — усредненный атом ближайшего соседа.
Параметры α и , достигающие нескольких десятков оболочек, точно измерены в монокристалле Cu 68,9 Zn 31,1 методом упругой дифракции нейтронов с использованием изотопа 65 30036 30036 Cu 30039 3009 На протяжении всей статьи число в нижнем индексе после элемента указывает на атомную долю или процентное содержание, а число перед элементом представляет собой весовой процент. Измеренное α 1 = − 0,137 указывает на то, что элемент в центре кластера имеет тенденцию быть ближайшим соседом другого элемента, что согласуется с отрицательной энтальпией смешения (Δ H Cu-Zn = − 6 кДж /моль) 18 . В соответствии с общей кластерной формулой бинарных ГЦК твердых растворов [A-M 12 ]A x B y , растворенный Zn расположен в центре кластера и ближайший к нему c 1 = 12 атомов, обогащенных в растворителе Cu, что приводит к кластерной формуле [Zn-Cu N 1 Zn 12- N 1 ] Zn x CU Y = [ Zn-M 12 ]Zn x Cu y , где M — усредненный атом ближайшего соседа.
Во-первых, количество атомов Cu n 1 в оболочке ближайшего соседа рассчитывается как α 1 по уравнению. (3): n 1 = 0,689·12·(1 + 0,137) = 9,40, что далее округляется до целого числа 10 в соответствии с режимом отрицательного взаимодействия между Zn и Cu. Тогда химическая единица принимает вид [Zn-Cu 10 Zn 2 ]Zn x Cu y с M = Cu 10/12
Во-вторых, соотношение между x и y рассчитывается путем введения R Zn/M и R Cu/M в уравнение (2): 1,23 x + 0,96 y = 4,53. Атомные радиусы Голдшмидта 19 — R Zn = 1,39 Å и R CU = 1,28 Å, R M = (10 R CU +2 666 = (10 R CU +2 66667 Z 7 Z 7. )/12 = 1,30 Å, так что R A/M = 1,39/1,30 = 1,07 и R B/M = 1,30/1,28/1,28/1,07 В сочетании с составом сплава M B = (10+ Y )/(13+ x + Y ) = 0,689, уникальное ( x , y ) решение (2,3, 1,8). Близкие целые числа — это (2, 2) и (3, 1). Затем химические единицы корпоспоминга являются [Zn-Cu 10 Zn 2 ] Zn 2 CU 2 = CU 12 Zn 5 = CU 70,59 ZN 29,41 = CU-30.01111. мас.%) и [Zn-Cu 10 Zn 2 ]Zn 3 Cu 1 = Cu 11 Zn 6 = Cu 64,71 Zn 35,29 = Cu-35,96Zn. Состав сплава Cu 68,9 Zn 31,1 как раз находится между двумя составами химических единиц. Соответствующий массовый процент 64,04–69,99 мас.% Cu точно соответствует наиболее широко используемой патронной латуни C26000 (номинальное 70Cu–30Zn, с указанными диапазонами составов 68,5–71,5 Cu, 0,05 Fe макс., 0,07 Pb макс., 0,15 макс. другие (всего) , бал Zn) 20 .
Близкие целые числа — это (2, 2) и (3, 1). Затем химические единицы корпоспоминга являются [Zn-Cu 10 Zn 2 ] Zn 2 CU 2 = CU 12 Zn 5 = CU 70,59 ZN 29,41 = CU-30.01111. мас.%) и [Zn-Cu 10 Zn 2 ]Zn 3 Cu 1 = Cu 11 Zn 6 = Cu 64,71 Zn 35,29 = Cu-35,96Zn. Состав сплава Cu 68,9 Zn 31,1 как раз находится между двумя составами химических единиц. Соответствующий массовый процент 64,04–69,99 мас.% Cu точно соответствует наиболее широко используемой патронной латуни C26000 (номинальное 70Cu–30Zn, с указанными диапазонами составов 68,5–71,5 Cu, 0,05 Fe макс., 0,07 Pb макс., 0,15 макс. другие (всего) , бал Zn) 20 .
Cu-8Al алюминиевая бронза
In Cu 85 Al 15 , α 1 = − 0,17 измеряется методом диффузного рассеяния рентгеновских лучей в диапазоне углов от 8° до 60° 6 21 приводит к n 1 = 11,93 ≈ 12 и к химической единице [Al-Cu 12 ]Al x Cu y
6
6 . Используя R Al = 1,43 Å и R Al/Cu = 1,12, и в соответствии с составом сплава, ( x , y ) решение равно (1,69, 3,23) и близкие целые числа (2, 3) и (1, 4). Химическая единица корпоспоминга: [AL-CU 12 ] AL 2 CU 3 = CU 15 AL 3 = CU 83,33 AL 16,67 = CU-73AL и [AL-CU 12 ]Al 1 Cu 4 = Cu 16 Al 2 = Cu 88,89 Al 11,8 4C=,11,11 9000 Массовая доля атомов Al колеблется от 5,04 до 7,83, что объясняет наиболее популярный C61000 (92Cu-8Al с диапазоном составов 6,0–8,5 Al, не более 0,05 Fe, не более 0,02 Pb, не более 0,20 Zn, не более 0,10 Si, не более 0,50 прочие (всего), бал. Cu) 20 .
Используя R Al = 1,43 Å и R Al/Cu = 1,12, и в соответствии с составом сплава, ( x , y ) решение равно (1,69, 3,23) и близкие целые числа (2, 3) и (1, 4). Химическая единица корпоспоминга: [AL-CU 12 ] AL 2 CU 3 = CU 15 AL 3 = CU 83,33 AL 16,67 = CU-73AL и [AL-CU 12 ]Al 1 Cu 4 = Cu 16 Al 2 = Cu 88,89 Al 11,8 4C=,11,11 9000 Массовая доля атомов Al колеблется от 5,04 до 7,83, что объясняет наиболее популярный C61000 (92Cu-8Al с диапазоном составов 6,0–8,5 Al, не более 0,05 Fe, не более 0,02 Pb, не более 0,20 Zn, не более 0,10 Si, не более 0,50 прочие (всего), бал. Cu) 20 . CU-20NI Alloy
в CU 80 NI 20 , значение α 1 , измеренное с помощью диффузного рассеяния нейтрона с использованием 65 ISOTOP склонность одного и того же элемента к соседству. Количество атомов Cu в ближайшей оболочке, рассчитанное с использованием α 1 равно 10 и соответствующая химическая единица [Cu-Cu 10 Ni 2 ]Cu x Ni
Количество атомов Cu в ближайшей оболочке, рассчитанное с использованием α 1 равно 10 и соответствующая химическая единица [Cu-Cu 10 Ni 2 ]Cu x Ni
6 y
Используя R Ni = 1,25 Å, близкие целые ( x , y ) решения представляют собой (2, 1) и (1, 2), что соответствует химическим единицам [Cu-Cu 10 Ni 2 ]Cu 2 Ni 1 = Cu 13 Ni 3 = Cu 81,25 Ni 18,75 = Cu-17.57ni и [Cu-Cu 10 Ni 2 ] Cu 1 Ni 2 = CU 12 NI 4 = CU 75,00 NI 25,008 = C 23.54Ни. Диапазон от 17,57 до 23,54 атомов никеля объясняет сплав C71000 (80Cu-20Ni, заданные диапазоны: 19–23 Ni, 0,05 макс. Pb, 1,00 Fe, 1,0 макс. Zn, 1,00 Mn, 0,5 макс. другие (всего), bal Cu) , которые обычно используются в качестве конденсаторов, конденсаторных пластин и электрических пружин 20 .
Cu-2Be бериллиевая бронза
In Cu 89,1 Be 10,9 сплав, α 1 = + 0,077, измерено с помощью диффузионного рентгеновского рассеяния, что свидетельствует о соседстве с одним и тем же элементом 3 5 2. В рамках [CU-M 12 ] CU x BE Y , количество атомов Cu N 1 -10,79, как рассчитывается из α 1 и приблизится к 10,79. в целое число 11. Используя M = Cu 11/12 Be 1/12 и R Be = 1,13 Å, близкое целое ( x , y ) решение равно (2, 1) и (3, 0), что приводит к химическим единицам [Cu- CU 11 BE 1 ] CU 2 BE 1 = CU 14 BE 2 = CU 87,50 BE 12,50 = CU-1,99BE и [CU-CU 11 BE 1 ]Cu 3 = Cu 15 Be 1 = Cu 93,75 Be 6,25 = Cu-0,94. Этот диапазон объясняет сплав C17200 (от 1,8 до 2,0 Be, минимум 0,20 Ni + Co, максимум 0,6 Ni + Co + Fe, максимум 0,10 Pb, максимум 0,5 другого (всего), bal Cu), который является наиболее популярным сплавом Cu-Be для проявляя высокую прочность и эластичность 20 .
Этот диапазон объясняет сплав C17200 (от 1,8 до 2,0 Be, минимум 0,20 Ni + Co, максимум 0,6 Ni + Co + Fe, максимум 0,10 Pb, максимум 0,5 другого (всего), bal Cu), который является наиболее популярным сплавом Cu-Be для проявляя высокую прочность и эластичность 20 .
Следует подчеркнуть, что все приведенные выше примеры сплавов относятся к промышленным маркам, наиболее часто используемым в каждой системе сплавов. Дополнительные примеры приведены в таблице 1, где большинство химических единиц объясняют общепринятые промышленные спецификации. Исключением являются формулы для сплавов Ni 80 Cu 20 и Ni 60 Cu 40 , что свидетельствует о том, что не все формулы соответствуют хорошим сплавам, но верно и обратное: широко используемые промышленные сплавы всегда удовлетворяют специфическим кластерным формулам, т.к. это необходимо для достижения состояний гомогенизации растворенных веществ.
Таблица 1 Химические единицы типичных бинарных сплавов на основе твердого раствора с ГЦК-структурой, полученные путем объединения измеренного параметра Коули α 1 из ссылок. 17,21,22,23,24,26 и модель кластер плюс атом клея.
17,21,22,23,24,26 и модель кластер плюс атом клея.
Полноразмерная таблица
Следует напомнить, что параметры ближнего порядка, такие как параметр Коули α, чувствительны к параметрам обработки, особенно к температуре 27 . В принципе, параметры ближнего порядка следует измерять в сплавах, отожженных вблизи критической температуры, когда дальний порядок полностью исчезает и атомное распределение стремится к стохастически стабильному 28,29 . Однако критическая температура в данном сплаве обычно неизвестна. Следовательно, измеренные параметры α следует более правильно рассматривать как тенденцию, по которой атомы распределяются между ближайшими соседними узлами и ближайшими соседними связующими узлами в молекулярно-подобной химической единице. Поэтому, например, латунь Cu-30Zn можно также связать с кластерной формулой [Zn-Cu 12 ]Zn 4 , как мы ранее предлагали 7 , что можно рассматривать как крайний случай, когда отрицательное модель взаимодействия Zn и Cu полностью соблюдается, хотя эта формула эквивалентна [Zn-Cu 10 Zn 2 ]Zn 2 Cu 2 рассчитано по измеренному α 1 .
Наконец, следует подчеркнуть, что настоящая работа представляет собой комбинацию нашей теоретической модели с измеримыми параметрами, такими как хорошо зарекомендовавший себя коэффициент Коули α 1 . Это усилило способность нашей модели интерпретировать составы сплавов. Однако подход, развиваемый в настоящей работе, не может быть легко распространен на многокомпонентные системы (здесь мы ограничиваемся только бинарными системами), где как теоретическое описание, так и экспериментальное измерение ближнего порядка весьма затруднены. Отмечено, что в последнее десятилетие возрождаются исследования ближнего порядка, особенно в высокоэнтропийных сплавах 30,31,32,33 . Информация, полученная с помощью сложных методов измерения и компьютерного моделирования, несомненно, обогатит наши знания о химическом ближнем упорядочении. Нашей будущей целью должно стать использование современных данных для работы со сложными по составу сплавами.
Выводы
Подводя итог, можно сказать, что после объединения измеренных параметров ближнего порядка с нашей моделью «кластер плюс атом клея» мы можем построить химические единицы, подобные молекулам, которые интерпретируют состав существующих промышленных сплавов в соответствии со стандартными марками. . Эта работа отвечает на давний вопрос о происхождении состава промышленных сплавов на основе твердых растворов, прослеживая молекулярные химические единицы, участвующие в химическом ближнем упорядочении в твердых растворах.
. Эта работа отвечает на давний вопрос о происхождении состава промышленных сплавов на основе твердых растворов, прослеживая молекулярные химические единицы, участвующие в химическом ближнем упорядочении в твердых растворах.
Наличие данных
Авторы заявляют, что основные данные, подтверждающие результаты этого исследования, содержатся в документе. Все остальные соответствующие данные можно получить у соответствующего автора по разумному запросу.
Ссылки
Бруни Г. Твердые растворы. Хим. 1 , 345 (1925).
КАС
Статья
Google ученый
Брэгг, У. Х. Значение кристаллической структуры. J. Chem. соц. Транс. 121 , 2766–2787 (1922).
КАС
Статья
Google ученый
Брэгг, В. Л. и Уильямс, Э. Дж. Влияние термического перемешивания на расположение атомов в сплавах. Проц. Р. Соц. Лонд. А 145 , 699–730 (1934).
Дж. Влияние термического перемешивания на расположение атомов в сплавах. Проц. Р. Соц. Лонд. А 145 , 699–730 (1934).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Бете, Х. А. Статистическая теория сверхрешеток. Проц. Р. Соц. Лонд. А 150 , 552–575 (1935).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Коули, Дж. М. Приближенная теория порядка в сплавах. Физ. Ред. 77 , 669–675 (1950).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Донг, К. и др. От кластеров к фазовым диаграммам: правила состава квазикристаллов и объемных металлических стекол. J. Phys. Д. 40 , R273 (2007).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
- «>
Донг Д., Ван К., Донг К. и Них Т. Молекулоподобные химические соединения в металлических сплавах. науч. Китай Матер. 20 , 1–9 (2021).
Google ученый
Jiang, B., Wang, Q., Dong, C. & Liaw, P. Исследование эволюции фазовой структуры, вызванной легирующими элементами в сплавах Ti, с помощью модели кластеров химического ближнего порядка. Науч. Респ. 9 , 3404 (2019).
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Harrison, W. Теория твердого тела (McGraw-Hill, 1970).
Google ученый
Фридель Дж. Электронная структура первичных твердых растворов в металлах. Доп. физ. 3 , 446-507 (1954).
ОБЪЯВЛЕНИЯ
Статья
Google ученый
- «>
Friedel, J. Металлические сплавы. Нуово Чименто 7 , 287–311 (1958).
Артикул
Google ученый
Häussler, P. Взаимосвязи между атомными и электронными структурами — жидкие и аморфные металлы как модельные системы. Физ. Респ. 222 , 65–143 (1992).
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Хан, Г. и др. Значения e/a идеальных металлических стекол по отношению к формулам кластеров. Acta Mater. 59 , 5917–5923 (2011).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Чен, К., Ван, К., Донг, К., Чжан, Ю. и Донг, Х. Правила состава монокристаллических жаропрочных сплавов на основе никеля и их влияние на свойства ползучести с помощью кластерной формулы. науч. Отчет 10 , 21621 (2020).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Вен Д. и др. Разработка нержавеющих сталей Fe-25Cr-22Ni для оболочек твэлов с высокой микроструктурной стабильностью путем легирования Mo/Nb/Ti/Ta/W. Матер. науч. англ. А 719 , 27–42 (2018).
КАС
Статья
Google ученый
Ма, Ю. и др. Новый магнитомягкий многоосновной сплав на основе B2 с однородным распределением когерентных объемно-центрированных кубических нанопреципитатов. Доп. Матер. 33 , 2006723 (2021).
КАС
Статья
Google ученый
Райнхард Л., Шёнфельд Б., Косторц Г. и Бюрер В. Ближний порядок в α-латуни. Физ. Ред. B 41 , 1727–1734 (1990).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
- «>
Takeuchi, A. & Inoue, A. Классификация сыпучих металлических стекол по разнице в размерах атомов, теплоте смешения и периоду составляющих элементов и ее применение для характеристики основного легирующего элемента. Матер. Транс. 46 , 2817–2829 (2005).
КАС
Статья
Google ученый
Гаскелл, П. О плотности стекол переходный металл-металлоид. Акта Металл. 29 , 1203–1211 (1981).
Google ученый
Дэвис, Дж. Р. Справочник ASM, том 2: Свойства и выбор: цветные сплавы и материалы специального назначения (ASM International, 1998).
Кулиш Н., Петренко П. Ближний порядок в бинарных твердых растворах. Порядок и его изменение при нагреве в сплавах Fe-Al, Cu-Al и Ag-Al. Физ. Состояние Solidi A 120 , 315–326 (1990).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
- «>
Vrijen, J. & Radelaar, S. Кластеризация в сплавах Cu-Ni: исследование диффузного рассеяния нейтронов. Физ. Rev. B. 17 , 409–421 (1978).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Ку, Ю., Коэн, Дж., Шапиро, С. и Таннер, Л. Закалка АС Cu-10,9 ат.% Be. Акта Металл. 36 , 591–604 (1988).
КАС
Статья
Google ученый
Schweika, W. & Haubold, H. Рассеяние нейтронов и исследование методом Монте-Карло ближнего порядка и взаимодействия атомов в Ni 0,89 Cr 0,11 . Физ. Rev. B. 37 , 9240–9248 (1988).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Бокоч С. М., Татаренко В. А. Межатомные взаимодействия в ГЦК сплавах Ni-Fe. Усп. Физ. Встретились. 11 , 413–450 (2010).
КАС
Статья
Google ученый
Jiang, X., Ice, G.E., Sparks, C.J., Robertson, L. & Zschack, P. Локальный атомный порядок и смещения отдельных пар Fe 46,5 Ni 53,5 и Fe 70007 22,5 7 Ni
из исследований диффузного рассеяния рентгеновских лучей. Физ. Rev. B. 54 , 3211–3226 (1996).
 Количество атомов Cu в ближайшей оболочке, рассчитанное с использованием α 1 равно 10 и соответствующая химическая единица [Cu-Cu 10 Ni 2 ]Cu x Ni
Количество атомов Cu в ближайшей оболочке, рассчитанное с использованием α 1 равно 10 и соответствующая химическая единица [Cu-Cu 10 Ni 2 ]Cu x Ni
 Этот диапазон объясняет сплав C17200 (от 1,8 до 2,0 Be, минимум 0,20 Ni + Co, максимум 0,6 Ni + Co + Fe, максимум 0,10 Pb, максимум 0,5 другого (всего), bal Cu), который является наиболее популярным сплавом Cu-Be для проявляя высокую прочность и эластичность 20 .
Этот диапазон объясняет сплав C17200 (от 1,8 до 2,0 Be, минимум 0,20 Ni + Co, максимум 0,6 Ni + Co + Fe, максимум 0,10 Pb, максимум 0,5 другого (всего), bal Cu), который является наиболее популярным сплавом Cu-Be для проявляя высокую прочность и эластичность 20 . 17,21,22,23,24,26 и модель кластер плюс атом клея.
17,21,22,23,24,26 и модель кластер плюс атом клея. 
 . Эта работа отвечает на давний вопрос о происхождении состава промышленных сплавов на основе твердых растворов, прослеживая молекулярные химические единицы, участвующие в химическом ближнем упорядочении в твердых растворах.
. Эта работа отвечает на давний вопрос о происхождении состава промышленных сплавов на основе твердых растворов, прослеживая молекулярные химические единицы, участвующие в химическом ближнем упорядочении в твердых растворах.Бруни Г. Твердые растворы. Хим. 1 , 345 (1925).
КАС
Статья
Google ученый
Брэгг, У. Х. Значение кристаллической структуры. J. Chem. соц. Транс. 121 , 2766–2787 (1922).
КАС
Статья
Google ученый
Брэгг, В. Л. и Уильямс, Э. Дж. Влияние термического перемешивания на расположение атомов в сплавах. Проц. Р. Соц. Лонд. А 145 , 699–730 (1934).
Дж. Влияние термического перемешивания на расположение атомов в сплавах. Проц. Р. Соц. Лонд. А 145 , 699–730 (1934).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Бете, Х. А. Статистическая теория сверхрешеток. Проц. Р. Соц. Лонд. А 150 , 552–575 (1935).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Коули, Дж. М. Приближенная теория порядка в сплавах. Физ. Ред. 77 , 669–675 (1950).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Донг, К. и др. От кластеров к фазовым диаграммам: правила состава квазикристаллов и объемных металлических стекол. J. Phys. Д. 40 , R273 (2007).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Донг Д., Ван К., Донг К. и Них Т. Молекулоподобные химические соединения в металлических сплавах. науч. Китай Матер. 20 , 1–9 (2021).
Google ученый
Jiang, B., Wang, Q., Dong, C. & Liaw, P. Исследование эволюции фазовой структуры, вызванной легирующими элементами в сплавах Ti, с помощью модели кластеров химического ближнего порядка. Науч. Респ. 9 , 3404 (2019).
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Harrison, W. Теория твердого тела (McGraw-Hill, 1970).
Google ученый
Фридель Дж. Электронная структура первичных твердых растворов в металлах. Доп. физ. 3 , 446-507 (1954).
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Friedel, J. Металлические сплавы. Нуово Чименто 7 , 287–311 (1958).
Артикул
Google ученый
Häussler, P. Взаимосвязи между атомными и электронными структурами — жидкие и аморфные металлы как модельные системы. Физ. Респ. 222 , 65–143 (1992).
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Хан, Г. и др. Значения e/a идеальных металлических стекол по отношению к формулам кластеров. Acta Mater. 59 , 5917–5923 (2011).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Чен, К., Ван, К., Донг, К., Чжан, Ю. и Донг, Х. Правила состава монокристаллических жаропрочных сплавов на основе никеля и их влияние на свойства ползучести с помощью кластерной формулы. науч. Отчет 10 , 21621 (2020).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Вен Д. и др. Разработка нержавеющих сталей Fe-25Cr-22Ni для оболочек твэлов с высокой микроструктурной стабильностью путем легирования Mo/Nb/Ti/Ta/W. Матер. науч. англ. А 719 , 27–42 (2018).
КАС
Статья
Google ученый
Ма, Ю. и др. Новый магнитомягкий многоосновной сплав на основе B2 с однородным распределением когерентных объемно-центрированных кубических нанопреципитатов. Доп. Матер. 33 , 2006723 (2021).
КАС
Статья
Google ученый
Райнхард Л., Шёнфельд Б., Косторц Г. и Бюрер В. Ближний порядок в α-латуни. Физ. Ред. B 41 , 1727–1734 (1990).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Takeuchi, A. & Inoue, A. Классификация сыпучих металлических стекол по разнице в размерах атомов, теплоте смешения и периоду составляющих элементов и ее применение для характеристики основного легирующего элемента. Матер. Транс. 46 , 2817–2829 (2005).
КАС
Статья
Google ученый
Гаскелл, П. О плотности стекол переходный металл-металлоид. Акта Металл. 29 , 1203–1211 (1981).
Google ученый
Дэвис, Дж. Р. Справочник ASM, том 2: Свойства и выбор: цветные сплавы и материалы специального назначения (ASM International, 1998).
Кулиш Н., Петренко П. Ближний порядок в бинарных твердых растворах. Порядок и его изменение при нагреве в сплавах Fe-Al, Cu-Al и Ag-Al. Физ. Состояние Solidi A 120 , 315–326 (1990).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Vrijen, J. & Radelaar, S. Кластеризация в сплавах Cu-Ni: исследование диффузного рассеяния нейтронов. Физ. Rev. B. 17 , 409–421 (1978).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Ку, Ю., Коэн, Дж., Шапиро, С. и Таннер, Л. Закалка АС Cu-10,9 ат.% Be. Акта Металл. 36 , 591–604 (1988).
КАС
Статья
Google ученый
Schweika, W. & Haubold, H. Рассеяние нейтронов и исследование методом Монте-Карло ближнего порядка и взаимодействия атомов в Ni 0,89 Cr 0,11 . Физ. Rev. B. 37 , 9240–9248 (1988).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Бокоч С. М., Татаренко В. А. Межатомные взаимодействия в ГЦК сплавах Ni-Fe. Усп. Физ. Встретились. 11 , 413–450 (2010).
КАС
Статья
Google ученый
Jiang, X., Ice, G.E., Sparks, C.J., Robertson, L. & Zschack, P. Локальный атомный порядок и смещения отдельных пар Fe 46,5 Ni 53,5 и Fe 70007 22,5 7 Ni
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Чжан Р. и др. Ближний порядок и его влияние на среднеэнтропийный сплав CrCoNi. Природа 581 , 283–287 (2020).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Коули, Дж. М. Параметры ближнего и дальнего порядка в неупорядоченных твердых растворах. Физ. Ред. 120 , 1648–1657 (1960).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Садиг, Б. и др. Ближний порядок и фазовая стабильность поверхностных сплавов: PdAu на Ru (0001). Физ. Преподобный Летт. 83 , 1379–1382 (1999).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Сингх П., Смирнов А. В. и Джонсон Д. Д. Атомный ближний порядок и зарождающийся дальний порядок в высокоэнтропийных сплавах. Физ. Ред. Б. 91 , 224204 (2015).
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Чен, X. и др. Прямое наблюдение химического ближнего порядка в среднеэнтропийном сплаве. Природа 592 , 712–716 (2021).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Сингх Р., Шарма А., Сингх П., Баласубраманиан Г. и Джонсон Д. Д. Ускорение вычислительного моделирования и проектирования высокоэнтропийных сплавов. Нац. вычисл. науч. 1 , 54–61 (2021).
Нац. вычисл. науч. 1 , 54–61 (2021).
Артикул
Google ученый
Костюченко Т., Рубан А. В., Нойгебауэр Дж., Шапеев А., Крманн Ф. Ближний порядок в гранецентрированных кубических сплавах VCoNi. Физ. Преподобный Матер. 4 , 113802 (2020).
Скачать ссылки
Благодарности
Настоящая работа была поддержана Фондом естественных наук Китая (51801017), Ключевой дисциплиной и крупным проектом Даляньского фонда научных и технологических инноваций (2020JJ25CY004) и Фондом предметного развития ключевых Лаборатория физики и химии поверхности (XKFZ201706).
Информация об авторе
Авторы и организации
Ключевая лаборатория модификации материалов лазерным, ионным и электронным пучком (Даляньский технологический университет), Министерство образования, Далянь, 116024, Китай
Чжуан Ли, Цин Ван и Чуанг Донг
Колледж физических наук и технологий Даляньского университета, Далянь, 116622, Китай
Дандан Донг
Научно-техническая лаборатория физики и химии поверхности, Мяньян, 621907, Китай
Lei Zhang
Школа материаловедения и инженерии, Университет Далян Цзиотонг, Даляни, 116028, Китай
Shuang Zhang & Chuang Dong
Авторы
- 9031
Авторажи Вы также можете искать этого автора в
PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Contributions
Z. L. провел основные расчеты и проанализировал данные сплава. Д.Д. и К.Д. предложил теорию. С.З., К.В. и Л.З. проверил интерпретацию сплава. В написании статьи участвовали все авторы.
L. провел основные расчеты и проанализировал данные сплава. Д.Д. и К.Д. предложил теорию. С.З., К.В. и Л.З. проверил интерпретацию сплава. В написании статьи участвовали все авторы.
Автор, ответственный за переписку
Дандан Донг.
Декларации этики
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете соответствующую ссылку на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
C46400 Морская латунь «Бессвинцовая» — AMS 4611
| Медь | Fe | Пб | Сн | Цинк | |
Мин./макс. | 59,0 — 62,0 | 0,1 | 0,2 | 0,5 — 1,0 | Рем |
| Номиналы | 60.0000 | — | — | 0,7000 | 39.2000 |
| Тип продукта | Закалка |
| Бар | AMS 4611, 4612, ASTM B21, FEDERAL QQ-B-639, SAE J463, J461 |
| Пруток, поковка | АСТМ В124 |
| Болты | АСТМ F468 |
| Поковки, штампы | АСТМ В283 |
| Гайки | АСТМ F467 |
| Плита | ФЕДЕРАЛЬНЫЙ QQ-B-639 |
| Плита, плакированная | АСТМ В432 |
| Пластина, трубка конденсатора | АСМЭ СБ171, АСТМ Б171 |
| Стержень | AMS 4611, 4612, ASTM B21, SAE J463, J461 |
| Стержень, поковка | АСТМ В124 |
| Винты | АСТМ F468 |
| Формы | АСТМ В21 |
| Формы, поковка | АСТМ В124 |
| Лист | ФЕДЕРАЛЬНЫЙ QQ-B-639 |
| Полоса | ФЕДЕРАЛЬНЫЙ QQ-B-639, SAE J463, J461 |
| Шпильки | АСТМ F468 |
| Проволока, металлизированная | ВОЕННЫЙ MIL-W-6712 |
| Закалка | Разд. Размер Размер | Холодная обработка | Тип Мин. | Температура | Прочность на растяжение | YS 0,05% UL | YS Смещение 0,02% | YS 0,005% Смещение | Удлинн. | Правая Б | Правая С | Правая Ж | Правая сторона 30T | ВХ 500 | ВН 500 | БХ 3000 | Сдвиг Прочность | Усталость Прочность | Изод Ударный Прочность |
| — | дюйм | % | — | Ф | тыс.фунтов/кв.дюйм | тыс.фунтов/кв.дюйм | тыс.фунтов/кв.дюйм | тыс.фунтов/кв.дюйм | % | Б | С | Ф | 30Т | 500 | 500 | 3000 | тыс. фунтов/кв.дюйм фунтов/кв.дюйм | тыс.фунтов/кв.дюйм | фут-фунт |
| — | мм. | — | — | С | МПа | МПа | МПа | МПа | — | — | — | — | — | — | — | — | МПа | МПа | Дж |
| ПЛОСКИЕ ИЗДЕЛИЯ | |||||||||||||||||||
| О50 | 0,04 | 68 | 62 | 30 | — | — | — | — | — | — | — | — | — | — | 41 | — | |||
| О50 | 1 | 0 | ТИП | 20 | 427 | 207 | — | — | 40 | 60 | — | — | 57 | — | — | — | 283 | — | 0 |
| О50 | 0,25 | 68 | 60 | 28 | — | — | — | — | — | — | — | — | — | — | 41 | — | |||
| О50 | 6,35 | 0 | ТИП | 20 | 414 | 193 | — | — | 45 | 58 | — | — | 56 | — | — | — | 283 | — | 0 |
| H01 | 0,04 | 68 | 70 | 58 | — | — | — | — | — | — | — | — | — | — | 43 | — | |||
| H01 | 1 | 0 | ТИП | 20 | 483 | 400 | — | — | 17 | 75 | — | — | 68 | — | — | — | 296 | — | 0 |
| М20 | 1 | 68 | 55 | 25 | — | — | — | — | — | — | — | — | — | — | 40 | — | |||
| М20 | 25,4 | 0 | ТИП | 20 | 379 | 172 | — | — | 50 | 55 | — | — | 55 | — | — | — | 276 | — | 0 |
| О60 | 0,25 | 68 | 58 | 25 | — | — | — | — | — | — | — | — | — | — | 40 | — | |||
| О60 | 6,35 | 0 | ТИП | 20 | 400 | 172 | — | — | 49 | 56 | — | — | 55 | — | — | — | 276 | — | 0 |
| СТЕРЖЕНЬ | |||||||||||||||||||
| H02 | 0,25 | 68 | 80 | 57 | — | — | — | — | — | — | — | — | — | — | 45 | — | |||
| H02 | 6,35 | 20 | ТИП | 20 | 552 | 393 | — | — | 20 | 85 | — | — | — | — | — | — | 310 | — | 0 |
| H01 | 1 | 68 | 69 | 46 | — | — | — | — | — | — | — | — | — | — | 43 | — | |||
| H01 | 25,4 | 8 | ТИП | 20 | 476 | 317 | — | — | 27 | 78 | — | — | — | — | — | — | 296 | — | 0 |
| О50 | 2,01 | 68 | 62 | 28 | — | — | — | — | — | — | — | — | — | — | 42 | — | |||
| О50 | 51 | 0 | ТИП | 20 | 427 | 193 | — | — | 43 | 60 | — | — | — | — | — | — | 290 | — | 0 |
| H02 | 1 | 68 | 75 | 53 | — | — | — | — | — | — | — | — | — | — | 44 | — | |||
| H02 | 25,4 | 20 | ТИП | 20 | 517 | 365 | — | — | 20 | 82 | — | — | — | — | — | — | 303 | — | 0 |
| О50 | 0,25 | 68 | 63 | 30 | — | — | — | — | — | — | — | — | — | — | 42 | — | |||
| О50 | 6,35 | 0 | ТИП | 20 | 434 | 207 | — | — | 40 | 60 | — | — | — | — | — | — | 290 | — | 0 |
| О60 | 2,01 | 68 | 56 | 25 | — | — | — | — | — | — | — | — | — | — | 40 | — | |||
| О60 | 51 | 0 | ТИП | 20 | 386 | 172 | — | — | 47 | 55 | — | — | — | — | — | — | 276 | — | 0 |
| H01 | 2,01 | 68 | 67 | 40 | — | — | — | — | — | — | — | — | — | — | 43 | — | |||
| H01 | 51 | 8 | ТИП | 20 | 462 | 276 | — | — | 35 | 75 | — | — | — | — | — | — | 296 | — | 0 |
| О50 | 1 | 68 | 63 | 30 | — | — | — | — | — | — | — | — | — | — | 42 | — | |||
| О50 | 25,4 | 0 | ТИП | 20 | 434 | 207 | — | — | 40 | 60 | — | — | — | — | — | — | 290 | — | 0 |
| О60 | 1 | 68 | 57 | 25 | — | — | — | — | — | — | — | — | — | — | 40 | — | |||
| О60 | 25,4 | 0 | ТИП | 20 | 393 | 172 | — | — | 47 | 55 | — | — | — | — | — | — | 276 | — | 0 |
| О60 | 0,25 | 68 | 58 | 27 | — | — | — | — | — | — | — | — | — | — | 40 | — | |||
| О60 | 6,35 | 0 | ТИП | 20 | 400 | 186 | — | — | 45 | 56 | — | — | — | — | — | — | 276 | — | 0 |
| H01 | 0,25 | 68 | 70 | 48 | — | — | — | — | — | — | — | — | — | — | 43 | — | |||
| H01 | 6,35 | 10 | ТИП | 20 | 483 | 331 | — | — | 25 | 80 | — | — | — | — | — | — | 296 | — | 0 |
| ТРУБКА | |||||||||||||||||||
| Н80 | 0 | 68 | 88 | 66 | — | — | — | — | — | — | — | — | — | — | — | — | |||
| Н80 | 0 | 35 | ТИП | 20 | 607 | 455 | — | — | 18 | 95 | — | — | — | — | — | — | — | — | 0 |
| Свойство продукта | Стандарт США | Метрическая система |
| Коэффициент теплового расширения | 11,8 МОм?̴МÁ10-6 на oF (68-572 F) | 21,2 МОм 10 6? на МО?ТВС (20-300 С) |
| Плотность | 0,304 фунта/дюйм3 при 68 F | 8,41 г/см3 при 20°C |
| Электропроводность | 26 %IACS @ 68 F | 0,152 мегасименс/см при 20°C |
| Удельное электрическое сопротивление | 39,9 Ом-смил/фут при 68 F | 6,63 микроом-см при 20 °C |
| Жидкость с температурой плавления США | 1650 Ф | 899 С |
| Точка плавления Твердый US | 1630 Ф | 888 С |
| Модули упругости при растяжении | 15000 фунтов на квадратный дюйм | 103400 МПа |
| Модули жесткости | 5600 фунтов/кв. дюйм дюйм | 38610 МПа |
| Удельный вес | 8,41 | 8,41 |
| Удельная теплоемкость | 0,09 БТЕ/фунт/МОм?̴åÁF @ 68 F | 377,1 Дж/кг МО?̴МÁ МО?̴åÁK при 293 K |
| Теплопроводность | 67,0 БТЕ МО?̴МÁ ft/(hr МО?̴МÁ ft2 МО?̴МАМÎ?̴åÁF) @ 68 F | 116,0 Вт/м МО?̴МÁ МО?̴åÁK при 20 C |
| Техника соединения | Пригодность |
| Пайка | Отлично |
| Сварка встык | Хорошо |
| Способность к холодной обработке | Ярмарка |
| Возможность горячей штамповки | Отлично |
| Дуговая сварка металла с покрытием | Не рекомендуется |
| Рейтинг подделываемости | 90 |
| Дуговая сварка в среде защитного газа | Ярмарка |
| Степень обрабатываемости | 30 |
| Ацетиленокислородная сварка | Хорошо |
| Сварной шов | Ярмарка |
| Пайка | Отлично |
| Точечная сварка | Хорошо |
Какой тип материи является латунью
от Admin
Содержание
Какой тип вещества является латунью?
Латунь представляет собой однородную смесь (твердый раствор) меди и цинка. Опять же, каждый металл сам по себе является чистым веществом. Только когда они смешаны на атомарном уровне, они представляют собой гомогенную смесь (или твердый раствор). Латунь представляет собой гомогенную смесь (твердый раствор) меди и цинка. Снова каждый металл сам по себе является чистым веществом
чистое вещество
Углеводород категория веществ, состоящая только из водорода и углерода.
Является ли латунь соединением или смесью?
Латунь смесь элементов меди и цинка . Бронза представляет собой смесь меди и олова. Вода – это соединение элементов водорода и кислорода. Киноварь представляет собой соединение, содержащее ртуть и серу.
Является ли латунь гетерогенной смесью?
Латунь представляет собой сплав, состоящий в основном из меди и цинка.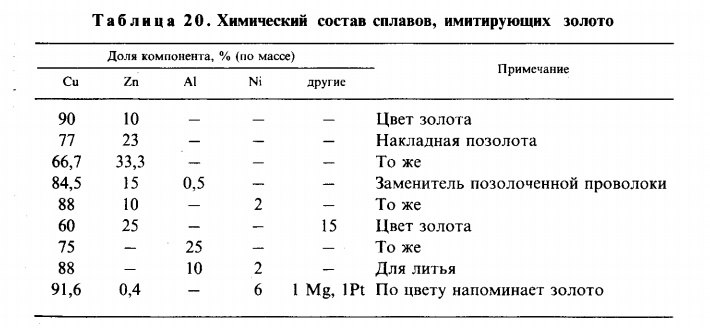 … Сплав считается гомогенная смесь потому что это смесь двух или более металлических элементов. Состав металлов остается одинаковым в каждом образце сплава. Следовательно, мы можем сказать, что латунь является примером гомогенной смеси.
… Сплав считается гомогенная смесь потому что это смесь двух или более металлических элементов. Состав металлов остается одинаковым в каждом образце сплава. Следовательно, мы можем сказать, что латунь является примером гомогенной смеси.
Что это за сталь и латунь?
Сплав представляет собой смесь или металлический твердый раствор , состоящий из двух или более элементов. Примеры сплавов включают такие материалы, как амальгама латуни, олова, фосфорной бронзы и стали.
Почему латунь называют смесью?
Латунь представляет собой гомогенную смесь . Это сделано, когда медь и цинк смешаны. Это называется гомогенной смесью, потому что она выглядит одинаково во всем.
Является ли латунь раствором или механической смесью?
Обычно латунь можно представить как твердый раствор , состоящий из цинка и других металлов (растворенных веществ), растворенных в меди (растворителе). Некоторые латуни однородны и состоят из одной фазы (например, альфа-латуни), поэтому латунь соответствует всем критериям решения.
Является ли латунь атомом?
Латунь — это сплав меди и цинка в пропорциях, которые можно варьировать для получения различных механических, электрических и химических свойств. Это сплав замещения: атомы двух составляющих могут замещать друг друга в пределах одной и той же кристаллической структуры.
Является ли латунь твердым раствором?
Раствор твердого тела в твердом: Металлические сплавы представляют собой растворы твердых тел в твердых телах. Например, латунь представляет собой раствор цинка в меди 9.0181 . Латунь предлагается смешивать расплавленный цинк с расплавленной медью и охлаждать их смесь. … Это потому, что он содержит твердое вещество, растворенное в жидкости.
Что из следующего является примером латуни?
Латунь является примером гомогенной смеси . Гомогенная смесь — это такая смесь, в которой состав ее компонентов остается неизменным во всем растворе.
Почему латунь представляет собой однородную смесь, а не соединение?
Латунь представляет собой гомогенную смесь двух металлов: меди и цинка. Медь и цинк связаны физически, а не химически . Таким образом, латунь представляет собой смесь, а не соединение.
Медь и цинк связаны физически, а не химически . Таким образом, латунь представляет собой смесь, а не соединение.
Является ли латунь металлическим соединением?
Латунь представляет собой гомогенную смесь двух металлов: меди и цинка. Медь и цинк связаны физически, а не химически. Таким образом, латунь представляет собой смесь, а не соединение .
Является ли латунь сплавом?
латунь сплав меди и цинка имеет историческое и непреходящее значение благодаря своей твердости и обрабатываемости. Самая ранняя латунь, называемая каламиновой латунью, относится к временам неолита. Вероятно, она была получена путем восстановления смесей цинковых и медных руд.
Какая смесь является бронзовой?
Бронза представляет собой сплав , состоящий в основном из меди, обычно с примерно 12–12,5% олова и часто с добавлением других металлов (таких как алюминий, марганец, никель или цинк), а иногда и неметаллов или металлоидов, таких как мышьяк, фосфор или кремний. .
.
Является ли латунь чистым веществом или смесью или соединением?
Несмотря на то, что и латунь, и серебро имеют одинаковый состав по всему , латунь не является чистым веществом , потому что у него нет определенного состава. Латунь представляет собой сплав меди и цинка, и пропорции этих двух металлов варьируются для получения латуни с разными свойствами.
Как химия изготавливается из бронзы?
Бронза представляет собой металлический сплав , изготовленный путем добавления олова к меди , хотя при необходимости он может содержать дополнительные боковые элементы. … Такие элементы, как свинец, марганец, никель, кремний, цинк и другие, добавляются для улучшения качества бронзы и получения широкого спектра сортов бронзы на выбор.
Имеет ли латунь химическую формулу?
В случае латуни атомы меди и цинка образуют металлические связи, поэтому на самом деле не существует химической формулы . Таким образом, нет никакого символа.
Является ли латунь растворенным веществом или растворителем?
Мы знаем, что латунь состоит из меди с добавлением цинка. Это твердый раствор, содержащий цинк и другие металлы в качестве растворенного вещества, а медь действует как растворитель . Итак, растворенное вещество — цинк, растворитель — медь, а раствор — латунь.
Является ли латунь ионной или ковалентной?
Сила притяжения между атомами в металлах, таких как медь и алюминий, или сплавах, таких как латунь и бронза, представляет собой металлические связи . Молекулярные ионные и ковалентные твердые тела имеют одну общую черту. За редким исключением электроны в этих твердых телах локализованы.
Почему латунь не является соединением?
Поскольку элементы в соединении должны быть в определенных пропорциях и химически связаны друг с другом, латунь представляет собой смесь, а не соединение. Напротив, два элемента Zn и Cu в латуни не находятся в фиксированных пропорциях (они могут сочетаться в любом соотношении) и имеют без химической связи .
Является ли латунь твердой жидкостью или газом?
Твердые решения очень распространены. Многие сплавы, керамика и смеси полимеров представляют собой твердые растворы. Медь и цинк растворяются друг в друге и затвердевают, образуя твердые растворы, называемые латунью.
Является ли латунь ионным соединением?
Чистый металл или сплав, такой как латунь (смесь меди и цинка) не является ни ионным, ни ковалентным соединением . … В случае ионных связей это между катионами ([+] заряженными ионами) и анионами ([-] заряженными.
Что такое Адмиралтейская латунь?
Определение адмиралтейской латуни
: коррозионно-стойкий сплав, содержащий около 71% меди, 28% цинка и 1% олова .
Является ли латунный сплав гомогенным или гетерогенным?
гомогенная смесь
Латунь гомогенная смесь . Это сделано, когда медь и цинк смешаны. Это называется гомогенной смесью, потому что она выглядит одинаково во всем.
Почему латунь является металлом?
Латунь, идентифицируемая по характерному темно-золотому цвету, представляет собой металлический сплав , состоящий из меди и цинка . Это делается путем изменения соотношения меди и цинка. … Добавление большего количества меди и меньшего количества цинка делает его жестче, а добавление большего количества цинка и меньшего количества меди делает его мягче.
Окисляется ли латунь?
Медь Бронза и латунь
Медь со временем окисляет с образованием зеленой патины, которая фактически защищает металл от дальнейшей коррозии. … Латунь — это сплав меди, цинка и других элементов, который также устойчив к коррозии.
Что такое наука о латуни?
Латунь — цветной красный металл, а — сплав, состоящий из меди и цинка . Пропорции меди и цинка можно варьировать для достижения различных желаемых механических и электрических свойств. … Латунь является хорошим проводником тепла с низкой температурой плавления.
