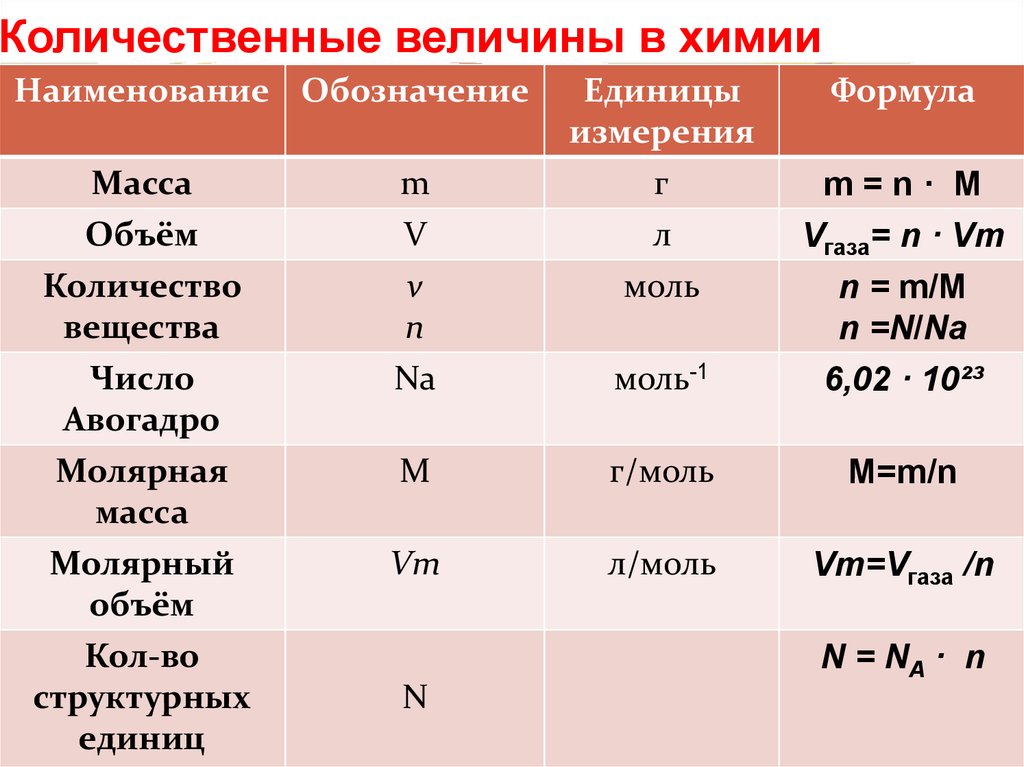
Формула латуни химическая: Сплавы латуни. Химический состав. Применение
Содержание
Латунь сплав. Латунь состав. Свойства латуни. Применение латуни. Литейная латунь. Диаграмма состояния медь-цинк.
Латунь — это двойной или многокомпонентный сплав на основе меди, где основным легирующим элементом является цинк. Латуни могут иметь в своем составе до 45 % цинка. Повышение содержания цинка до 45 % приводит к увеличению предела прочности до 450 МПа. Максимальная пластичность имеет место при содержании цинка около 37 %.
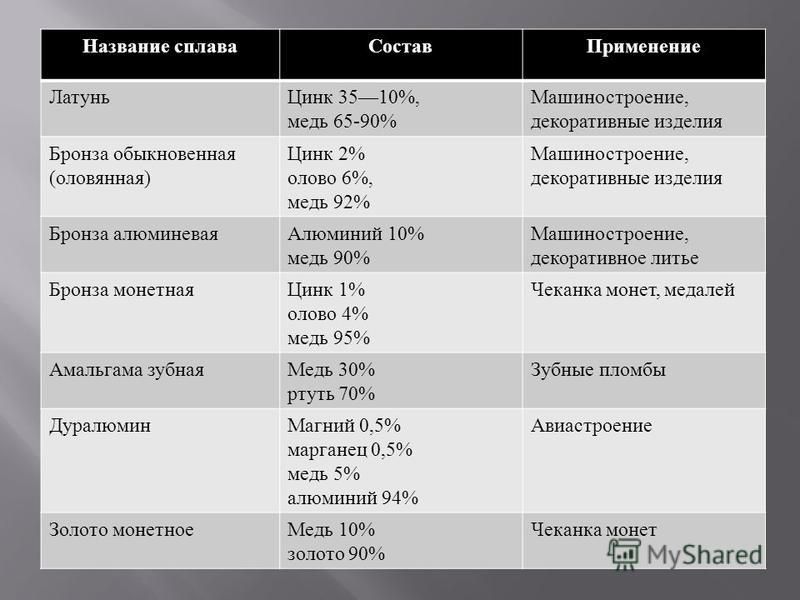
Бронза сплав. Бронза состав. Бронза оловянная. Алюминиевая бронза. Бериллиевая бронза.
При сплавлении меди с цинком образуется ряд твердых растворов α, β, γ, ε.
Диаграмма состояния медь–цинк
Из диаграммы состояния медь–цинк видно, что в зависимости от состава имеются однофазные латуни, состоящие из α–твердого раствора, и двухфазные (α + β)–латуни.
По способу изготовления изделий различают латуни деформируемые и литейные.
Деформируемые латуни маркируются буквой Л, за которой следует число, показывающее содержание меди в процентах, например в латуни Л62 содержится 62 % меди и 38 % цинка. Если кроме меди и цинка, имеются другие элементы, то ставятся их начальные буквы ( О – олово, С – свинец, Ж – железо, Ф – фосфор, Мц – марганец, А – алюминий, Ц – цинк). Количество этих элементов обозначается соответствующими цифрами после числа, показывающего содержание меди, например, сплав ЛАЖ60-1-1 содержит 60 % меди, 1 % алюминия, 1 % железа и 38 % цинка.
Если кроме меди и цинка, имеются другие элементы, то ставятся их начальные буквы ( О – олово, С – свинец, Ж – железо, Ф – фосфор, Мц – марганец, А – алюминий, Ц – цинк). Количество этих элементов обозначается соответствующими цифрами после числа, показывающего содержание меди, например, сплав ЛАЖ60-1-1 содержит 60 % меди, 1 % алюминия, 1 % железа и 38 % цинка.
Однофазные α–латуни используются для изготовления деталей деформированием в холодном состоянии. Изготавливают ленты, гильзы патронов, радиаторные трубки, проволоку.
Для изготовления деталей деформированием при температуре выше 500oС используют (α + β)–латуни. Из двухфазных латуней изготавливают листы, прутки и другие заготовки, из которых последующей механической обработкой изготавливают детали. Обрабатываемость резанием улучшается присадкой в состав латуни свинца, например, латунь марки ЛС59-1, которую называют “автоматной латунью”.
Латуни имеют хорошую коррозионную стойкость, которую можно повысить дополнительно присадкой олова. Латунь ЛО70-1 стойка против коррозии в морской воде и называется “морской латунью“.
Латунь ЛО70-1 стойка против коррозии в морской воде и называется “морской латунью“.
Добавка никеля и железа повышает механическую прочность до 550 МПа.
Магний металл. Магниевые сплавы. Литейные магниевые сплавы. Деформируемые магниевые сплавы.
Металл титан. Титановые сплавы. Сплавы титана. Титан и его сплавы. Применение титановых сплавов.
Литейные латуни также маркируются буквой Л. После буквенного обозначения основного легирующего элемента (цинк) и каждого последующего ставится цифра, указывающая его усредненное содержание в сплаве. Например, латунь ЛЦ23А6Ж3Мц2 содержит 23 % цинка, 6 % алюминия, 3 % железа, 2 % марганца. Наилучшей жидкотекучестью обладает латунь марки ЛЦ16К4. К литейным латуням относятся латуни типа ЛС, ЛК, ЛА, ЛАЖ, ЛАЖМц. Литейные латуни не склонны к ликвации, имеют сосредоточенную усадку, отливки получаются с высокой плотностью.
Латуни являются хорошим материалом для конструкций, работающих при отрицательных температурах.
Обозначение латуней (ГОСТ 15527-2004 и ГОСТ 17711-93)
Латунь двойной или многокомпонентный сплав на основе меди, где основным легирующим компонентом является цинк, иногда с добавлением олова (меньшим, чем цинка, иначе получится традиционная оловянная бронза), никеля, свинца, марганца, железа и других элементов. По металлургической классификации к бронзам не относится.
По металлургической классификации к бронзам не относится.
Латунь является одним из самых востребованных и широко применяемых материалов.
Сплав бывает разных оттенков – от темно-желтого до желто-красного, золотистого, белого, и даже зеленоватого. Какой цвет приобретет сплав зависит от процента добавок. Латунь характеризуется прочностью, пластичностью, хорошей жидкотекучестью, коррозийной стойкостью, незначительной усадкой, а также она хорошо поддается любым видам обработки.
Латунь — двойной или многокомпонентный сплав на основе меди легированный цинком
Латунь – коррозиестойкий сплав цинка и меди, сочетающий в себе высокую прочность с хорошей обрабатываемостью. Медь представляет собой основу латуни, определяющую базовые свойства. Цинк – легирующий компонент, процентное содержание которого может достигать 49%. В составе могут присутствовать и другие легирующие элементы, но их массовая доля обычно составляет не более 1,5%. Латунные сплавы имеют ярко желтый цвет, меняющийся в зависимости от процентного соотношения основных компонентов.
Удачное сочетание характеристик делает латунь оптимальным выбором для изготовления труб, профилей, водопроводной арматуры, деталей некоторых механизмов и других элементов, для которых важна хорошая коррозиестойкость в сочетании с прочностью. Характерной особенностью производственного процесса является то, что порядка половины всего используемого цинка поступает с утилизационных предприятий. Поверхность латунных изделий легко поддается полировке, но темнеет со временем под воздействием воздуха, поэтому часто покрывается лаком или подвергается никелированию.
Типы латуней
Принято выделять латуни однофазные или так называемые латуни альфа-типа, содержащие до 30-35% цинка, и двухфазные разновидности альфа-бета типа с большим (до 47-50 %), чем в однофазных, содержанием основного легирующего компонента. Однофазные латуни более пластичны, с увеличением же добавок возрастает прочность латуни, но существенно снижается ее пластичность.
Двухфазные латунные сплавы существенно менее пластичны, чем однофазные. Такое изменение свойств в связи с изменением состава объясняется тем, что при увеличении числа легирующих добавок неизменно меняется и структура сплава. При этом прочность двухфазных латунных разновидностей существенно выше, чем у однофазных. Двухфазные латунные сплавы могут содержать до 6% свинца в качестве дополнительной легирующей добавки.
Такое изменение свойств в связи с изменением состава объясняется тем, что при увеличении числа легирующих добавок неизменно меняется и структура сплава. При этом прочность двухфазных латунных разновидностей существенно выше, чем у однофазных. Двухфазные латунные сплавы могут содержать до 6% свинца в качестве дополнительной легирующей добавки.
Латунные сплавы с относительно невысоким содержанием цинка до 10% принято называть томпаками, при содержании цинка 10-20% – полутомпаками.
Химический состав латуни
Латунь по своему химическому составу близка к бронзе, и латунь, и бронза имеют в своей основе медь. Существенное отличие заключается в том, что основным легирующим компонентом в латунных сплавах является цинк, содержание которого может достигать 45%.
Рассмотрим подробнее свойства основных компонентов латуни.
Zn (цинк) элемент таблицы Менделеева, атомный номер 30. Элемент относится к побочной подгруппе 2 группы IV периода. Металл является переходным, для него характерно такое свойство, как проявление в атомах электронов на d- и f-орбиталях. Металл имеет светло-голубой оттенок, который на воздухе темнеет, покрываясь оксидной пленкой.
Металл имеет светло-голубой оттенок, который на воздухе темнеет, покрываясь оксидной пленкой.
Cu – основной компонент сплава. Элемент относится к 11 группе IV периода периодической системы Менделеева и имеет атомный номер 29. Металл как и цинк является переходным. У металла красивый желтовато-золотистый цвет. При образовании оксидной пленки медь приобретает красноватый оттенок.
Как говорилось выше, латунь может иметь структуру, которая состоит из альфа-фазы или из альфа-бета фазы.
В качестве легирующих компонентов латунь может включать в себя:
- Mn для повышения прочности сплавов, в том числе и антикоррозионной. Дополнительное введение помимо Mn еще Al, Sn, Fe усиливает прочностные и антикоррозионные характеристики металла.
- Sn для повышения устойчивости к соленой воде. Такие латунные сплавы приобрели «негласное» название – морская латунь и широко применяются в местах контакта с морской водой.
- Ni придает соединению высокие прочностные характеристики и также повышает антикоррозионные свойства.

- Pb применяется в том случае, если латунная деталь будет подвергаться резке. Этот элемент делает металл более податливым при механической обработке. Латуни, легированные свинцом называют автоматными.
- Si необходим для усиления антифрикционных характеристик сплава, что позволяет спокойно использовать его наряду с бронзой в некоторых технологических узлах, подшипниках и пр. Но, стоит отметить, что кремний существенно снижает твердость и прочность латунных изделий.
В таблице ниже приведены химические составы некоторых марок латунных сплавов. По таблице видно, что все марки имеют разный состав, содержание меди в некоторых марках может достигать 91%.
Свойства латуни в зависимости от процентного соотношения компонентов, температуры нагрева
При изменении процентного соотношения компонентов твердого раствора, введении дополнительных легирующих элементов меняются и свойства получаемого металла.
Попробуем проследить, как меняются свойства металла при изменении содержания Zn:
- При содержании цинка менее или равном 30% увеличиваются твердость и эластичность металла.

- При дальнейшем увеличении содержания цинка эластичность начинает снижаться в связи с уплотнением альфа-раствора. Твердость при этом увеличивается.
- Но при достижении содержания цинка 45% твердость тоже падает.
За счет своей эластичности латуни хорошо обрабатываются давлением. Особенно это относится к однофазным сплавам. Температурный режим для изменения формы не должен попадать в диапазон 300-700°C, это «хрупкая зона» металла. Альфа-бета разновидности проявляют повышенную пластичность при увеличении температуры нагрева выше 700°C.
Таким образом, содержание химических элементов в металле напрямую влияет на его технологические параметры, свойства. Альфа-латунные сплавы отличаются повышенной пластичностью, альфа-бета разновидности – прочные и крепкие, но они не подходят для деформационной обработки. Латунный сплав обладает повышенной устойчивостью к коррозии и морской воде за счет добавления легирующих компонентов, что позволяет использовать его в участках постоянного воздействия агрессивных сред.
Зависимость характеристик от состава латуни
Свойства латуни напрямую определяются массовыми долями основных компонентов. При доле цинка до 35% латунь имеет однофазную структуру (альфа-фаза), для которой характерна высокая пластичность в широком температурном диапазоне. При большей доле цинка латунные сплавы приобретают двухфазную структуру и в естественных температурных условиях становятся достаточно хрупкими.
В продаже представлены двухкомпонентные марки, состоящие только из цинка и меди, и многокомпонентные – легированные дополнительными химическими элементами, модифицирующими их свойства. Дополнительные легирующие компоненты позволяют менять отдельные характеристики, такие как прочность, вязкость, пластичность и прочее.
- Сетка латунная
- Латунный квадрат
- Латунные листы Л63
- Латунные листы ЛС59-1
- Латунные ленты
- Латунные прутки Л63
- Латунная проволока Л63
- Латунные трубы Л63
- Латунные шестигранные прутки ЛС59-1
- Латунные шестигранные прутки Л63
- Латунные круглые прутки ЛС59-1
- Латунная проволока ЛС59-1
- Латунные трубы Л68
Разновидности латунного металлопроката
Основные разновидности латунного металлопроката сводятся к следующему:
- латунные прутки – длинные детали с круглым, квадратным, прямоугольным сечением;
- латунные плиты – плоские заготовки толщиной 2,5 см и больше;
- латунная проволока для электротехники и прочих отраслей промышленности;
- латунная труба для проведения линий коммуникаций;
- латунные круги для изготовления станков, приборостроения и пр.
 ;
; - латунные листы для разных отраслей промышленности и пр.
Для каждого типа латунного металлопроката необходим металл определенной марки со строго регламентированным химическим составом.
Марки латуни
- Л63 – плохо обрабатывается механическими методами, используется для изготовления гаек, болтов, деталей машин и элементов теплотехники;
- ЛС59-1 – хорошо обрабатывается, применяется для изготовления гаек, болтов, зубчатых колес и втулок.
Первая марка представляет собой двухкомпонентный сплав с массовой долей цинка до 37%. Во втором содержание цинка достигает 40%, но, несмотря на это, он пластичнее и технологичнее благодаря дополнительному легированию свинцом.
Технологичность латуни
Металлы на основе меди и цинка хорошо поддаются механической обработке, благодаря чему из заготовок и предварительных отливок можно вытачивать любые детали. Кроме того, они хорошо поддаются пайке.
Основным недостатком можно назвать склонность к растрескиванию латуни с повышенным содержанием цинка (более 20%), особенно при использовании во влажной среде и при наличии паров аммиака. Первым признаком снижения прочности латунного металлопроката является потеря естественного цвета, постепенно ухудшаются и другие свойства.
Первым признаком снижения прочности латунного металлопроката является потеря естественного цвета, постепенно ухудшаются и другие свойства.
Состав и классификация латуней
Классический состав предполагает наличие в сплаве меди и цинка в пропорции 2:1 соответственно. Такой латунь знали Древние римляне. Скептики вспомнят, что цинк в чистом виде открыли в XVI веке. Но в случае с Древним Римом речь идет о цинксодержащей породе, которую на тот момент уже перерабатывали.
В те времена было поверье, что именно наличие цинка определяет цвет, и только позже стало известно, что солнечный оттенок сплава латуни получается благодаря тому, что наличие цинка разбавляет медную красноту.
- Латунь делят на двухкомпонентые (простые) и многокомпонентные (специальные).
Одна из маркировок изделий, материалом для которых служит латунь, означает процентное содержание компонентов. Так буква Л указывает на тип сплава — латунь. а рядом стоящий числовой индекс указывает на содержание меди в составе. Например, Л80» расшифровывается, как «латунь, состоящая из 80% меди и 20% цинка».
Например, Л80» расшифровывается, как «латунь, состоящая из 80% меди и 20% цинка».
Две составляющие – не обязательное требование. Если их больше, то каждый вводимый в состав латуни компонент отображается в маркировке при помощи соответствующего буквенного символа, следующего за буквой Л. В качестве добавок может выступать олово, никель или свинец. При этом латунь меняет свои свойства.
Добавки вводятся в сплав для достижения определенных целей. Например, латунь в классической пропорции не может быть применена в судостроении. Все благодаря неустойчивости латуни к воздействию солевых растворов (морской воды). Добавки, введенные в состав сплава решает эту проблему, сохраняя основные характеристики.
- По степени обработки сплавы бывают: деформируемые (латунная лента, проволока, труба, латунный лист) и литейные (арматура, подшипник, детали приборов).
Деформируемые двухкомпонентные латуни
Деформируемые многокомпонентные латуни
Литейные латуни
Способы улучшения характеристик латунных сплавов
Значительно снизить хрупкость сплава можно при помощи отжига, осуществляемого в температурном диапазоне 240-260 °C. В процессе термической обработки улучшаются прочностные показатели материала, и устраняется остаточное напряжение. Основным способом влияния на эксплуатационные характеристики (прочность, плотность, пластичность, цвет и прочие) является введение легирующих компонентов.
В процессе термической обработки улучшаются прочностные показатели материала, и устраняется остаточное напряжение. Основным способом влияния на эксплуатационные характеристики (прочность, плотность, пластичность, цвет и прочие) является введение легирующих компонентов.
Чистый сплав цинка и меди называется двухкомпонентным, если в составе присутствуют легирующие элементы – многокомпонентным. Чаще всего в качестве легирующих добавок выступает свинец, кремний, никель, железо, олово и марганец. Их процентное содержание обычно невелико (до 1-1,5%), но характеристики меняются кардинально. Если превысить норму, то качество латунного металлопроката может значительно ухудшиться.
Введение кремния и свинца позволяет улучшить прочностные и антифрикционные характеристики латуни, благодаря чему значительно возрастает износостойкость изготовленных из него механических деталей. Если массовая доля кремния превысит технические нормативы, характеристики латуни могут резко ухудшиться. Также свинец и кремний при соблюдении пропорций позволяют улучшить эстетические свойства материала.
Олово, алюминий и марганец повышают приспособляемость к растяжению, а добавление железа с марганцем позволяет увеличить показатель относительного удлинения. Здесь важно отметить, что все остальные легирующие добавки действуют на показатель удлинения отрицательно.
Для повышения антикоррозионных свойств в латунные сплавы добавляют никель, олово, марганец и алюминий. Добавление никеля позволяет избавиться от растрескивания в условиях повышенной влажности. Дополнительный положительный эффект от легирования оловом заключается в повышении прочности, плотности и стойкости к морской воде, а также соляным туманам. Поэтому такие материалы используются в приборах, предназначенных для судоходства.
Легирование свинцом повышает пластичность и технологичность, благодаря чему латунь легче поддается механической резке. При обработке на токарном станке заготовки не растрескиваются. Стружка получается мелкой, а поверхность – практически идеально гладкой, благодаря чему готовая деталь не нуждается в финишной обработке.
Мышьяк в качестве легирующего компонента для сплавов цинка и меди применяется редко. Обычно легированные им детали применяются для работы в агрессивных химических средах. Если одновременно с мышьяком в сплав добавляется железо и никель, стойкость готового изделия значительно возрастает, и оно может работать в контакте со слабыми растворами щелочей и кислот.
Характеристики
Единых базовых параметров латунного сплава не существует. Однако материал без проблем обрабатывается прессованием и механическим воздействием, с хорошей сопротивляемостью коррозии.
| Теплопроводность | 121 Вт/(м·K) |
| Плотность | 8921 кг/м³ и 7140 кг/м³ |
| Температура плавления | 932 °C |
| Кристаллическая система | кубическая сингония |
| Модуль Юнга | 115 ± 20 ГПа, 100 ГПа и 130 ГПа |
| Коэффициент Пуассона | 0,37 |
| Модуль Юнга при сжатии | 50 ГПа |
Особенности
Единого значения плотности, температуры плавления, порога тепло-, электропроводности латуни не существует. Параметры определяются количеством и долей элементов.
Параметры определяются количеством и долей элементов.
Чем «богаче» состав, тем больше вариаций:
- По сравнению с бронзой, латуни быстрее истираются, менее прочны. Хуже пропускают ток и тепло.
- Не так устойчивы к коррозии и агрессивным средам (морская вода, растворенные органические кислоты). Хотя по этому признаку превосходят чистую медь.
- При взаимодействии с кислотой латунь бледнеет до обесцвечивания. В месте попадания капли агрессивного раствора пузырится.
По данному химическому свойству ее легко отличить от золота. С ним ничего не случается.
- В диапазоне 212-624°С структура латуни разрушается: материал рассыпается.
Скорость коррозии растет с увеличением температуры. Этот феномен нейтрализуется финальным этапом обработки: изделия обжигаются при низких температурах.
Влияние лигатур на свойства сплава
Недостатки материала сглаживаются добавлением лигатур. Попутно легирующие элементы усиливают достоинства:
- Олово, никель, марганец в разы повышают порог прочности и коррозионной сопротивляемости сплава.
- Кремний прочность и твердость снижает. Однако сварщику работать с таким материалом легче.
- Свинец также ухудшает утилитарные характеристики, но облегчает резку.
- Алюминий создает на расплаве защитную пленку-оксид, тормозя «улетание» цинка во время плавки.
Влияние лигатур отражают неофициальные названия сплавов металла. Так, оловянные латуни именуют морскими. Свинцовые – автоматными, поскольку обработка ведется на станках-автоматах.
Свинцовые сплавы – самые востребованные среди латуней.
Кремниево-свинцовый материал малоистираем. Ценится как дублер дорогостоящих бронз.
Литейные сплавы латуни
Выделяют два основных вида латунных сплавов массового потребления: литейные и деформируемые (в отдельную группу выделяют также ювелирные). Характеристики и технологии обработки литейных латуней описываются в ГОСТ 17711. Для материалов данного типа характерна повышенная плотность, сниженное содержание газов и хорошая коррозионная стойкость. Благодаря частичному испарению цинка в процессе литья металл хорошо раскисляется, но этот процесс важно контролировать, чтобы характеристики готового изделия соответствовали расчетным значениям.
Благодаря частичному испарению цинка в процессе литья металл хорошо раскисляется, но этот процесс важно контролировать, чтобы характеристики готового изделия соответствовали расчетным значениям.
Для литейных латуней характерна пониженная ликвация (неоднородность, возникающая в процессе литья и кристаллизации), повышенная текучесть расплава и незначительный коэффициент усадки. По механическим характеристикам готовые детали из такого металла похожи на изделия из алюминиевых и оловянных бронз, при этом их себестоимость существенно ниже за счет более простой технологии получения.
Разумеется, литейные латунные сплавы имеют и определенные недостатки. Так при кристаллизации на поверхности изделий могут образовываться достаточно крупные раковины, приводящие к значительному проценту брака. Также важно учитывать, что из-за испарения цинка плавку необходимо осуществлять с применением специальных флюсов.
Применение латуни
Латунь является универсальным материалом, поэтому нашла широкое применение во многих сферах. Материал, который обладает высокой стойкостью к коррозии, активно используют в машиностроении и судостроении. Также она служит материалом для изготовления сосудов, застежек, наугольников для украшения книг, нательных крестиков и воинских знаков отличия: орденов и медалей. Латунь востребована в производстве труб, кранов, муфт, арматур, и прочих деталей, которые востребованы в сантехнике. Даже при создании ювелирных изделий используют латунь.
Материал, который обладает высокой стойкостью к коррозии, активно используют в машиностроении и судостроении. Также она служит материалом для изготовления сосудов, застежек, наугольников для украшения книг, нательных крестиков и воинских знаков отличия: орденов и медалей. Латунь востребована в производстве труб, кранов, муфт, арматур, и прочих деталей, которые востребованы в сантехнике. Даже при создании ювелирных изделий используют латунь.
Деформируемые сплавы латуни
Данная категория сплавов цинка и меди обрабатывается давлением. Характеристики и технология работы с ними регламентируется стандартом ГОСТ 15527. Поставляются они в виде металлопроката и заготовок для последующей обработки и изготовления деталей необходимой формы. Дополнительно выделяют две категории медно-цинковых сплавов: двойные (двухкомпонентные) и специальные (многокомпонентные). К деформируемым сплавам относятся две наиболее популярные марки: Л63 (двухкомпонентная) и ЛС59-1 (многокомпонентная, легированная свинцом).
По структуре выделяют также однофазные и двухфазные сплавы. Однофазная латунь имеет однородный неизменяемый цвет и обладает хорошей технологичностью. У двухфазных повышена плотность, они становятся более хрупкими и хуже поддаются холодной обработке. Температура плавления для всех медьсодержащих сплавов находится примерно в одном диапазоне.
Какие виды проката производятся из латуней
Благодаря высокой пластичности деформируемых латуней, номенклатуры видов проката очень широка. Купить латунный прокат в METAL БЮРО можно по минимальным ценам в виде поковок, листов, лент, полос, профилей, труб и проволоки. Сортамент каждого из этих типов проката регламентируется своим стандартом. В частности, листы и полосы – ГОСТ 931-90, ленты – ГОСТ 2208-91, прутки – ГОСТ 2060-90, трубы ГОСТ 494-90, проволока – ГОСТ 1066-90. При этом химический состав всех обрабатываемых давлением латуней подчиняется ГОСТ 15527-2004.
Физико-химические свойства латунных сплавов
По внешнему виду латунь напоминают бронзу, из-за чего их путают или даже отождествляют. Но в бронзе основным легирующим компонентом является олово, а не цинк, поэтому это два совершенно разных медьсодержащих металла с существенно отличающимися физико-химическими свойствами.
Но в бронзе основным легирующим компонентом является олово, а не цинк, поэтому это два совершенно разных медьсодержащих металла с существенно отличающимися физико-химическими свойствами.
Цинк (Zn, Zincum) находится на 30-й позиции в периодической таблице Менделеева. Он входит в побочную подгруппу второй группы четвертого периода. В нормальных условиях чистый цинк представляет собой хрупкий металл с характерным голубоватым оттенком. На воздухе он быстро окисляется, а если палочку из цинка согнуть, слышен характерный треск (этим цинк напоминает олово). В природе чистый цинк не встречается.
Медь (Cu, Cuprum) в периодической таблице расположилась прямо перед цинком – на 29-й позиции. Она относится к элементам одиннадцатой группы четвертого периода. В чистом виде представляет собой мягкий пластичный металл розово-золотого цвета. В естественных условиях поверхность очищенной меди быстро окисляется, вступая в соединение с кислородом воздуха. Несмотря на это, встречается в самородном виде, благодаря чему стала одним из первых металлов, известных человеку. Наиболее древние медные изделия, найденные при раскопках селения Чатал-Гююк (Турция), датируются 7500-м годом до нашей эры.
Наиболее древние медные изделия, найденные при раскопках селения Чатал-Гююк (Турция), датируются 7500-м годом до нашей эры.
Технология получения
В природе латунь не встречается.
Исходником-шихтой для ее производства служит сырье трех видов:
- Первичное. Добыча медных, цинковых, других руд ведется на природных месторождениях.
- Медный, цинковый, другой металлический лом, пригодный к переработке (вторсырье). Аккумулируется на пунктах приема.
- Отходы собственного производственного цикла меткомбинатов.
Традиционные способы получения предусматривают использование печей для выплавки меди и ее сплавов. Обычно это электро-индукционные агрегаты, снабженные магнитопроводом и работающие на низких частотах.
Микроструктура отшлифованного и протравленного латунного сплава под 400-кратным увеличением
Процесс получения сплава:
- Раскаленную медь помещают в печь.
- Следом загружают кусковой цинк.
- Плавка проходит при 875-945°С.
- В специальные латуни добавляют легирующие добавки.
- Массу перемешивают до однородности, разливают по формам.
На выходе получаются плоские либо круглые латунные слитки. У выплавленных изделий разная твердость, степень закалки и старения.
Продвинутые технологии предусматривают установку вентиляции для вытяжки во время плавки паров, опасных для человека.
Влияние доли цинка на свойства латунного сплава
Основные свойства сочетания цинка и меди зависят от процентного содержания главных компонентов. Поскольку чистая медь пластична, сплавы с долей цинка менее 30 процентов также обладают данным свойством. Повышение доли цинка постепенно делает металл более хрупким, а при появлении β’-фазы хрупкость резко возрастает. При этом твердость растет вплоть до 45-процентного содержания цинка, после чего данный параметр резко снижается.
Поскольку одним из основных видов формовки латунных деталей является деформация под давлением, важно учитывать пластичность используемых сплавов. Однофазные составы сохраняют пластичность и могут проходить штамповку при обычной температуре, но в диапазоне 300-700 °C могут приобретать нежелательную хрупкость. Двухфазные сплавы приобретают необходимую для штамповки пластичность только при температурах, превышающих 700 °C.
Однофазные составы сохраняют пластичность и могут проходить штамповку при обычной температуре, но в диапазоне 300-700 °C могут приобретать нежелательную хрупкость. Двухфазные сплавы приобретают необходимую для штамповки пластичность только при температурах, превышающих 700 °C.
Технология расплава латуни
Для получения расплава используется две основных технологии:
- плавление в тиглях из огнеупорной глины нагревом в пламенной или шахтной печи;
- плавление в отражательной печи без применения тиглей.
Расплавленный металл заливают в песчаные формы для получения заготовок и слитков. Важно учитывать, что часть цинка во время процесса испаряется, поэтому необходимо выбирать сплав, в котором его доля будет несколько выше. Поправка на испарение рассчитывается индивидуально для конкретной технологии так, чтобы доли металлов в готовом изделии максимально соответствовали проектным значениям.
Что представляет собой
Это один из самых узнаваемых материалов планеты. Как и бронза, латунь не металл, а сплав.
Как и бронза, латунь не металл, а сплав.
Бывает дву- либо поликомпонентным. Базовый компонент сплава – главный цветной металл планеты медь:
- В первом случае ее дополняет цинк (до 44%). На эту пару приходится основная доля по массе в сплаве.
- В многокомпонентных составах к цинку прибавляются олово, свинец, никель, железо, марганец, другие лигатуры.
Цинк улучшает потребительские свойства, попутно снижая цену конечного продукта.
Латунь не относится к металлам. Как и бронза, это конгломерат нескольких компонентов.
Маркировка латуни
Во избежание путаницы первая буква в маркировке медно-цинковых сплавов всегда «Л». Если сплав двухкомпонентный, то маркировка состоит только из данной буквы и двух цифр, показывающих процентное содержание меди. Так маркировка одного из наиболее распространенных сплавов Л63 подразумевает 63% меди и до 37% цинка (допустимые значения составляют 62-65% для меди и 34-37,5 для цинка, количество других примесей – не более 0,5%).
Добавление дополнительных легирующих компонентов в значимых количествах также отражается в обозначении марки сплава. Также в название добавляется название основного легирующего компонента. К примеру, популярная марка ЛС59-1 расшифровывается следующим образом:
- Л – латунь;
- С – свинцовая;
- 59 – процентное содержание меди;
- 1 – содержание свинца.
Расшифровка марок латуни с большим количеством компонентов производится аналогичным образом. Буквы после «Л» обозначают дополнительные легирующие примеси, а через дефис (или несколько дефисов) указываются их весовые доли в процентах. Например, маркировка ЛАЖМц70-5-3-1 подразумевает наличие в составе 5% алюминия, 3% железа и 1% марганца. Доля цинка составляет соответственно 20-21% (с учетом 0,5-0,75% примесей).
2.5: Химические соединения — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 50430
- Роберт Белфорд
- Университет Арканзаса в Литл-Роке
цели обучения
- Различать ионные соединения и молекулярные соединения по способу образования связей и различным характеристикам
- Определите элементы, которые существуют в виде двухатомных молекул
- Дайте определение аллотропам
- Интерпретация различных типов формул, включая молекулярные формулы, структурные формулы и сокращенные структурные формулы
Введение
Химические соединения образуются, когда 2 или более атомов связаны друг с другом. Мы рассмотрим два основных типа связи, ковалентную и ионную, и, таким образом, сосредоточимся на двух основных видах химических соединений, ковалентной и ионной. Каждое из этих соединений связано с химической формулой, и важно отметить, что существует третий тип связи, очень распространенный и который мы здесь не рассматриваем, а именно металлическая связь. Чистый металл или сплав, подобный латуни (смесь меди и цинка), не является ни ионным, ни ковалентным соединением. Латунь не образует «соединения» в классическом смысле теории Дальтона, где существует постоянное соотношение меди и цинка, что приводит к определенной формуле. На самом деле латунь можно рассматривать как твердый раствор, и различные марки латуни зависят от соотношения меди и цинка. Поэтому мы не связываем типичную химическую формулу с металлами и сплавами.
Мы рассмотрим два основных типа связи, ковалентную и ионную, и, таким образом, сосредоточимся на двух основных видах химических соединений, ковалентной и ионной. Каждое из этих соединений связано с химической формулой, и важно отметить, что существует третий тип связи, очень распространенный и который мы здесь не рассматриваем, а именно металлическая связь. Чистый металл или сплав, подобный латуни (смесь меди и цинка), не является ни ионным, ни ковалентным соединением. Латунь не образует «соединения» в классическом смысле теории Дальтона, где существует постоянное соотношение меди и цинка, что приводит к определенной формуле. На самом деле латунь можно рассматривать как твердый раствор, и различные марки латуни зависят от соотношения меди и цинка. Поэтому мы не связываем типичную химическую формулу с металлами и сплавами.
Химические связи являются результатом кулоновского (электростатического) взаимодействия между заряженными частицами, когда одноименные заряды отталкиваются, а противоположные притягиваются.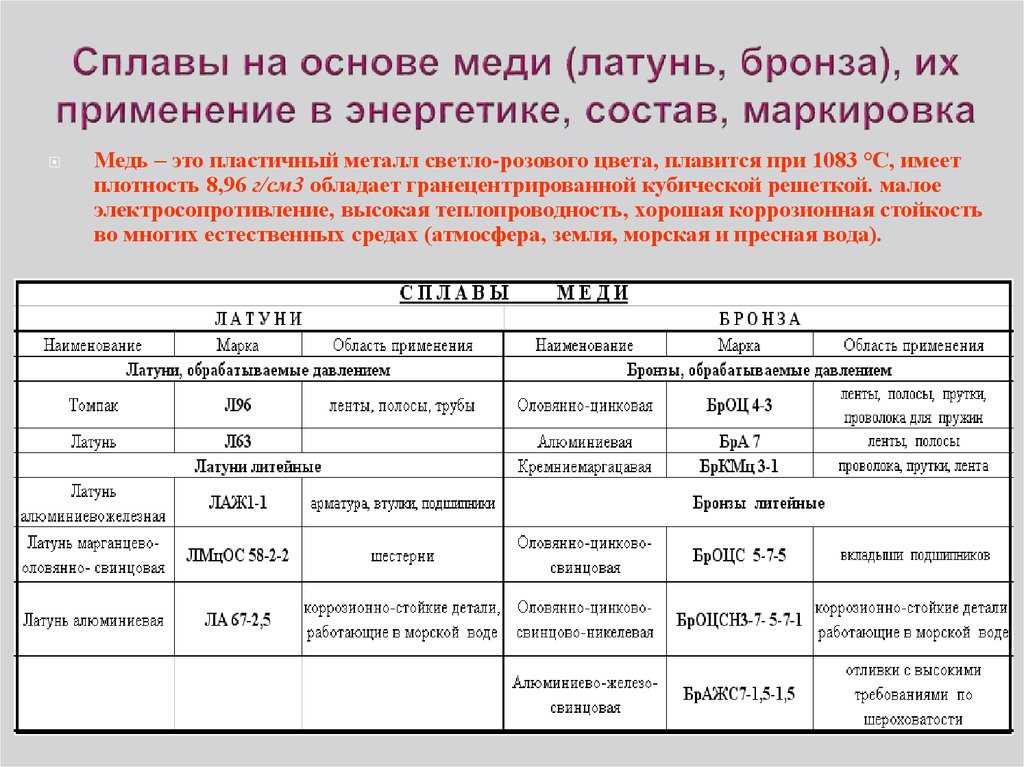 2}\]
2}\]
- E – потенциальная энергия
- F сила
- r расстояние разделения (обратите внимание, что потенциал стремится к нулю, когда они разделены бесконечностью)
- q это заряд ионов
Важно понимать, что заряд находится в числителе, а расстояние в знаменателе. Это означает, что чем больше заряд (при постоянном расстоянии), тем больше сила, и чем меньше расстояние (чем ближе ионы друг к другу), тем больше сила. Проще говоря, сильно заряженные частицы, находящиеся близко друг к другу, взаимодействуют сильнее, чем слабые частицы, находящиеся далеко друг от друга. Фактически, концепция нулевой кулоновской энергии приравнивается к частицам, разделенным бесконечностью. Следует также отметить, что эта сила может быть притягивающей или отталкивающей.
Ковалентные связи и молекулы
Ковалентные связи возникают, когда два или более атома разделяют валентных (внешней оболочки) электронов, что приводит к образованию молекулярных соединений , которые обычно включают неметаллы. Они возникают в результате действия кулоновских сил притяжения и отталкивания между [+] ядрами и [-] валентными (внешними) электронами различных атомов. Легче всего это увидеть в простейшей молекуле — двухатомном водороде. Слева на приведенной ниже диаграмме у вас есть два изолированных атома, которые находятся так далеко, что синий электрон не чувствует притяжения к красному ядру, а красный электрон не чувствует притяжения к синему ядру, и поэтому нет связи. формы. По мере того, как они сближаются, электроны каждого атома начинают чувствовать притяжение к ядру другого атома и сближаются.
Они возникают в результате действия кулоновских сил притяжения и отталкивания между [+] ядрами и [-] валентными (внешними) электронами различных атомов. Легче всего это увидеть в простейшей молекуле — двухатомном водороде. Слева на приведенной ниже диаграмме у вас есть два изолированных атома, которые находятся так далеко, что синий электрон не чувствует притяжения к красному ядру, а красный электрон не чувствует притяжения к синему ядру, и поэтому нет связи. формы. По мере того, как они сближаются, электроны каждого атома начинают чувствовать притяжение к ядру другого атома и сближаются.
Рисунок \(\PageIndex{1}\): упрощенное изображение, показывающее водород в виде двух изолированных атомов (слева) и двухатомной ковалентной молекулы (справа)
Рисунок \(\PageIndex{2}\) представляет потенциальную энергию (ямка) диаграмма, показывающая энергию как функцию расстояния между двумя двумя атомами водорода. Вот если подумать, ноль энергии — это когда их разделяет бесконечность, и притяжения нет. Когда они соединяются, образуется связь, поскольку электроны каждого атома притягиваются к ядру другого [противоположные заряды притягиваются], энергия которого ниже нуля, потому что для разрыва связи необходимо добавить энергию. Но в какой-то момент они сближаются настолько, что ядра начинают отталкиваться друг от друга [как отталкиваются заряды], что заставляет их раздвигаться. Так что в действительности ковалентная связь не статична с фиксированной длиной связи, а является своего рода вибрацией, как в пружине, когда атомы колеблются вперед и назад.
Когда они соединяются, образуется связь, поскольку электроны каждого атома притягиваются к ядру другого [противоположные заряды притягиваются], энергия которого ниже нуля, потому что для разрыва связи необходимо добавить энергию. Но в какой-то момент они сближаются настолько, что ядра начинают отталкиваться друг от друга [как отталкиваются заряды], что заставляет их раздвигаться. Так что в действительности ковалентная связь не статична с фиксированной длиной связи, а является своего рода вибрацией, как в пружине, когда атомы колеблются вперед и назад.
Рисунок \(\PageIndex{2}\): Диаграмма потенциальной ямы, объясняющая, почему связь не статична, а колеблется, поскольку молекулы чередуются между [+/+] ядерными/ядерными отталкиваниями (когда они действительно близки) и [ +/-] ядерное/электронное притяжение (когда они начинают разделяться). Нижняя часть кривой считается длиной связи. Видео \ (\PageIndex{1}\) содержит анимацию, демонстрирующую это. Видео \(\PageIndex{1}\) : Если вы продвинете этот 3 :07 Youtube до 1:20, вы увидите образование ковалентной связи, когда два атома приближаются друг к другу, а на 2:06 анимацию показывает, как связь не статична, а колеблется. https://youtu.be/Wl5QHeS2UXE?t=128. Загружено доктором Амаль Кумар.
Двухатомные элементы
Атомы некоторых элементов образуют молекулы, образуя связи друг с другом, и если есть два атома, они называются двухатомными элементами, и вам необходимо знать семь двухатомных элементов.
Рисунок \(\PageIndex{3}\): Элементы, образующие двухатомные и многоатомные молекулы в своем естественном состоянии (CC BY-SA-NC; анонимно).
Те, что в таблице Менделеева окрашены в фиолетовый цвет, образуют двухатомные молекулы, те, что в зеленом, образуют многоатомные молекулы.
ПРИМЕЧАНИЕ: Когда мы говорим «кислород» (или любая двухатомная молекула), мы можем иметь в виду одноатомный кислород O или двухатомный кислород O 2 . Мы должны смотреть на контекст утверждения. Если мы описываем его как вещество, например, «он дышит кислородом», мы имеем в виду O 2 , но если мы описываем его как часть соединения, например, сколько атомов кислорода содержится в 3,00 граммах воды, мы имеем в виду O.
Мы должны смотреть на контекст утверждения. Если мы описываем его как вещество, например, «он дышит кислородом», мы имеем в виду O 2 , но если мы описываем его как часть соединения, например, сколько атомов кислорода содержится в 3,00 граммах воды, мы имеем в виду O.
Аллотропы
Аллотропы – это когда атомы элемента могут образовывать более одного стабильного соединения. Например, кислород может образовывать O 2 (двухатомный кислород) и O 3 (озон), которые являются аллотропами. (Не путать с изотопами, которые представляют собой разные нуклиды одного и того же элемента, содержащие разное количество нейтронов). Селен образует несколько аллотропов, включая Se 9.0110 2 , Se 6 и Se 8. Заметим, что наиболее устойчивый аллотроп может изменяться при изменении температуры и давления, например, при высоких T (900 o C) Se 2 является наиболее стабильны, но при более низкой температуре более крупные становились более устойчивыми.
Видео \(\PageIndex{2}\): 1:51 мин. YouTube на аллотропах углерода, загруженное Elearnin (https://youtu.be/sUqr6Uk29Z8).
Молекулярная формула
Когда несколько атомов удерживаются вместе ковалентными связями, они образуют единую химическую единицу, которую мы называем молекулой. Как постулируется в атомной теории Дальтона, соотношение атомов различных элементов представляет собой целые числа, и это можно описать молекулярной формулой молекулы. Таким образом, каждая молекула воды (H 2 O) имеет два атома водорода и один атом кислорода, в то время как каждая молекула аспирина (C 9 H 8 .O 4 ) имеет 9 атомов углерода, 8 водорода и 4 кислорода.
Представления молекулярных структур
Молекулярные формулы говорят вам, сколько атомов каждого типа элемента находится в связи, но они не обязательно говорят вам, какие атомы связаны с какими другими атомами, или их ориентацию в пространстве. Напротив, структурных формул показывают, какие атомы связаны друг с другом и, в некоторых случаях, примерное расположение атомов в пространстве. Знание структурной формулы соединения позволяет химикам создать трехмерную модель, которая предоставляет информацию о том, как это соединение будет вести себя физически и химически.
Напротив, структурных формул показывают, какие атомы связаны друг с другом и, в некоторых случаях, примерное расположение атомов в пространстве. Знание структурной формулы соединения позволяет химикам создать трехмерную модель, которая предоставляет информацию о том, как это соединение будет вести себя физически и химически.
Рисунок \(\PageIndex{4}\): Молекулы, содержащие одинарные, двойные и тройные связи. Водород (H 2 ) имеет одинарную связь между атомами. Кислород (O 2 ) имеет двойную связь между атомами, обозначенную двумя линиями (=). Азот (N 2 ) имеет тройную связь между атомами, обозначенную тремя линиями (≡). Каждая связь представляет собой электронную пару. (изображение из основного содержимого LibreText.)
Структурная формула для H 2 может быть представлена как H–H, а для I 2 — как I–I, где линия указывает на одну пару общих электронов, a одинарная связь. Две пары электронов являются общими в двойной связи, что обозначено двумя линиями, например, O 2 означает O=O. Три пары электронов являются общими в тройной связи, что обозначено тремя линиями, например, N 2 равно N≡N (см. рисунок \(\PageIndex{3}\) pr \(\PageIndex{4}\)). Углерод уникален тем, что он образует одинарные, двойные и тройные связи с самим собой и другими элементами. Количество связей, образуемых атомом в его ковалентных соединениях, не является произвольным. Водород, кислород, азот и углерод имеют очень сильную склонность к образованию веществ, в которых они имеют соответственно одну, две, три и четыре связи с другими атомами (таблица \(\PageIndex{1}\)).
Три пары электронов являются общими в тройной связи, что обозначено тремя линиями, например, N 2 равно N≡N (см. рисунок \(\PageIndex{3}\) pr \(\PageIndex{4}\)). Углерод уникален тем, что он образует одинарные, двойные и тройные связи с самим собой и другими элементами. Количество связей, образуемых атомом в его ковалентных соединениях, не является произвольным. Водород, кислород, азот и углерод имеют очень сильную склонность к образованию веществ, в которых они имеют соответственно одну, две, три и четыре связи с другими атомами (таблица \(\PageIndex{1}\)).
| Атом | Количество облигаций |
|---|---|
| H (группа 1) | 1 |
| О (группа 16) | 2 |
| Н (группа 15) | 3 |
| С (группа 14) | 4 |
Структурная формула воды может быть представлена следующим образом:
Поскольку последний аппроксимирует экспериментально определенную форму молекулы воды, он более информативен. Точно так же аммиак (NH 3 ) и метан (CH 4 ) часто записывают как плоские молекулы, хотя они и не являются плоскими:
Точно так же аммиак (NH 3 ) и метан (CH 4 ) часто записывают как плоские молекулы, хотя они и не являются плоскими:
Однако, как показано на рисунке \(\PageIndex{5}\), реальная трехмерная структура NH 3 выглядит как пирамида с треугольным основанием из трех атомов водорода. Структура CH 4 с четырьмя атомами водорода, расположенными вокруг центрального атома углерода, как показано на рисунке \(\PageIndex{3}\), является тетраэдрической: атомы водорода расположены в каждой другой вершине куба. Многие соединения, в частности соединения углерода, имеют четыре связанных атома, расположенных вокруг центрального атома, образуя тетраэдр.
Трехмерные структуры воды, аммиака и метана. а) Вода представляет собой молекулу V-образной формы, в которой все три атома лежат в одной плоскости. (b) Напротив, аммиак имеет пирамидальную структуру, в которой три атома водорода образуют основание пирамиды, а атом азота находится в вершине. в) четыре атома водорода метана образуют тетраэдр; атом углерода находится в центре. (изображение из основного содержимого LibreText.)
в) четыре атома водорода метана образуют тетраэдр; атом углерода находится в центре. (изображение из основного содержимого LibreText.)
Рисунок \(\PageIndex{6}\): Различные способы представления структуры метана (a) Молекулярная формула метанола дает только число присутствующих атомов каждого вида. (b) Структурная формула показывает, какие атомы связаны. (c) Модель шара и стержня изображает атомы в виде сфер, а связи — в виде стержней. (d) Перспективный рисунок (также называемый клиновидным изображением) пытается показать трехмерную структуру молекулы. (e) Модель заполнения пространства показывает атомы в молекуле, но не связи. (f) Сокращенная структурная формула — это, безусловно, самый простой и распространенный способ представления молекулы. (изображение из основного контента LibreText.)
Хотя структурная формула, шарико-стержневая модель, перспективный рисунок и заполняющая пространство модель предоставляют значительный объем информации о структуре молекулы, каждая из них требует времени. и усилие. Следовательно, химики часто используют сокращенную структурную формулу (часть (f) на рисунке \(\PageIndex{5}\)), в которой опущены линии, представляющие связи между атомами, и просто перечислены атомы, связанные с данным атомом рядом с ним. Несколько групп, присоединенных к одному и тому же атому, показаны в круглых скобках, за которыми следует нижний индекс, указывающий количество таких групп. Например, сокращенная структурная формула метанола — CH 3 OH, что указывает на наличие в молекуле звена CH 3 , похожего на фрагмент метана (CH 4 ). Таким образом, метанол можно рассматривать либо как молекулу метана, в которой один атом водорода заменен группой –ОН, либо как молекулу воды, в которой один атом водорода заменен фрагментом –СН 3 . Из-за простоты использования и информативности мы используем сокращенные структурные формулы для молекул в этом тексте. Шарико-стержневые модели используются, когда необходимо проиллюстрировать трехмерную структуру молекул, а заполняющие пространство модели используются только тогда, когда необходимо визуализировать относительные размеры атомов или молекул, чтобы понять важный момент.
и усилие. Следовательно, химики часто используют сокращенную структурную формулу (часть (f) на рисунке \(\PageIndex{5}\)), в которой опущены линии, представляющие связи между атомами, и просто перечислены атомы, связанные с данным атомом рядом с ним. Несколько групп, присоединенных к одному и тому же атому, показаны в круглых скобках, за которыми следует нижний индекс, указывающий количество таких групп. Например, сокращенная структурная формула метанола — CH 3 OH, что указывает на наличие в молекуле звена CH 3 , похожего на фрагмент метана (CH 4 ). Таким образом, метанол можно рассматривать либо как молекулу метана, в которой один атом водорода заменен группой –ОН, либо как молекулу воды, в которой один атом водорода заменен фрагментом –СН 3 . Из-за простоты использования и информативности мы используем сокращенные структурные формулы для молекул в этом тексте. Шарико-стержневые модели используются, когда необходимо проиллюстрировать трехмерную структуру молекул, а заполняющие пространство модели используются только тогда, когда необходимо визуализировать относительные размеры атомов или молекул, чтобы понять важный момент.
Пример \(\PageIndex{1}\)
Напишите молекулярную формулу каждого соединения.
- Соединение фосфора и серы, ответственное за воспламенение так называемых зажигательных спичек, содержит 4 атома фосфора и 3 атома серы на молекулу.
- Этиловый спирт, спирт алкогольных напитков, имеет 1 атом кислорода, 2 атома углерода и 6 атомов водорода на молекулу.
- , когда-то широко использовавшийся в автомобильных кондиционерах и причастный к повреждению озонового слоя, имеет 1 атом углерода, 3 атома хлора и 1 атом фтора на молекулу.
Фреон-11
Дано : идентификация присутствующих элементов и число атомов каждого
Запрошено : молекулярная формула
Стратегия :
- Определите символ для каждого элемента в молекуле. Определите, какое соединение является органическим или неорганическим соединением.
- Для неорганических соединений перечислите элементы, начиная с самого левого в таблице Менделеева.
 Перечислите элементы в одной группе, начиная с нижнего элемента и вверх. Для органических соединений сначала перечислите углерод, затем водород, затем любой другой элемент в алфавитном порядке.
Перечислите элементы в одной группе, начиная с нижнего элемента и вверх. Для органических соединений сначала перечислите углерод, затем водород, затем любой другой элемент в алфавитном порядке. - Из предоставленной информации добавьте нижний индекс для каждого вида атома, чтобы написать молекулярную формулу.
Раствор
а. В молекуле 4 атома фосфора и 3 атома серы. Поскольку соединение не содержит в основном углерод и водород, оно является неорганическим. Фосфор находится в группе 15, а сера в группе 16. Поскольку фосфор находится слева от серы, он пишется первым. Запись количества атомов каждого типа в правом нижнем индексе дает P 4 S 3 в качестве молекулярной формулы.
б. Этиловый спирт содержит преимущественно углерод и водород, поэтому он является органическим соединением. Формула органического соединения записывается с числом атомов углерода первым, числом атомов водорода затем, а остальные атомы в алфавитном порядке: CHO. C Добавление нижних индексов дает молекулярную формулу ]\(C_2H_6O\).
C Добавление нижних индексов дает молекулярную формулу ]\(C_2H_6O\).
в. Фреон-11 содержит углерод, хлор и фтор. Его можно рассматривать либо как неорганическое соединение, либо как органическое соединение (в котором фтор заменил водород). Таким образом, формула для фреона-11 может быть записана с использованием любого из двух соглашений. Согласно соглашению для неорганических соединений, углерод пишется первым, потому что он находится дальше в таблице Менделеева. Фтор и хлор находятся в одной группе, поэтому они перечислены, начиная с низшего элемента и вверх: CClF. Добавление нижних индексов дает молекулярную формулу CCl 3 F. Такую же формулу получаем для фреона-11, используя условное обозначение для органических соединений. Сначала записывается число атомов углерода, затем число атомов водорода (ноль), а затем остальные элементы в алфавитном порядке, что также дает CCl 3 F.
Упражнение \(\PageIndex{1}\)
Напишите молекулярную формулу каждого соединения.
- Закись азота, также называемая «веселящим газом», имеет 2 атома азота и 1 атом кислорода на молекулу. Закись азота используется в качестве мягкого анестетика при небольших хирургических вмешательствах и в качестве пропеллента в банках со взбитыми сливками.
- Сахароза, также известная как тростниковый сахар, имеет 12 атомов углерода, 11 атомов кислорода и 22 атома водорода.
- Гексафторид серы, газ, используемый для создания давления в теннисных мячах без давления и в качестве охлаждающей жидкости в ядерных реакторах, содержит 6 атомов фтора и 1 атом серы на молекулу.
- Ответить
А) Н 2 О
Б) С 12 Н 22 О 11
С) СФ 6
Пример \(\PageIndex{2}\)
Напишите молекулярную формулу для каждого соединения. Приведена сокращенная структурная формула.
- Монохлорид серы (также называемый дихлоридом серы) представляет собой коррозионно-желтую жидкость с неприятным запахом, используемую в производстве синтетического каучука.
 Его сокращенная структурная формула ClSSCl.
Его сокращенная структурная формула ClSSCl. - Этиленгликоль является основным компонентом антифриза. Его сокращенная структурная формула HOCH 2 CH 2 ОХ.
- Триметиламин – одно из веществ, ответственных за запах испорченной рыбы. Его сокращенная структурная формула (CH 3 ) 3 N.
Дано : сокращенная структурная формула
Запрошено : молекулярная формула
Стратегия :
- Определите каждый элемент в сокращенной структурной формуле, а затем определите, является ли соединение органическим или неорганическим.
- При необходимости используйте органические или неорганические обозначения для перечисления элементов. Затем добавьте соответствующие нижние индексы, чтобы указать количество атомов каждого элемента, присутствующего в молекулярной формуле.
Решение :
Молекулярная формула содержит список элементов в молекуле и число атомов каждого из них.
- Каждая молекула монохлорида серы имеет два атома серы и два атома хлора. Поскольку он не содержит в основном углерод и водород, это неорганическое соединение. В таблице Менделеева сера находится слева от хлора, поэтому в формуле она пишется первой. Добавление нижних индексов дает молекулярную формулу S 2 Класс 2 .
- Подсчитав количество атомов в этиленгликоле, мы получаем шесть атомов водорода, два атома углерода и два атома кислорода на молекулу. Соединение состоит в основном из атомов углерода и водорода, поэтому оно является органическим. Как и во всех органических соединениях, C и H пишутся первыми в молекулярной формуле. Добавление соответствующих индексов дает молекулярную формулу C 2 H 6 O 2 .
- Сокращенная структурная формула показывает, что триметиламин содержит три CH 3 единиц, поэтому у нас есть один атом азота, три атома углерода и девять атомов водорода на молекулу.
 Поскольку триметиламин содержит в основном углерод и водород, это органическое соединение. Согласно соглашению об органических соединениях, C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 N.
Поскольку триметиламин содержит в основном углерод и водород, это органическое соединение. Согласно соглашению об органических соединениях, C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 N.
Упражнение \(\PageIndex{2}\)
Напишите молекулярную формулу каждой молекулы.
- Хлороформ, который был одним из первых анестетиков и до недавнего времени использовался во многих сиропах от кашля, содержит один атом углерода, один атом водорода и три атома хлора.
- Гидразин используется в качестве топлива в реактивных двигателях космических челноков. Его сокращенная структурная формула H 2 NNH 2 .
- Путресцин — это соединение с резким запахом, впервые выделенное из экстрактов гниющего мяса. Его сокращенная структурная формула: H 2 NCH 2 CH 2 CH 2 CH 2 NH 2 . Это часто записывается как H 2 N (CH 2 ) 4 NH 2 , чтобы указать, что имеется четыре фрагмента CH 2 , связанных вместе.

- Ответить
а. CHCl 3
б. Н 2 Н 4
в. С 4 Н 12 Н 2
Ионные связи и ионные соединения
Если количество протонов в атоме или молекуле не равно количеству электронов, они имеют суммарный заряд и называются ионами. Заметьте, если это атом, то его называют одноатомным ионом, а если это молекула, то его называют многоатомным ионом. Очевидно, существует два типа ионов, положительные и отрицательные, которые называются соответственно катионами и анионами. Заряд иона равен количеству протонов минус количество электронов.
Катион: Суммарный положительный заряд, количество протонов больше, чем количество электронов
Анион: Суммарный отрицательный заряд, количество протонов меньше, чем количество электронов.
В следующем видео на Youtube рассматриваются некоторые концепции, которые мы изучим позже (электроотрицательность и полярные связи), но если вы посмотрите от одиннадцати до 49 секунд, вы получите хорошую визуализацию разницы между ионной и ковалентной связью.
Формула для ионных соединений.
При написании формулы ионного соединения мы используем наименьшее целочисленное отношение катионов ([+] ионов) к анионам ([-] ионов). Если вы посмотрите на кристалл соли, то увидите, что каждый положительный ион со всех 6 сторон окружен отрицательными ионами, и образуется кристаллическая решетка. Поэтому нет смысла иметь «молекулярную формулу» для ионного соединения, потому что число атомов будет расти по мере роста кристалла.
Рисунок \(\PageIndex{7}\) Слева показана кристаллическая решетка поваренной соли NaCl, которая также показана справа, где она образует кристаллы галита. Поскольку количество ионов зависит от размера кристалла, мы используем самое низкое соотношение положительных и отрицательных ионов, которое приводит к нейтральной структуре.
Поскольку количество ионов зависит от размера кристалла, мы используем самое низкое соотношение положительных и отрицательных ионов, которое приводит к нейтральной структуре.
Концепция ионных связей будет далее развита в следующем разделе.
Словарь
Проверь себя
Запрос \(\PageIndex{1}\)
Авторы и ссылки
Роберт Э. Белфорд (Университет Арканзаса Литл-Рок; химический факультет). Ответственность за широту, глубину и правдивость этой работы несет Роберт Э. Белфорд, [email protected]. Вы должны связаться с ним, если у вас есть какие-либо опасения. В этом материале есть как оригинальные материалы, так и контент, основанный на предыдущих вкладах сообщества LibreTexts и других ресурсов, включая, помимо прочего:
- Анонимный
- Модификации Ронии Каттум
- Елена Лисицына (интерактивные модули H5P)
Эта страница под названием 2.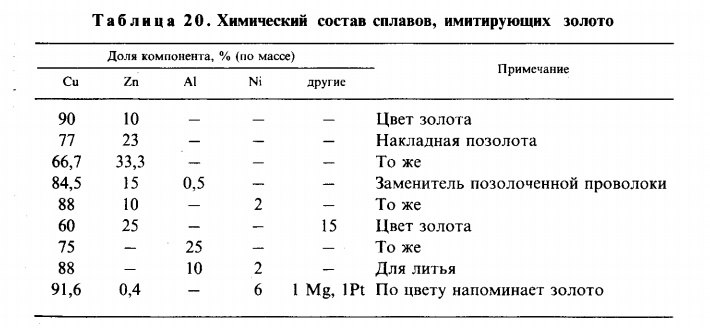 5: Химические соединения распространяется в соответствии с лицензией CC BY-NC-SA 4.0, ее автором, ремиксом и/или куратором является Роберт Белфорд.
5: Химические соединения распространяется в соответствии с лицензией CC BY-NC-SA 4.0, ее автором, ремиксом и/или куратором является Роберт Белфорд.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Роберт Белфорд
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- да на странице
- Теги

C26000 Alloy, C260 Картриджная латунь
Описание продукта: Картриджная латунь 70%
Отпуск: H01 четвертьтвердый, H02 полутвердый, H04 твердый
Шестигранник: от 3/8″ до 2″ Н.Д.
Стандартная длина: 144 дюйма
Архитектура: решетка
Автомобильная промышленность: электрические разъемы, сердцевины нагревателя, контакты одометра, сердцевины радиатора, бачки радиатора, трубка радиатора, бачки, термостаты
Строительные скобяные изделия: декоративные скобяные изделия, дверные ручки, отделочная фурнитура, петли, накладки, замки, нажимные пластины
Потребитель: клетки для птиц, пуговицы, звенья цепи, чеканка, бижутерия, травленые изделия, каминные экраны, лампы, вкладыши для ручек/карандашей и зажимы, плантаторы, корпуса (электрические розетки), защелки, детали шприцев, детали часов
Электрооборудование: корпуса фонарей, светильники, отражатели, корпуса винтов, клеммные соединители
Крепеж: проушины, застежки, люверсы, штифты, заклепки, винты
Промышленность: пневмотранспортные системы, бортовая цепь, цепь, теплообменники, вкладыши, силовые цилиндры, насосы, звукоизоляционное оборудование, пружины, трубки для приборов и машин, проволочные экраны
Боеприпасы, патронные гильзы, механические корпуса для зажигалок , снаряды (кожухи механические для боеприпасов)
Прочее: трафареты, шайбы
Сантехника: сантехника, накладки на краны, фурнитура, сантехнические аксессуары, сантехнические изделия из латуни, ловушки
| ЦДА | АСТМ | САЕ | АМС | Федеральный | Военный | Другое |
|---|---|---|---|---|---|---|
| C26000 | Б927 Б927М | Дж461 Дж463 | 70/30 |
| Cu% | Pb% | Zn% | Fe% | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
Химический состав согласно ASTM B927/B927M-17 Примечание: Cu + сумма названных элементов, 99,7% мин. | |||||||||||
| 68,50- 71,50 | 0,07 | Рем. | 0,05 | ||||||||
| Медный сплав UNS № | Класс обрабатываемости | Плотность (фунт/дюйм3 при 68 °F) |
|---|---|---|
| C26000 | 30 | 0,308 |
Механические свойства в соответствии с ASTM B927/B927M-17
С26000
H01 Четвертьтвердый
РАЗМЕРНЫЙ ДИАПАЗОН: ШТОК ДИАМЕТРОМ МЕНЕЕ 1/2 ДЮЙМА
| Прочность на растяжение, не менее | Предел текучести при удлинении 0,5% под нагрузкой, мин. | Удлинение, 4x Диаметр или 4x Толщина, мин. | Твердость по Роквеллу «B» | Замечания | ||
|---|---|---|---|---|---|---|
| тысяч фунтов на квадратный дюйм | МПа | фунтов на квадратный дюйм | МПа | % | типичный HRB | |
| 50 | 345 | 30 | 205 | 20 | 55 | |
ДИАПАЗОН РАЗМЕРОВ: СТЕРЖЕНЬ ОТ ДИАМЕТРА ОТ 1/2 ДЮЙМА ДО 1 ДЮЙМА ВКЛЮЧИТЕЛЬНО
| Прочность на растяжение, не менее | Предел текучести при удлинении 0,5% под нагрузкой, мин. | Удлинение, 4x Диаметр или 4x Толщина, мин. | Роквелл «B» Твердость | Замечания | ||
|---|---|---|---|---|---|---|
| тысяч фунтов на квадратный дюйм | МПа | фунтов на квадратный дюйм | МПа | % | типичный HRB | |
| 48 | 330 | 25 | 170 | 24 | 55 | |
ДИАПАЗОН РАЗМЕРОВ: СТЕРЖЕНЬ ДИАМЕТРОМ БОЛЕЕ 1 ДЮЙМА
| Прочность на растяжение, не менее | Предел текучести при удлинении 0,5% под нагрузкой, мин. | Удлинение, 4x Диаметр или 4x Толщина, мин. | Твердость по Роквеллу «B» | Замечания | ||
|---|---|---|---|---|---|---|
| тысяч фунтов на квадратный дюйм | МПа | фунтов на квадратный дюйм | МПа | % | типичный HRB | |
| 46 | 315 | 20 | 140 | 28 | 55 | |
C26000
H02 полутвердый
ДИАПАЗОН РАЗМЕРОВ: ШТОК ДИАМЕТРОМ МЕНЕЕ 1/2 ДЮЙМА
| Прочность на растяжение, не менее | Предел текучести при удлинении 0,5% под нагрузкой, мин. | Удлинение, 4x Диаметр или 4x Толщина, мин. | Твердость по Роквеллу «B» | Замечания | ||
|---|---|---|---|---|---|---|
| тысяч фунтов на квадратный дюйм | МПа | фунтов на квадратный дюйм | МПа | % | типичный HRB | |
| 57 | 395 | 35 | 241 | 15 | 70 | |
ДИАПАЗОН РАЗМЕРОВ: СТЕРЖЕНЬ ОТ ДИАМЕТРА ОТ 1/2 ДЮЙМА ДО 1 ДЮЙМА ВКЛЮЧИТЕЛЬНО
| Прочность на растяжение, не менее | Предел текучести при удлинении 0,5% под нагрузкой, мин. | Удлинение, 4x Диаметр или 4x Толщина, мин. | Твердость по Роквеллу «B» | Замечания | ||
|---|---|---|---|---|---|---|
| тысяч фунтов на квадратный дюйм | МПа | фунтов на квадратный дюйм | МПа | % | типичный HRB | |
| 54 | 370 | 32 | 220 | 20 | 70 | |
ДИАПАЗОН РАЗМЕРОВ: СТЕРЖЕНЬ ДИАМЕТРОМ БОЛЕЕ 1 ДЮЙМА
| Прочность на растяжение, не менее | Предел текучести при удлинении 0,5% под нагрузкой, мин. | Удлинение, 4x Диаметр или 4x Толщина, мин. | Твердость по Роквеллу «B» | Замечания | ||
|---|---|---|---|---|---|---|
| тысяч фунтов на квадратный дюйм | МПа | фунтов на квадратный дюйм | МПа | % | типичный HRB | |
| 50 | 345 | 30 | 205 | 25 | 70 | |
C26000
H04 Жесткий
РАЗМЕРНЫЙ ДИАПАЗОН: ШТОК ДИАМЕТРОМ МЕНЕЕ 1/2 ДЮЙМА
| Прочность на растяжение, не менее | Предел текучести при удлинении 0,5% под нагрузкой, мин. | Удлинение, 4x Диаметр или 4x Толщина, мин. | Твердость по Роквеллу «B» | Замечания | ||
|---|---|---|---|---|---|---|
| тысяч фунтов на квадратный дюйм | МПа | фунтов на квадратный дюйм | МПа | % | типичный HRB | |
| 70 | 485 | 50 | 345 | 10 | 82 | |
ДИАПАЗОН РАЗМЕРОВ: СТЕРЖЕНЬ ОТ ДИАМЕТРА ОТ 1/2 ДЮЙМА ДО 1 ДЮЙМА ВКЛЮЧИТЕЛЬНО
| Прочность на растяжение, не менее | Предел текучести при удлинении 0,5% под нагрузкой, мин. | Удлинение, 4x Диаметр или 4x Толщина, мин. | Роквелл «B» Твердость | Замечания | ||
|---|---|---|---|---|---|---|
| тысяч фунтов на квадратный дюйм | МПа | фунтов на квадратный дюйм | МПа | % | типичный HRB | |
| 65 | 450 | 45 | 310 | 15 | 82 | |
ДИАПАЗОН РАЗМЕРОВ: СТЕРЖЕНЬ ДИАМЕТРОМ БОЛЕЕ 1 ДЮЙМА
| Прочность на растяжение, не менее | Предел текучести при удлинении 0,5% под нагрузкой, мин. | Удлинение, 4x Диаметр или 4x Толщина, мин. | Твердость по Роквеллу «B» | Замечания | ||
|---|---|---|---|---|---|---|
| тысяч фунтов на квадратный дюйм | МПа | фунтов на квадратный дюйм | МПа | % | типичный HRB | |
| 60 | 415 | 40 | 275 | 20 | 82 | |
Физические свойства предоставлены CDA | |||||||||||
| Стандарт США | Метрическая система | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Точка плавления — ликвидус | 1750 °F | 954 °С | |||||||||
| Точка плавления — Солидус | 1680 °F | 916 °С | |||||||||
| Плотность | 0,308 фунта/дюйм3 при 68 °F | 8,53 г/см3 при 20 °C | |||||||||
| Удельный вес | 8,53 | 8,53 | |||||||||
| Электропроводность | 28% IACS при 68 °F | 0,162 мегасименс/см при 20 °C | |||||||||
| Теплопроводность | 70 БТЕ/кв. фут/фут·ч/°F при 68 °F фут/фут·ч/°F при 68 °F | 121,2 Вт/м при 20 °C | |||||||||
| Коэффициент теплового расширения 68-572 | 11,1 · 10-6 на °F (68-572 °F) | 19,2 · 10-6 на °C (20-300 °C) | |||||||||
| Удельная теплоемкость | 0,09 БТЕ/фунт/°F при 68 °F | 377,1 Дж/кг при 20 °C | |||||||||
| Модуль упругости при растяжении | 16000 фунтов на квадратный дюйм | 110317 МПа | |||||||||
| Модуль жесткости | 6000 фунтов/кв. дюйм | 41369 МПа | |||||||||
Свойства изготовления, предоставленные CDA | |||||||||||
| Техника | Пригодность | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Пайка | Отлично | ||||||||||
| Пайка | Отлично | ||||||||||
| Ацетиленовая сварка | Хорошо | ||||||||||
| Дуговая сварка в среде защитного газа | Хорошо | ||||||||||
| Дуговая сварка металла с покрытием | Не рекомендуется | ||||||||||
| Точечная сварка | Ярмарка | ||||||||||
| Сварной шов | Не рекомендуется | ||||||||||
| Сварка встык | Хорошо | ||||||||||
| Способность к холодной обработке | Отлично | ||||||||||
| Возможность горячей штамповки | Ярмарка | ||||||||||
| Класс обрабатываемости | 30 | ||||||||||
Термические свойства предоставлены CDA *Температура измеряется в градусах Фаренгейта. |

 Отдельные значения представляют максимумы.
Отдельные значения представляют максимумы.