Формула меди: Формула Меди структурная химическая
Содержание
Меди гидроокись | справочник Пестициды.ru
Физико-химические свойства
Гидроокись меди – кристаллическое или аморфное вещество голубого цвета. В воде практически не растворяется. При нагревании Cu(OH)2 или его водных растворов до 70–90°С разлагается до CuO и H2О. С кислотами образует соответствующие соли, в водных растворах щелочей – ярко-синие неустойчивые купраты[6].
Физические характеристики
- молекулярная масса – 97,56;
- плотность – 3,368 г/см3[6].
Действие на вредные организмы
Механизм действия. Взаимодействие ионов меди с аминогруппами грибной клетки, сульфгидрильными группами ферментов и коферментов обуславливают активность медьсодержащих фунгицидов, в том числе, и препаратов на основе меди гидроокиси. Это взаимодействие способствует денатурации и осаждению белков, что ведет к гибели клеток патогенов[2].
Резистентность. Препарат не вызывает резистентности[7].
Препарат не вызывает резистентности[7].
Применение
Опрыскивание препаратом желательно проводить утром или вечером при температуре воздуха не больше 22–25°С. Эффективность препарата значительно снижается при выпадении дождя после обработки[8].
Зарегистрированные препараты на основе меди гидроокиси разрешены к применению в сельском хозяйстве против болезней винограда (милдью), яблони (монилиоз, парша)[4][3].
Баковые смеси. Препарат может быть совместим со многими пестицидами, кроме серной извести и сильных кислотных соединений[8].
Фитотоксичность. Благодаря сбалансированному содержанию меди, препарат не фитотоксичен для растений[7].
Токсикологические данные | |
| ДСД (мг/кг массы тела человека) | 0,17 |
| ПДК в почве (мг/кг) | 3,0 |
| ПДК в воде водоемов (мг/дм3) | 1,0 (орг. ) ) |
| ПДК в воздухе рабочей зоны (мг/м3) | 0,5 |
| ПДК в атмосферном воздухе (мг/м3) | 0,0008 |
| МДУ в продукции (мг/кг): | |
в бахчевых | 5,0 |
в винограде | 5,0 |
в картофеле | 2,0 |
в луке | 5,0 |
в мясе | 2,0 |
в овощах | 5,0 |
в огурцах | 5,0 |
в плодовых (косточковые, семечковые) | 5,0 |
в свекле сахарной | 5,0 |
в томатах | 5,0 |
в цитрусовых | 20,0 |
в ягодах | 5,0 |
в яйцах | 2,0 |
| ВМДУ в продукции (мг/кг): | |
в хмеле сухом | 10,0 |
Токсикологические свойства и характеристики
Теплокровные. Медьсодержащие препараты ядовиты для теплокровных животных и человека[5].
Медьсодержащие препараты ядовиты для теплокровных животных и человека[5].
В почве. Установлено, что медь и ее соединения оказывают бактерицидное действие на микроорганизмы водоемов и почвы, что может привести к угнетению процессов минерализации органических веществ и почвенной микрофлоры[5].
Классы опасности. Препараты на основе меди гидроокиси относятся ко 2 классу опасности для человека и 3 классу опасности для пчел[4].
Таблица Токсикологические данные составлена в соответствии с ГН 1.2.3111-13[1].
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Гигиенические критерии состояния окружающей среды №64. Карбаматные пестициды: общее введение. Всемирная организация здравоохранения, Женева, 1991. – 128 с.
2.
Голышин Н. М. Фунгициды. — М.: Колос, 1993. -319 с.: ил.
— М.: Колос, 1993. -319 с.: ил.
3.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2013 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России)
4.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2022 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России)
5.
Медведь Л.И. Справочник по пестицидам (гигиена применения и токсикология) / Коллектив авторов, под ред. академика АМН СССР, профессора Медведя Л.И. -К.: Урожай, 1974. 448 с.
6.
Химическая энциклопедия. Гл.ред. Кнунянц И.Л. М.: Сов.энцикл., 1990. – 623 с.
Источники из сети интернет:
7.
http://agrohimteh.ru
8.
http://www.agroserver.ru
СвернутьСписок всех источников
Металлические нанопорошки
19 Мая 2020
КОМПАНИЯ «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» (ТОМСК, РФ) ИЗГОТАВЛИВАЕТ НАНОПОРОШКИ ОКСИДА МЕДИ И ЦИНКА С АНТИМИКРОБНЫМ ДЕЙСТВИЕМ
КОМПАНИЯ «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» (ТОМСК, РФ) ИЗГОТАВЛИВАЕТ НАНОПОРОШКИ ОКСИДА МЕДИ И ЦИНКА С АНТИМИКРОБНЫМ ДЕЙСТВИЕМ
Пандемия коронавируса COVID-19 показала, что существует неотложная потребность в эффективных мерах по предотвращению распространения вирусных инфекций различных нозологий. Последние случаи вспышек вируса атипичной пневмонии, птичьего гриппа, гриппа h2N1, и наконец, коронавируса COVID-19 показали, что высокоэффективные бытовые технические средства, позволяющие прервать пути распространения инфекций, отсутствуют. На данный момент известно, что есть два главных пути передачи вирусов.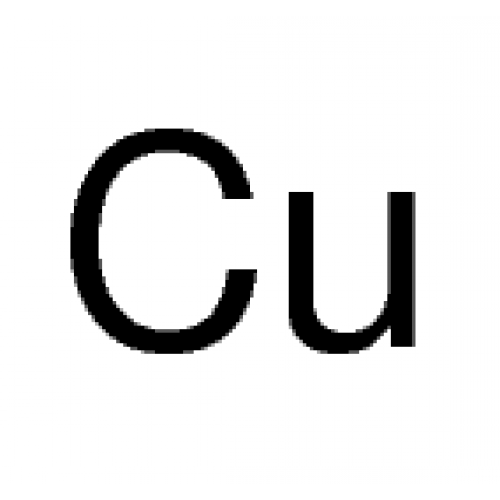 Во-первых, это воздушно-капельный механизм передачи инфекции, во-вторых, это контакт человека с зараженными поверхностями.
Во-первых, это воздушно-капельный механизм передачи инфекции, во-вторых, это контакт человека с зараженными поверхностями.
В настоящее время для прерывания путей передачи вирусов в быту в качестве индивидуальных защитных средств используются маски, защищающие органы дыхания, перчатки и различные антисептики, которыми обрабатываются руки и окружающие предметы и поверхности.
Защитные маски позволяют уменьшить распространение респираторных вирусов, особенно при использовании в замкнутом пространстве или при тесном контакте с человеком с симптомами заражения [1, 2]. Однако сами маски также могут быть источником инфекции [3]. Маска примерно через два часа становится влажной и уже в ней начинают размножаться микроорганизмы. По мнению ВОЗ, маски не гарантируют защиты от COVID-19. Установлено, что эффективность хирургических масок даже самого высокого класса защиты FFP3 недостаточна (гриппом заражается не менее 23 % медицинских сестер, носивших хирургические маски класса FFP3).
Вирус COVID-19 передается не только воздушно-капельным, но и контактным путем, и может сохраняться на поверхностях до 72 часов. Поэтому другой стороной вышеуказанной проблемы является передача вирусов, в т.ч. COVID-19, в лечебных учреждениях через медицинскую одежду, постельное белье, корпуса медицинского оборудования и др.
Поэтому другой стороной вышеуказанной проблемы является передача вирусов, в т.ч. COVID-19, в лечебных учреждениях через медицинскую одежду, постельное белье, корпуса медицинского оборудования и др.
Одним из путей решений вышеуказанных проблем является придание натуральным и искусственным, в т.ч. медицинским, материалам и поверхностям антисептических свойств, например, с помощью биоцидных наночастиц. Волокна, импрегнированные биоактивными наночастицами, проявляют биоцидные свойства – антибактериальные, противогрибковые, противовирусные [4]. В большинстве современных исследований в области применения наночастиц для уничтожения патогеннов, основное внимание уделяется однокомпонентным наноматериалам (например, наночастицам оксида меди CuO, оксида цинка ZnO, серебра Ag). До недавнего времени серебро оставалось наиболее популярным материалом, который предлагался как эффективное антимикробное средство. Однако последние исследования показывают, что серебро при применении в действующих концентрациях оказывает цитотоксический эффект на клетки организма человека [5]. Кроме того серебро имеет высокую стоимость, что приведет к заметному увеличению цены конечной продукции. Поэтому сейчас основное внимание уделяется применению в качестве бактерицидных и противовирусных материалов наночастицам CuO и ZnO, которые практически малотоксичны для человека.
Кроме того серебро имеет высокую стоимость, что приведет к заметному увеличению цены конечной продукции. Поэтому сейчас основное внимание уделяется применению в качестве бактерицидных и противовирусных материалов наночастицам CuO и ZnO, которые практически малотоксичны для человека.
Например, импрегнация биоактивных наночастиц оксида меди в фильтрующий материал позволяет придать одноразовым респираторным маскам мощные биоцидные свойства без изменения их барьерных свойств [6]. При контакте с вирусом ионы меди вызывают массовое повреждение компонентов клеточной стенки, вирусных генов и ключевых белков [7].
Таким образом, с использованием нанопорошков оксидов меди и цинка, возможно разработать ряд продуктов, позволяющих прервать пути передачи вирусов в быту и в медицинских учреждениях – лицевых масок, одежды медицинского персонала, перчаток, больничных простыней, корпусов медицинского оборудования, контейнеры для хранения продуктов, клавиатуру компьютеров, корпуса мобильных телефонов и др.
Компания «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» может изготовить нанопорошки оксидов меди и цинка для разработки новых антимикробных материалов.
1. Jefferson T, Foxlee R, Del Mar C, Dooley L, Ferroni E, et al. (2008) Physicalinterventions to interrupt or reduce the spread of respiratory viruses: systematicreview. BMJ 336: 77–80.
2. Jefferson T, Foxlee R, Del Mar C, Dooley L, Ferroni E, et al. (2007) Interventions for the interruption or reduction of the spread of respiratoryviruses. Cochrane Database Syst Rev 6207.
3. Zhiqing L. et al. Surgical masks as source of bacterial contamination during operative procedures //Journal of orthopaedic translation.2018; 14: 57-62.
4. Borkow, G. and Gabbay, J. (2004). Putting Copper into Action:Copper-impregnated Products with Potent Biocidal Activities, FASEB Jounal,18(14): 1728–1730.
5. Akter M. et al. A systematic review on silver nanoparticles-induced cytotoxicity: Physicochemical properties and perspectives //Journal of advanced research. – 2018. – Т. 9. – С. 1-16.
– 2018. – Т. 9. – С. 1-16.
6. Gadi Borkow et al. A Novel Anti-Influenza Copper Oxide Containing Respiratory Face Mask // PLoS ONE, June 2010, Volume 5, Issue 6.
7. Borkow & Gabbay (2005) Copper as a biocidal tool. Current Medicinal Chemistry12:2163-75
ООО «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ»
Адрес: 634055, Российская Федерация, Томск, проспект Академический, 8/8
Телефон/Факс: +7 (3822) 28-68-72 , 8-961-888-16-24
http://www.nanosized-powders.com
Химическая формула меди. Степени окисления, свойства и ответы на часто задаваемые вопросы валюты. В химии химическая формула меди обозначается как Cu. поскольку медь принадлежит к группе переходных металлов в периодической таблице, которая имеет подоболочку d и обозначается как (n — 1) d переход. Имеет атомный номер 29.. Медь очень мягкая, ковкая, пластичная, а свежая открытая поверхность меди имеет розовато-оранжевый цвет.
Они являются хорошими проводниками электричества с высокой теплопроводностью и поэтому широко используются в качестве металла в электропроводке. Различные сплавы также используются для изготовления ювелирных изделий, где используется стерлинговое серебро, медно-никелевый сплав используется для изготовления монет и морского оборудования, термопар для измерения температуры и тензодатчика из медного сплава константана. Необработанная металлическая форма меди показана ниже.
Различные сплавы также используются для изготовления ювелирных изделий, где используется стерлинговое серебро, медно-никелевый сплав используется для изготовления монет и морского оборудования, термопар для измерения температуры и тензодатчика из медного сплава константана. Необработанная металлическая форма меди показана ниже.
Степени окисления меди
Хотя медь демонстрирует несколько степеней окисления из-за наличия d-оболочек в диапазоне +1, +2,+3,+4, наиболее стабильной является степень окисления +2. Распределение электронов валентной оболочки переходного металла меди: Xe 4s 1 3d 10 . Таким образом, подоболочка 4s как 1 электрон вместе с 3d-электронами вместе действует как электроны валентной оболочки. Таким образом, получение стабильных степеней окисления относится к энергетическому балансу. Таким образом, потеря электронов из валентных оболочек требует энергии, а получение сильного окисления означает потерю валентных электронов, которые требуют большей энергии. Таким образом, затраты энергии на достижение определенной степени окисления должны компенсироваться сродством к электрону неметалла и электростатическими силами притяжения диполей и связывания отрицательных ионов.
Таким образом, затраты энергии на достижение определенной степени окисления должны компенсироваться сродством к электрону неметалла и электростатическими силами притяжения диполей и связывания отрицательных ионов.
Таким образом, металлическая медь может потерять дополнительный одиночный электрон из подоболочки 3d с одним 4s-электроном, энергия которого компенсируется, но переход к более высокому окислению требует большей энергии, которая компенсируется сродством к электрону неметалла и электростатическими силами притяжения диполей и отрицательных ионов. и поэтому неустойчивы по своей природе. Но для более электроотрицательных атомов, таких как фтор и кислород, которые обладают более высоким сродством к электрону, при образовании соединения возникает более высокая степень окисления меди. Но большинство известных соединений меди проявляют степень окисления меди +2, например CuSO 9 .0015 4 , который представляет собой формулу сульфата меди.
Так как сульфатная группа в формуле сульфата меди сама по себе имеет степень окисления +2, а в формуле сульфата меди только один атом меди уравновешивает один атом сульфата. Таким образом, ясно, что CuSO 4 имеет степень окисления Cu (II). Другим распространенным соединением окисления меди Cu (II) является оксид меди или оксид меди, который является названием соединения CuO. Химически формула оксида меди или формула оксида меди CuO.
Таким образом, ясно, что CuSO 4 имеет степень окисления Cu (II). Другим распространенным соединением окисления меди Cu (II) является оксид меди или оксид меди, который является названием соединения CuO. Химически формула оксида меди или формула оксида меди CuO.
Производство и метод
Большая часть меди добывается из крупных карьеров медно-порфировых месторождений в виде сульфидов меди, которые содержат около 0,5-1,0% меди. Большинство этих медных рудников расположены в Чили, штат Юта, США и Мексике. По данным Британской геологической службы, перец чили был одним из крупнейших производителей медной руды в 2005 году, за ним следуют США, Индонезия и Перу. С 1900 года использование меди резко возросло, и с учетом чистого количества меди, доступного по всему миру, было трудно сопоставить использование меди с использованием в развитых странах. Таким образом, появилась альтернатива меди, которая представляет собой полиметаллические конкреции, также известные как марганцевые конкреции, которые извлекаются из концентрических слоев меди и гидроксида марганца, присутствующих на дне океана.
На протяжении многих лет, начиная с 1900 года, некоторые методы используются для добычи меди. Для извлечения меди из конкреций используются такие методы, как серное выщелачивание, плавка с последующим применением меднокислотного процесса. Таким образом, медь, присутствующая в рудах земли, восстанавливается до 10-15% меди путем пенной флотации и процесса отбеливания. Таким образом, чтобы удалить большую часть железа, присутствующего в рудном взвеси, проводят плавление материала с кремнеземом, так что железо удаляется в виде шлака. Этот метод превращает сульфиды железа в оксиды, которые реагируют с кремнеземом с образованием силикатного шлака, всплывающего на поверхность нагретого материала. Таким образом, оставшийся медный штейн находится в форме сульфида меди, то есть Cu 2 Название соединения S, и его обжигают для превращения сульфидов в оксид меди (l), который представляет собой другую формулу оксида меди со стадией окисления +1, которая нестабильна по своей природе и легко разлагается при нагревании до чистой меди.
2Cu 2 S + 3O 2 → 2Cu 2 O + 2SO 2
2Cu 2 O → 4Cu + O 2
Another process by which copper is synthesised in the laboratory происходит путем восстановления CuO, формулы оксида меди. В этой реакции оксид меди восстанавливается в присутствии водорода, где он теряет свой кислород, который присоединяется к водороду с образованием воды, и поэтому также называется гидролизом CuO.
CuO + H 2 → Cu + H 2 O
Еще один жизнеспособный процесс: формула сульфата меди помещается в контейнер, называемый автоклавом, и подвергается воздействию газообразного водорода при давлении 25 бар (где давление H 2 газ около 30 бар). Затем раствор сульфата меди (на самом деле это название соединения CuSO4) нагревают примерно до 150 oC в течение часа, что приводит к образованию меди, которая выпадает в осадок в виде медного порошка.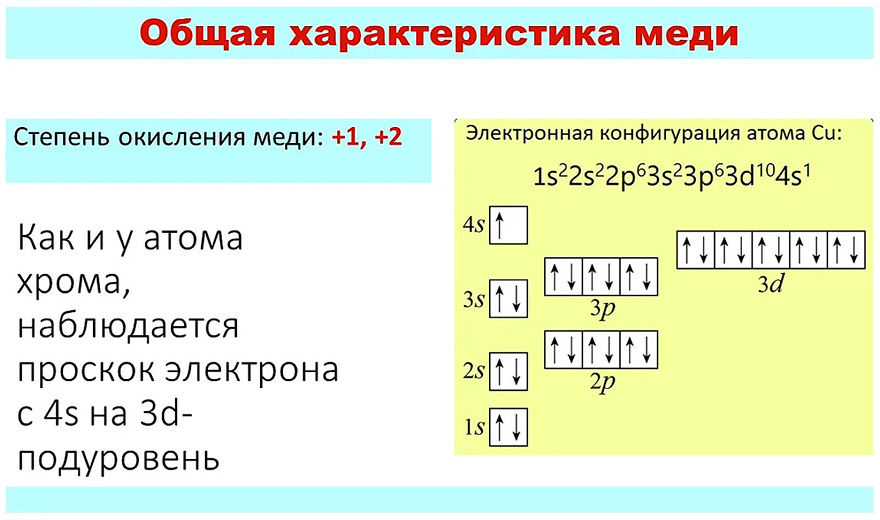
CuSO 4 (водн.) + H 2 (г) → Cu(s) + H 2 SO 4 (водн.)
Физико-химические свойства меди следующие:
Свойства меди
Properties | Values |
Atomic Weight | 63.546 g/mol |
Atomic Number | 29 |
Phase | Solid |
Melting Point | 1084.62 oC or 1357.77 K |
Boiling Point | 2562 oC or 2835 K |
Плотность | 8,96 г/см3 8,02 г/см3 в жидком состоянии. |
Теплота плавления | 13,26 кДж/моль |
ОТВЕТ ВАПУРИЗАЦИИ | 300,4 кДж/моль |
Молярная теплоемкость | 24.440 Дж. (Моль. Шкала Полинга. |
Энергия ионизации | 1-я: 745,5 кДж/моль 2-я: 1957,9 кДж/моль0 |
Атомный радиус | 128 PM |
Термическое расширение | 16,5 мкм/(M.K). ) |
Твердость | 3,0 мм.0090 |
Удельное электрическое сопротивление | 16,78 нОм·м при 20 oC. |
Young’s Modulus | 110 -128 GPa |
Spectra Lines of Copper |
Conclusion
The chemical element copper has the atomic number 29 and the symbol Cu. Это металл с чрезвычайно высокой тепло- и электропроводностью, мягкий, ковкий и пластичный. Чистая медь имеет розовато-оранжевый оттенок при первом контакте с воздухом. В качестве тепло- и электропроводного материала медь также используется в строительстве. Он также является компонентом нескольких металлических сплавов, в том числе мельхиора, который используется для создания монет и военно-морского оборудования, и константана, который используется в тензодатчиках и термопарах для измерения температуры.
Это металл с чрезвычайно высокой тепло- и электропроводностью, мягкий, ковкий и пластичный. Чистая медь имеет розовато-оранжевый оттенок при первом контакте с воздухом. В качестве тепло- и электропроводного материала медь также используется в строительстве. Он также является компонентом нескольких металлических сплавов, в том числе мельхиора, который используется для создания монет и военно-морского оборудования, и константана, который используется в тензодатчиках и термопарах для измерения температуры.
Химическая формула меди: свойства и применение
- Автор
Анкита Сахай - Последнее изменение 30-11-2022
Химическая формула меди: Медь — это металл, имеющий символ «\({\rm{Cu}}\»). Медь является третьим наиболее широко используемым металлом в мире. Это элемент d-блока в периодической таблице с атомным номером \(29\). Он кажется красноватым и является чрезвычайно пластичным металлом. Медь также известна как «чеканочный металл», потому что она использовалась для изготовления монет в древние времена. Это один из хорошо известных металлов, который используется во многих областях по всему миру.
Это один из хорошо известных металлов, который используется во многих областях по всему миру.
Медь является чрезвычайно хорошим проводником тепла и электричества, и благодаря этому свойству меди она широко используется для изготовления посуды и электрических проводов. Медь также является необходимым микроэлементом, необходимым человеческому организму. Медь обычно извлекается из руд Халькопирит, также известный как медный колчедан и подобные сульфидные руды. Медь в основном встречается в Чили и Перу, расположенных в Южной Америке. В Индии основными производителями меди являются Джаркханд, Раджастхан и Мадхья-Прадеш. После того, как медные руды извлечены, они обрабатываются в несколько этапов для извлечения из них чистой и рафинированной металлической меди.
Химическая формула меди
Узнайте, как написать химическую формулу
Название происходит от латинского слова cuprum , обозначающего Кипр, остров, где римляне впервые получили медь. Поскольку медь является элементом, вместо химической формулы у нее есть символ. Символ меди: \({\rm{‘Cu’}}\). Символ \({\rm{‘Cu’}}\) происходит от самого купрума . Этот элемент известен с доисторических времен.
Символ меди: \({\rm{‘Cu’}}\). Символ \({\rm{‘Cu’}}\) происходит от самого купрума . Этот элемент известен с доисторических времен.
Медь — это металл, который используется в различных сферах жизни и занимает важное место в цивилизации. Медь находится в группе \(11\) и периоде \(4\) современной периодической таблицы. Его атомный номер \(29{\text {th}}\) элемент современной периодической таблицы, также известный как переходный элемент, поскольку он является элементом d-блока. Некоторые важные физические свойства меди приведены ниже:
- Медь имеет характерный красновато-коричневый цвет.
- Медь — чрезвычайно мягкий, пластичный и ковкий металл. Таким образом, ему можно придать нужную форму или согнуть в соответствии с нашими потребностями.
- Является хорошим проводником тепла и электричества. По этой причине из него изготавливают электрические провода и посуду. 9{65} \mathrm{Cu}\)
Химические свойства меди
1. Как и другие металлы, медь реагирует с влажной атмосферой, что приводит к коррозии. Медь тускнеет до сине-зеленого цвета, образуя гидроксид меди и карбонат меди. Но процесс коррозии в меди протекает крайне медленно, так как под воздействием влаги и воздуха на поверхности металлической меди образуется защитный оксидный слой и основные соли.
Медь тускнеет до сине-зеленого цвета, образуя гидроксид меди и карбонат меди. Но процесс коррозии в меди протекает крайне медленно, так как под воздействием влаги и воздуха на поверхности металлической меди образуется защитный оксидный слой и основные соли.
2. Медь растворяется в азотной кислоте.
3. Медь реагирует с кислородом воздуха с образованием оксида меди (II).
\({\rm{2Cu}}\left( {\rm{s}} \right){\rm{ + }}{{\rm{O}}_{\rm{2}}}\left ( {\rm{g}} \right) \to {\rm{2CuO}}\left( {\rm{s}} \right)\)
4. Медь реагирует с галогенами с образованием галогенидов меди разных цветов. , такие как хлорид меди (желто-коричневое твердое вещество в безводном и сине-зеленое твердое вещество в дигидрате), фторид меди (белый цвет) и бромид меди (черный цвет).
5. В ряду реакционной способности металлов медь занимает нижнее положение. Таким образом, он менее реактивен. Медь вытесняется железом, когда железный гвоздь опускают в раствор медного купороса. Это приводит к образованию сульфата железа и меди.
\(\mathrm{CuSO}_{4}(\mathrm{aq})+\mathrm{Fe}(\mathrm{s}) \rightarrow \mathrm{FeSO}_{4}(\mathrm{aq} )+\mathrm{Cu}(\mathrm{s})\)
Использование меди
1. Они используются в электроприборах – Поскольку медь является отличным проводником электричества и имеет низкое удельное сопротивление. Серебро — еще один металл, который является отличным проводником электричества, даже лучше, чем медь. Его доступная цена делает его широко используемым во всем мире в производстве электроэнергии, передаче электроэнергии, телекоммуникациях, электронных схемах, производстве электрических проводов, кабелей и т. д.
2. Используется для изготовления посуды – Благодаря высокой теплопроводности, высокой температуре плавления и кипения, а также высокой пластичности медь широко используется для изготовления посуды различных форм и размеров. Как и другие металлы, медные сосуды легко проводят тепло к хранящейся в них пище и быстро готовят ее.
3. Медь также используется в теплообменниках кондиционеров, радиаторах компьютеров, автомобильных радиаторах, термосварочных машинах и телевизорах, поскольку этот металл является хорошим проводником тепла.
Медь также используется в теплообменниках кондиционеров, радиаторах компьютеров, автомобильных радиаторах, термосварочных машинах и телевизорах, поскольку этот металл является хорошим проводником тепла.
4. Медь очень полезна в водопроводных трубах и соединительных шинах, которые являются жизненно важными элементами систем распределения электроэнергии, поскольку ее можно легко соединить пайкой, болтами или клеем.
5. Медь является одним из основных питательных веществ для человеческого организма. Он обеспечивает образование эритроцитов в организме вместе с железом. Достаточное количество меди в рационе очень важно, поскольку она помогает поддерживать здоровье костей, кровеносных сосудов, нервов и иммунной системы. Медь помогает предотвратить сердечно-сосудистые заболевания и остеопороз. Медью богаты моллюски, орехи и семечки, крупы с пшеничными отрубями, цельнозерновые продукты, шоколад, мясо и т. д.
6. Медь также используется при изготовлении скульптур и статуй из-за легкости соединения. Он также используется ювелирами и другими ремесленниками.
Он также используется ювелирами и другими ремесленниками.
7. Медь широко используется в автомобилях в качестве высокочистого медного провода, по которому проходит ток от автомобильного аккумулятора по всему автомобилю к такому оборудованию, как фары, центральный замок, цифровой экран и системы спутниковой навигации. Он также используется в электромобилях.
8. Медь также используется в трубопроводах. Он используется для транспорт вода для бытовых нужд; он также используется для подачи природного газа в дома и другие места, где это необходимо.
9. Изготавливаются различные сплавы из меди, такие как бронза (медь и олово), латунь (медь и цинк), никель-серебро (медь, цинк и никель). Эти сплавы прочнее и устойчивы к коррозии, чем металлическая медь.
Резюме
В двух словах, медь — это металл, представленный как ‘\({\rm{Cu}}\)’. Это переходный металл, поскольку он присутствует в \ ({\ rm {d}} \) -блоке периодической таблицы.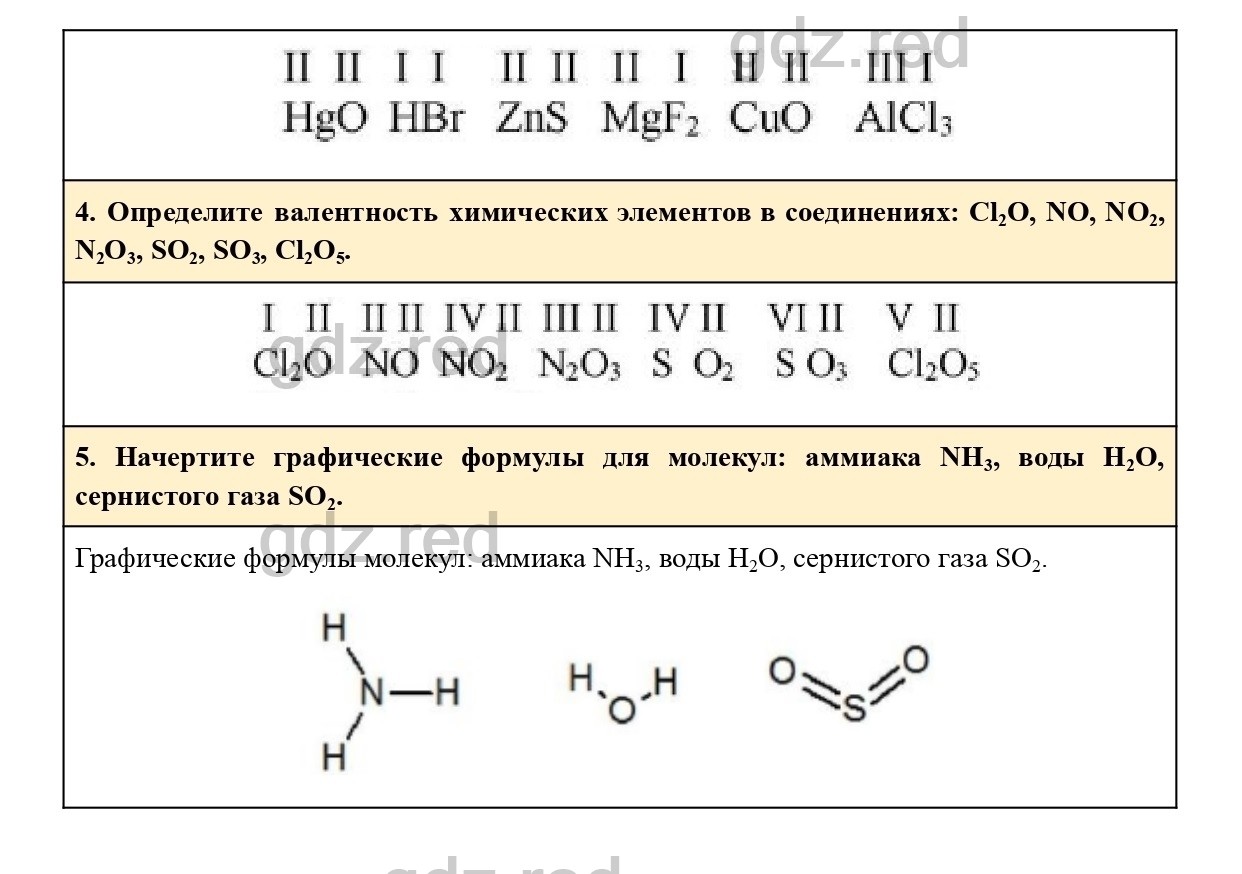 Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт», которая в основном добывается в Южной Америке. Медные рудники также есть в некоторых частях Индии, таких как Джаркханд, Раджастхан и т. д. С древних времен медь была необходима для различных видов жизнедеятельности.
Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт», которая в основном добывается в Южной Америке. Медные рудники также есть в некоторых частях Индии, таких как Джаркханд, Раджастхан и т. д. С древних времен медь была необходима для различных видов жизнедеятельности.
Это хороший проводник электричества, поэтому в основном используется для изготовления электрических проводов, кроме меди. Серебро — еще один металл, который является отличным проводником электричества, но медь дешевле серебра, поэтому ее используют для изготовления электрических проводов. Медь поставляет электричество и чистую воду в наши дома и города и играет важную роль в достижении устойчивого развития. Более того, это необходимо для самой жизни, поскольку нашему телу нужны следы меди в качестве минералов, чтобы выжить. 9{1}\)
Q.2. Откуда произошло химическое название меди?
Ответ: Химически медь обозначается как ‘\({\rm{Cu}}\)’. Его символ происходит от латинского слова cuprum , обозначающего Кипр, остров, где римляне впервые получили медь. Таким образом, символ \({\rm{‘Cu’}}\) происходит от первых двух букв самого купрума .
Его символ происходит от латинского слова cuprum , обозначающего Кипр, остров, где римляне впервые получили медь. Таким образом, символ \({\rm{‘Cu’}}\) происходит от первых двух букв самого купрума .
Q.3. Что такое медь?
Ответ: Медь — это металл, присутствующий в d-блоке периодической таблицы. Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт». Медь — очень ковкий и пластичный металл. Кроме того, это отличный проводник электричества и тепла. Благодаря этим уникальным свойствам медь широко используется в производстве электрических проводов и посуды. Он используется в различных сферах жизни и имеет древнюю историю. Медь также известна как «металл для монет», потому что в древние времена люди использовали медные монеты.
Q.4. Каковы два химических свойства меди?
Ответ: Два химических свойства меди: (i) Медь реагирует с кислородом воздуха с образованием оксида меди (II).

