Характеристика элемента медь: Ошибка 403 — доступ запрещён
Содержание
Эссенциальные микроэлементы: что это, их роль в жизнедеятельности человека
Общие сведения
Минеральный состав внутриклеточной жидкости строго поддерживается на определенном уровне.
Элементы вместе с водой являются строительным материалами, кофакторами и катализаторами биохимических реакций, стабилизаторами белков и ферментов, обеспечивая постоянство осмотического давления, кислотно-щелочного баланса, процессов всасывания, секреции, кроветворения, костеобразования, свертывания крови. Благодаря присутствию элементов осуществляется процесс мышечного сокращения, нервной проводимости и внутриклеточного дыхания. Химические элементы в организме находятся в виде различных соединений и солей, их влияние на организма обусловлено дозой элемента. Для каждого элемента существует свой физиологический рабочий диапазон концентраций, обеспечивающий нормальное протекание физиологических реакций в организме.
Нарушенная экология, возросший темп жизни с неизбежным нарастанием стрессовых ситуаций, методы обработки продуктов питания, «убивающие» биологически активные вещества ведут к нарушению металло-лигандного гомеостаза и сдвигу равновесия в сторону увеличения или уменьшения концентрации элемента. Накопление элементов или их дефицит способствует активации альтернативных путей метаболизма, который в ряде случаев приводят к патологическим состояниям.
Накопление элементов или их дефицит способствует активации альтернативных путей метаболизма, который в ряде случаев приводят к патологическим состояниям.
Химические элементы классифицируются в зависимости от их роли в организме. 98% тела человека состоит из органических элементов: H, C, N, O. Вместе с неорганическими элементами Na, Mg, K, Ca, P, S, Cl они составляют основу клеток и тканей, выполняя структурообразующую функцию. К эссенциальным или жизненно необходимым микроэлементам относятся Mn, Fe, Co, Ni, Cu, Zn, Mo, Se, I, при их отсутствии нарушаются базовые реакции деления и размножение клеток. К условно-эссенциальным микроэлементам относятся Li, V, Cr, B, F, Si, As, их роль до конца не определена. Существуют также «токсические металлы», которые в минимальных концентрациях способны оказывать стимулирующее воздействие на организм, но в высоких концентрациях проявляют токсические эффекты.
Микроэлементы составляют лишь 0,02% организма, но способны изменять протекание важнейших биологических реакций. Анализ волос или мочи позволяет выявить избыточное накопление микроэлементов или их дефицит. Содержание микроэлементов в волосах отражает микроэлементный статус организма в целом, поэтому пробы волос являются интегральным показателем минерального обмена. Волосы помогают диагностировать хронические заболевания, когда они себя еще ничем не проявляют.
Анализ волос или мочи позволяет выявить избыточное накопление микроэлементов или их дефицит. Содержание микроэлементов в волосах отражает микроэлементный статус организма в целом, поэтому пробы волос являются интегральным показателем минерального обмена. Волосы помогают диагностировать хронические заболевания, когда они себя еще ничем не проявляют.
Железо (Fe)
Железо является жизненно необходимым элементом для организма. Железо входит в состав гемсодержащих белков (гемоглобин и миоглобин) и участвует в переносе кислорода. Железо также входит в состав цитохромов (сложные белки, относящиеся к классу хромопротеидов), участвующих в процессах тканевого дыхания.
Общее содержание железа в организме человека составляет 3-5 г. Из этого количества 57% находится в гемоглобине крови, 23% — в тканях и тканевых ферментах (ферритин и гемосидерин), а остальные 20% — депонированы в печени, селезенке, костном мозге, мышцах и представляют собой «физиологический резерв» железа. Железо существует в двух формах: окисленной (Fe3+) и воcстановленной (Fe2+). Восстановленная форма лучше усваивается организмом. Только 10 % поступившего железо всасывается в кишечнике.
Железо существует в двух формах: окисленной (Fe3+) и воcстановленной (Fe2+). Восстановленная форма лучше усваивается организмом. Только 10 % поступившего железо всасывается в кишечнике.
Физиологическая потребность в железе:
- мужчины: 8–10 мг/сут;
- женщины: 15–20 мг/сут;
- беременных женщины: 30–40 мг/сут;
- дети: 4–18 мг/сут.
В больших количествах восстановленная форма железа (гемовое железо), содержится: в свиной печени, говяжьих почках, сердце и печени. Окисленная форма железа (негемовое железо) содержится в неживотных продуктах: непросеянной муке, сушеных персиках, орехах, бобах, спарже, овсяном толокне.
Недостаток железа приводит к тяжелым расстройствам, наиболее важным из которых является железодефицитная анемия. Железодефицитная анемия может привести к сердечной недостаточности.
Избыточное накопление железа приводит к отложению металла в органах (печень, поджелудочная железа, суставы, сердце). Явления отравления железом выражаются рвотой, диареей, падением артериального давления, параличом ЦНС и воспалением почек. При лечении железом могут развиться запоры, так как железо связывает сероводород, что ослабляет моторику кишечника. Избыток железа в организме может привести к дефициту меди, цинка, хрома и кальция, а также к избытку кобальта.
Явления отравления железом выражаются рвотой, диареей, падением артериального давления, параличом ЦНС и воспалением почек. При лечении железом могут развиться запоры, так как железо связывает сероводород, что ослабляет моторику кишечника. Избыток железа в организме может привести к дефициту меди, цинка, хрома и кальция, а также к избытку кобальта.
Йод (I)
Йод необходим на всех этапах жизнедеятельности. Период младенчества и раннего детства являются критическими в отношении дефицита йода. Йод входит в состав гормонов щитовидной железы тироксина (T4) и трийодтиронина (T3). Йод необходим для роста и дифференцировки клеток всех тканей организма человека, внутриклеточного дыхания, регуляции трансмембранного транспорта натрия и гормонов.
Общее количество йода в организме составляет 25 мг, из них 15 мг аккумулирует щитовидная железа. Значительное количество йода содержится в печени, почках, коже, волосах, ногтях, яичниках и предстательной железе.
Физиологическая потребность в йоде:
- взрослые: 100–150 мкг/сут;
- беременные: 175–200 мкг/сут;
- дети: от 60 до 150 мкг/сут.
Богатым источником йода являются водоросли, овощи, выращенные на почве обогащенной йодом, лук, морепродукты.
При недостаточном поступлении йода у взрослых увеличиваются размеры щитовидной железы, замедляется основной обмен, наблюдается падение артериального давления. У детей недостаток йода сопровождается резкими изменениями всей структуры тела: ребенок отстает в умственном и физическом развитии.
Избыток йода в организме наблюдается при гипертиреозе. Развивается Базедова болезнь, сопровождающаяся экзофтальмом, тахикардией, раздражительностью, мышечной слабостью, потливостью, исхуданием, склонностью к диарее. Повышение основного обмена ведет к гипертермии, дистрофическим изменениям кожи и ее придатков, раннему поседению, депигментации кожи на ограниченных участках (витилиго), атрофии мышц.
Марганец (Mn)
Важен для репродуктивных функций и нормальной работы центральной нервной системы. Марганец участвует в синтезе нейромедиаторов, улучшает мышечные рефлексы, обеспечивает развитие соединительной и костной ткани, увеличивает утилизацию жиров, усиливает эффекты инсулина.
3–5 % поступившего марганца всасывается. Наиболее богаты марганцем трубчатые кости и печень, поджелудочная железа. Марганец содержится в клетках, богатых митохондриями.
Физиологическая потребность в марганце:
- взрослые: 2–5 мг/сут;
- для детей в 2 раза выше.
Особенно богаты марганцем чай, растительные соки, цельные злаковые, орехи, зеленые овощи с листьями, горох, свёкла.
При недостатке марганца нарушаются процессы окостенения во всем скелете, трубчатые кости утолщаются и укорачиваются, суставы деформируются. Нарушается репродуктивная функция яичников и яичек.
Избыток марганца усиливает дефицит магния и меди.
Медь (Cu)
Медь принимает участие в поддержание эластичности связок, сухожилий, кожи и стенок легочных альвеол, стенок капилляров, а также прочности костей. Медь входит в состав защитных оболочек нервных волокон, участвует в процессах пигментации, так как входит в состав меланина. Медь влияет на углеводный обмен, посредством усиления процессов окисления глюкозы и торможения распада гликогена мышц и печени. Медь обладает противовоспалительными действиями, помогает при борьбе с бактериальными агентами. Медь является кофактором ферментов антиоксидантной защиты и помогает нейтрализовать действие свободных радикалов.
Общее содержание меди в организме человека составляет примерно 100–150 мг. Лучше всего организм усваивает двухвалентную медь. В тонком кишечнике всасывается до 95% меди, поступившей с пищей. Основное «депо» меди в организме — печень, поскольку синтезирует белок-переносчик меди церулоплазмин.
Физиологическая потребность в меди:
- взрослые: 1 мг/сут;
- дети: от 0,5 до 1 мг/сут.

Медь содержится в овощах, бобовых, морепродуктах, яблоках.
При недостатке меди в организме наблюдаются: задержка роста, анемия, дерматозы, депигментация волос, частичное облысение, потеря аппетита, сильное исхудание, понижение уровня гемоглобина, атрофия сердечной мышцы. Избыток меди приводит к дефициту цинка и мoлибдена, а также марганца.
Молибден (Мо)
Способствует метаболизму углеводов и жиров, является важной частью фермента, отвечающего за утилизацию железа, в связи с чем помогает предупредить анемию. Принимает участие в обмене мочевой кислоты, включении фтора в состав эмали зубов, гемопоэзе.
Биодоступность молибдена составляет 50%. Молибден не депонируется в организме, а распределяется между клетками крови.
Физиологическая потребность в молибдене:
- взрослые: 45–100 мкг/сут;
- дети: от 0,5 до 1 мг/сут.
Содержится в темно-зеленых листовых овощах, неочищенном зерне, бобовых. Проявления недостаточности изучены плохо. Повышенное содержание в организме встречается очень редко.
Проявления недостаточности изучены плохо. Повышенное содержание в организме встречается очень редко.
Селен (Sе)
Элемент антиоксидантной защиты, хорошо сочетается с витамином Е. Селен помогает поддерживать должную эластичность тканей. Селен усиливает иммунитет, поэтому активно используется в онкологической практике, в лечении гепатитов, панкреатитов, кардиомиопатий. Селен защищает организм от тяжёлых металлов.
Всасывается в тонком кишечнике, депонируется в почках, печени, костном мозге.
Физиологическая потребность в селене:
- женщины: 50 мкг/сут;
- беременные: 65 мкг/сут;
- мужчины: 70 мкг/сут;
- дети: 10-50 мкг/сут.
В чистом виде встречается в природе редко, главным образом в виде примеси к сернистым металлам. Присутствует в чесноке, сале, отрубях, белых грибах, растительных маслах, морских водорослях.
При дефиците селена в организме усиленно накапливаются мышьяк и кадмий, которые, в свою очередь, еще больше усугубляют его дефицит.
Избыток селена приводит к гепато- и холецистопатиям, изменениям работы нервно-мышечного аппарата (боли в конечностях, судороги, чувство онемения). Избыток может привести к дефициту кальция.
Цинк (Zn)
Цинк входит в состав более 300 ферментов, чем объясняет его влияние на углеводный, жировой и белковый обмен веществ, на окислительно-восстановительные процессы, регуляцию активности генов. Цинк связан с правильным функционированием репродуктивной, неврологической, иммунной систем, ЖКТ и кожи. Присутствие микроэлемента важно для нормального сперматогенеза, органогенеза, работы нейромедиаторов и панкреатических ферментов, правильного развития тимуса, эпителизации ран в процессе заживления и ощущения вкуса.
В организме содержится около 1,5–3 г цинка. Цинк всасывается в тонком кишечнике. Медь является антагонистом цинка, и конкурирует с цинком за всасывание в кишечнике. 99% цинка находится внутриклеточно, 1% — в плазме. Цинк присутствует во всех органах и тканях, но в большей степени цинк депонируют предстательная железа, семенники, мышцы, кожа, волосы.
Физиологическая потребность в цинке составляет: 12 мг/сут для взрослых, 3–2 мг/сут для детей.
Наиболее богаты цинком дрожжи, пшеничные, рисовые и ржаные отруби, зерна злаков и бобовых, какао, морепродукты, грибы, лук, картофель.
При дефиците цинка наблюдается задержка роста, перевозбуждение нервной системы и быстрое утомление. Поражение кожи происходит с утолщением эпидермиса, отеком кожи, слизистых оболочек рта и пищевода, ослаблением и выпадением волос. Недостаточное поступление цинка приводит к бесплодию. Дефицит цинка может приводить к усиленному накоплению железа, меди, кадмия, свинца.
При цинковом отравлении наступает фиброзное перерождение поджелудочной железы. Избыток цинка задерживает рост и нарушает минерализацию костей.
Кобальт (Co)
Входит в состав витамина В12, участвует в обмене гормонов щитовидной железы, подавляет обмен йода, регулирует гемопоэз, усиливает всасываемость железа.
В организме 1,5 г кобальта. Биодоступность кобальта 20%. В организм кобальт депонируется в печени, костной ткани и мышцах.
Биодоступность кобальта 20%. В организм кобальт депонируется в печени, костной ткани и мышцах.
Физиологическая потребность в кобальте составляет: 10 мкг/сут для взрослых.
Кобальт содержится в печени, молоке, овощах.
Дефицит кобальта связан с В12-дефицитной анемией, вегетарианством или паразитарной инвазией. Избыток кобальта наблюдается при интоксикации кобальта (вредное производство, разрушение ортопедических имплантантов).
Никель (Ni)
Никель пролонгирует эффекты инсулина, участвует в окислении аскорбиновой кислоты, ускоряет образование дисульфидных групп.
Никель всасывается в кишечнике, биодоступность от 1 до 10 %. Запасы никеля находятся в поджелудочной железе, легких, сердце.
Физиологическая потребность в никеле составляет: 100–200 мкг/сут для взрослых.
Богаты никелем чай, гречиха, морковь и салат.
Дефицит никеля не описан. Избыток никеля наблюдается при его токсическом поступлении, злокачественных новообразованиях легких, ожогах, инсультах и инфарктах. Избыток может проявлять потерей пигментацией кожи.
Избыток может проявлять потерей пигментацией кожи.
Минеральные вещества | Tervisliku toitumise informatsioon
В человеческом организме установлено наличие более 70 химических элементов. Достоверно установлена потребность в более чем 20 биоэлементах. Для обеспечения достаточного количества этих элементов крайне важно, чтобы питание было разнообразным.
Встречающиеся в организме минеральные вещества можно условно разделить на две группы:
- Содержание макроэлементов в организме составляет более 0,01%. Ими являются фосфор (P), кальций (Ca), натрий (Na), калий (K), магний (Mg), сера (S), хлор (Cl) (см Таблица 1).
- Содержание микроэлементов – менее 0,01%, у некоторых даже 0,00001.
Потребность в некоторых микроэлементах установлена, это железо (Fe), цинк (Zn), медь (Cu), йод (I), селен (Se) , марганец (Mn), молибден (Mo), фтор (F), хром (Cr), кобальт (Co), кремний (Si), ванадий (V), бор (B), никель (Ni), мышьяк (As) и олово (Sn).
Помимо них в организме обнаружен целый ряд элементов, функция которых пока не ясна, их появление в организме может быть обусловлено загрязнением окружающей среды и частым соприкосновением с ними. Например, люди, работающие в теплицах, постоянно контактируют с химическими веществами, различные элементы могут быть признаком разного рода заболеваний. В числе таких элементов алюминий (Al), стронций (Sr), барий (Ba), рубидий (Rb), палладий (Pd), бром (Br).
В организм могут попадать и тяжелые, т.е. ядовитые металлы, такие как кадмий (Cd), ртуть (Hg) или свинец (Pb).
Минеральные вещества в нашем организме являются важными компонентами скелета, биологических жидкостей и энзимов и способствуют передаче нервных импульсов.
Люди и животные получают различные биологические элементы из пищи, воды и окружающего воздуха, самостоятельно синтезировать минеральные вещества живые организмы не могут. В растениях минеральные вещества накапливаются из почвы, и их количество зависит от места произрастания и наличия удобрений. В питьевой воде также имеются минеральные вещества, и их содержание зависит от места, откуда получают воду.
В питьевой воде также имеются минеральные вещества, и их содержание зависит от места, откуда получают воду.
Несмотря на то, что человек нуждается в небольших количествах минеральных веществ (макроэлементов в миллиграммах и граммах, микроэлементов – в милли- и микрограммах), в его организме, тем не менее, отсутствуют достаточные запасы минеральных веществ, чтобы нормально перенести их долговременный дефицит. Потребность в минеральных веществах зависит также от возраста, пола и прочих обстоятельств (см Таблица 2). Например, повышенная потребность в железе у женщин связана с менструациями и беременностью, а спортсменам требуется больше натрия, потому что он интенсивно выводится с потом.
Чрезмерные количества минеральных веществ могут привести к сбоям в работе организма, потому что, будучи компонентами биоактивных соединений, они оказывают влияние на регуляторные функции. Получать чрезмерные количества минеральных веществ (за исключением натрия) с пищей практически невозможно, однако это может произойти при чрезмерном употреблении биологически активных добавок и обогащенных минеральными веществами продуктов.
Усвоению минеральных веществ могут препятствовать:
- злоупотребление кофе,
- употребление алкоголя,
- курение,
- некоторые лекарства,
- некоторые противозачаточные таблетки,
- определенные вещества, встречающиеся в некоторых продуктах, например, в ревене и шпинате.
Потери минеральных веществ при тепловой обработке продуктов питания значительно меньше, чем потери витаминов. Однако при рафинировании или очистке часть минеральных веществ удаляется. Поэтому важно есть больше цельнозерновых и нерафинированных продуктов. Минеральные вещества могут образовывать соединения с другими веществами, содержащимися в продуктах питания (например, с оксалатами в ревене), в результате чего организм не может их усвоить.
Таблица 1
Названия и источники важнейших минеральных веществ
Обозначение | Название | Лучшие источники * |
Макроэлементы | ||
Na | натрий | поваренная соль (NaCl), готовая еда, сыр, ржаной хлеб, консервы, мясные продукты, оливки, картофельные чипсы |
K | калий | растительные продукты: сушеные фрукты и ягоды, орехи, семена, топинамбур, картофель, редис, капуста, зеленые овощи, мука «Кама», свёкла, банан, ржаной хлеб, смородина, томаты |
Ca | кальций | молоко и молочные продукты (особенно сыр), миндаль, орехи, семена, рыба (с костями), шпинат |
Mg | магний | орехи, семена, мука «Кама», ржаной хлеб, шпинат, бобовые, греча, цельнозерновые продукты, свинина, говядина и курятина, банан, брокколи |
P | фосфор | семена, орехи, молочные продукты (особенно сыр), печень, птица, говядина, ржаной хлеб, рыба, цельнозерновые продукты, бобовые |
S | сера | продукты с белками, содержащими аминокислоты метионин (зерновые, орехи) и цистеин (мясо, рыба, соевые бобы, зерновые) |
Cl | хлор | поваренная соль |
Микроэлементы | ||
Fe | железо | печень, кровяная колбаса, семечки, яйца, изюм, ржаной хлеб, нежирная говядина и свинина, цельнозерновые продукты, греча, клубника |
Zn | цинк | печень, мясо, мука «Кама», семена, орехи, сыр, ржаной хлеб, бобовые, дары моря (крабы, салака), цельнозерновые продукты, яйца |
Cu | медь | печень, какао-порошок, мясо, бобовые, цельнозерновые продукты, семена, орехи, греча, ржаной хлеб, лосось, авокадо, свёкла, дары моря |
I | йод | йодированная соль, рыба и другие дары моря, сыр, яйца, некоторые виды ржаного хлеба и йогурта |
Se | селен | арахис, печень, рыба и дары моря, семена подсолнечника, мясо |
* Количество, содержащееся в 100 г продукта, покрывает не менее 10% суточной потребности взрослой женщины
Таблица 2
Рекомендуемые в зависимости от возраста суточные нормы потребления важнейших минеральных веществ
Возраст | Натрий, мг | Кальций, мг | Калий, г | Магний, мг | Железо, мг | Цинк, мг | Медь, мг | Йод, мкг | Селен, мкг |
Дети |
|
|
|
|
|
|
|
|
|
6–11 месяцев | до 650 | 550 | 1,1 | 80 | 8 | 5 | 0,3 | 60 | 15 |
12–23 месяца | до 830 | 600 | 1,4 | 85 | 8 | 6 | 0,3 | 90 | 25 |
2–5 лет | до 1580 | 600 | 1,8 | 120 | 8 | 6 | 0,4 | 90 | 30 |
6–9 лет | до 1580 | 700 | 2 | 200 | 9 | 7 | 0,5 | 120 | 30 |
Женщины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 2,9 | 300 | 11 | 8 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
18–30 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
31–60 лет | до 2400 | 800 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
61–74 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
> 75 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
Беременные | до 2400 | 900 | 3,1 | 360 | 15 | 10 | 1 | 175 | 60 |
Кормящие матери | до 2400 | 900 | 3,1 | 360 | 15 | 11 | 1,3 | 200 | 60 |
Мужчины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 3,3 | 300 | 11 | 11 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,5 | 380 | 11 | 12 | 0,9 | 150 | 60 |
18–30 лет | до 2400 | 900 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
31–60 лет | до 2400 | 800 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
61–74 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
> 75 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
* Для 18–20-летних рекомендуемая суточная доза составляет 900 мг кальция и 700 мг фосфора.
** Потребность в железе зависит от потери железа при менструациях. Для женщин в постменопаузе рекомендуемая дневная доза железа составляет 10 мг.
*** Для достижения сбалансированного содержания железа во время беременности в организме женщины должны иметься запасы железа как минимум на 500 мг больше, чем до беременности. В двух последних триместрах беременности, в зависимости от уровня железа в организме, может потребоваться дополнительный прием железа.
**** На самом деле, селена можно потреблять больше указанной в таблице рекомендованной дозы, поскольку селен по-разному всасывается из разных источников и происходит постоянное обеднение им поверхности, т.е. таблицы питательной ценности продуктов «не поспевают» за истинным положением дел (в них зачастую указываются значения больше реальных).
Максимальные разовые безопасные дозы минеральных веществ и пищевых добавок:
| Минеральное вещество | Доза |
|---|---|
| Кальций (мг) | 2500 |
| Фосфор (мг) | 3000 |
| Калий (мг) | 3,7* |
| Железо (мг) | 60 |
| Цинк (мг) | 25 |
| Медь (мг) | 5 |
| Йод (мкг) | 600 |
| Селен (мкг) | 300 |
* Только из биоактивных добавок или обогащенной пищи
Факты о меди – Химия для детей
Пожалуйста, напишите или поделитесь этой статьей!
Электронная почта
ФБ
Медь — это элемент периодической таблицы элементов, который находится в первой строке одиннадцатого столбца таблицы.
Известно, что медь является переходным металлом в силу ее специфических свойств.
Атомный символ меди — Cu, а ее атомный номер — 29. Это означает, что медь имеет 29протонов, 29 электронов, а также 34 нейтрона.
Медь появляется в виде твердого металла при комнатной температуре, как и большинство металлов, и ее температура плавления составляет 1084 градуса Цельсия.
Его температура кипения чрезвычайно высока и составляет 2562 градуса по Цельсию.
Благодаря высокой температуре плавления 1084 градуса мы знаем, что медь стабильна в твердом состоянии при очень высоких температурах.
Характеристики и свойства
Типичная форма меди при комнатной температуре и в чистом виде представляет собой твердый металл оранжево-медного цвета.
Медь особенно известна своей способностью проводить электричество и тепло, что делает ее широко используемой в электропроводке и производстве.
Еще одним дополнительным свойством меди, которое позволяет так часто использовать ее в промышленных условиях, является ее способность изгибаться, перемещаться и преобразовываться в новые формы.
История
Интересно, что медь была одним из первых металлических элементов, которые люди использовали в качестве инструмента.
Однако открытие меди произошло так давно в древней истории, что сегодня мы не знаем, кто был первым человеком, открывшим медь как элемент.
Медь можно найти во внешнем слое земной коры и часто даже в чистом виде, в отличие от других типов металлов, которые необходимо очищать перед использованием.
По этой причине многие древние цивилизации могли использовать его без предварительной очистки.
Причина, по которой медь обычно встречается в чистом виде, заключается в том, что она очень медленно реагирует с кислородом.
Поскольку его реакция медленная и незначительная, он не очень сильно меняется по сравнению с его первоначальной формой на воздухе (за исключением того, что со временем он зеленеет!)
На самом деле, первичная реакция меди на воздухе заключается в изменении цвета от ярко-оранжевого до более темно-коричневого цвета, а при воздействии воды она может корродировать в карбонат зеленого цвета.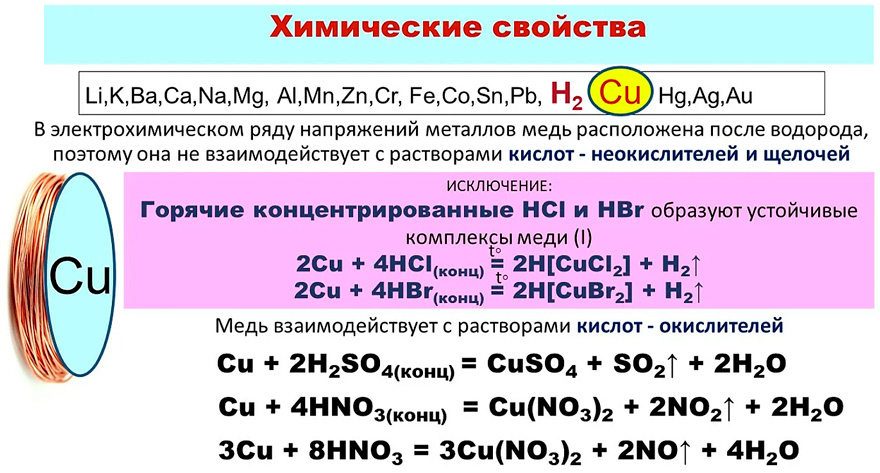 .
.
Интересно, что Статуя Свободы в Соединенных Штатах полностью сделана из меди, и причина, по которой статуя сегодня кажется зеленой, связана с коррозией от окружающей воды (как на острове).
Статуя Свободы, вид с парома кольцевой линии, Манхэттен, Нью-Йорк
Медь на 100% пригодна для повторного использования, и основное место, откуда мир получает медь, — это переработка или рудники в Чили, Южная Америка.
Как и денежная единица Соединенных Штатов, никель, который на самом деле только частично состоит из никеля, пенни Соединенных Штатов также только частично состоит из меди.
До 1982 года пенни на 95% состояли из меди, но после этого года медь выросла в цене и в цене, поэтому пенни теперь состоят из 97,5% цинка, и только 2% их состава составляют меди.
Веселая викторина!
- Какой химический символ у меди?
- Сколько протонов у меди?
- В какой форме находится медь при комнатной температуре?
- Какого цвета медь?
- Что происходит, когда медь подвергается воздействию воды?
Ответы:
- Cu
- 29
- Цельный металл, но сгибаемый
- Блестящий оранжево-коричневый
- Корродирует и со временем зеленеет
Химия
Медь (Cu) Элемент: важные физико-химические свойства,
Медь представляет собой элемент с химическим символом Cu и атомным номером 29. Медь, которая классифицируется как переходный металл, находится в твердом состоянии при температуре окружающей среды. Медь — мягкий, ковкий металл, который хорошо проводит электричество и хорошо нагревается. Чистая медь не подвергается коррозии; со временем он взаимодействует с воздухом, образуя покрытие серо-зеленого карбоната меди, известного как медь-медь. Это видно на статуях из меди, таких как Статуя Свободы.
Медь, которая классифицируется как переходный металл, находится в твердом состоянии при температуре окружающей среды. Медь — мягкий, ковкий металл, который хорошо проводит электричество и хорошо нагревается. Чистая медь не подвергается коррозии; со временем он взаимодействует с воздухом, образуя покрытие серо-зеленого карбоната меди, известного как медь-медь. Это видно на статуях из меди, таких как Статуя Свободы.
Свойства элемента меди (Cu), применение
Чистая медь — единственный элемент, имеющий красноватый оттенок. Провода являются основным применением чистой меди в электрооборудовании. Медная проволока, намотанная на железный сердечник и затем наэлектризованная, способствует созданию электромагнита. Медь часто комбинируют с другими металлами для создания более твердых сплавов, таких как бронза и латунь.
Содержание
История меди
Медь является одним из древнейших обнаруженных металлов. Есть свидетельства того, что медь была обнаружена в 4 000 г. до н. э., однако она могла быть обнаружена примерно на 5 000 лет раньше. Почти десять лет назад археологи Калифорнийского университета в Сан-Диего обнаружили в Хирбат Хамра Ифдан недалеко от Мертвого моря медеплавильный завод с 70 помещениями, который датируется примерно 2700 годом до нашей эры; это один из первых проверенных заводов по производству формальных металлов.
до н. э., однако она могла быть обнаружена примерно на 5 000 лет раньше. Почти десять лет назад археологи Калифорнийского университета в Сан-Диего обнаружили в Хирбат Хамра Ифдан недалеко от Мертвого моря медеплавильный завод с 70 помещениями, который датируется примерно 2700 годом до нашей эры; это один из первых проверенных заводов по производству формальных металлов.
С доисторических времен медь была необходимым минералом для человечества. Один из основных «эпох» или периодов в истории человечества обозначается как бронза в честь медного сплава. Медь и ее многочисленные сплавы сыграли значительную роль в развитии нескольких цивилизаций, от древних египтян и римлян до современных обществ по всему миру.
Медь на протяжении тысячелетий использовалась для чеканки монет, ювелирных изделий и украшений, но промышленная революция положила начало ее широкому использованию. Чтобы удовлетворить растущий спрос на универсальные металлы и семейства их сплавов с промышленными качествами в отношении формовки, коррозионной стойкости и проводимости, были разработаны крупномасштабные процессы добычи и переработки.
История названия: Медь происходит от латинского термина «cuprum», что означает «кипрский металл», поскольку остров Кипр в Средиземном море был давним источником добычи меди. Символ элемента Cu также происходит от меди.
Месторождение меди
Самородная медь может быть найдена во многих местах, как в виде первичного минерала в базальтовой лаве, так и в виде восстановленной формы соединений меди, таких как сульфиды, арсениды, хлориды и карбонаты. Он содержится в золе водорослей, некоторых морских кораллах, печени человека, многочисленных моллюсках и членистоногих. Медь выполняет ту же функцию транспорта кислорода в гемоцианине голубокровных моллюсков и ракообразных, что и железо в гемоглобине краснокровных видов. Медь, микроэлемент, присутствующий в организме человека, помогает стимулировать синтез гемоглобина.
Медь входит в состав нескольких минералов, включая халькоцит, халькопирит, борнит, куприт, малахит и азурит. Крупнейшее известное месторождение минерала — медно-порфировое месторождение в Андах Чили. В начале 21 века Чили стала крупнейшим в мире производителем меди. Перу, Китай и США также являются крупными производителями.
Крупнейшее известное месторождение минерала — медно-порфировое месторождение в Андах Чили. В начале 21 века Чили стала крупнейшим в мире производителем меди. Перу, Китай и США также являются крупными производителями.
Медные руды
| Азурит | Cu 3 (CO 3 ) 2 (ОН) 2 | |
| Борнит | Cu 5 4 Fe 44 8 44 | |
| Халькоцит | Cu 2 S | |
| Халькопирит | CuFeS 2 | |
| Ковеллит | CuS 90154087 Куприт | Cu 2 O |
| Малахит | Cu 2 (CO 3 )(OH) 2 | |
7 Тенорит 3 8 146 |
Изотопы меди
Медь (Cu) содержит два стабильных изотопа 63 Cu и 65 Cu, а также еще несколько радиоизотопов.
Подавляющее большинство радиоизотопов имеют период полураспада минут или меньше, при этом 67 Cu имеет самый длинный период полураспада — 61,8 часа. Нестабильные изотопы меди с атомной массой менее 63, вероятно, подвергнутся β + распадаются, тогда как те, у которых масса больше 65, склонны к распаду. 64 Cu распадается через оба β + .
Cu-63 и Cu-65 используются для исследования метаболизма меди и желудочно-кишечных заболеваний. Cu-63 используется для производства медицинского радиоизотопа Zn-62, а также может быть использован для создания радиоизотопа Cu-64 для диагностики и лечения рака. Cu-65 также рассматривался как предшественник для создания Cu-64 с помощью циклотрона.
Элементарные свойства меди
| Электронная конфигурация | [Ar] 3d 10 4s 1 | 29 |
| Атомный вес | 63,546 г. моль -1 моль -1 | |
| Состояние при 20°C | Твердое тело | |
| Группа, период и блок | 11, 4, d-блок | 3 9142 Плотность 8,96 г см -1 |
| Ковалентный радиус | 132 ± 4 пм | |
| Радиус Ван-дер-Ваальса | 140 нм | |
| 2,8,18,1 | ||
| Электроны | 29 | |
| Протоны | 29 | |
| Нейтроны в наиболее распространенном изотопе | 34 | 1,90 |
Физические свойства меди
- Медь имеет красноватый цвет и блестящий металлический блеск. Он податлив, пластичен и является отличным электрическим и тепловым проводником.
- Медь — один из самых пластичных металлов; он не особенно прочный и не хрупкий.
- Благодаря получению удлиненных кристаллов с такой же гранецентрированной кубической структурой, что и более мягкая отожженная медь, холодная обработка значительно увеличивает прочность и твердость материала.

- Обычные газы, такие как кислород, азот, двуокись углерода и двуокись серы, растворяются в расплавленной меди и значительно изменяют ее механические и электрические характеристики.
- По тепло- и электропроводности этот металл уступает только серебру. Медь состоит из двух стабильных изотопа: меди-63 (69,15 %) и меди-65 (30,85 %). (30,85%).
- Медь имеет температуру плавления 1083,4 ± 0,2°С, температуру кипения 2567°С, удельный вес 8,9.6 при 20 градусах Цельсия и валентности 1 или 2.
| Точка плавления | 1084,62 °C, 1984,32 °F, 1357,77 K |
| 7 | |
| Плотность | 8,96 г см -1 |
| Энергии ионизации | 1-й: 745,5 кДж/моль 2-й: 1957,9 кДж/моль |
| Теплота испарения | |
| Молярная теплоемкость | 24,440 Дж/(моль·К) |
| Электроотрицательность | Шкала Полинга: 1,90 |

 Эти характеристики, в отличие от физических характеристик, можно исследовать, только подвергая медь различным химическим обработкам. Медь, например, имеет чрезвычайно низкую реакционную способность. Поскольку медь реагирует с другими элементами, она создает соединения. Сульфат меди (CuSO 4 ), оксид меди (CuO), хлорид меди (CuCl 2 ) и нитрат меди (Cu(NO 3 ) 2 ) являются некоторыми примерами.
Эти характеристики, в отличие от физических характеристик, можно исследовать, только подвергая медь различным химическим обработкам. Медь, например, имеет чрезвычайно низкую реакционную способность. Поскольку медь реагирует с другими элементами, она создает соединения. Сульфат меди (CuSO 4 ), оксид меди (CuO), хлорид меди (CuCl 2 ) и нитрат меди (Cu(NO 3 ) 2 ) являются некоторыми примерами.
 Cu 2 S, или сульфид меди, образуется при нагревании меди в присутствии серы.
Cu 2 S, или сульфид меди, образуется при нагревании меди в присутствии серы. Комплексный ион [Cu(OH 2 ) 6 ] 2+ является реальной формой Cu(II), которая существует в реальном мире.
Комплексный ион [Cu(OH 2 ) 6 ] 2+ является реальной формой Cu(II), которая существует в реальном мире.



 Медь можно использовать повторно бесконечно долго, так как она не портится. Фактически, скорость его переработки выше, чем у любого другого инженерного металла. Биостатические свойства меди предотвращают рост бактерий на ее поверхности, что делает ее полезным противомикробным средством.
Медь можно использовать повторно бесконечно долго, так как она не портится. Фактически, скорость его переработки выше, чем у любого другого инженерного металла. Биостатические свойства меди предотвращают рост бактерий на ее поверхности, что делает ее полезным противомикробным средством. В зависимости от кислотности почвы и наличия органических веществ медь может оказывать значительное влияние на деятельность конкретных сельскохозяйственных угодий. Несмотря на это, навоз, содержащий медь, продолжают использовать.
В зависимости от кислотности почвы и наличия органических веществ медь может оказывать значительное влияние на деятельность конкретных сельскохозяйственных угодий. Несмотря на это, навоз, содержащий медь, продолжают использовать.
