Характеристика химического элемента меди: Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов / Справочник :: Бингоскул
Содержание
Медь и её характеристики
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Общая характеристика меди
Общее содержание меди в земной коре сравнительно невелико [0,01% (масс.)], однако она чаще чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины.
Важнейшими минералами, входящими в состав медных руд, являются: халькозин, или медный блеск Cu2S; халькопирит, или медный колчедан CuFeS2; малахит (CuOH)2CO3.
Чистая медь – тягучий вязкий металл светло-розового цвета (рис. 1), легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на её поверхности тончайшая пленка оксидов (придающая меди боле темный цвет) служит хорошей защитой от дальнейшего окисления. Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (CuOH)2CO3.
1), легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на её поверхности тончайшая пленка оксидов (придающая меди боле темный цвет) служит хорошей защитой от дальнейшего окисления. Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (CuOH)2CO3.
Рис. 1. Медь. Внешний вид.
Атомная и молекулярная масса меди
Поскольку в свободном состоянии хром существует в виде одноатомных молекул Cu, значения его атомной и молекулярной масс совпадают. Они равны 63,546.
Изотопы меди
Известно, что в природе медь может находиться в виде двух стабильных изотопов 63Cu (69,1%) и 65Cu (30,9%). Их массовые числа равны 63 и 65 соответственно. Ядро атома изотопа меди 63Cu содержит двадцать девять протонов и тридцать четыре нейтрона, а изотоп 65Cu – столько же протонов и тридцать шесть нейтронов.
Существуют искусственные нестабильные изотопы меди с массовыми числами от 52-х до 80-ти, а также семь изомерных состояний ядер, среди которых наиболее долгоживущим является изотоп 67Cu с периодом полураспада равным 62 часа.
Ионы меди
Электронная формула, демонстрирующая распределение по орбиталям электронов меди выглядит следующим образом:
1s22s22p63s23p63d104s1.
В результате химического взаимодействия медь отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Cu0 -1e → Cu+;
Cu0 -2e → Cu2+.
Молекула и атом меди
В свободном состоянии медь существует в виде одноатомных молекул Cu. Приведем некоторые свойства, характеризующие атом и молекулу меди:
|
Энергия ионизации атома, эВ
|
7,72
|
|
Относительная электроотрицательность
|
1,90
|
|
Радиус атома, нм
|
0,128
|
Сплавы меди
Важнейшими сплавами меди с другими металлами являются латуни (сплавы меди с цинком), медноникелевые сплавы и бронзы.
Латуни содержат до 45% цинка. Различают простые и специальные латуни. В состав последних входят другие элементы, например железо, алюминий, олово, кремний.
Медноникелевые сплавы подразделяются на конструкционные и электротехнические. К конструкционным относятся мельхиоры и нейзильберы. Мельхиоры содержат 20-30% никеля и небольшие количества железа и марганца, а нейзильберы содержат 5-35% никеля и 13-45% цинка. К электротехническим медноникелевым сплавам относятся константан (40% никеля, 1,5% марганца), манганин (3% никеля и 12% марганца) и копель (43% никеля и 0,5% марганца).
Бронзы подразделяются по основному входящему в их состав компоненту (кроме меди) на оловянные, алюминиевые, кремнистые и т.д.
Примеры решения задач
|
Понравился сайт? Расскажи друзьям! |
| ||
1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов д.
 И. Менделеева и особенностями строения их атомов
И. Менделеева и особенностями строения их атомов
Понятие
переходный элемент обычно используется
для обозначения любого из d-
или f-элементов.
Эти элементы занимают переходное
положение между электроположительными
s-элементами
и электроотрицательными p-элементами.
d-элементы
образуют три переходных ряда — в 4-м,
5-м и 6-м периодах соответственно.
Первый
переходный ряд включает 10 элементов,
от скандия до цинка. Он характеризуется
внутренней застройкой 3d-орбиталей.
Хром и медь имеют на 4s-орбиталях
всего по одному электрону. Дело в том,
что полузаполненные или заполненные
d-подоболочки
обладают большей устойчивостью, чем
частично заполненные.
В
атоме хрома на каждой из пяти 3d-орбиталей,
образующих 3d-подоболочку,
имеется по одному электрону. Такая
подоболочка является полузаполненной.
Cr24 1s22s22p63s23p64s13d5
Для
атома хрома электроно-графическая
формула выглядит так:
Это
явление называется проскок (провал)
электрона.
В
атоме меди на каждой из пяти 3d-орбиталей
находится по паре электронов (аналогичным
образом объясняется аномалия серебра).
Cu29 1s22s22p63s23p64s13d10
Все
d-элементы
являются металлами. Большинство из них
имеет характерный металлический блеск.
По сравнению с s-металлами
их прочность в целом значительно выше.
В частности, для них характерны свойства:
высокий предел прочности на разрыв;
тягучесть; ковкость (их можно расплющить
ударами в листы).
d-элементы
и их соединения обладают рядом характерных
свойств: переменные состояния окисления;
способность к образованию комплексных
ионов; образование окрашенных соединений.
d-элементы
характеризуются также более высокой
плотностью по сравнению с другими
металлами. Это объясняется сравнительно
малыми радиусами их атомов. Атомные
Атомные
радиусы этих металлов мало изменяются
в этом ряду.
d-элементы
— хорошие проводники электрического
тока, особенно те из них, в атомах которых
имеется только один внешний s-электрон
сверх полузаполненной или заполненной
d-оболочки.
Например,
медь.
Химические
свойства.
Электроотрицательность и энергии
ионизации металлов первого переходного
ряда возрастают в направлении от хрома
к цинку. Это означает, что металлические
свойства элементов первого переходного
ряда постепенно ослабевают в указанном
направлении. Такое изменение их свойств
проявляется и в последовательном
возрастании окислительно-восстановительных
потенциалов с переходом от отрицательных
к положительным значениям.
Хром
— твердый голубовато-белый металл. При
высоких температурах горит в кислороде
с образованием Сr2О3,
реагирует с парами воды
2Сr
+ 3Н2O
Сr2О3
+ 3Н2
и
с галогенами, образуя галогениды состава
СrГ3.
Хром (так же, как алюминий) пассивируется
холодными концентрированными Н2SО4
и НNО3.
Однако при сильном нагревании эти
кислоты растворяют хром:
2Сr
+ 6Н2SО4(конц)
= Сr2(SО4)3
+ 3SО2↑
+ 6Н2О,
Сr
+ 6НNО3(конц)
= Сr(NО3)3
+ 3NO2↑
+ 3Н2О.
При
обычной температуре хром растворяется
в разбавленных кислотах (НСl,
Н2SО4)
с выделением водорода, образуя соли
Сr2+.
Обрабатывая их растворы щелочами,
получают желтый осадок гидроксида
хрома (II):
СrСl2
+ 2 NaОН
= Сr(ОН)2↓
+ 2 NaСl.
Соли
Cr3+
сходны с аналогичными солями алюминия.
При действии щелочей на соли Сr3+
выпадает
студнеобразный осадок гидроксида хрома
(III)
зеленого цвета:
Сr2(SО4)3
+ 6 NaОН
= 2 Сr(ОН)3↓
+ 3 Na2SО4,
обладающий
амфотерными свойствами. Он растворяется
Он растворяется
как в кислотах с образованием солей
хрома (III)
2
Сr(ОН)3
+ 3 Н2SО4
= Сr2(SО4)3
+ 6 Н2О,
так
и в щелочах с образованием комплексной
соли
Сr(ОН)3
+ 3КОН = К3[Cr(ОН)6].
Наиболее
важными соединениями хрома в высшей
степени окисления +6 хромат калия К2СrО4
и дихромат калия К2Сr2О7.
В
кислой среде ион CrO42-
превращается
в ион Сr2О72-
. В щелочной среде эта реакция протекает
в обратном направлении:
Железо
На
воздухе в присутствии влаги ржавеет:
4Fе
+ 3O2
+ 6Н2О
= 4Fе(ОН)3.
С
галогенами оно образует галогениды
железа (III)
2Fе
+ 3Вr2
= 2FеВr3,
а
взаимодействуя с соляной и разбавленной
серной кислотами соли железа(II),
так как катион водорода Н+
является слабым окислителем:
Fе
+ Н2SО4
= FеSО4
+ Н2↑.
Концентрированные
(НNО3,
Н2SО4)
пассивируют железо на холоде, однако
растворяют его при нагревании:
2Fе
+ 6Н2SО4(конц)
= Fе2(SО4)3
+ 3SО2↑
+ 6Н2О,
Fе
+ 6НNО3(конц)
= Fе(NО3)3
+ 3NО2↑
+ 3Н2О.
Медь
– довольно мягкий металл красно-желтого
цвета, обладающий наименьшей активностью
среди рассмотренных выше переходных
металлов, которые вытесняют ее из
растворов солей. Медь не реагирует с
соляной и разбавленной серной кислотами
и растворяется только в кислотах –
окислителях:
Сu
+ 2 Н2SО4(конц)
= СuSО4
+ SО2↑
+ 2 Н2О,
Сu
+ 4 НNO3(конц)
= Сu(NО3)2
+ 2 NО2↑
+ 2 Н2О,
3
Cu
+ 8 НNО3(разб)
= 3 Сu(NO3)2
+ 2 NO↑
+ 4 Н2О.
Известны
соединения меди со степенями окисления
+1 и +2, из которых +2 более устойчива.
Ионы
Сu2+
в водном растворе существуют в виде
комплексов гексааквамеди (II)
[Сu(Н2О)6]2+,
придающих раствору сине-голубую окраску.
Основная
соль меди – медный купорос CuSO4.5H2O
голубого цвета, но при прокаливании
теряет воду и становится белого цвета,
т.е. окраску раствору придает комплексный
ион. Более точное строение медного
купороса [Cu(H2O)4]SO4
H2O.
Цинк
амфотерный металл. Валентные
электроны атома цинка 4s23d10.
Так как все d-орбитали
у цинка заполнены электронами, все его
соли бесцветны. Это объясняется теорией
кристаллического поля лигандов. В
соединениях проявляет только одну
степень окисления +2.
Взаимодействует
с кислотами:
Zn
+ 2HCl
= ZnCl2
+ H2
Zn
+ H2SO4(разб)
= ZnSO4
+ H2
Zn
+ 2H2SO4(конц)
= ZnSO4
+ SO2
+ 2H2O
4Zn+10HNO3(разб)=4Zn(NO3)2+NH4NO3+3H2O.
Zn
+ 4HNO3(конц)
= Zn(NO3)2
+ 2NO2
+ 2H2O
Взаимодействует
со щелочами: реагирует с растворами
щелочей с образованием гидроксокомплексов,
при сплавлении образует цинкаты:
Zn
+ 2NaOH + 2H2O
= Na2[Zn(OH)4]
+ H2
Zn
+ 2KOH = K2ZnO2
+ H2
Части периодической таблицы
Когда элементы объединяются в соединения, существует два основных типа
склеивание, которое может возникнуть. Ионные связи образуются при наличии
перенос электронов от одного вида к другому с образованием
заряженные ионы, которые очень сильно притягиваются друг к другу электростатическим
взаимодействия и ковалентных связей , которые возникают, когда атомы
обмениваться электронами для получения нейтральных молекул. В общем
В общем
металл и неметаллы объединяются, образуя ионные соединения , а
неметаллы соединяются с другими неметаллами с образованием ковалентных соединений
(молекулы).
Поскольку металлы находятся левее в таблице Менделеева, они
имеют низкую энергию ионизации
и низкое сродство к электрону,
поэтому они относительно легко теряют электроны и с трудом приобретают их.
У них также относительно мало валентных электронов, и они могут образовывать ионы (и
тем самым удовлетворяют правилу октета) легче, теряя свою валентность
электроны с образованием положительно заряженных катионы .
- Металлы основной группы обычно образуют заряды, такие же, как
номер их группы: то есть металлы группы 1А, такие как
натрий и калий образуют заряды +1, металлы группы 2А, такие как
магний и кальций образуют заряды 2+, а металлы группы 3А, такие как
так как алюминий образует заряды 3+. - Металлы, следующие за переходными металлами (по направлению к
в нижней части групп 4A и 5A) могут потерять либо свои крайние с
и p электронов, образующих заряды, идентичные их
номер группы, или они могут потерять только p электронов, в то время как
сохраняя свои два s электронов, образуя заряды, которые являются
номер группы минус два.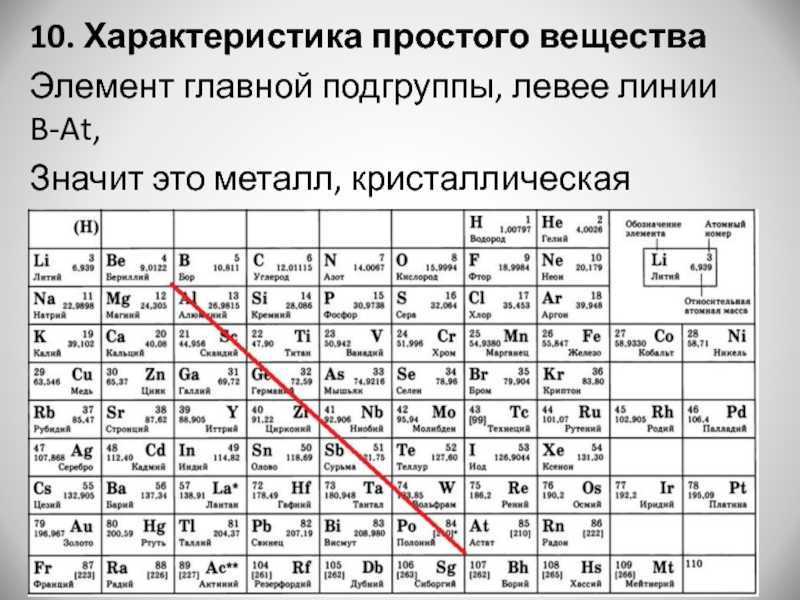 Другими словами, олово и свинец в Группе
Другими словами, олово и свинец в Группе
4А может образовывать 4+ или 2+ заряда, тогда как висмут из группы 5А может
образуют заряд 5+ или 3+. - Переходные металлы обычно способны образовывать 2+ заряда
потеряв свою валентность с электронов, но может и потерять
электроны со своих d орбиталей, чтобы сформировать другие заряды.
Большинство переходных металлов могут образовывать более одного возможного заряда.
в ионных соединениях.
Неметаллы находятся правее в периодической таблице и имеют
высокая энергия ионизации и
высокое сродство к электрону, поэтому
они относительно легко приобретают электроны и с трудом их теряют.
Они также имеют большее количество валентных электронов и уже
близко к полному октету из восьми электронов. неметаллы
приобретают электроны до тех пор, пока они не будут иметь такое же количество электронов, как
ближайший благородный газ (группа 8A), образующий отрицательно заряженный анионы
которые имеют заряды, равные номеру группы минус восемь. То есть,
То есть,
неметаллы группы 7А образуют заряды 1-, неметаллы группы 6А образуют заряды 2-
заряды, а металлы группы 5А образуют 3-заряды. Группа 8А
элементы уже имеют восемь электронов на своих валентных оболочках и имеют
мало склонны либо приобретать, либо терять электроны, и не легко
образуют ионные или молекулярные соединения.
Ионные соединения удерживаются вместе в правильном порядке, называемом кристалл
решетки силами притяжения между противоположно заряженными
катионы и анионы. Эти силы притяжения очень сильны, и
поэтому большинство ионных соединений имеют очень высокие температуры плавления. (Для
Например, хлорид натрия, NaCl, плавится при 80°С, а оксид алюминия,
Al 2 O 3 , плавится при 2054C.) Ионные соединения
обычно твердые, жесткие и хрупкие. Ионные соединения не проводят
электричество, потому что ионы не могут свободно двигаться в твердой фазе,
но ионные соединения могут проводить электричество, когда они растворены в
вода.
Когда неметаллы объединяются с другими неметаллами, они, как правило, разделяют
электроны в ковалентных связях вместо образования ионов, что приводит к
образование нейтральных молекул. (Имейте в виду, что поскольку водород
тоже неметалл, соединение водорода с другим неметаллом
также будет образовывать ковалентную связь.) Молекулярные соединения могут быть
газами, жидкостями или твердыми веществами с низкой температурой плавления и включают широкий спектр
веществ. (См.
Галерея молекул для
примеры.)
Когда металлы соединяются друг с другом, связь обычно описывается
как металлическая связка (вы могли догадаться). В этом
В модели каждый атом металла отдает один или несколько своих валентных электронов
создать электронное море , которое окружает все атомы, удерживая
вещества вместе за счет притяжения между катионами металлов и
отрицательно заряженные электроны. Так как электроны в электроне
море может свободно двигаться, металлы очень легко проводят электричество, в отличие от
молекулы, где электроны более локализованы. Атомы металлов могут
Атомы металлов могут
двигаться мимо друг друга легче, чем в ионных соединениях (которые
удерживаются в фиксированных положениях за счет притяжения между катионами и
анионы), позволяя металлу забиваться в листы или вытягиваться в
проволока. Различные металлы можно очень легко комбинировать, чтобы получить
сплавы , которые могут иметь сильно отличающиеся физические свойства от их
составляющие металлы. Сталь представляет собой сплав железа и углерода,
что намного тверже самого железа; хром, ванадий, никель и
к железу также часто добавляют другие металлы для получения различных сталей.
типы. Латунь представляет собой сплав меди и цинка, который используется
в сантехнике, электрических деталях и музыкальных инструментах.
Бронза — это сплав меди и олова, который намного тверже, чем
медь; когда бронза была открыта древними цивилизациями, это ознаменовало
значительный шаг вперед по сравнению с использованием менее прочных каменных орудий.
Товарная медь — все, что вам нужно знать о меди
Товарная медь — это химический элемент с символом CU в периодической таблице и атомным номером 29.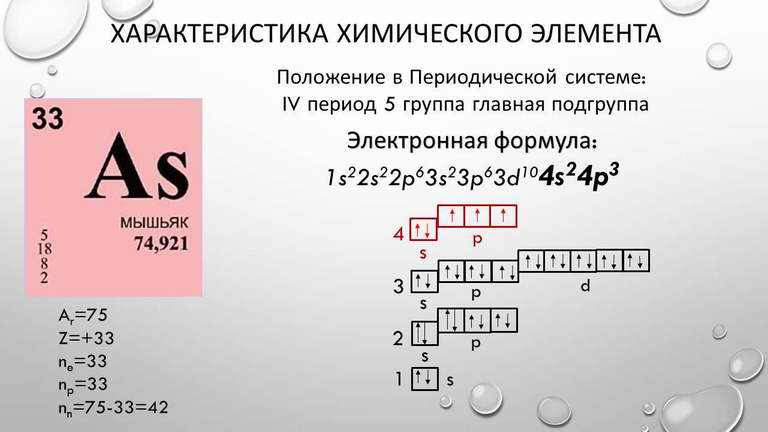 Чистая медь мягкая и ковкая; открытая поверхность имеет красновато-оранжевый налет. Он используется как проводник тепла и электричества, строительный материал и составная часть различных металлических сплавов.
Чистая медь мягкая и ковкая; открытая поверхность имеет красновато-оранжевый налет. Он используется как проводник тепла и электричества, строительный материал и составная часть различных металлических сплавов.
Медные сплавы — это металлические сплавы, основным компонентом которых является медь. Они обладают высокой устойчивостью к коррозии. Самыми известными традиционными типами являются бронза, в которой важным дополнением является олово, и латунь, в которой вместо цинка используется цинк. Оба эти термина неточны, и сегодня термин «медный сплав» часто заменяют, особенно в музеях.
История
Этот металл и его сплавы использовались на протяжении тысячелетий. В римскую эпоху медь в основном добывалась на Кипре, отсюда и происхождение названия металла cyprium (кипрский металл), позже сокращенного до купрум. Его соединения обычно встречаются в виде солей меди (II), которые часто придают синий или зеленый цвет минералам, таким как бирюза, и исторически широко использовались в качестве пигментов. Архитектурные конструкции, построенные из меди, подвергаются коррозии, превращаясь в зеленую медь-медь
Архитектурные конструкции, построенные из меди, подвергаются коррозии, превращаясь в зеленую медь-медь
Ионы меди(II) растворимы в воде, где в низких концентрациях действуют как бактериостатические вещества, фунгициды и консерванты древесины. В достаточном количестве они ядовиты для высших организмов; в более низких концентрациях он является важным микроэлементом для всех высших растений и животных. Основными областями, где содержится медь у животных, являются ткани, печень, мышцы и кости.
Изготовление меди
Большая часть меди добывается или извлекается в виде сульфидов меди в крупных карьерах на медно-порфировых месторождениях, содержащих от 0,4 до 1,0% меди. Примеры включают Чукикамата в Чили, шахту Бингем-Каньон в Юте, США и шахту Эль-Чино в Нью-Мексико, США. По данным Британской геологической службы , в 2005 году Чили была крупнейшим производителем меди с долей не менее одной трети в мире, за ней следуют США, Индонезия и Перу. Количество используемой меди увеличивается, а доступного количества едва хватает, чтобы позволить всем странам достичь уровня использования развитого мира.
Запасы
Медь используется не менее 10 000 лет, но более 95% всей когда-либо добытой и выплавленной меди было извлечено с 1900 г. Как и в случае со многими природными ресурсами, общее количество меди на Земле огромно (около 1014 тонн только в верхнем километре земной коры, или около 5 миллионов лет при нынешних темпах добычи). Однако лишь малая часть этих запасов является экономически целесообразной при нынешних ценах и технологиях. Различные оценки существующих запасов меди, доступных для добычи, варьируются от 25 до 60 лет, в зависимости от основных предположений, таких как темпы роста. Переработка является основным источником меди в современном мире. Из-за этих и других факторов будущее производства и поставок меди является предметом многочисленных дискуссий, в том числе концепции Пика меди, аналога Пика Нефти.
Области применения
В основном медь применяется в электрических проводах (60%), кровле и водопроводе (20%) и промышленном оборудовании (15%). Медь в основном используется как металл, но когда требуется более высокая твердость, ее объединяют с другими элементами для получения сплава (5% от общего использования), такого как латунь и бронза. Небольшая часть поставок меди используется в производстве композиций для пищевых добавок и фунгицидов в сельском хозяйстве. Возможна механическая обработка меди, хотя обычно необходимо использовать сплав для сложных деталей, чтобы получить хорошие характеристики обрабатываемости.
Медь в основном используется как металл, но когда требуется более высокая твердость, ее объединяют с другими элементами для получения сплава (5% от общего использования), такого как латунь и бронза. Небольшая часть поставок меди используется в производстве композиций для пищевых добавок и фунгицидов в сельском хозяйстве. Возможна механическая обработка меди, хотя обычно необходимо использовать сплав для сложных деталей, чтобы получить хорошие характеристики обрабатываемости.
Электроника
Электрические свойства меди используются в медных проводах и устройствах, таких как электромагниты. Интегральные схемы и печатные платы все чаще используют медь вместо алюминия из-за его превосходной электропроводности; в радиаторах и теплообменниках используется медь из-за ее превосходной способности рассеивать тепло по сравнению с алюминием. Вакуумные трубки, электронно-лучевые трубки и магнетроны в микроволновых печах используют медь, как и волноводы для микроволнового излучения
Архитектура и промышленность
Из-за водонепроницаемости меди с древних времен она использовалась в качестве кровельного материала для многих зданий. Зеленый цвет этих зданий обусловлен длительной химической реакцией: медь сначала окисляется до оксида меди (II), затем до меди и сульфида меди и, наконец, до карбоната меди (II), также называемого медью-медью, который вызывает сильную коррозию. -устойчивый. Медь, используемая в этом приложении, представляет собой раскисленную фосфором медь (Cu-DHP). В молниеотводах используется медь как средство отвода электрического тока по земле вместо разрушения основной конструкции. Медь обладает отличными свойствами пайки и пайки, ее можно сваривать; наилучшие результаты дает дуговая сварка металлическим газом.
Зеленый цвет этих зданий обусловлен длительной химической реакцией: медь сначала окисляется до оксида меди (II), затем до меди и сульфида меди и, наконец, до карбоната меди (II), также называемого медью-медью, который вызывает сильную коррозию. -устойчивый. Медь, используемая в этом приложении, представляет собой раскисленную фосфором медь (Cu-DHP). В молниеотводах используется медь как средство отвода электрического тока по земле вместо разрушения основной конструкции. Медь обладает отличными свойствами пайки и пайки, ее можно сваривать; наилучшие результаты дает дуговая сварка металлическим газом.
Медь в сплавах
Существует множество медных сплавов, многие из которых имеют важное применение. Латунь представляет собой сплав меди и цинка, а бронза обычно относится к медно-оловянным сплавам, но может относиться к любому сплаву меди, такому как алюминиевая бронза. Медь является одним из наиболее важных компонентов каратных серебряных и золотых сплавов и каратных припоев, используемых в ювелирной промышленности, изменяя цвет, твердость и температуру плавления получаемых сплавов.
Сплав меди и никеля, называемый мельхиором, используется в скульптурных монетах малого номинала, часто для внешнего покрытия. 5-центовая монета США под названием никель состоит из 75% меди и 25% никеля и имеет однородный состав. 9Сплав 0% меди/10% никеля отличается устойчивостью к коррозии и используется в различных деталях, подвергающихся воздействию морской воды. Сплавы меди с алюминием (около 7%) имеют приятный золотистый цвет и используются в украшениях. Сплавы меди с оловом входят в состав бессвинцовых припоев.
Противомикробные средства
Поверхности из медного сплава обладают природными природными свойствами уничтожать широкий спектр микроорганизмов (например, E. coli O157:H7, метициллин-резистентный золотистый стафилококк (MRSA), Staphylococcus, Clostridium difficile, вирус гриппа A). аденовирусы и грибы). Было доказано, что 355 медных сплавов убивают более 99,9% болезнетворных бактерий всего за два часа при регулярной очистке. Агентство по охране окружающей среды США (EPA) одобрило регистрацию этих медных сплавов в качестве «противомикробных материалов, полезных для здоровья населения», что позволяет производителям на законных основаниях заявлять о положительной пользе для здоровья населения продуктов, изготовленных из зарегистрированных противомикробных медных сплавов.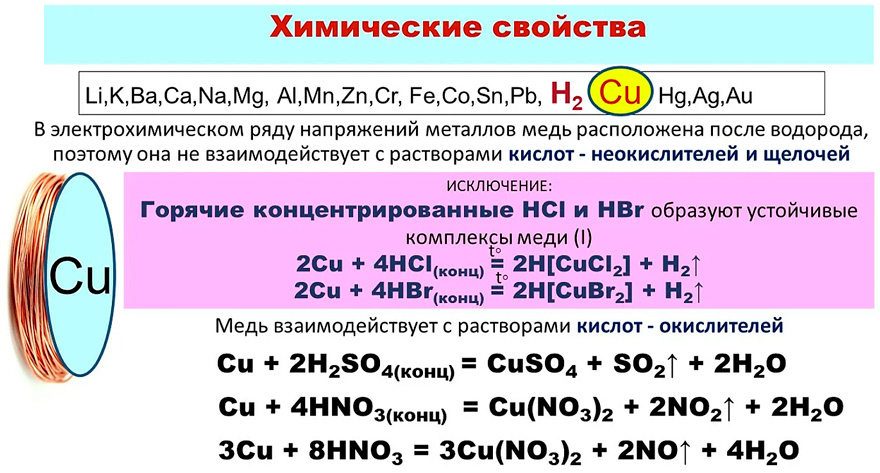 Кроме того, EPA одобрило длинный список антимикробных медных изделий, изготовленных из этих сплавов, таких как поручни, поручни, прикроватные тумбочки, раковины, смесители, дверные ручки, туалетная фурнитура, компьютерные клавиатуры, оборудование для оздоровительных клубов, ручки тележек для покупок. и т. д. (полный список продуктов см. в разделе Антимикробные сенсорные поверхности из медного сплава#Одобренные продукты). Медные дверные ручки используются в больницах для уменьшения передачи болезней, а болезнь легионеров подавляется медными трубками в водопроводных системах. Изделия из антимикробного медного сплава в настоящее время устанавливаются в медицинских учреждениях Великобритании, Ирландии, Японии, Кореи, Франции, Дании и Бразилии, а также в системе метро в Сантьяго, Чили, где поручни из медно-цинкового сплава будут установлены примерно в 30 странах. станций в период с 2011 по 2014 год.
Кроме того, EPA одобрило длинный список антимикробных медных изделий, изготовленных из этих сплавов, таких как поручни, поручни, прикроватные тумбочки, раковины, смесители, дверные ручки, туалетная фурнитура, компьютерные клавиатуры, оборудование для оздоровительных клубов, ручки тележек для покупок. и т. д. (полный список продуктов см. в разделе Антимикробные сенсорные поверхности из медного сплава#Одобренные продукты). Медные дверные ручки используются в больницах для уменьшения передачи болезней, а болезнь легионеров подавляется медными трубками в водопроводных системах. Изделия из антимикробного медного сплава в настоящее время устанавливаются в медицинских учреждениях Великобритании, Ирландии, Японии, Кореи, Франции, Дании и Бразилии, а также в системе метро в Сантьяго, Чили, где поручни из медно-цинкового сплава будут установлены примерно в 30 странах. станций в период с 2011 по 2014 год.
Другое применение
Соединения меди в жидкой форме используются в качестве консерванта для древесины, особенно при обработке исходных частей конструкций во время восстановления повреждений, вызванных сухой гнилью. Вместе с цинком медные провода могут быть помещены поверх непроводящих кровельных материалов, чтобы препятствовать росту мха. Текстильные волокна используют медь для создания антимикробных защитных тканей, как и керамические глазури, витражи и музыкальные инструменты. В гальванике обычно используется медь в качестве основы для других металлов, таких как никель.
Вместе с цинком медные провода могут быть помещены поверх непроводящих кровельных материалов, чтобы препятствовать росту мха. Текстильные волокна используют медь для создания антимикробных защитных тканей, как и керамические глазури, витражи и музыкальные инструменты. В гальванике обычно используется медь в качестве основы для других металлов, таких как никель.
Медь является одним из трех металлов, наряду со свинцом и серебром, используемых в процедуре тестирования музейных материалов, называемой тестом Одди. В этой процедуре медь используется для обнаружения хлоридов, оксидов и соединений серы.
Медь часто сплавляют с драгоценными металлами, такими как серебро и золото, для создания, например, коринфской бронзы, гепатизона, тумбаги и сякудо.
Торговля товаром Медь
В отличие от большинства других металлов медь торгуется как на Лондонской бирже металлов (LME), так и на Нью-Йоркской товарной бирже (NYMEX). Цены на LME по-прежнему служат эталоном для внебиржевых контрактов, и отклонения этой цены на NYMEX обычно минимальны.
Ценовые факторы
Благодаря подъему экономики Китая и Индии спрос на медь быстро растет. Эти быстро развивающиеся экономики нуждаются в огромном количестве меди для продолжения своего развития, что приведет к росту цен.
Количество оставшихся месторождений меди ограничено, и согласно текущим расчетам, они будут истощены в период от пятидесяти до шестидесяти лет. Это создает серьезные проблемы, поскольку потребление меди все еще неуклонно растет. Страны-потребители начнут искать альтернативы или активизировать деятельность по переработке, чтобы увеличить внутреннее предложение.
История цен
Исторически цена на медь была нестабильной и выросла в пять раз с 60-летнего минимума в 0,60 доллара США/фунт (1,32 доллара США/кг) в июне 1999 года до 3,75 доллара США за фунт (8,27 доллара США/кг). в мае 2006 г. В феврале 2007 г. она упала до 2,40 долл. США/фунт (5,29 долл. США/кг), а затем снова выросла до 3,50 долл. США/фунт (7,71 долл. США/кг) в апреле 2007 г.
