Характеристика химического элемента по плану медь: Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов / Справочник :: Бингоскул
Содержание
Характеристика химического элемента по положению его в ПСХЭ. Повторение и обобщение по теме «Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома»
Характеристика химического элемента по положению его в ПСХЭ. Повторение и обобщение по теме «Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома»
I. Периодический закон в свете теории строения атомов
| Понятие | Физ. смысл | Характеристика понятия |
| Заряд ядра | Равен порядковому номеру элемента | Основная характеристика элемента, определяет химические свойства, так как с ростом заряда ядра увеличивается количество электронов в атоме, в том числе и на внешнем уровне. Следовательно, изменяются свойства |
| Периодичность | С увеличением заряда ядра наблюдается периодическая повторяемость строения внешнего уровня, следовательно, периодически изменяются свойства (внешние электроны – валентные) |
II. Периодическая система в свете теории строения атома
Периодическая система в свете теории строения атома
| Понятие | Физ. смысл | Характеристика понятия |
| Порядковый номер |
Равен числу протоновв ядре.
Равен числу электронов в атоме.
| |
| Период | Номер периода равен числу электронных оболочек |
Горизонтальный ряд элементов.
1,2,3 – малые; 4,5,6 – большие; 7 – незавершенный.
В 1 периоде всего два элемента и больше быть не может. Это определяется формулой N = 2n2
Каждый период начинается щелочным металлом и заканчивается инертным газом.
Первые два элемента любого периода s — элементы, последние шесть р – элементы, между ними d — и f – элементы.
В периоде слева направо:
1.
2.заряд ядра – увеличивается
3.количество энерг. уровней – постоянно
4.кол-во электронов на внеш.уровне — увеличивается
5.радиус атомов – уменьшается
6.электроотрицательность – увеличивается
Следовательно, внешние электроны удерживаются сильнее, и металлические свойства ослабевают, а неметаллические усиливаются
В малых периодах этот переход происходит через 8 элементов, в больших – через 18 или 32.
В малых периодах валентность увеличивается от 1 до 7 один раз, в больших – два раза. В том месте, где происходит скачок в изменении высшей валентности, период делится на два рядя.
От периода к периоду происходит резкий скачок в изменении свойств элементов, так как появляется новый энергетический уровень.
|
| Группа | Номер группы равен числу электронов на внешнем уровне (для элементов главных подгрупп) |
Вертикальный ряд элементов.
Каждая группа делится на две подгруппы: главную и побочную. Главную подгруппу составляют s – ир – элементы, побочную -d — и f– элементы.
Подгруппы объединяют наиболее сходные между собой элементы.
В группе, в главной подгруппе сверху вниз:
1.относит. атомная масса – увеличивается
2.число электронов на внеш. уровне – постоянно
3.заряд ядра – увеличивается
4.кол – во энерг. уровней – увеличивается
5.радиус атомов — увеличивается
6.электроотрицательность – уменьшается.
Следовательно, внешние электроны удерживаются слабее, и металлические свойства элементов усиливаются, неметаллические- ослабевают.
Элементы некоторых подгрупп имеют названия:
1а группа – щелочные металлы
2а – щелочноземельные металлы
6а – халькогены
7а – галогены
8а – инертные газы (имеют завершённый внешний уровень)
|
Выводы:
1. Чем меньше электронов на внешнем уровне и больше радиус атома, тем меньше электроотрицательность и легче отдавать внешние электроны, следовательно, тем сильнее выражены металлические свойства
Чем меньше электронов на внешнем уровне и больше радиус атома, тем меньше электроотрицательность и легче отдавать внешние электроны, следовательно, тем сильнее выражены металлические свойства
Чем больше электронов на внешнем уровне и меньше радиус атома, тем больше электроотрицательность и тем легче принимать электроны, следовательно, тем сильнее неметаллические свойства.
2. Для металлов характерна отдача электронов, для неметаллов – прием.
III. Особое положение водорода в периодической системе
Водород в периодической системе занимает две клетки (в одной из них заключен в скобки) – в 1 группе и в 7 – ой.
В первой группе водород стоит потому, что у него, как и у элементов первой группы, на внешнем уровне один электрон.
В седьмой группе водород стоит потому, что у него, как и у элементов седьмой группы, до завершения энергетического уровня.
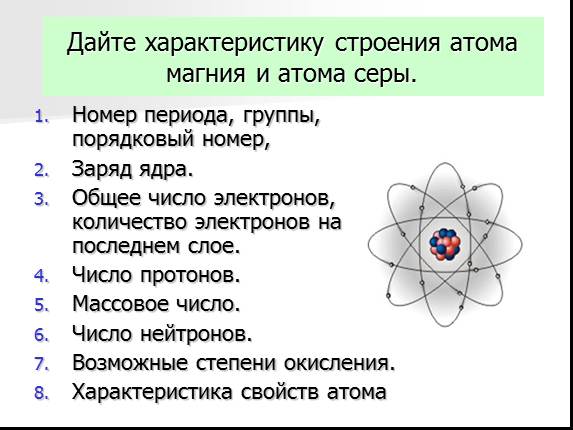
IV. План – алгоритм характеристики элемента по его положению в ПСХЭ Д. И. Менделеева
1. Название
Название
2.Химический знак
3.Порядковый номер
4.Номер периода (большой 4-7 или малый 1-3)
5.Номер группы, подгруппа (главная «А» или побочная «Б»)
6.Состав атома: число электронов, число протонов, число нейтронов
Подсказка!
Число электронов = числу протонов = порядковому номеру;
Число нейтронов = атомная масса (Ar из таблицы Менделеева) – число протонов.
7. Вид элемента (s, p, d, f)
Подсказка!
s-элементы: это первые два элемента в 1-7 периодах;
p-элементы: последние шесть элементов1-6 периодов;
d-элементы: это элементы больших периодов (по 10 штук) между s— и p-элементами;
f-элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы.
8.Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня.
Подсказка! Внешний уровень завершён у элементов VIII группы главной подгруппы «А» — Ne, Ar, Kr, Xe, Rn.
Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома = порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в котором находится элемент;
У s— и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент.
Например, Na+11)2)8)1=номеру группы;
У d— элементов на последнем уровне число электронов всегда равно 2 (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат 1 электрон).
Например, Ti+22)2)8)10)2 ; Cr++24)2)8)13)1 – исключение
Максимальное возможное число электронов на уровнях определяют по формуле Nэлектронов = 2n2, где n – номер энергоуровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV – 32 электрона и т.д.
9.Электронная и электронно-графическая формулы строения атома
Подсказка!
Для написания электронной формулы используйте шкалу энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
Помните! На s – орбитали максимум может быть 2 электрона, на p – 6, на d – 10, на f – 14 электронов.
Например, +11Na 1s22s22p63s1; +22Ti 1s22s22p63s23p64s23d2
10.Металл или неметалл
Подсказка!
К неметаллам относятся: 2 s-элемента — водород и гелий и 20 p-элементов – бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.
К металлам относятся: все d— и f-элементы, все s-элементы (исключения водород и гелий), некоторые p-элементы.
11.Высший оксид (только для s, p)
Подсказка!
Общая формула высшего оксида дана под группой химических элементов (R2O, RO и т.д.)
12.Летучее водородное соединение (только для s, p)
Подсказка!
Общая формула летучего водородного соединения дана под группой химических элементов (RH4, RH3 и т.д.) – только для элементов 4 -8 групп.
V. Задание для самостоятельной работы
Дайте характеристику следующим элементам по плану: кальций, фосфор, медь.
План характеристики химического элемента по его положению в Периодической системе элементов Д. И. Менделеева
И. Менделеева
VI. Тренажеры
Тренажёр №1 «Характеристика элемента металла по его положению в Периодической системе элементов Д. И. Менделеева»
Тренажёр №2 «Характеристика элемента неметалла по его положению в Периодической системе элементов Д. И. Менделеева»
Тренажёр №3. Интерактивное упражнение для контроля и самопроверки на строение атомов элементов
«Лабиринт по периодической системе химических элементов Д.И.Менделеева»
Необходимо найти верный путь к финишу, отмечая его последовательно цифрами, начиная с 1. (Подсказка: количество ходов – 9.)
Игра-лабиринт №2
Домашнее задание
Особенности строения электронных оболочек атомов элементов
На этой странице вы узнаете:
- Чем общежития электронов отличаются от студенческих?
- В атомах химических элементов есть свои уровни комфортности?
- Химические элементы делятся на семейства? Это что, биология какая-то?
Сейчас в обществе все больше набирает оборот модный тренд — минималистичный образ жизни. Как в фильме «Сто вещей и ничего лишнего». Главные герои — два закадычных друга — решили на спор отказаться от всех своих вещей (абсолютно всех, включая одежду и телефон). Спустя время и преодолев череду проблем, они поняли, что вещи — это не главное в жизни.
Как в фильме «Сто вещей и ничего лишнего». Главные герои — два закадычных друга — решили на спор отказаться от всех своих вещей (абсолютно всех, включая одежду и телефон). Спустя время и преодолев череду проблем, они поняли, что вещи — это не главное в жизни.
Видимо, по такому принципу «живет» хорошо нам знакомый товарищ — водород. У него всего один электрон, который всегда на своем месте. А как быть, например, с атомом хлора, у которого их аж 17, ведь их надо содержать в порядке? Сейчас мы с вами узнаем, как располагаются электроны в электронной оболочке атома и многое другое.
Строение электронной оболочки атома
Представим, что электрон — это студент, а электронная оболочка атома — общежитие. Как будет жить наш студент в общежитии?
Разберемся сначала с «планом помещения».
- В нём есть отдельные комнаты, которые называются атомными орбиталями — в них могут проживать максимум 2 электрона.
- Несколько комнат объединяются в блок с общей кухней — их мы назовем энергетическими подуровнями.

- Этажи общежития — энергетические уровни. Определенный этаж содержит определенное количество блоков.
Таким образом, все электроны «живут» на энергетических уровнях-этажах, каждый из которых имеет энергетические подуровни-блоки со своими орбиталями-комнатами.
То, что мы видим с вами на рисунке — электронно-графическая формула для отдельных атомов химических элементов — это расположение всех его электронов на орбиталях.
| Чем общежития электронов отличаются от студенческих? 1. Энергетические уровни (этажи) имеют порядковую нумерацию. Причем на первом уровне располагается всего один подуровень (блок), на втором — два, на третьем — три, на четвертом и последующих — по 4. 2. Подуровни (блоки) обозначают в следующем порядке по мере отдаления от ядра: s (имеет одну орбиталь) → p (три орбитали) → d (пять орбиталей)→ f (семь орбиталей). 3. Орбиталь (комната) специального обозначения не имеет. Может содержать максимум 2 электрона (студента). |
Как нам поможет Периодическая таблица химических элементов Д.И. Менделеева при заполнении схемы строения электронных оболочек атомов?
- Число электронов в атоме химического элемента равно его порядковому номеру в Периодической системе Д. И. Менделеева.
- Количество уровней совпадает с номером периода, в котором располагается элемент: 1, 2, 3…
- Количество электронов на внешнем энергетическом уровне для элементов главных (A) подгрупп можно также легко узнать — в какой группе по номеру расположен химический элемент, столько электронов и будет находиться на его внешнем уровне.
- Для элементов побочных подгрупп количество электронов на внешнем энергетическом уровне равно двум.
 Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.
Исключениями являются медь, серебро, хром, золото и некоторые другие элементы. - Количество валентных электронов для элементов главных (A) подгрупп равно номеру группы, для элементов побочных подгрупп — числу электронов на внешнем энергетическом уровне и незаполненном предвнешнем подуровне.
Это можно использовать для проверки своих действий при распределении электронов по уровням.
Уже сейчас, используя полученную информацию, мы можем решить задание №2 ОГЭ по химии.
На приведенном рисунке изображена модель атома химического элемента.
Запишите в таблицу порядковый номер в Периодической системе (Х) химического элемента, модель атома которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе.
Решение:
1) Порядковый номер химического элемента в Периодической системе можно определить по числу электронов в атоме. Сосчитав все электроны, получаем, что их 14 штук, следовательно, X — 14.
2) Номер группы Периодической системы, в которой расположен химический, элемент можно узнать по числу электронов на его внешнем электронном уровне. Сосчитав их, получим, что их 4 штуки, следовательно, Y — 4.
Ответ: 144
Электронная конфигурация атома
Для изображения строения электронных слоев атома (электронной конфигурации) пользуются условной записью.
Удобно представлять атомные орбитали в виде ячеек, в которых располагаются два электрона, их обозначаем в виде двух стрелочек, первая направлена вверх, а вторая — вниз. Это называется принципом Паули.
Он гласит, что два электрона не могут иметь одинаковые спины. Спин — характеристика электрона, проще всего его можно представить как вращение электрона по часовой стрелке и против часовой, поэтому в ячейке они расположены в противоположном направлении (то есть +1/2 и -1/2).
При заполнении этих ячеек удобно пользоваться правилом Хунда (или правилом «трамвайного вагона»):
| При наличии свободных орбиталей на подуровне электроны занимают именно их, а не «подсаживаются» к другим электронам: Ты приглядись, решив присесть, |
В нашем с вами примере студентов заселяют по одному в комнату пока это возможно.
| Важное замечание: в комнате не больше двух студентов — атомная орбиталь вмещает максимально два электрона. |
Например, на изображении представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы:
| В атомах химических элементов есть свои уровни комфортности? Да, проанализировав таблицу, мы увидим, что на s-подуровне (блоке) может находиться не больше двух электронов, на p-подуровне — не больше шести электронов, на d-подуровне — не больше десяти электронов, на f-подуровне — не больше четырнадцати электронов. Электроны, как и студенты, стремятся занять более комфортные места, так система стремится к минимуму энергии. Порядок заполнения подуровней в атомах химических элементов следующий: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … Согласитесь, если студентам заселиться в блок вдвоем, им будет проще найти друг с другом общий язык, чем если бы их было в блоке четырнадцать. |
Схематично порядок заполнения энергетических подуровней электронно-графической формулы представлен на картинке:
После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.
Потренируемся в написании электронной конфигурации на примере атомов хлора и титана.
Химический элемент титан располагается в IVB группе IV периода, имеет порядковый номер, равный 22. Исходя из этого, мы можем сказать, что в его атоме:
— четыре энергетических уровня (IV период), из которых первый и второй уровни полностью заполнены;
— четыре электрона на внешнем энергетическом уровне и предвнешнем подуровне;
— всего двадцать два электрона (порядковый номер).
В соответствии с порядком заполнения орбиталей распределим электроны:
22Ti 1s22s22p63s23p64s23d2 — как мы видим, сначала заполняется 4s-подуровень, а затем 3d-подуровень, это соответствует порядку заполнения орбиталей, описанному выше.
Проверим себя. В сумме все верхние цифры (обозначающие число электронов на подуровне), должны образовать ровно 22: 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22, следовательно, электронная конфигурация атома хлора составлена верно.
| Химические элементы делятся на семейства? Это что, биология какая-то? К счастью, с биологией у атомов химических элементов мало общего, иначе, представьте, что в качестве домашнего питомца у вас был бы атом хлора, а в зоопарке бы показывали семью атомов золота. Что-то из области фантастики, не так ли? Однако, да, химические элементы разделяют на семейства по строению их электронных оболочек. — s-элементы — это элементы IA и IIA групп, в их атомах последний электрон занимает место на s-подуровне внешнего энергетического уровня; |
Таким образом, мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома. Теперь для нас не составит труда описать строение атома любого химического элемента.
Теперь для нас не составит труда описать строение атома любого химического элемента.
Фактчек
- Электроны располагаются на электронных уровнях, причем их число определяется положением элемента в Периодической системе (по номеру периода).
- Энергетические уровни, в свою очередь, состоят из подуровней.
- Энергетические подуровни состоят из атомных орбиталей, которые для удобства обозначаются ячейками.
- По принципу Паули на каждой атомной орбитали могут располагаться максимально два электрона, причем их спины должны быть противонаправлены.
- Электроны располагаются по подуровням так, чтобы энергия системы была минимальна.
- Химические элементы делятся на s-, p-, d- и f-семейства по тому, на какой подуровень пишем последний электрон при составлении электронной конфигурации атома.
Проверь себя
Задание 1.
Сколько электронов может максимально располагаться на орбитали?
- 1 электрон
- 2 электрона
- 3 электрона
- 4 электрона
Задание 2.
Как атомные подуровни заполняются электронами?
- в порядке увеличения их энергии
- в порядке уменьшения их энергии
- в периодическом порядке
Задание 3.
Сколько атомных орбиталей содержит d-подуровень?
- 1
- 3
- 5
- 7
Задание 4.
Какую форму имеет s-орбиталь?
- шара
- гантели
- эллипса
- нескольких гантелей
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 1.
Ch205: Глава 2. Атомы, элементы и периодическая таблица
Глава 2. Атомы, элементы и периодическая таблица
Этот контент также можно загрузить в формате PDF для печати или в интерактивном формате PDF. Для интерактивного PDF требуется Adobe Reader для полной функциональности.
Для интерактивного PDF требуется Adobe Reader для полной функциональности.
Этот текст опубликован в соответствии с лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
Секции:
2.1 Что такое органическая химия?
2.2 Элементы. 3 Субатомные частицы
Протоны определяют принадлежность элемента
Изотопы и атомная масса
Электроны и Периодическая таблица элементов
Особенности периодической таблицы
2.3 Краткое содержание главы
2.4 Ссылки
2.1 Что такое органическая химия?
Вы когда-нибудь задумывались, почему некоторые растения можно использовать для изготовления лекарств, а другие токсичны и могут убить вас? Или почему одни продукты считаются полезными, а другие — вредными? Или как производятся такие напитки, как пиво, сидр и вино? Этот курс предназначен для ознакомления читателя с фундаментальными понятиями органической химии с использованием потребительских товаров, технологий и услуг в качестве модельных систем для обучения этим основным понятиям и демонстрации того, как органическая химия является неотъемлемой частью повседневной жизни.
Органическая химия является растущей отраслью химии. Проще говоря, это изучение всех соединений на основе углерода; их строение, свойства, реакции и их использование в синтезе. Это химия жизни, включающая в себя все вещества, полученные из живых систем. Применение органической химии сегодня можно увидеть повсюду, от пластика, из которого состоят компоненты вашего компьютера, до нейлона, из которого сделана ваша одежда, до макромолекул и клеток, из которых состоит само ваше тело! Органическая химия расширила наш мир знаний и является неотъемлемой частью областей медицины, биохимии, биологии, промышленности, нанотехнологий, ракетостроения и многих других!
Чтобы начать обсуждение органической химии, нам нужно сначала взглянуть на химические элементы и понять, как они взаимодействуют, образуя химические соединения.
. 029
Элемент – это вещество, которое нельзя разложить на более простые химические вещества. На Земле известно около 90 природных элементов. Используя технологии, ученые смогли создать почти 30 дополнительных элементов, которые не так легко найти в природе. Сегодня химия признает в общей сложности 118 элементов, которые все представлены в стандартной таблице элементов, называемой Периодической таблицей элементов (рисунок 2.1). Каждый элемент представлен одно- или двухбуквенным кодом, где первая буква всегда заглавная, а если присутствует вторая буква, она пишется строчной. Например, символ водорода — H, а символ углерода — C. Некоторые элементы имеют, казалось бы, странные буквенные коды, например, натрий — это Na. Эти буквенные коды получены из латинской терминологии. Например, символ натрия (Na) происходит от латинского слова natrium, что означает карбонат натрия.
Используя технологии, ученые смогли создать почти 30 дополнительных элементов, которые не так легко найти в природе. Сегодня химия признает в общей сложности 118 элементов, которые все представлены в стандартной таблице элементов, называемой Периодической таблицей элементов (рисунок 2.1). Каждый элемент представлен одно- или двухбуквенным кодом, где первая буква всегда заглавная, а если присутствует вторая буква, она пишется строчной. Например, символ водорода — H, а символ углерода — C. Некоторые элементы имеют, казалось бы, странные буквенные коды, например, натрий — это Na. Эти буквенные коды получены из латинской терминологии. Например, символ натрия (Na) происходит от латинского слова natrium, что означает карбонат натрия.
Рисунок 2.1: Элементы. Некоторые примеры чистых элементов включают (A) висмут, Bi, тяжелый металл, используемый в качестве замены свинца и в некоторых лекарствах, таких как пепто-бисмол, противодиарейное средство, и (B) стронций, Sr, основной компонент фейерверков. (C) Все обнаруженные элементы представлены в Периодической таблице элементов, которая обеспечивает элегантный механизм не только для отображения элементов, но и для описания многих их характеристик.
(C) Все обнаруженные элементы представлены в Периодической таблице элементов, которая обеспечивает элегантный механизм не только для отображения элементов, но и для описания многих их характеристик.
Содержание элементов сильно различается. Во Вселенной в целом самым распространенным элементом является водород (около 90%), за ним следует гелий (большая часть оставшихся 10%). Насколько мы можем обнаружить, все остальные элементы присутствуют в относительно незначительных количествах. Однако на планете Земля ситуация несколько иная. Кислород составляет 46,1 % массы земной коры (относительно тонкого слоя породы, образующей земную поверхность), в основном в сочетании с другими элементами, а кремний — 28,5 %. Водород, самый распространенный элемент во Вселенной, составляет всего 0,14% земной коры. В таблице 2.1 «Элементный состав Земли» приведены относительные содержания элементов на Земле в целом и в земной коре. В таблице 2.2 «Элементный состав человеческого тела» указано относительное содержание элементов в организме человека. Если вы сравните Таблицу 2.1 «Элементный состав Земли» и Таблицу 2.2 «Элементный состав человеческого тела», вы обнаружите несоответствие между процентным содержанием каждого элемента в организме человека и на Земле. Кислород имеет самое высокое процентное содержание в обоих случаях, но углерод, элемент со вторым по величине процентным содержанием в организме, относительно редко встречается на Земле и даже не фигурирует как отдельная запись в Таблице 2.1 «Элементный состав Земли»; углерод является частью 0,174%, представляющих «другие» элементы. Как человеческое тело концентрирует так много, казалось бы, редких элементов?
Если вы сравните Таблицу 2.1 «Элементный состав Земли» и Таблицу 2.2 «Элементный состав человеческого тела», вы обнаружите несоответствие между процентным содержанием каждого элемента в организме человека и на Земле. Кислород имеет самое высокое процентное содержание в обоих случаях, но углерод, элемент со вторым по величине процентным содержанием в организме, относительно редко встречается на Земле и даже не фигурирует как отдельная запись в Таблице 2.1 «Элементный состав Земли»; углерод является частью 0,174%, представляющих «другие» элементы. Как человеческое тело концентрирует так много, казалось бы, редких элементов?
Относительное количество элементов в организме связано не столько с их изобилием на Земле, сколько с их наличием в форме, которую мы можем ассимилировать. Мы получаем кислород из воздуха, которым дышим, и воды, которую пьем. Мы также получаем водород из воды. С другой стороны, хотя углерод присутствует в атмосфере в виде двуокиси углерода, а около 80% атмосферы состоит из азота, мы получаем эти два элемента из пищи, которую едим, а не из воздуха, которым дышим.
(Вернуться к началу)
Атомная теория
Современная атомная теория, предложенная примерно в 1803 году английским химиком Джоном Дальтоном, представляет собой фундаментальную концепцию, согласно которой все элементы состоят из атомов. Атом — это наименьшая часть элемента, которая сохраняет идентичность этого элемента. Отдельные атомы чрезвычайно малы; даже самый большой атом имеет приблизительный диаметр всего 5,4 × 10 90 119 −10 90 120 м. При таком размере требуется более 18 миллионов таких атомов, выстроенных бок о бок, чтобы они равнялись ширине вашего мизинца (около 1 см).
Большинство элементов в чистом виде существуют в виде отдельных атомов. Например, макроскопический кусок металлического железа микроскопически состоит из отдельных атомов железа. Однако некоторые элементы существуют в виде групп атомов, называемых молекулами. Некоторые важные элементы существуют в виде двухатомных комбинаций и называются двухатомными молекулами. Представляя двухатомную молекулу, мы используем символ элемента и включаем нижний индекс 2, чтобы указать, что два атома этого элемента соединены вместе. Элементами, которые существуют в виде двухатомных молекул, являются водород (H 2 ), кислород (O 2 ), азот (N 2 ), фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ).
Представляя двухатомную молекулу, мы используем символ элемента и включаем нижний индекс 2, чтобы указать, что два атома этого элемента соединены вместе. Элементами, которые существуют в виде двухатомных молекул, являются водород (H 2 ), кислород (O 2 ), азот (N 2 ), фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ).
(наверх)
Субатомные частицы
9 0006 В атомную теорию Дальтона было внесено несколько незначительных, но важных модификаций. Во-первых, Дальтон считал атомы неделимыми. Теперь мы знаем, что атомы не только могут быть разделены, но и состоят из трех различных видов частиц со своими свойствами, отличными от химических свойств атомов.
Первая субатомная частица была идентифицирована в 1897 году и названа электроном. Это чрезвычайно крошечная частица с массой около 9,109 × 10 −31 кг. Эксперименты с магнитными полями показали, что электрон имеет отрицательный электрический заряд.
Эксперименты с магнитными полями показали, что электрон имеет отрицательный электрический заряд.
К 1920 году экспериментальные данные указывали на существование второй частицы. Протон имеет тот же заряд, что и электрон, но его заряд положительный, а не отрицательный. Еще одно важное различие между протоном и электроном — это масса. Несмотря на то, что масса протона все еще невероятно мала, она составляет 1,673 × 10 9 .0119 −27 кг, что почти в 2000 раз превышает массу электрона. Поскольку противоположные заряды притягиваются друг к другу (в то время как «одинаковые» заряды отталкиваются друг от друга), протоны притягивают электроны (и наоборот).
Наконец, дополнительные эксперименты указали на существование третьей частицы, называемой нейтроном. Доказательства, полученные в 1932 году, установили существование нейтрона, частицы с массой примерно такой же, как у протона, но без электрического заряда.
Теперь мы понимаем, что все атомы можно разложить на субатомные частицы: протоны, нейтроны и электроны. В таблице 2.3 «Свойства субатомных частиц» перечислены некоторые из их важных характеристик и символы, используемые для обозначения каждой частицы. Эксперимент показал, что протоны и нейтроны концентрируются в центральной области каждого атома, называемой ядром (множественное число, ядра). Электроны находятся вне ядра и вращаются вокруг него, потому что они притягиваются к положительному заряду ядра. Большая часть массы атома находится в ядре, а вращающиеся вокруг него электроны составляют размер атома. В результате атом состоит в основном из пустого пространства. (рис. 2.4 и 2.5).
В таблице 2.3 «Свойства субатомных частиц» перечислены некоторые из их важных характеристик и символы, используемые для обозначения каждой частицы. Эксперимент показал, что протоны и нейтроны концентрируются в центральной области каждого атома, называемой ядром (множественное число, ядра). Электроны находятся вне ядра и вращаются вокруг него, потому что они притягиваются к положительному заряду ядра. Большая часть массы атома находится в ядре, а вращающиеся вокруг него электроны составляют размер атома. В результате атом состоит в основном из пустого пространства. (рис. 2.4 и 2.5).
Рис. 2.4 Анатомия атома. Протоны и нейтроны атома сгруппированы в центре атома в структуре, называемой ядром. Электроны вращаются вокруг ядра атома в электронном облаке или в пустом пространстве, окружающем ядро атома. Обратите внимание, что большую часть площади атома занимает пустое пространство электронного облака.
Источник: https://upload.wikimedia. org/wikipedia/commons/2/24/Figure_02_01_01.jpg
org/wikipedia/commons/2/24/Figure_02_01_01.jpg
Рис. 2.5 Путь электрона в атоме водорода. Электроны не находятся на дискретных орбитах, как планеты вокруг Солнца. Вместо этого существует вероятность того, что электрон может занять определенное место в электронном облаке (а) Чем темнее цвет, тем выше вероятность того, что один электрон водорода будет находиться в этой точке в любой момент времени. (b) Точно так же, чем теснее точки, тем выше вероятность того, что один электрон водорода окажется в этой точке. На обеих диаграммах ядро находится в центре диаграммы.
(Вернуться к началу)
Протоны определяют идентичность элемента химические свойства. Короче говоря, элемент определяется количеством протонов, находящихся в его ядре. Число протонов внутри элемента также называется его атомным номером и представлено математическим термином Z (рис. 2.6). Если вы вернетесь к периодической таблице элементов, показанной на рис. 2.1, вы увидите, что периодическая таблица организована по количеству протонов, содержащихся в элементе. Таким образом, когда вы читаете каждую строку Периодической таблицы (слева направо), каждый элемент увеличивается на один протон (или на один атомный номер, 9).0010 Z ).
2.1, вы увидите, что периодическая таблица организована по количеству протонов, содержащихся в элементе. Таким образом, когда вы читаете каждую строку Периодической таблицы (слева направо), каждый элемент увеличивается на один протон (или на один атомный номер, 9).0010 Z ).
Рис. 2.6 Структура периодической таблицы. Каждый элемент периодической таблицы представлен атомным символом (Cu для меди), атомным номером в верхнем левом углу и атомной массой в правом углу.
(Вернуться к началу)
Изотопы, аллотропы и атомная масса
Сколько нейтронов содержится в атомах определенного элемента? Сначала считалось, что число нейтронов в ядре также является характеристикой элемента. Однако было обнаружено, что атомы одного и того же элемента могут иметь разное количество нейтронов. Атомы одного и того же элемента, имеющие разное число нейтронов, называются изотопами (рис. 2.7). Например, 99% атомов углерода на Земле имеют в своих ядрах 6 нейтронов и 6 протонов; около 1% атомов углерода имеют в своих ядрах 7 нейтронов и 6 протонов. Таким образом, встречающийся в природе углерод на Земле на самом деле представляет собой смесь изотопов, хотя смесь на 99% состоит из углерода с 6 нейтронами в каждом ядре. Изотопный состав оказался полезным методом датирования многих слоев горных пород и окаменелостей.
Таким образом, встречающийся в природе углерод на Земле на самом деле представляет собой смесь изотопов, хотя смесь на 99% состоит из углерода с 6 нейтронами в каждом ядре. Изотопный состав оказался полезным методом датирования многих слоев горных пород и окаменелостей.
Рис. 2.7 Изотопы водорода. Все атомы водорода имеют один протон и один электрон. Однако они могут различаться числом нейтронов. (а) Большинство атомов водорода содержат только один p+ и один e- и не содержат нейтронов (b) Небольшое количество водорода существует в виде изотопа дейтерия, который имеет один протон и один нейтрон в своем ядре, и (c) еще меньшее количество содержит один протон и два нейтрона в своем ядре и называется тритием. Обратите внимание, что тритий является нестабильным изотопом и со временем распадается. Таким образом, тритий является радиоактивным элементом.
Большинство элементов существуют в виде смесей изотопов. Фактически, в настоящее время известно более 3500 изотопов всех элементов. Когда ученые обсуждают отдельные изотопы, им нужен эффективный способ указать количество нейтронов в любом конкретном ядре. Атомная масса (А) атома представляет собой сумму числа протонов и нейтронов в ядре (рис. 2.6). Зная атомную массу ядра (и зная атомный номер Z этого конкретного атома), вы можете определить количество нейтронов, вычитая атомный номер из атомной массы.
Когда ученые обсуждают отдельные изотопы, им нужен эффективный способ указать количество нейтронов в любом конкретном ядре. Атомная масса (А) атома представляет собой сумму числа протонов и нейтронов в ядре (рис. 2.6). Зная атомную массу ядра (и зная атомный номер Z этого конкретного атома), вы можете определить количество нейтронов, вычитая атомный номер из атомной массы.
Простой способ указать массовое число конкретного изотопа — указать его в виде надстрочного индекса слева от символа элемента. Атомные номера часто указываются в виде нижнего индекса слева от символа элемента. Таким образом, мы можем увидеть
, что указывает на определенный изотоп меди. 29 — это атомный номер Z (одинаковый для всех атомов меди), а 63 — это атомная масса (А) изотопа. Чтобы определить число нейтронов в этом изотопе, мы вычитаем 29из 63: 63 − 29 = 34, значит, в этом атоме 34 нейтрона.
Аллотропы элемента отличаются и отделены от термина изотоп, и их не следует путать. Некоторые химические элементы могут образовывать более одного типа структурной решетки, эти различные структурные решетки известны как аллотропы . Это относится к фосфору, как показано на рис. 2.2. Белый или желтый фосфор образуется, когда четыре атома фосфора выстраиваются в тетраэдрическую конформацию (рис. 2.8). Другие кристаллические решетки фосфора более сложны и могут быть сформированы при воздействии на фосфор различных температур и давлений. Например, клеточная решетка красного фосфора может быть образована при нагревании белого фосфора свыше 280 град.0119 o С (рис. 2.8). Обратите внимание, что аллотропные изменения влияют на то, как атомы элемента взаимодействуют друг с другом, образуя трехмерную структуру. Они не изменяют образец в отношении присутствующих атомных изотопных форм и НЕ НЕ изменяют и не влияют на атомную массу ( A ) элемента.
Некоторые химические элементы могут образовывать более одного типа структурной решетки, эти различные структурные решетки известны как аллотропы . Это относится к фосфору, как показано на рис. 2.2. Белый или желтый фосфор образуется, когда четыре атома фосфора выстраиваются в тетраэдрическую конформацию (рис. 2.8). Другие кристаллические решетки фосфора более сложны и могут быть сформированы при воздействии на фосфор различных температур и давлений. Например, клеточная решетка красного фосфора может быть образована при нагревании белого фосфора свыше 280 град.0119 o С (рис. 2.8). Обратите внимание, что аллотропные изменения влияют на то, как атомы элемента взаимодействуют друг с другом, образуя трехмерную структуру. Они не изменяют образец в отношении присутствующих атомных изотопных форм и НЕ НЕ изменяют и не влияют на атомную массу ( A ) элемента.
Различные аллотропы разных элементов могут иметь разные физические и химические свойства, и поэтому их по-прежнему важно учитывать. Например, кислород имеет две разные аллотропные формы, причем преобладающей аллотропной формой является двухатомная форма кислорода, O 2 . Однако кислород может существовать и в виде O 3 , озона. В нижних слоях атмосферы озон образуется как побочный продукт выхлопных газов автомобилей и других промышленных процессов , где он способствует загрязнению. Он имеет очень резкий запах и является очень сильным окислителем. Может вызывать поражение слизистых оболочек и дыхательных путей у животных. Воздействие озона связывают с преждевременной смертью, астмой, бронхитом, сердечными приступами и другими сердечно-легочными заболеваниями. В верхних слоях атмосферы он создается естественными электрическими разрядами и существует в очень низких концентрациях. Присутствие озона в верхних слоях атмосферы имеет решающее значение, поскольку он перехватывает очень вредное ультрафиолетовое излучение Солнца, не позволяя ему достичь поверхности Земли.
Например, кислород имеет две разные аллотропные формы, причем преобладающей аллотропной формой является двухатомная форма кислорода, O 2 . Однако кислород может существовать и в виде O 3 , озона. В нижних слоях атмосферы озон образуется как побочный продукт выхлопных газов автомобилей и других промышленных процессов , где он способствует загрязнению. Он имеет очень резкий запах и является очень сильным окислителем. Может вызывать поражение слизистых оболочек и дыхательных путей у животных. Воздействие озона связывают с преждевременной смертью, астмой, бронхитом, сердечными приступами и другими сердечно-легочными заболеваниями. В верхних слоях атмосферы он создается естественными электрическими разрядами и существует в очень низких концентрациях. Присутствие озона в верхних слоях атмосферы имеет решающее значение, поскольку он перехватывает очень вредное ультрафиолетовое излучение Солнца, не позволяя ему достичь поверхности Земли.
Рис. 2.8 Аллотропы фосфора. (A) Белый фосфор существует в виде (B) тетраэдрической формы фосфора, тогда как (C) красный фосфор имеет более (D) клеточную кристаллическую решетку. (E) Различные элементарные формы фосфора могут быть созданы путем обработки образцов белого фосфора повышением температуры и давления.
2.8 Аллотропы фосфора. (A) Белый фосфор существует в виде (B) тетраэдрической формы фосфора, тогда как (C) красный фосфор имеет более (D) клеточную кристаллическую решетку. (E) Различные элементарные формы фосфора могут быть созданы путем обработки образцов белого фосфора повышением температуры и давления.
Источник: https://en.wikipedia.org/wiki/Allotropes_of_фосфор
(Вернуться к началу)
Электроны и периодическая таблица элементов
Помните, что электроны в 2000 раз меньше протонов, и все же каждый из них содержит равный, но противоположный заряд. Электроны имеют отрицательный заряд, а протоны — положительный. Интересно, что когда элементы существуют в своей элементарной форме, как показано в периодической таблице, количество электронов, находящихся в атоме, равно количеству протонов. Следовательно, электрический заряд элемента компенсируется, и общий заряд атома равен нулю.
Электроны — подвижная часть атома. Они движутся и вращаются вокруг ядра атома в электронном облаке — термин, используемый для обозначения пространства вокруг ядра. Однако они не двигаются случайным образом. У электронов есть адреса или определенные орбитальные вращения внутри электронного облака, почти так же, как наши многоквартирные дома имеют адреса в наших городах. Чтобы найти адрес электрона, нужно немного знать об организации электронного облака (…или города, в котором живет электрон).
Они движутся и вращаются вокруг ядра атома в электронном облаке — термин, используемый для обозначения пространства вокруг ядра. Однако они не двигаются случайным образом. У электронов есть адреса или определенные орбитальные вращения внутри электронного облака, почти так же, как наши многоквартирные дома имеют адреса в наших городах. Чтобы найти адрес электрона, нужно немного знать об организации электронного облака (…или города, в котором живет электрон).
Электронное облако атома разделено на слои, называемые оболочками, примерно так же, как слои луковицы, если ее очистить. Однако неверно думать о скорлупе как об одном слое без толщины и глубины. Оболочка имеет трехмерное пространство внутри, которое содержит большое количество «квартир» или пространств, которые могут занимать электроны. Таким образом, оболочка, или число n, — это только первая часть адреса электрона внутри атома. Это было бы похоже на знание только района, где живет ваш друг. Если вы знаете только окрестности, вам будет сложно найти своего друга, если вы хотите пригласить его на ужин.
Всего существует 7 оболочек (или слоев), которые атом может иметь для своих электронов. Если атом маленький, у него может быть только 1 или 2 оболочки. Только очень большие атомы имеют все 7 слоев. После этого добавление 8-й оболочки делает атом слишком нестабильным для существования… по крайней мере, мы никогда не находили атомы, содержащие 8-ю оболочку! Вы заметите, что в таблице Менделеева (рис. 2.9) всего 7 строк (обратите внимание, что ряды элементов лантанидов и актинидов обычно показаны под основной таблицей, чтобы их можно было уместить на одной странице, но на самом деле они находятся в середине строк 6 и 7 периодической таблицы в соответствии с их атомными номерами). Каждый из этих рядов представляет электронную оболочку. Таким образом, по мере того, как атомы становятся больше и содержат больше электронов, они приобретают дополнительные оболочки, до 7,9.0007
Рис. 2.9 Структура периодической таблицы. Каждый элемент периодической таблицы представлен атомным символом (Cu для меди), атомным номером в верхнем левом углу и атомной массой в правом углу.
Источник: Робсон Г. (2006) Википедия. https://en.wikipedia.org/wiki/Electron_shell
В этом учебнике мы не занимаемся изучением адресов всех электронов, но нас очень интересуют электроны, которые находятся ближе всего к поверхности атома или те, которые находятся во внешней оболочке атома. Электроны, находящиеся ближе всего к поверхности атома, являются наиболее реакционноспособными и участвуют в формировании связей между атомами. Говорят, что эти электроны размещены в атомной, валентной оболочке или электронной оболочке, наиболее удаленной от ядра атома. (или ближайший к поверхности атома).
(Вернуться к началу)
Особенности периодической таблицы
Элементы, обладающие сходными химическими свойствами, сгруппированы в столбцы, называемые группами (или семействами). Помимо нумерации, некоторые из этих групп имеют названия, например, щелочные металлы (первая колонка элементов), щелочноземельные металлы (вторая колонка элементов), галогены (предпоследняя колонка элементов) и благородные газы (последняя колонка элементов).
Каждая строка элементов периодической таблицы называется периодом. Периоды имеют разную длину; в первом периоде всего 2 элемента (водород и гелий), а во втором и третьем периодах по 8 элементов. Четвертый и пятый периоды содержат по 18 элементов каждый, а более поздние периоды настолько длинные, что сегмент каждого из них удаляется и помещается под основную часть таблицы.
Некоторые свойства элементов становятся очевидными при рассмотрении периодической таблицы в целом. Каждый элемент может быть классифицирован как металл, неметалл или полуметалл, как показано на рисунке 2.10 «Типы элементов». Металл — это блестящее вещество, обычно (но не всегда) серебристое, прекрасно проводящее электричество и тепло. Металлы также податливы (их можно бить в тонкие листы) и пластичны (их можно вытягивать в тонкие проволоки). Неметалл обычно тусклый и плохой проводник электричества и тепла. Твердые неметаллы также очень хрупкие. Как показано на рис. 2.7 «Типы элементов», металлы занимают левые три четверти таблицы Менделеева, а неметаллы (за исключением водорода) сгруппированы в верхнем правом углу таблицы Менделеева. Элементы с промежуточными свойствами Другой способ категоризации элементов таблицы Менделеева показан на рисунке 2.11 «Специальные названия разделов таблицы Менделеева». Первые два столбца слева и последние шесть столбцов справа называются основными элементами группы. Блок из десяти столбцов между этими столбцами содержит переходные металлы. Две строки под основной частью периодической таблицы содержат внутренние переходные металлы. Элементы в этих двух рядах также обозначаются соответственно как металлы-лантаниды и металлы-актиноиды (рис. 2.11).
Элементы с промежуточными свойствами Другой способ категоризации элементов таблицы Менделеева показан на рисунке 2.11 «Специальные названия разделов таблицы Менделеева». Первые два столбца слева и последние шесть столбцов справа называются основными элементами группы. Блок из десяти столбцов между этими столбцами содержит переходные металлы. Две строки под основной частью периодической таблицы содержат внутренние переходные металлы. Элементы в этих двух рядах также обозначаются соответственно как металлы-лантаниды и металлы-актиноиды (рис. 2.11).
Рис. 2.10. Типы элементов. Элементы — это металлы, неметаллы или полуметаллы. Каждая группа расположена в другой части периодической таблицы.
Рис. 2.11. Специальные названия разделов периодической таблицы. Некоторые разделы периодической таблицы имеют специальные названия. Например, элементы литий, натрий, калий, рубидий, цезий и франций вместе известны как щелочные металлы. Обратите внимание, что элементы основной группы не включают переходные металлы.
Обратите внимание, что элементы основной группы не включают переходные металлы.
Периодическая таблица составлена на основе сходства свойств элементов, но чем объясняется это сходство? Оказывается, расположение столбцов или семейств в Периодической таблице отражает то, как подоболочки заполнены электронами. Следует отметить, что элементы в одном и том же столбце имеют одинаковую электронную конфигурацию валентной оболочки. Например, все элементы в первом столбце имеют один электрон на валентной оболочке. Это последнее наблюдение имеет решающее значение. Химия в значительной степени является результатом взаимодействия между валентными электронами различных атомов. Таким образом, атомы с одинаковой электронной конфигурацией валентной оболочки будут иметь схожий химический состав (рис. 2.12).
Рис. 2.12. Число электронов валентной оболочки. Расположение элементов в периодической таблице соответствует количеству валентных электронов, находящихся в этом элементе. Все семейства (столбцы) в периодической таблице содержат одинаковое количество электронов валентной оболочки, что придает им схожие химические свойства и реакционную способность. Вы можете легко сосчитать элементы основной группы, чтобы увидеть увеличение числа электронов в валентной оболочке. Все переходные металлы имеют 2 e- в своей валентной оболочке, хотя они также содержат внутреннюю орбитальную подоболочку, которая очень близка к валентной оболочке. Это придает некоторым из этих металлов разные уровни реакционной способности. Обратите внимание, что максимально возможное количество электронов валентной оболочки равно 8, и это достигается только благородными газами.
Все семейства (столбцы) в периодической таблице содержат одинаковое количество электронов валентной оболочки, что придает им схожие химические свойства и реакционную способность. Вы можете легко сосчитать элементы основной группы, чтобы увидеть увеличение числа электронов в валентной оболочке. Все переходные металлы имеют 2 e- в своей валентной оболочке, хотя они также содержат внутреннюю орбитальную подоболочку, которая очень близка к валентной оболочке. Это придает некоторым из этих металлов разные уровни реакционной способности. Обратите внимание, что максимально возможное количество электронов валентной оболочки равно 8, и это достигается только благородными газами.
Рис. 2.13. Роль железа в транспорте кислорода. Белок гемоглобина составляет около 95% сухого содержимого эритроцита, и каждый белок гемоглобина может связывать и переносить четыре молекулы кислорода (O 2 ).
По материалам: https://en.wikipedia.org/wiki/Hemoglobin и https://en. wikipedia.org/wiki/Capillary Резюме
wikipedia.org/wiki/Capillary Резюме
(В начало)
2.4 Ссылки
Материалы главы 2 были адаптированы из следующих ресурсов Creative Commons, если не указано иное: 9 0007
1. Портал органической химии. ВикиУниверситет. Доступно по адресу: https://en.wikiversity.org/wiki/Portal:Organic_chemistry
2. Анонимно. (2012) Введение в химию: общая, органическая и биологическая (V1.0). Опубликовано Creative Commons by-nc-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
3. Поулсен Т. (2010) Введение в химию. Опубликовано Creative Commons by-nc-sa 3.0. Доступно по адресу: http://openedgroup.org/books/Chemistry.pdf
The Essential Elements — Science Learning Hub
Добавить в коллекцию
Поскольку наши знания о химии живых систем (биохимии ) увеличивается, мы узнаем больше об основных элементах. Считается, что млекопитающие, подобные нам, используют только 25 из 116 известных элементов.
Считается, что млекопитающие, подобные нам, используют только 25 из 116 известных элементов.
За исключением кислорода, эти элементы не встречаются в чистом виде. Вместо этого они обнаруживаются либо растворенными в воде в ионной форме, такой как ионы натрия и ионы хлора, либо в виде частей больших молекул, таких как гемоглобин.
Какие элементы присутствуют в организме человека?
Ученые считают, что около 25 известных элементов необходимы для жизни. Всего четыре из них — углерод (C), кислород (O), водород (H) и азот (N) — составляют около 96% человеческого тела.
Эти четыре элемента входят в базовую структуру всех биохимических молекул. Например, глюкоза является углеводом и ее молекулярная формула C 6 H 12 O 6 – каждая молекула глюкозы состоит из 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода.
Остальные найденные элементы можно разделить на две основные группы – основные элементы и микроэлементы.
Организм человека функционирует в результате большого количества химических реакций с участием соединений всех этих элементов.
Важны микроэлементы
Хотя многие элементы необходимы в очень малых количествах, они играют очень важную роль в поддержании эффективной работы организма:
- Большая часть 3–4 граммов железа в организме содержится в гемоглобине, веществе, ответственном за перенос кислорода из легких в остальные части тела.
- В организме содержится около 75 мг меди, около трети которой находится в мышцах. Медь в сочетании с некоторыми белками образует ферменты, которые действуют как катализаторы и помогают ряду функций организма. Некоторые участвуют в преобразовании меланина для пигментации кожи, а другие помогают формировать поперечные связи в коллагене и эластине и тем самым поддерживать и восстанавливать соединительные ткани. Это особенно важно для сердца и артерий. Исследования показывают, что дефицит меди является одним из факторов, приводящих к повышенному риску развития ишемической болезни сердца.

Хорошо сбалансированное питание обеспечит рабочий организм всеми необходимыми микроэлементами.
Слишком много или слишком мало?
Большое количество незаменимых элементов может оказаться токсичным:
- Слишком много меди в рационе может привести к повреждению печени, обесцвечиванию кожи и волос и вызвать гиперактивность у детей.
- Слишком много железа в рационе может привести к повреждению сердца и печени.
Слишком малое количество любого данного основного элемента может привести к ухудшению здоровья и, если его не лечить, может привести к смерти:
- Цинк входит в состав некоторых пищеварительных ферментов и других белков. Недостаток в рационе может привести к задержке роста, чешуйчатому воспалению кожи, нарушению репродуктивной функции и ослаблению иммунитета.
- У людей, страдающих дефицитом железа, проявляются такие симптомы, как недостаток энергии, быстрая утомляемость и одышка.
Природа науки
Научное знание никогда не бывает абсолютным или определенным. По мере того, как ученые узнают больше об основных элементах, необходимых в рационе, старые убеждения, возможно, придется изменить в свете новых данных.
По мере того, как ученые узнают больше об основных элементах, необходимых в рационе, старые убеждения, возможно, придется изменить в свете новых данных.
Сопутствующий контент
Элементы необходимы для очень многих вещей — узнайте о роли микроэлементов в здоровье человека. Цинк и магний также имеют решающее значение для здоровья.
Углерод — это больше, чем просто еще один элемент, как объясняется в статье Углерод — элемент основы жизни.
Статья Периодическая таблица элементов содержит краткое введение в элементы.
Если вы ищете, чем заняться, команда Science Learning Hub подготовила коллекцию ресурсов, связанных с периодической таблицей элементов. Войдите, чтобы сделать эту коллекцию частью вашей частной коллекции, просто нажмите на значок копирования. Затем вы можете добавить дополнительный контент, заметки и внести другие изменения. Зарегистрировать учетную запись в Центрах научного обучения легко и бесплатно — зарегистрируйтесь, указав свой адрес электронной почты или учетную запись Google.

 относит. атомная масса – увеличивается
относит. атомная масса – увеличивается


 Таких семейств выделяют четыре:
Таких семейств выделяют четыре: