Хим элемент медь: Химический элемент Медь: свойства и применение
Содержание
Медь как химический элемент таблицы Менделеева
М Медь является химическим элементом с атомным номером 29 и условным обозначением Cu. Медь представляет собой мягкий ковкий пластичный металл с очень хорошей тепло- и электропроводимостью.
Содержание
- Как была открыта Медь;
- Где и как добывают Медь;
- Распространенность Меди;
- Применение Меди;
- Интересные факты
Как была открыта медь
Такие металлы как медь, золото, серебро и олово были известны людям очень давно. Так как с медью легко работать, она использовалась древнейшими известными культурами уже 10000 лет назад. Пик популярности использования меди приходится начиная с 5 и заканчивая 3 тысячелетием до Нашей Эры. Это время в некоторых регионах принято называть «медным веком». Из этого металла изготавливались как орудия труда, так и украшения. На территории современного Ирана был найден медный кулон возраст которого приблизительно оценивается в 8700 год до Нашей Эры. Так же медь является первым металлом, который научились легировать с помощью олова и мышьяка до бронзы. В связи с этим открытием, которое произошло вероятно около 3 тысячелетия до Нашей Эры, началась так называемая эпоха «Бронзового века». Эта эпоха продлилась ориентировочно до первого тысячелетия до Нашей эры.
Так же медь является первым металлом, который научились легировать с помощью олова и мышьяка до бронзы. В связи с этим открытием, которое произошло вероятно около 3 тысячелетия до Нашей Эры, началась так называемая эпоха «Бронзового века». Эта эпоха продлилась ориентировочно до первого тысячелетия до Нашей эры.
Затем производство меди и его обработка набирала уже значительные обороты. К началу новой эпохи мировое производство меди ориентировочно варьировалось в пределах 15 тонн в год. В первом тысячелетии Нашей Эры уже производились массивные сооружения из меди и его сплавов. В пример можно поставить бронзовую статую Будды храма Нара в Японии. По историческим сведениям ее отлили в 749 году. Для сооружения 16-ти метровой конструкции понадобилось 400 тонн сырья. Научное открытие самого металла можно присудить немецкому ученому Готфриду Осанну. Он изобрел порошковую металлургию, которую использовал на меди в 1830 году. В ходе своих испытаний он описал и определил атомный вес этого химического элемента.
Где и как добывают медь
Как становится понятно из текста выше, такой химический элемент как медь использовался уже с древнейших времен. И добыча этого элемента уже осуществлялась еще до Нашей эры. Медь является третьим металлом по применению после железа и алюминия. Вся добытая медная руда до 1900 года составляет менее 5% от всей руды извлеченной из недр Земли. В 2008 году добыча меди превысила порог в 15 миллионов тонн в год. На сегодняшний день эта цифра готовится превысить отметку в 20 миллионов тонн. Ведущими производителями меди являются Чили, Перу, Китай, США, Конго, Австралия, Замбия, Индонезия, Мексика и Россия.
Процесс получения самой меди выглядит следующим образом. Вначале медный камень Cu2S извлекается из медного гравия CuFeS2. Для этого гравий обжигают с добавлением кокса, а оксиды железа зашлаковывают кремнеземом. Шлак из силиката железа плавает на поверхности и может быть легко слит. Медный камень, оставшийся на дне, затем перерабатывается в черновую медь. Эта процедура обычно осуществляется в два этапа. На первом этапе образовавшийся сульфид железа обжигается до оксида железа и связывается с кварцевым шлаком, который в последующем выливается. На втором этапе две трети медного камня окисляется до оксида. После этого оксид меди реагирует с оставшимся сульфидом в результате чего появляется черновая медь.
Эта процедура обычно осуществляется в два этапа. На первом этапе образовавшийся сульфид железа обжигается до оксида железа и связывается с кварцевым шлаком, который в последующем выливается. На втором этапе две трети медного камня окисляется до оксида. После этого оксид меди реагирует с оставшимся сульфидом в результате чего появляется черновая медь.
Черновая медь имеет чистоту порядка 98%, а оставшиеся 2% приходятся на примеси железа, цинка, серебра и золота. Очистка черновой меди осуществляется методом электролитического рафинирования в серной кислоте. В ходе этой реакции железо и цинк растворяются в виде катионов, а благородные металлы осаждаются на дне. Чистота меди на выходе этого процесса составляет 99,99%.
Распространенность меди
Распространенность такого химического элемента как медь довольно широка. По распространенности в земной коре медь занимает 23 позицию. Ее содержание в земной коре оценивается в 0,006%. Этот химический элемент является одним из немногих, который встречается в природе в самородном виде.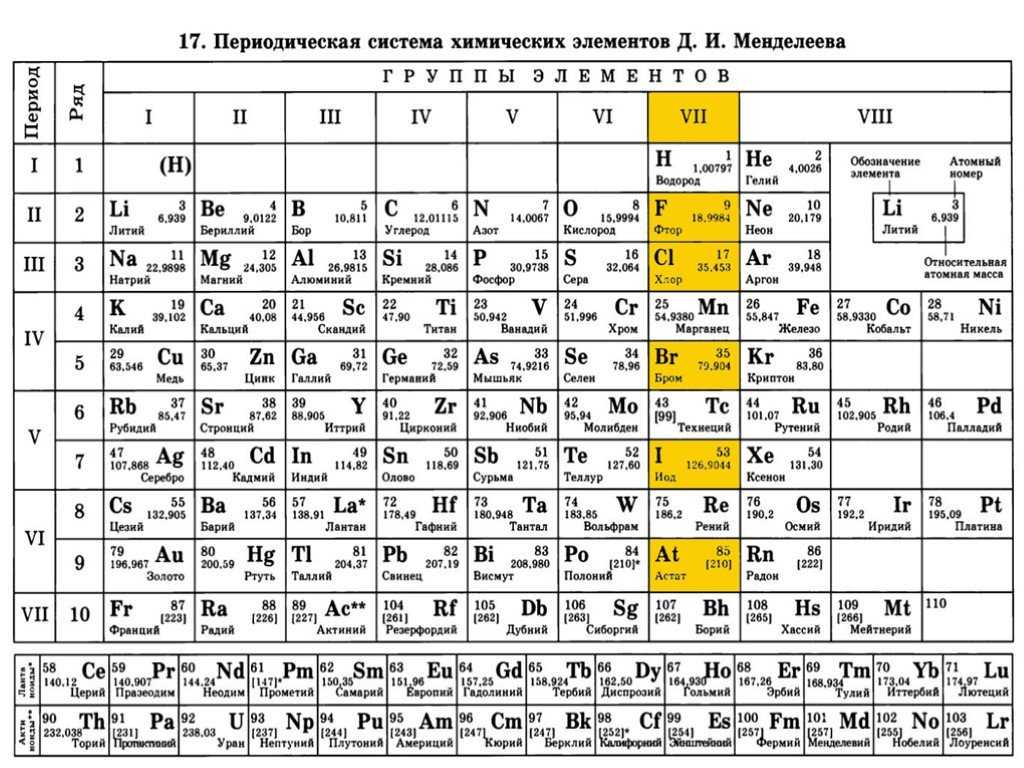 Сегодня известно более 3000 мест по всему миру, где ведется добыча меди. Самыми плодородными месторождениями обладают такие страны как Чили, Россия и США. На сегодняшний день, медными рудниками обладают более 50 стран по всему миру.
Сегодня известно более 3000 мест по всему миру, где ведется добыча меди. Самыми плодородными месторождениями обладают такие страны как Чили, Россия и США. На сегодняшний день, медными рудниками обладают более 50 стран по всему миру.
Так же стоит отметить, что медь по большей своей части добывается в составе минералов, так как в природном виде она встречается довольно редко. На сегодняшний день известно свыше 600 итнералов в составе которых присутствует медь. Самыми ценными из них являются халькопирит, халькозин, борнит, атакамит и малахит. В составе этих минералов процентное содержание меди превышает 60%.
Что же касается распространенности во вселенной, то тут не все так однозначно. Определить его распространенность не представляется возможным из-за малого количества информации. Известно только его присутствие на луне и на марсе по взятым образцам с этих космических тел. Предположительная оценка концентрации не считается маленькой.
Применение меди
Около 98% всей меди используется либо в своем естественном виде, либо в виде сплавов. Широкое применение она находит благодаря своим физическим и химическим свойствам. К основным его своиствам относится пластичность, теплопроводность, электропроводность и устойчивость к коррозии. Для некоторых видов применения медь является слишком мягким металлом, поэтому она находит применение в составе таких сплавов как латунь(сплав цинка и меди) или бронза(сплав олова и меди).
Широкое применение она находит благодаря своим физическим и химическим свойствам. К основным его своиствам относится пластичность, теплопроводность, электропроводность и устойчивость к коррозии. Для некоторых видов применения медь является слишком мягким металлом, поэтому она находит применение в составе таких сплавов как латунь(сплав цинка и меди) или бронза(сплав олова и меди).
Благодаря высокой электропроводности и устойчивости к коррозии она находит широкое применение в электронике. Из меди изготавливаются электрокабели, различные электрические провода, телефонные линии и микроволновые оболочки. Так же можно отметить сторительную отрасль. В этой отрасли изготавливаются медные плиты, а также листы для кровли. Кроме этого не стоит забывать про декоративную составляющую. В пример можно поставить фурнитуру для мебели и декоративные изделия ручного производства.
Если брать электронику, то медь является составным компонентом различного рода процессоров, аккумуляторов, печатных плат и др. Так же благодаря своей теплопроводности она используется в радиаторах охлаждения. В пример можно поставить радиаторы охлаждения видеокарт и процессоров.
Так же благодаря своей теплопроводности она используется в радиаторах охлаждения. В пример можно поставить радиаторы охлаждения видеокарт и процессоров.
Медь в прямом или косвенном смысле применяется почти во всех областях применения. Будь то пищевые добавки или компонент краски для стекла и керамики. Так же боеприпасы для оружия или краситель для фейрверков(синий цвет). Некоторые медицинские препараты для людей или удобрение для почвы и растений. Медь так же применяется как компонент пожаротушения класса D и для изготовления антимикробных защитных тканей.
Подведя итоги стоит отметить, что на сегодняшний день нет такой отрасли производства где прямого или косвенного участия не принимала бы медь.
Интересные факты
Так как применение меди очень широкое, соответственно и интересных фактов связанных с медью достаточно. Стоит начать с того, что цена на чистую медь на мировом рынке не такая уж и маленькая. В 2014 году 1 тонна меди на мировом рынке оценивалась в 7000 американских долларов. В связи с такой высокой ценой увеличилось количество краж медных предметов. Например в Германии железнодорожная кампания Deutsche Bahn AG понесла убытков на 14 миллионов евро из-за воровства медных заземляющих железнодорожных кабелей.
В связи с такой высокой ценой увеличилось количество краж медных предметов. Например в Германии железнодорожная кампания Deutsche Bahn AG понесла убытков на 14 миллионов евро из-за воровства медных заземляющих железнодорожных кабелей.
Еще одним интересным моментом является то, что первые изобретенные человеком зеркала изготавливались именно из меди. Медь натиралась(полировалась) до такой степени, пока не было видно отбражение на поверхности меди. Так же в области применения стоит отметить, что большая часть монет произведенных по всему миру содержит в своем составе медь. Еще одним интересным фактом является то, что медь как железо и алюминий могут подвергаться вторичной переработке без потери своих свойств.
Так же можно отметить и биологическую составляющую меди. В больших количествах она является токсичной, а в малых — неотъемлемая часть существования организма человека. В различных состояниях в человеческом организме содержится около 150 мг меди. Суточная доза потребления меди является нормальной для человека весом 75 кг равной 2 мг.
Презентация на тему «Медь» в рамках подготовки к ЕГЭ по химии
медь
I . Исторические сведения
II . Медь – химический элемент:
1) Положение меди в периодической системе
химических элементов Д.И.Менделеева
2) Строение атома.
3) Нахождение в природе
III. Медь – простое вещество
1. Состав. Строение. Свойства .
2 . Получение.
3. Химические свойства
4 . Применение
5. Биологическое значение меди.
IV. Соединения меди
VI . Качественная реакция на медь
I . Исторические сведения
Медь (англ. Copper, франц. Cuivre, нем. Kupfer) — один из первых металлов, которые человек стал применять для технических целей. В древности медь применялась в основном в виде сплава с оловом — бронзы для изготовления оружия. Периоды использования меди и бронзы ознаменовали целые эпохи культурного развития человечества под названием медный век и бронзовый век.
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III в. до н. э. существовали медные рудники и производилась выплавка меди.
Положение меди в ПСХЭ Д.И. Менделеева. Строение атома.
порядковый номер
группа
период
I B
Cu
4
4
29
+29
металл
4 s 1
2 s 2 2 p 6
1 s 2
3 s 2 3 p 6
3 d 1 0
1 8
1
8
2
валентные электроны
Cu 0 ─ 2e → Cu +2
Cu 0 ─ 1 e → Cu +1
Нахождение меди
в природе
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS 2 , также известный как медный колчедан, халькозин Cu 2 S и борнит Cu 5 FeS 4 . Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu 2 O , азурит Cu 3 (CO 3 ) 2 (OH) 2 , малахит Cu 2 CO 3 (OH) 2 . Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн .
Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн .
Медь занимает по распространению в природе 23-е место среди всех элементов: ее массовая доля в земной коре равна 0,01%.
Физические свойства
Медь тяжелый розово-красный металл, мягкий и ковкий, плавится при температуре 1084,5°С, очень хорошо проводит электрический ток и теплоту: электрическая проводимость меди в 1,7 раза выше, чем алюминия, в 6 раз выше, чем железа, и лишь немного уступает электрической проводимости серебра
Кристаллическая решётка меди .
Получение меди
Исходным сырьем для промышленного получения меди
являются сульфидные руды. Процесс получения меди из
сульфидных руд относят к пирометаллургическим
(протекающим при повышенной температуре)
Вначале сульфид меди (например, Cu 2 S) подвергают окислительному обжигу:
Cu 2 S + 20 2 = 2CuO + S0 2
К образовавшемуся оксиду, меди (II) добавляют новую порцию сульфида. При высокой температуре протекает реакция: 2CuO + Cu 2 S = 4Сu + S0 2
При высокой температуре протекает реакция: 2CuO + Cu 2 S = 4Сu + S0 2
Очищают медь от примесей электролитическим рафинированием.
Для этой цели в качестве анода используют медные листы , подлежащие
рафинированию, в качестве катода – пластинки чистой меди , электролита –
раствор сульфата меди ( II ). При прохождении электрического тока через
электролит медь анода растворяется, а на катоде выделяется чистая медь,
т.е. протекает электролиз с растворимым анодом.
Анод, нерафинированная
медь.
Содержащиеся в меди примеси остаются в растворе часть из них – анодный шлам – оседает на дне электролитической ванны.
Анодный шлам служит важным
источником благородных металлов
е
е
+
CuSO 4 = Cu 2+ + SO 4 2–
Cu 2+
Cu 2+ + 2e →Cu 0
На катоде :
Cu 0 − 2e → Cu 2+
На аноде :
Cu 2+
Катод,
рафинированная
медь.
примеси
Получение меди гидрометаллургическим способом.
Медную руду обрабатывают растворами серной кислоты или
или аммиака:
CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuO + 4NH 3 + H 2 O = [Cu(NH 3 ) 4 ](OH) 2
Медь, перешедшую в раствор, восстанавливают более активным металлом:
CuSO 4 + Fe = FeSO 4 + Cu
[Cu(NH 3 ) 4 ](OH) 2 + Zn = Cu + [Zn(NH 3 ) 4 ](OH) 2
Химические свойства
Cu
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn,Cr Fe Co,Sn,Pb, H 2, Hg,Ag,Au
О 2
+
+
Cu
неметаллы
H 2 SO 4 (конц.)
HNO 3
+
растворы солей
+
При комнатной температуре медь устойчива на воздухе.
При нагревании на воздухе металл покрывается черной
пленкой оксида меди ( II) . Составьте уравнение реакции.
2Cu + O 2 = 2CuO
При длительном хранении медные изделия покрываются
зеленым налетом .
2Cu + CO 2 + H 2 O + O 2 = (CuOH) 2 CO 3
Взаимодействие с неметаллами:
Медь вступает в реакции с галогенами, серой, селеном.
С водородом, углеродом, азотом медь не взаимодействует
даже при высокой температуре.
Составьте уравнение реакции меди с хлором, бромом, серой. Рассмотрите эти реакции как окислительно-восстановительные. Назовите окислитель и восстановитель.
Cu 0 + Br 2 0 = Cu +2 Br 2 –
Cu 0 ─ 2e → Cu +2 1
Br 2 0 + 2e → 2Br –1 1
Cu 0 ─ восстановитель, процесс окисления
Br 2 – окислитель, процесс восстановления
Взаимодействие хлора с медью
Даже малоактивные металлы энергично взаимодействуют с хлором. Пучок медной проволоки, нагретый в пламени горелки помещают в цилиндр, наполненный хлором. Медь раскаляется, взаимодействует с хлором, с кончика проволоки на дно цилиндра начинает капать расплавленный хлорид меди ( II ).
Cu 0 + Cl 2 0 = Cu +2 Cl 2 –
опыт
Cu 0 ─ 2e → Cu +2 1
Cl 2 0 + 2e → 2Cl –1 1
Cu 0 ─ восстановитель, процесс окисления
Cl 2 – окислитель, процесс восстановления
Взаимодействие серы с медью
Медь — неактивный металл. Но при повышенных температурах она активно взаимодействует с серой. Сера плавится и постепенно закипает. Пробирка наполняется бурыми парами серы. В парах серы медь загорается. Продукт взаимодействия – черный сульфид меди.
Но при повышенных температурах она активно взаимодействует с серой. Сера плавится и постепенно закипает. Пробирка наполняется бурыми парами серы. В парах серы медь загорается. Продукт взаимодействия – черный сульфид меди.
Cu + S = CuS
опыт
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь
расположена правее водорода. Кислоты не обладающие
окислительными свойствами, на нее не действуют, но медь
легко растворяется в кислотах-окислителях – концентрирован-
ной серной и азотной. Рассмотрите эти реакции как
окислительно-восстановительные. Назовите окислитель и
восстановитель.
0
+6
+2
+4
Cu + H 2 S O 4 → Cu SO 4 + S O 2 + H 2 O
опыт
Cu 0 ─ 2e → Cu +2 2
S +6 + 4e → S +4` 1
Cu + 2 H 2 SO 4 = CuSO 4 + SO 2 + 2 H 2 O
Cu 0 ─ восстановитель, процесс окисления
H 2 SO 4 (за счет S +6 ) – окислитель, процесс восстановления
0
+5
+2
Cu + HN O 3 → Cu (NO 3 ) 2 + N O 2 + H 2 O
+4
Cu 0 ─ 2e → Cu +2 1
N + 5 + 1e → N +4` 2
Cu + 4 HNO 3 = Cu(NO 3 ) 2 + 2 NO 2 + 2 H 2 O
Cu 0 ─ восстановитель, процесс окисление
HNO 3 – окислитель, процесс восстановление
опыт
+2
+2
0
+5
0
Cu + HN O 3 → Cu (NO 3 ) 2 + N O + H 2 O
Cu 0 ─ 2e → Cu +2 3
N + 5 + 3 e → N +4 2 2
3 Cu + 8 HNO 3 = 3 Cu(NO 3 ) 2 + 2 NO 2 + 4 H 2 O
Cu 0 ─ восстановитель, процесс окисление
HNO 3 – окислитель, процесс восстановление
Разбавленные серная и соляная кислоты на медь не
действуют. Однако в присутствии кислорода воздуха медь
Однако в присутствии кислорода воздуха медь
растворяется в этих кислотах с образованием солей меди (II):
2Cu + O 2 + 2H 2 SO 4 = 2CuSO 4 + 2H 2 O
2Cu + O 2 + 4HCl = 2CuCl 2 + 2H 2 O
Взаимодействие с растворами солей
+ 2
+2
0
0
Cu + Hg(NO 3 ) 2 → Cu(NO 3 ) 2 + Hg
опыт
Рассмотрите эту реакцию как окислительно-восстановительную и
расставьте коэффициенты.
Cu 0 ─ 2e → Cu +2 1
Hg +1 + 2e → Hg 0 1
Cu + Hg(NO 3 ) 2 = Cu(NO 3 ) 2 + Hg
Cu 0 ─ восстановитель, процесс окисления
Hg(NO 3 ) 2 (за счет Hg +2 ) – окислитель, пр . восстановления
Применение меди
в электротехнике
1
теплоотводные устройства
2
производство труб
3
сплавы на основе меди
4
ювелирные сплавы
5
в архитектуре
6
другие сферы применения
7
Из-за низкого удельного сопротивления медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов. Для этих целей металл должен быть очень чистый
Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов. Для этих целей металл должен быть очень чистый
1
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся радиаторы охлаждения, кондиционирования и отопления.
2
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов, во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
3
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых бронза и латунь, дюралюминий ( w ( Cu) = 4 ,4%)
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880°С .
4
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к этим механическим воздействиям.
Медь применяют для изготовления украшений
5
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди служат безаварийно по 100—150 лет.
6
Другие сферы применени я
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
7
Биологическая роль
Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития. В растениях и животных содержание меди варьируется от 10 -15 до 10 -3 %. Всего в организме человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных — участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов. Так как медь токсична, в животном организме она находится в связанном состоянии. Медь необходима для осуществления различных функций организма — дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди.
Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди.
Соединения меди
оксиды
гидроксиды
соли
Соединения меди ( I )
Оксид меди ( I) красного цвета, в
природе встречается в виде минерала
куприта.
Соединения меди ( I )
Cu 2 O
Составьте формулу оксида меди ( I).
В лаборатории его получают восстановлением свежеосажденного гидроксида меди ( II) альдегидами или глюкозой.
опыт
O O
Н – С + 2 Cu(OH) 2 → H – C + Cu 2 O ↓+ 2 H 2 O
H OH
t°
O O
CH 2 ОН – ( C НОН) 4 – С + 2 Cu(OH) 2 → CH 2 ОН – ( C НОН) 4 – С +
H OH
+ Cu 2 O + 2H 2 O
t°
опыт
Получают оксид меди(I) прокаливанием металлической
меди при недостатке кислорода
4Cu + O 2 = 2 Cu 2 O
Химические свойства Cu 2 O
При нагревании без доступа воздуха разлагается на металлическую медь и оксид меди (II):
Cu 2 O = CuO + Cu
Водородом, оксидом углерода (II), алюминием оксид меди ( II) восстанавливается до металлической меди:
Cu 2 O + H 2 = 2Cu + H 2 O
Cu 2 O + CO = 2Cu + CO 2
3 Cu 2 O + 2 Al = 6 Cu + Al 2 O 3
1) В разбавленной серной и соляной кислотах растворяется только в присутствии кислорода.
2Cu 2 O + 8HCl (разб.) + O 2 = 4CuCl 2 + 4H 2 O
2) В концентрированной серной кислоте растворяется с выделением диоксида серы SO 2 .
С u 2 O + H 2 SO 4 (конц.) → CuSO 4 + SO 2 + H 2 O
3) В концентрированной азотной кислоте растворяется с выделением диоксида азота N O 2
Cu 2 O + HNO 3 → Cu(NO 3 ) 2 + NO 2 + H 2 O
Рассмотрите реакции 2,3 как окислительно-восстановительные. Расставьте коэффициенты. Определите окислитель, восстановитель
С u +1 2 O + H 2 S +6 O 4( конц.) → Cu +2 SO 4 + S +4 O 2 + H 2 O
С u +1 – 1е → Cu +2 2
S +6 + 2е → S +4 1
С u 2 O + 3 H 2 SO 4 = 2 CuSO 4 + SO 2 + 3 H 2 O
С u 2 O (за счёт С u +1 ) — восстановитель, процесс окисления
H 2 SO 4 (за счёт S +6 ) – окислитель, процесс восстановления
Cu 2 +1 O + HN + 5 O 3( конц.) = Cu +2 (NO 3 ) 2 + N +4 O 2 + H 2 O
С u +1 – 1е → Cu +2 1
N + 5 + 1 е → N +4 1
Cu 2 O + 6HNO 3( конц. ) = 2Cu(NO 3 ) 2 + 2NO 2 + 3H 2 O
) = 2Cu(NO 3 ) 2 + 2NO 2 + 3H 2 O
С u 2 O (за счёт С u +1 ) — восстановитель, процесс окисления
HNO 3 (за счёт N +5 ) – окислитель, процесс восстановления
Устойчивыми соединениями меди ( I) являются
нерастворимые соединения ( CuCl, Cu 2 S ) или комплексные соединения [Cu(NH 3 ) 2 ]OH, [Cu(NH 3 ) 2 ]Cl,
которые получают растворением в концентрированном растворе аммиака оксида меди ( I), хлорида меди (I)
Cu 2 O + 4 (NH 3 · H 2 O) = 2[Cu(NH 3 ) 2 ]OH + 3Н 2 О
CuCl + 2NH 3 = [Cu(NH 3 ) 2 ]Cl
Аммиачные растворы солей меди взаимодействуют с
алкинами, например, с ацетиленом:
CH ≡ CH + 2[Cu(NH 3 ) 2 ]Cl → Cu–C≡C–Cu + 2NH 3 + 2NH 4 Cl
В окислительно-восстановительных реакциях соединения
меди ( I) проявляют окислительно-восстановительную
двойственность.
С u 2 O + H 2 → Cu + H 2 O
С u 2 O + H 2 SO 4 + KMnO 4 → CuSO 4 + MnSO 4 + K 2 SO 4 + H 2 O
С uCl + HNO 3 → Cu(NO 3 ) 2 + HCl + NO 2 + H 2 O
Рассмотрите реакции как окислительно-восстановительные.
Определите окислитель, восстановитель
С u 2 +1 O + H 2 0 → Cu 0 + H 2 +1 O
С u +1 + 1е → Cu 0 2
Н 2 0 – 2е → 2Н +1 1
С u 2 O + H 2 = 2 Cu + H 2 O
С u 2 O (за счет С u +1 ) – окислитель, процесс восстановления
Н 2 – восстановитель, процесс окисления
С u 2 +1 O + H 2 SO 4 + KMn +7 O 4 →Cu +2 SO 4 + Mn +2 SO 4 + K 2 SO 4 + H 2 O
2С u +1 – 2е → 2 Cu +2 5
Mn + 7 + 5 е → Mn + 2 2
5 С u 2 O + 13H 2 SO 4 + 2KMnO 4 = 10CuSO 4 + 2MnSO 4 + K 2 SO 4 +
+ 13H 2 O
С u 2 O (за счет С u +1 ) – восстановитель, процесс окисления
KMnO 4 ( за счет Mn + 7 ) – окислитель, процесс восстановления
С u +1 Cl + HN +5 O 3 → Cu +2 (NO 3 ) 2 + HCl + N +4 O 2 + H 2 O
С u +1 – 1е → Cu +2 5
N + 5 + 1 е → N + 4 1
С uCl + 3 HNO 3( конц.) = Cu(NO 3 ) 2 + HCl + NO 2 + H 2 O
С uCl (за счет С u +1 ) – восстановитель, процесс окисления
HNO 3 ( за счет N + 5 ) – окислитель, процесс восстановления
оксид меди ( II )
Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита
В природе встречается в виде минерала тенорита
(мелаконита) чёрного цвета.
CuO
Составьте формулу оксида меди ( II).
Получение оксида меди (II)
Оксид меди ( II ) получают как при взаимодействии меди с
кислородом, так и при разложении гидроксида меди ( II ),
нитрата меди ( II ) и малахита ( CuOH ) 2 CO 3 .
Составьте уравнения реакций получения оксида меди ( II)
t°
2Cu + O 2 = 2CuO
t°
Cu(OH) 2 = CuO + H 2 O
опыт
t°
2Cu(NO 3 ) 2 = 2CuO + 4NO 2 + O 2
t°
опыт
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O
Химические свойства CuO
Оксид меди ( II ) обладает слабыми амфотерными
свойствами, т.е. взаимодействуют как с кислотами так и
со щелочами.
Составьте уравнения реакции взаимодействия CuO
c соляной, серной кислотами.
CuO + 2HCl = CuCl 2 + H 2 O
CuO + 2H + + Cl – = Cu 2+ + 2Cl – + H 2 O
CuO + 2H + = Cu 2+ + H 2 O
опыт
CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuO + 2H + + SO 4 2– = Cu 2+ + SO 4 2– + H 2 O
CuO + 2H + = Cu 2+ + H 2 O
При сплавлении со щелочами CuO образует куприты:
CuO + 2KOH = K 2 CuO 2 + H 2 O
Взаимодействие уксусной кислоты с оксидом меди ( II)
Как и неорганические кислоты, уксусная кислота реагирует с оксидами металлов. При обычных условиях реакция идет очень медленно. При нагревании наблюдается растворение
При обычных условиях реакция идет очень медленно. При нагревании наблюдается растворение
Н оксида меди ( II ) и появление голубой окраски раствора. В пробирке образовался ацетат меди ( II ).
2 СН 3 СООН + CuO → (CH 3 COO) 2 Cu + H 2 O
опыт
Оксид меди ( II ) при нагревании взаимодействует с аминоуксусной кислотой. Раствор приобретает голубую окраску. Альфа-аминокислоты дают с медью окрашенные, очень устойчивые комплексные соли. Эти комплексные соединения очень прочны и не разрушаются под действием раствора щелочи.
опыт
Такие восстановители, как водород, аммиак, оксид
углерода (II), кокс, алюминий и другие восстанавливают
CuO до свободной меди.
Составьте уравнения реакций.
опыт
CuO + H 2 = Cu + H 2 O
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O
CuO + C О = Cu + CO 2
CuO + C ( кокс) = Cu + CO
3CuO + 2Al = 3Cu + Al 2 O 3
CuO обладает слабыми амфотерными свойствами.
При сплавлении со щелочами оксид меди ( II ) образует
купраты.
CuO + 2 KOH = K 2 CuO 2 + H 2 O
Оксид меди ( II ) растворяется в водном растворе аммиака
CuO + 4(NH 3 · H 2 O) = [Cu(NH 3 ) 4 ](OH) 2 + 3H 2 O
Оксид меди ( II )
восстанавливается
спиртами, превращая их в
альдегиды
O
CuO + C 2 H 5 OH → CH 3 ─ C + Cu + H 2 O
H
опыт
Гидрооксид меди ( II )
Гидроксид меди(II) — голубое аморфное или кристаллическое вещество.
Составьте формулу гидроксида меди ( II).
Cu(OH) 2
Получение гидроксида
меди (II)
Лабораторный опыт.
К раствору сульфата меди ( II ) добавляйте по каплям раствор гидроксида натрия. Образующийся в начале голубой осадок
основной соли в избытке щелочи переходит в синий гидроксид меди ( II ).
Составьте уравнения реакций получения гидроксида
меди( II ), используя сульфат меди ( II ), хлорид меди ( II ) и гидроксид натрия. Рассмотрите реакции с т.зр. ТЭД.
Рассмотрите реакции с т.зр. ТЭД.
опыт
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4
Cu 2+ + SO 4 2– + 2Na + + 2OH – = Cu(OH) 2 ↓ + 2Na + + SO 4 2–
Cu 2+ + 2OH – = Cu(OH) 2 ↓
CuCl 2 + 2NaOH = Cu(OH) 2 + 2NaCl
Cu 2+ + 2Cl – + 2Na + + 2OH – = Cu(OH) 2 ↓ + 2Na + + 2Cl –
Cu 2+ + 2OH – = Cu(OH) 2 ↓
Химические свойства Cu ( O H) 2
Перечислите свойства нерастворимых оснований.
Составьте уравнения реакций гидроксида меди ( II ) с
растворами кислот (соляной и серной). Рассмотрите
реакции с точки зрения теории электролитической
диссоциации.
Cu(OH) 2 + Н 2 SO 4 = CuSO 4 + 2 H 2 O
опыт
Cu(OH) 2 + 2 Н + + SO 4 2– = Cu 2+ + SO 4 2– + 2 H 2 O
Cu(OH) 2 + 2 Н + = Cu 2+ + 2 H 2 O
Cu(OH) 2 + 2HCl = CuCl 2 + 2 H 2 O
Cu(OH) 2 + 2 Н + + 2Cl – = Cu 2+ + 2Cl – + 2 H 2 O
Cu(OH) 2 + 2 Н + = Cu 2+ + 2 H 2 O
Лабораторный опыт.![]()
Нагрейте пробирку с гидроксидом меди ( II ).
Чем вызвано изменение окраски?
Составьте уравнение реакции.
нагревание
голубая суспезия
Cu(OH) 2
черный осадок
CuO
опыт
t°
С u(OH) 2 CuO + H 2 O
Гидроксид меди ( II ) очень легко растворяется в избытке аммиака с образованием аммиаката меди. Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов меди(II) в растворе.
Cu(OH) 2 + 4NH 4 OH = [Cu(NH 3 ) 4 ](OH) 2 + 4H 2 O
или
Cu(OH) 2 + 4NH 3 = [Cu(NH 3 ) 4 ](OH) 2
Гидроксид меди ( II ) при нагревании окисляет альдегиды до карбоновых кислот. При этом интенсивная окраска реактива исчезает и образуется кирпично-красный осадок оксида меди ( I ).
опыт
t°
Н-СОН + 2 Cu ( OH ) 2 HCOOH + Cu 2 О + 2 H 2 O
При добавлении к глицерину , осадок гидроксида меди (II) растворяется и образуется темно-синий раствор глицерата меди (II). При добавлении гидроксида меди (II) к раствору этиленгликоля также образуется темно-синий раствор. Реакция с гидроксидом меди (II) является качественной реакцией на многоатомные спирты.
При добавлении гидроксида меди (II) к раствору этиленгликоля также образуется темно-синий раствор. Реакция с гидроксидом меди (II) является качественной реакцией на многоатомные спирты.
опыт
H
СН 2 – ОН СН 2 – О O– СН 2
Cu
2 СН – ОН + Cu(OH) 2 СН 2 – О O– СН 2
– 2H 2 O H
СН 2 – ОН СН 2 –О H СН 2 – OH
Соли
Сульфат меди(II) (CuSO 4 ) — белые кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO 4 · 5H 2 O — медный купорос. Благодаря этому свойству сульфат меди(II) иногда используется в качестве индикатора влажности помещения
опыт
Малахит (основной карбонат меди) – Cu 2 (OH) 2 CO 3
При нагревании до 200°С разлагается с выделением
углекислого газа и воды, превращаясь в черный оксид
меди ( II )
t°
Cu 2 (OH) 2 CO 3 2CuO + H 2 O + CO 2
опыт
Для малахита характерна растворимость в кислотах с выделением углекислого газа, а также в аммиаке, который окрашивается при этом в голубой цвет.
(CuOH) 2 CO 3 + 4 HCl = 2CuCl 2 + CO 2 + 3 H 2 O
(CuOH) 2 CO 3 + 8(NH 3 ·H 2 O) = [Cu(NH 3 ) 4 ]CO 3 + +[Cu(NH 3 ) 4 ](OH) 2 + 8H 2 O
С глубокой древности известен способ получения из малахита свободной меди. В условиях неполного сгорания угля, при котором образуется угарный газ, происходит реакция:
2CO+(CuOH) 2 CO 3 =3CO 2 +2Cu+ H 2 O
Медь можно обнаружить по зелёно-голубой окраске пламени .
Медь химический элемент интересные факты
Интересные факты о меди.
Интересный факт №1
Латинское название меди Cuprum произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
Интересный факт №2
Медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %
Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %
Интересный факт №3
Медь встречается в природе как в соединениях, так и в самородном виде. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо.
Интересный факт №4
Медь является природным антибактериальным средством, и «тормозит» распространение бактерий в воде и воздухе из систем, изготовленных из нее. Таким же образом, латунные дверные ручки и поручни в общественных зданиях могут помочь свести к минимуму риск бактериальной передачи.
Интересный факт №5
Полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Интересный факт №6
В разнообразных областях техники широко используются сплавы с использованием меди, самыми распространёнными являются бронза и латунь
Интересный факт №7
Медь является одним из важнейших участников метаболических процессов в организме человека и входит практически во все органы и ткани, поэтому она привлекает внимание биомедицины. Группой известных лабораторий Ирландии и Франции был разработан состав, который при соприкосновении с кожей активизирует жизненно важные процессы в организме человека. Этим составом обрабатываются нити джинсов Gold Vision – 3000 Classic. Модель была создана знаменитыми французскими кутюрье. Уникальность этих джинсов состоит в «медном поясе», «усиленных» медью карманах и гульфике, а также в использовании медных клепок и пуговиц. Таким образом формируется «медный корсет», который создает условия для улучшения физиологических функций организма.
Группой известных лабораторий Ирландии и Франции был разработан состав, который при соприкосновении с кожей активизирует жизненно важные процессы в организме человека. Этим составом обрабатываются нити джинсов Gold Vision – 3000 Classic. Модель была создана знаменитыми французскими кутюрье. Уникальность этих джинсов состоит в «медном поясе», «усиленных» медью карманах и гульфике, а также в использовании медных клепок и пуговиц. Таким образом формируется «медный корсет», который создает условия для улучшения физиологических функций организма.
Интересный факт №8
Инструменты изготовленые из меди или медных сплавов не вызывают искру, и, таким образом, используются везде, где есть опасность взрыва.
Интересный факт №9
Медное покрытие применяется для изготовления скальпеля хирурга и проводит электричество для нагрева лезвия, делая, таким образом, прибор самостоятельного прижигания.
Интересный факт №10
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Интересный факт №11
Многие народы приписывают меди целебные свойства. Непальцы, например, считают медь священным металлом, который способствует сосредоточению мыслей, улучшает пищеварение и лечит желудочно-кишечные заболевания (больным дают пить воду из стакана, в котором лежат несколько медных монет). Один из самых больших и красивых непальских храмов носит название «Медный».
Интересный факт №12
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Интересный факт №13
В организме взрослого человека содержится до 80 мг меди.
Интересный факт №14
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Интересный факт №1
Латинское название меди Cuprum произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
э. существовали медные рудники и производилась выплавка меди.
Интересный факт №2
Медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %
Интересный факт №3
Медь встречается в природе как в соединениях, так и в самородном виде. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо.
Интересный факт №4
Медь является природным антибактериальным средством, и «тормозит» распространение бактерий в воде и воздухе из систем, изготовленных из нее. Таким же образом, латунные дверные ручки и поручни в общественных зданиях могут помочь свести к минимуму риск бактериальной передачи.
Интересный факт №5
Полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Интересный факт №6
В разнообразных областях техники широко используются сплавы с использованием меди, самыми распространёнными являются бронза и латунь
Интересный факт №7
Медь является одним из важнейших участников метаболических процессов в организме человека и входит практически во все органы и ткани, поэтому она привлекает внимание биомедицины. Группой известных лабораторий Ирландии и Франции был разработан состав, который при соприкосновении с кожей активизирует жизненно важные процессы в организме человека. Этим составом обрабатываются нити джинсов Gold Vision – 3000 Classic. Модель была создана знаменитыми французскими кутюрье. Уникальность этих джинсов состоит в «медном поясе», «усиленных» медью карманах и гульфике, а также в использовании медных клепок и пуговиц. Таким образом формируется «медный корсет», который создает условия для улучшения физиологических функций организма.
Таким образом формируется «медный корсет», который создает условия для улучшения физиологических функций организма.
Интересный факт №8
Инструменты изготовленые из меди или медных сплавов не вызывают искру, и, таким образом, используются везде, где есть опасность взрыва.
Интересный факт №9
Медное покрытие применяется для изготовления скальпеля хирурга и проводит электричество для нагрева лезвия, делая, таким образом, прибор самостоятельного прижигания.
Интересный факт №10
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Интересный факт №11
Многие народы приписывают меди целебные свойства. Непальцы, например, считают медь священным металлом, который способствует сосредоточению мыслей, улучшает пищеварение и лечит желудочно-кишечные заболевания (больным дают пить воду из стакана, в котором лежат несколько медных монет). Один из самых больших и красивых непальских храмов носит название «Медный».
Один из самых больших и красивых непальских храмов носит название «Медный».
Интересный факт №12
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Интересный факт №13
В организме взрослого человека содержится до 80 мг меди.
Такой металл, как медь, и раньше имел огромное значение для человечества. Недаром целая эпоха получила название Медного века — тогда из этого металла делали оружие, доспехи, орудия труда, украшения, посуду и многое другое. Но и сейчас важность меди невозможно переоценить, так как она используется в самых разных областях промышленности, от космической отрасли и машиностроения до производства любой электроники и множества красок.
Факты про медь
- Около 80% всех медных изделий перерабатываются и используются повторно, так как этот металл слишком дорог, чтобы попросту его выбрасывать после использования.

- На острове Кипр люди добывали и обрабатывали медь ещё более 4000 лет назад.
- Среди всех металлов в мире медь занимает третье в мире место как по уровню производства, так и по уровню потребления, уступая в этих номинациях лишь алюминию и железу (интересные факты об алюминии).
- Самая чистая медь идёт на производство проводов и электрических кабелей. Очистка в этом случае требуется действительно максимально глубокая, так как любые примеси резко снижают электропроводимость.
- На медных месторождениях этот металл довольно часто попадается в виде чистых самородков, хотя иногда встречается и со сторонними примесями.
- Медь является природным антибактериальным средством, и «тормозит» распространение бактерий в воде и воздухе из систем, изготовленных из нее. Таким же образом латунные дверные ручки и поручни в общественных зданиях могут помочь свести к минимуму риск бактериальной передачи, так как медь входит в состав латунного сплава.
- Среди всех металлов по уровню электропроводимости медь уступает лишь серебру.
 Но серебро стоит слишком дорого для того, чтобы использовать его для производства большинства видов проводов и прочей электроники (интересные факты о серебре).
Но серебро стоит слишком дорого для того, чтобы использовать его для производства большинства видов проводов и прочей электроники (интересные факты о серебре). - Благодаря высокой теплопроводности медь стала незаменимой частью множества охладительных систем.
- Так как медь обладает высокой стойкостью к коррозии, обычно именно из неё изготавливают капсулы для захоронения токсичных отходов.
- Археологи обнаружили медные трубы в руинах на территории Египта, которым было около 5000 лет. За минувшие тысячелетия эти труды, изготовленные древними египтянами, даже не утратили работоспособности.

 В частности, особенным почётом этот металл пользуется в Непале.
В частности, особенным почётом этот металл пользуется в Непале.Медь является первым элементом группы IB периодической таблицы и имеет четыре степени окисления: Cu(O): Заполните и подпишите онлайн
Медь является первым элементом группы IB периодической таблицы и имеет четыре степени окисления: Cu (O): Заполнить и подписать онлайн | докхаб
- Дом
- Медь является первым элементом группы IB периодической таблицы и имеет четыре степени окисления: Cu(O),
Получить форму
4. 2 из 5
2 из 5
36 голосов
DocHub Отзывы
44 отзыва
DocHub Отзывы
23 оценки
15 005
10 000 000+
303
100 000+ пользователей
Вот как это работает
01. Редактируйте свою форму онлайн
Введите текст, добавьте изображения, затемните конфиденциальные данные, добавьте комментарии, выделение и многое другое.
02. Подпишите в несколько кликов
Нарисуйте свою подпись, введите ее, загрузите изображение или используйте мобильное устройство в качестве панели для подписи.
03. Поделитесь своей формой с другими
Отправьте ее по электронной почте, по ссылке или по факсу. Вы также можете скачать его, экспортировать или распечатать.
Как редактировать Медь является первым элементом группы IB периодической таблицы и отображает четыре степени окисления: Cu(O), с DocHub
9,5
Простота установки
Рейтинги пользователей DocHub на G2
9,0
Простота использования
Рейтинги пользователей DocHub на G2
Самый простой способ редактирования Медь является первым элементом группы IB периодической таблицы и отображает четыре степени окисления: Cu(O) в формате PDF онлайн
Работать с документами в нашем универсальном и удобном PDF-редакторе очень просто. Выполните следующие шаги, чтобы завершить Медь является первым элементом группы IB периодической таблицы и отображает четыре степени окисления: Cu(O), онлайн быстро и легко:
Выполните следующие шаги, чтобы завершить Медь является первым элементом группы IB периодической таблицы и отображает четыре степени окисления: Cu(O), онлайн быстро и легко:
- Войдите в свою учетную запись . Зарегистрируйтесь, указав свой адрес электронной почты и пароль, или зарегистрируйте бесплатную учетную запись, чтобы попробовать услугу, прежде чем выбрать подписку.
- Импорт документа . Перетащите файл со своего устройства или добавьте его из других служб, таких как Google Диск, OneDrive, Dropbox или по внешней ссылке.
- Редактировать Медь является первым элементом группы IB периодической таблицы и имеет четыре степени окисления: Cu(O), . С легкостью добавляйте и выделяйте текст, вставляйте изображения, галочки и знаки, добавляйте новые заполняемые области, а также меняйте порядок страниц или удаляйте их из документа.
- Получить Медь является первым элементом группы IB периодической таблицы и имеет четыре степени окисления: Cu(O), полное .
 Загрузите измененный документ, экспортируйте его в облако, распечатайте из редактора или поделитесь им с другими участниками с помощью общей ссылки или в виде вложения электронной почты.
Загрузите измененный документ, экспортируйте его в облако, распечатайте из редактора или поделитесь им с другими участниками с помощью общей ссылки или в виде вложения электронной почты.
Воспользуйтесь преимуществами DocHub, самого простого редактора для быстрого управления документами в Интернете!
будьте готовы получить больше
Заполните эту форму менее чем за 5 минут
Получить форму
Есть вопросы?
У нас есть ответы на самые популярные вопросы наших клиентов. Если вы не можете найти ответ на свой вопрос, пожалуйста, свяжитесь с нами.
Свяжитесь с нами
Медь относится к группе А или В?
Металлы группы IB (медь, серебро и золото) иногда называют металлами для чеканки монет.
Какой элемент входит в группу 4 периода?
Элементами группы 4 являются титан (Ti), цирконий (Zr), гафний (Hf) и резерфордий (Rf).
Как называются металлы группы В?
Элементы группы B называются переходными металлами.
Что такое металлы группы А?
Группа 1A (или IA) периодической таблицы — это щелочные металлы: водород (H), литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций ( фр.). Это (кроме водорода) мягкие, блестящие, легкоплавкие, высокореакционноспособные металлы, тускнеющие на воздухе.
К какой группе и периоду относится медь?
Поле фактов Группа111084,62°C, 1984,32°F, 1357,77 KПериод42560°C, 4640°F, 2833 КБlockd8.96Атомный номер2963.546Состояние при 20°CSolid63Cu2 больше строк
Похожие запросы
группа 12 период 4 элемент
атомный номер меди
химическая формула меди
массовое число меди
электронная конфигурация меди
символ медного элемента
группа 1 период 7 элемент
группа 12 период 4 элемент
атомный номер меди
химическая формула меди
массовое число меди
электронная конфигурация меди
символ медного элемента
группа 1 период 7 элемент
Связанные формы
будьте готовы получить больше
Заполните эту форму за 5 минут или меньше
Получить форму
Люди также спрашивают
Какой элемент входит в группу 11 периода 4?
Медь (Cu) является элементом группы 11.
Какой элемент находится в группе и периоде 4?
Общим элементом группы 4 и периода 4 является титан.
Где находится медь в периодической таблице?
Элемент меди имеет символ Cu и атомный номер 29. Медь является переходным металлом в верхней части группы 11 в периодической таблице, наряду с серебром и золотом.
Что такое 11 группа в периодической таблице?
Группа 11 по современной нумерации IUPAC — это группа химических элементов периодической таблицы, состоящая из меди, серебра и золота. Рентгений также помещен в эту группу в периодической таблице, хотя еще не проводилось никаких химических экспериментов, подтверждающих, что он ведет себя как более тяжелый гомолог золота.
Рентгений также помещен в эту группу в периодической таблице, хотя еще не проводилось никаких химических экспериментов, подтверждающих, что он ведет себя как более тяжелый гомолог золота.
Медь относится к металлу 1 группы?
медь (Cu), химический элемент, красноватый, чрезвычайно пластичный металл группы 11 (Ib) периодической таблицы, который является необычайно хорошим проводником электричества и тепла. Медь встречается в природе в свободном металлическом состоянии. Эта самородная медь была впервые использована (ок. 9 г. до н. э.).0009
Ссылки по теме
Активные сайты меди в биологии — PMC — NCBI
by EI Solomon · 2014 · Цитируется по 1253 — Сайты меди, которые выполняют ET, представляют собой мононуклеарный синий сайт Cu, который имеет высококовалентную CuII-S(Cys ) связь и биядерный сайт CuA, который имеет . ..
..
Узнать больше
Переходные металлы — части периодической таблицы
Переходные металлы периода 4 — скандий (Sc), титан (Ti), ванадий ( V), хром (Cr), марганец (Mn), железо (Fe), кобальт (Co), никель (Ni), медь (Cu), …
Узнать больше
Шаблон:Список степеней окисления элементов — Википедия
Попробуйте другие инструменты PDF
© 2022 ООО «ДокХаб»
Медный металл | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Название продукта: Медный металл
Номер продукта: Все применимые коды продуктов American Elements, например. КР-М-02
, КР-М-03
, КР-М-04
, КР-М-05
, CU-M-06
Номер CAS: 7440-50-8
Соответствующие установленные области применения вещества: Научные исследования и разработки
Сведения о поставщике:
American Elements
6 Анхелес, Калифорния
Тел. : +1 310-208-0551
: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси
Классификация согласно Регламенту (ЕС) № 1272/2008
Вещество не классифицируется как опасное для здоровья или окружающей среды в соответствии с регламентом CLP.
Классификация в соответствии с Директивой 67/548/ЕЭС или Директивой 1999/45/ЕС
Н/Д
Информация об особых опасностях для человека и окружающей среды:
Данные отсутствуют
Опасности, не классифицированные иначе
Данные отсутствуют
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Н/Д
Пиктограммы опасности
Н/Д
Сигнальное слово
Н/Д
Краткая характеристика опасности
Н/Д
Классификация WHMIS
Не контролируется
Система классификации
Оценки HMIS (шкала 0–4)
(Система идентификации опасных материалов)
Здоровье (острое воздействие) = 0
Воспламеняемость = 0
Физическая опасность = 0
Другие опасности
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
Вещества
Номер CAS / Название вещества:
7440-50-8 Медь
Идентификационный номер(а):
Номер ЕС: 231-159-6
РАЗДЕЛ 4.
 МЕРЫ ПЕРВОЙ ПОМОЩИ
МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
Общая информация
Никаких специальных мер не требуется.
При вдыхании:
В случае жалоб обратиться за медицинской помощью.
При попадании на кожу:
Обычно продукт не раздражает кожу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Если симптомы сохраняются, обратитесь к врачу.
При проглатывании:
Если симптомы сохраняются, обратитесь к врачу.
Информация для врача
Наиболее важные симптомы и эффекты, как немедленные, так и замедленные
Нет доступных данных
Указание на необходимость немедленной медицинской помощи и специального лечения
Данные отсутствуют
РАЗДЕЛ 5. ПРОТИВОПОЖАРНЫЕ МЕРЫ
Средства пожаротушения
Подходящие средства тушения
Специальный порошок для пожаров металлов. Не используйте воду.
Неподходящие средства пожаротушения из соображений безопасности
Вода
Особые опасности, исходящие от вещества или смеси
Если этот продукт участвует в пожаре, могут выделяться следующие вещества:
Оксиды меди
Рекомендации для пожарных
Защитное снаряжение:
Никаких специальных мер не требуется.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Индивидуальные меры предосторожности, защитное снаряжение и чрезвычайные меры
Не требуется.
Меры предосторожности по охране окружающей среды:
Не допускать попадания материала в окружающую среду без официального разрешения.
Не допускайте попадания продукта в канализацию, канализационные системы или другие водотоки.
Не допускайте проникновения материала в землю или почву.
Методы и материалы для локализации и очистки:
Собрать механически.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для получения информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Информация о защите от взрывов и пожаров:
Никаких специальных мер не требуется.
Условия для безопасного хранения, включая любые несовместимости
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Информация о хранении на одном общем складе:
Нет данных
Дополнительная информация об условиях хранения:
Хранить контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Специфическое конечное использование
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем:
Дополнительные данные отсутствуют; см. раздел 7.
Параметры контроля
Компоненты с предельными значениями, требующими контроля на рабочем месте: 7440-50-8 Медь (100,0%)
PEL (США) Длительное значение: 1* 0,1** мг/м 3 в виде Cu *пыль и туман **дым
REL (США) Длительное значение: 1* 0,1** мг/м 3 as Cu *пыль и туман **дым
ПДК (США) Длительное значение: 1* 0,2** мг/м 3 *пыль и туман; **дым; как Cu
EL (Канада) Длительное значение: 1* 0,2** мг/м 3 *пыль и туман; **дым
EV (Канада) Длительное значение: 0,2* 1** мг/м 3 в виде меди, *дым;**пыль и туман
Дополнительная информация: нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Следуйте типичные защитные и гигиенические методы обращения с химическими веществами.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование: Не требуется.
Защита рук: Не требуется.
Время проникновения через материал перчаток (в минутах)
Данные отсутствуют
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Внешний вид:
Форма: Твердое вещество в различных формах
Цвет: Медного цвета
Запах: Без запаха
Порог запаха: Нет данных.
pH: неприменимо
Точка плавления/диапазон плавления: 1083 °C (1981 °F)
Точка/диапазон кипения: 2562 °C (4644 °F) газ): нет данных.
Температура воспламенения: Данные отсутствуют
Температура разложения: Данные отсутствуют
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление паров при 20 °C (68 °F): 0 гПа
Плотность при 20 °C (68 °F): 8,94 г/см 3 (74,604 фунта/галлон)
Относительная плотность: Данные отсутствуют.
Плотность паров: N/A
Скорость испарения: N/A
Растворимость в воде (H 2 O): Нерастворим
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация
Нет данных
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Нет данных
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения
Термическое разложение / условия, которых следует избегать:
Разложение не происходит при использовании и хранении в соответствии со спецификациями.
Возможность опасных реакций
Опасные реакции не известны
Условия, которых следует избегать
Нет данных
Несовместимые материалы:
Нет данных
Опасные продукты разложения:
Оксиды меди
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Реестр токсического воздействия химических веществ (RTECS) содержит данные об острой токсичности для этого вещества.
Значения LD/LC50, соответствующие классификации:
Пероральная LD50 >5000 мг/кг (мышь)
Раздражение или коррозия кожи: Нет раздражающего действия.
Раздражение или коррозия глаз: Не оказывает раздражающего действия.
Сенсибилизация: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток: Эффекты неизвестны.
Канцерогенность:
EPA-D: Канцерогенность для человека не классифицируется: недостаточно доказательств канцерогенности для человека и животных или данные отсутствуют.
Реестр токсических эффектов химических веществ (RTECS) содержит данные об онкогенности, и/или канцерогенности, и/или новообразованиях для этого вещества.
Репродуктивная токсичность:
Реестр токсического воздействия химических веществ (RTECS) содержит репродуктивные данные для этого вещества.
Специфическая токсичность для системы органов-мишеней — многократное воздействие: Эффекты неизвестны.
Специфическая системная токсичность на орган-мишень — однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности: Эффекты неизвестны.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
Канцерогенные категории
OSHA-Ca (Управление по безопасности и гигиене труда)
Вещество не указано.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Акватоксичность:
Нет данных
Стойкость и способность к разложению
Нет данных
Способность к биоаккумуляции
Нет данных
Мобильность в почве
Нет данных
Дополнительная экологическая информация:
Не допускать попадания материала в окружающую среду без официальных разрешений.
Не допускайте попадания неразбавленного продукта или больших количеств в грунтовые воды, водотоки или канализационные системы.
Избегайте попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
Другие неблагоприятные воздействия
Данные отсутствуют
РАЗДЕЛ 13.
 РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Для обеспечения надлежащей утилизации обратитесь к официальным правилам .
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, ADN, IMDG, IATA
N/A
Надлежащее отгрузочное наименование ООН
DOT, ADN, IMDG, IATA
N/A
Класс(ы) опасности при транспортировке
DOT, ADR, ADN, IMDG, IATA
Класс
N/A
Группа упаковки
DOT, IMDG, IATA
N/A
Опасности для окружающей среды:
Загрязнитель морской среды (IMDG):
Да (PP)
Да (P)
Особые меры предосторожности для пользователя
N/A
Код IBC
N/A
Транспорт/Дополнительная информация:
DOT
Загрязнитель морской среды (DOT):
№
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Правила/законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к данному веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ Агентства по охране окружающей среды США. .
.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
SARA Раздел 313 (списки конкретных токсичных химических веществ)
7440-50-8 Медь
Предложение штата Калифорния 65
Предложение 65 — Химические вещества, вызывающие рак
Вещество не указано.
Prop 65 — Токсичность для развития
Вещество не указано.
Предложение 65 — Токсичность для развития у женщин
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Прочие нормы, ограничения и запретительные нормы
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
REACH — Предварительно зарегистрированные вещества
Вещество указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
1 H | 1 D | © Jumk.de Веб-проекты | Выходные данные и конфиденциальность Зоопарк частиц | Химические калькуляторы | Моделирование атомного коллайдера | 2 He | ||||||||||||||
3 Ли | 4 Be | 5 Б | 6 С | 7 N | 8 О | 9 Ф | 10 Ne | ||||||||||
11 Нет | 12 мг | 13 Ал | 14 Si | 15 Р | 16 С | 17 Класс | 18 Ar | ||||||||||
19 К | 20 Ca | 21 Sc | 22 Ti | 23 В | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 Как | 34 Se | 35 Бр | 36 Кр |
37 руб. | 38 Старший | 39 Д | 40 Zr | 41 Nb | 42 Пн | 43 Тс | 44 Ру | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 В | 50 Sn | 51 Сб | 52 Те | 53 I | 54 Xe |
55 Cs | 56 Ба | 57-71 Ла-Лу | 72 Hf | 73 Та | 74 Вт | 75 Re | 76 ОС | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Тл | 82 Pb | 83 Би | 84 По | 85 В | 86 Рн |
87 Пт | 88 Ра | 89-103 Ac-Lr | 104 Rf | 105 Дб | 106 Сг | 107 Бх | 108 Гс | 109 Мт | 110 Дс | 111 № | 112 Cn | 113 Nh | 114 Фл | 115 Мк | 116 | 117 Ц | 118 Ог |
| Главная | Случайный Все, Все2, Мозаика Игра на концентрацию Знание Свойства элемента Записи, архивы | 57 Ла | 58 Се | 59 Pr | 60 Nd | 61 Пм | 62 См | 63 ЕС | 64 Гд | 65 Тб | 66 Dy | 67 Хо | 68 Er | 69 Тм | 70 Yb | 71 Лу | ||
89 Ac | 90 Чт | 91 Па | 92 У | 93 Np | 94 Пу | 95 Ам | 96 См | 97 Бк | 98 См. | 99 Es | 100 Fm | 101 Md | 102 № | 103 Лр | |||
Объявление | |||||||||||||||||
← 29 → ↓ Переходный металл, масса: 63,546 ед., 2 стабильных изотопа (63, 65), ранг распространенности (земля/космос): 25/25 Щелкните изображение, чтобы увеличить. Самородок натуральной меди, 44 грамма. Исходный размер в см: 1 x 2,5 x 3,5 Медь — распространенный и достаточно инертный металл золотисто-красного цвета, который можно использовать для самых разных целей. Он известен с древних времен и был первым металлом, использованным человеком. Вместе с оловом это основной ингредиент бронзы. В сплаве с цинком образует латунь. Медь имеет очень высокую электропроводность, поэтому она используется для большинства электрических линий (медная проволока). Иногда можно найти такие медные самородки, но большую часть меди добывают из руды. Слева: медная руда из музея Санта-Клара-а-Нова, Альмодовар, Португалия. Патина на медной кровле, смесь в основном карбонара, сульфата, хлорида и гидроксида меди. Реклама Последнее изменение страницы 24 апреля. | |||||||||||||||||


 Но серебро стоит слишком дорого для того, чтобы использовать его для производства большинства видов проводов и прочей электроники (интересные факты о серебре).
Но серебро стоит слишком дорого для того, чтобы использовать его для производства большинства видов проводов и прочей электроники (интересные факты о серебре). Загрузите измененный документ, экспортируйте его в облако, распечатайте из редактора или поделитесь им с другими участниками с помощью общей ссылки или в виде вложения электронной почты.
Загрузите измененный документ, экспортируйте его в облако, распечатайте из редактора или поделитесь им с другими участниками с помощью общей ссылки или в виде вложения электронной почты. ..
.. ..
..