Химические и физические свойства меди: Ошибка 403 — доступ запрещён
Содержание
Химические свойства меди, температура плавления, плотность, цвет, молярная масса, валентность, удельный вес, формула меди и ее сплавов, степень окисления, физические свойства
Химические свойства меди определяются положением ее в периодической системе Д. И. Менделеева. Обозначение данного металла Cu (купрум, cuprum), он имеет 29-й порядковый номер, находится в первой группе (побочной подгруппе), в 4 большом периоде.
Выделяется отдельный ее вид: черновая медь, которая является при конвертировании продукта кислородом. Атомная (молярная) масса равна 63,5 г/моль, молекулярная масса — 63,5 а. е. м.
В зависимости от соединения, в котором металл находится, он может иметь валентность +1 и +2, но в редких случаях степень окисления может быть +3 и +5, что является исключением. Строение атома Cu и электронная формула показаны на рисунке:
Кристаллическая решетка меди представляет собой каркас в форме куба, который образован прямыми линиями. Решетка довольно прочная, молекулярная, так как в узлах находятся молекулы.
Содержание
Физические свойства и характеристика
Медь в чистом виде – это довольно ковкий, тягучий, вязкий металл, имеющий красновато-коричневый цвет.
Его твердость достигается путем добавления в состав различных примесей. Она имеет высокую электропроводность и теплопроводность, но примеси, которые зачастую добавляют в сплав, ухудшают эти показатели.
Преимуществом данного металла является устойчивость к коррозии. Температура плавления равна 1085 градусов по Цельсию, а температура кипения – 2562 градуса. Плотность равна 8900 кг/м3. Удельный вес равен 8930 кг/м3.
Медь в чистом виде является диамагнетиком, то есть магнитными свойствами не обладает. Магнититься могут только ее сплавы, где концентрация непосредственно самой меди не более 50%.
С чем реагирует
Медь НЕ реагирует с водородом, углеродом, азотом, а так же кремнием.
Реагирует с кислотами и солями, оксидами, галогенами, кислородом и неметаллами, но не может реагировать со щелочами, так как находится в электрохимическом ряду после водорода. Так же не может реагировать с фтором, бромом, хлором.
Так же не может реагировать с фтором, бромом, хлором.
Отношение к кислороду
По отношению к кислороду металл проявляет слабую активность, но при длительном нахождении на воздухе покрывается очень тонкой, почти незаметной зеленоватой пленкой, которая и является оксидом меди.
В зависимости от температуры, при которой протекает реакция, купрум образует 2 оксида: CuO и Cu2O.
Взаимодействие с водой
По причине того, что медь находится в ряду электрохимического напряжения после водорода, она не вытесняет водород из воды. Но если присутствует кислород, водород может вытеснять молекулы металла, за счет чего и происходит окислительно-восстановительная реакция.
Реакции с кислотами
Из-за своего положения в электрохимическом ряду, не вытесняет водород из кислот, поэтому некоторые из них на нее не действуют. Но при достаточном доступе кислорода, растворяются в них, образуя соответствующие кислотам соли.
Отношение к галогенам и неметаллам
С галогенами медь реагирует довольно хорошо. В обычных условиях изменения не особо заметны, но на поверхности со временем образуется очень тонкий слой галогенидов. А при повышенных температурах реакция происходит очень быстро и бурно.
В обычных условиях изменения не особо заметны, но на поверхности со временем образуется очень тонкий слой галогенидов. А при повышенных температурах реакция происходит очень быстро и бурно.
Cu реагирует с серой, в зависимости от температуры образуются следующие сульфиды: Сu2S, CuS.
Может образовывать йодиды (с йодом).
Реакции с оксидами неметаллов
Медь может реагировать не со всеми оксидами неметаллов, что зависит от неметалла, температуры и других условий протекания химической реакции.
Химические свойства меди
Одновалетной
Ион Cu+ крайне неустойчив, особенно в водных растворах. Примерами одновалентной меди могут служить:
- оксид (I) – Cu2O,
- сульфид (I) – С
Двухвалентной
Это наиболее характерная степень окисления для меди. Так же более устойчивая и распространенная, например:
- оксид (II) – CuO,
- соли.
Трехвалентной
Наиболее редкая и нестабильная степень окисления этого металла, которая является исключением, например:
- оксид (III) – Cu2O3,
- купрат (III).

Заключение
Медь – распространенное вещество, которое незаменимо во многих отраслях, так как является очень гибким и плавким. Имеет высокие показатели, во многом сравнимые с железом, что позволяет изготавливать из нее многие незаменимые детали в производстве и механике.
Химические свойства элементов:медь, нахождение меди в природе, получение меди, свойства меди
Ключевые слова: медь, нахождение меди в природе, получение меди, физические свойства меди, сплавы. меди, химические свойства меди.
Медь (Cuprum), Си — химический элемент побочной подгруппы первой группы периодической системы элементов Д.И. Менделеева. Латинское название происходит от острова Кипр, где древние греки добывали медную руду. Порядковый номер 29, атомная масса меди 63,54. Природная медь состоит из смеси 2-х стабильных изотопов 63Cu (69,1%) и 65Cu (30,9%). Путем бомбардировки никеля протонами или ядрами дейтерия искусственно получают радиоактивные изотопы меди 6lCu и 64Си с периодами полураспада 3,3 и 12,8 часов соответственно. Эти изотопы обладают высокой удельной активностью и используются в качестве меченых атомов. В химическом отношении медь занимает промежуточное положение между элементами главной подгруппы VIII группы и щелочными элементами I группы периодической системы.
Путем бомбардировки никеля протонами или ядрами дейтерия искусственно получают радиоактивные изотопы меди 6lCu и 64Си с периодами полураспада 3,3 и 12,8 часов соответственно. Эти изотопы обладают высокой удельной активностью и используются в качестве меченых атомов. В химическом отношении медь занимает промежуточное положение между элементами главной подгруппы VIII группы и щелочными элементами I группы периодической системы.
НАХОЖДЕНИЕ МЕДИ В ПРИРОДЕ
Содержание меди в земной коре составляет около 0,01%. Она встречается в свободном состоянии в виде самородков, достигающих значительных размеров (до нескольких тонн). Однако руды самородной меди сравнительно мало распространены, и в настоящее время из них добывается не более 5% меди от общей ее мировой добычи. Медь является халькофильным элементом. До 80% ее присутствует в земной коре в виде соединений с серой. Около 15% меди находится в виде карбонатов, силикатов, оксидов, являющихся продуктами выветривания первичных сульфидных медных руд. Медь образует до 240 минералов, однако лишь около 40 имеют промышленное значение .Различают сульфидные и окисленные руды меди. Промышленное значение имеют сульфидные руды, из которых наиболее широко используется медный колчедан (халькопирит) CuFeS2. В природе он встречается главным образом в смеси с железным колчеданом FeS2 и пустой породой, состоящей из оксидов кремния, алюминия, кальция . Часто сульфидные руды содержат примеси благородных металлов (золота, серебра), цветных и редких металлов ( цинка, свинца, никеля, кобальта, молибдена ) и рассеянных элементов (германий).Содержание меди в руде обычно составляет 1—5%, но благодаря технологии флотации, ее можно обогащать, получая концентрат, содержащий 20% меди и более . Наиболее крупные запасы медных руд в России сосредоточены главным образом на Урале, в Казахстане и Средней Азии, за рубежом — в Африке (Катанта, Замбия), Америке (Чили, США, Канада).
Медь образует до 240 минералов, однако лишь около 40 имеют промышленное значение .Различают сульфидные и окисленные руды меди. Промышленное значение имеют сульфидные руды, из которых наиболее широко используется медный колчедан (халькопирит) CuFeS2. В природе он встречается главным образом в смеси с железным колчеданом FeS2 и пустой породой, состоящей из оксидов кремния, алюминия, кальция . Часто сульфидные руды содержат примеси благородных металлов (золота, серебра), цветных и редких металлов ( цинка, свинца, никеля, кобальта, молибдена ) и рассеянных элементов (германий).Содержание меди в руде обычно составляет 1—5%, но благодаря технологии флотации, ее можно обогащать, получая концентрат, содержащий 20% меди и более . Наиболее крупные запасы медных руд в России сосредоточены главным образом на Урале, в Казахстане и Средней Азии, за рубежом — в Африке (Катанта, Замбия), Америке (Чили, США, Канада).
ПОЛУЧЕНИЕ МЕДИ
Руды и получаемые из них путем механического обогащения концентраты перерабатывают на медь пирометаллургическим и гидрометаллургическим методами . Первый из них применяется преимущественно для переработки сернистых руд. Вторым методом, получившим небольшое распространение, перерабатывают окисленные и смешанные бедные руды, содержащие около 1% меди.Пирометаллургический метод заключается в обжиге концентратов, плавке полученного огарка на штейн (сплав сульфидов меди и железа), продувке штейна в конвертере с получением черновой меди (содержащей около 5% примесей), рафинировании последних огневым процессом или электролизом для получения чистой меди. Гидрометаллургический метод получения меди заключается в извлечении ее из руд различными растворителями с последующим выделением металла из растворов электролизом или посредством вытеснения его железом в виде цементной меди. Иногда медь выделяют в виде оксида.
Первый из них применяется преимущественно для переработки сернистых руд. Вторым методом, получившим небольшое распространение, перерабатывают окисленные и смешанные бедные руды, содержащие около 1% меди.Пирометаллургический метод заключается в обжиге концентратов, плавке полученного огарка на штейн (сплав сульфидов меди и железа), продувке штейна в конвертере с получением черновой меди (содержащей около 5% примесей), рафинировании последних огневым процессом или электролизом для получения чистой меди. Гидрометаллургический метод получения меди заключается в извлечении ее из руд различными растворителями с последующим выделением металла из растворов электролизом или посредством вытеснения его железом в виде цементной меди. Иногда медь выделяют в виде оксида.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕДИ
Техническая медь — металл красного, в изломе розового цвета, при просвечивании в тонких слоях — зеленовато-голубой. Имеет гранецентрированную кубическую решетку, плотность 8,96 кг/м3 (20°С). Медь — вязкий, мягкий и ковкий металл, уступающий только серебру высокими теплопроводностью и электропроводностью. Эти качества, а также пластичность и сопротивление коррозии обусловили широкое применение меди в промышленности.
Медь — вязкий, мягкий и ковкий металл, уступающий только серебру высокими теплопроводностью и электропроводностью. Эти качества, а также пластичность и сопротивление коррозии обусловили широкое применение меди в промышленности.
СПЛАВЫ МЕДИ
Небольшие примеси висмута (0,001%*) и свинца (0,01%) делают медь ломкой, а примесь серы вызывает хрупкость на холоду .С металлами медь образует различные сплавы. В двухкомпонентных медных сплавах с Zn, Sn, Al, Ni, Fe, Mn, Si, Be, Cr, Pb, P и др. легирующий элемент входит в твердый раствор замещения на основе Си, а также может образовывать электронные соединения, характеризующиеся определенной электронной концентрацией. В многокомпонентных сплавах часто присутствуют сложные металлические соединения точно неустановленного состава. Легирующие элементы вводят в медь для повышения прочности и твердости, улучшения антифрикционных свойств и стойкости против коррозии и для получения сплавов с заданными физическими свойствами. Медные сплавы делят на латуни, бронзы и медно-никелевые сплавы .
Латунями называют сплавы меди и цинка. Медь может растворять цинк в любом количестве. При добавлении к меди до 45—47% Zn увеличивается предел прочности сплава при растяжении; дальнейшее увеличение содержания цинка вызывает снижение предела прочности. Вязкость (пластичность) сплава возрастает при добавлении к меди до 30—32% Zn, а затем уменьшается, достигая очень малой величины при содержании 47—50% Zn.
Ковкая латунь (мунц-металл) содержит 60% Си и 40% Zn, томпак — 90—80% Си и 10—20% Zn. Состав специальных латуней: алюминиевая (66—68% Си, ~3% А1, ~30% Zn), марганцовисто-свинцовая (57—60% Си, 1,5—2,5% РЬ; 1,5—2,5% Мп, -38% Zn).
Бронзами называют сплавы меди с оловом. В присутствии олова улучшаются механические свойства меди, бронзы обладают хорошими литейными свойствами. Обычно содержание олова не превышает 10%. Алюминиевая бронза содержит 82—90% Си, 4—10% Al, 1—6% Fe + Si; кремнеоловянная бронза — 99,94% Си, по 0,03% Sn и Si.
Сплавы меди с никелем. Никель сильно повышает твердость меди. Сплав 50% Си и 50% Ni обладает наибольшей твердостью. Кроме высокой твердости, эти сплавы обладают пониженной электропроводностью, вследствие чего употребляются в электротехнике .
Хорошие механические свойства, высокая стойкость против коррозии во многих средах, ценные физические свойства в сочетании с простотой плавки, литья и обработки давлением обусловили широкое применение медных сплавов в многочисленных отраслях техники: в авиа-, авто-, судостроении, химической промышленности, станкостроении, электротехнике, приборостроении, в производстве паровой и водяной арматуры, посуды, художественных и других изделий.
ХИМИЧЕСКИЕ СВОЙСТВА МЕДИ
Медь — электроположительный металл. Медь вытесняется из своих солей более электроотрицательными элементами и не растворяется в кислотах, не являющихся окислителями. Медь растворяется в азотной кислоте с образованием (Си(NOз)2 и оксидов азота, в горячей конц. H2SO4 — с образованием CuSO4 и SO2. В нагретой разбавленной H2SO4 медь растворяется только при продувании через раствор воздуха .Химическая активность меди невелика, при температурах ниже 185°С с сухим воздухом и кислородом не реагирует. В присутствии влаги и СО2 на поверхности меди образуется зеленая пленка основного карбоната. При нагревании меди на воздухе идет поверхностное окисление; ниже 375°С образуется СиО, а в интервале 375—1100°С при неполном окислении меди — двухслойная окалина (СиО + СuО). Влажный хлор взаимодействует с медью уже при комнатной температуре, образуя хлорид меди(II), хорошо растворимый в воде. Медь реагирует и с другими галогенами. Особое сродство проявляет медь к сере: в парах серы она горит. С водородом, азотом, углеродом медь не реагирует даже при высоких температурах. Растворимость водорода в твердой меди незначительна и при 400°С составляет 0,06 г в 100 г меди. Присутствие водорода в меди резко ухудшает ее механические свойства (так называемая «водородная болезнь»).
H2SO4 — с образованием CuSO4 и SO2. В нагретой разбавленной H2SO4 медь растворяется только при продувании через раствор воздуха .Химическая активность меди невелика, при температурах ниже 185°С с сухим воздухом и кислородом не реагирует. В присутствии влаги и СО2 на поверхности меди образуется зеленая пленка основного карбоната. При нагревании меди на воздухе идет поверхностное окисление; ниже 375°С образуется СиО, а в интервале 375—1100°С при неполном окислении меди — двухслойная окалина (СиО + СuО). Влажный хлор взаимодействует с медью уже при комнатной температуре, образуя хлорид меди(II), хорошо растворимый в воде. Медь реагирует и с другими галогенами. Особое сродство проявляет медь к сере: в парах серы она горит. С водородом, азотом, углеродом медь не реагирует даже при высоких температурах. Растворимость водорода в твердой меди незначительна и при 400°С составляет 0,06 г в 100 г меди. Присутствие водорода в меди резко ухудшает ее механические свойства (так называемая «водородная болезнь»). При пропускании аммиака над раскаленной медью образуется Cu2N. Уже при температуре каления медь подвергается воздействию оксидов азота: N2O и NO взаимодействуют с образованием СuО, a NO2 — с образованием СиО. Карбиды Cu2C2 и СuС2 могут быть получены действием ацетилена на аммиачные растворы солей меди. Оксид меди(I) Си2O красного цвета, незначительно растворяется в воде. При взаимодействии сильных щелочей с солями меди(I) выпадает желтый осадок, переходящий при нагревании в осадок красного цвета, по-видимому Сu2О. Гидроксид меди(I) обладает слабыми основными свойствами, он немного растворим в концентрированных растворах щелочей.
При пропускании аммиака над раскаленной медью образуется Cu2N. Уже при температуре каления медь подвергается воздействию оксидов азота: N2O и NO взаимодействуют с образованием СuО, a NO2 — с образованием СиО. Карбиды Cu2C2 и СuС2 могут быть получены действием ацетилена на аммиачные растворы солей меди. Оксид меди(I) Си2O красного цвета, незначительно растворяется в воде. При взаимодействии сильных щелочей с солями меди(I) выпадает желтый осадок, переходящий при нагревании в осадок красного цвета, по-видимому Сu2О. Гидроксид меди(I) обладает слабыми основными свойствами, он немного растворим в концентрированных растворах щелочей.
Сплавы меди
Реакции с медью(взаимодействие меди)
Оксиды меди
Сульфат меди
Хлорид меди
Нитрат меди
Гидроксид меди
Cooper and Silver: Physical & Chemical Properties — 1976 Words
Для химической и металлургической промышленности важно тщательное изучение свойств используемых материалов и применение справочных данных для анализа и возможного прогнозирования результатов практического применения. существенный. Таким образом, фактически информация о материале, его химическом составе и физико-химических свойствах имеет решающее значение для принятия решения о его полезности в конкретных практических задачах. Вообще говоря, возможность применения конструкционного материала в технических науках определяется его характеристиками. Такой подход обусловлен как необходимостью соответствия параметров материала промышленному применению, так и минимизацией повреждений в сочетании с созданием продукции более высокого качества.
существенный. Таким образом, фактически информация о материале, его химическом составе и физико-химических свойствах имеет решающее значение для принятия решения о его полезности в конкретных практических задачах. Вообще говоря, возможность применения конструкционного материала в технических науках определяется его характеристиками. Такой подход обусловлен как необходимостью соответствия параметров материала промышленному применению, так и минимизацией повреждений в сочетании с созданием продукции более высокого качества.
Исследовательский вопрос данной работы сводился к анализу двух неактивных металлов — серебра и меди — по их физико-химическим параметрам для оценки их потенциального использования в промышленности. Характеристики, представляющие интерес и, следовательно, подлежащие измерению в данной работе, включают температуру, термодинамические и физические параметры. В частности, для меди и серебра описаны температуры плавления и кипения, а также плотность материалов и их удельная теплоемкость. Также указано электрическое сопротивление в сочетании с коэффициентом термической стабильности. Кроме того, учитывая, что оба металла являются классическими проводниками электрического тока, повышенный интерес вызвал регрессионный анализ электрического сопротивления в зависимости от температуры: если оба материала линейно увеличивают сопротивление, важно определить более подходящий материал для производственных задач. при заданной температуре. В то же время исследование удельной поглощаемой энергии является задачей проектирования элементов уменьшенной массы. Известно, что эта характеристика определяется как количество энергии — тепловой или электрической — поглощаемой единицей массы вещества. Таким образом, при разных значениях параметра приоритетное преимущество будет иметь тот материал, который поглощает больше энергии в электрохимической и машиностроительной промышленности. По этой причине оценка этого параметра представляет собой интригующую часть исследования, позволяющего определить эффективность меди и серебра как конструкционных материалов.
Также указано электрическое сопротивление в сочетании с коэффициентом термической стабильности. Кроме того, учитывая, что оба металла являются классическими проводниками электрического тока, повышенный интерес вызвал регрессионный анализ электрического сопротивления в зависимости от температуры: если оба материала линейно увеличивают сопротивление, важно определить более подходящий материал для производственных задач. при заданной температуре. В то же время исследование удельной поглощаемой энергии является задачей проектирования элементов уменьшенной массы. Известно, что эта характеристика определяется как количество энергии — тепловой или электрической — поглощаемой единицей массы вещества. Таким образом, при разных значениях параметра приоритетное преимущество будет иметь тот материал, который поглощает больше энергии в электрохимической и машиностроительной промышленности. По этой причине оценка этого параметра представляет собой интригующую часть исследования, позволяющего определить эффективность меди и серебра как конструкционных материалов.
Актуальность данной темы была продиктована необходимостью качественной и количественной оценки двух металлов для реализации проектных задач. Исследования широкого спектра цифровых научных статей привели к выводу, что хотя сравнение серебра и меди не является новаторской идеей данной работы, большинство работ ориентированы на узко заданное направление, игнорируя общую информацию (Хлина и др., 2017; Барахона и др., 2016). По этой причине данная диссертация будет подходящим материалом для обобщения имеющейся информации и демонстрации логики расчета и интерпретации некоторых наиболее важных величин.
Определение физических свойств
Для облегчения визуализации и создания более понятного сравнения физические свойства двух металлов показаны в таблице 1.
Таблица 1. Сводная информация о физических свойствах материалов (Helmenstine, 2019 ; Hampson & Hanssen, 2019; Sebastian et al., 2017).
Как видно, данные по каждому металлу представляют собой набор чисел, значение которых, однако, больше для меди, чем для серебра. Таким образом, физические свойства меди и серебра различны по каждому из параметров, что и обосновывает столь разное использование материалов в промышленности. Прежде чем продемонстрировать практическое использование данных, необходимо уточнить, какие параметры были предложены для обсуждения. Температурой плавления металлов называют температуру перехода твердого кристаллического вещества в жидкую фазу, и наоборот. Температура кипения считается температурным порогом, при котором жидкость закипает при постоянном давлении. В то же время интересно отметить, что температуры плавления и кипения, хотя и являются сходными характеристиками, на самом деле представляют собой совершенно разные структурные изменения в материалах. При плавлении жидкая и твердая фазы находятся в равновесии, тогда как при кипении начинает преобладать жидкость. Плотность — скалярная физическая величина, зависящая от строения кристаллической решетки, определяемая для однородного вещества массой единицы его объема. Таким образом, из двух материалов одинакового объема большую массу имеет тот, у которого плотность выше.
Таким образом, физические свойства меди и серебра различны по каждому из параметров, что и обосновывает столь разное использование материалов в промышленности. Прежде чем продемонстрировать практическое использование данных, необходимо уточнить, какие параметры были предложены для обсуждения. Температурой плавления металлов называют температуру перехода твердого кристаллического вещества в жидкую фазу, и наоборот. Температура кипения считается температурным порогом, при котором жидкость закипает при постоянном давлении. В то же время интересно отметить, что температуры плавления и кипения, хотя и являются сходными характеристиками, на самом деле представляют собой совершенно разные структурные изменения в материалах. При плавлении жидкая и твердая фазы находятся в равновесии, тогда как при кипении начинает преобладать жидкость. Плотность — скалярная физическая величина, зависящая от строения кристаллической решетки, определяемая для однородного вещества массой единицы его объема. Таким образом, из двух материалов одинакового объема большую массу имеет тот, у которого плотность выше. Удельная теплоемкость характеризует количество тепловой энергии, которое необходимо передать материалу, чтобы изменить его температуру на один градус. Из названия этого термина, электрическое сопротивление, становится ясно, что он описывает потенциал для проведения электрического тока: чем выше сопротивление, тем слабее проводится ток. Наконец, зависимость электрического сопротивления вещества от его текущей температуры характеризуется температурным коэффициентом сопротивления.
Удельная теплоемкость характеризует количество тепловой энергии, которое необходимо передать материалу, чтобы изменить его температуру на один градус. Из названия этого термина, электрическое сопротивление, становится ясно, что он описывает потенциал для проведения электрического тока: чем выше сопротивление, тем слабее проводится ток. Наконец, зависимость электрического сопротивления вещества от его текущей температуры характеризуется температурным коэффициентом сопротивления.
Ориентируясь только на цифры из таблицы, необходимо сделать сразу несколько важных замечаний. Прежде всего, правильно будет отметить, что медь – более «твердый» металл, чем серебро. Хотя серебро на самом деле имеет большую молекулярную массу и плотность, оно относительно хорошо проводит электрический ток и требует меньших внешних усилий для использования в качестве проводника. Это также может быть связано с большим количеством свободных электронов. Во-вторых, для меди ситуация, по-видимому, обратная: металл имеет более высокие температуры кипения и плавления, что свидетельствует об относительной сложности его атомной структуры по сравнению с серебром. В-третьих, термоэлектрические свойства меди также показывают более высокую жесткость, а именно то, что металлу требуется больше тепловой энергии для нагрева на 1 градус: теплоемкость меди выше. Более высокая теплоемкость по сравнению с серебром делает медь более устойчивой к передаче электричества, а превосходное удельное электрическое сопротивление только подтверждает этот факт.
В-третьих, термоэлектрические свойства меди также показывают более высокую жесткость, а именно то, что металлу требуется больше тепловой энергии для нагрева на 1 градус: теплоемкость меди выше. Более высокая теплоемкость по сравнению с серебром делает медь более устойчивой к передаче электричества, а превосходное удельное электрическое сопротивление только подтверждает этот факт.
Для того чтобы построить зависимость электрического сопротивления от температуры, необходимо обратиться к формуле этого параметра, представленной ниже. С помощью программы MS Excel были выполнены расчеты сопротивления для семнадцати контрольных точек и построен график, показанный на рисунке 1. Нетрудно заметить, что электрическое сопротивление каждого из металлов линейно возрастает с повышением температуры. Фактически это означает, что чем выше температура среды, тем более сложный материал будет выполнять функции проводника. Например, если бы нужно было выбирать, какой материал использовать для высокотемпературной работы под высоким напряжением, то при прочих равных условиях серебро было бы более выгодным вариантом.
p i = p 20 [1 + α(t – 20°C)]
Рис. 1. График зависимости электрического сопротивления от температуры.
Интересно отметить, что в основе явления линейности увеличения теплоемкости при повышении температуры лежит квантовое изменение конфигураций атомов. В частности, каждый из элементов имеет определенный запас колебательных и вращательных уровней внутренней энергии, которые начинают возбуждать в случае поступления в вещество дополнительной теплоты. Так как атом нагревается, их кинетическая энергия увеличивается, что приводит к более активным колебаниям атомов. Нагрев сопровождается увеличением заполнения этих уровней, в связи с чем увеличивается количество запасенной энергии металла.
Между тем представленные выше данные позволяют прогнозировать и оценивать характер физических свойств. В частности, с помощью графика можно прогнозировать значения теплоемкости металлов при конкретных температурах. Например, если бы в строительной отрасли стоял выбор между использованием меди и серебра в качестве материала высоковольтного провода, и уточнялось бы, что рабочая температура процесса будет достигать 1300 градусов, то благодаря графике это можно было понять, что серебро было бы более удобным вариантом.
Следует признать, что удельное количество поглощенной энергии представляет собой количество энергии (т. е. тепла), которая была передана веществу для изменения его сопротивления. Учитывая линейность роста удельного сопротивления и физический смысл величины, для установления связи между удельным электрическим сопротивлением и поглощенной энергией можно использовать следующее соотношение:
В то же время величину удельной поглощенной энергии можно найти формула:
В этой формуле нет. 4 видно, что существует прямая зависимость между удельной теплоемкостью вещества и удельной поглощенной энергией. В то же время величина энергии определяется разницей температур: чем существеннее был нагрет материал, тем больше энергии он смог поглотить. Разница температур также важна в формуле поиска электрического сопротивления. Таким образом, эта разность температур (ΔT) в формуле нет. 4 является эквивалентом того, что используется в формуле удельного электрического сопротивления №. 1. Выразив разность температур, получим следующее уравнение:
1. Выразив разность температур, получим следующее уравнение:
Далее, если результат, полученный в пятой формуле, заменить на формулу №. 4 можно получить готовое выражение. При этом следует отметить, что вместо обобщенных значений удельной теплоемкости, электрического сопротивления и температурного коэффициента сопротивления правильнее использовать известные значения.
В целом нетрудно заметить несколько закономерностей, которые можно обнаружить при обращении к формуле №2. Первый момент, на который следует обратить внимание, это прямая зависимость уникальной поглощаемой энергии от теплоемкости материала: чем выше один из этих показателей, тем выше другой. При этом следует обратить внимание на знаменатель, в котором стоит температурный коэффициент сопротивления. Если подставить известные значения серебра и меди в формулы №. 6 и нет. 7, то должны получиться следующие выражения:
На основе формулы №. 9 и нет. 11, необходимо сказать, что первый член уравнения для серебра SEA сравним с таким же значением для меди.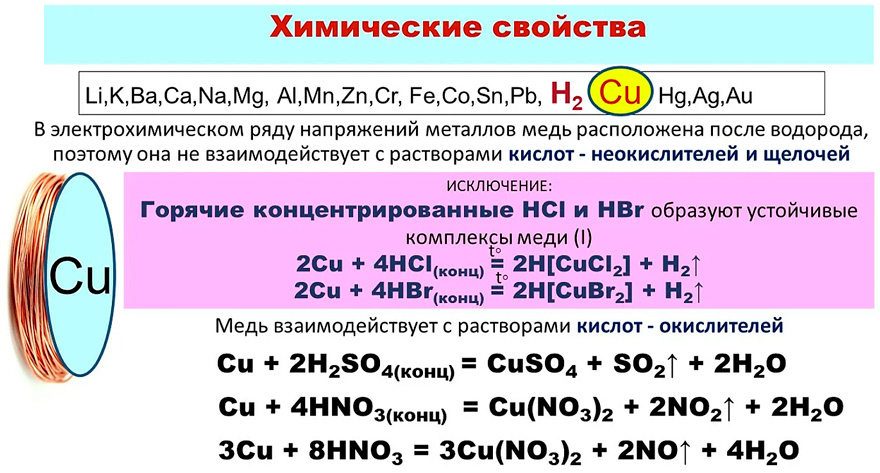 Подставив в формулы оставшееся значение p 20 , получим:
Подставив в формулы оставшееся значение p 20 , получим:
Завершающим этапом сравнения двух элементов по приведенным выше формулам будет определение характера зависимости удельной поглощенной энергии от тип металла. Учитывая, что в формулах нет. 12 и нет. 13 единственной переменной является значение электрического сопротивления в конкретной точке, можно построить две функции и оценить кажущуюся разницу. Как показано на рисунке 2, значения удельной поглощенной энергии для серебра всегда будут выше, чем значения SEA для меди при тех же значениях удельного электрического сопротивления. Этот результат можно интерпретировать следующим образом: преобладание плотности энергии серебра свидетельствует о более высокой ценности этого материала, чем меди.
Рис. 2. Визуализация формул для определения особой поглощаемой энергии для двух материалов: меди (синяя линия) и серебра (зеленая).
Выбор того или иного материала в качестве исходного для работы должен сопровождаться анализом его физических свойств. Конкретные критерии сравнения могут включать плотность, термоэлектрические и механические характеристики. Например, медь имеет более высокий приоритет с точки зрения термической стабильности и плотности, но проигрывает по удельной теплоемкости и сопротивлению. Серебро лучше проводит электрический ток, но само по себе является более плотным веществом, что увеличивает вес изделия на 15% по сравнению с медью. Подводя итог, важно сделать вывод, что выбор конкретного источника должен основываться на совокупности факторов, включая потребности, затраты и обоснованность использования.
Конкретные критерии сравнения могут включать плотность, термоэлектрические и механические характеристики. Например, медь имеет более высокий приоритет с точки зрения термической стабильности и плотности, но проигрывает по удельной теплоемкости и сопротивлению. Серебро лучше проводит электрический ток, но само по себе является более плотным веществом, что увеличивает вес изделия на 15% по сравнению с медью. Подводя итог, важно сделать вывод, что выбор конкретного источника должен основываться на совокупности факторов, включая потребности, затраты и обоснованность использования.
Ссылки
Хэмпсон, Дж., и Ханссен, С. (2019). Электротехническая практика . Cengage AU.
Helmenstine, AM (2019). Факты о меди: химические и физические свойства. МысльКо. Веб.
Helmenstine, AM (2019). Факты о серебре (атомный номер 47 и символ элемента Ag) . МысльКо. Веб.
МысльКо. Веб.
Helmenstine, AM (2019). Таблица удельного электрического сопротивления и проводимости . МысльКо. Веб.
Себастьян, М. Т. и др. (2017). Материалы для микроволновых печей и их применение . Джон Уайли и сыновья.
Хлина, Дж., Ребоун, Дж., Хирман, М., и Хамачек, А. (2017). Сравнение свойств толстой пленки меди и серебра на подложках из оксида алюминия [документ в формате PDF]. Веб.
Бараона, М., Бетанкур, Д., и Эллинджер, Ф. (2016). Сравнение бесчиповых меток СШП на гибких подложках , изготовленных из алюминия, меди или серебра [документ в формате PDF]. Веб.
Атомный номер, физические, химические свойства, использование и часто задаваемые вопросы
Перейти к содержимому
Что такое медь?
Медь – атомный номер: Медь – это химический элемент с символом Cu и атомным номером 29. Это мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Медь встречается в природе в виде различных минералов, но чаще всего добывается в виде сульфида меди. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных сплавов.
Это мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Медь встречается в природе в виде различных минералов, но чаще всего добывается в виде сульфида меди. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных сплавов.
- Атомный номер меди 29. Это означает, что в ядре меди 29 протонов. Медь — мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. В природе встречается в различных минералах, но чаще всего добывается в виде сульфида меди. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных сплавов.
- Медь — химический элемент с символом Cu и атомным номером 29. Это мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Медь встречается в природе в виде минералов сульфида меди и оксида меди, но чаще всего добывается из медных руд, обнаруженных в медных месторождениях.

Зарегистрируйтесь, чтобы получить бесплатный пробный тест и учебные материалы
+91
Подтвердите OTP-код (обязательно)
Я согласен с условиями и политикой конфиденциальности.
Свойства меди
- Медь — красноватый металл, который очень хорошо проводит электричество.
- Он ковкий, то есть его можно растянуть в тонкую проволоку, и податливый, то есть из него можно сбить тонкие листы.
- Медь также является хорошим проводником тепла, что означает, что ее можно использовать для эффективной передачи тепла.
Применение меди
- Медь — это универсальный металл с широким спектром применения.
- Применяется в строительстве, электромонтаже, транспорте, производстве и других отраслях промышленности.
- Медь — мягкий, ковкий металл красновато-оранжевого цвета. В природе встречается в виде сульфидов меди и карбонатов меди. Медь — один из немногих металлов, встречающихся в природе в чистом виде.

- Медь использовалась людьми на протяжении многих тысяч лет. Он использовался для изготовления монет, украшений и других декоративных предметов. Медь также использовалась для изготовления кухонной утвари, сельскохозяйственных инструментов и других орудий.
- Медь также является отличным проводником электричества и используется для электропроводки и других электрических применений.
Соединения меди
- Медь может образовывать соединения в различных степенях окисления, включая медь (Cu1+), медь (Cu2+) и медь (Cu3+). Эти соединения можно разделить на две основные категории: купраты и цианид меди.
- Купраты представляют собой ионные соединения, содержащие медь в медно- или медносодержащем состоянии. Соединения меди обычно растворимы в воде, а соединения меди обычно нерастворимы. Цианиды меди также являются ионными соединениями, но они содержат медь в медном состоянии. Эти соединения также обычно растворимы в воде.
- Купраты и цианид меди могут образовываться при реакции меди с окислителем.

