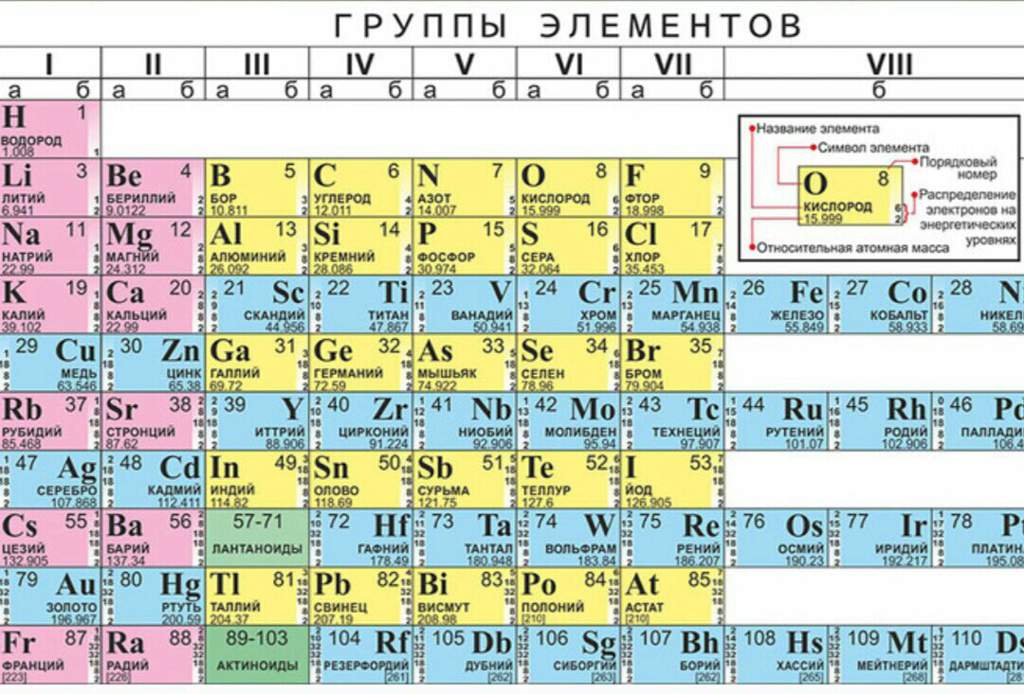
Химический элемент купрум: Медь. Большая российская энциклопедия
Содержание
Химический элемент медь — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Медь
Выполнил: ст.гр. БО-18-1
Портнягина И.М
2. Место меди в Периодической системе химических элементов Д.И. Менделеева
Медь расположена в 11 группе Периодической
системы химических элементов Д.И. Менделеева.
В четвертом периоде медь является
предпоследним d-элементом, её валентные
электроны 3d94s2, однако вследствие
устойчивости d10-состояния энергетическим более
выгодным оказывается переход одного dэлектрона на 4s-подуровень, поэтому валентные
электроны меди имеют следующую
конфигурацию: 3d104s1. В соединениях для меди
В соединениях для меди
характерная степень окисления +2, возможно
проявление степеней окисления +1 и +3.
3. Физические свойства меди
Медь – пластичный, розовато-красный металл с
металлическим блеском. Обладает высокой
тепло- и электропроводностью, по значению
электропроводности уступает только серебру.
Температура плавления 1083°С, температура
кипения 2567°С, плотность 8,92 г/см3.
На воздухе медь покрывается плотной зеленосерой пленкой основного карбоната, которая
защищает её от дальнейшего окисления.
4. Химические свойства меди
С кислородом в зависимости от температуры
взаимодействия медь образует два оксида:
2Cu + O2 = 2CuO (черный цвет)
При температуре около 150 оС металл
покрывается темно-красной пленкой оксида
меди (I):
4Cu + O2 = 2Cu2O
При нагревании с фтором, хлором, бромом
образуются галогениды меди (II):
Cu + Br2 = CuBr2;
с йодом – образуется йодид меди (I):
2Cu + I2 = 2CuI.
Cu + S = CuS
4Cu + SO2= Cu2S + 2CuO
4Cu + 2NO2 = 4CuO + N2
5. Взаимодействие с аммиаком
Медь растворяется в водном растворе аммиака
в присутствии кислорода воздуха с
образованием гидроксида тетраамминмеди (II):
2Cu + 8Nh4 + 2h3O + O2 = 2[Cu(Nh4)4](OH)2.
6. Восстановительные свойства
Медь окисляется оксидом азота (IV) и хлоридом
железа (III):
2Cu + NO2 = Cu2O + NO;
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
7. Взаимодействие с кислотами
В электрохимическом ряду
напряжений металлов медь расположена после
водорода, поэтому она не взаимодействует с
растворами разбавленной соляной и серной
кислот и щелочей.
Растворяется в разбавленной азотной кислоте с
образованием нитрата меди (II) и оксида азота
(II):
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O.
Реагирует с концентрированными растворами
серной и азотной кислот с образованием солей
меди (II) и продуктов восстановления кислот:
Cu + 2h3SO4 = CuSO4 + SO2 + 2h3O;
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O.
С концентрированной соляной кислотой медь
реагирует с образованием трихлорокупрата (II)
водорода:
Cu + 3HCl = H[CuCl3] + h3
Медь — один из первых металлов,
широко освоенных человеком изза сравнительной доступности
для получения и малой
температуры плавления.
Латинское название меди Cuprum
произошло от названия
острова Кипр.
Известно, что при возведении
пирамиды Хеопса использовались
медные инструменты.
Кипр
Пирамида
Хеопса
9. Нахождение в природе.
Медь встречается в природе как
в соединениях, так и в
самородном виде. Нередко
встречаются месторождения
меди в осадочных породах —
медистые песчаники и сланцы.
Содержание меди в руде составляет
от 0,3 до 1,0 %.
Самородный вид
Медь в соединениях
10. Физические свойства
Медь — золотисто-розовый
пластичный металл, на воздухе
быстро покрывается оксидной
плёнкой. Медь обладает
высокой тепло и электропроводност
ью, занимает второе место по
электропроводности после серебра.
11. Применение
Медь широко применяется
в электротехнике для изготовления
силовых кабелей, проводов или
других проводников.
Теплопроводимость меди позволяет
применять её в
различных теплоотводных
устройствах: радиаторах охлаждения
,кондиционироввания
и отопления.
Медный радиатор.
Медный кабель.
Медь широко используется для
производства медных труб применяющихся
для транспортировки жидкостей и газов
В разнообразных областях техники широко
используются сплавы с использованием
меди, самыми широко распространёнными
из которых являются бронза и латунь.
Для деталей машин используют сплавы
меди с цинком, оловом, алюминием,
кремнием и др.
• Медноникелевые сплавы,
широко используются в
судостроении.
Медные трубы.
Метизы (Детали машин)
Сплавы меди.
13. Ювелирные сплавы
В ювелирном деле часто
используются сплавы меди
с золотом для увеличения прочности
изделий к деформациям и
истиранию, так как чистое золото —
очень мягкий металл и нестойко к
этим механическим воздействиям.
14. Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного
листа служат
безаварийно по 100—150 лет.
Медная кровля.
Медные водосточные трубы.
Медный фасад.
15. Биологическая роль
Медь — необходимый
элемент для высших растений и
животных.
После усваивания меди
кишечником она
транспортируется к печени с
помощью альбумина.
Продукты, богатые медью.
Здоровому
взрослому
человеку необходимо
поступление меди в
количестве 0,9 мг в
день. При недостатке
меди снижается
активность ферментных
систем и замедляется
белковый обмен, в
результате замедляется
и нарушается рост
костных тканей.
16. Влияние на экологию
При открытом способе добычи меди,
после её прекращения карьер
становится источником токсичных
веществ. Самое токсичное озеро в
мире — Беркли Пит — образовалось в
кратере медного рудника. Оно
Оно
находится в Штате Монтана в США.
в 1984 году
в 2008 году
17. Заключение
Несмотря на то, что медь была одним из самых
первых открытых человеком металлов,
масштабы и способы ее потребления только
возрастают. Благодаря развитию науки и
прогрессу, ученые открывают все новые
свойства металла и, соответственно, новые
области его применения.
Мне кажется, что применение этого металла
в производственных сферах человечеством
изучено подробно, тогда как ее роль в
физиологических и биологических процессах,
происходящих в организмах, еще только
предстоит исследовать в полной мере.
English
Русский
Правила
Глава 1. Медь – простое вещество
§1. Электронное строение. Степени окисления.
Медь
— элемент первой группы побочной
подгруппы четвёртого периода периодической
системы химических элементов Д. И.
Менделеева, с атомным номером 29.
Обозначается символом Cu (лат. Cuprum).
Электронное
строение атома: 1s22s22p63s23p63d104s1.
Подобно атомам щелочных металлов, атомы
меди имеют в наружном слое один электрон,
но в отличие от атомов щелочных металлов,
предпоследний электронный слой содержит
восемнадцать электронов. Медь –
предпоследний член первой декады
d-элементов.
Поэтому у меди наблюдается так называемый
«провал электрона» — конфигурация
наружного электронного слоя 3d104s1
устойчивее,
чем 3d94s2.
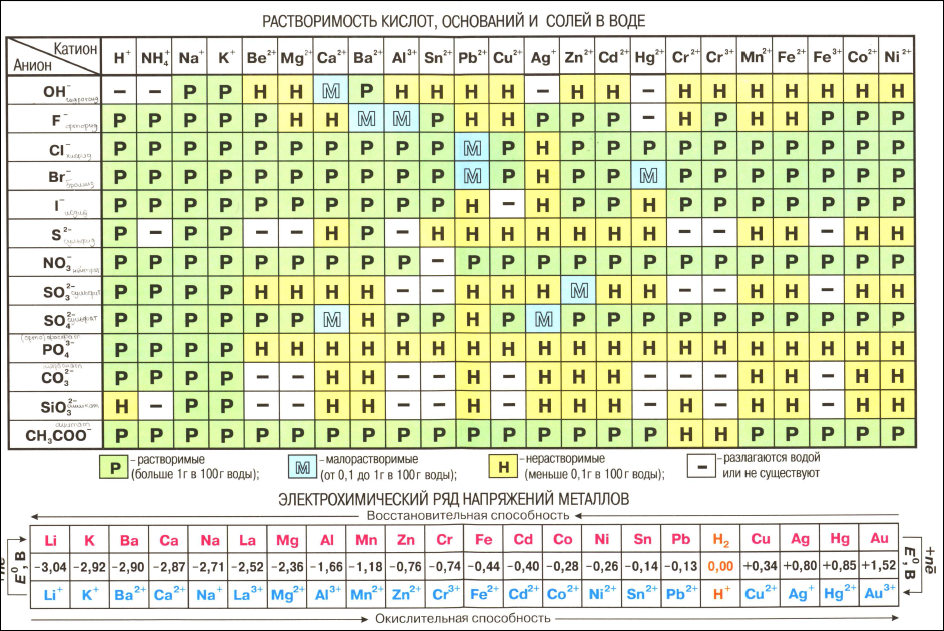
Элемент | Радиус | Энергия Э0→Э | Радиус | Стандартный Э++e—→Э0, |
K | 0. | 4.18 | 0.149 | -2.925 |
Cu | 0.128 | 7.73 | 0.098 | +0.52 |
Сравнивая
медь с металлом главной подгруппы того
же периода — калием, можно видеть, что
радиус атома и иона меди почти в два
раза меньше соответственно атома и иона
калия. Это обуславливает значительно
бóльшую плотность, высокие температуры
плавления, так как меньшие по размеру
атомы располагаются в кристаллической
решетке более плотно, вследствие чего
силы притяжения между ними велики.
Малый
радиус объясняет так же более высокие
значения энергии ионизации меди, чем
калия. Это приводит к большим различиям
в химических свойствах этих металлов
одного периода и одной группы. Медь –
малоактивный металл, в ряду напряжений
стоит после водорода, в отличие от калия
– одного из самых активных металлов. В
В
то же время, восмнедцатиэлектронный
наружный слой, устойчивый у других
элементов, здесь еще не вполне
стабилизируется, и способен к частичной
потере электронов. Так, медь, наряду с
однозарядными катионами образует и
двухзарядные, которые для нее наиболее
характерны. Так же известны соединения
со степенью окисления +3 в составе анионов
или в комплексных соединений.
§2. Нахождение в природе. Месторождения.
Металлы
подгруппы меди обладают небольшой
химической активностью, поэтому они
находятся частично в виде химических
соединений, а частично в свободном виде,
особенно золото.
Медь
в далекие геологические эпохи, очевидно,
находилась только в виде сернистых
соединений – халькопирита
(или)
и халькозина.
Объясняется это тем, что медь обладает
довольно большим химическим сродством
к сере, в настоящее время сульфиды –
наиболее распространенные минералы
меди. При высоких температурах, например,
в районах вулканической деятельности,
под действием избытка кислорода
происходило превращение сульфидов меди
в окислы, например:
При
температуре ниже 10000C
происходило образование окиси меди,
которая в небольших количествах
встречается в природе:
.
Самородная
(металлическая) медь, очевидно, возникла
в природе при сильном нагревании частично
окисленных сернистых руд. Можно
представить, что после землетрясений,
грандиозных извержений окисленные
минералы меди были погребены под толстым
слоем горных пород и нагревались за
счет земного тепла. При этом происходило
взаимодействие окислов с сульфидами:
.
Подобные
процессы протекают при выплавке меди
на металлургических заводах. Такие
природные “металлургические заводы”
выплавляют громадные количества меди:
самый крупный из найденных самородков
весил 420 т. По-видимому, в меньших масштабах
взаимодействие окислов некоторых
металлов с сульфидами идет и в настоящее
время, например, в районе некоторых
Курильских островов.
Некоторые
другие минералы меди получились из
окисных руд. Например, под действием
влаги и двуокиси углерода происходила
гидратация окиси меди и образование
основных карбонатов:
.
В
лаборатории мы эти процессы не наблюдаем,
так как они идут медленно. В “лаборатории”
природы сроки в несколько тысяч лет
совершенно незначительны. В дальнейшем
под влиянием давления вышележащих
горных пород и некоторого нагревания
происходило уплотнение основного
карбоната меди, и он превратился в
изумительный по красоте минерал –
малахит. Особенно красив полированный
малахит. Он бывает окрашен от светло-зеленого
до темно-зеленого цвета. Переходы
оттенков причудливы и создают
фантастический рисунок на поверхности
камня.
Переход
нерастворимых сульфидных соединений
меди в раствор мог осуществляться за
счет взаимодействия растворов сульфата
железа (III):
.
Растворы
сульфата железа, как указано выше,
получаются в природе при действии воды,
насыщенной кислородом, на пирит. Эти
процессы медленно идут в природе и в
настоящее время. [1, с.8-10]
Медь
входит более чем в 198 минералов, из
которых для промышленности важны лишь
17. Для производства меди наибольшее
Для производства меди наибольшее
значение имеют халькопирит (он же –
медный колчедан) CuFeS2,
халькозин (медный блеск) Cu2S,
ковеллин CuS,
борнит (пестрая медная руда) Cu5FeS4.
Иногда встречается и самородная медь.
Распространение меди в земной коре
–4,7*103%
по массе (1015
— 1016
тонн).
[3]
Соединения
меди распределены в земной коре
неравномерно, что объясняется различием
в геологических условиях, сложившихся
в различных местах земного шара.
Богатейшие месторождения меди имеются
в Конго (Катангский пояс). Материалы,
собранные археологами о древнейших
месторождениях датируются тысячелетиями
до новой эры. Древнейшие выработки меди
на территории нашей страны найдены в
Закавказье, на побережье Балхаша, в
многочисленных пунктах Сибири.
Планомерные
поиски месторождений меди начинаются
при Иване III, Иване Грозном и особенно
при Петре I. При Иване Грозном в Олонецкий
При Иване Грозном в Олонецкий
уезд был послан новгородский гость
(купец) Семен Гаврилов “для сыску медные
руды”, где она и была найдена. В 1652 г.
Казанский воевода сообщил царю: “Медные
руды… сыскано много и заводы к медному
делу заводим”. [2, с.26] Из документов
следует, что с 1562 по 1664 г. было послано
из “Казани к Москве чистыя меди 4641 пуд.
6 гривенков”. В 1702 г. стала выходить
первая русская газета “Ведомости”,
которую, очевидно, редактировал Петр
I. 2 января 1703 г. в ней писали: “Из Казани
пишут. На реке Соку нашли много нефти и
медной руды, из той руды меди выплавили
изрядно, отчего чают не малую прибыль
Московскому государству”. [2, с.27]
В
начале этого столетия главнейшими
месторождениями, которые разрабатывались,
были: в районе Северного Урала –
Богословский завод, в районе Нижнего
Тагила – Выйский завод, а на Кавказе –
Калакентский и Кедабекский заводы.
В
наше время известны месторождения меди
на восточном склоне Урала, Средней Азии,
Закавказье и т. д.
д.
Большое
количество меди и других ископаемых
находится на дне океанов, которое покрыто
так называемыми конкрециями – скоплениями
в виде камней округлой неправильной
формы. Они содержат в среднем 0,5% меди.
По подсчетам ученых запасы этой ценной
и своеобразной руды составляют 5 млрд.
тонн. [1, с.16-18]
11 Объяснение запутанных химических символов – сложные проценты
Нажмите, чтобы увеличить
Большинство химических символов для элементов в периодической таблице имеют смысл; однако есть небольшой выбор, который, похоже, не имеет никакого отношения к названию своего элемента. После публикации периодической таблицы названий отклоненных элементов несколько дней назад возникли вопросы об этих элементах, поэтому давайте взглянем на их сбивающие с толку символы, а также на причины, стоящие за ними.
Натрий – Натрий (Na)
Латинское название натрия, «natrium», происходит от греческого «nítron» (название карбоната натрия). Его первоисточником, вероятно, является арабское произведение «натрун». Ряд современных языков до сих пор называют элемент натрием, а не натрием, и именно от этого имени происходит его химический символ Na.
Ряд современных языков до сих пор называют элемент натрием, а не натрием, и именно от этого имени происходит его химический символ Na.
Калий – калий (K)
«Kalium» – это латинское название калия, происходящее от арабского «al qalīy», что означает «кальцинированная зола» (зола, оставшаяся после сжигания растительного материала). Как и в случае с натрием, в ряде современных языков калий по-прежнему называется калием, и это название дает элементу его химический символ К.
Железо – Феррум (Fe)
Латинское название железа «ferrum» дает ему символ Fe; оно просто означает «железо» или «меч» и, возможно, имеет семитское происхождение. Этот элемент известен под множеством различных названий на разных языках, причем некоторые источники предполагают, что для него существует более 200 различных названий. Вот список из 213 из них.
Медь – купрум (Cu)
Нет недостатка в элементах, названных в честь мест, но название меди более тонкое, чем у большинства. Латинское название меди было «cyprium», что само по себе происходит от «kypros», греческого названия Кипра. Остров Кипр много веков назад славился своими запасами меди. Со временем название было упрощено до «купрум», а затем оно превратилось в английскую версию «медь».
Латинское название меди было «cyprium», что само по себе происходит от «kypros», греческого названия Кипра. Остров Кипр много веков назад славился своими запасами меди. Со временем название было упрощено до «купрум», а затем оно превратилось в английскую версию «медь».
Серебро – Argentum (Ag)
Считается, что латинское название серебра «argentum» происходит от индоевропейского языка, что, вероятно, связано с блеском металла. Страна Аргентина названа в честь серебра (хотя и косвенно как ссылка на Рио-де-ла-Плата) и является единственной страной, названной в честь химического элемента, а не наоборот.
Олово – Stannum (Sn)
Латинское название олова, «stannum», возможно, происходит от индоевропейского слова «stag» (капает), потому что олово плавится при низкой температуре. Есть также предположение, что оно могло быть получено из корнуоллского слова «stean» из-за знаменитых оловянных рудников Корнуолла, хотя другие утверждают, что это слово просто происходит от латыни.
Сурьма – Stibium (Sb)
Латинское слово «stibium» происходит от греческого слова «stíbi», что означает краска для глаз, относящаяся к использованию соединений сурьмы в качестве древнего косметического средства для глаз. Это слово, в свою очередь, вероятно, происходит от арабского или египетского. Сегодня немногие страны называют сурьму сурьмой, несмотря на ее символ.
Вольфрам – Вольфрам (W)
Вольфрам был назван в честь минерала, в котором он был обнаружен, вольфрамита. Это происходит от немецкого «wolf rahm» или «волчья пена», что означает количество олова, «съеденного» металлом во время его добычи. Wolfram до сих пор используется на нескольких языках. Слово «вольфрам» происходит от шведского и означает «тяжелый камень», что несколько уместно, так как это седьмой по плотности элемент в периодической таблице.
Золото – Aurum (Au)
Латинское название золота было «aurum», что означает «желтый», происходящее от слова «aurora» («рассвет»). Название «золото», используемое в германских языках, означает «желтый блестящий металл»; многие другие европейские языки используют производные от aurum.
Название «золото», используемое в германских языках, означает «желтый блестящий металл»; многие другие европейские языки используют производные от aurum.
Меркурий – Hydrargyrum (Hg)
Первоначальное латинское название Меркурия на самом деле было «argentum vivum» (живое серебро), но позднее латинское название было заимствовано из греческого «hydrargyros» (жидкое серебро) для обозначения «Hydrargyrum». Первоначальное английское название элемента было «ртуть». Алхимики считали его близким к золоту, и из-за этого они назвали его Меркурием в честь ближайшей к Солнцу планеты. Некоторым другим металлам, известным с древних времен, также были даны имена, соответствующие планетам, но Меркурий — единственный, который застрял.
Свинец — Plumbum
Латинское название свинца, «свинец», вероятно, происходит от языка, предшествующего древнегреческому. Это латинское название также является источником английских слов «сантехника» и «водопроводчик» из-за исторического использования свинца в водопроводных трубах.
Понравился этот пост и картинка? Рассмотрите возможность поддержки Compound Interest на Patreon и получайте превью предстоящих публикаций и многое другое!
Изображение в этой статье находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Ознакомьтесь с рекомендациями по использованию контента сайта.
Ссылки и дополнительная литература
- Список этимологий названий элементов – Википедия
- Elementymology & elements multidict – P van der Krogt
Нравится Загрузка…
Медь Цена, происхождение, добыча и использование
Медь (лат. Cuprum) — химический элемент с символом элемента Cu и атомным номером 29. Это переходный металл, в периодической таблице он находится в 4-м периоде и 1-й подгруппе (после новой группы счета 11) или медной группе. Латинское название cuprum происходит от (aes) cyprium «руда с греческого острова Кипр», где в древности добывали медь.
Будучи относительно мягким металлом, медь легко поддается обработке и является прочной. Как отличный проводник тепла и электричества, он находит универсальное применение. Кроме того, он также относится к группе монетных металлов.
Как слабореакционноспособный тяжелый металл, медь относится к полудрагоценным металлам.
История
Медь, золото, серебро и олово были первыми металлами, которые человечество познало в своем развитии. Поскольку медь легко обрабатывается, она уже использовалась самыми древними известными культурами около 10 000 лет назад. Время его длительного использования от 5-го тысячелетия до н.э. до 3-го тысячелетия до нашей эры. В зависимости от региона до нашей эры его также называют медным веком. Худжайрат аль-Гузлан в Иордании уже имел 4.000 т. Хр. Массовое производство меди. В алхимии медь ассоциировалась с Венерой/Женственностью ♀ (планетарными металлами) и считалась соединением серы и ртути. Из этого металла были изготовлены первые зеркала. В поздний бронзовый век Восточного Средиземноморья медь в основном добывалась на Кипре и экспортировалась оттуда в основном в виде тяжелых медных слитков весом около 30 кг в виде бычьих шкур (так называемые слитки из воловьей шкуры). Фрагменты слитков кипрской воловьей шкуры периода между 16 и 11 веками до н.э. Хр. Встречаются в значительной части Средиземноморья, вплоть до Сардинии, на Балканах и даже к северу от Альп (депо-фонд Обервильфлинген). Крупнейшим доиндустриальным производителем меди была Римская империя с предполагаемым годовым объемом производства 15 000 тонн.
В поздний бронзовый век Восточного Средиземноморья медь в основном добывалась на Кипре и экспортировалась оттуда в основном в виде тяжелых медных слитков весом около 30 кг в виде бычьих шкур (так называемые слитки из воловьей шкуры). Фрагменты слитков кипрской воловьей шкуры периода между 16 и 11 веками до н.э. Хр. Встречаются в значительной части Средиземноморья, вплоть до Сардинии, на Балканах и даже к северу от Альп (депо-фонд Обервильфлинген). Крупнейшим доиндустриальным производителем меди была Римская империя с предполагаемым годовым объемом производства 15 000 тонн.
Позже медь сплавили с оловянными и свинцовыми компонентами до бронзы. Этот более твердый и технически стойкий сплав стал названием бронзового века. Различие между свинцом и оловом было введено только с ростом знаний о металлах, так что термин бронза с сегодняшней точки зрения применяется только к сплавам олова и меди с высоким содержанием меди.
Золотисто-желтый медно-цинковый сплав «латунь» был известен еще в Древней Греции. Его плавили путем совместной обработки соответствующих руд, но интенсивно эту процедуру использовали только римляне. В древней Колумбии часто использовали золото-медный сплав Тумбага.
Его плавили путем совместной обработки соответствующих руд, но интенсивно эту процедуру использовали только римляне. В древней Колумбии часто использовали золото-медный сплав Тумбага.
Залегание
Медь встречается в земной коре с содержанием около 0,006% и поэтому по частоте встречаемости элементов в земной коре находится на 23. Местоположение. Часто медь появляется в твердом состоянии, то есть в элементарной форме. В настоящее время (2017 г.) 3000 известны во всем мире твердой меди, в том числе в Афганистане, Аргентине, Австралии, Бельгии, Боливии, Бразилии, Болгарии, Чили, Китае, Демократической Республике Конго, Германии, Финляндии, Франции, Греции, Индии, Иране. , Ирландия, Италия, Япония, Канада, Казахстан, Марокко, Мексика, Монголия, Намибия, Новая Зеландия, Норвегия, Австрия, Перу, Филиппины, Польша, Португалия, Румыния, Россия, Замбия, Швеция, Швейцария, Зимбабве, Словакия, Испания , Южная Африка, Чехия, Турция, Украина, Венгрия, Соединенные Штаты Америки (США) и Великобритания (Великобритания).
В нескольких образцах горных пород Срединно-Атлантического хребта и Луны, доставленных зондом миссии Луна-24 Моря Кризисов, была обнаружена благородная медь.
Основные производители медной руды Источник: Википедия
Медь как минерал
Медный самородок
Природные месторождения твердой меди, то есть в ее элементарной форме, были известны задолго до основания Международной минералогической ассоциации ( ИМА). Таким образом, медь признана так называемым устаревшим минералом в качестве независимого минерального вида.
Согласно классификации минералов по Штрунцу (9 издание) медь по системе №. «1.АА.05» (Элементы — Металлы и интерметаллические соединения — Семейство купалитов меди — Группа меди) соответственно в устаревшем 8. Издании, указанном под I/A.01 (серия меди). В классификации минералов по Дане, которая преимущественно используется в англоязычных странах, минерал элемента находится под номером системы. 01.01.01.03 (Золотая группа).
Медные дендриты
В природе медь обычно образуется в базальтовых лавах либо в виде «медно-красных», блестящих металлических самородков (затвердевших из расплава), либо в виде разветвленных структур, так называемых дендритов. Иногда можно найти кристальную тренировку. Медь встречается в парагенезисе с различными, в основном вторичными, медными минералами, такими как борнит, халькоцит, корнуоллит, куприт, азурит и малахит, а также тенорит, но также может быть связана со многими другими минералами, такими как кальцит, клиноклас, пренит, пумпеллиит, кварц. и серебро.
Кристаллы меди Dicey
Медные руды распространены. Например, медь получают из халькопирита (халькопирит, CuFeS2), халькоцита (халькозин, Cu2S), реже из борнита (халькопирит меди, Cu5FeS4), атакамита (CuCl2 · Cu(OH)2), малахита (Cu2[(OH) 2|CO3] ) и другие руды. В 2019 году было известно 636 минералов меди. Минералы с наибольшим содержанием меди в соединении – куприт (до 88,8%) и альгодонит (до 83,6%), а также парамелаконит, тенорит и халькоцит (до 79%). ,9%).
,9%).
Продвижение
Самым крупным производителем меди является Чили, за которым следуют Перу и США. В Европе следует отметить Польшу, Португалию и Швецию. Основные экспортеры были организованы с 1967 по 1988 год в CIPEC. В CIPEC вошли Чили, Перу и Папуа-Новая Гвинея, на чьем острове Бугенвиль один из крупнейших в мире медных рудников в 1988 году привел к гражданской войне.
Исторически значимыми были медные рудники на полуострове Кевино в Верхнем озере (США). Здесь находилось крупнейшее в мире месторождение твердой меди. Деградация происходила там уже в доколумбовые времена. В Германии медный сланец добывали на Земле Мансфельдер до 19 в.90, а в Корнуолле это в основном в 18 и 19 веках, учитывая значительную добычу меди.
Извлечение
Извлечение меди после процесса левитационной плавки
Различные способы
1. | Чили | 5.330 | 170.000 | 360.000 |
| 2. | Перу | 2,390 | 81.000 | 120.000 |
| 3. | Китайская Народная Республика | 1.860 | 27.000 | 63.000 |
| 4. | США | 1,270 | 45.000 | 70.000 |
| 5. | Австралия | 920 | 88.000 | 88.000 |
| 6. | ДР Конго | 850 | 20.000 | тыс. А. |
| 7. | Мексика | 755 | 46.000 | 50.000 |
| 7. | Замбия | 755 | 20.000 | 35.000 |
| 9. | Индонезия | 650 | 26. 000 000 | 38.000 |
| 10. | Канада | 620 | 11.000 | 20.000 |
| Другие страны | 4.300 | 260.000 | 110.000 | |
| Мир | 19.700 | 790.000 | 1.000.000 |
|---|
Наиболее важными печами для производства меди являются пламенные печи, а с 1980 года — печи для взвешенной плавки.
Процесс извлечения меди
Для производства меди сначала получают так называемый медный камень (Cu2S с различным содержанием FeS, содержание Cu около 2%) из халькопирита (CuFeS70). Для этого исходный материал обжигают с добавлением кокса, а содержащиеся в нем оксиды железа зашлаковывают кремнистыми агрегатами. Железосиликатный шлак плавает на штейне и может быть легко слит.
Röstarbeit:
Плавильные работы:
Полученный таким образом медный штейн далее перерабатывается в сырую медь (также черную медь). Для этого его заливают в конвертер с жидким свечением и в этот расплав вдувают воздух. На первом этапе (продувка шлака) содержащийся в нем сульфид железа обжигается до оксида железа, который связывается кварцем со шлаком, который можно слить. На втором этапе (Гарблазен) две трети оставшегося Cu2S окисляются до Cu2O. Затем оксид реагирует с оставшимся сульфидом с образованием сырой меди.
Для этого его заливают в конвертер с жидким свечением и в этот расплав вдувают воздух. На первом этапе (продувка шлака) содержащийся в нем сульфид железа обжигается до оксида железа, который связывается кварцем со шлаком, который можно слить. На втором этапе (Гарблазен) две трети оставшегося Cu2S окисляются до Cu2O. Затем оксид реагирует с оставшимся сульфидом с образованием сырой меди.
Пузырьки шлака:
Garblasen:
Неочищенная медь имеет содержание меди 98%. Остальные 2% содержат драгоценные металлы, такие как серебро и золото, а также неблагородные металлы, такие как железо и цинк. Электролитическое рафинирование меди проводят в сульфатсодержащем растворе сульфата меди (II) с медным неочищенным анодом и чистым медным катодом. Во время электролиза все металлы, менее благородные, чем медь, окисляются и растворяются в виде катионов, тогда как более благородные металлы оседают в виде анодного шлама.
Уравнение реакции электролитического рафинирования:
Анод
Катод
В то время как анод медленно растворяется с образованием катионов, только медь, электролитическая медь, осаждается за счет восстановления ионов меди на катоде массовая доля w (Cu) = 99,99%.
Анодный шлам, образующийся в качестве побочного продукта, позже перерабатывается и используется в качестве исходного материала для извлечения драгоценных металлов.
Добыча меди происходит в Аффинериене. В Европе головной офис Aurubis AG (ранее Norddeutsche Affinerie) находится в Гамбурге, ранее он также был медеплавильным заводом в Дуйсбурге (ныне DK Recycling).
Медь также может быть получена в виде так называемой цементной меди путем осаждения из раствора сульфата меди с железом. Процесс осаждения называется цементацией. Полученная медь часто бывает загрязнена. Осаждение меди на железо из встречающихся в природе растворов солей металлов практикуется в Китае с 1086 года нашей эры.
Медь также может быть представлена алюминотермической реакцией. Термитом служит смесь оксида меди (II) и алюминиевой крупки. Использование агента текучести (например, фтористого кальция) может увеличить выход, поскольку элементарные металлы не могут растворить образующийся шлак в агенте текучести. Алюминотермическая экстракция неэкономична из-за необходимого количества алюминия.
Алюминотермическая экстракция неэкономична из-за необходимого количества алюминия.
Извлечение меди после Schweehmmelzverfahren, источник Википедия
Свойства
Физические свойства
При плотности 8920 кг/м³ медь является одним из тяжелых металлов, который имеет кубическую центрированную поверхность и поэтому кристаллизуется. ближайшая упаковка с пространственной группой Fm3m (номер пространственной группы 225). Параметр решетки для чистой меди составляет 0,3615 нм (соответствует 3,615 Å) для 4 формульных единиц на элементарную ячейку.
Медь является очень хорошим проводником тепла. Температура ее плавления 1083,4 °С. Точно так же медь является очень хорошим проводником электричества с электропроводностью 58·106 См/м. Его проводимость лишь немного хуже, чем у серебра, и намного лучше, чем у золота. Поскольку все примеси, растворенные в меди, особенно такие примеси, как фосфор и железо, значительно снижают проводимость, для материалов проводников часто требуются самые высокие уровни чистоты.
Твердость меди по Моосу составляет от 2,5 до 3, что соответствует твердости по Виккерсу (VHN) 77-99 при испытательном усилии 100 г. Холодная штамповка повышает прочность со 150…200 МПа (литое состояние) до значений около 450 МПа. Удлинение при разрыве составляет 4,5% при значениях твердости около 100 HB. Деформированная и впоследствии отожженная медь с прочностью 200…240 МПа имеет удлинение при разрыве более 38% и значения твердости около 50 НВ.
Ковка очень возможна при температурах от 700 до 800°С. Холодные деформации хорошо поддаются без промежуточного отжига.
Так как голый металл меди имеет ярко-красный цвет, цвет линии розовый. Красный цвет обусловлен тем, что при нормальной температуре он немного больше поглощает дополнительный зеленый и синий свет. Он начинается в воздухе и становится красновато-коричневым. При дальнейшем атмосферном воздействии и коррозии гладкая поверхность теряется очень медленно (часто в течение столетий) и меняется цвет от красновато-коричневого до сине-зеленого за счет образования патины.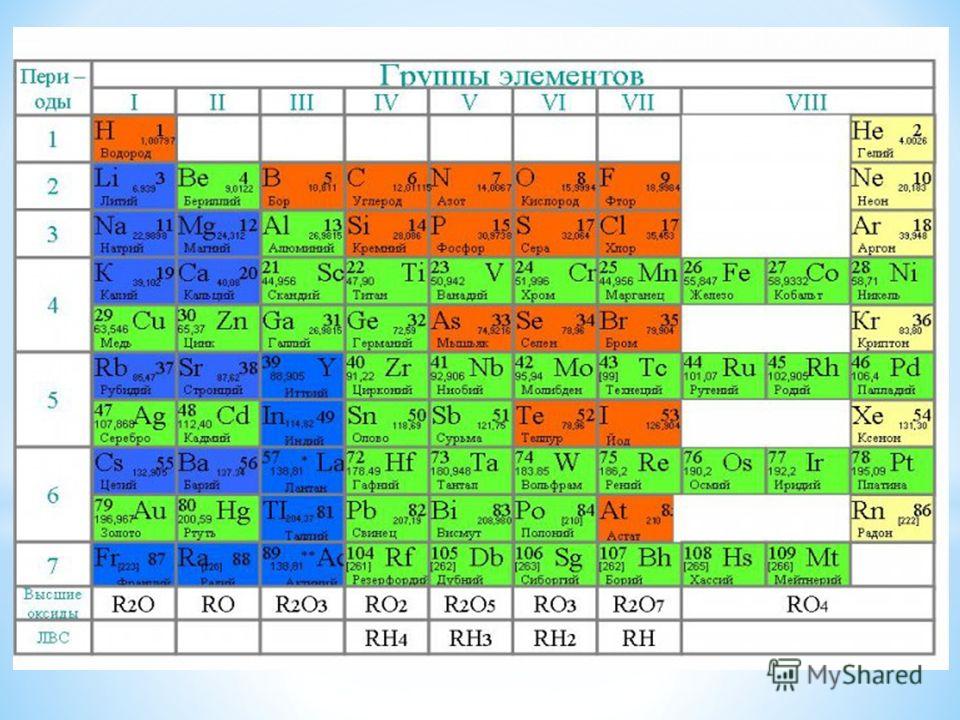
Химические свойства
Медь встречается в степенях окисления 0, + 1, + 2, + 3 и + 4, чаще всего + 1 и + 2, где + 2 является наиболее устойчивой степенью окисления в водных растворах; Уровень +4 встречается крайне редко (например, в Cs2CuF6). Соли меди (II) (например, медный купорос) имеют преимущественно синий или зеленый цвет. Медь имеет некоторые сходные химические свойства с серебром и золотом из той же группы. На железный гвоздь, погруженный в раствор сульфата меди, наносится слой металлической меди, при этом железо растворяется в виде сульфата железа, так как железо менее благородно, чем медь (см. также ряды напряжений). Медь обычно не подвергается воздействию соляной кислоты, но сильно подвергается воздействию кислорода и растворяется в горячей серной кислоте. Он также растворяется в азотной кислоте и царской водке. Смесь соляной или серной кислоты с перекисью водорода очень быстро растворяет медь. Металл также подвергается воздействию органических кислот.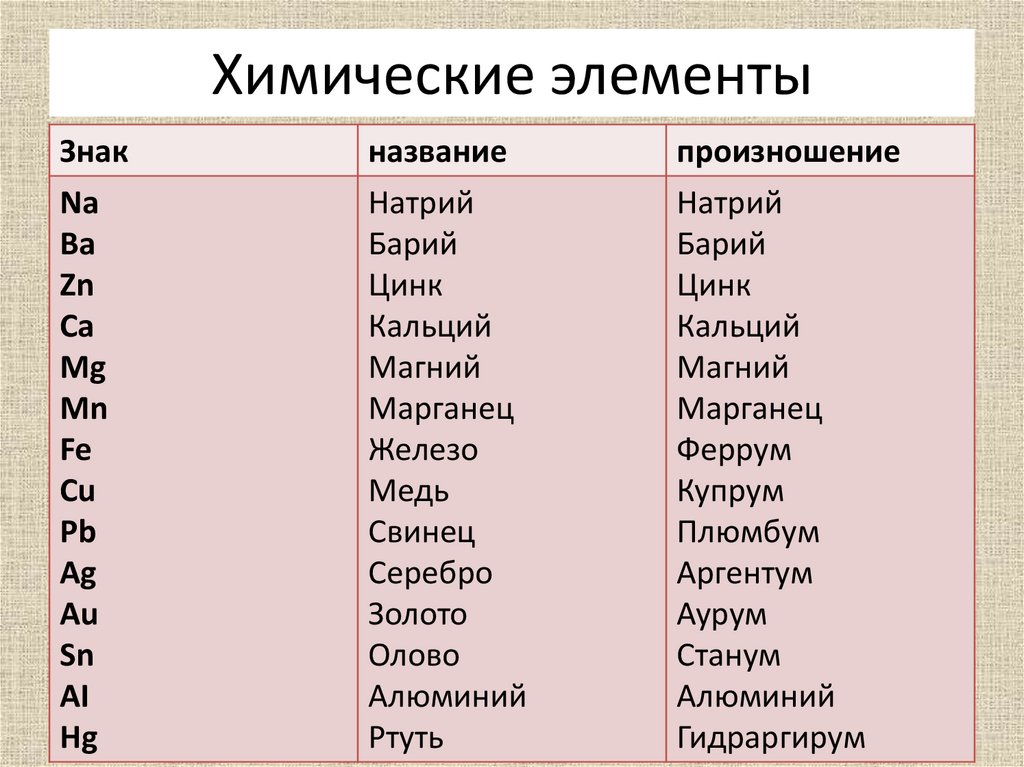 По отношению к щелочам ведет себя стабильно. При красном калении он реагирует с кислородом, образуя толстый слой оксида меди. Медь пассивируется фтором и его соединениями. В зависимости от размера зерна медный порошок бывает легковоспламеняющимся или горючим. Металл в компактном виде не горюч и не подвергается дальнейшему воздействию образования тонкого оксидного слоя воздуха и воды, поэтому устойчив к чистому воздуху и воде.
По отношению к щелочам ведет себя стабильно. При красном калении он реагирует с кислородом, образуя толстый слой оксида меди. Медь пассивируется фтором и его соединениями. В зависимости от размера зерна медный порошок бывает легковоспламеняющимся или горючим. Металл в компактном виде не горюч и не подвергается дальнейшему воздействию образования тонкого оксидного слоя воздуха и воды, поэтому устойчив к чистому воздуху и воде.
В жидкой меди растворяются кислород и водород, которые при застывании расплава могут превращаться в пар и тем самым являться причиной газовой пористости отливки.
В кислородсодержащих разновидностях меди при контакте с водородосодержащими газами могут образовываться трещины и пустоты, что приводит к так называемому водородному охрупчиванию меди.
Биологические свойства
По сравнению со многими другими тяжелыми металлами медь относительно слаба для высших организмов. Так человек может ежедневно принимать 0,04 грамма меди без ущерба для своего здоровья. В свободной, не связанной с белками форме медь обладает антибактериальными свойствами; здесь говорят, как и в случае с серебром, об олигодинамическом эффекте, почему z. B. также цветочная вода, хранящаяся в медных сосудах или в которую помещена медная монета, не так быстро загрязняется.
В свободной, не связанной с белками форме медь обладает антибактериальными свойствами; здесь говорят, как и в случае с серебром, об олигодинамическом эффекте, почему z. B. также цветочная вода, хранящаяся в медных сосудах или в которую помещена медная монета, не так быстро загрязняется.
Бактерицидные свойства
Медь токсична для многих микроорганизмов даже в низких концентрациях. Поэтому (а также из-за простоты установки) водопроводные трубы часто содержат медь. Из-за бактерицидных свойств меди ее проверяют в масштабных испытаниях, чтобы определить, имеет ли экономический смысл оборудовать больничные палаты дверными ручками с медным покрытием. Например, клиническое исследование 2008/2009 гг. показывает, что в клинике Asklepios Wandsbeck, Гамбург, после замены 50 дверных ручек/пластин и выключателей света количество микробов MRSA сократилось до 63%. Чилийское исследование показало, что от 7,2 до 19Влажность воздуха 7% снизила содержание меди на целых 92%. Многоцентровое исследование 2010/2011 гг. из США показывает, что уровень заражения в «медных помещениях» снижается почти на 60%, на самих медных предметах более чем на 80%. В 2013 году отделение педиатрии в Нидерберге, Северный Рейн-Вестфалия, было переведено на медные сплавы.
Многоцентровое исследование 2010/2011 гг. из США показывает, что уровень заражения в «медных помещениях» снижается почти на 60%, на самих медных предметах более чем на 80%. В 2013 году отделение педиатрии в Нидерберге, Северный Рейн-Вестфалия, было переведено на медные сплавы.
Токсическое действие заключается в том, что ионы меди связываются с тиоловыми группами белков и переокисляют липиды клеточной мембраны, приводя к образованию свободных радикалов, повреждающих ДНК и клеточные мембраны. У человека, например, при болезни Вильсона (болезнь накопления меди) это приводит к поражению органов с высоким избытком меди.
Медные сплавы с содержанием меди не менее 60% также проявляют токсический эффект в отношении норовирусов.
Действие против улиток
Слизь улитки окисляет медь в медной проволоке или медной фольге, которая служит барьером для находящихся под угрозой исчезновения растений. Это создает раздражающее вещество, которое мешает улитке ползти дальше.
Органические потребности в меди
В большинстве многоклеточных организмов медь является компонентом многих ферментов (металлоферментов) и, следовательно, жизненно важным микроэлементом. Медь входит в состав синего гемоцианина, который у моллюсков и членистоногих служит красителем крови для транспорта кислорода.
Суточная потребность взрослого человека составляет 1,0-1,5 миллиграмма. В организме человека медь в основном запасается в печени.
Медь в основном содержится в шоколаде, печени, злаках, овощах и орехах. Дефицит меди редко возникает у человека, в основном при длительном поносе, у недоношенных детей, после длительного недоедания или мальабсорбции при таких заболеваниях. Спру, болезнь Крона или муковисцидоз. Потребление высоких доз цинка, железа или молибдата также может привести к снижению количества меди в организме. Синдром Менкеса — редкое врожденное нарушение обмена меди.
Избыток меди выбрасывается в пищеварительную систему с желчью для выведения.
Сульфат меди (медный купорос) является сильным рвотным средством и поэтому используется для лечения многих интоксикаций, таких как белый фосфор, который в данном конкретном случае также имеет то преимущество, что одновременно связывает фосфор в виде труднорастворимого фосфида меди.
При редком наследственном заболевании Болезнь Вильсона нарушается экскреция меди и происходит увеличение накопления меди сначала в печени, затем, при этом выведение меди в кровоток, в других органах. Другим не менее редким заболеванием обмена меди является синдром Менкеса. Хотя медь может поглощаться клетками, они не могут упорядоченно транспортироваться дальше, так что в одних органах содержание меди повышено, а в других меньше.
Медь и болезнь Альцгеймера
Снова и снова обсуждалась взаимосвязь между медью и развитием болезни Альцгеймера. Уже в 2003 году исследователи предположили, что медь замедляет выработку амилоида А и что недостаток меди способствует развитию болезни Альцгеймера. Однако последующее пилотное исследование с участием 70 пациентов с болезнью Альцгеймера не показало никакого защитного эффекта от повышенного потребления меди, даже несмотря на то, что отходы Abeta42 стабилизировались в спинномозговой жидкости, маркере болезни Альцгеймера.
Однако последующее пилотное исследование с участием 70 пациентов с болезнью Альцгеймера не показало никакого защитного эффекта от повышенного потребления меди, даже несмотря на то, что отходы Abeta42 стабилизировались в спинномозговой жидкости, маркере болезни Альцгеймера.
Другие исследования показали, что медь может быть вредна для мозга. Таким образом, исследование с ионофором PBT2 в качестве активного ингредиента против болезни Альцгеймера показало хорошие результаты в исследовании фазы II. Активный ингредиент связывает не только цинк, но и медь и таким образом снижает концентрацию меди в головном мозге.
Новое исследование показывает, что медь накапливается в капиллярах головного мозга при длительном высоком потреблении и может повредить там гематоэнцефалический барьер. В результате удаление бета-амилоида затруднено, накопление вещества вызывает болезнь Альцгеймера.
Применение
Медь используется в чистом виде или в виде сплава в электроустановках, трубопроводах (отопление, вода, газ), прецизионных деталях, монетах, столовых приборах, произведениях искусства, музыкальных инструментах и многом другом.
При использовании в контакте с другими металлами вызывает контактную коррозию при воздействии влаги.
Электрический кабель (многожильный провод)
После серебра медь имеет вторую по величине электропроводность среди всех веществ даже после золота и поэтому используется среди прочего для:
электрические кабели, проволочные перемычки и силовые кабели малого сечения, воздушные линии
Следы печатных плат на печатных платах и частично в интегральных схемах
Электрические машины: проволочные обмотки в трансформаторах, индукторах/катушках и электродвигателях
Компоненты: корпуса анодов магнетронов, зажимы, ножки для соединения компонентов, держатели контактов, пресс-втулки
Хотя алюминий дешевле и, исходя из массы на длину, является лучшим проводником электричества, чем медь. Однако он объемный. У. а. Поэтому, а также из-за того, что медь лучше контактирует и обладает более высоким сопротивлением изгибу, ее обычно предпочитают в качестве проводника по сравнению с алюминием, за исключением случаев, когда речь идет о весе или цене.
Проволока и жилы из так называемой бескислородной меди (OFC, англ. для бескислородной меди чистотой >99,99%) имеют очень мелкозернистую кристаллическую структуру и особенно высокую усталостную прочность. Применяются для кабелей и проводов, подвергающихся высоким механическим воздействиям.
Для воздушных линий применяют сплавы меди и магния. Должен быть найден компромисс между увеличением прочности на разрыв и уменьшением проводимости.
Медь обладает высокой отражательной способностью в инфракрасном диапазоне и поэтому используется в качестве зеркала для излучения лазера на углекислом газе и для покрытия стекла (изоляционного стекла).
Благодаря своей высокой теплопроводности и коррозионной стойкости он хорошо подходит в качестве материала для теплообменников, радиаторов и монтажных плат силовых полупроводников.
«Брюнингталер» — медная или бронзовая курсовая монета номиналом 4 рейхспфеннига 1932 г. — изображение из Википедии
В декоративно-прикладном искусстве гонят медный лист, который деформируется чеканкой, что легко возможно благодаря его мягкости. В изобразительном искусстве медь до сих пор используется для изготовления печатных форм для гравюр и офортов.
В изобразительном искусстве медь до сих пор используется для изготовления печатных форм для гравюр и офортов.
Даже крыши покрыты медным листом, который затем образует стойкий зеленоватый налет, состоящий из различных основных меди или карбонатов меди. Эта патина, которую часто ошибочно называют «зеленью» (см. Ацетат меди), хорошо защищает основной металл от дальнейшей коррозии, поэтому медные крыши могут прослужить несколько столетий. Медные гвозди используются в традиционной шиферной крыше.
сплавы
Медная крыша для Dresden Residenzschloss, изображение: Википедия
Медь также входит в состав многих таких сплавов. Как латунь (с цинком), бронза (с оловом) и нейзильбер (с цинком и никелем). Эти медные сплавы широко используются из-за их хороших свойств, таких как цвет, коррозионная стойкость и технологичность. Деформируемые сплавы (латунь и нейзильбер) и литые материалы (бронза, бронза): Деформируемым сплавам придают желаемую форму пластическим формованием (горячее формование: прокатка, ковка и т. д. или холодное формование: волочение проволоки, ковка, холодная прокатка, глубокая вытяжка и др.), в то время как литые материалы обычно трудно или невозможно пластически формуются.
д. или холодное формование: волочение проволоки, ковка, холодная прокатка, глубокая вытяжка и др.), в то время как литые материалы обычно трудно или невозможно пластически формуются.
В зависимости от добавления никеля цвет меди исчезает и образуются коррозионно-стойкие сплавы (мельхиор) от желтоватого до белого цвета.
Многие материалы для монет изготовлены из меди, поэтому «Северное золото», называемое металлом золотых частей монет евро, представляет собой сплав меди, цинка, алюминия и олова. Монетные металлы монет 2001-DM действительны до 1, а яркие части монет евро изготовлены из мельхиоровых сплавов.
Соединения меди используются в цветных пигментах, в качестве тонеров, в медицинских препаратах и покрытиях для гальванических поверхностей.
История цен
Медь – относительно дорогой металл. Его цена во многом обусловлена основными товарными биржами и биржами товарных фьючерсов в мире. Лидером торговли медью является Лондонская биржа металлов (LME).

 236
236