Как обозначается латунь в таблице менделеева: Как обозначается латунь в таблице менделеева
Содержание
Латунь обозначение в химии в таблице менделеева
Лату́нь — двойной или многокомпонентный сплав на основе меди, где основным легирующим компонентом является цинк, иногда с добавлением олова (меньшим, чем цинка, иначе получится традиционная оловянная бронза), никеля, свинца, марганца, железа и других элементов. По металлургической классификации к бронзам не относится.
Содержание
История и происхождение названия [ править | править код ]
Несмотря на то, что цинк как химический элемент был открыт только в XVI веке, латунь была известна ещё до нашей эры [1] [2] . Моссинойки получали её, сплавляя медь с галмеем [3] , то есть с цинковой рудой. В Англии латунь была впервые получена путём сплавления меди с металлическим цинком, этот метод 13 июля 1781 года запатентовал Джеймс Эмерсон (британский патент № 1297) [4] [5] . В XIX веке в Западной Европе и России латунь использовали в качестве поддельного золота.
Во времена Августа в Риме латунь называлась орихалк (лат. aurichalcum — буквально «златомедь»), из неё чеканились сестерции и дупондии. Орихалк получил название от цвета сплава, похожего на цвет золота. Однако в самой Римской империи до завоевания Британии в I веке н. э. латунь не производилась, поскольку у римлян не было доступа к источникам цинка (которые появились и стали разрабатываться только после образования провинции Британия в составе империи), до этого цинк мог только ввозиться эллинскими и римскими торговцами, собственной его добычи в континентальной Европе и Средиземноморье не было [6] .
aurichalcum — буквально «златомедь»), из неё чеканились сестерции и дупондии. Орихалк получил название от цвета сплава, похожего на цвет золота. Однако в самой Римской империи до завоевания Британии в I веке н. э. латунь не производилась, поскольку у римлян не было доступа к источникам цинка (которые появились и стали разрабатываться только после образования провинции Британия в составе империи), до этого цинк мог только ввозиться эллинскими и римскими торговцами, собственной его добычи в континентальной Европе и Средиземноморье не было [6] .
Общая мировая потребность в цинке для изготовления латуни составляет в настоящее время около 2,1 млн т. При этом в производстве используется 1 млн т. первичного цинка, 600 тыс. т. цинка, полученного из отходов собственного производства, и 0,5 млн т вторичного сырья [ источник не указан 567 дней ] . Таким образом, более 50 % цинка, используемого в производстве латуни, получают из отходов. Технические латуни содержат обычно до 48-50 % цинка. В зависимости от содержания цинка различают альфа-латуни и альфа+бета-латуни. Однофазные альфа-латуни (до 35 % цинка) хорошо деформируются в горячем и холодном состояниях. В свою очередь двухфазные альфа+бета-латуни (до 47- 50 % цинка) малопластичны в холодном состоянии. Их обычно подвергают горячей обработке давлением при температурах, соответствующих области альфа- или альфа+бета-фаз. По сравнению с альфа-латунью двухфазные латуни обладают большей прочностью и износостойкостью при меньшей пластичности. Двойные латуни нередко легируют алюминием, железом, магнием, свинцом или другими элементами. Такие латуни называют специальными или многокомпонентными. Легирующие элементы (кроме свинца) увеличивают прочность (твёрдость), но уменьшают пластичность латуни. Содержание в латуни свинца (до 4 %) облегчает обработку резанием и улучшает антифрикционные свойства. Алюминий, цинк, кремний и никель увеличивают коррозионную стойкость латуни. Добавление в латунь железа, никеля и магния повышает её прочность.
В зависимости от содержания цинка различают альфа-латуни и альфа+бета-латуни. Однофазные альфа-латуни (до 35 % цинка) хорошо деформируются в горячем и холодном состояниях. В свою очередь двухфазные альфа+бета-латуни (до 47- 50 % цинка) малопластичны в холодном состоянии. Их обычно подвергают горячей обработке давлением при температурах, соответствующих области альфа- или альфа+бета-фаз. По сравнению с альфа-латунью двухфазные латуни обладают большей прочностью и износостойкостью при меньшей пластичности. Двойные латуни нередко легируют алюминием, железом, магнием, свинцом или другими элементами. Такие латуни называют специальными или многокомпонентными. Легирующие элементы (кроме свинца) увеличивают прочность (твёрдость), но уменьшают пластичность латуни. Содержание в латуни свинца (до 4 %) облегчает обработку резанием и улучшает антифрикционные свойства. Алюминий, цинк, кремний и никель увеличивают коррозионную стойкость латуни. Добавление в латунь железа, никеля и магния повышает её прочность.
Физические свойства [ править | править код ]
- Плотность — 8500—8700 кг/м³.
- Удельная теплоёмкость при 20 °C — 0,377 кДж·кг −1 ·K −1 .
- Удельное электрическое сопротивление — (0,07-0,08)⋅10 −6 Ом·м .
- Не является ферромагнетиком
- Температура плавления латуни в зависимости от состава достигает 880—950 °C. С увеличением содержания цинка температура плавления понижается. Латунь достаточно хорошо сваривается различными видами сварки, в том числе газовой и дуговой в среде защитных газов, и прокатывается. Технологии сварки латуни описаны в соответствующей литературе. Хотя поверхность латуни, если не покрыта лаком, чернеет на воздухе, но в массе она лучше сопротивляется действию атмосферы, чем медь. Имеет жёлтый цвет и отлично полируется.
- Висмут и свинец имеют вредное влияние на латунь, так как уменьшают способность к деформации в горячем состоянии. Тем не менее легирование свинцом применяют для получения сыпучей стружки, что облегчает её резку [7] .

Диаграмма состояния Cu — Zn [ править | править код ]
Медь с цинком образуют кроме основного α-раствора ряд фаз электронного типа β, γ, ε. Наиболее часто структура латуней состоит из α- или α+β’- фаз: α-фаза — твёрдый раствор цинка в меди с кристаллической решёткой меди ГЦК, а β’-фаза — упорядоченный твёрдый раствор на базе химического соединения CuZn с электронной концентрацией 3/2 и примитивной элементарной ячейкой.
При высоких температурах β-фаза имеет неупорядоченное расположение ([ОЦК]) атомов и широкую область гомогенности. В этом состоянии β-фаза пластична. При температуре ниже 454—468 °C расположение атомов меди и цинка в этой фазе становится упорядоченным, и она обозначается β’. Фаза β’ в отличие от β-фазы является более твёрдой и хрупкой; γ-фаза представляет собой электронное соединение Cu5Zn8.
Однофазные латуни характеризуются высокой пластичностью; β’-фаза очень хрупкая и твёрдая, поэтому двухфазные латуни имеют более высокую прочность и меньшую пластичность, чем однофазные.
Содержание цинка в меди оказывает влияние на механические свойства отожжённых латуней.
При содержании цинка до 30 % возрастают одновременно и прочность, и пластичность. Затем пластичность уменьшается, вначале за счёт усложнения α — твёрдого раствора, а затем происходит резкое её понижение в связи с появлением в структуре хрупкой β’-фазы. Прочность увеличивается до содержания цинка около 45 % , а затем уменьшается так же резко, как и пластичность.
Большинство латуней хорошо обрабатывается давлением. Особенно пластичны однофазные латуни. Они деформируются при низких и при высоких температурах. Однако в интервале температур 300—700 °C существует зона хрупкости, поэтому при таких температурах латуни не деформируют.
Двухфазные латуни пластичны при нагреве выше температуры β’-превращения, особенно выше 700 °C, когда их структура становится однофазной (β-фаза). Для повышения механических свойств и химической стойкости латуней в них часто вводят легирующие элементы: алюминий (Al), никель (Ni), марганец (Mn), кремний (Si) и т. д.
д.
Порядок маркировки [ править | править код ]
Принята следующая маркировка. Латунный сплав обозначают буквой «Л», после чего следуют буквы основных элементов, образующих сплав. В марках деформируемых латуней первые две цифры после буквы «Л» указывают среднее содержание меди в процентах. Например, Л70 — латунь, содержащая 70 % Cu. В случае легированных деформируемых латуней указывают ещё буквы и цифры, обозначающие название и количество легирующего элемента, ЛАЖ60-1-1 означает латунь с 60 % Cu, легированную алюминием (А) в количестве 1 % и железом (Ж) в количестве 1 %. Содержание Zn определяется по разности от 100 %. В литейных латунях среднее содержание компонентов сплава в процентах ставится сразу после буквы, обозначающей его название. Например, латунь ЛЦ40Мц1,5 содержит 40 % цинка (Ц) и 1,5 % марганца (Мц).
ЛАТУНИ и ЛАТУННЫЙ ПРОКАТ
Классификация латуней
Латуни – это сплавы на основе меди и цинка. По химическому составу они подразделяются на простые (только медь и цинк) и специальные (наряду с медью и цинком содержат Pb , Fe , Al , Sn и другие элементы). Химический состав латуней определен в ГОСТ 15527-2004.
Химический состав латуней определен в ГОСТ 15527-2004.
Простые латуни маркируются буквой Л и цифрой, обозначающей процентное содержание меди: Л96, Л90, Л85, Л80, Л75, Л68, Л63. Содержание цинка определяется по остатку от 100%.
Например, Л63 содержит 63% меди и 37% цинка. Простые латуни называют также двойными латунями (два основных компонента).
Специальные латуни кроме цинка содержат и другие легирующие элементы. Их маркировка включает в себя дополнительные буквы и цифры, указывающие легирующие элементы и их содержание в %. Содержание цинка определяется по остатку от 100%. Например ЛС59-1 содержит 59% меди, 1% свинца и 40% цинка. Многокомпонентные латуни делятся на классы, которые называются по основному (кроме цинка) легирующему элементу.
В таблице представлены основные марки латуней. Они используются как для литья (литейные), так и для производства проката (деформируемые). Некоторые латуни используются для сварки и пайки (ГОСТ 16130-90).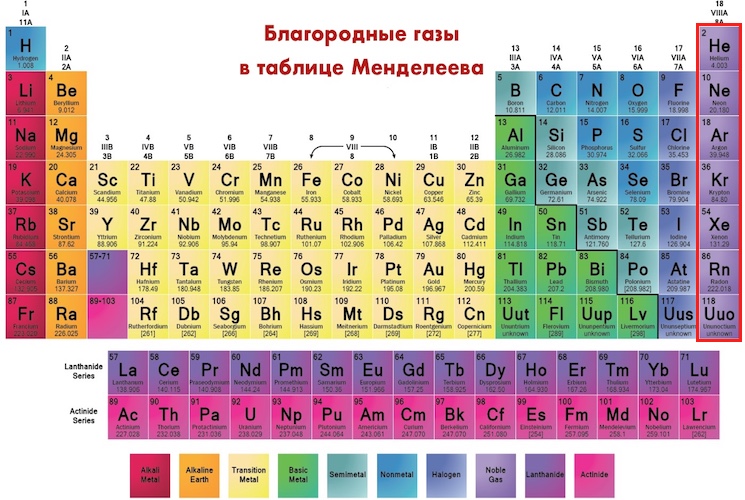 В таблице они выделены желтой заливкой.
В таблице они выделены желтой заливкой.
| ПРОСТЫЕ | АЛЮМИНИЕВЫЕ | КРЕМНИСТЫЕ | ОЛОВЯННЫЕ | СВИНЦОВЫЕ |
| Л96 | ЛА85-0.5 | ЛК80-3 | ЛО90-1 | ЛС74-3 |
| Л90 | ЛА77-2 | ЛК62-0.5 | ЛО70-1 | ЛС64-2 |
| Л85 | ЛА67-2.5 | ЛКС65-1.5-3 | ЛО62-1 | ЛС63-3 |
| Л80 | ЛАЖ60-1-1 | ЛО60-1 | ЛС59-1 | |
| Л75 | ЛАН59-3-2 | МАРГАНЦЕВЫЕ | ЛОК59-1-0.3 | ЛС59-2 |
| Л70 | ЛЖМц59-1-1 | ЛС58-2 | ||
| Л68 | ЛАНКМц 75-2-2. 5-0.5-0.5 5-0.5-0.5 | ЛМц58-2 | НИКЕЛЕВЫЕ | ЛС58-3 |
| Л63 | ЛМцА57-3-1 | ЛН65-5 | ЛЖС58-1-1 |
Структура латуней.
В зависимости от химического состава латуни могут быть однофазными, двухфазными и многофазными.
Большинство простых латуней и некоторые специальные латуни являются о днофазными ( ? -латуни) и представляют собой твердый раствор цинка в меди ( ? -фаза). Они обладают хорошей пластичностью во всем интервале температур, поэтому однофазные ? -латуни, например Л68, хорошо обрабатываются давлением при высоких и низких температурах.
Двухфазные латуни содержат включения твердых и хрупких фаз, например ? -фазу. ( ? + ? ) латуни и другие двухфазные латуни ограниченно обрабатываются давлением (например, только при высоких температурах).
С винцовые латуни имеют структуру ( ? + Pb ) или ( ? + ? + Pb ). Практически не растворяясь в латуни, свинец присутствует в виде самостоятельной фазы, что обеспечивает отличную обрабатываемость резанием.
С увеличением содержания легирующих элементов могут возникать дополнительные твердые и хрупкие фазы. Поэтому легирование дополнительной компонентой обычно не превышает 0.5 – 3 % (см. таблицу марок латуней).
Фазовый состав определяет принадлежность к классу литейных или деформируемых латуней, возможность выпуска различных полуфабрикатов и их свойства. Подробнее о структуре латуней – Структура и свойства сплавов.
Общие свойства латуней
Простые латуни.
Твердость, предел текучести, предел прочности и пластичность простых латуней выше, чем у меди. В целом эти показатели растут с увеличением содержания цинка. Наилучшей пластичностью обладает Л68 (наибольшая глубина вытяжки для листов, наибольшее число перегибов для проволоки). В Л63 количество ? -фазы незначительно и оно мало отражается на пластичности Л63 и её способности к обработке давлением при низких температурах, но требует строгого соблюдения режима охлаждения.
В Л63 количество ? -фазы незначительно и оно мало отражается на пластичности Л63 и её способности к обработке давлением при низких температурах, но требует строгого соблюдения режима охлаждения.
Из простых латуней производится прокат всех видов. Все простые латуни имеют хорошие литейные свойства и могут использоваться для производства отливок. Антифрикционными свойствами простые латуни, также как и медь, не обладают.
Специальные латуни.
Специальные латуни обладают большей прочностью, лучшей коррозионной стойкостью к большему числу сред по сравнению с простыми латунями. Большинство специальных латуней имеют хорошие антифрикционные свойства.
Многие из них устойчивы к морской воде (оловянные, алюминиевые, кремнистые. марганцевые), перегретому пару (марганцевые латуни) и т.д. Некоторые из них сочетают отличные коррозионные свойства с хорошими антифрикционными свойствами (ЛК65-1.5-3, ЛО90-1, ЛЖМц59-1-1). Особая стойкость отдельных латуней к конкретным средам в специфических условиях эксплуатации определяет сферу их преимущественного применения. Например, оловянные латуни называют «морскими латунями».
Например, оловянные латуни называют «морскими латунями».
Самыми распространенными являются свинцовые латуни. Их главное свойство – отличная обрабатываемость резанием. Это проявляется в возможности скоростной обработки заготовок с малым износом инструмента. При этом образуется мелкая сыпучая стружка, что определяет чистоту обрабатываемой поверхности и минимальный наклеп при резании. Это определяет применение свинцовых латуней для изготовления мелкоразмерных деталей для точной механики. Их отрицательной стороной является низкая ударная вязкость, низкая прочность на изгиб при наличии надреза. Самой распространенной из свинцовых латуней является ЛС59-1.
Наилучшую обрабатываемость имеет латунь ЛС63-3. По отношению к ней оценивают обрабатываемость цветных металлов и углеродистых сталей (в процентах).
Практически все латуни являются хорошим конструкционным материалом при низких температурах. Также как и медь они сохраняют пластичность и не становятся хрупкими при охлаждении вплоть до гелиевых температур.
За счет более высоких температур рекристаллизации (300-370 о С ) ползучесть латуней при высоких температурах меньше, чем у меди. В зоне средних температур (200-600 о С ) в латунях наблюдается явление хрупкости. Оно связано с образованием хрупких межкристаллических прослоек из нерастворимых при низких температурах примесей (свинец, висмут). С повышением температуры ударная вязкость латуней уменьшается.
Электро- и теплопроводность латуней заметно ниже, чем у меди.
Некоторые параметры физических и механических свойств наиболее распространенных латуней (в сравнении с медью) приведены в таблице:
| МАТЕРИАЛ | МЕДЬ | Л68 | Л63 | ЛС59-1 | ЛЖМц59-1-1 |
| УДЕЛЬНОЕ ЭЛЕКТРОСОПРОТИВЛЕНИЕ | 0.018 | 0. 064 064 | 0.065 | 0.065 | 0.093 |
| ТЕПЛОПРОВОДНОСТЬ | 0.925 | 0.28 | 0.25 | 0.25 | 0.18 |
| УДАРНАЯ ВЯЗКОСТЬ | 17 | 17 | 14 | 5 | 12 |
| ПРЕДЕЛ ПРОЧНОСТИ НА СРЕЗ, МПа | 210 | 200 | 240 | 260 | 300 |
| ОБРАБАТЫВАЕМОСТЬ. % | 18 | 30 | 40 | 80 | 25 |
Механические свойства латунного проката
Из латуней производятся практически все виды проката.
Прутки латунные (круглые, шестигранные и квадратные) выпускаются по ГОСТ 2060-2006. Номиналы и состояния прутков различных марок приведены в таблице.
Маркировка латуни
Марка
Все двухкомпонентные латуни хорошо обрабатываются давлением. Их поставляют в виде труб и трубок разной формы сечения, листов, полос, ленты, проволоки и прутков различного профиля.
Латунные изделия с большим внутренним напряжением (например, нагартованные) подвержены растрескиванию. При длительном хранении на воздухе на них образуются продольные и поперечные трещины. Чтобы избежать этого, перед длительным хранением необходимо снять внутреннее напряжение, проведя низкотемпературный отжиг при 200-300 C.
Количество марок многокомпонентных латуней больше, чем двухкомпонентных.
Марку этих латуней составляют следующим образом:
– первой, как в простых латунях, ставится буква Л;
– вслед за ней – ряд букв, указывающих, какие легирующие элементы, кроме цинка, входят в эту латунь;
– затем через дефисы следуют цифры, первая из которых характеризует среднее содержание меди в процентах, а последующие – каждого из легирующих элементов в той же последовательности, как и в буквенной части марки.
Порядок букв и цифр устанавливается по содержанию соответствующего элемента: сначала идет тот элемент, которого больше, а далее по нисходящей. Содержание цинка определяется по разности от 100%.
Например: марка ЛАЖМц66-6-3-2 расшифровывается так: латунь, в которой содержится 66 % Cu, 6 %Al, 3 % Fe и 2 % Mn. Цинка в ней 100-(66+6+3+2)=23 %.
Основными легирующими элементами в многокомпонентных латунях являются алюминий, железо, марганец, свинец, кремний, никель. Они по-разному влияют на свойства латуней:
Марганец повышает прочность и коррозионную стойкость, особенно в сочетании с алюминием, оловом и железом.
Олово повышает прочность и сильно повышает сопротивление коррозии в морской воде. Латуни, содержащие олово, часто называют морскими латунями.
Никель повышает прочность и коррозионную стойкость в различных средах.
Свинец ухудшает механические свойства, но улучшает обрабатываемость резанием. Им легируют (1-2 %) латуни, которые подвергаются механической обработке на станках-автоматах. Поэтому эти латуни называют автоматными.
Поэтому эти латуни называют автоматными.
Кремний ухудшает твердость, прочность. При совместном легировании кремнием и свинцом повышаются антифрикционные свойства латуни и она может служить заменителем более дорогих, например оловянных бронз, применяющихся в подшипниках скольжения.
Применение специальных латуней:
ЛАЖ60-1-1 – Трубы, прутки
ЛЖМц59-1-1 – Полосы, прутки, трубы, проволока
ЛЦ40С – Арматура, втулки, сепараторы шариковых и роликовых подшипников и др.
ЛЦ40Мц3Ж – Сложные по конфигурации детали, арматура, гребные винты и их лопасти и др.
Оборудование для литья латуни — О металле
Оборудование для литья латуни
Металлы и сплавы – в буквальном смысле слова основа человеческой цивилизации. Чистые металлы не так уж часто применяются в народном хозяйстве, а вот сплавы используются повсеместно.
Это не удивительно, так как сплав объединяет в себе свойства нескольких веществ в самой лучшей пропорции.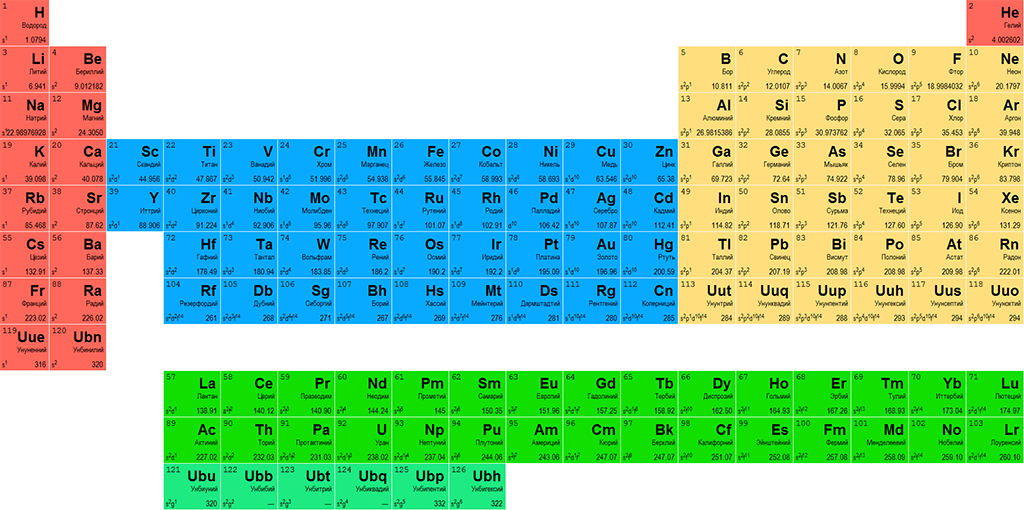
Данная статья рассказывает о производстве и обработке расплава латуни, подготовке материала, составе, свойствах и применении материала.
Структура и хим. состав латуни — вопрос весьма важный. Латунь – двух- или многокомпонентный твердый раствор – сплав, на основе меди и цинка. Известна латунь чрезвычайно давно, еще со временем Древнего Рима, и используется до сих пор. Свойства ее зависят от количественного состава.
Традиционный состав латуни – 70% меди и 30% цинка. Цинк повышает механические и технологические качества сплава, и при этом удешевляет его, поскольку является металлом более доступным по стоимости. На практике применение растворов с долей цинка большей чем 50% встречается редко.
Латунь отличается очень красивым золотистым цветом. Однако без защитного слоя – лака, например, довольно быстро темнеет. В довольно большом количестве случаев это свойство недостатком не считают.
Маркируется сплав в зависимости от состава. Обозначается латунь буквой «Л», затем следует цифра, указывающая на долю меди – 70, например. Если сплав легировался, то все добавки указываются по уменьшению их доли, а затем указывается и состав. Например, ЛАЖ60-1-1 означает, что в латуни 60% меди, и что сплав легирован алюминием – 1% , и железом – 1%.
Если сплав легировался, то все добавки указываются по уменьшению их доли, а затем указывается и состав. Например, ЛАЖ60-1-1 означает, что в латуни 60% меди, и что сплав легирован алюминием – 1% , и железом – 1%.
О том, как горит латунь, и как происходит плавка материала дома, расскажет данный видеоролик:
Классифицируют составы по доле цинка:
- если его содержание составляет 5–20%, латунь называют красной – томпак;
- если доля цинка колеблется в диапазоне 20–36%, сплав носит название желтая латунь;
- сплав с долей цинка в 48–50% называют техническим.
При производстве латуни более 50% цинка получают из переработки вторичного сырья, поэтому сплав можно отнести к довольно экологичной продукции.
Разделение по качеству дополнительных ингредиентов
Сплавы разделяют и по количеству, и качеству дополнительных ингредиентов.
Двухкомпонентные
Двухкомпонентные включают в себя только медь и цинк. Здесь на свойства сплава сильно влияет фазовый состав. Медь способна растворить не более 39% цинка.
Медь способна растворить не более 39% цинка.
Причем при увеличении температуры растворимость уменьшается, образуется при этом только однофазный раствор – α-фаза.
Такие сплавы называют α-латунями, они отличаются высокой пластичностью и достаточно прочны, если доля цинка достигает 30%.
При увеличении доли цинка часть металла уже не растворяется и формируется двухфазный раствор – α+β’-латунь. β’– фаза более твердая, но и более хрупкая, поэтому такой сплав прочнее, но пластичность теряет.
Эта особенность обуславливает и не совсем обычный метод обработки. Так, для холодной обработки – фигурные профили, проволока, используется только α-латунь, поскольку ее пластичность высока при низкой температуре, а в температурном диапазоне от +300 до +700 С резко падает, так что при нагреве деформировать латунь бесполезно. А вот α+β’-растворы обрабатывают именно при высокой температуре.
Многокомпонентные
Многокомпонентные в качестве добавок могут содержать:
- никель – увеличивает коррозийную стойкость;
- кремний – уменьшает прочность, но совместно со свинцом придает антифрикционные свойства;
- свинец – не более 4%, уменьшает прочность, но облегчает механическую обработку.
 Такие латуни часто называют автоматными;
Такие латуни часто называют автоматными; - железо – уменьшает рост зерен, что улучшает механические свойства сплава;
- олово – не больше, чем доля цинка. Иначе сплав превращается в одну из разновидностей бронзы. Олово придает сплаву стойкость к действию морской воды, за что такая латунь и получила название морской;
- марганец – увеличивает стойкость к коррозии, способствует прочности.
Далее мы рассмотрим технологии и оборудование для литья латуни, формы, температуру и другие важные нюансы производства латуни в России.
Производство металла
Поскольку основным компонентом латуни является медь, то материал относят к медным сплавам. Схема производства достаточно проста. Однако с технологической точки зрения процесс оказывается сложным, поскольку требует очень четкого соблюдения температурных режимов и обработки сырья и заготовки.
В общем виде получение сплава выглядит так:
- расплавление меди в специальных тиглях;
- введение цинка;
- введение дополнительных компонентов – железа, никеля;
- разливка в формы;
- закалка – штампованием или вытягиваем.

Дело осложняется еще и тем, что условия получения сплавов во многом зависит от состава сплава и его назначения.
Ниже дано видео о плавке латуни в домашних условиях.
В видео ниже рассказывается, как произвести и расплавить латунь в домашних условиях:
Производство латуни следует начать с получения меди из медной руды. На деле это сложное полиметаллическое сырье, в котором доля меди как раз невелика. Главными компонентами являются пустая руда, железо и медь, и первый этап получения латуни сводится к тому, чтобы отделить медь от других составляющих.
Получение сырья
Процесс это исключительно сложный, так как его целью является перевод сырья из единой многокомпонентной смеси в гетерогенную систему, состоящую из нескольких фаз с разным составом и разными свойствами.
Только после этого фазы можно отделить друг от друга и получить пригодные для дальнейшего использования составы.
Применяют для этого самые разные методики: в некоторых случаях извлекаемая фаза дополнительно обогащается «главным» металлом, в других, наоборот – обедняется, в третьих прибегают к механическим методам отделения, когда фазы, например, отличаются растворимостью и так далее.
Чаще всего используют следующие два способа.
- Пирометаллургическая технология предполагает переработку медной руды с последующим рафинированием черновой меди. Включает плавку, конвертирование медного штейна, огневое рафинирование – по сути, очистка от крупных примесей, и электролитическое. Последнее позволяет не только провести глубокую очистку меди, но и извлечь какие-либо сопутствующие компоненты, если они представляют ценность.
- Гидрометаллургический метод применяется при использовании бедной медной руды. Суть его сводится к выщелачиванию – воздействию серной кислоты, сернокислого железа. Для этого руду измельчают и растворяют в растворителях, а затем добывают медь либо методом цементации – осаждению чистой меди на железе, для чего используют обычные обрезки листа и проволоки, либо электролизом.
Таким образом удается полностью извлечь медь даже из самой бедной руды.
Получение цинка тоже имеет свои особенности, но, в общем, является более простым процессом.
О том, можно ли сварить латунь в домашних условиях и как ее производят на заводе, расскажем ниже.
Метод получения сплава
Выплавка латуни зависит от состава сплава. Здесь необходимо учитывать и разную температуру кипения металлов, и разную способность к окислению.
- Плавка с чистым металлом – при использовании оборотных металлов шихта может загружаться в любом порядке. Если же в шихте наличествует чистый металл, то сначала расплавляют медь, а потом оборотные металлы. Цинк и свинец, если он есть, вводят в расплав в последнюю очередь, предварительно, нагретыми до 100–120 С. Плавка производится под слоем древесного угля, который загружается с первой порцией шихты.
- Плавка кремнистой латуни – такой состав склонен поглощать восстановительные газы, поэтому здесь древесный уголь не применяется. Плавку проводят под покровным флюсом – стеклом или бурой, чтобы предупредить взаимодействие с кислородом. Первой в печь загружают медь, затем отходы и меднокремнистую лигатуру.
 Цинк загружают в расплав последним, после того как будет удален шлак.
Цинк загружают в расплав последним, после того как будет удален шлак. - Плавка марганцовой латуни – проводится под древесным углем или флюсом из стекла. В этом случае последним вводится марганец вместе с лигатурами, после того как расплавляются все остальные ингредиенты.
Изготовление листа
Обычная форма выпуска латуни – листы и проволока. В общем виде процесс происходит таким образом.
- Слитки из плавильного цеха попадают в прокатный, где прогреваются в печи до температуры деформации –790–830 С.
- На стане слитки деформируются до размеров и толщины заготовки.
- Заготовка в виде рулона поступает на сварку, а затем подвергается двухстороннему фрезерованию.
- Затем полуфабрикат возвращается в прокатный цех, где на трехклетьевом стане прокатки его прокатывают до получения заданной толщины листа.
- Готовую полосу разрезают на мерные длины.
- Листы отжигаются в камерных печах, а затем протравливаются в травильных ванных.

- Материал вновь деформируют до конечной толщины и снова протравливают.
Про оборудование для литья латуни на заводе по ее изготовлению читайте ниже.
Так как медь – металл востребованный, то на производстве реализуются методы извлечения меди как из богатых, так и очень бедных руд. Так что сырьем может выступать практически любая руда, содержащая хоть какую-то долю металла.
Литье под давлением
Литье под давлением – это высокопроизводительный автоматизированный технологический процесс создания тонкостенных деталей из цветных металлов, стали и пластмасс.
С высокой скоростью жидкий расплав заполняет пресс форму. и далее в результате под давлением получаются отливки заданной формы.
Эта статья подробно описывает технологию, оборудование и изделия, которые можно получить при помощи метода.
Описание технологических операций
Процесс литья под давлением осуществляется в стальных пресс-формах. Расплавленный материал подаётся в пресс-форму и кристаллизуется там под воздействием высокого давления.
Пресс-форма это технологическая литейная оснастка, сконструированная из подвижной и неподвижной стальных частей. Подвижная половина передвигается по направляющим цилиндрам, неподвижная закреплена на стационарной плите.
Перед заливкой подвижная часть плотно прижимается к неподвижной гидроцилиндром и фиксируется в этом положении специальными замками. После застывания заготовки, подвижная часть оборудования отъезжает, а отливку выталкивают механические толкатели.
Перед смыканием пресс-формы, контактирующие с расплавленным металлом поверхности, покрывают разделительной смазкой.
Специальный состав обеспечивает беспрепятственное отделение отливок после литья, защищает сталь от негативного воздействия высоких температур.
Литье под давлением выполняется в автоматизированном режиме в промышленных установках. Главными узлом этого оборудования выступает камера для прессования, она бывает холодной или горячей.
Холодная камера – это горизонтальный цилиндр, с поршнем внутри и воронкой, предназначенной для заливания расплава. После заливки металла, поршень движется внутри цилиндра, нагнетая расплав в пресс-форму.
После заполнения формы повышается усилие на поршень для создания достаточной величины давления для кристаллизации металла.
Горячая камера для прессования представляет собой ванну с расплавом, которая расположена в подогреваемом чугунном тигле. Поступательное движение поршня выталкивает расплав из тигля. Металл поднимается по каналу и поступает в пресс-форму. В конструкции канала предусмотрен подогреваемый мундштук. Этот элемент нужен, чтобы жидкий металл не затвердевал внутри.
После застывания детали, остатки расплава из канала сливаются обратно в чугунную ванну. Оборудование этого типа применяется для изделий из сплавов цинка и магния.
Оборудование этого типа применяется для изделий из сплавов цинка и магния.
Температура нагрева расплава
Нагрев материала для литья под давлением осуществляется исходя из марки сплава и геометрических параметров детали. Если расплав перегрет, при заполнении пресс-формы брызги попадают в отверстия для вентиляции и закупоривают их. Это приводит к ухудшению газоотвода и, как следствие, к возникновению пор в отливке.
Высокая температура жидкого металла приводит к увеличению времени затвердевания изделия, как следствие нужно больше времени на весь технологический процесс.
Увеличивается износ оборудования из-за длительного соприкосновения с перегретым расплавом.
Возрастает опасность приваривания заливаемого металла к оборудованию, из-за этого может повредиться деталь при выталкивании. Всё это приводит к быстрому износу пресс-формы.
При литье под давлением расплав спрессовывают при минимальной температуре. Цветные металлы нагревают всего на 10–300ºС выше температуры, при которой сплав полностью твердеет. При небольших толщинах элементов отливки сплав нужно нагревать сильнее. Для литья больших изделий простой конфигурации сплав нагревают чуть выше температуры плавления.
При небольших толщинах элементов отливки сплав нужно нагревать сильнее. Для литья больших изделий простой конфигурации сплав нагревают чуть выше температуры плавления.
Для деталей, к которым предъявляются высокие требования по прочности, металл заливают в твердо жидком состоянии. За счет этого обеспечиваются следующие преимущества:
- предотвратить появление усадочных дефектов в отливке;
- снизить тепловое воздействие на оборудование;
- снизить время охлаждения изделия;
- уменьшить опасность приваривания пресс-формы и отливки.
Металл с включениями твёрдой фазы можно прессовать только в установках, с холодной камерой. При использовании оборудования с горячей камерой есть риск застывания расплава в подводящем канале.
Пример литья под давлением деталей из алюминия – процент твёрдых частиц в расплаве, когда пресс-форма беспрепятственно заполняется, а качество отливки остаётся на высоком уровне, составляет от 40 до 60%.
Скорость подачи расплава в пресс-форму
Поршень спрессовывает металл в пресс-форму с определённой скоростью. Значение выбирается в зависимости от характеристик сплава и геометрических параметров отливки.
Если изделие простое с толстыми стенками высокая скорость прессования не нужна. Если деталь имеет сложную геометрию и тонкие элементы скорость запрессовки должна быть высокой.
Это требуется, чтобы расплав успел заполнить все узкие полости до затвердевания.
Слишком большая скорость подачи расплавленного материала становится причиной следующего явления: струя разделятся на мелкие капли, образуя смесь расплава и воздуха. Если количество каналов для отвода газов недостаточно или они забиты металлом, пузырьки воздуха останутся в отливке. Это приведёт к образованию пор в металле, чтобы исключить такие дефекты пресс-форму помещают в вакуум.
От скорости движения расплава зависит качество отливок и долговечность оборудования. Если скорость литья под давлением слишком высокая, то защитную смазку с соприкасающихся с жидким металлом поверхностей может смыть. Из-за этого отливка приварится к пресс-форме, и при выталкивании ее может повредить или сломать.
Слишком медленная подача, снизит качество детали. Металл будет застывать прямо во время заполнения формы до того, как усилие будет увеличено. Скорость поступления расплава в пресс-форму при литье под давлением обычно выбирается в диапазоне от 10 до 50 м/с. Небольшую скорость используют для литья деталей из стали, медных сплавов, высокая скорость требуется для сплавов олова и цинка.
Давление на расплав при застывании
В момент, когда расплав полностью заполняет пресс-форму, усилие на поршень многократно увеличивается. Воздействие давлением не прекращается до тех пор, пока металл полностью не затвердеет.
В результате возрастает плотность и механические характеристики отливки, в ней не образуются усадочные дефекты.
При повышении усилия сжатия уменьшается количество бракованных изделий, растёт чистота поверхности металла, повышается качество отливок.
Чем выше требования к прочности детали, тем больше должно быть усилие прессования. Алюминиевые сплавы прессуют давлением от 40 до 200 МПа. Для сплавов на основе магния используют от 40 до 180 МПа. Цинковые сплавы повергают давлению от 10 до 50 МПа. Для обеспечения высокого качества при увеличении толщины стенки нужно повышать давление при кристаллизации.
Температура подогрева пресс-формы
Перед подачей жидкого сплава литейное оборудование нужно нагреть до определённой температуры, которая подбирается для каждого сплава в зависимости от толщины стенок изделия. Температура предварительного подогрева пресс-формы:
- для литья цинка до 120–1600 ºС;
- магния 200–2400 ºС;
- алюминия 180–2500 ºС;
- стали 200–2800 ºС;
- латуни 280–3200 ºС.
Если отливка тонкостенная – пресс-форму нагревают до температуры ближе к большим значениям указанных выше интервалов. Для толстостенных деталей – ближе к нижнему значению. Это нужно чтобы в тонкостенных отливках расплав не затвердел в процессе заполнения формы. В технологии заливки больших деталей напротив необходимо увеличить скорость застывания.
Для толстостенных деталей – ближе к нижнему значению. Это нужно чтобы в тонкостенных отливках расплав не затвердел в процессе заполнения формы. В технологии заливки больших деталей напротив необходимо увеличить скорость застывания.
Преимущества и недостатки литья под давлением
Отливки, выполненные на установках для литья под давлением – это детали, с низкой шероховатостью, высокой точностью исполнения, которым не нужна механическая обработка или она минимальна. После литься детали поступают на отрезные прессы, где с них удаляются литники и промывники.
Состоящий из небольшого количества операций процесс может быть полностью автоматизирован. Из-за простоты операций, быстрого затвердевания металла и автоматического извлечения изделий этот процесс является высокопроизводительным.
Недостаток технологии – это сложность и высокая стоимость технологической оснастки. Экономически не рационально использовать литье под давлением в средне серийном и мелкосерийном производстве. Способ не подходит для литья тугоплавких металлов, которые плавятся при температуре выше, чем сталь.
Эту технологию не применяют для изготовления больших отливок, так как преимущества метода пропадают из-за неравномерного затвердевания, а из-за высокой цены габаритного высокоточного оборудования использование этого способа экономически нецелесообразно.
Применение
Литье под давлением изготавливают тонкостенные детали со сложной геометрией. Этой технологией делают изделия из меди, алюминия, цинка, магниевых сплавов, сталей и пластика. Эта технология позволяет выполнять геометрически сложные отливки с толщиной элементов до 1 мм.
Литье под давлением применяют в следующих отраслях промышленности:
- приборостроение;
- автомобилестроение;
- самолётостроение;
- станкостроение;
- изготовление элементов смесителей.

- производство бытовой техники;
Литье под давлением широко используют для производства изделий из полиэтилена, полипропилена и других синтетических материалов. Из-за большой стоимости применяемой оснастки эта технология экономически обоснована только в массовом или крупносерийном производстве.
Сегодня ни одно машиностроительное предприятие, массово изготавливающее детали бытовой техники, приборы, двигатели внутреннего сгорания и другие высокотехнологичные механизмы, не может обойтись без установок для литья под давлением.
Технологии производства, состав и структура сплава латуни
Металлы и сплавы – в буквальном смысле слова основа человеческой цивилизации. Чистые металлы не так уж часто применяются в народном хозяйстве, а вот сплавы используются повсеместно.
Это не удивительно, так как сплав объединяет в себе свойства нескольких веществ в самой лучшей пропорции.
Данная статья рассказывает о производстве и обработке расплава латуни, подготовке материала, составе, свойствах и применении материала.
Структура и хим. состав латуни — вопрос весьма важный. Латунь – двух- или многокомпонентный твердый раствор – сплав, на основе меди и цинка. Известна латунь чрезвычайно давно, еще со временем Древнего Рима, и используется до сих пор. Свойства ее зависят от количественного состава.
Традиционный состав латуни – 70% меди и 30% цинка. Цинк повышает механические и технологические качества сплава, и при этом удешевляет его, поскольку является металлом более доступным по стоимости. На практике применение растворов с долей цинка большей чем 50% встречается редко.
Латунь отличается очень красивым золотистым цветом. Однако без защитного слоя – лака, например, довольно быстро темнеет. В довольно большом количестве случаев это свойство недостатком не считают.
Маркируется сплав в зависимости от состава. Обозначается латунь буквой «Л», затем следует цифра, указывающая на долю меди – 70, например. Если сплав легировался, то все добавки указываются по уменьшению их доли, а затем указывается и состав. Например, ЛАЖ60-1-1 означает, что в латуни 60% меди, и что сплав легирован алюминием – 1% , и железом – 1%.
Например, ЛАЖ60-1-1 означает, что в латуни 60% меди, и что сплав легирован алюминием – 1% , и железом – 1%.
О том, как горит латунь, и как происходит плавка материала дома, расскажет данный видеоролик:
Классифицируют составы по доле цинка:
- если его содержание составляет 5–20%, латунь называют красной – томпак;
- если доля цинка колеблется в диапазоне 20–36%, сплав носит название желтая латунь;
- сплав с долей цинка в 48–50% называют техническим.
При производстве латуни более 50% цинка получают из переработки вторичного сырья, поэтому сплав можно отнести к довольно экологичной продукции.
Оборудование для литья латуни — Справочник металлиста
Медь — один из первых металлов, освоенных человечеством.
Медь
Благодаря низкой температуре плавления и высокой пластичности она не теряет своей популярности уже пятое тысячелетие. Красный металл широко используется как в промышленности, так и в домашних условиях для изготовления украшений, поделок и деталей путем литья из меди.
В промышленных условиях используются такие технологии, как
Литье меди
- Литье меди в формы
- Порошковая металлургия
- Гальваническое нанесение покрытия
- Горячий и холодный прокат
- Штамповка из листов
- Волочение проволоки
- Механическая обработка
Они требуют сложного и дорогого профессионального оборудования, высокой квалификации персонала и сопровождаются высокими энергозатратами.
Проволочное волочение меди
В домашних условиях небольшой мастерской применяются простые технологии, во многом повторяющие приемы работы мастеров медного века. Это медное литье и волочение проволоки, а также ковка и чеканка. Несмотря на простоту и древность технологических приемов, домашние мастера достигают высокого качества изделий.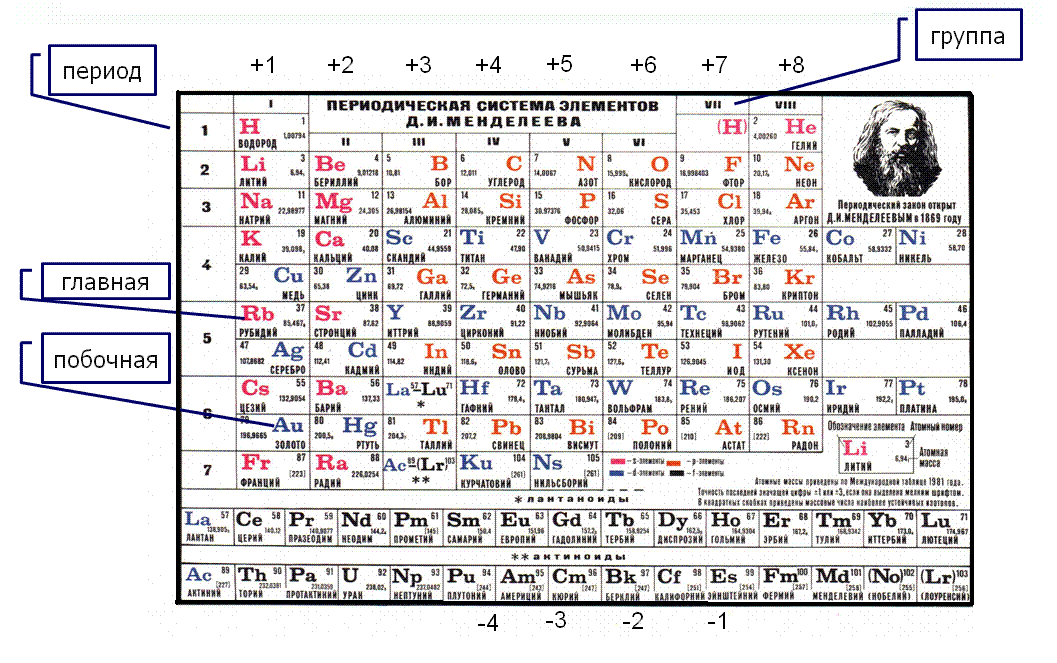 Достаточная точность литья обеспечивается тщательным изготовлением формы.
Достаточная точность литья обеспечивается тщательным изготовлением формы.
Характеристики меди
Медь — это металл с относительно низкой температурой плавления (1083С), плотностью 8 г/см3 и высокой пластичностью. Она встречается в природе в виде самородков.
Благодаря этим качествам она стала первым металлом, освоенным человечеством. Археологи находят инструменты и оружие, в захоронениях, датируемых III тысячелетием до н.э.
Скорее всего, человечество освоило медное литье еще раньше, в конце каменного века.
Основные свойства металлов подгруппы меди
Латинское название металла- Cuprum связывают с названием острова Кипр, известного античного центра производства бронзовых изделий. Сплавы на основе меди — бронза и латунь обладают высокой прочностью и меньше подвержены окислению. Бронза широко применялась как основной металл человечества вплоть до освоения массовых технологий производства стали.
Медь обладает отличной электро- и теплопроводностью. Это обуславливает ее широкое использование в электротехнике и теплотехнике.
Это обуславливает ее широкое использование в электротехнике и теплотехнике.
Кроме того, медь обладает выраженными бактерицидными свойствами.
Оборудование для плавки и литья меди
Для литья меди в домашних условиях не требуется особо сложного или дорого оборудования. Приобрести его или изготовить самостоятельно вполне по плечу домашнему мастеру.
Потребуется
- Тигли — цилиндрические открытые сосуды.
Примеры графитовых тигелей
- Стальные щипцы для снятия и постановки тигля в печь.
- Муфельная печь или газовая горелка.
- Стальной крюк для снятия корки из окислов с поверхности расплава.
- Форма для литья.
Прежде всего, нужно расплавить медь. Чем лучше будет измельчено исходное сырье, тем быстрее произойдет расплав. Плавление будет происходить в тигле из керамики или огнеупорной глины.
Муфельная печь должна быть оборудована термометром и застекленным оконцем для визуального контроля.
Электронная система регулировки и поддержания температуры сделает медное литье проще и обеспечит лучшее качество отливки.
Формы для медного литья делается на основе модели. В зависимости от выбранной технологии формы бывают одноразовые (из специально отформованной в опалубке смеси) и многоразовые — стальные кокили. В последнее время получили распространение формы из высокотемпературного силикона.
В домашних условиях чаще применяют одноразовые формы. Модель изготовляют из воска или специальных сортов пластилина. Модель полностью повторяет пространственную конфигурацию будущего изделия. При заливке в форму горячего расплава воск плавится и вытесняется металлом, занимающим его место и повторяющим все детали рельефа формы. Такая форма называется выплавляемой.
Выжигаемая форма для литья меди
Существуют также выжигаемые формы. В них применяется модель, сделанная из горючего материала, например папье-маше. Модель в этом случае сгорает при заливке высокотемпературного расплава, продукты сгорания в виде газов выходят через заливное отверстие.
Применение медного литья
Медное литье применяется для изготовления широкого спектра изделий. В ювелирном деле легендарный металл чаще используют в составе сплавов. В небольших количествах ее добавляют в золотые изделия для повышения их прочности и стойкости к истиранию. Бронза, представляющая собой сплав меди с оловом, используется для создания авторских подвесок, цепочек, колец и сережек.
В ювелирном деле легендарный металл чаще используют в составе сплавов. В небольших количествах ее добавляют в золотые изделия для повышения их прочности и стойкости к истиранию. Бронза, представляющая собой сплав меди с оловом, используется для создания авторских подвесок, цепочек, колец и сережек.
Ювелирные украшения из меди
Литье из меди применяется также для изготовления рыболовных блесен уникальной формы. Еще одна сфера применения — создание авторских масштабных моделей техники — кораблей, автомобилей, танков, самолетов и пр. Здесь кроме бронзы используется латунь — сплав с цинком.
Латунь и бронза применяются также для отливки элементов декора помещений, накладок и авторских дверных ручек. Здесь, кроме конструкционных достоинств — прочности, долговечности и внешнего вида, применяются и бактерицидные свойства меди и ее сплавов.
Процесс расплавки меди в домашних условиях
Процесс литья меди в домашних условиях несложен, но требует тщательной подготовки, планирования и четкого соблюдения временных и температурных параметров.
Начинается он с измельчения проволоки или лома и помещения ее в тигель. Одновременно следует включить муфельную печь на прогрев. Чем лучше будет измельчен металл, тем быстрее и эффективнее пройдут и расплав, и отливка.
Важно следить за температурой расплава. При превышении температуры расплав начинает активно поглощать кислород воздуха и окисляться, сто ведет к снижению качества отливок.
Чтобы снизить влияние кислорода воздуха, поверхность расплава присыпают толченым активированным углем.
Если муфельная печь недоступна, то тигель можно установить на сварную треногу и нагревать повернутой соплом вверх газовой горелкой.
Важно! Горелка обязательно должна быть надежно закреплена
Можно также сделать печь из шамотных кирпичей и стальной решетки, на которой будет рассыпан уголь. Такую печь необходимо обдувать мощным вентилятором или пылесосом.
Такую печь необходимо обдувать мощным вентилятором или пылесосом.
После того как металл расплавился, нужно надежно захватить тигель щипцами и извлечь из печи, поставив на огнеупорное основание.
Используя стальной крюк, нужно сдвинуть к стенке образовавшуюся на поверхности расплава пленку из окислов, и, не допуская его остывания, тонкой струйкой вылить в отверстие формы. Если используется выплавляемая форма, следите за тем, чтобы струя наливаемого металла давала возможность для выхода материала модели.
Обязательно дайте отливке полностью остыть перед тем, как будете разбирать форму, очищать и дорабатывать изделие.
Важно! Обязательно использование защитных очков и перчаток с крагами. Не забудьте проверить наличие и работоспособность огнетушителя, пригодного для тушения электроустановок под напряжением.
Пусть ваше литье будет удачным, и медная отливка, изготовленная в домашних условиях, порадует вас и ваших заказчиков!
, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Литье из бронзы: технология художественного бронзового литья
Литье бронзы позволяет изготавливать изделия, отличающиеся исключительной декоративной привлекательностью. Технология литья из данного сплава, основу которого составляет медь, известна на протяжении многих веков, но и в наше время она продолжает совершенствоваться.
Внешний вид бронзовых изделий говорит об кропотливом труде мастера, превращающего безликий металл в художественное произведение
История технологии
По мнению историков, возраст, который имеет бронзовое литье, составляет 12 тысяч лет. Изначально при помощи такой технологии из бронзы изготавливались украшения и простейшие орудия труда. С течением времени данная технология совершенствовалась, и сегодня она представляет собой метод, при помощи которого создают множество уникальных изделий из данного сплава.
Современный уровень развития литья из бронзы позволяет получать из данного сплава меди различные предметы не только в производственных, но и в домашних условиях.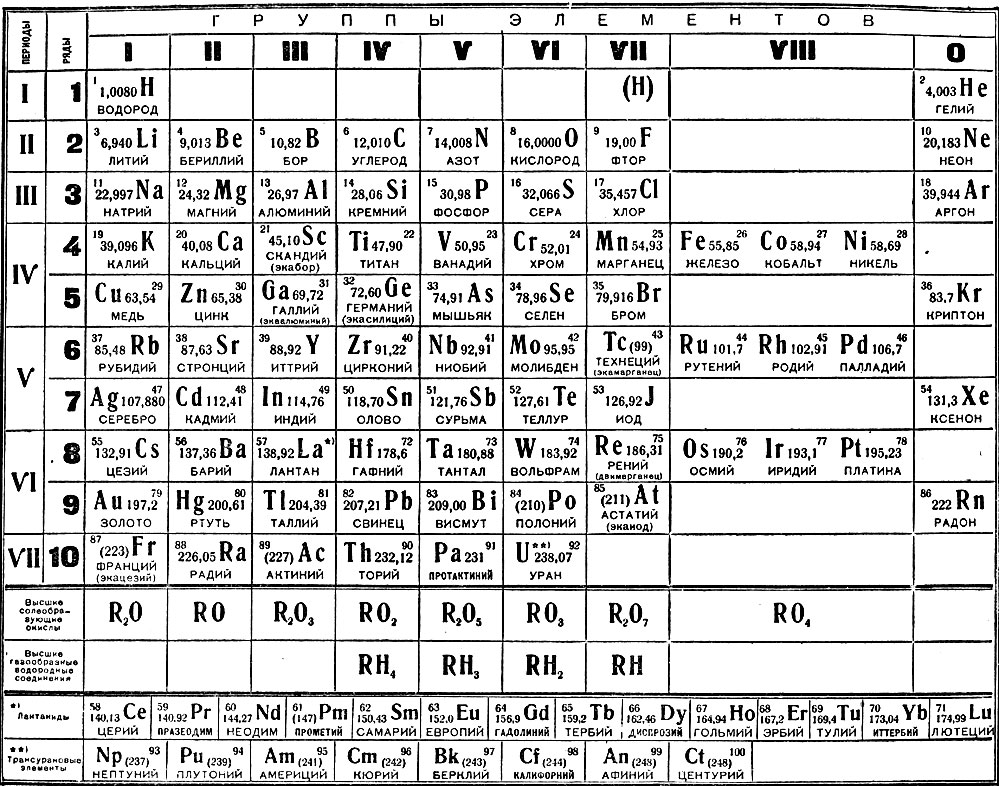
Благодаря изобретению бронзы, а также развитию технологий ее обработки, основной из которых является литье, мы и сегодня можем наслаждаться видом произведений искусства, которые были созданы мастерами еще в Средние века и в античные времена.
Старинный бронзовый набор письменных принадлежностей
Наибольшую популярность бронзовое литье, а также литье латуни – еще одного сплава, основу которого составляет медь, приобрело в эпоху классицизма и европейского барокко. Именно в те времена люди научились использовать эти материалы для того, чтобы создавать уникальные интерьерные элементы и декор.
Такие сплавы, созданные на основе меди, и сегодня активно применяются при изготовлении:
- предметов, служащих для оформления интерьера;
- ворот и заборов, выполняющих не только декоративную, но и защитную функцию;
- скульптурных композиций и сувенирной продукции;
- барельефов и элементов оформления осветительных приборов – люстр и бра;
- элементов лестничных конструкций и входных групп.

что это такое, история открытия, применение, физические и химические свойства, место в таблице Менделеева
Цинк относится к металлам. При нормальных условиях представляет собой хрупкое кристаллическое вещество голубоватого цвета, которое на воздухе быстро тускнеет. Добывается из металлических руд. Содержится в живых организмах – необходим для синтеза нуклеиновых кислот. Используется в промышленности, производстве украшений, медицине.
История открытия
С древности применялись сплавы этого элемента с другими металлами. Самый известный – латунь. Еще Парацельс описывал цинк и назвал его Zincum.
Этот элемент долго не удавалось получить. Только в середине XVIII века английский химик выделил его пары путем дистилляции. Немного позже началось его производство. Через несколько лет был открыт еще один способ получения этого металла из оксида с помощью прокаливания с углем. А с начала XX века его стали получать методом электролиза.
Цинк в таблице Менделеева
Zincum в таблице Менделеева обозначается символом Zn. Относится к 12 группе четвертого периода. Стоит под номером 30. Атомная масса элемента – 65,38.
Относится к 12 группе четвертого периода. Стоит под номером 30. Атомная масса элемента – 65,38.
Строение атома цинка
Атом Zn состоит из положительно заряженного ядра из 30 протонов. Вокруг него движутся 30 электронов по 4 орбитам.
Конфигурация атома 3d104s2. Кристаллы вытянуты и имеют гексагональную упаковку.
Физические свойства
Это хрупкий, но твердый металл. По цвету – голубовато-серебристый. Если сгибать пластинку цинка при комнатной температуре, то будет слышен треск.
Плотность – 7,13 г/см3. При наличии примесей становится более хрупким. Чистый цинк при температуре выше 100° пластичен, прокатывается в тонкие листы.
Этот металл деформируется при t° 210°С. Среди металлов у него довольно низкая температура плавления – 419,6°С. При этом уменьшается плотность и увеличивается объем. При t° 906°С начинает кипеть.
Другие свойства Zn:
- теплоемкость 0,382 kJ/kgK;
- теплопроводность 18°;
- электропроводность 5,9 Ώm;
- предел прочности 200-250 Мн/м²;
- магнитная восприимчивость -0,157.

Химические свойства
Это активный химический элемент. Способен изменяться даже на воздухе: покрывается тонкой пленкой оксида. При повышенной температуре и влажности может разрушаться.
При высокой температуре сгорает, образуя яркое пламя. Реагирует при взаимодействии с газами. При сильном нагревании – с водой, серой.
Водород, азот и углерод не вступают в реакцию с цинком. Этот элемент обладает антикоррозионной стойкостью.
Другие химические свойства:
- реагирует с серой, кислородом, фосфором;
- при повышенной температуре при взаимодействии цинка вместе с сероводородом или водой начинает выделяться водород;
- при взаимодействии цинка с щелочами образуются соли;
- реагирует с кислотами или их растворами – выделяется водород;
- окисляется при контакте с железом.
Важное свойство этого элемента – он может вытеснять некоторые металлы из растворов солей или оксидов. На примере уравнений с цинком и сульфатом меди видно, как получается медь: Zn + CuSO4 = Cu + ZnSO4; Zn + CuO = Cu + ZnO.
Цинк в природе
Чистый цинк не встречается. Добывается из металлических руд, где его содержится не более 1-4%. Крупнейшие месторождения расположены в Казахстане, Австралии, Боливии.
Самая распространенная руда, содержащая этот металл – сфалерит. Из-за примесей может быть любого цвета, потому называется еще цинковой обманкой. Встречаются также другие минералы:
- цинкит;
- смитсонит;
- каламин;
- смесь цинковой обманки и бурого шпата.
Полученную руду концентрируют, осаждают и обжигают. Получается оксид. Из него путем электролиза добывают цинк с чистотой 98,7-99,9%. Из примесей могут присутствовать свинец, олово, железо, медь.
Применение
Цинк высокой очистки используют при добыче золота и серебра. Это один из элементов, который присутствует в батарейках и аккумуляторах, содержится в припоях.
Благодаря антикоррозионным свойствам металл часто используется для защиты железа или стали от ржавчины. Чистую его форму применяют также в полиграфии. Кроме этого из него делают мелкие детали различных механизмов, автомобилей.
Кроме этого из него делают мелкие детали различных механизмов, автомобилей.
Особенно широко применяются различные химические соединения:
- селенид – для получения оптических стекол для углекислотных лазеров;
- хлорид – при пайке металлов;
- теллурид и фосфорит – хорошие проводники;
- сульфид – для производства люминесцентных красок;
- фосфид применяется, как отрава для грызунов;
- окись – для получения белой краски, как добавка к резине, повышающая ее прочность;
- гидроксид цинка – адсорбент в хирургических повязках.
В промышленности и машиностроении часто применяются сплавы. Самый известный из них – латунь. Это соединение цинка с медью. Иногда к данному металлу добавляется никель, свинец, железо, марганец.
Латунь прочная, не окисляется, не подвергается коррозии. Применяется при производстве посуды, предметов интерьера, сантехники, ювелирных изделий.
В машиностроении используется сплав с медью, магнием, алюминием – ЦАМ. Он прочный, стойкий к коррозии, хорошо поддается литейной обработке. Изделия из него долговечны, не деформируются, мало весят. Из этого сплава изготавливаются детали самолетов, автомобилей, затворы пистолетов.
Он прочный, стойкий к коррозии, хорошо поддается литейной обработке. Изделия из него долговечны, не деформируются, мало весят. Из этого сплава изготавливаются детали самолетов, автомобилей, затворы пистолетов.
В ювелирном деле часто элемент соединяется с золотом. Такой сплав обладает большей пластичностью. Из него получается белое золото, которое ценится при производстве украшений.
Цинк – важный минерал, необходимый для деятельности живых организмов:
- входит в состав ферментов;
- участвует при синтезе гормонов, белков, аминокислот;
- регулирует работу простаты и выработку спермы;
- участвует в расщеплении алкоголя.
Поэтому этот микроэлемент применяется в медицине. Входит в состав мазей и кремов для лечения кожных заболеваний и ускорения заживления ран. Витамины с цинком назначаются для укрепления иммунитета, улучшения состояния кожи и волос. Препараты, содержащие это вещество, оказывают антисептическое, вяжущее, противовоспалительное и подсушивающее действие.
Цинк – это металл, который благодаря своим свойствам широко применяется в разных областях человеческой деятельности. Начиная от фармации и заканчивая машиностроением. Напишите в комментариях, где еще можно использовать этот элемент и какую пользу он приносит. Поделитесь статьей в социальных сетях, а также сохраните ее в закладках, чтобы не потерять полезную информацию.
Свойства, применение и биологическая роль цинка в жизни человека:
Источники:
- https://ferrolabs.ru/blog/tsink-i-ego-splavy
- https://mineralpro.ru/minerals/zinc
- https://ru.wikipedia.org/wiki/%D0%A6%D0%B8%D0%BD%D0%BA
- http://himege.ru/cink-obshhaya-xarakteristika-elementa-ximicheskie-svojstva-cinka-i-ego-soedinenij
- https://allmetalls.ru/zn.html
Части периодической таблицы
Когда элементы объединяются в соединения, существует два основных типа
склеивание, которое может возникнуть. Ионные связи образуются при наличии
Ионные связи образуются при наличии
перенос электронов от одного вида к другому с образованием
заряженные ионы, которые очень сильно притягиваются друг к другу электростатическим
взаимодействия и ковалентных связей , которые возникают, когда атомы
обмениваться электронами для получения нейтральных молекул. В общем
металл и неметаллы объединяются, образуя ионные соединения , а
неметаллы соединяются с другими неметаллами с образованием ковалентных соединений
(молекулы).
Поскольку металлы находятся левее в таблице Менделеева, они
имеют низкую энергию ионизации
и низкое сродство к электрону,
поэтому они относительно легко теряют электроны и с трудом приобретают их.
У них также относительно мало валентных электронов, и они могут образовывать ионы (и
тем самым удовлетворяют правилу октета) легче, теряя свою валентность
электроны с образованием положительно заряженных катионы .
- Металлы основной группы обычно образуют заряды, такие же, как
номер их группы: то есть металлы группы 1А, такие как
натрий и калий образуют заряды +1, металлы группы 2А, такие как
магний и кальций образуют заряды 2+, а металлы группы 3А, такие как
так как алюминий образует заряды 3+.
- Металлы, следующие за переходными металлами (по направлению к
в нижней части групп 4A и 5A) могут потерять либо свои крайние с
и p электронов, образующих заряды, идентичные их
номер группы, или они могут потерять только p электронов, в то время как
сохраняя свои два s электронов, образуя заряды, которые являются
номер группы минус два. Другими словами, олово и свинец в Группе
4А может образовывать 4+ или 2+ заряда, тогда как висмут из группы 5А может
образуют заряд 5+ или 3+. - Переходные металлы обычно способны образовывать 2+ заряда
потеряв свою валентность с электронов, но может и потерять
электроны со своих d орбиталей, чтобы сформировать другие заряды.
Большинство переходных металлов могут образовывать более одного возможного заряда.
в ионных соединениях.
Неметаллы находятся правее в периодической таблице и имеют
высокая энергия ионизации и
высокое сродство к электрону, поэтому
они относительно легко приобретают электроны и с трудом их теряют.
Они также имеют большее количество валентных электронов и уже
близко к полному октету из восьми электронов. неметаллы
приобретают электроны до тех пор, пока они не будут иметь такое же количество электронов, как
ближайший благородный газ (группа 8A), образующий отрицательно заряженный анионы
которые имеют заряды, равные номеру группы минус восемь. То есть,
неметаллы группы 7А образуют заряды 1-, неметаллы группы 6А образуют заряды 2-
заряды, а металлы группы 5А образуют 3-заряды. Группа 8А
элементы уже имеют восемь электронов на своих валентных оболочках и имеют
мало склонны либо приобретать, либо терять электроны, и не легко
образуют ионные или молекулярные соединения.
Ионные соединения удерживаются вместе в правильном порядке, называемом кристалл
решетки силами притяжения между противоположно заряженными
катионы и анионы. Эти силы притяжения очень сильны, и
поэтому большинство ионных соединений имеют очень высокие температуры плавления. (За
(За
Например, хлорид натрия, NaCl, плавится при 80°С, а оксид алюминия,
Al 2 O 3 , плавится при 2054C.) Ионные соединения
обычно твердые, жесткие и хрупкие. Ионные соединения не проводят
электричество, потому что ионы не могут свободно двигаться в твердой фазе,
но ионные соединения могут проводить электричество, когда они растворены в
вода.
Когда неметаллы объединяются с другими неметаллами, они, как правило, разделяют
электроны в ковалентных связях вместо образования ионов, что приводит к
образование нейтральных молекул. (Имейте в виду, что поскольку водород
тоже неметалл, соединение водорода с другим неметаллом
также будет образовывать ковалентную связь.) Молекулярные соединения могут быть
газами, жидкостями или твердыми веществами с низкой температурой плавления и включают широкий спектр
веществ. (См.
Галерея молекул для
примеры.)
Когда металлы соединяются друг с другом, связь обычно описывается
как металлическая связка (вы могли догадаться). В этом
В этом
В модели каждый атом металла отдает один или несколько своих валентных электронов
создать электронное море , которое окружает все атомы, удерживая
вещества вместе за счет притяжения между катионами металлов и
отрицательно заряженные электроны. Так как электроны в электроне
море может свободно двигаться, металлы очень легко проводят электричество, в отличие от
молекулы, где электроны более локализованы. Атомы металлов могут
двигаться мимо друг друга легче, чем в ионных соединениях (которые
удерживаются в фиксированных положениях за счет притяжения между катионами и
анионы), позволяя металлу забиваться в листы или вытягиваться в
провод. Различные металлы можно очень легко комбинировать, чтобы получить
сплавы , которые могут иметь сильно отличающиеся физические свойства от их
составляющие металлы. Сталь представляет собой сплав железа и углерода,
что намного тверже самого железа; хром, ванадий, никель и
к железу также часто добавляют другие металлы для получения различных сталей.
типы. Латунь представляет собой сплав меди и цинка, который используется
в сантехнике, электрических деталях и музыкальных инструментах.
Бронза — это сплав меди и олова, который намного тверже, чем
медь; когда бронза была открыта древними цивилизациями, это ознаменовало
значительный шаг вперед по сравнению с использованием менее прочных каменных орудий.
18.1: Периодичность — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 105667
- OpenStax
- OpenStax
Развитие навыков
- Элементы классификации
- Предсказывать свойства периодичности репрезентативных элементов
Мы начнем этот раздел с изучения поведения репрезентативных металлов в зависимости от их положения в периодической таблице.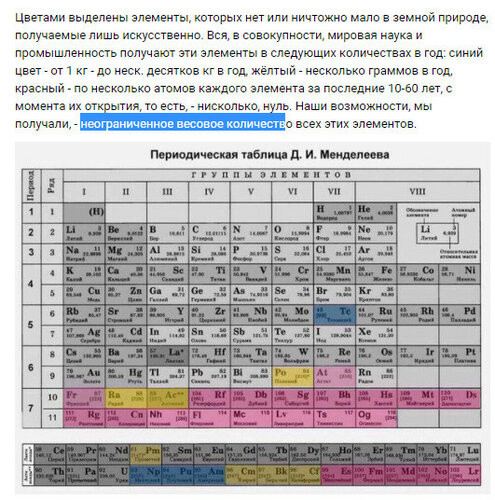 Основное внимание в этом разделе будет уделено применению периодичности к репрезентативным металлам.
Основное внимание в этом разделе будет уделено применению периодичности к репрезентативным металлам.
Элементы можно разделить на группы в соответствии с их электронной конфигурацией. Типичными элементами являются элементы, в которых орбитали s и p заполняются. Переходные элементы — это элементы, в которых заполняются орбитали d (группы 3–11 в периодической таблице), а внутренние переходные металлы — это элементы, в которых заполняются орбитали f . Орбитали d заполнены элементами 11-й группы; следовательно, элементы в группе 12 квалифицируются как репрезентативные элементы, потому что последний электрон входит в с орбитальная. Металлы среди репрезентативных элементов являются репрезентативными металлами. Металлический характер является результатом способности элемента терять свои внешние валентные электроны и приводит к высокой тепло- и электропроводности, среди других физических и химических свойств. Есть 20 нерадиоактивных репрезентативных металлов в группах 1, 2, 3, 12, 13, 14 и 15 периодической таблицы (элементы, заштрихованные желтым цветом на рисунке \(\PageIndex{1}\)). Радиоактивные элементы коперниций, флеровий, полоний и ливерморий также являются металлами, но не рассматриваются в этой главе.
Радиоактивные элементы коперниций, флеровий, полоний и ливерморий также являются металлами, но не рассматриваются в этой главе.
Рисунок \(\PageIndex{1}\) : Расположение репрезентативных металлов показано в периодической таблице. Неметаллы показаны зеленым, металлоиды — фиолетовым, а переходные металлы и внутренние переходные металлы — синим.
В дополнение к репрезентативным металлам некоторые из репрезентативных элементов являются металлоидами. Металлоид — это элемент, обладающий свойствами, находящимися между свойствами металлов и неметаллов; эти элементы обычно являются полупроводниками. Остальные репрезентативные элементы являются неметаллами. В отличие от металлов, которые обычно образуют катионы и ионные соединения (содержащие ионные связи), неметаллы склонны образовывать анионы или молекулярные соединения. Как правило, сочетание металла и неметалла дает соль. Соль – это ионное соединение, состоящее из катионов и анионов.
Соль – это ионное соединение, состоящее из катионов и анионов.
Большинство репрезентативных металлов не встречаются в природе в несвязанном состоянии, поскольку они легко реагируют с водой и кислородом воздуха. Однако можно выделить элементарный бериллий, магний, цинк, кадмий, ртуть, алюминий, олово и свинец из встречающихся в природе минералов и использовать их, поскольку они очень медленно реагируют с воздухом. Одна из причин, по которой эти элементы реагируют медленно, заключается в том, что эти элементы реагируют с воздухом, образуя защитное покрытие. Образованием этого защитного покрытия является пассивация. Покрытие представляет собой нереакционноспособную пленку оксида или какого-либо другого соединения. Элементарный магний, алюминий, цинк и олово играют важную роль в производстве многих привычных предметов, включая проволоку, посуду, фольгу и многие предметы домашнего обихода и личного пользования. Хотя бериллий, кадмий, ртуть и свинец легко доступны, их использование ограничено из-за их токсичности.
Группа 1: Щелочные металлы
Щелочные металлы литий, натрий, калий, рубидий, цезий и франций составляют группу 1 периодической таблицы. Хотя водород относится к группе 1 (а также к группе 17), он является неметаллом и заслуживает отдельного рассмотрения далее в этой главе. Название щелочной металл связано с тем фактом, что эти металлы и их оксиды реагируют с водой с образованием очень основных (щелочных) растворов.
Свойства щелочных металлов аналогичны друг другу, как и ожидалось для элементов одного семейства. Щелочные металлы имеют самые большие атомные радиусы и самую низкую энергию первой ионизации в своих периодах. Эта комбинация позволяет очень легко удалить один электрон в самой внешней (валентной) оболочке каждого из них. Легкая потеря этого валентного электрона означает, что эти металлы легко образуют стабильные катионы с зарядом 1+. Их реакционная способность увеличивается с увеличением атомного номера из-за легкости потери одинокого валентного электрона (уменьшение энергии ионизации). Поскольку окисление так легко, обратное, восстановление, затруднено, что объясняет, почему трудно изолировать элементы. Твердые щелочные металлы очень мягкие; литий, показанный на рисунке \(\PageIndex{2}\), имеет самую низкую плотность среди всех металлов (0,5 г/см 3 ).
Поскольку окисление так легко, обратное, восстановление, затруднено, что объясняет, почему трудно изолировать элементы. Твердые щелочные металлы очень мягкие; литий, показанный на рисунке \(\PageIndex{2}\), имеет самую низкую плотность среди всех металлов (0,5 г/см 3 ).
Рисунок \(\PageIndex{2}\) : Литий плавает в парафиновом масле, потому что его плотность меньше плотности парафинового масла.
Все щелочные металлы энергично реагируют с водой с образованием газообразного водорода и щелочного раствора гидроксида металла. Это означает, что они легче окисляются, чем водород. Например, реакция лития с водой:
\[\ce{2Li}(s)+\ce{2h3O}(l)⟶\ce{2LiOH}(aq)+\ce{h3}(g )\]
Щелочные металлы реагируют непосредственно со всеми неметаллами (кроме инертных газов) с образованием бинарных ионных соединений, содержащих 1+ ионов металлов. Эти металлы настолько реакционноспособны, что необходимо избегать контакта как с влагой, так и с кислородом воздуха. Поэтому их хранят в герметичных контейнерах под минеральным маслом, как показано на рисунке \(\PageIndex{3}\), для предотвращения контакта с воздухом и влагой. Чистые металлы никогда не существуют в природе в свободном (несвязанном) виде из-за их высокой реакционной способности. Кроме того, эта высокая реакционная способность делает необходимым получение металлов электролизом соединений щелочных металлов.
Поэтому их хранят в герметичных контейнерах под минеральным маслом, как показано на рисунке \(\PageIndex{3}\), для предотвращения контакта с воздухом и влагой. Чистые металлы никогда не существуют в природе в свободном (несвязанном) виде из-за их высокой реакционной способности. Кроме того, эта высокая реакционная способность делает необходимым получение металлов электролизом соединений щелочных металлов.
Рисунок \(\PageIndex{3}\): Чтобы предотвратить контакт с воздухом и водой, калий для лабораторного использования поставляется в виде палочек или шариков, хранящихся в керосине или минеральном масле или в герметичных контейнерах. (кредит: http://images-of-elements.com/potassium.php)
В отличие от многих других металлов, реакционная способность и мягкость щелочных металлов делают эти металлы непригодными для конструкционных применений. Однако есть приложения, в которых реакционная способность щелочных металлов является преимуществом. Например, производство таких металлов, как титан и цирконий, частично зависит от способности натрия восстанавливать соединения этих металлов. При производстве многих органических соединений, включая некоторые красители, лекарства и духи, используется восстановление литием или натрием.
Например, производство таких металлов, как титан и цирконий, частично зависит от способности натрия восстанавливать соединения этих металлов. При производстве многих органических соединений, включая некоторые красители, лекарства и духи, используется восстановление литием или натрием.
Рисунок \(\PageIndex{4}\) : Цветное пламя стронция, цезия, натрия и лития (слева направо). Изображение предоставлено Клэр Мюррей и Аннабель Бейкер из Diamond Light Source.
Натрий и его соединения придают пламени ярко-желтый цвет, как показано на рисунке \(\PageIndex{4}\). Прохождение электрического разряда через пары натрия также дает этот цвет. В обоих случаях это пример спектра излучения, как обсуждалось в главе об электронной структуре. В уличных фонарях иногда используются натриевые лампы, потому что пары натрия лучше проникают в туман, чем большинство других источников света. Это связано с тем, что туман рассеивает не столько желтый свет, сколько белый. Другие щелочные металлы и их соли также придают цвет пламени. Литий дает яркий малиновый цвет, тогда как другие создают бледный фиолетовый цвет.
Другие щелочные металлы и их соли также придают цвет пламени. Литий дает яркий малиновый цвет, тогда как другие создают бледный фиолетовый цвет.
Видео \(\PageIndex{1}\): В этом видео показаны реакции щелочных металлов с водой.
Группа 2: Щелочноземельные металлы
Щелочноземельные металлы (бериллий, магний, кальций, стронций, барий и радий) составляют группу 2 периодической таблицы. Название щелочного металла происходит от того факта, что оксиды более тяжелых членов группы реагируют с водой с образованием щелочных растворов. Заряд ядра увеличивается при переходе от группы 1 к группе 2. Из-за этого увеличения заряда атомы щелочноземельных металлов меньше и имеют более высокие энергии первой ионизации, чем щелочные металлы за тот же период. Более высокая энергия ионизации делает щелочноземельные металлы менее реакционноспособными, чем щелочные металлы; однако они по-прежнему являются очень реактивными элементами. Их реакционная способность, как и ожидалось, увеличивается с увеличением размера и уменьшением энергии ионизации. В химических реакциях эти металлы легко теряют оба валентных электрона с образованием соединений, в которых они проявляют степень окисления 2+. Из-за их высокой реакционной способности щелочноземельные металлы, как и щелочные металлы, обычно получают электролизом. Несмотря на низкие энергии ионизации, два металла с самыми высокими энергиями ионизации (бериллий и магний) действительно образуют соединения, которые проявляют некоторые ковалентные свойства. Как и щелочные металлы, более тяжелые щелочноземельные металлы придают цвет пламени. Как и в случае щелочных металлов, это часть эмиссионного спектра этих элементов. Кальций и стронций дают оттенки красного, тогда как барий дает зеленый цвет.
Их реакционная способность, как и ожидалось, увеличивается с увеличением размера и уменьшением энергии ионизации. В химических реакциях эти металлы легко теряют оба валентных электрона с образованием соединений, в которых они проявляют степень окисления 2+. Из-за их высокой реакционной способности щелочноземельные металлы, как и щелочные металлы, обычно получают электролизом. Несмотря на низкие энергии ионизации, два металла с самыми высокими энергиями ионизации (бериллий и магний) действительно образуют соединения, которые проявляют некоторые ковалентные свойства. Как и щелочные металлы, более тяжелые щелочноземельные металлы придают цвет пламени. Как и в случае щелочных металлов, это часть эмиссионного спектра этих элементов. Кальций и стронций дают оттенки красного, тогда как барий дает зеленый цвет.
Магний — серебристо-белый металл, ковкий и пластичный при высоких температурах. Пассивация снижает реакционную способность металлического магния. При контакте с воздухом на поверхности металла образуется плотно прилегающий слой оксикарбоната магния, тормозящий дальнейшую реакцию.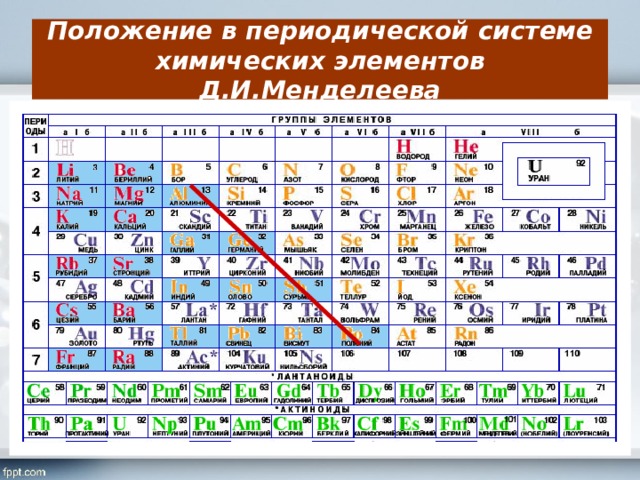 (Карбонат образуется в результате реакции двуокиси углерода в атмосфере.) Магний — самый легкий из широко используемых конструкционных металлов, поэтому большая часть производства магния предназначена для легких сплавов.
(Карбонат образуется в результате реакции двуокиси углерода в атмосфере.) Магний — самый легкий из широко используемых конструкционных металлов, поэтому большая часть производства магния предназначена для легких сплавов.
Магний (Рисунок \(\PageIndex{5}\)), кальций, стронций и барий реагируют с водой и воздухом. При комнатной температуре барий проявляет наиболее бурную реакцию. Продуктами реакции с водой являются водород и гидроксид металла. Образование газообразного водорода указывает на то, что более тяжелые щелочноземельные металлы являются лучшими восстановителями (более легко окисляются), чем водород. Как и ожидалось, эти металлы реагируют как с кислотами, так и с неметаллами с образованием ионных соединений. В отличие от большинства солей щелочных металлов, многие из обычных солей щелочноземельных металлов нерастворимы в воде из-за высокой энергии решетки этих соединений, содержащих ион двухвалентного металла.
Рисунок \(\PageIndex{5}\) : Слева направо: Mg(s), теплая вода с pH 7 и полученный раствор с pH выше 7, обозначенный розовым цветом. цвет фенолфталеинового индикатора. (кредит: модификация работы Сахара Атва)
цвет фенолфталеинового индикатора. (кредит: модификация работы Сахара Атва)
Мощная восстанавливающая способность горячего магния полезна при получении некоторых металлов из их оксидов. Действительно, сродство магния к кислороду настолько велико, что горящий магний вступает в реакцию с углекислым газом, образуя элементарный углерод:
\[\ce{2Mg}(s)+\ce{CO2}(g)⟶\ce{2MgO}(s)+\ce{C}(s)\]
По этой причине CO 2 огнетушитель не потушит горение магния. Кроме того, яркий белый свет, излучаемый горящим магнием, делает его полезным для сигнальных ракет и фейерверков.
Группа 12 Металлы
Элементы группы 12 являются переходными; однако последним добавленным электроном является не d электрон, а s электрон. Поскольку последний добавленный электрон — это s электрон, эти элементы квалифицируются как репрезентативные металлы или постпереходные металлы. Элементы группы 12 ведут себя скорее как щелочноземельные металлы, чем как переходные металлы.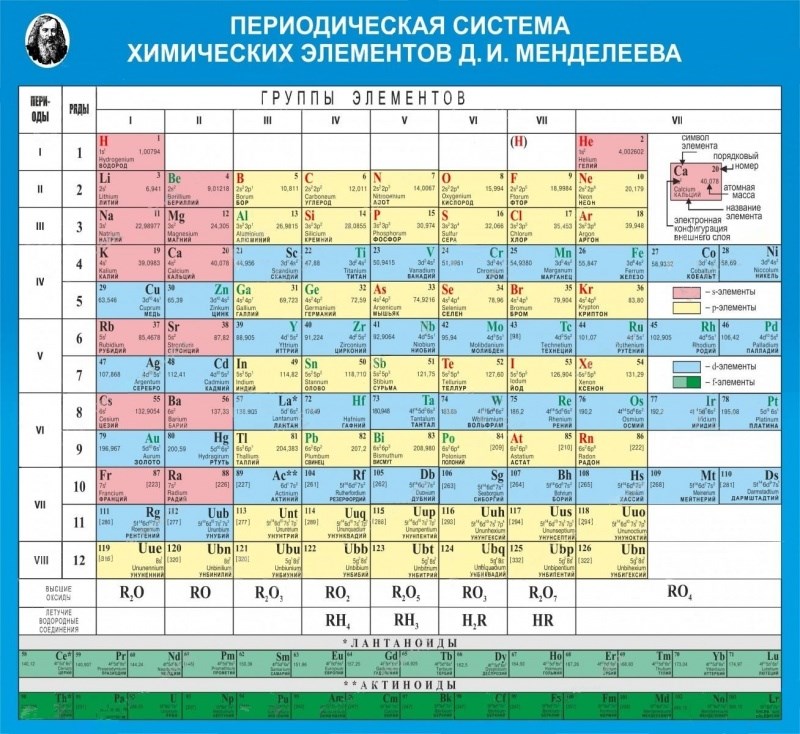 2+}\). И в элементарных формах, и в соединениях кадмий и ртуть токсичны.
2+}\). И в элементарных формах, и в соединениях кадмий и ртуть токсичны.
Цинк является наиболее реакционноспособным в группе 12, а ртуть наименее реактивна. (Это обратная тенденция реакционной способности металлов групп 1 и 2, в которой реакционная способность увеличивается вниз по группе. Увеличение реакционной способности с увеличением атомного номера происходит только для металлов в группах 1 и 2.) Уменьшение реакционной способности из-за образования ионов с конфигурацией псевдоблагородного газа и других факторов, которые выходят за рамки этого обсуждения. Химическое поведение цинка и кадмия очень похоже друг на друга, но отличается от поведения ртути.
Цинк и кадмий имеют более низкий восстановительный потенциал, чем водород, и, подобно щелочным металлам и щелочноземельным металлам, при взаимодействии с кислотами они выделяют газообразный водород. Реакция цинка с соляной кислотой, показанная на рисунке \(\PageIndex{6}\): Растворяется в соляной кислоте, образуя раствор бесцветных ионов Zn 2+ , ионов Cl – и газообразный водород.
Цинк — это серебристый металл, который быстро тускнеет до сине-серого цвета. Это изменение цвета происходит из-за прилипшего покрытия из основного карбоната Zn 2 (OH) 2 CO 3 , который пассивирует металл для предотвращения дальнейшей коррозии. Сухие элементы и щелочные батареи содержат цинковый анод. Латунь (Cu и Zn) и немного бронзы (Cu, Sn и иногда Zn) являются важными цинковыми сплавами. Около половины производимого цинка служит для защиты железа и других металлов от коррозии. Эта защита может иметь форму расходуемого анода (также известного как гальванический анод, который является средством обеспечения катодной защиты различных металлов) или тонкого покрытия на защищаемом металле. Оцинкованная сталь – это сталь с защитным покрытием из цинка.
Расходуемые аноды
Расходуемый анод или гальванический анод — это средство обеспечения катодной защиты различных металлов. Катодная защита относится к предотвращению коррозии путем превращения корродирующего металла в катод. В качестве катода металл противостоит коррозии, которая представляет собой процесс окисления. Коррозия происходит на протекторном аноде, а не на катоде.
В качестве катода металл противостоит коррозии, которая представляет собой процесс окисления. Коррозия происходит на протекторном аноде, а не на катоде.
Построение такой системы начинается с прикрепления более активного металла (с более отрицательным восстановительным потенциалом) к металлу, нуждающемуся в защите. Присоединение может быть прямым или через провод. Чтобы замкнуть цепь, солевой мост необходим. Этот соляной мост часто представляет собой морскую воду или грунтовые воды. После замыкания цепи окисление (коррозия) происходит на аноде, а не на катоде.
Обычно используемые жертвенные аноды представляют собой магний, алюминий и цинк. Магний имеет самый отрицательный восстановительный потенциал из трех и лучше всего работает, когда солевой мостик менее эффективен из-за низкой концентрации электролита, например, в пресной воде. Цинк и алюминий работают в соленой воде лучше, чем магний. Алюминий легче цинка и имеет более высокую емкость; однако оксидное покрытие может пассивировать алюминий. В особых случаях полезны другие материалы. Например, железо защитит медь.
В особых случаях полезны другие материалы. Например, железо защитит медь.
Ртуть сильно отличается от цинка и кадмия. Ртуть — единственный металл, который находится в жидком состоянии при 25 °C. Многие металлы растворяются в ртути, образуя растворы, называемые амальгамами (см. статью об амальгамах), которые представляют собой сплавы ртути с одним или несколькими другими металлами. Ртуть, показанная на рисунке \(\PageIndex{7}\), представляет собой нереакционноспособный элемент, который окисляется труднее, чем водород. Таким образом, он не вытесняет водород из кислот; однако он будет реагировать с сильными окисляющими кислотами, такими как азотная кислота:
\[\ce{Hg}(l)+\ce{HCl}(водн.)⟶\textrm{нет реакции}\]
\[\ce{3Hg}(л)+\ce{8HNO3}(водн.)⟶\ce{3Hg(NO3)2}(водн.)+\ce{4h3O}(л)+\ce{2NO}(г )\]
Первоначально образовавшийся чистый NO быстро подвергается дальнейшему окислению до красновато-коричневого NO 2 .
<
Рисунок \(\PageIndex{7}\): Слева направо: Hg(l), Hg + концентрированная HCl, Hg + концентрированная HNO 3 . 2+}\). Все соединения ртути токсичны, и при их синтезе необходимо проявлять большую осторожность.
2+}\). Все соединения ртути токсичны, и при их синтезе необходимо проявлять большую осторожность.
Амальгамы
Амальгама представляет собой сплав ртути с одним или несколькими другими металлами. Это похоже на рассмотрение стали как сплава железа с другими металлами. Большинство металлов образуют амальгаму с ртутью, за исключением железа, платины, вольфрама и тантала. Из-за проблем с токсичностью ртути использование амальгам значительно сократилось. Исторически сложилось так, что амальгамы играли важную роль в электролизерах и при извлечении золота. Амальгамы щелочных металлов все еще находят применение, потому что они являются сильными восстановителями и с ними легче обращаться, чем с чистыми щелочными металлами. У старателей возникла проблема, когда они нашли мелкодисперсное золото. Они узнали, что добавление ртути в их кастрюли собирает золото в ртуть, образуя амальгаму для облегчения сбора. К сожалению, потери небольшого количества ртути за эти годы привели к загрязнению многих рек в Калифорнии ртутью.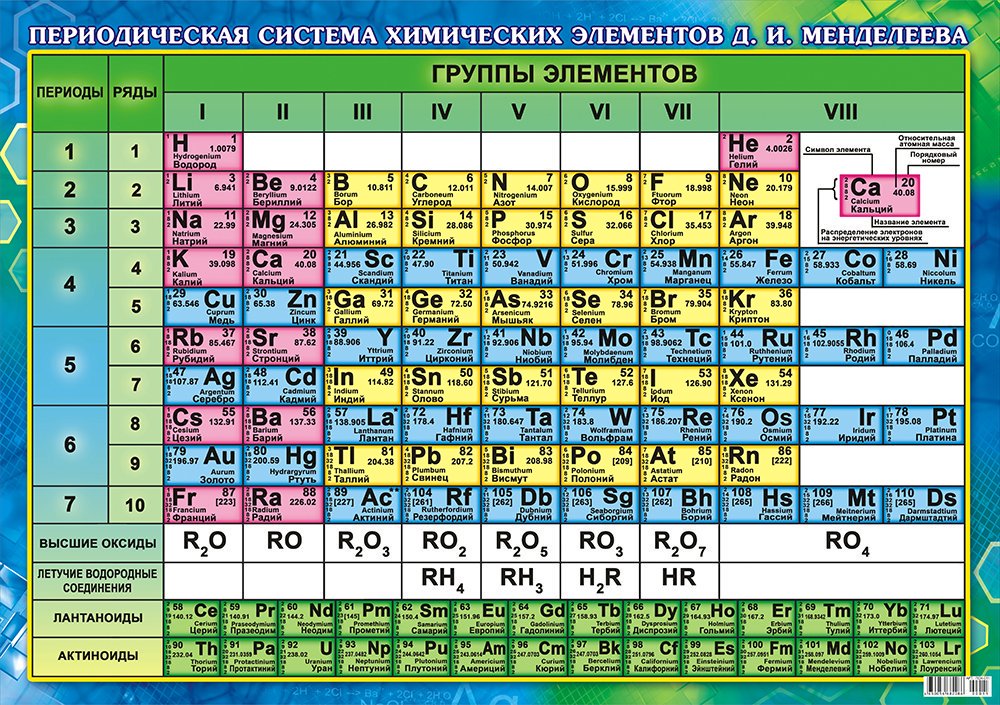 Стоматологи используют амальгамы, содержащие серебро и другие металлы, для заполнения полостей. Есть несколько причин для использования амальгамы, включая низкую стоимость, простоту манипуляций и долговечность по сравнению с альтернативными материалами. Стоматологические амальгамы примерно на 50% состоят из ртути по весу, что в последние годы вызывает озабоченность из-за токсичности ртути.
Стоматологи используют амальгамы, содержащие серебро и другие металлы, для заполнения полостей. Есть несколько причин для использования амальгамы, включая низкую стоимость, простоту манипуляций и долговечность по сравнению с альтернативными материалами. Стоматологические амальгамы примерно на 50% состоят из ртути по весу, что в последние годы вызывает озабоченность из-за токсичности ртути.
После анализа наилучших имеющихся данных Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) считает пломбы на основе амальгамы безопасными для взрослых и детей старше шести лет. Даже при множественных пломбах уровень ртути у пациентов остается намного ниже самого низкого уровня, связанного с вредом. Клинические исследования не обнаружили связи между зубными амальгамами и проблемами со здоровьем. Проблемы со здоровьем могут быть разными в случае детей до шести лет или беременных женщин. Выводы FDA соответствуют мнениям Агентства по охране окружающей среды (EPA) и Центров по контролю за заболеваниями (CDC). Единственным отмеченным соображением для здоровья является то, что у некоторых людей есть аллергия на амальгаму или один из ее компонентов.
Единственным отмеченным соображением для здоровья является то, что у некоторых людей есть аллергия на амальгаму или один из ее компонентов.
Группа 13
Группа 13 содержит металлоид бора и металлы алюминий, галлий, индий и таллий. Самый легкий элемент, бор, является полупроводником, и его бинарные соединения имеют тенденцию быть ковалентными, а не ионными. Остальные элементы группы — металлы, но их оксиды и гидроксиды меняют характер. Оксиды и гидроксиды алюминия и галлия проявляют как кислотное, так и основное поведение. Вещество, подобное этим двум, которое будет реагировать как с кислотами, так и с основаниями, является амфотерным. Эта характеристика иллюстрирует сочетание неметаллического и металлического поведения этих двух элементов. Оксиды и гидроксиды индия и таллия проявляют только основное поведение в соответствии с явно металлическим характером этих двух элементов. Температура плавления галлия необычно низкая (около 30 °C), и он легко расплавится в вашей руке.
Алюминий амфотерен, потому что он будет реагировать как с кислотами, так и с основаниями. Типичная реакция с кислотой:
\[\ce{2Al}(s)+\ce{6HCl}(aq)⟶\ce{2AlCl3}(aq)+\ce{3h3}(g)\]
Продукты реакции алюминия с основанием зависят от условий реакции, при этом одним из возможных вариантов является:
\[\ce{2Al}(s)+\ce{2NaOH}(aq)+\ce{6h3O }(l)⟶\ce{2Na[Al(OH)4]}(aq)+\ce{3h3}(g)\]
Как с кислотами, так и с основаниями реакция с алюминием приводит к образованию газообразного водорода. 93+}\), сокращенно Al 3+ ( aq ). Галлий, индий и таллий также образуют ионные соединения, содержащие ионы М 3+ . Эти три элемента демонстрируют не только ожидаемую степень окисления 3+ от трех валентных электронов, но и степень окисления (в данном случае 1+), которая на два ниже ожидаемого значения. Это явление, эффект инертной пары, относится к образованию стабильного иона со степенью окисления на два ниже ожидаемой для группы. Пара электронов – это валентность s орбиталь для этих элементов. Вообще эффект инертной пары важен для нижних p -блочных элементов. В водном растворе ион Tl + ( aq ) более стабилен, чем Tl 3+ ( aq ). Обычно эти металлы реагируют с воздухом и водой с образованием ионов 3+; однако таллий реагирует с образованием производных таллия (I). Все металлы группы 13 реагируют непосредственно с неметаллами, такими как сера, фосфор и галогены, образуя бинарные соединения.
Вообще эффект инертной пары важен для нижних p -блочных элементов. В водном растворе ион Tl + ( aq ) более стабилен, чем Tl 3+ ( aq ). Обычно эти металлы реагируют с воздухом и водой с образованием ионов 3+; однако таллий реагирует с образованием производных таллия (I). Все металлы группы 13 реагируют непосредственно с неметаллами, такими как сера, фосфор и галогены, образуя бинарные соединения.
Все металлы группы 13 (Al, Ga, In и Tl) являются реакционноспособными. Однако пассивация происходит по мере того, как под воздействием воздуха образуется прочная, твердая, тонкая пленка оксида металла. Разрушение этой пленки может препятствовать пассивации, позволяя металлу реагировать. Один из способов разрушить пленку — подвергнуть пассивированный металл воздействию ртути. Часть металла растворяется в ртути, образуя амальгаму, которая сбрасывает защитный оксидный слой, подвергая металл дальнейшей реакции. Образование амальгамы позволяет металлу реагировать с воздухом и водой.
Видео \(\PageIndex{2}\) : Хотя алюминий легко окисляется, пассивация делает его очень полезным в качестве прочного и легкого строительного материала. Из-за образования амальгамы ртуть вызывает коррозию конструкционных материалов из алюминия. Это видео демонстрирует, как можно разрушить целостность алюминиевой балки добавлением небольшого количества элементарной ртути.
Наиболее важными сферами применения алюминия являются строительная и транспортная отрасли, а также производство алюминиевых банок и алюминиевой фольги. Это использование зависит от легкости, ударной вязкости и прочности металла, а также его устойчивости к коррозии. Поскольку алюминий является отличным проводником тепла и устойчив к коррозии, он используется в производстве кухонной утвари.
Алюминий является очень хорошим восстановителем и может заменить другие восстановители при выделении некоторых металлов из их оксидов. Хотя алюминий дороже, чем восстановление углеродом, он важен для выделения Mo, W и Cr из их оксидов.
Хотя алюминий дороже, чем восстановление углеродом, он важен для выделения Mo, W и Cr из их оксидов.
Группа 14
Металлическими элементами группы 14 являются олово, свинец и флеровий. Углерод — типичный неметалл. Остальные элементы группы, кремний и германий, являются примерами полуметаллов или металлоидов. Олово и свинец образуют стабильные двухвалентные катионы Sn 2+ и Pb 2+ , со степенью окисления на два ниже групповой степени окисления 4+. Стабильность этой степени окисления является следствием эффекта инертной пары. Олово и свинец также образуют ковалентные соединения с формальной степенью окисления 4+. Например, SnCl 4 и PbCl 4 — низкокипящие ковалентные жидкости.
Рисунок \(\PageIndex{8}\): (a) Хлорид олова (II) представляет собой ионное твердое вещество; б) хлорид олова(IV) – ковалентная жидкость.
Олово легко реагирует с неметаллами и кислотами с образованием соединений олова (II) (что указывает на то, что оно легче окисляется, чем водород) и с неметаллами с образованием соединений олова (II) или олова (IV) (Рисунок \(\PageIndex {8}\)), в зависимости от стехиометрии и условий реакции. Свинец менее реактивен. Его лишь немного легче окислить, чем водород, и для окисления обычно требуется горячая концентрированная кислота.
Свинец менее реактивен. Его лишь немного легче окислить, чем водород, и для окисления обычно требуется горячая концентрированная кислота.
Многие из этих элементов существуют в виде аллотропов. Аллотропы — это две или более формы одного и того же элемента в одном физическом состоянии с разными химическими и физическими свойствами. Есть два распространенных аллотропа олова. Эти аллотропы представляют собой серое (хрупкое) олово и белое олово. Как и в случае с другими аллотропами, разница между этими формами олова заключается в расположении атомов. Белое олово стабильно при температуре выше 13,2 °C и ковко, как и другие металлы. При низких температурах более стабильной формой является серое олово. Серое олово хрупкое и имеет тенденцию рассыпаться в порошок. Следовательно, изделия из олова будут разрушаться в холодную погоду, особенно при продолжительных холодах. Изменение медленно прогрессирует от места возникновения, и сначала образовавшееся серое олово катализирует дальнейшее изменение. В некотором смысле этот эффект подобен распространению инфекции в организме растения или животного, поэтому люди называют этот процесс оловянной болезнью или оловянным вредителем.
В некотором смысле этот эффект подобен распространению инфекции в организме растения или животного, поэтому люди называют этот процесс оловянной болезнью или оловянным вредителем.
В основном олово используется для покрытия стали с образованием жести в виде листового железа, из которого состоит олово в жестяных банках. Важными сплавами олова являются бронза (Cu и Sn) и припой (Sn и Pb). Свинец играет важную роль в свинцовых аккумуляторных батареях в автомобилях.
Группа 15
Висмут, самый тяжелый член группы 15, является менее реакционноспособным металлом, чем другие типичные металлы. Он легко отдает три из пяти своих валентных электронов активным неметаллам с образованием триположительного иона Bi 9.0152 3+ . Он образует соединения с групповой степенью окисления 5+ только при обработке сильными окислителями. Стабильность состояния 3+-окисления является еще одним примером эффекта инертной пары.
Резюме
В этом разделе основное внимание уделяется периодичности репрезентативных элементов. 2+}\)). Алюминий, галлий, индий и таллий (группа 13) окисляются легче, чем водород. Алюминий, галлий и индий встречаются со степенью окисления 3+ (однако таллий также обычно встречается в виде Tl 9ион 0152 + ). Олово и свинец образуют устойчивые двухвалентные катионы и ковалентные соединения, в которых металлы проявляют степень окисления 4+.
2+}\)). Алюминий, галлий, индий и таллий (группа 13) окисляются легче, чем водород. Алюминий, галлий и индий встречаются со степенью окисления 3+ (однако таллий также обычно встречается в виде Tl 9ион 0152 + ). Олово и свинец образуют устойчивые двухвалентные катионы и ковалентные соединения, в которых металлы проявляют степень окисления 4+.
Глоссарий
- щелочноземельный металл
- любой из металлов (бериллий, магний, кальций, стронций, барий и радий), занимающий 2-ю группу периодической таблицы; это реактивные двухвалентные металлы, образующие основные оксиды
- аллотропы
- две или более формы одного и того же элемента в одном физическом состоянии с различной химической структурой
- висмут
- самый тяжелый член группы 15; менее активный металл, чем другие типичные металлы
- металл (представитель)
- атомы металлических элементов групп 1, 2, 12, 13, 14, 15 и 16, которые образуют ионные соединения, теряя электроны со своих внешних s или p орбиталей
- металлоид
- элемент, обладающий свойствами, находящимися между свойствами металлов и неметаллов; эти элементы обычно являются полупроводниками
- пассивация
- металлы с защитной нереакционноспособной пленкой из оксида или другого соединения, создающей барьер для химических реакций; физическое или химическое удаление пассивирующей пленки позволяет металлам продемонстрировать ожидаемую химическую активность
- репрезентативный элемент
- , в котором орбитали s и p заполняются
Элемент
- представитель металла
- металл среди репрезентативных элементов
Авторы
Пол Флауэрс (Университет Северной Каролины, Пемброк), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф.
 Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Загрузите бесплатно по адресу http://cnx.org/contents/85abf193-2bd…[email protected]).
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Загрузите бесплатно по адресу http://cnx.org/contents/85abf193-2bd…[email protected]).
Эта страница под названием 18.1: Periodicity распространяется по незаявленной лицензии и была создана, изменена и/или курирована OpenStax.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- ОпенСтакс
- Показать страницу TOC
- нет на странице
- Метки
- щелочноземельный металл
- Аллотропы
- Тег автора:OpenStax
- Висмут
- металл
- металлоид
- пассивация
- репрезентативный элемент
- представитель металла
Йодометрическое определение меди в латуни
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 75716
- Оливер Сили
- Калифорнийский государственный университет Домингес-Хиллз
В растворе кислоты практически все окислители количественно окисляют йодид-ион до йода. Образовавшийся в результате реакции йод затем можно оттитровать стандартным раствором тиосульфата натрия. Этот тип непрямого титрования получил общее название йодометрия . Йодометрические методы анализа имеют широкое применение по следующим причинам:
Образовавшийся в результате реакции йод затем можно оттитровать стандартным раствором тиосульфата натрия. Этот тип непрямого титрования получил общее название йодометрия . Йодометрические методы анализа имеют широкое применение по следующим причинам:
- Йодид калия, KI, легко доступен в высокой чистоте.
- Хороший индикатор, крахмал, доступен для обозначения точки эквивалентности в реакции между йодом и тиосульфатом. Крахмал становится сине-черным в присутствии йода. Следовательно, когда иссиня-черная окраска исчезает, йод полностью восстановился до йодид-иона.
- Йодометрические реакции быстрые и количественные.
- Для реакции с йодом доступен точный и стабильный восстановитель, тиосульфат натрия (Na 2 S 2 O 3 ).
Количество йода, высвобождающегося в результате реакции между йодид-ионом и окислителем, является мерой количества окислителя, первоначально присутствующего в растворе. Количество стандартного раствора тиосульфата натрия, необходимое для титрования выделившегося йода, эквивалентно количеству окислителя. Йодометрические методы можно использовать для количественного определения сильных окислителей, таких как дихромат калия, перманганат, перекись водорода, ион меди и кислород.
Количество стандартного раствора тиосульфата натрия, необходимое для титрования выделившегося йода, эквивалентно количеству окислителя. Йодометрические методы можно использовать для количественного определения сильных окислителей, таких как дихромат калия, перманганат, перекись водорода, ион меди и кислород.
Как упоминалось выше, конечная точка титрования йода тиосульфатом определяется изменением цвета индикатора крахмала. При нагревании крахмала в воде образуются различные продукты разложения, среди которых бета-амилоза, образующая с йодом темно-сине-черный комплекс. Чувствительность индикатора повышается при наличии в растворе йодид-иона. Однако, если раствор крахмала добавляют в присутствии высокой концентрации йода, исчезновение сине-черной окраски происходит очень постепенно. Поэтому для использования в непрямых методах индикатор добавляют в тот момент, когда практически весь йод восстанавливается до йодид-иона, что приводит к более быстрому и внезапному исчезновению окраски. Раствор индикатора крахмала должен быть свежеприготовленным, так как он разлагается и его чувствительность снижается. Однако правильно приготовленный раствор будет храниться в течение нескольких недель. Консервант, такой как небольшое количество ионов ртути, может быть добавлен для замедления разложения.
Раствор индикатора крахмала должен быть свежеприготовленным, так как он разлагается и его чувствительность снижается. Однако правильно приготовленный раствор будет храниться в течение нескольких недель. Консервант, такой как небольшое количество ионов ртути, может быть добавлен для замедления разложения.
Растворы тиосульфата натрия доводят до приблизительной концентрации путем растворения соли натрия в предварительно прокипяченной воде. Кипячение воды необходимо для уничтожения микроорганизмов, метаболизирующих ион тиосульфата. Небольшое количество Na 2 CO 3 добавляют к раствору, чтобы довести pH примерно до 9. Раствор стандартизируют, беря известное количество окислителя, обрабатывая его избытком иодид-иона и затем титруя раствор. выделившегося йода с раствором, подлежащим стандартизации. Для этой процедуры можно использовать окислители, такие как дихромат калия, бромат, йодат или ион меди. Вы будете использовать йодат калия, KIO 9{2-}\]
Эта реакция протекает количественно в нейтральных или слабокислых растворах. В сильнощелочных или кислых растворах окисление тиосульфата не протекает по одной реакции. В первом случае тиосульфат-ион окисляется до сульфата, а также до тетратионата. В последнем образующаяся тиосерная кислота подвергается внутренней окислительно-восстановительной реакции с образованием сернистой кислоты и серы. Обе эти реакции приводят к ошибкам, так как стехиометрия реакций отличается от приведенной выше для тиосульфата как восстановителя. Безусловно, важен контроль pH. Во многих случаях выделившийся йод титруют в слабокислом растворе, используемом для реакции сильного окислителя с йодид-ионом. В этих случаях титрование высвобожденного йода должно быть завершено быстро, чтобы исключить чрезмерное воздействие атмосферы, поскольку кислая среда представляет собой оптимальные условия для атмосферного окисления избытка иодид-иона. 9- \rightleftharpoons 2CuI(s) + I_2\]
В сильнощелочных или кислых растворах окисление тиосульфата не протекает по одной реакции. В первом случае тиосульфат-ион окисляется до сульфата, а также до тетратионата. В последнем образующаяся тиосерная кислота подвергается внутренней окислительно-восстановительной реакции с образованием сернистой кислоты и серы. Обе эти реакции приводят к ошибкам, так как стехиометрия реакций отличается от приведенной выше для тиосульфата как восстановителя. Безусловно, важен контроль pH. Во многих случаях выделившийся йод титруют в слабокислом растворе, используемом для реакции сильного окислителя с йодид-ионом. В этих случаях титрование высвобожденного йода должно быть завершено быстро, чтобы исключить чрезмерное воздействие атмосферы, поскольку кислая среда представляет собой оптимальные условия для атмосферного окисления избытка иодид-иона. 9- \rightleftharpoons 2CuI(s) + I_2\]
Это быстрая количественная реакция в слабокислых растворах, если имеется большой избыток йодид-иона и если медь находится в форме простого иона, а не сложный. Выделившийся йод можно оттитровать обычным способом стандартным раствором тиосульфата. Реакция с участием иона меди и иодида протекает количественно, так как образующийся в результате восстановления ион меди удаляется из раствора в виде осадка иодида меди.
Выделившийся йод можно оттитровать обычным способом стандартным раствором тиосульфата. Реакция с участием иона меди и иодида протекает количественно, так как образующийся в результате восстановления ион меди удаляется из раствора в виде осадка иодида меди.
Железо мешает, так как ионы железа(III) окисляют йодид. Поскольку в результате растворения образца латуни железо будет находиться в степени окисления +3, необходимо средство для предотвращения этого вмешательства. Это может быть достигнуто путем превращения железа (III) в растворимый комплекс фосфата железа (III) с использованием фосфорной кислоты. При рН 3,0-4,0 железофосфатный комплекс не восстанавливается йодид-ионом. Если присутствуют мышьяк и сурьма, они не будут мешать при этом pH, если они находятся в своих более высоких степенях окисления. Латунные составы также могут содержать до 39% Zn, 2,5 % Sn и 8,5 % Pb. При растворении в концентрированной азотной кислоте цинк и свинец превращаются в Pb 2+ и Zn 2+ . Они не мешают анализу меди, так как не восстанавливаются до состояний Pb + и Zn + под действием иодид-иона в условиях данного эксперимента. Олово окисляется до Sn 4+ концентрированной азотной кислотой, и после разбавления и корректировки pH эта форма становится SnO 2 , которая нерастворима и может наблюдаться в виде инертного белого осадка на дне колбы. В этих условиях олово не мешает анализу.
Они не мешают анализу меди, так как не восстанавливаются до состояний Pb + и Zn + под действием иодид-иона в условиях данного эксперимента. Олово окисляется до Sn 4+ концентрированной азотной кислотой, и после разбавления и корректировки pH эта форма становится SnO 2 , которая нерастворима и может наблюдаться в виде инертного белого осадка на дне колбы. В этих условиях олово не мешает анализу.
Источники ошибок
Ниже приведены наиболее важные источники ошибок в йодометрическом методе:
- Потеря йода при испарении из раствора. Это можно свести к минимуму, имея большой избыток йодида, чтобы йод оставался связанным в виде иона трийодида. Также должно быть очевидно, что титрование с участием йода должно проводиться в холодных растворах, чтобы свести к минимуму потери при испарении.
- Атмосферное окисление йодид-иона в кислом растворе. В кислом растворе необходимо быстрое титрование выделившегося йода, чтобы предотвратить окисление.

- Растворы крахмала, которые уже не свежие или приготовлены неправильно. В этом случае индикатор не будет вести себя должным образом в конечной точке, и количественное определение будет невозможно.
ЭКСПЕРИМЕНТАЛЬНАЯ ИНФОРМАЦИЯ
Нажмите здесь, чтобы увидеть изображения того, что можно ожидать от этого эксперимента.
Приготовление 0,10 М стандарта Na
2 S 2 O 3 Раствор
Мерным цилиндром отмерить 1 литр дистиллированной воды. Поместите его в 1-литровый стакан и кипятите воду не менее 5 минут. Взвесьте 25 г Na 9.0049 2 S 2 O 3 ·5H 2 O и 0,1 г Na 2 CO 3 . Растворите тиосульфат в горячей воде и затем охладите этот раствор с помощью бани со льдом до комнатной температуры. Затем добавьте карбонат и перемешайте до его полного растворения. Перелейте раствор в пластиковую бутылку емкостью 1 литр. Когда не используете, храните эту бутылку в темноте шкафа для оборудования, так как разложение тиосульфата катализируется светом.
Пустое определение
Йодид калия может содержать заметные количества йодат-иона, которые в кислом растворе реагируют с йодидом с образованием йода. Высвобожденный йод будет реагировать с тиосульфатом, что приведет к слишком низкой кажущейся молярности тиосульфата. Следующая процедура позволяет определить коррекцию бланка, которая будет надлежащим образом корректировать любой йодат, который может присутствовать. Готовят раствор ровно 2,00 г KI, растворенных в 50 мл дистиллированной воды, затем подкисляют раствор 5 мл 3 М серной кислоты и сразу же добавляют 5 мл индикатора крахмала. Если сразу после смешивания появляется иссиня-черная окраска, используйте раствор тиосульфата в бюретке, чтобы определить объем раствора, необходимый для исчезновения окраски. Этот объем необходимо вычесть из объемов стандартизации и анализов. Если йодид калия полностью не содержит йодата, то, конечно, никакого окрашивания не будет, и коррекция бланка не потребуется.
Стандартизация Na
2 S 2 O 3 Раствор
Высушите приблизительно 2 г йодата калия, KIO 3 , при температуре 110 o C в течение одного часа. Взвешивают с точностью ±0,0001 г три образца йодата калия весом около 0,12 г непосредственно в трех колбах Эрленмейера объемом 250 мл. Растворяют йодат в 75 мл дистиллированной воды. Накройте колбы парафильмом и храните их. Промойте и наполните бюретку раствором. В каждый из растворов йодата калия добавить по 2,00 г KI. Если требуется коррекция пробела, добавьте ровно 2,00 г KI к каждый . Если определение холостого опыта не требуется, точное количество KI не имеет решающего значения, но должно быть близко к 2 г. Затем к одному из растворов добавьте 10 мл 1 М HCl. Он станет темно-коричневого цвета. Немедленно оттитровать раствором тиосульфата. Когда цвет раствора станет очень бледно-желтым, добавьте 5 мл индикатора крахмала. Продолжайте титрование до тех пор, пока не исчезнет синяя окраска крахмального комплекса. Выполните ту же процедуру с каждым из двух других растворов, сначала добавляя HCl, а затем титруя. Исправьте свои данные титрования на ошибку бюретки и, если необходимо, примените поправку на бланк.
Взвешивают с точностью ±0,0001 г три образца йодата калия весом около 0,12 г непосредственно в трех колбах Эрленмейера объемом 250 мл. Растворяют йодат в 75 мл дистиллированной воды. Накройте колбы парафильмом и храните их. Промойте и наполните бюретку раствором. В каждый из растворов йодата калия добавить по 2,00 г KI. Если требуется коррекция пробела, добавьте ровно 2,00 г KI к каждый . Если определение холостого опыта не требуется, точное количество KI не имеет решающего значения, но должно быть близко к 2 г. Затем к одному из растворов добавьте 10 мл 1 М HCl. Он станет темно-коричневого цвета. Немедленно оттитровать раствором тиосульфата. Когда цвет раствора станет очень бледно-желтым, добавьте 5 мл индикатора крахмала. Продолжайте титрование до тех пор, пока не исчезнет синяя окраска крахмального комплекса. Выполните ту же процедуру с каждым из двух других растворов, сначала добавляя HCl, а затем титруя. Исправьте свои данные титрования на ошибку бюретки и, если необходимо, примените поправку на бланк. Рассчитайте молярность Na 2 S 2 O 3 раствор. Результаты должны совпадать в пределах 0,2% от среднего. Если вы не достигли такой точности, титруйте дополнительные образцы.
Рассчитайте молярность Na 2 S 2 O 3 раствор. Результаты должны совпадать в пределах 0,2% от среднего. Если вы не достигли такой точности, титруйте дополнительные образцы.
Растворение образца латуни
В следующих процедурах этого раздела используются нагревательные плиты в вытяжных шкафах. Растворы растворенной латуни обычно имеют небольшой объем и высокие концентрации кислот и солей. Могут происходить «удары» или небольшие взрывы пара в перегретой жидкости. Вы не хотите, чтобы ваша рука была близко к отверстию колбы, если раствор внезапно «ударится», потому что капли кислоты (не говоря уже о части вашего образца) вылетят из колбы и, возможно, попадут вам в руку. По этой причине вы должны использовать свои щипцы, чтобы ставить колбы на плиту и снимать их. Не используйте полоски бумажных полотенец или резиновые ручки Hot Hands, потому что ваша настоящая рука окажется слишком близко к горлышку колбы.
Образец латуни, который вы получите, не нужно сушить перед использованием. Точно взвесьте три образца латуни весом около 0,3 г каждый непосредственно в отдельные колбы Эрленмейера объемом 250 мл. В вытяжной шкаф добавить 5 мл 6 М HNO 3 . Нагрейте раствор на плите в вытяжном шкафу до полного растворения. Добавьте 10 мл концентрированного (не 3 М) H 2 SO 4 и продолжайте нагревание до появления белых паров SO 3 . Важно, чтобы вы не перепутали обычный водяной пар с SO 9.0049 3 дым. Также важно, чтобы колба , а не была снята с колпака. SO 3 пары опасны, их нельзя вдыхать. Только при появлении немного более плотного белого дыма SO 3 можно быть уверенным, что весь HNO 3 удален. NO 3 — окислит I — и, следовательно, серьезно помешает процедуре. Охладите колбу на воздухе в течение одной-двух минут, а затем на бане со льдом, после чего осторожно добавьте 20 мл дистиллированной H 2 O. Прокипятить одну-две минуты, затем снова охладить на ледяной бане.
Точно взвесьте три образца латуни весом около 0,3 г каждый непосредственно в отдельные колбы Эрленмейера объемом 250 мл. В вытяжной шкаф добавить 5 мл 6 М HNO 3 . Нагрейте раствор на плите в вытяжном шкафу до полного растворения. Добавьте 10 мл концентрированного (не 3 М) H 2 SO 4 и продолжайте нагревание до появления белых паров SO 3 . Важно, чтобы вы не перепутали обычный водяной пар с SO 9.0049 3 дым. Также важно, чтобы колба , а не была снята с колпака. SO 3 пары опасны, их нельзя вдыхать. Только при появлении немного более плотного белого дыма SO 3 можно быть уверенным, что весь HNO 3 удален. NO 3 — окислит I — и, следовательно, серьезно помешает процедуре. Охладите колбу на воздухе в течение одной-двух минут, а затем на бане со льдом, после чего осторожно добавьте 20 мл дистиллированной H 2 O. Прокипятить одну-две минуты, затем снова охладить на ледяной бане.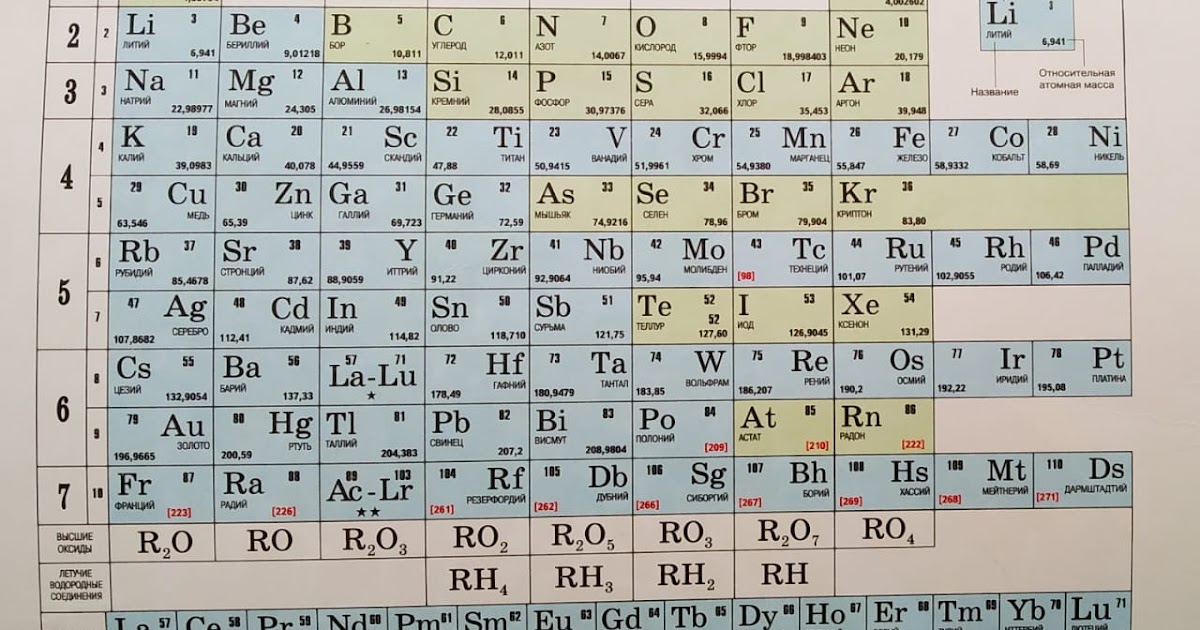 Продолжайте держать колбу на ледяной бане и с помощью пипетки по каплям добавляйте концентрированный NH 3 (водн.) при соответствующем перемешивании до тех пор, пока светло-голубой цвет раствора полностью не изменится на темно-синий цвет раствора. медно-тетраамминовый комплекс. Может потребоваться до 400 капель (20 мл). Раствор необходимо охлаждать на бане со льдом, так как происходит реакция между концентрированным H 2 SO 4 и концентрированный NH 3 сильно экзотермичен. Теперь добавляйте по каплям 3 M H 2 SO 4 , пока темно-синий цвет не исчезнет. Вам не нужно производить полное исчезновение темно-синего цвета, но вам нужно приблизиться к этой точке. Последующее добавление фосфорной кислоты снизит pH примерно до 3,5. Если вы добавите слишком много 3M H 2 SO 4 , pH может оказаться достаточно низким, чтобы вызвать нежелательные побочные реакции при восстановлении Cu 2+ с йодидом.
Продолжайте держать колбу на ледяной бане и с помощью пипетки по каплям добавляйте концентрированный NH 3 (водн.) при соответствующем перемешивании до тех пор, пока светло-голубой цвет раствора полностью не изменится на темно-синий цвет раствора. медно-тетраамминовый комплекс. Может потребоваться до 400 капель (20 мл). Раствор необходимо охлаждать на бане со льдом, так как происходит реакция между концентрированным H 2 SO 4 и концентрированный NH 3 сильно экзотермичен. Теперь добавляйте по каплям 3 M H 2 SO 4 , пока темно-синий цвет не исчезнет. Вам не нужно производить полное исчезновение темно-синего цвета, но вам нужно приблизиться к этой точке. Последующее добавление фосфорной кислоты снизит pH примерно до 3,5. Если вы добавите слишком много 3M H 2 SO 4 , pH может оказаться достаточно низким, чтобы вызвать нежелательные побочные реакции при восстановлении Cu 2+ с йодидом. Если вы не уверены в исчезновении темно-синего цвета, вы можете поместить 50 мл 0,06 М Cu 2+ в чистую колбу на 250 мл и добавлять по каплям 12 М аммиака, пока не получите безошибочно узнаваемый темно-синий цвет. Затем по каплям добавляйте 3M H 2 SO 4 , пока не исчезнет синий цвет почти . Затем добавьте 2 мл концентрированной фосфорной кислоты, и вы должны увидеть, как темный цвет полностью исчезнет. Вы можете скопировать эту процедуру, чтобы добиться соответствующего pH около 3,5 для последующих этапов анализа. Теперь вернемся к вашему реальному образцу: как только вы убедитесь, что не добавили слишком много 3M H 2 SO 4 , но темная окраска тетраамминового комплекса меди почти исчезла, добавьте к каждому образцу 2,0 мл концентрированной фосфорной кислоты, H 3 PO 4 . Убедитесь сами, что они имеют светло-медный цвет, а не темный, и накройте колбы парафильмом и отложите в сторону, пока не будете готовы приступить к титрованию.
Если вы не уверены в исчезновении темно-синего цвета, вы можете поместить 50 мл 0,06 М Cu 2+ в чистую колбу на 250 мл и добавлять по каплям 12 М аммиака, пока не получите безошибочно узнаваемый темно-синий цвет. Затем по каплям добавляйте 3M H 2 SO 4 , пока не исчезнет синий цвет почти . Затем добавьте 2 мл концентрированной фосфорной кислоты, и вы должны увидеть, как темный цвет полностью исчезнет. Вы можете скопировать эту процедуру, чтобы добиться соответствующего pH около 3,5 для последующих этапов анализа. Теперь вернемся к вашему реальному образцу: как только вы убедитесь, что не добавили слишком много 3M H 2 SO 4 , но темная окраска тетраамминового комплекса меди почти исчезла, добавьте к каждому образцу 2,0 мл концентрированной фосфорной кислоты, H 3 PO 4 . Убедитесь сами, что они имеют светло-медный цвет, а не темный, и накройте колбы парафильмом и отложите в сторону, пока не будете готовы приступить к титрованию.
Титрование образца растворенной латуни
Если вы оставили растворенные образцы стоять на ночь, обязательно нагрейте образец на горячей плите (это можно сделать на рабочем столе), чтобы растворить все более крупные кристаллы сульфата меди, могло образоваться. Обязательно охладите образцы до комнатной температуры или ниже с помощью ледяной бани. В этот момент растворы все еще будут содержать тонкий белый осадок; однако это не помешает остальной части процедуры. С этого момента работайте только с одним образцом за раз. Добавьте 4,0 г KI в один из ваших образцов и немедленно титруйте стандартным раствором тиосульфата. Образец содержит белый осадок CuI и цвет I 3 — следует наблюдать в отношении этого осадка. Сначала суспензия будет коричневой или темно-желто-коричневой. Продолжайте добавлять тиосульфат, пока суспензия не станет светло-горчичного цвета. В этот момент добавьте 5 мл индикатора крахмала и титруйте до тех пор, пока смесь в колбе не приобретет молочно-розовый или бледно-лиловый оттенок. Теперь добавьте 2 г KSCN и хорошо перемешайте; раствор несколько потемнеет. После добавления тиоцианата продолжайте добавлять по каплям еще тиосульфат. Вы должны наблюдать внезапное изменение цвета на белый или кремовый. Это конечная точка титрования. После титрования всех трех образцов рассчитайте процентное содержание Cu в каждом из образцов латуни, среднее процентное содержание и среднее отклонение.
Теперь добавьте 2 г KSCN и хорошо перемешайте; раствор несколько потемнеет. После добавления тиоцианата продолжайте добавлять по каплям еще тиосульфат. Вы должны наблюдать внезапное изменение цвета на белый или кремовый. Это конечная точка титрования. После титрования всех трех образцов рассчитайте процентное содержание Cu в каждом из образцов латуни, среднее процентное содержание и среднее отклонение.
Приведенное выше описание применимо к образцам латуни с низким содержанием цинка (<10%). У некоторых из вас могут быть образцы латуни с более высокой концентрацией цинка. Такие образцы становятся довольно темными после добавления KI и лишь немного светлеют при добавлении тиосульфата. «Горчичный цвет» будет темнее, чем у образцов с низким процентным содержанием меди. При добавлении крахмала образец снова станет темно-сине-черным, а по мере приближения к конечной точке с тиосульфатом суспензия приобретет фиолетовый цвет, а не молочно-розовый или бледно-лиловый оттенок. При добавлении KSCN раствор несколько потемнеет, как и в случае с другими образцами, но конечная точка будет немного темнее белого или кремового цвета, описанного выше. Если вы считаете, что у вас есть образец с высоким содержанием цинка, внимательно наблюдайте за своим прогрессом и делайте заметки, которые позволят вам добиться повторяемости.
Если вы считаете, что у вас есть образец с высоким содержанием цинка, внимательно наблюдайте за своим прогрессом и делайте заметки, которые позволят вам добиться повторяемости.
Пояснение: Восстановление Cu 2+ до Cu + происходит в результате окисления I — до I 2 . I 2 соединяется с йодид-ионом с образованием темно-коричневого триодид-иона I 3 — . Избыток иодид-иона также вызывает осаждение восстановленной меди в виде белого йодида меди CuI. I 2 и I 3 — в растворе имеют тенденцию к адсорбции на поверхности CuI, что делает их недоступными для быстрого восстановления тиосульфатом. В результате йодометрическое титрование с использованием восстановленной меди имеет тенденцию давать более низкие результаты, если только адсорбированный I 2 может быть высвобожден путем добавления иона тиоцианата, SCN — , который конкурирует с адсорбированными молекулами йода на поверхности твердых частиц CuI. После добавления тиоцианата продолжайте добавлять по каплям еще тиосульфат. Вы должны наблюдать внезапное изменение цвета на белый или кремовый. Это конечная точка титрования. После титрования всех трех образцов рассчитайте процентное содержание Cu в каждом из образцов латуни, среднее процентное содержание и среднее отклонение.
После добавления тиоцианата продолжайте добавлять по каплям еще тиосульфат. Вы должны наблюдать внезапное изменение цвета на белый или кремовый. Это конечная точка титрования. После титрования всех трех образцов рассчитайте процентное содержание Cu в каждом из образцов латуни, среднее процентное содержание и среднее отклонение.
ОТЧЕТ
Ваш отчет должен содержать следующую информацию в двух разделах ниже.
1. Неизвестный номер
2. Три навески KIO 3 , используемые для стандартизации тиосульфата
3. Объем в мл тиосульфата для каждого из ваших стандартизационных титрований
4. Средняя молярность раствора сульфата
5. Масса латуни, использованная для каждого образца
6. Объем раствора тиосульфата, использованный для каждого образца
7. Процентное содержание меди в каждом образце
8. Среднее процентное содержание меди в вашем образце латуни
9. Среднее отклонение от среднего значения процентного содержания меди для трех образцов
10. Страницы лабораторной тетради, содержащие соответствующие данные
Страницы лабораторной тетради, содержащие соответствующие данные
Вопросы по анализу меди в латуни
1. Почему необходимо кипятить воду, используемую для приготовления раствора тиосульфата?
2. Почему Na 2 CO 3 добавляют в раствор тиосульфата?
3. Почему раствор тиосульфата хранят в темноте?
4. Почему HCl добавляют в смесь IO 3 — и почему раствор необходимо немедленно титровать?
5. Почему раствор, содержащий образец растворенной латуни, нагревают для удаления паров SO 3 ?
6. Почему в образец латуни добавлен H 3 PO 4 ?
7. С какой целью KSCN добавляют непосредственно перед конечной точкой титрования?
8. Почему раствор, содержащий растворенную латунь, подщелачивают концентрированным NH 3 , а затем снова подкисляют H 2 SO 4 ?
9. Какова формула комплекса тетрамминмеди(II)?
10. Почему Zn 2+ и Pb 2+ не мешают этой процедуре?
Почему Zn 2+ и Pb 2+ не мешают этой процедуре?
11. Какие осложнения могут возникнуть, если титрование йодтиосульфатом проводить в сильнокислом растворе?
12. Если бы раствор был сильно щелочным, как бы это повлияло на реакцию йодтиосульфата?
13. Почему индикатор крахмала не добавляют в начале тритрации?
Supplement
Йодометрическое определение меди в латуни одновременно и приятно, и сложно из-за диспропорционирования йодата и йодида в кислом растворе с образованием йода, который необходимо быстро титровать из-за летучей природы элементарного вещества. йода из-за осторожности, которую необходимо соблюдать при приготовлении раствора тиосульфата, чтобы он не был съеден бактериями (см. Его нагревание в литровом стакане слева и последующее охлаждение во льду справа ) до его использования и из-за тонкости наблюдаемых изменений цвета.
Здесь мы имеем точно взвешенный раствор йодата калия с добавлением HCl, который только что был подан с избытком йодида калия. Произошло диспропорционирование степеней окисления йода в йодате и йодиде с образованием элементарного йода в комплексе с избытком йодида с образованием триодид-иона. В результате получается темно-красно-коричневый раствор (почти черный), как показано справа.
Произошло диспропорционирование степеней окисления йода в йодате и йодиде с образованием элементарного йода в комплексе с избытком йодида с образованием триодид-иона. В результате получается темно-красно-коричневый раствор (почти черный), как показано справа.
При титровании точно взвешенного (а теперь восстановленного) йодата раствором тиосульфата в процессе его стандартизации раствор сначала становится темно-красным, затем оранжевым, затем желтым. Титрование, показанное здесь слева и справа, иллюстрирует цвета, которые вы можете увидеть в процессе этого стандартизационного титрования.
Наконец, достигается светло-желтый цвет. Изображения слева и справа соответствуют тому, что можно было бы ожидать до добавления индикатора крахмала. Ваш раствор может быть немного темнее этого без существенного влияния на вашу точность (чрезмерное связывание крахмала с йодом, приводящее к преждевременной конечной точке), но не слишком сильно.
Точно так же вы должны быть осторожны, чтобы не выйти за пределы светло-желтой сцены. Пример справа иллюстрирует точку, в которой не хотелось бы двигаться дальше, не рискуя возможностью того, что конечная точка была превышена.
Пример справа иллюстрирует точку, в которой не хотелось бы двигаться дальше, не рискуя возможностью того, что конечная точка была превышена.
На этом этапе можно добавить предварительно откалиброванную аликвоту 5 мл раствора индикатора крахмала, как показано слева. Ваш раствор должен сразу же стать фиолетовым, как показано на рисунке. Осторожно взболтайте раствор, чтобы смешать крахмал с оставшимся в растворе йодом, чтобы подготовить его к немедленному титрованию до конечной точки, как показано слева.
При правильном выполнении процедуры можно ожидать, что до конечной точки останется всего несколько капель. Аккуратно встряхивайте, добавляя по каплям раствор тиосульфата, пока весь фиолетовый цвет не исчезнет.
Образец латуни следует растворить в концентрированной азотной кислоте при нагревании раствора на плитке, как показано слева. Поскольку оксиды азота могут мешать титрованию тиосульфатом, их необходимо удалить добавлением 10 мл концентрированной серной кислоты, как показано справа, но на самом деле рука студента не должна касаться горлышка другой колбы. Растворы растворенной латуни обычно имеют небольшой объем и высокие концентрации кислот и солей. Могут происходить «удары» или небольшие взрывы пара в перегретой жидкости. Вы не хотите, чтобы ваша рука была близко к отверстию колбы, если раствор внезапно «ударится», потому что капли кислоты (не говоря уже о части вашего образца) вылетят из колбы и, возможно, попадут вам в руку.
Растворы растворенной латуни обычно имеют небольшой объем и высокие концентрации кислот и солей. Могут происходить «удары» или небольшие взрывы пара в перегретой жидкости. Вы не хотите, чтобы ваша рука была близко к отверстию колбы, если раствор внезапно «ударится», потому что капли кислоты (не говоря уже о части вашего образца) вылетят из колбы и, возможно, попадут вам в руку.
На изображении слева показаны результаты именно такого разбрызгивания через пять дней после его появления. Эта ученица держала флягу резиновой горячей рукой, и когда фляжка была удалена, она «ударилась», забрызгав ее руку. Ученица немедленно вымыла руку большим количеством воды, а инструктор помог ей втереть раствор карбоната натрия во все пятна. Затем она отправилась в студенческий здравпункт на лечение, но горячая концентрированная кислота уже сделала свое дело. Использование щипцов для тиглей, как показано справа, является более безопасным методом перемещения колб с этими растворами.
Аналогичное разбрызгивание произошло недавно, когда прошло пять секунд между моментом, когда капли горячей азотной и серной кислоты попали на руку и кисть студентки, и тем, когда она начала смывать кислоту большим количеством проточной воды. На верхней паре фотографий показано место падения капель через несколько минут после того, как это произошло. После этого она посетила Студенческий центр здоровья для лечения.
На верхней паре фотографий показано место падения капель через несколько минут после того, как это произошло. После этого она посетила Студенческий центр здоровья для лечения.
Через неделю.
Две недели спустя.
Чтобы ничего не оставлять на волю случая, мы не можем слишком сильно подчеркнуть, что с сильными кислотами нужно обращаться уважительно и бережно. На изображении справа показан результат разбрызгивания и продолжительного контакта с серной кислотой 3M через шесть месяцев после того, как это произошло. Студент работал в неуниверситетской лаборатории. Его начальник пролил и разбрызгал некоторое количество серной кислоты 3M, но не знал, что она вышла за пределы непосредственной зоны рабочего места. Студент стоял в нескольких футах от него. Через час после всплеска студент почувствовал жжение возле лодыжки. На нем были эластичные спортивные штаны, которые непосредственно соприкасались с кожей в этой области. Когда он попытался подтянуть штанину, чтобы выяснить, что вызывает жжение, он заметил, что ткань приклеилась (более или менее) к его коже в месте, вызывающем жжение. Он понял, что произошло, и вскоре после этого отрезал нижнюю часть штанины и обратился за медицинской помощью. Оставшийся шрам является хорошим признаком долговременного появления такой травмы.
Он понял, что произошло, и вскоре после этого отрезал нижнюю часть штанины и обратился за медицинской помощью. Оставшийся шрам является хорошим признаком долговременного появления такой травмы.
Любая кислота, попавшая на кожу, должна быть немедленно смыта. Кислота, стекающая по стенкам лабораторных бутылей, представляет известную опасность для студентов, которые используют бутылки с реагентами совместно.
Человек не сразу осознает такой контакт, потому что даже в случае с концентрированными кислотами есть некоторая задержка, прежде чем реакция между кислотой и кожей повысит температуру достаточно, чтобы можно было почувствовать эффект. Студентам рекомендуется всегда осознавать потенциальные неудачи, вызванные их процедурами, и быть готовыми принять немедленные и соответствующие меры. Если пальцы или другие участки с открытыми участками кожи кажутся влажными, когда они не должны быть влажными, поверхность следует немедленно промыть проточной водой. На изображениях слева и справа показано воздействие либо концентрированной серной, либо азотной кислоты, которые оставались на коже более нескольких секунд (но менее минуты), прежде чем смывались. К счастью, большинство изменений окраски, вызванных таким контактом, исчезают в течение нескольких дней, но постоянная бдительность в лаборатории — это правило, которого следует придерживаться всегда.
К счастью, большинство изменений окраски, вызванных таким контактом, исчезают в течение нескольких дней, но постоянная бдительность в лаборатории — это правило, которого следует придерживаться всегда.
Продолжая давать полезные советы, отметим, что присутствие концентрированной серной кислоты способствует удалению оставшихся оксидов азота из горячего раствора. Эти красные оксиды сначала выкипают, затем начинают выделяться пары триоксида серы, как слева
Полученный образец сначала охлаждают во льду, как слева.
Затем по каплям добавляют концентрированный аммиак до образования темно-синего комплекса тетраамина меди, как показано справа. Затем добавляют 3M серную кислоту до тех пор, пока темная окраска ПОЧТИ не исчезнет, затем добавляют концентрированную фосфорную кислоту, чтобы довести pH до точки, при которой титрование может быть идеально выполнено.
Добавляется йодид калия, и раствор при взбалтывании выглядит так, как показано на рисунке слева. Фактический цвет, который вы получите, будет несколько отличаться и будет зависеть от количества цинка в латуни. Высокие концентрации цинка дают более темные цвета. Раствор титруют, и он медленно теряет свой темный цвет. Обратите внимание на чуть более светлый цвет справа. Наконец, он станет светло-желто-коричневого или горчичного цвета, как показано ниже и слева.
Фактический цвет, который вы получите, будет несколько отличаться и будет зависеть от количества цинка в латуни. Высокие концентрации цинка дают более темные цвета. Раствор титруют, и он медленно теряет свой темный цвет. Обратите внимание на чуть более светлый цвет справа. Наконец, он станет светло-желто-коричневого или горчичного цвета, как показано ниже и слева.
В этот момент добавляют крахмал с помощью калиброванной пипетки слева и взбалтывают суспензию так, чтобы комплекс темного йода/бета-амилозы стал однородным по всему раствору, как справа.
По ходу титрования вы начнете замечать, что при добавлении по каплям раствора тиосульфата в центре раствора латуни образуется пятно, которое все больше и больше начинает напоминать лавандовый цвет. Пятно, образующееся слева, конечно, не кажется мне бледно-лиловым, но в какой-то степени это результат угла и экспозиции фотографии.
Наконец, цвет лаванды становится более выраженным, и вся ваша подвеска будет все больше и больше выглядеть слева и справа.


 Такие латуни часто называют автоматными;
Такие латуни часто называют автоматными;
 Цинк загружают в расплав последним, после того как будет удален шлак.
Цинк загружают в расплав последним, после того как будет удален шлак.



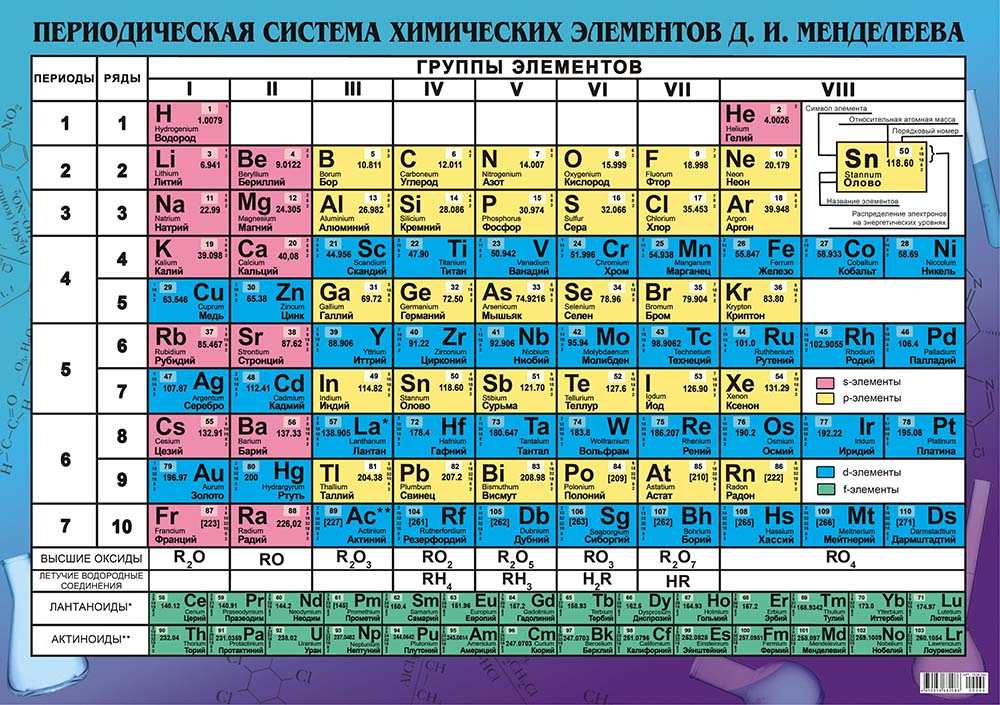 Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Загрузите бесплатно по адресу http://cnx.org/contents/85abf193-2bd…
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Загрузите бесплатно по адресу http://cnx.org/contents/85abf193-2bd…