Какие виды коррозии вам известны: Виды коррозии | Руководство по выбору материалов
Содержание
ГДЗ химия 11 класс Радецкий, дидактический материал, тема 5, раб 1, вариант 1, 3 задание. В чём сущность коррозии? – Рамблер/класс
ГДЗ химия 11 класс Радецкий, дидактический материал, тема 5, раб 1, вариант 1, 3 задание. В чём сущность коррозии? – Рамблер/класс
Интересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
В чём заключается сущность коррозии металлов? Какие виды коррозии вам известны?
ответы
Привет!
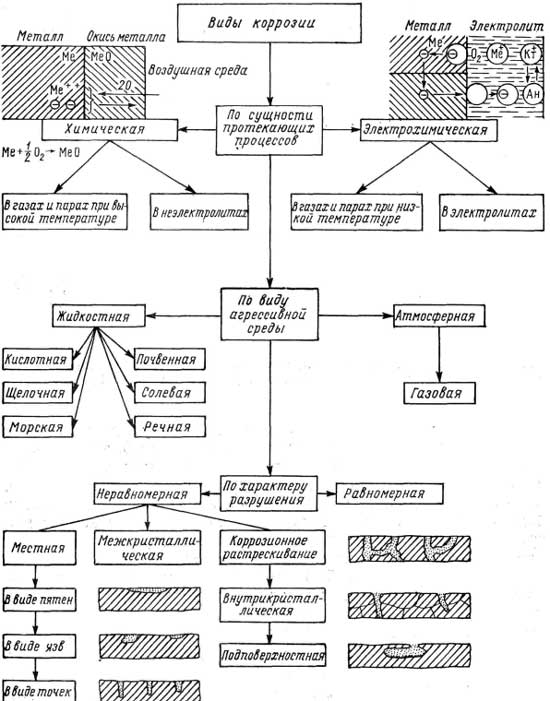
Коррозия — процесс разрушения металла под действием окружающей среды. По механизму разрушения различают два типа коррозии. 1. Химическая — в основе лежит химическое взаимодействие. 2. Электрохимическая — наряду с химическими процессами наблюдаются и электрические.
По механизму разрушения различают два типа коррозии. 1. Химическая — в основе лежит химическое взаимодействие. 2. Электрохимическая — наряду с химическими процессами наблюдаются и электрические.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
ЕГЭ Математика 11 класс. Ященко И. В. Тренировочная работа 39 Вопрос 10 Найдите корень уравнения.
Привет пользователи! Окажите пожалуйста услугу…ответить помогите….
Найдите корень уравнения
(Подробнее…)
ЕГЭМатематикаЯщенко И.В.Семенов А.В.11 класс
Помогите решить очень нужно
Помогите
ГДЗЭкзамены
Приветики! Поможете мне с прогрессией? Раздел II. № 6.21. ГДЗ Алгебра 9 класс ОГЭ Кузнецова.
1) Найдите сумму первых десяти членов арифмети-
ческой прогрессии, если сумма первых трех ее чле-
нов равна нулю, а сумма (Подробнее. ..)
..)
ГДЗАлгебра9 классКузнецова Л. В.
Задача 4. Работа 3. Расчетные задачи. Химия. Дидактический материал. 10 класс. А.М. Радецкий ГДЗ
Помогите найти решение вот на такую задачу:
Какая масса сажи образуется при термическом разложении этана массой 90 г, если (Подробнее…)
ГДЗХимияРадецкий А.М.10 класс
Задача 16. Работа 3. Расчетные задачи. Химия. Дидактический материал. 10 класс. А.М. Радецкий ГДЗ
Горит! Спасайте! Выручите ответом на задачу.
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором (Подробнее…)
ГДЗХимияРадецкий А.М.10 класс
Урок по теме «Коррозия металлов»
Образовательные цели: сформировать представление о коррозии металлов как самопроизвольном окислительно-восстановительном процессе, её значении, причинах, механизме и способах защиты; показать влияние на скорость коррозии таких факторов, как природа веществ, температура и присутствие катализатора (ингибитора).
Развивающие: развить умение проведения химического эксперимента с соблюдением правил техники безопасности, строить логические цепочки и выводы из наблюдений, прогнозировать решение некоторых проблем.
Воспитательные: совершенствовать коммуникативные умения в ходе коллективного обсуждения, продолжать формировать убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире.
Оборудование: компьютер, мультимедийный проектор, оборудование и реактивы для лабораторного эксперимента, таблицы: «Коррозия металлов», «Защита металлов от коррозии», презентация к уроку.
Методы и приемы обучения: метод проблемного изложения материала, метод поисковой беседы, исследовательский метод и сопровождение лабораторного проблемного эксперимента.
Тип урока: изучение нового материала.
Ход урока
I. Организационный момент.
Организационный момент.
II. Объяснение нового материала.
В начале прошлого столетия по заказу одного американского миллионера, была построена роскошная яхта «Зов моря». Днище её было обшито сплавом меди и никеля, киль и другие детали были изготовлены из стали. Когда яхту спустили на воду, оказалось, что она не пригодна к использованию. И ещё до выхода в открытое море была полностью выведена из строя
31 января 1951 года обрушился железный мост в Квебеке (Канада), введенный в эксплуатацию в 1947 году.
В 1964 году рухнуло одно из самых высотных сооружений в мире – 400 метровая антенная мачта в Гренландии.
Разобраться, что произошло нам, поможет стихотворение:
Мы видим мрачную картину,
Вот ржавый гвоздь и ржавая труба,
И даже новую машину
За год буквально съела ржа.
Ползет она как змей ужасный
И вглубь, и вширь, и поперек.
Корабль, краскою блиставший,
С дырой в боку ко дну идет.
Ржавеет все – тросы, лебедка,
Опоры зданий и мостов,
И даже руль подводной лодки
Всегда к ржавлению готов.
И где же выход из проблемы,
И в чем причина бедствий тех?
Найдем ответ мы непременно
Пусть нам сопутствует успех.
Уч-ль: Итак, ребята, какова тема нашего урока?
Уч-ся: Коррозия металлов.
Уч-ль: мы знаем тему урока (слайд №1, приложение 1), давайте теперь сформулируем цели нашего урока, что нам необходимо сегодня изучить.
Уч-ся: Что такое коррозия, её причины, реакции, которые при этом происходят, как бороться с коррозией. (слайд №2, приложение 1)
Уч-ль: чтобы знать, как бороться с врагом надо хорошо изучить его. Обратите внимание на эпиграф к уроку: «Знать – значит победить!» (А.Н. Несмеянов) (Слайд №3, приложение 1)
Обратите внимание на эпиграф к уроку: «Знать – значит победить!» (А.Н. Несмеянов) (Слайд №3, приложение 1)
Слово коррозия происходит от латинского corrodere, что означает разъедать (слайд №4, приложение 1). Хотя коррозию чаще всего связывают с металлами, но ей подвергаются также камни, пластмассы и другие полимерные материалы и дерево. Например, в настоящее время мы являемся свидетелями большого беспокойства людей в связи с тем, что от кислотных дождей катастрофически страдают памятники (здания и скульптуры), выполненные из известняка или мрамора. Таким образом, мы с вами подошли к формулировке понятия «коррозия»
Коррозия – называют самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды.
Процессы физического разрушения к коррозии не относят хотя часто они наносят не меньший вред памятникам культуры. Их называют истиранием, износом.
Уч-ль: чем покрывается железный гвоздь при коррозии?
Уч-ся: ржавчиной.
Уч-ль: Ржавлением называется только коррозия железа и его сплавов. Другие металлы коррозируют, но не ржавеют. Хотя коррозируют практически все металлы, но в повседневной жизни человек чаще всего сталкивается с коррозией железа.
Перейдем с вами теперь к классификации коррозии металлов. (слайд № 5, приложение 1)
Приложение 2
«По природе агрессивных сред»: воздушная, газовая, морская, почвенная, биологическая.
«По механизму возникновения» (слайд № 7, приложение 1): химическая и электрохимическая.
Рассмотрим подробнее химическую коррозию. (слайд № 8, приложение 1) – запись в тетради.
Химическая коррозия – разрушение металла при взаимодействии его с сухими газами или жидкостями, не проводящими электрический ток (например, нефть).
Ей подвергается арматура печей, детали двигателей внутреннего сгорания и аппаратура химической промышленности. При этом происходит окислительно-восстановительные реакции, в ходе которой металл окисляется, а присутствующий в среде окислитель восстанавливается, электроны переходят от металла к окислителю без возникновения в цепи электрического тока.
Демонстрация. Прокалим медную проволоку на воздухе. Что наблюдаете.
Уч-ся: изменение окраски – появление черного налета, значит произошла химическая реакция.
При взаимодействии меди с кислородом идет реакция:
2Cu + O2 → 2CuO (запись в тетради и на доске)
Cu0 – 2e → Cu2+| 2| — востановитель, процесс окисления
O20 + 4e → 2O2- | 1| — окислитель, процесс восстановления
Некоторые металлы на воздухе покрываются плотной оксидной пленкой, например алюминий, и металл не корродирует. Что не скажешь о железе – ржавчина не прилегает к металлу, рыхлая, и металл может разрушиться весь.Оксидная пленка оксида железа содержит: FeO, Fe2O3, Fe3O4.
Что не скажешь о железе – ржавчина не прилегает к металлу, рыхлая, и металл может разрушиться весь.Оксидная пленка оксида железа содержит: FeO, Fe2O3, Fe3O4.
Мы рассмотрели с вами химическую коррозию, а теперь рассмотрим электрохимическую.
Электрохимическая коррозия – разрушение металла в среде электролита с возникновением электрического тока. (Запись в тетради). (Cлайд №9, приложение 1)
При данном виде коррозии требуется наличие электролита (конденсат, дождевая вода и т.д.), как например при ржавлении железа во влажном воздухе. При электрохимической коррозии возникает электрическая цепь.
4Fe + 3O2(воздух) + 6H2O(влага) → 4Fe(OH)3
Может подвергаться один металл, но и металлы в контакте друг с другом.
Демонстрация: Взаимодействие цинка с разбавленной соляной кислотой. Что происходит?
Уч-ся: Цинк реагирует с кислотой, выделяется газ водород.
Уч-ль: Добавим немного раствора хлорида меди (II). Что наблюдаем?
Уч-ся: На поверхности цинка выделяется медь и водород бурно выделяется.
Схема процесса:
Zn0 – 2e → Zn2+ (запись в тетради)
2H+ + 2e → H20
Zn0 + 2H+ → Zn2+ + H20
В результате возникает гальванический элемент. Замечено, что сверхчистые металлы устойчивы к коррозии.Например, сверхчистое железо намного меньше корродирует, чем обычное железо. (Слайд №10, приложение 1) Знаменитая Кутубская колонна в Индии близ Дели уже полторы тысячи лет стоит и не разрушается, несмотря на жаркий и влажный климат. Сделана она из чистого железа (99,72 %) и весом 6,5 тонн, высотой 7,2 метра и в диаметреот 42 см у основания и до 30 см у верха. Колонна была воздвигнута в честь царя Чандрагупты II . По народному поверью кто прислонится к колонне спиной и сведет за ней руки исполнится заветное желание. Ученые предполагают, что эта колонна изготовлена из метеоритного железа. Мы рассмотрели с вами виды коррозии.
Сделана она из чистого железа (99,72 %) и весом 6,5 тонн, высотой 7,2 метра и в диаметреот 42 см у основания и до 30 см у верха. Колонна была воздвигнута в честь царя Чандрагупты II . По народному поверью кто прислонится к колонне спиной и сведет за ней руки исполнится заветное желание. Ученые предполагают, что эта колонна изготовлена из метеоритного железа. Мы рассмотрели с вами виды коррозии.
Следующим этапом нашего урока будет рассмотрение факторов, влияющих на коррозию металлов.
Для этого необходимо провести ряд лабораторных орытов. У учащихся на столах карточки с инструкциями по проведению лабораторных опытов и соблюдению правил по технике безопасности.
Проведем лабораторные опыты:
- Fe + H2O→ (слайд № 11, приложение 1)
- Fe + NaCl (p-p) →
- Fe, Cu + NaCl(p-p)→
- Fe,Zn + NaCl (p-p) →
- Fe + NaCl + NaOH →
Учащиеся проводят опыты и сравнивают с опытным образцом проведенным несколько дней назад. Результаты обсуждаются и сравниваются с данными со слайда. (слайды № 12-13, приложение 1)
Результаты обсуждаются и сравниваются с данными со слайда. (слайды № 12-13, приложение 1)
Стакан №1: Железо слабо прокорродировало, в чистой воде коррозия идет медленно, так как это слабый электролит.
Стакан №2: Скорость коррозии выше, чем в первом случае, следовательно хлорид натрия увеличивает скорость коррозии.
Стакан №3: Железный гвоздь в контакте с медной проволокой, опущенный в раствор хлорида натрия сильно прокорродировал.
Стакан №4: в контакте с цинком железо не корродирует.
Стакан №5: железный гвоздь, опущенный в раствор хлорида натрия, к которому добавили гидроксида натрия не корродирует.
Уч-ль: Какой вывод мы можем сделать?
Уч-ся: Скорость коррозии меняется в зависимости от контакта с другими химическими веществами.
Уч-ль: а есть ли способы защиты от коррозии?
Уч-ся: есть.
Уч-ль: зная механизм коррозии и причины её возникновения, человек научился защищать металлы от коррозии. Вспомним с вами эпиграф нашего урока (Знать — значит победить) (слайд №14, приложение 1)
- Неметаллическое покрытие (лаки, масла, краски и т.д.). Эти вещества изолируют металл от внешней среды. ( Работа с таблицей методы защиты от коррозии). Например, Эйфелева башня в Париже изготовлена из стали и требует покрытия краской для защиты от коррозии и стала весить вместо 9 тонн стала на 70 тонн больше. (слайд №15, приложение 1)
- Металлическое покрытие – некорродирующими металлами (Zn, Cr, Ag, Ni, Sn и т.д.). Кровельное железо покрывают цинком, который охраняет железо от коррозии, хотя цинк и является более активным металлом. Он сам покрыт оксидной пленкой. (слайд №16, приложение 1)
- Нержавеющие стали ( введение легирующих металлов: Cr, Ni, Co, Cu и т.
 д.). Основано на создании сплавов с антикоррозионными свойствами. Введение в сталь 12% хрома получают сталь устойчивую к коррозии. А введением никеля, кобальта и меди — усиливают антикоррозионные свойства, так как повышают склонность сплавов к пассивации (образование на поверхности металла устойчивой оксидной пленки). (слайд №17, приложение 1)
д.). Основано на создании сплавов с антикоррозионными свойствами. Введение в сталь 12% хрома получают сталь устойчивую к коррозии. А введением никеля, кобальта и меди — усиливают антикоррозионные свойства, так как повышают склонность сплавов к пассивации (образование на поверхности металла устойчивой оксидной пленки). (слайд №17, приложение 1) - Введение ингибитора. Ингибитор – это вещество, способное в малых количествах замедлять протекание химических процессов или останавливать их. Дамасские мастера для снятия окалины использовали растворы серной кислоты с добавками пивных дрожжей, муки, крахмала. Эти примеси были первыми ингибиторами. В результате растворялись лишь окалина и ржавчина. Посмотрите на табл. «Методы защиты от коррозии» Гвоздь в воде с маслом не корродирует – масло является ингибитором) Ингибиторы широко применяются при очистке от накипи паровых котлов, снятия окалины с обработанных изделий, при хранении и перевозке соляной кислоты в стальной таре.

- Протекторная (более активный металл, стоящий левее в ряду электрохимического напряжения металлов) – легко разрушается. Протекторная защита применяется в тех случаях если, когда защищается конструкция (подземный трубопровод, корпус корабля), находящаяся в среде электролита (морская вода, подземные почвенные воды и т.д.). Сущность такой защиты заключается в том, что конструкцию соединяют с протектором – более активным металлом, чем металл защищаемой конструкции. Например, дно корабля защищают кусочками из металла Zn, защищая железное дно от разрушения. В роли протекторов выступают и другие металлы: Mg, Al, Zn и сплавы из них. Мы рассмотрели с вами способы защиты металлов от коррозии.
III. Первичное закрепление материала (слайд №19, приложение 1)
Самостоятельная работа «Коррозия металлов» по вариантам.
Вариант №1
- Что такое «коррозия»? Какие факторы способствуют замедлению коррозии металлов?
- На стальной крышке поставлена медная заклепка.
 Что разрушится раньше – крышка или заклепка? Почему?
Что разрушится раньше – крышка или заклепка? Почему?
Вариант №2
- Какие виды коррозии вам известны?
- Почему луженный( покрытый оловом) железный бак на месте повреждения защитного слоя быстро разрушается?
Вариант №3
- Какие факторы, способствуют усилению коррозии?
- Какие металлы при взаимном контакте в присутствии электролита быстрее разрушаются Cu или Zn, Al или Fe? Почему?
Вариант №4
- Перечислите способы борьбы с коррозией?
- Почему на оцинкованном баке, на месте царапины, цинк разрушается, а железо не ржавеет?
IV. Подведение итогов урока
Д/з: §10, упр.6 (слайд №20, приложение 1)
Приложение 3
Приложение 4
видов коррозии | Руководство по выбору материалов
Чтобы найти правильное решение по материалам, нужно начать с источника проблемы.
> Просмотрите и загрузите версию Руководства по выбору материалов для печати легче всего обнаружить и предсказать. Это необычно, но не неслыханно, чтобы общая коррозия приводила к катастрофическим отказам. По этой причине общую коррозию часто считают бельмом на глазу, а не серьезной проблемой. Общая коррозия протекает относительно равномерно по поверхности металла. Постепенное уменьшение толщины стенки компонента необходимо учитывать при расчете номинального давления.
Как это образуется
В морской или другой агрессивной среде поверхность углеродистой или низколегированной стали начинает разрушаться, что приводит к образованию окалины оксида железа, которая со временем становится толще, пока не откалывается и не образуется новая окалина. формы.
Может быть измерено с помощью
- Скорость износа материала в течение года. Например, незащищенная углеродистая сталь может отступать в морской среде на 1 мм каждый год.
- Потеря веса сплава при контакте с агрессивными жидкостями, обычно измеряемая в миллиграммах на квадратный сантиметр открытого материала в день
Возможные решения
Нержавеющая сталь 316/316L; 6-молибденовые сплавы; сплав 2507; сплав 825; сплав 625; сплав С-276; Alloy 400
Локализованная точечная коррозия в хлоридсодержащих средах
Точечная коррозия приводит к образованию небольших полостей или ямок на поверхности материала. Хотя эти ямки можно обнаружить при тщательном визуальном осмотре, они могут расти достаточно глубоко, чтобы продырявить НКТ. Питтинг чаще наблюдается в средах с высоким содержанием хлоридов при повышенных температурах.
Хотя эти ямки можно обнаружить при тщательном визуальном осмотре, они могут расти достаточно глубоко, чтобы продырявить НКТ. Питтинг чаще наблюдается в средах с высоким содержанием хлоридов при повышенных температурах.
Как это образуется
Когда защитный слой оксида (или пассивный оксидный слой) на поверхности металла разрушается, металл становится восприимчивым к потере электронов. Это заставляет железо в металле растворяться в растворе на более анодированном дне ямы, диффундировать вверх и окисляться до оксида железа или ржавчины. Концентрация раствора хлорида железа в яме может увеличиваться и становиться более кислой по мере углубления ямы. Эти изменения приводят к ускоренному росту язвы, перфорации стенок НКТ и протечкам.
Более высокие значения PREN указывают на более высокую стойкость к точечной коррозии. Питтинговая коррозия лучше всего предотвращается правильным выбором сплава. Различные металлы и сплавы можно сравнивать с помощью их эквивалентного числа сопротивления точечной коррозии (PREN), которое рассчитывается на основе химического состава материала. PREN увеличивается с более высокими уровнями хрома, молибдена и азота.
PREN увеличивается с более высокими уровнями хрома, молибдена и азота.
Возможные решения
6-молибденовые сплавы; сплав 2507; сплав 825; сплав 625; сплав С-276; Сплав 400
Локализованная щелевая коррозия в хлоридсодержащих средах
В типичной жидкостной системе щели существуют между трубками и трубными опорами или зажимами труб, между соседними участками труб, а также под грязью и отложениями, которые могут скопиться на поверхностях. Трещин практически невозможно избежать в трубных установках, а узкие щели представляют наибольшую опасность возникновения коррозии.
Как она образуется
Как и точечная коррозия, щелевая коррозия начинается с разрушения пассивного оксидного слоя, защищающего металл. Это разрушение приводит к образованию небольших ямок. Ямы становятся все больше и глубже, пока не покроют всю расщелину. В некоторых местах трубка может быть перфорирована. Щелевая коррозия возникает при гораздо более низких температурах, чем точечная коррозия.
Возможные решения
6-молибденовые сплавы; сплав 2507; сплав 825; сплав 625; сплав С-276; Alloy 400
Материал имеет значение
Когда морская вода диффундирует в щель, некоторые ионы Fe++ растворяются и не могут быстро диффундировать из узкой щели. В соленой воде отрицательно заряженные ионы хлора (Cl-) притягиваются этими положительно заряженными ионами Fe++ и начинают диффундировать в расщелину. По мере увеличения концентрации хлорида раствор в щели становится более агрессивным, вызывая растворение большего количества железа, что, в свою очередь, привлекает больше ионов хлорида для диффузии в щель. В конечном итоге щелевой раствор превращается в кислый раствор с высокой концентрацией хлоридов, который очень агрессивен.
Коррозионное растрескивание под напряжением в хлоридсодержащих средах
Коррозионное растрескивание под напряжением (SCC) опасно, поскольку оно может разрушить компонент при уровнях напряжения ниже предела текучести сплава. В присутствии ионов хлорида аустенитные нержавеющие стали подвержены SCC. Ионы взаимодействуют с материалом в вершине трещины, где растягивающие напряжения максимальны, что облегчает рост трещины. Во время выполнения SCC может быть трудно обнаружить, и окончательный сбой может произойти внезапно.
В присутствии ионов хлорида аустенитные нержавеющие стали подвержены SCC. Ионы взаимодействуют с материалом в вершине трещины, где растягивающие напряжения максимальны, что облегчает рост трещины. Во время выполнения SCC может быть трудно обнаружить, и окончательный сбой может произойти внезапно.
Как он образуется
Для возникновения SCC должны одновременно выполняться три условия:
- Металл должен быть восприимчив к SCC
- Должны существовать условия окружающей среды (жидкость или температура), способствующие SCC
- Напряжение растяжения (приложенное + остаточное) должно быть выше критического уровня
Более высокое содержание никеля показывает более высокую устойчивость к SCC, индуцированному хлоридами.
Возможные решения
6-молибденовые сплавы; сплав 2507; сплав 825; сплав 625; сплав С-276; Сплав 400
SSC 1
Крекинг сернистого газа или сульфидный крекинг под напряжением при высоком парциальном давлении сероводорода (H
2 S)
Крекинг сернистого газа, также известный как сульфидное растрескивание контакт с сероводородом (H 2 S) и влагой. H 2 S становится сильно коррозионным в присутствии воды. Это условие может привести к охрупчиванию материала, что приведет к растрескиванию под совместным действием растягивающего напряжения и коррозии.
H 2 S становится сильно коррозионным в присутствии воды. Это условие может привести к охрупчиванию материала, что приведет к растрескиванию под совместным действием растягивающего напряжения и коррозии.
Как он образуется
Риск SSC увеличивается при увеличении следующих факторов:
- Металл должен быть восприимчив к SSC
- Окружающая среда должна быть достаточно кислой (с высоким содержанием H 2 S)
- Напряжение растяжения (приложенное + остаточное) должно быть выше критического уровня
Повышенный риск SSC возникает, когда происходит большее количество следующих факторов по сравнению с материалами, менее подверженными SSC:
- Твердость материала/прочность на растяжение
- Концентрация ионов водорода (нижнее значение pH)
- H 2 S парциальное давление
- Суммарное растягивающее напряжение (приложенное + остаточное)
- Время экспозиции
Риск SSC увеличивается при более низких температурах, когда материалы имеют тенденцию быть менее пластичными.
Возможные решения
Сплав 825; сплав 625; сплав С-276; Alloy 400
Материал имеет значение
Стандарт NACE MR0175/ISO 15156 описывает подходящие материалы для кислых сред при добыче нефти и газа. Дополнительные сведения о выборе компонентов для месторождений высокосернистой нефти см. в разделе Выбор компонентов жидкостной системы для использования на месторождениях высокосернистой нефти.
Водородное охрупчивание 2
Водородное охрупчивание
Атомы водорода могут диффундировать в металлы, делая их хрупкими. Все материалы, подверженные водородному охрупчиванию, также очень подвержены коррозионному растрескиванию под напряжением.
Как он формируется
Растрескивание под действием водорода может произойти, если металл подвергается статическому или циклическому растягивающему напряжению. Водород может вызывать изменения механических свойств и поведения металла, в том числе:
- Уменьшение пластичности (удлинение и уменьшение площади)
- Снижение ударной вязкости и вязкости разрушения
- Повышенная усталостная характеристика
Водородного охрупчивания можно избежать, выбрав материал, устойчивый к водороду, например, аустенитные сплавы с содержанием никеля от 10% до 30%.
Ферритные сплавы с очень низким содержанием никеля становятся значительно охрупчивающимися, в то время как аустенитные сплавы с содержанием никеля от 10% до 30% показывают относительно небольшое охрупчивание.
Источник: Г.Р. Caskey, Справочник по совместимости водорода для нержавеющих сталей (1983)
Потенциальные решения
316/316L нержавеющая сталь
Межгранулярная коррозия
, чтобы понять межгранулярную коррозию (IGC), рассмотрим, что все металлы состоит из отдельных зерен. Внутри каждого зерна атомы систематически расположены, образуя трехмерную решетку. IGC воздействует на материал по границам зерен (там, где собираются вместе зерна, из которых состоит металл).
Как образуется
Во время сварки, термической обработки или воздействия высоких температур карбиды могут начать формироваться на границах зерен. Эти осадки карбида могут увеличиваться со временем. Это образование карбида влияет на равномерное распределение элементов в металле, лишая материал, прилегающий к границам зерен, важных элементов, таких как хром. Когда агрессивные жидкости (например, кислоты) воздействуют на области, обедненные хромом, могут образовываться межкристаллитные трещины. Эти трещины могут распространяться по всему материалу и оставаться незамеченными, что делает IGC опасной формой коррозии.
Когда агрессивные жидкости (например, кислоты) воздействуют на области, обедненные хромом, могут образовываться межкристаллитные трещины. Эти трещины могут распространяться по всему материалу и оставаться незамеченными, что делает IGC опасной формой коррозии.
Возможные решения
Нержавеющая сталь 316/316L
Гальваническая коррозия в присутствии электролита
Гальваническая коррозия возникает при контакте материалов с разным электродным потенциалом в присутствии электролита.
SCE расшифровывается как насыщенный каломельный электрод. Анодный индекс: высокоблагородные материалы с «пассивными поверхностями» не так подвержены гальванической коррозии, как менее благородные материалы или благородные материалы с «активными поверхностями». В этой таблице магний является наименее благородным материалом, а графит — наиболее благородным материалом.
Пассивный слой на нержавеющей стали состоит из очень тонкой оксидной пленки с высоким содержанием хрома, которая автоматически формируется в окружающем воздухе и защищает материал от коррозии. Пассивный слой делает материал более благородным и менее подверженным коррозии. Совместимость металлов можно определить по анодному индексу, который описывает разность потенциалов или напряжений металлов, измеренных в морской воде, относительно стандартного электрода.
Пассивный слой делает материал более благородным и менее подверженным коррозии. Совместимость металлов можно определить по анодному индексу, который описывает разность потенциалов или напряжений металлов, измеренных в морской воде, относительно стандартного электрода.
Как он образуется
Когда разность потенциалов между двумя разнородными металлами в присутствии электролита слишком велика, пассивный слой материала начинает разрушаться.
Возможные решения
Во избежание гальванической коррозии выбирайте материалы с разницей напряжений не более 0,2 В. Например, фитинг из нержавеющей стали 316 (-0,05 В) с трубкой из 6-молибдена (0,00 В) приведет к возникновению напряжения 0,05 В между двумя сплавами. Это напряжение значительно меньше 0,2 В, что означает низкий риск гальванической коррозии.
Поговорите с доверенным консультантомДоступ к услугам экспертного уровня
Для получения дополнительной информации ознакомьтесь с этими дополнительными полезными справочными материалами от Swagelok.
> Просмотрите и загрузите версию Руководства по выбору материалов для печати
1 Перепечатано из Science Direct, Volume 1, Issue 3, S.M.R. Зиаи, А. Х. Кокаби, М. Наср-Эсехани, Коррозионное растрескивание под напряжением сульфидов и вызванное водородом растрескивание корпуса клапана управления потоком A216-WCC, тематическое исследование, страницы 223-224, июль 2013 г. с разрешения Elsevier.
2 Водородное охрупчивание Изображение предоставлено Салимом Брахими, IBECA Technologies Corp.
Какие формы коррозии металлов наиболее распространены?
30 сентября 2022 г. 30 сентября 2022 г.
| 9:08
Что такое коррозия металлов?
Деструкция материала, вызванная химическим взаимодействием между ним и окружающей средой, называется коррозией. Хотя коррозия может воздействовать на материалы за пределами металлов, такие как полимеры и керамика, этот термин чаще всего используется для обозначения износа металлов.
Какие виды коррозии металлов наиболее распространены?
В зависимости от того, как она проявляется, коррозия классифицируется. Типы коррозии классифицируются в зависимости от того, как металл выглядит после того, как он подвергся коррозии, при этом основным методом идентификации является визуальное наблюдение. Хотя обычно достаточно невооруженного глаза, бывают ситуации, когда увеличение выгодно или необходимо.
- Коррозионное растрескивание под напряжением
Коррозия под напряжением возникает, когда материал подвергается как растягивающим нагрузкам, так и агрессивной среде. Каждый металл имеет определенный диапазон или предел прочности при растяжении, и коррозия под напряжением, скорее всего, произойдет ближе к высоте этого предела.
- Питтинговая коррозия
В ходе исследования специалист по качеству также обнаружил в веществе несколько крошечных полостей. Хотя коррозионное растрескивание под напряжением также присутствует, оно демонстрирует отчетливые симптомы точечной коррозии, значительно более разрушительного типа коррозии. К этим крошечным глубоким полостям может привести множество разнообразных вещей.
К этим крошечным глубоким полостям может привести множество разнообразных вещей.
- Эрозия Коррозия
Одно из наиболее частых явлений в списке, эрозионная коррозия, происходит, когда агрессивная жидкость проходит по металлу, ускоряя разрушение поверхности этого металла. Обычно оставляя впадины, кратеры или канавки на поверхности металла, этот вид износа заметен невооруженным глазом.
- Щелевая коррозия
Как следует из названия, этот тип коррозии развивается внутри трещин или трещин на поверхности металла. Щелевая коррозия также может воздействовать на все, с чем «соединен» металл, например, металл, приваренный к другому металлическому объекту, или даже металл, соединенный с неметаллическими объектами.
- Селективное выщелачивание
Когда только один (или несколько) элементов в сплаве начинает корродировать, это известно как коррозия с селективным выщелачиванием. Сплавы начинают физически отделяться друг от друга по мере того, как эта деградация прогрессирует. Ваша воронка теперь показывает признаки выборочного выщелачивания из-за ее истории использования и текущих обстоятельств.
Сплавы начинают физически отделяться друг от друга по мере того, как эта деградация прогрессирует. Ваша воронка теперь показывает признаки выборочного выщелачивания из-за ее истории использования и текущих обстоятельств.
- Равномерная коррозия
Ржавчина — это типичный пример однородной коррозии, которую может распознать большинство людей, особенно те, кто приобрел Mazda6 в период с 2005 по 2008 год. Такой равномерной коррозии подвержена обширная часть (или вся площадь поверхности) указанного материала. Это различимо невооруженным глазом.
- Межкристаллитная коррозия
Межкристаллитная коррозия — это коррозия, которая происходит на границах зерен, не затрагивая зерна. Когда есть четкое различие между границами зерен и зернами в их реактивности к загрязнениям, это получается. Из-за неправильной сварки и термической обработки нержавеющей стали, меди и т. д. возникает разница в реакционной способности.
- Гальваническая/биметаллическая коррозия
Биметаллическая коррозия возникает, когда два несовместимых металла остаются в контакте в течение длительного времени. Разница электродных потенциалов между металлами создает биметаллическую ячейку. В биметаллической парной ячейке один металл действует как катод, а другой — как анод.
- Атмосферная коррозия
Одним из видов влажной коррозии, вызванной электролитами, является атмосферная коррозия. В этой ситуации влага в воздухе, дождь и т. д. служат электролитами, вызывающими коррозию на открытой металлической поверхности.
- Фреттинг-коррозия
При соединении двух материалов в месте контакта развивается фреттинг-коррозия. Это происходит в результате проскальзывания и вибраций в зоне контакта. Болтовые и заклепочные соединения, зажимные поверхности и т. д. подвержены такому виду коррозии.
Piping Mart
Pipingmart — это портал B2B, специализирующийся на промышленных, металлических и трубопроводных изделиях.