Коррозия химическая и электрохимическая: Ошибка 403 — доступ запрещён
Содержание
Основные виды коррозии металлов | «ЧелМетСнаб»
Содержание:
- Методы защиты металлов от коррозии, их эффективность
- Возможно вас заинтересует
- Народнохозяйственное значение борьбы с коррозией
Коррозией металлов называется их разрушение вследствие химического или электрохимического взаимодействия с окружающей средой. По механизму протекания процесса различают два типа коррозии металлов: химическую и электрохимическую.
Химическая коррозия — это коррозийный процесс, протекающий в средах, не проводящий электрический ток. Химическая коррозия имеет место, например, при высокотемпературном нагреве стали для горячей обработки давлением или термической обработки. При этом на поверхности металла образуются различные химические соединения — оксиды, сульфиды и другие — в виде пленки.
В отдельных случаях образовавшиеся при химической коррозии пленки, особенно сплошные, предохраняют металл от дальнейшей коррозии. Например, алюминий, олово, свинец, никель и хром способны к образованию на поверхности металлов плотных защитных пленок. пленки же на поверхности стальных и чугунных изделий непрочны, способны к растрескиванию и проникновению коррозии в глубь металла.
Например, алюминий, олово, свинец, никель и хром способны к образованию на поверхности металлов плотных защитных пленок. пленки же на поверхности стальных и чугунных изделий непрочны, способны к растрескиванию и проникновению коррозии в глубь металла.
Электрохимическая коррозия обычно сопровождается протеканием электрического тока. Примерами могут служить ржавление металлических конструкций и изделий в атмосфере, корпусов судов и стальной арматуры гидросооружений в речной и морской воде и т.п.
Детальное рассмотрение механизмов химической и электрохимической коррозии показывает, что резкого различия между ними не существует. В ряде случаев возможен постепенный переход химической коррозии в электрохимическую и, наоборот, механизм коррозии металлов в растворах электролитов может иметь двоякий характер.
Коррозия по условиям протекания бывает следующая. Газовая- коррозия металла в газах при высоких температурах. Коррозия в неэлектролитах (например, коррозия стали в бензине). Атмосферная коррозия различных металлических конструкций на воздухе. Коррозия в электролитах- в проводящих электрический ток жидких средах. Почвенная (например, коррозия подземных трубопроводов). Коррозия внешним током или электрокоррозия (например, коррозия подземной трубы блуждающими токами). Контактная — электрохимическое разрушение металлов, происходящее в результате контакта различных металлов в электролите (например, коррозия деталей из алюминиевых сплавов, соприкасающихся с деталями из меди). Структурная- связанная со структурной неоднородностью металлов; например, ускорение коррозионного процесса чугуна в растворе серной кислоты в результате имеющихся в нем включений графита. Коррозия под напряжением, изменяющимся по значению и знаку, что часто вызывает коррозионную усталость- понижение предела выносливости металла. Коррозия при трении; например, разрушение шейки вала при вращении в морской воде. Щелевая, протекающая в узких щелях и зазорах между отдельными деталями. Биокоррозия- коррозия металлов под воздействием продуктов, выделяемых микроорганизмами, и пота рук человека.
Атмосферная коррозия различных металлических конструкций на воздухе. Коррозия в электролитах- в проводящих электрический ток жидких средах. Почвенная (например, коррозия подземных трубопроводов). Коррозия внешним током или электрокоррозия (например, коррозия подземной трубы блуждающими токами). Контактная — электрохимическое разрушение металлов, происходящее в результате контакта различных металлов в электролите (например, коррозия деталей из алюминиевых сплавов, соприкасающихся с деталями из меди). Структурная- связанная со структурной неоднородностью металлов; например, ускорение коррозионного процесса чугуна в растворе серной кислоты в результате имеющихся в нем включений графита. Коррозия под напряжением, изменяющимся по значению и знаку, что часто вызывает коррозионную усталость- понижение предела выносливости металла. Коррозия при трении; например, разрушение шейки вала при вращении в морской воде. Щелевая, протекающая в узких щелях и зазорах между отдельными деталями. Биокоррозия- коррозия металлов под воздействием продуктов, выделяемых микроорганизмами, и пота рук человека. По характеру коррозионных процессов и месту их распределения различают сплошную, местную и межкристаллитную коррозию. Сплошная коррозия характеризуется тем, что металлическое изделие разрушается почти равномерно и коррозия охватывает всю его поверхность. Этот вид коррозии сравнительно легко поддается контролю и оценке.
По характеру коррозионных процессов и месту их распределения различают сплошную, местную и межкристаллитную коррозию. Сплошная коррозия характеризуется тем, что металлическое изделие разрушается почти равномерно и коррозия охватывает всю его поверхность. Этот вид коррозии сравнительно легко поддается контролю и оценке.
Местная коррозия обычно бывает сосредоточенна на отдельных участках поверхности изделия. Это более опасный вид коррозии, так как распространяется на значительную глубину, а следовательно, приводит к потере работоспособности изделий. Чаще всего этот вид коррозии наблюдается в местах механических повреждений поверхности изделий. При межкристаллитной коррозии процесс разрушения начинается с поверхности изделия и распространяется в глубь его, в основном по границам зерен. Межкристаллитная коррозия вызывает хрупкость металла и значительное снижение его несущей способности. Этот часто встречающийся на практике вид коррозии является весьма опасным и обычно имеет место при термической обработке металлов или сварке. Степень коррозийной стойкости сталей существенно зависит от содержания углерода. Так, с уменьшением содержания углерода в легированной хромоникелевой стали марки Х18Н9 до 0.015% практически устраняется склонность ее к межкристаллитной коррозии.
Степень коррозийной стойкости сталей существенно зависит от содержания углерода. Так, с уменьшением содержания углерода в легированной хромоникелевой стали марки Х18Н9 до 0.015% практически устраняется склонность ее к межкристаллитной коррозии.
Методы защиты металлов от коррозии, их эффективность
Существуют многочисленные способы защиты металлов от коррозии. Выбор того или иного способа определяется конкретными условиями работы и хранения металлических изделий. Применяются следующие способы защиты: легирование сталей, нанесение металлических покрытий, электрохимическая защита.
Легирование наиболее надежно защищает металл от коррозии, причем наиболее эффективно в условиях воздействия механических напряжений и коррозийной среды. Легирование позволяет предотвратить и коррозийное растрескивание изделий.
Так, например, к группе сталей с особыми химическими свойствами относят коррозионно-стойкие стали. Их получают путем введения в углеродистые и низколегированные стали значительных добавок хрома или хрома и никеля. При содержании хрома 13, 17 и 25% хромистые стали являются не только коррозионно-, но и жаростойкими. Хромоникелевые стали обладают большей коррозионной стойкостью, чем хромистые, и находят широкое применение в химической промышленности.
При содержании хрома 13, 17 и 25% хромистые стали являются не только коррозионно-, но и жаростойкими. Хромоникелевые стали обладают большей коррозионной стойкостью, чем хромистые, и находят широкое применение в химической промышленности.
Механизм защиты сталей от коррозии их легированием различен и связан либо с повышением коррозионной стойкости всего объема металла, либо с образованием на поверхности изделия защитных пленок.
Металлические покрытия наносят на поверхность изделия тонким слоем металла, обладающего достаточной стойкостью в данной среде. Металлические покрытия придают также поверхностным слоям металлоизделий требуемую твердость, износостойкость. Различают два типа металлических покрытий- анодное и катодное. Для железоуглеродистых сплавов таким анодным покрытием может служить покрытие из цинка и кадмия. В воде и во влажном воздухе цинк покрывается слоем основной углекислой соли белого цвета, защищающим его от дальнейшего разрушения. Широкое применение получили цинковые покрытия для защиты арматуры, труб и резервуаров от действия воды и горячих жидкостей.
Металлические покрытия наносят различными способами. Наиболее часто применяется горячий метод, гальванизация и металлизация.
При горячем методе изделие погружают в расплавленный металл, который смачивает его поверхность и покрывает тонким слоем. Затем изделие вынимают из ванны и охлаждают. Таким методом изделие покрывают слоем олова или цинка. Лужение применяют при изготовлении белой жести, при устройстве покрытий на внутренних поверхностях пищевых котлов и других изделий. Цинкованием предохраняют от коррозии, например, кровельное железо, водопроводные трубы.
При гальваническом способе металлические изделия помещают в гальваническую ванну. Под действием электрического тока на поверхности изделия происходит катодное осаждение пленки защитного металла. Толщину гальванического покрытия можно регулировать в широких пределах. Покрытия получают также распылением расплавленного металла с помощью специальных металлизационных пистолетов и напылением на его поверхность защищаемого металла.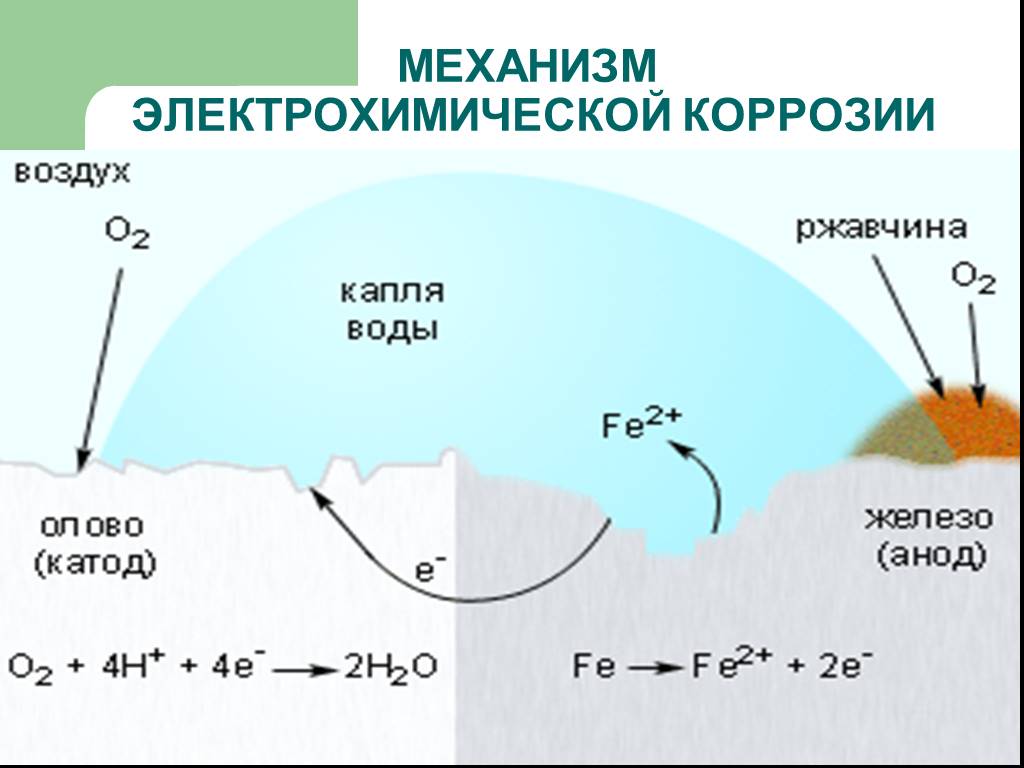 Этот вид защиты используют для крупногабаритных конструкций: ж./д мостов и т. д. В качестве защитного металла используют алюминий, цинк, хром, коррозионно-стойкие стали.
Этот вид защиты используют для крупногабаритных конструкций: ж./д мостов и т. д. В качестве защитного металла используют алюминий, цинк, хром, коррозионно-стойкие стали.
Неметаллические покрытия выполняются из лаков, красок, эмалей и др. веществ и изолируют изделие от воздействия внешней среды. Эти покрытия имеют преимущество перед металлическими. Они легко наносятся на изделие, хорошо закрывают поры, не изменяют свойств металла и являются относительно дешевыми. При хранении и перевозке изделий металлические изделия покрывают специальными смазочными материалами, минеральными маслами и жирами. Для защиты изделий, работающих в высокоагрессивных средах, применяют пластмассовые покрытия из винипласта, поливинилхлорида.
Химические покрытия — защитные оксидные иные пленки- создаются при воздействии на металл сильных химических реагентов. Широко применяются также оксидирование и фосфатирование металлоизделий.
Оксидирование заключается в создании на поверхности изделия оксидной пленки, обладающей большой коррозийной стойкостью. Наиболее широко применяют оксидирование для защиты от коррозии изделий из алюминия и его сплавов.
Наиболее широко применяют оксидирование для защиты от коррозии изделий из алюминия и его сплавов.
Фосфатирование стальных изделий заключается в создании поверхностного слоя из фосфатов марганца и железа. Фосфатные покрытия используются в дальнейшем в качестве подслоя. Фосфатные покрытия часто применяются в сочетании со смазочными материалами для уменьшения трения при обработке металлов давлением, волочением, для хорошей приработке трущихся деталей машин.
В отдельных случаях прибегают к защите металлов от коррозии при помощи протекторов. Сущность протекторной защиты заключается в том, что к поверхности защищаемого изделия прикрепляют протекторы- куски металла. Образуется гальваническая пара , в которой анод- протектор, катод- изделие. В результате протектор разрушается, защищая изделие. Таким образом, защищают, например, подводные металлические части кораблей, прикрепляя к ним пластины цинка.
Возможно вас заинтересует
Народнохозяйственное значение борьбы с коррозией
Одним из основных факторов, определяющих долговечность машин и оборудования, является коррозия металлов. Потери от коррозии можно разделить на прямые и косвенные. Прямые потери- это стоимость заменяемых изделий, затраты на защитные мероприятия и безвозвратные потери металла вследствие коррозии. По подсчетам специалистов, безвозвратные потери металла в мировом масштабе составляют в настоящее время около 10…15% от объема производства стали. Косвенные потери продукта в результате утечек, снижение производительности агрегата, загрязнение продуктами коррозии целевого продукта и т.п.
Потери от коррозии можно разделить на прямые и косвенные. Прямые потери- это стоимость заменяемых изделий, затраты на защитные мероприятия и безвозвратные потери металла вследствие коррозии. По подсчетам специалистов, безвозвратные потери металла в мировом масштабе составляют в настоящее время около 10…15% от объема производства стали. Косвенные потери продукта в результате утечек, снижение производительности агрегата, загрязнение продуктами коррозии целевого продукта и т.п.
Значительная часть мощности предприятий черной металлургии затрачивается на восполнение потерь металла вследствие коррозии. Однако это далеко не полностью отражает действительный ущерб, связанный с выходом из строя изделий из металла. Значительные потери обусловлены авариями оборудования, простоями его, потерями и отходами в металлообработке, нарушениями качества продукции и в конечном счете повышением ее себестоимости и снижением производительности труда. Поэтому экономия металла, повышение качества металлов и металлоизделий, уменьшение коррозионных потерь — непременное условие повышения эффективности производства и качества продукции, которое должно обеспечиваться в государственном масштабе.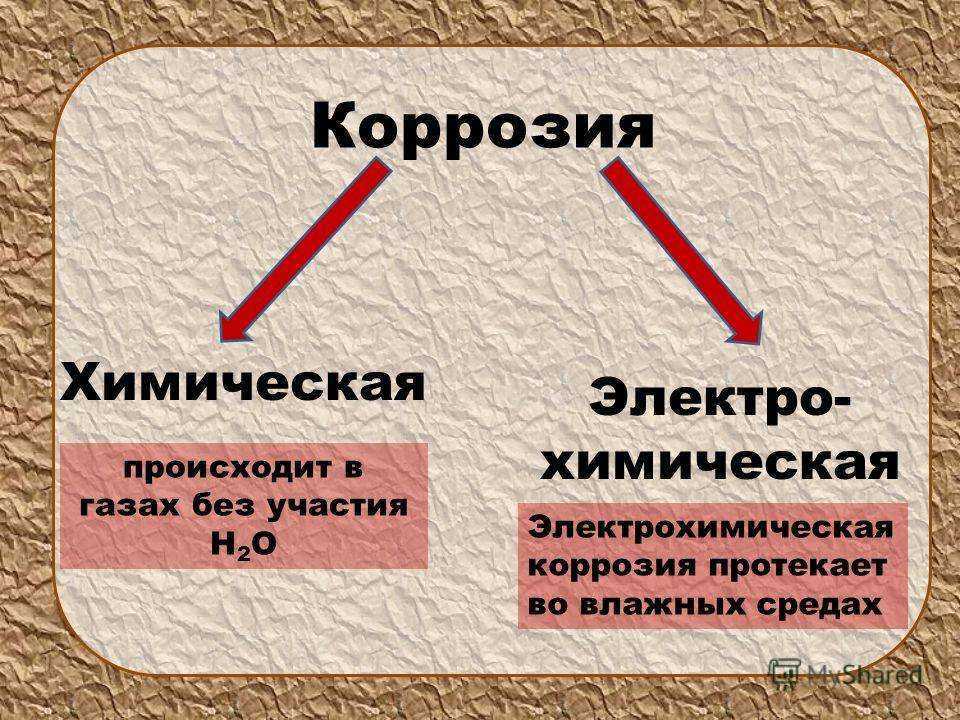
Процесс коррозии железа. Химическая коррозия, электрохимическая коррозия, элетрокоррозия
Процесс коррозии железа чаще всего сводится к его окислению кислородом воздуха или кислотами, содержащимися в растворах, и превращению его в оксиды. Коррозия металлов (ржавление) вызывается окислительно-восстановительными реакциями, протекающими на границе металла и окружающей среды. В зависимости от механизма возникновения, различают такие виды коррозии железа, как: химическая, электрохимическая и электрическая.
Процесс химической коррозии железа
Окислительно-восстановительные реакции в данном случае проходят через переход электронов на окислитель. В процессе коррозии такого типа кислород воздуха взаимодействует с поверхностью железа. При этом образуется оксидная пленка, которая называется ржавчиной:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
В отличие от плотно прилегающих оксидных пленок, которые образуются в процессе коррозии на щелочных металлах, алюминии, цинке, рыхлая оксидная пленка на железе свободно пропускает к поверхности металла кислород воздуха, а также другие газы и пары воды. Это способствует дальнейшей коррозии железа.
Это способствует дальнейшей коррозии железа.
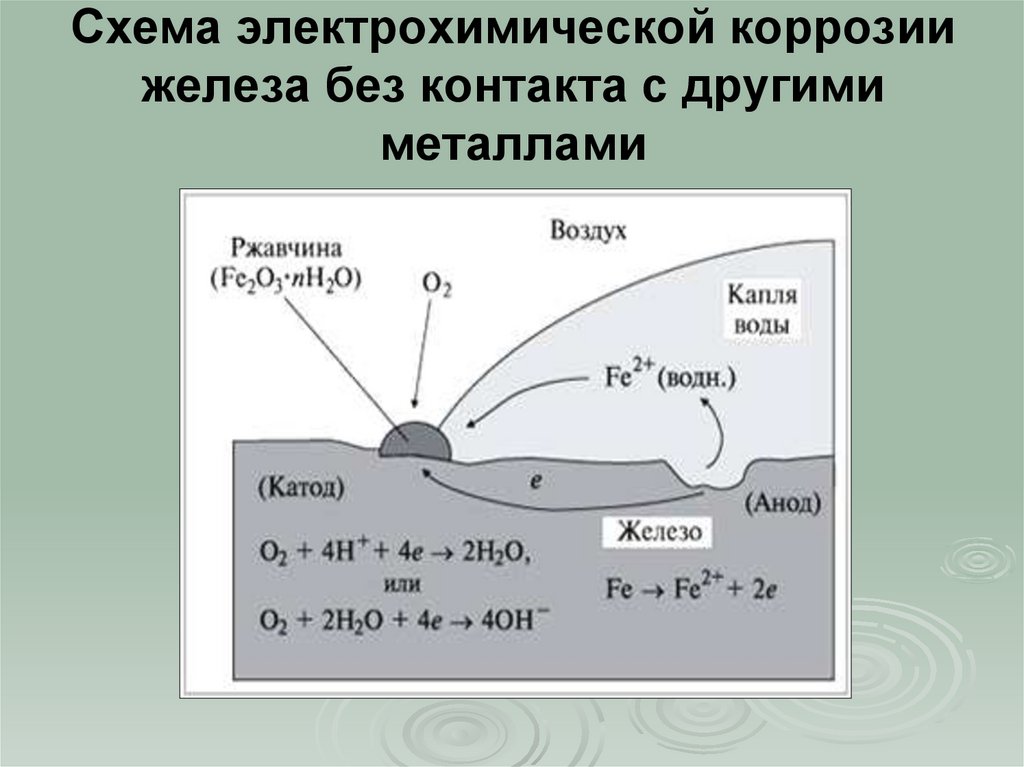
Процесс электрохимической коррозии
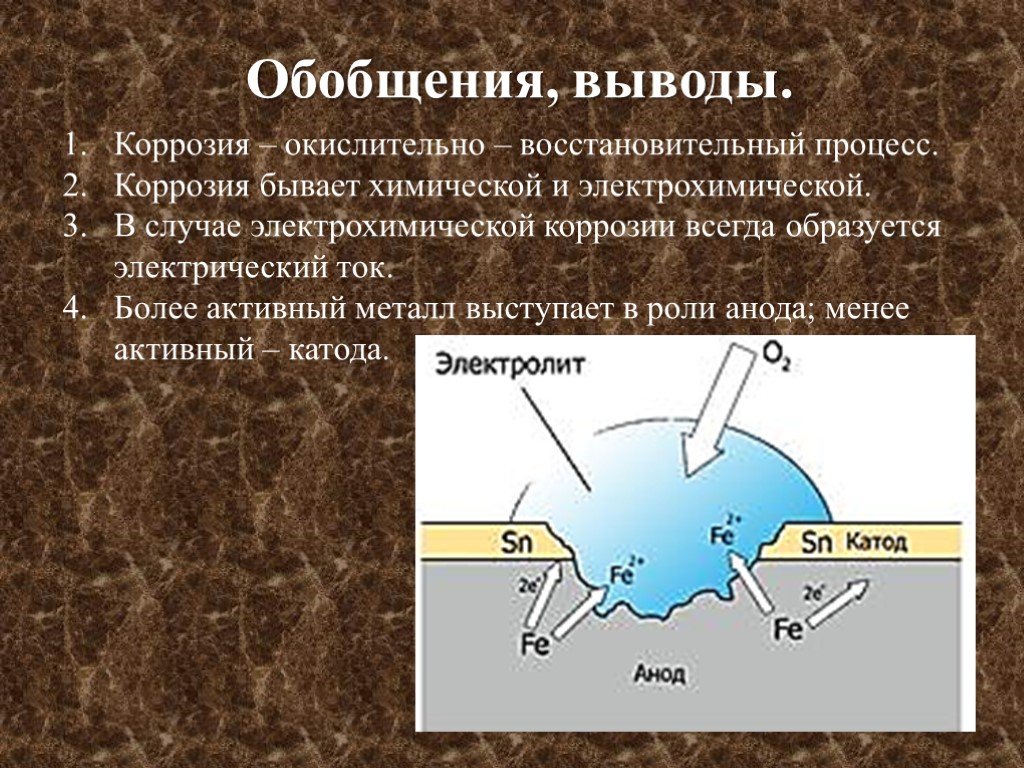
Этот вид коррозии проходит в среде, которая проводит электрический ток. Металл в грунте подвергается, преимущественно, электрохимической коррозии. Процесс коррозии такого типа – это результат химических реакций с участием компонентов окружающей среды. Также электрохимическая коррозия возникает в случае контакта металлов, находящихся в ряду напряжений на некотором расстоянии друг от друга, в результате чего возникает гальваническая пара катод-анод.
Атмосферный и грунтовый процесс коррозии выражается схемой:
Fe + O2 + H2O → Fe2O3 · xH2O
В результате образуется ржавчина различной расцветки, что обусловлено тем, что образуются различные окислы железа. Какое именно вещество образуется в процессе коррозии железа, зависит от давления кислорода, влажности воздуха, температуры, длительности процесса, состава железного сплава, состояния поверхности изделия и т. д. Скорость разрушения разных металлов различна.
д. Скорость разрушения разных металлов различна.
Процесс коррозии металла в растворах электролитов – это результат работы большого количества микроскопических гальванических элементов, у которых в качестве катода выступают примеси в металле, а в качестве анода – сам металл. В результате чего возникают микроскопические гальванические элементы.
Также атомы железа на разных участках имеют различную способность отдавать электроны (окисляться). Участки металла, на котором протекает этот процесс, выступают в роли анода. Остальные участки – катодные, на которых происходят процессы восстановления воды и кислорода:
H2O + 2e– = 2OH– + H2↑
O2 + 2H2O + 4e– = 4OH–
Результат – из ионов железа (II) и гидроксид-ионов образуется гидроксид железа (II). Далее идет его окисление до гидроксида железа (III) – основного компонента ржавчины:
Fe2+ + 2OH– = Fe(OH)2
Fe(OH)2 + O2 + H2O → Fe2O3 · xH2O
Для того чтобы гальванический элемент работал, необходимо наличие двух металлов различной химической активности и среды, которая проводит электрический ток, – электролита. При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
Процесс электрической коррозии
Такой вид разрушения металлических подземных конструкций, кабелей и сооружений могут вызывать блуждающие токи, исходящие от трамваев, метро, электрических железных дорог и различных электроустановок с постоянным током.
Ток с металлических конструкций выходит в грунт в виде положительных ионов металла – происходит электролиз металла. Участок выхода токов – это анодные зоны. Именно в них и протекают активные процессы электрической коррозии железа. Блуждающие токи могут достигать 300 А и действовать в радиусе нескольких десятков километров.
Блуждающими токами, исходящими от источников переменного тока, вызывается слабая коррозия подземных стальных конструкций, и сильная – конструкций из цветных металлов.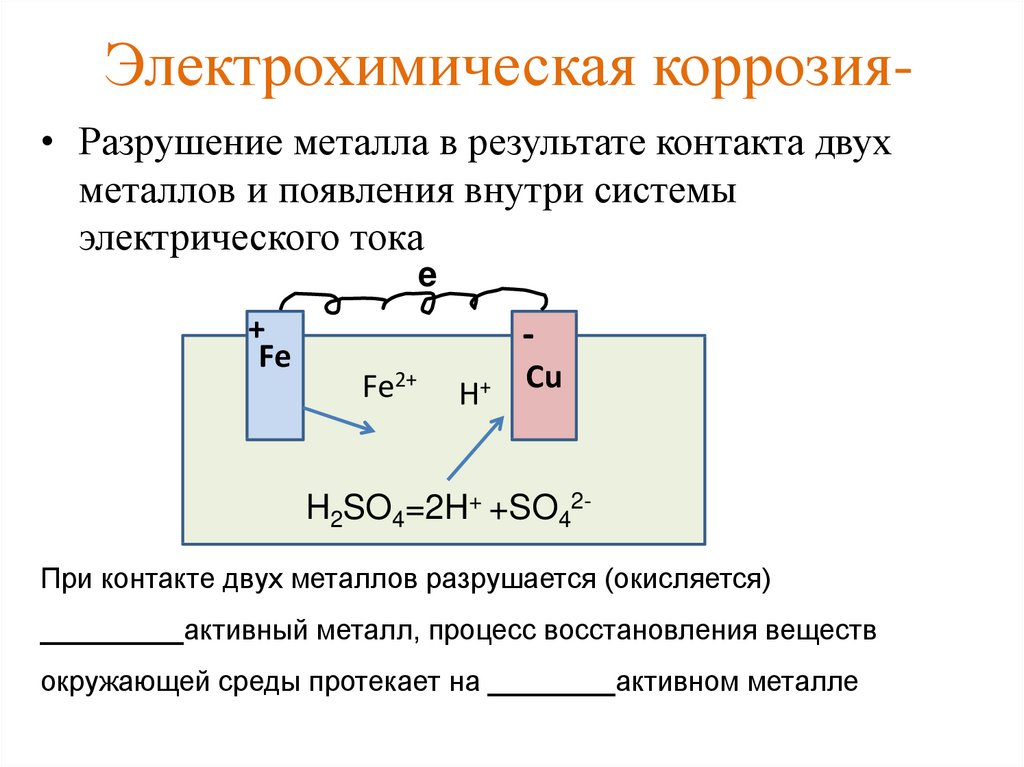 Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Типы коррозии в самолетах
Существуют две общие классификации коррозии, которые охватывают большинство конкретных форм: прямое химическое воздействие и электрохимическое воздействие. При обоих типах коррозии металл превращается в металлическое соединение, такое как оксид, гидроксид или сульфат. Процесс коррозии включает в себя два одновременных изменения: металл, подвергшийся воздействию или окислению, подвергается так называемому анодному изменению, а коррозионное вещество восстанавливается и считается претерпевающим катодное изменение.
Прямое химическое воздействие
Прямое химическое воздействие или чисто химическая коррозия представляет собой воздействие, возникающее в результате прямого воздействия на голую поверхность едких жидких или газообразных веществ. В отличие от электрохимического воздействия, при котором анодные и катодные изменения происходят на измеримом расстоянии друг от друга, изменения при прямом химическом воздействии происходят одновременно в одной и той же точке. Наиболее распространенными агентами, вызывающими прямое химическое поражение самолетов, являются: пролитая аккумуляторная кислота или пары аккумуляторов; остаточные отложения флюса в результате недостаточно очищенных, сварных, паяных или паяных соединений; и захваченные едкие чистящие растворы. [Рисунок 1]
Наиболее распространенными агентами, вызывающими прямое химическое поражение самолетов, являются: пролитая аккумуляторная кислота или пары аккумуляторов; остаточные отложения флюса в результате недостаточно очищенных, сварных, паяных или паяных соединений; и захваченные едкие чистящие растворы. [Рисунок 1]
| Рисунок 1. Прямая химическая атака в аккумуляторном отсеке становится меньше проблем. Использование этих закрытых блоков снижает опасность разлива кислоты и паров батареи. Многие типы флюсов, используемых при пайке и сварке, вызывают коррозию, химически разрушая металлы или сплавы, с которыми они используются. Поэтому важно удалять остатки флюса с поверхности металла сразу после операции соединения. Остатки флюса гигроскопичны по своей природе, поглощают влагу и, если их тщательно не удалить, имеют тенденцию вызывать сильную точечную коррозию. Чистящие растворы щелочи в концентрированной форме хранятся плотно закрытыми и как можно дальше от самолетов. Электрохимическая атакаКоррозия — это естественное явление, при котором металл подвергается химическому или электрохимическому воздействию, превращая его обратно в металлическое соединение. Следующие четыре условия должны выполняться до возникновения электрохимической коррозии. [Рисунок 2]
Устранение любого из этих условий останавливает электрохимическую коррозию. ПРИМЕЧАНИЕ. Краска может маскировать начальные стадии коррозии. Поскольку продукты коррозии занимают больший объем, чем исходный металл, окрашенные поверхности необходимо часто осматривать на наличие неровностей, таких как вздутия, чешуйки, сколы и комки.
Электрохимическую атаку химически можно сравнить с реакцией электролитической батареи, которая происходит при гальваническом гальваническом или гальванопокрытии. Для реакции при этой коррозионной атаке требуется среда, обычно вода, способная проводить слабый электрический ток. Когда металл вступает в контакт с коррозионным агентом, а также связан жидким или газообразным путем, по которому проходят электроны, начинается коррозия, поскольку металл распадается в результате окисления. [Рисунок 2] Во время атаки количество коррозионного агента уменьшается и, если его не обновить или удалить, может полностью вступить в реакцию с нейтрализацией металла. Все металлы и сплавы электрически активны и имеют определенный электрический потенциал в данной химической среде. Этот потенциал обычно называют «благородством» металла. [Рисунок 3] Чем менее благороден металл, тем легче он подвергается коррозии. Металлы, выбранные для использования в конструкциях самолетов, представляют собой продуманный компромисс прочности, веса, коррозионной стойкости, технологичности и стоимости, сбалансированный с потребностями конструкции.
Компоненты сплава также имеют определенные электрические потенциалы, которые обычно отличаются друг от друга. Условиями для этих коррозионных реакций являются наличие проводящей жидкости и металлов, имеющих разность потенциалов. Если путем регулярной очистки и повторной отделки поверхности удалить среду и устранить мельчайшую электрическую цепь, коррозия не может возникнуть. Это основа эффективной борьбы с коррозией. Электрохимическая атака является причиной большинства форм коррозии конструкции и компонентов самолета. СВЯЗАННЫЕ ПОСТЫ В чем разница между химической и электрохимической коррозией?Копия Химическая реакция: — В химической реакции электроны передаются от одного вида к другому непосредственно в той же среде. Электрохимические реакции: — В этих реакциях электроны переносятся от одного вида к другому опосредованно через электроды, помещенные в ту же или другую среду. Какая_есть_разница_между_химической_реакцией_и_электрохимической_реакцией Этот ответ: Учебные пособия Заработок + 20 баллы В: В чем разница между химической и электрохимической коррозией? Напишите свой ответ… Отправить Остались вопросы? Продолжить изучение химии Что такое электрохимическая коррозия? Электрохимическая коррозия включает поток электронов В чем разница между коррозией и ржавчиной? Коррозия – это химическая или электрохимическая реакция между Разница между химической и электрохимической коррозией? Химическая коррозияЭлектрохимическая коррозияКоррозия – это распад инженерного материала на составляющие его атомы вследствие химических реакций с окружающей средой. В наиболее распространенном использовании этого слова это означает электрохимическое окисление металлов в реакции с окислителем, таким как кислород. Коррозия в водной среде и в атмосферной среде (которая также включает тонкие водные слои) является электрохимическим процессом, поскольку коррозия включает в себя перенос электронов между металлической поверхностью и водным раствором электролита. Другими словами, коррозия — это износ металлов в результате химической реакции. Многие конструкционные сплавы подвергаются коррозии просто от воздействия влаги в воздухе, но воздействие может сильно повлиять на этот процесс. В чем разница между горением и коррозией? i вещь ХИМИЧЕСКАЯ РЕАКЦИЯ, ПРОИСХОДЯЩАЯ ПРИ ВЗАИМОДЕЙСТВИИ КИСЛОРОДА с В чем разница между химическим свойством и химическим изменением? Разница между химическим свойством и химическим изменением |

 Некоторые чистящие растворы, используемые для удаления коррозии, сами по себе являются потенциально коррозионными агентами. Поэтому особое внимание должно быть направлено на их полное удаление после использования на летательных аппаратах. Там, где вероятно улавливание чистящего раствора, используйте неагрессивное чистящее средство, даже если оно менее эффективно.
Некоторые чистящие растворы, используемые для удаления коррозии, сами по себе являются потенциально коррозионными агентами. Поэтому особое внимание должно быть направлено на их полное удаление после использования на летательных аппаратах. Там, где вероятно улавливание чистящего раствора, используйте неагрессивное чистящее средство, даже если оно менее эффективно.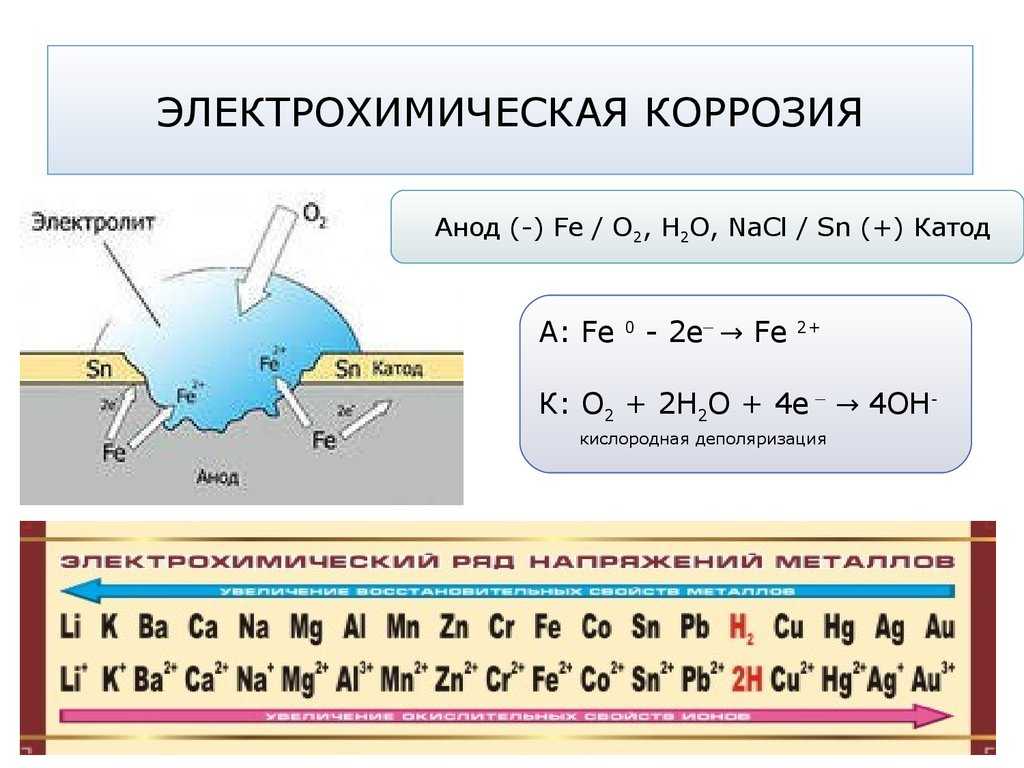
 Различные области одной и той же металлической поверхности имеют разные уровни электрического потенциала и, если они соединены проводником, таким как соленая вода, создают ряд коррозионных ячеек, и начинается коррозия.
Различные области одной и той же металлической поверхности имеют разные уровни электрического потенциала и, если они соединены проводником, таким как соленая вода, создают ряд коррозионных ячеек, и начинается коррозия. Воздействие на поверхность сплава проводящей коррозионной среды приводит к тому, что более активный металл становится анодным, а менее активный — катодным, что создает условия для коррозии. Они называются локальными ячейками. Чем больше разница в электрическом потенциале между двумя металлами, тем серьезнее коррозионная атака, если создать надлежащие условия.
Воздействие на поверхность сплава проводящей коррозионной среды приводит к тому, что более активный металл становится анодным, а менее активный — катодным, что создает условия для коррозии. Они называются локальными ячейками. Чем больше разница в электрическом потенциале между двумя металлами, тем серьезнее коррозионная атака, если создать надлежащие условия.
 Материал, как правило, металл.
Материал, как правило, металл. к некоторым веществам (см. ниже). Коррозия может быть сосредоточена локально, образуя ямку или трещину, или она может распространяться на большую площадь, более или менее равномерно разъедая поверхность. Поскольку коррозия является процессом, контролируемым диффузией, она возникает на открытых поверхностях. В результате методы снижения активности открытой поверхности, такие как пассивация и хроматирование, могут повысить коррозионную стойкость материала. Однако некоторые механизмы коррозии менее заметны и менее предсказуемы. Электрохимическая коррозия, протекающая в таких условиях, является крупным разрушительным процессом, приводящим к таким дорогостоящим, неприглядным и разрушительным последствиям, как образование ржавчины и других продуктов коррозии, образование зияющих отверстий. или трещины в самолетах, автомобилях, лодках, желобах, экранах, сантехнике и многих других предметах, изготовленных из любого металла, кроме золота.
к некоторым веществам (см. ниже). Коррозия может быть сосредоточена локально, образуя ямку или трещину, или она может распространяться на большую площадь, более или менее равномерно разъедая поверхность. Поскольку коррозия является процессом, контролируемым диффузией, она возникает на открытых поверхностях. В результате методы снижения активности открытой поверхности, такие как пассивация и хроматирование, могут повысить коррозионную стойкость материала. Однако некоторые механизмы коррозии менее заметны и менее предсказуемы. Электрохимическая коррозия, протекающая в таких условиях, является крупным разрушительным процессом, приводящим к таким дорогостоящим, неприглядным и разрушительным последствиям, как образование ржавчины и других продуктов коррозии, образование зияющих отверстий. или трещины в самолетах, автомобилях, лодках, желобах, экранах, сантехнике и многих других предметах, изготовленных из любого металла, кроме золота.