Медь характеристика элемента: Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов / Справочник :: Бингоскул
Содержание
1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
Понятие
переходный элемент обычно используется
для обозначения любого из d-
или f-элементов.
Эти элементы занимают переходное
положение между электроположительными
s-элементами
и электроотрицательными p-элементами.
d-элементы
образуют три переходных ряда — в 4-м,
5-м и 6-м периодах соответственно.
Первый
переходный ряд включает 10 элементов,
от скандия до цинка. Он характеризуется
внутренней застройкой 3d-орбиталей.
Хром и медь имеют на 4s-орбиталях
всего по одному электрону. Дело в том,
что полузаполненные или заполненные
d-подоболочки
обладают большей устойчивостью, чем
частично заполненные.
В
атоме хрома на каждой из пяти 3d-орбиталей,
образующих 3d-подоболочку,
имеется по одному электрону. Такая
подоболочка является полузаполненной.
Cr24 1s22s22p63s23p64s13d5
Для
атома хрома электроно-графическая
формула выглядит так:
Это
явление называется проскок (провал)
электрона.
В
атоме меди на каждой из пяти 3d-орбиталей
находится по паре электронов (аналогичным
образом объясняется аномалия серебра).
Cu29 1s22s22p63s23p64s13d10
Все
d-элементы
являются металлами. Большинство из них
имеет характерный металлический блеск.
По сравнению с s-металлами
их прочность в целом значительно выше.
В частности, для них характерны свойства:
высокий предел прочности на разрыв;
тягучесть; ковкость (их можно расплющить
ударами в листы).
d-элементы
и их соединения обладают рядом характерных
свойств: переменные состояния окисления;
способность к образованию комплексных
ионов; образование окрашенных соединений.
d-элементы
характеризуются также более высокой
плотностью по сравнению с другими
металлами. Это объясняется сравнительно
малыми радиусами их атомов. Атомные
радиусы этих металлов мало изменяются
в этом ряду.
d-элементы
— хорошие проводники электрического
тока, особенно те из них, в атомах которых
имеется только один внешний s-электрон
сверх полузаполненной или заполненной
d-оболочки.
Например,
медь.
Химические
свойства.
Электроотрицательность и энергии
ионизации металлов первого переходного
ряда возрастают в направлении от хрома
к цинку. Это означает, что металлические
свойства элементов первого переходного
ряда постепенно ослабевают в указанном
направлении. Такое изменение их свойств
проявляется и в последовательном
возрастании окислительно-восстановительных
потенциалов с переходом от отрицательных
к положительным значениям.
Хром
— твердый голубовато-белый металл. При
При
высоких температурах горит в кислороде
с образованием Сr2О3,
реагирует с парами воды
2Сr
+ 3Н2O
Сr2О3
+ 3Н2
и
с галогенами, образуя галогениды состава
СrГ3.
Хром (так же, как алюминий) пассивируется
холодными концентрированными Н2SО4
и НNО3.
Однако при сильном нагревании эти
кислоты растворяют хром:
2Сr
+ 6Н2SО4(конц)
= Сr2(SО4)3
+ 3SО2↑
+ 6Н2О,
Сr
+ 6НNО3(конц)
= Сr(NО3)3
+ 3NO2↑
+ 3Н2О.
При
обычной температуре хром растворяется
в разбавленных кислотах (НСl,
Н2SО4)
с выделением водорода, образуя соли
Сr2+.
Обрабатывая их растворы щелочами,
получают желтый осадок гидроксида
хрома (II):
СrСl2
+ 2 NaОН
= Сr(ОН)2↓
+ 2 NaСl.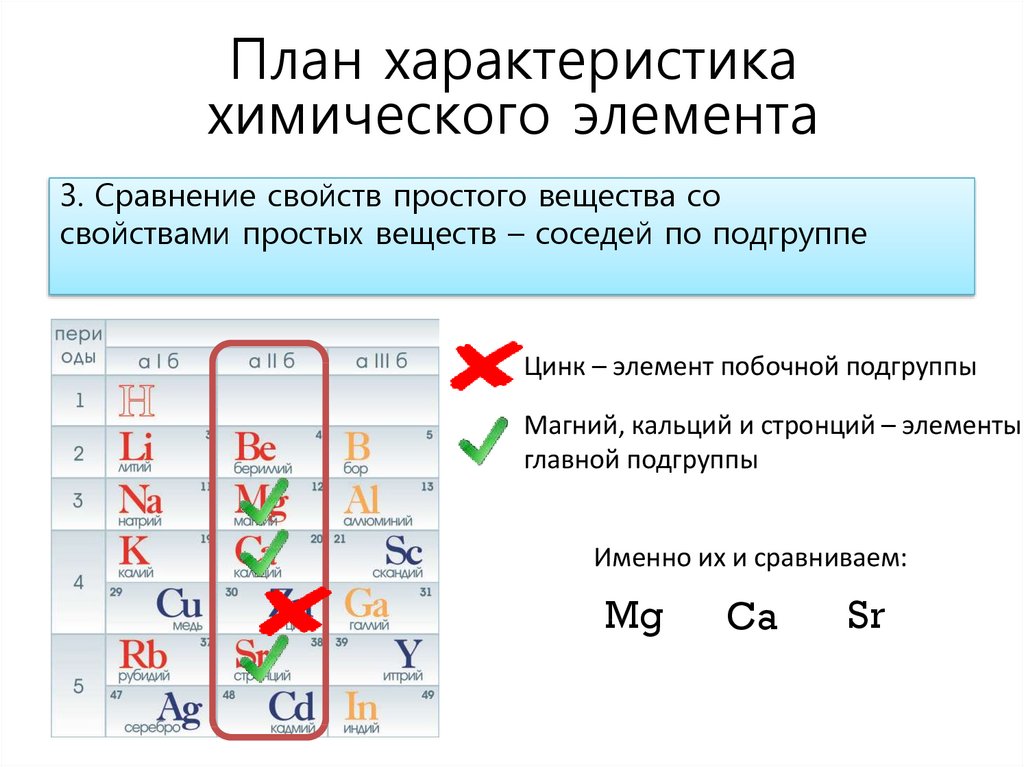
Соли
Cr3+
сходны с аналогичными солями алюминия.
При действии щелочей на соли Сr3+
выпадает
студнеобразный осадок гидроксида хрома
(III)
зеленого цвета:
Сr2(SО4)3
+ 6 NaОН
= 2 Сr(ОН)3↓
+ 3 Na2SО4,
обладающий
амфотерными свойствами. Он растворяется
как в кислотах с образованием солей
хрома (III)
2
Сr(ОН)3
+ 3 Н2SО4
= Сr2(SО4)3
+ 6 Н2О,
так
и в щелочах с образованием комплексной
соли
Сr(ОН)3
+ 3КОН = К3[Cr(ОН)6].
Наиболее
важными соединениями хрома в высшей
степени окисления +6 хромат калия К2СrО4
и дихромат калия К2Сr2О7.
В
кислой среде ион CrO42-
превращается
в ион Сr2О72-
. В щелочной среде эта реакция протекает
В щелочной среде эта реакция протекает
в обратном направлении:
Железо
На
воздухе в присутствии влаги ржавеет:
4Fе
+ 3O2
+ 6Н2О
= 4Fе(ОН)3.
С
галогенами оно образует галогениды
железа (III)
2Fе
+ 3Вr2
= 2FеВr3,
а
взаимодействуя с соляной и разбавленной
серной кислотами соли железа(II),
так как катион водорода Н+
является слабым окислителем:
Fе
+ Н2SО4
= FеSО4
+ Н2↑.
Концентрированные
(НNО3,
Н2SО4)
пассивируют железо на холоде, однако
растворяют его при нагревании:
2Fе
+ 6Н2SО4(конц)
= Fе2(SО4)3
+ 3SО2↑
+ 6Н2О,
Fе
+ 6НNО3(конц)
= Fе(NО3)3
+ 3NО2↑
+ 3Н2О.
Медь
– довольно мягкий металл красно-желтого
цвета, обладающий наименьшей активностью
среди рассмотренных выше переходных
металлов, которые вытесняют ее из
растворов солей. Медь не реагирует с
соляной и разбавленной серной кислотами
и растворяется только в кислотах –
окислителях:
Сu
+ 2 Н2SО4(конц)
= СuSО4
+ SО2↑
+ 2 Н2О,
Сu
+ 4 НNO3(конц)
= Сu(NО3)2
+ 2 NО2↑
+ 2 Н2О,
3
Cu
+ 8 НNО3(разб)
= 3 Сu(NO3)2
+ 2 NO↑
+ 4 Н2О.
Известны
соединения меди со степенями окисления
+1 и +2, из которых +2 более устойчива.
Ионы
Сu2+
в водном растворе существуют в виде
комплексов гексааквамеди (II)
[Сu(Н2О)6]2+,
придающих раствору сине-голубую окраску.
Основная
соль меди – медный купорос CuSO4.5H2O
голубого цвета, но при прокаливании
теряет воду и становится белого цвета,
т.е. окраску раствору придает комплексный
ион. Более точное строение медного
купороса [Cu(H2O)4]SO4
H2O.
Цинк
амфотерный металл. Валентные
электроны атома цинка 4s23d10.
Так как все d-орбитали
у цинка заполнены электронами, все его
соли бесцветны. Это объясняется теорией
кристаллического поля лигандов. В
соединениях проявляет только одну
степень окисления +2.
Взаимодействует
с кислотами:
Zn
+ 2HCl
= ZnCl2
+ H2
Zn
+ H2SO4(разб)
= ZnSO4
+ H2
Zn
+ 2H2SO4(конц)
= ZnSO4
+ SO2
+ 2H2O
4Zn+10HNO3(разб)=4Zn(NO3)2+NH4NO3+3H2O.
Zn
+ 4HNO3(конц)
= Zn(NO3)2
+ 2NO2
+ 2H2O
Взаимодействует
со щелочами: реагирует с растворами
щелочей с образованием гидроксокомплексов,
при сплавлении образует цинкаты:
Zn
+ 2NaOH + 2H2O
= Na2[Zn(OH)4]
+ H2
Zn
+ 2KOH = K2ZnO2
+ H2
это тело или вещество? свойства меди||year|IMAGESNAMESmed—eto-telo-ili-veshestvo-svojstva-medi/IMAGESNAMES
Приблизительно III тысячелетие до нашей эры считается переходным от камня как основного промышленного вещества к бронзе. Период перестройки принято считать медным веком. Ведь именно это соединение на тот период времени было самым главным в строительстве, в изготовлении предметов быта, посуды и прочих процессах.
sadržaj
- Общая характеристика элемента медь
- Медь — это тело или вещество?
- Простое вещество медь — это цветной металл
- Физические свойства
- Химические свойства
- Области применения
- Сплавы меди и их свойства
- Биологическое значение
На сегодняшний день медь своей актуальности не потеряла и по-прежнему считается очень важным металлом, часто используемым в разных нуждах. Медь — это тело или вещество? Какими свойствами она обладает и для чего нужна? Попробуем разобраться далее.
Медь — это тело или вещество? Какими свойствами она обладает и для чего нужна? Попробуем разобраться далее.
Общая характеристика элемента медь
Как химический элемент, медь имеет свое местоположение в периодической системе. Оно следующее.
- Четвертый большой период, первый ряд.
- Первая группа, побочная подгруппа.
- Порядковый номер 29.
- Атомный вес — 63,546.
- Электронная конфигурация внешнего слоя выражается формулой 3d104s1.
Элемент имеет два стабильных природных изотопа с массовыми числами 63 и 65. Латинское название элемента cuprum, что объясняет его химический символ Cu. В формулах читается как «купрум», русское наименование — медь.
Медь — это тело или вещество?
Чтобы ответить на данный вопрос, следует для начала определиться с понятиями «вещество» и «тело». Они изучаются еще на школьных ступенях, так как являются основополагающими. С точки зрения науки химии и физики, веществом считаются все материалы, из которых изготавливаются те или иные предметы. То есть примерами веществ могут служить все химические соединения как органической, так и неорганической природы.
То есть примерами веществ могут служить все химические соединения как органической, так и неорганической природы.
Тело — это сам предмет, который состоит как раз из какого-то вещества. Они могут быть искусственно сконструированы человеком, либо же иметь природное происхождение. Примеры тел: гвозди, окна, пластинки, стол, шкаф, цветочный горшок и прочее.
Чтобы различить эти два понятия, приведем несколько сравнительных примеров.
- Сахар — вещество, леденец на палочке — тело.
- Железо — вещество, гвоздь — тело.
- Окно — тело, стекло — вещество.
Очевидно из этих рассуждений, что на вопрос: «Медь — это тело или вещество?» — ответ однозначен. Это вещество. Вот если речь пойдет о медной пластинке или медном колечке, тогда, безусловно, следует говорить о них как о теле.
С точки зрения химии, медь — это вещество, относящееся к категории металлов. Оно обладает рядом очень ценных свойств, которые лежат в основе широкого использования данного соединения.
Простое вещество медь — это цветной металл
Как мы уже обозначили, медь — металл. Однако не все представители этой группы веществ одинаковы по своим характеристикам. Существуют мягкие и твердые, белые и желтые, красные металлы и прочее. Медь же относится к цветным мягким металлам.
Электронное строение ее атома позволяет точно определить, медь — это металл или неметалл. Ведь на внешнем уровне у нее всего один электрон, это значит, что его она способна легко отдавать, проявляя типичные металлические восстановительные свойства. Следовательно, в том, что она должна относиться к категории именно металлов, сомнений быть не может. Об этом же говорят и физические свойства ее простого вещества.
Физические свойства
Медь — это вещество или тело? Полностью убедиться в правильности ответа можно лишь рассмотрев ее физические свойства. Если мы говорим о данном элементе как о простом веществе, то для него характерен следующий набор свойств.
- Металл красного цвета.
- Мягкий и очень ковкий.
- Отличный теплопроводник и электропроводник.
- Не тугоплавкий, температура плавления составляет 1084,5 0С.
- Плотность составляет 8,9 г/см3.
- В природе встречается в основном в самородном виде.
Таким образом, получается, что медь — это вещество, причем известное с самой древности. На основе нее издревле создаются многие архитектурные сооружения, изготовляется посуда и предметы быта.
Химические свойства
С точки зрения химической активности, медь — это тело или вещество, обладающее низкой способностью к взаимодействию. Существует две основные степени окисления этого элемента, которые он проявляет в соединениях. Это:
- +1;
- +2.
Очень редко можно встретить вещества, в которых данные значения заменяются на +3.
Итак, медь может взаимодействовать с:
- воздухом;
- углекислым газом;
- соляной кислотой и некоторыми другими соединениями только при очень высоких температурах.

Все это объясняется тем, что на поверхности металла формируется защитная оксидная пленка. Именно она предохраняет его от дальнейшего окисления и придает стабильность и малоактивность.
Из простых веществ медь способна взаимодействовать с:
- галогенами;
- селеном;
- цианидами;
- серой.
Часто формирует комплексные соединения либо двойные соли. Практически все сложные соединения данного элемента, кроме оксидов — ядовитые вещества. Те молекулы, которые образует одновалентная медь, легко окисляются до двувалентных представителей.
Области применения
Медь — это смесь или чистое вещество, которое в любом из этих состояний находит широкое применение в промышленности и быту. Можно обозначить несколько основных отраслей использования соединений меди и чистого металла.
- Кожевенная промышленность, в которой используются некоторые соли.
- Производство меха и шелка.
- Изготовление удобрений, средств защиты растений от вредителей (медный купорос).

- Сплавы меди находят широкое применение в автомобилестроении.
- Судостроение, авиаконструкции.
- Электротехника, в которой медь используется, благодаря хорошей антикоррозионной устойчивости и высокой электро- и теплопроводности.
- Различное приборостроение.
- Изготовление посуды и бытовых предметов хозяйственного значения.
Очевидно, что несмотря на долгие сотни лет, рассматриваемый металл только укрепил свои позиции и доказал состоятельность и незаменимость в применении.
Сплавы меди и их свойства
Существует много сплавов на основе меди. Она сама отличается высокими техническими характеристиками, так как легко поддается ковке и прокатке, является легкой и достаточно прочной. Однако при добавлении определенных компонентов свойства значительно улучшаются.
В данном случае следует задать вопрос: «Медь — это вещество или физическое тело, когда речь идет о ее сплавах?» Ответ будет такой: это вещество. Все равно она является именно им до тех пор, пока из сплава не будет изготовлено какое-либо физическое тело, то есть определенный продукт.
Какие сплавы меди бывают?
- Практически равное сочетание меди и цинка в одном составе принято называть латунью. Этот сплав отличается высокой прочностью и устойчивостью к химическим воздействиям.
- Оловянистая бронза — сочетание меди и олова.
- Мельхиор — никель и медь в соотношении 20/80 из 100. Используется для изготовления украшений.
- Константан — сочетание никеля, меди и добавка марганца.
Биологическое значение
Не столь важно, медь — это вещество или тело. Значимо другое. Какую роль играет медь в жизни живых организмов? Оказывается, весьма немаловажную. Так, ионы рассматриваемого металла выполняют следующие функции.
- Участвуют в преобразовании ионов железа в гемоглобин.
- Являются активными участниками процессов роста и размножения.
- Позволяют усваиваться аминокислоте тирозину, следовательно влияют на проявление цвета волос, кожи.
Если организм недополучает данный элемент в нужном количестве, то могут возникать неприятные заболевания. Например, анемия, облысение, болезненная худоба и прочее.
Например, анемия, облысение, болезненная худоба и прочее.
Dijelite na društvenim mrežama:
Povezan
Эссенциальные микроэлементы: что это, их роль в жизнедеятельности человека
Общие сведения
Минеральный состав внутриклеточной жидкости строго поддерживается на определенном уровне.
Элементы вместе с водой являются строительным материалами, кофакторами и катализаторами биохимических реакций, стабилизаторами белков и ферментов, обеспечивая постоянство осмотического давления, кислотно-щелочного баланса, процессов всасывания, секреции, кроветворения, костеобразования, свертывания крови. Благодаря присутствию элементов осуществляется процесс мышечного сокращения, нервной проводимости и внутриклеточного дыхания. Химические элементы в организме находятся в виде различных соединений и солей, их влияние на организма обусловлено дозой элемента. Для каждого элемента существует свой физиологический рабочий диапазон концентраций, обеспечивающий нормальное протекание физиологических реакций в организме.
Нарушенная экология, возросший темп жизни с неизбежным нарастанием стрессовых ситуаций, методы обработки продуктов питания, «убивающие» биологически активные вещества ведут к нарушению металло-лигандного гомеостаза и сдвигу равновесия в сторону увеличения или уменьшения концентрации элемента. Накопление элементов или их дефицит способствует активации альтернативных путей метаболизма, который в ряде случаев приводят к патологическим состояниям.
Химические элементы классифицируются в зависимости от их роли в организме. 98% тела человека состоит из органических элементов: H, C, N, O. Вместе с неорганическими элементами Na, Mg, K, Ca, P, S, Cl они составляют основу клеток и тканей, выполняя структурообразующую функцию. К эссенциальным или жизненно необходимым микроэлементам относятся Mn, Fe, Co, Ni, Cu, Zn, Mo, Se, I, при их отсутствии нарушаются базовые реакции деления и размножение клеток. К условно-эссенциальным микроэлементам относятся Li, V, Cr, B, F, Si, As, их роль до конца не определена. Существуют также «токсические металлы», которые в минимальных концентрациях способны оказывать стимулирующее воздействие на организм, но в высоких концентрациях проявляют токсические эффекты.
Существуют также «токсические металлы», которые в минимальных концентрациях способны оказывать стимулирующее воздействие на организм, но в высоких концентрациях проявляют токсические эффекты.
Микроэлементы составляют лишь 0,02% организма, но способны изменять протекание важнейших биологических реакций. Анализ волос или мочи позволяет выявить избыточное накопление микроэлементов или их дефицит. Содержание микроэлементов в волосах отражает микроэлементный статус организма в целом, поэтому пробы волос являются интегральным показателем минерального обмена. Волосы помогают диагностировать хронические заболевания, когда они себя еще ничем не проявляют.
Железо (Fe)
Железо является жизненно необходимым элементом для организма. Железо входит в состав гемсодержащих белков (гемоглобин и миоглобин) и участвует в переносе кислорода. Железо также входит в состав цитохромов (сложные белки, относящиеся к классу хромопротеидов), участвующих в процессах тканевого дыхания.
Общее содержание железа в организме человека составляет 3-5 г. Из этого количества 57% находится в гемоглобине крови, 23% — в тканях и тканевых ферментах (ферритин и гемосидерин), а остальные 20% — депонированы в печени, селезенке, костном мозге, мышцах и представляют собой «физиологический резерв» железа. Железо существует в двух формах: окисленной (Fe3+) и воcстановленной (Fe2+). Восстановленная форма лучше усваивается организмом. Только 10 % поступившего железо всасывается в кишечнике.
Физиологическая потребность в железе:
- мужчины: 8–10 мг/сут;
- женщины: 15–20 мг/сут;
- беременных женщины: 30–40 мг/сут;
- дети: 4–18 мг/сут.
В больших количествах восстановленная форма железа (гемовое железо), содержится: в свиной печени, говяжьих почках, сердце и печени. Окисленная форма железа (негемовое железо) содержится в неживотных продуктах: непросеянной муке, сушеных персиках, орехах, бобах, спарже, овсяном толокне.
Недостаток железа приводит к тяжелым расстройствам, наиболее важным из которых является железодефицитная анемия. Железодефицитная анемия может привести к сердечной недостаточности.
Избыточное накопление железа приводит к отложению металла в органах (печень, поджелудочная железа, суставы, сердце). Явления отравления железом выражаются рвотой, диареей, падением артериального давления, параличом ЦНС и воспалением почек. При лечении железом могут развиться запоры, так как железо связывает сероводород, что ослабляет моторику кишечника. Избыток железа в организме может привести к дефициту меди, цинка, хрома и кальция, а также к избытку кобальта.
Йод (I)
Йод необходим на всех этапах жизнедеятельности. Период младенчества и раннего детства являются критическими в отношении дефицита йода. Йод входит в состав гормонов щитовидной железы тироксина (T4) и трийодтиронина (T3). Йод необходим для роста и дифференцировки клеток всех тканей организма человека, внутриклеточного дыхания, регуляции трансмембранного транспорта натрия и гормонов.
Общее количество йода в организме составляет 25 мг, из них 15 мг аккумулирует щитовидная железа. Значительное количество йода содержится в печени, почках, коже, волосах, ногтях, яичниках и предстательной железе.
Физиологическая потребность в йоде:
- взрослые: 100–150 мкг/сут;
- беременные: 175–200 мкг/сут;
- дети: от 60 до 150 мкг/сут.
Богатым источником йода являются водоросли, овощи, выращенные на почве обогащенной йодом, лук, морепродукты.
При недостаточном поступлении йода у взрослых увеличиваются размеры щитовидной железы, замедляется основной обмен, наблюдается падение артериального давления. У детей недостаток йода сопровождается резкими изменениями всей структуры тела: ребенок отстает в умственном и физическом развитии.
Избыток йода в организме наблюдается при гипертиреозе. Развивается Базедова болезнь, сопровождающаяся экзофтальмом, тахикардией, раздражительностью, мышечной слабостью, потливостью, исхуданием, склонностью к диарее.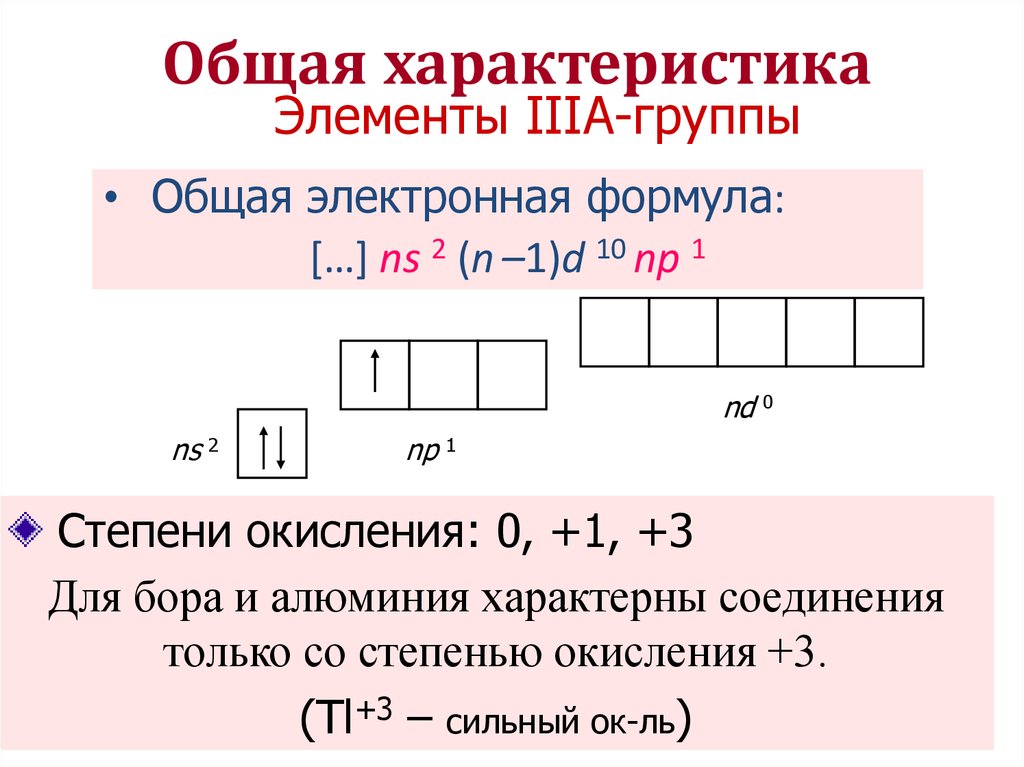 Повышение основного обмена ведет к гипертермии, дистрофическим изменениям кожи и ее придатков, раннему поседению, депигментации кожи на ограниченных участках (витилиго), атрофии мышц.
Повышение основного обмена ведет к гипертермии, дистрофическим изменениям кожи и ее придатков, раннему поседению, депигментации кожи на ограниченных участках (витилиго), атрофии мышц.
Марганец (Mn)
Важен для репродуктивных функций и нормальной работы центральной нервной системы. Марганец участвует в синтезе нейромедиаторов, улучшает мышечные рефлексы, обеспечивает развитие соединительной и костной ткани, увеличивает утилизацию жиров, усиливает эффекты инсулина.
3–5 % поступившего марганца всасывается. Наиболее богаты марганцем трубчатые кости и печень, поджелудочная железа. Марганец содержится в клетках, богатых митохондриями.
Физиологическая потребность в марганце:
- взрослые: 2–5 мг/сут;
- для детей в 2 раза выше.
Особенно богаты марганцем чай, растительные соки, цельные злаковые, орехи, зеленые овощи с листьями, горох, свёкла.
При недостатке марганца нарушаются процессы окостенения во всем скелете, трубчатые кости утолщаются и укорачиваются, суставы деформируются. Нарушается репродуктивная функция яичников и яичек.
Нарушается репродуктивная функция яичников и яичек.
Избыток марганца усиливает дефицит магния и меди.
Медь (Cu)
Медь принимает участие в поддержание эластичности связок, сухожилий, кожи и стенок легочных альвеол, стенок капилляров, а также прочности костей. Медь входит в состав защитных оболочек нервных волокон, участвует в процессах пигментации, так как входит в состав меланина. Медь влияет на углеводный обмен, посредством усиления процессов окисления глюкозы и торможения распада гликогена мышц и печени. Медь обладает противовоспалительными действиями, помогает при борьбе с бактериальными агентами. Медь является кофактором ферментов антиоксидантной защиты и помогает нейтрализовать действие свободных радикалов.
Общее содержание меди в организме человека составляет примерно 100–150 мг. Лучше всего организм усваивает двухвалентную медь. В тонком кишечнике всасывается до 95% меди, поступившей с пищей. Основное «депо» меди в организме — печень, поскольку синтезирует белок-переносчик меди церулоплазмин.
Физиологическая потребность в меди:
- взрослые: 1 мг/сут;
- дети: от 0,5 до 1 мг/сут.
Медь содержится в овощах, бобовых, морепродуктах, яблоках.
При недостатке меди в организме наблюдаются: задержка роста, анемия, дерматозы, депигментация волос, частичное облысение, потеря аппетита, сильное исхудание, понижение уровня гемоглобина, атрофия сердечной мышцы. Избыток меди приводит к дефициту цинка и мoлибдена, а также марганца.
Молибден (Мо)
Способствует метаболизму углеводов и жиров, является важной частью фермента, отвечающего за утилизацию железа, в связи с чем помогает предупредить анемию. Принимает участие в обмене мочевой кислоты, включении фтора в состав эмали зубов, гемопоэзе.
Биодоступность молибдена составляет 50%. Молибден не депонируется в организме, а распределяется между клетками крови.
Физиологическая потребность в молибдене:
- взрослые: 45–100 мкг/сут;
- дети: от 0,5 до 1 мг/сут.

Содержится в темно-зеленых листовых овощах, неочищенном зерне, бобовых. Проявления недостаточности изучены плохо. Повышенное содержание в организме встречается очень редко.
Селен (Sе)
Элемент антиоксидантной защиты, хорошо сочетается с витамином Е. Селен помогает поддерживать должную эластичность тканей. Селен усиливает иммунитет, поэтому активно используется в онкологической практике, в лечении гепатитов, панкреатитов, кардиомиопатий. Селен защищает организм от тяжёлых металлов.
Всасывается в тонком кишечнике, депонируется в почках, печени, костном мозге.
Физиологическая потребность в селене:
- женщины: 50 мкг/сут;
- беременные: 65 мкг/сут;
- мужчины: 70 мкг/сут;
- дети: 10-50 мкг/сут.
В чистом виде встречается в природе редко, главным образом в виде примеси к сернистым металлам. Присутствует в чесноке, сале, отрубях, белых грибах, растительных маслах, морских водорослях.
Присутствует в чесноке, сале, отрубях, белых грибах, растительных маслах, морских водорослях.
При дефиците селена в организме усиленно накапливаются мышьяк и кадмий, которые, в свою очередь, еще больше усугубляют его дефицит.
Избыток селена приводит к гепато- и холецистопатиям, изменениям работы нервно-мышечного аппарата (боли в конечностях, судороги, чувство онемения). Избыток может привести к дефициту кальция.
Цинк (Zn)
Цинк входит в состав более 300 ферментов, чем объясняет его влияние на углеводный, жировой и белковый обмен веществ, на окислительно-восстановительные процессы, регуляцию активности генов. Цинк связан с правильным функционированием репродуктивной, неврологической, иммунной систем, ЖКТ и кожи. Присутствие микроэлемента важно для нормального сперматогенеза, органогенеза, работы нейромедиаторов и панкреатических ферментов, правильного развития тимуса, эпителизации ран в процессе заживления и ощущения вкуса.
В организме содержится около 1,5–3 г цинка. Цинк всасывается в тонком кишечнике. Медь является антагонистом цинка, и конкурирует с цинком за всасывание в кишечнике. 99% цинка находится внутриклеточно, 1% — в плазме. Цинк присутствует во всех органах и тканях, но в большей степени цинк депонируют предстательная железа, семенники, мышцы, кожа, волосы.
Цинк всасывается в тонком кишечнике. Медь является антагонистом цинка, и конкурирует с цинком за всасывание в кишечнике. 99% цинка находится внутриклеточно, 1% — в плазме. Цинк присутствует во всех органах и тканях, но в большей степени цинк депонируют предстательная железа, семенники, мышцы, кожа, волосы.
Физиологическая потребность в цинке составляет: 12 мг/сут для взрослых, 3–2 мг/сут для детей.
Наиболее богаты цинком дрожжи, пшеничные, рисовые и ржаные отруби, зерна злаков и бобовых, какао, морепродукты, грибы, лук, картофель.
При дефиците цинка наблюдается задержка роста, перевозбуждение нервной системы и быстрое утомление. Поражение кожи происходит с утолщением эпидермиса, отеком кожи, слизистых оболочек рта и пищевода, ослаблением и выпадением волос. Недостаточное поступление цинка приводит к бесплодию. Дефицит цинка может приводить к усиленному накоплению железа, меди, кадмия, свинца.
При цинковом отравлении наступает фиброзное перерождение поджелудочной железы. Избыток цинка задерживает рост и нарушает минерализацию костей.
Избыток цинка задерживает рост и нарушает минерализацию костей.
Кобальт (Co)
Входит в состав витамина В12, участвует в обмене гормонов щитовидной железы, подавляет обмен йода, регулирует гемопоэз, усиливает всасываемость железа.
В организме 1,5 г кобальта. Биодоступность кобальта 20%. В организм кобальт депонируется в печени, костной ткани и мышцах.
Физиологическая потребность в кобальте составляет: 10 мкг/сут для взрослых.
Кобальт содержится в печени, молоке, овощах.
Дефицит кобальта связан с В12-дефицитной анемией, вегетарианством или паразитарной инвазией. Избыток кобальта наблюдается при интоксикации кобальта (вредное производство, разрушение ортопедических имплантантов).
Никель (Ni)
Никель пролонгирует эффекты инсулина, участвует в окислении аскорбиновой кислоты, ускоряет образование дисульфидных групп.
Никель всасывается в кишечнике, биодоступность от 1 до 10 %. Запасы никеля находятся в поджелудочной железе, легких, сердце.
Запасы никеля находятся в поджелудочной железе, легких, сердце.
Физиологическая потребность в никеле составляет: 100–200 мкг/сут для взрослых.
Богаты никелем чай, гречиха, морковь и салат.
Дефицит никеля не описан. Избыток никеля наблюдается при его токсическом поступлении, злокачественных новообразованиях легких, ожогах, инсультах и инфарктах. Избыток может проявлять потерей пигментацией кожи.
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21742
Цели обучения
- Понять основные свойства, отличающие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которая не может быть разделена на более простые вещества или построена из более простых веществ любым обычным химическим или физическим методом. Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные получены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их положением в периодической таблице.
Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные получены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их положением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Неблестящий, различных цветов |
| Ковкий и пластичный (гибкий) в виде твердых тел | Хрупкий, твердый или мягкий |
| Проведение тепла и электричества | Плохие проводники |
| Оксиды металлов основные, ионные | Оксиды неметаллов кислотные, ковалентные |
| Форма катионов в водном растворе | Образуют анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, образующие положительные ионы за счет потери электронов в ходе химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются прекрасными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются прекрасными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, ковкие, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы являются твердыми при комнатной температуре, за исключением ртути, которая при комнатной температуре находится в жидком состоянии (галлий жидкий в жаркие дни).
- Блеск : Металлы обладают способностью отражать свет от своей поверхности и могут полироваться, например, золото, серебро и медь.
- Ковкость: Металлы обладают способностью выдерживать удары молотком и могут быть превращены в тонкие листы, известные как фольга.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле. - Пластичность: Металлы можно вытягивать в проволоку. Например, 100 г серебра можно вытянуть в тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и могут резаться ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на самой внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь являются двумя лучшими проводниками тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые. Иридий и осмий имеют самую высокую плотность, тогда как литий имеет самую низкую плотность.

- Температуры плавления и кипения : Металлы имеют высокие температуры плавления и кипения. У вольфрама самые высокие температуры плавления и кипения, а у ртути самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы представляют собой электроположительные элементы, которые обычно образуют основные или амфотерные оксиды с кислородом. Другие химические свойства включают:
- Электроположительный характер : Металлы, как правило, имеют низкую энергию ионизации, и обычно теряют электроны (т.е. окисляются ), когда подвергаются химическим реакциям Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в с подоболочкой)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не следуют очевидной схеме, 2 9{-}} \label{1.
 3} \]
3} \]Соединения металлов с неметаллами, как правило, ионные по своей природе. Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\[\ce{Na2O(s) + h3O(l) \rightarrow 2NaOH(aq)}\label{1.4} \]
\[\ce{CaO(s) + h3O(l) \rightarrow Ca(OH)2(aq)} \label{1.5} \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислоты 9{2-}\), таким образом, \(Al_2O_3\).
Пример \(\PageIndex{2}\)
Как вы думаете, будет ли он твердым, жидким или газообразным при комнатной температуре?
Растворы
Оксиды металлов обычно твердые при комнатной температуре
Пример \(\PageIndex{3}\)
Напишите сбалансированное химическое уравнение для реакции оксида алюминия с азотной кислотой:
Раствор
0
0 Оксид металла + кислота -> соль + вода
\[\ce{Al2O3(s) + 6HNO3(aq) \rightarrow 2Al(NO3)3(aq) + 3h3O(l)} \nonumber \]
Неметаллы
Элементы, которые имеют тенденцию приобретать электроны с образованием анионов во время химических реакций, называются неметаллами.
 Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газообразное (кислород) и твердое тело (углерод). Только бром существует в виде жидкости при комнатной температуре.
- Нековкий и пластичный : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Плохие проводники тепла и электричества.
- Блеск: Не имеют металлического блеска и не отражают свет.
- Точки плавления и кипения : Точки плавления неметаллов обычно ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют при стандартных условиях в виде двухатомных молекул : \(\ce{h3(g)}\), \(\ce{N2(g)}\), \(\ce{O2(g) }\), \(\ce{F2(g)}\), \(\ce{Cl2(g)}\), \(\ce{Br2(l)}\), \(\ce{I2( с)}\).

Химические свойства неметаллов
Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами. Они электроотрицательны по характеру. Неметаллы, реагируя с металлами, имеют тенденцию приобретать электроны (обычно приобретают электронную конфигурацию благородного газа) и становятся анионы:
\[\ce{3Br2(l) + 2Al(s) \rightarrow 2AlBr3(s)} \nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами. Обычно они образуют кислотные или нейтральные оксиды с кислородом, которые растворяются в воде с образованием кислот:
\[\ce{CO2(g) + h3O(l)} \rightarrow \underset{\text{угольная кислота}}{\ce {h3CO3(aq)}} \nonumber \]
Как вы знаете, газированная вода слабокислая (угольная кислота).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\[\ce{CO2(g) + 2NaOH(aq) \rightarrow Na2CO3(aq) + h3O(l)} \nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.
 Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — свойство некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.
Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — свойство некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.Таблица \(\PageIndex{2}\): Элементы, разделенные на металлы, неметаллы и металлоиды. Металлы Неметаллы Металлоиды Золото Кислород Кремний Серебро Углерод Бор Медь Водород Мышьяк Железо Азот Сурьма Меркурий Сера Германий Цинк Фосфор Тенденции металлических и неметаллических свойств
Металлический характер наиболее силен для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению по мере продвижения вправо в любой период (неметаллический характер увеличивается с увеличением электроотрицательности и ионизации).
 энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.
энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.Неметаллический характер увеличивается снизу вверх и слева направо с наибольшим количеством неметаллических элементов в правом верхнем углу. металлический характер демонстрирует противоположную тенденцию: самый металлический элемент находится внизу слева.
Участники и ссылки
Майк Блабер (Университет штата Флорида)
Бинод Шреста (Университет Лотарингии)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- сплав
- металл
- металлический символ
- металлоид
- неметалл
Является ли медь элементом? — Techiescientist
Медь представляет собой металл розовато-оранжевого цвета, встречающийся в природе в сочетании с другими элементами в форме минералов, таких как малахит, куприт, борнит, азурит и т. д. Однако в природе он также встречается в свободном элементном состоянии. .
Будучи хорошим проводником электричества, медь используется в производстве ряда электроприборов. Также благодаря своему яркому и привлекательному внешнему виду медь используется в производстве украшений и других декоративных изделий.
Натыкались ли вы дома или в другом месте на какие-то изделия из меди и любовались ими, думая, что за материал в них? Вы думали об этом с точки зрения химии? Или, что еще хуже, вы спрашивали других о его функциях, но не могли получить ответ?
Если это произошло, не волнуйтесь.
 Techiescientist здесь, чтобы решить все ваши вопросы.
Techiescientist здесь, чтобы решить все ваши вопросы.Итак, продолжайте читать, чтобы узнать больше о меди…
Является ли медь элементом? Да, Медь — элемент. Медь состоит только из одного типа атомов, т. е. атомов меди, которые не могут быть далее разделены. Он указан в периодической таблице в группе 11 и имеет атомный номер 29. Следовательно, медь является элементом.
Что такое элемент?
Элементы – это основные вещества, присутствующие в чистом виде. Они состоят только из атомов одного типа и не могут быть далее разделены ни на какое другое вещество, кроме своих собственных атомов. Например, медь, кислород, фтор и т. д. Основной единицей элемента является атом.
В периодической таблице перечислены все элементы, открытые учеными на данный момент, и они расположены в соответствии с их характеристиками. Элементы со схожими свойствами помещаются в одну группу. Они представлены своими атомарными символами.
В основном элементы делятся на металлы и неметаллы.

Что такое соединение?
Соединения – это вещества, которые образуются при химическом соединении атомов двух или более элементов вместе в определенных соотношениях. Основной единицей соединения является молекула.
Каждое соединение обладает уникальными физическими и химическими свойствами, которые отличаются от любого из соединяющихся атомов.
Свойства соединения изменяются, если соотношение атомов нарушено. Вот почему соединения представлены их химическими формулами.
Например, вода представлена химической формулой H 2 O, что указывает на то, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Медь – атомный номер, массовое число, атомная диаграмма
Медь является элементом 11 группы и 4 периода периодической таблицы. Он принадлежит к элементам D-блока, также известным как переходные металлы. Положение меди в периодической таблице показано ниже:
Информация, которую мы можем извлечь из приведенного выше рисунка:
• Атомный номер меди 29.

• Атомная масса или массовое число меди 63,546
• Атомный символ меди — Cu.
• Электронная конфигурация меди [Ar]3d 10 4с 1 .
Атомную структуру меди также можно изобразить на основе приведенной выше информации.
Обратите внимание, что количество протонов = количество электронов = атомный номер элемента
В случае меди атомный номер = 29.
Следовательно, количество протонов = количество электронов = 29
Кроме того, Количество нейтронов = Атомная масса (округление до ближайшего целого числа) – Количество протонов
Следовательно, Количество нейтронов в меди = 63 – 29= 34
С учетом приведенной выше информации атомная модель меди нарисована ниже:
Следовательно, атом меди состоит из 29 протонов и 34 нейтронов в ядре, а 29 электронов вращаются вокруг ядра в различных оболочках.
Почему медь не является соединением?
И элементы, и соединения представляют собой чистые вещества, образованные одним типом повторяющихся единиц, а именно.
 атомы и молекулы.
атомы и молекулы.Элементы — это чистейшая форма материи, состоящая только из атомов одного типа. Эти атомы расположены по определенному образцу и считаются основной единицей элемента. Невозможно далее разделить атомы на более простые объекты.
Периодическая таблица содержит список всех 118 элементов и классифицирует элементы на металлы и неметаллы. Элементы в периодической таблице занимают определенные позиции и идентифицируются по их атомным номерам.
Обычно элементы встречаются в природе в сочетании с другими элементами, такими как минералы, а иногда и в своем естественном состоянии. Например, золото, серебро, натрий и т. д.
С другой стороны, соединения — это вещества, образованные сочетанием двух или более типов атомов. Эти атомы объединены в определенном соотношении и связаны химической связью.
Основной единицей соединений является молекула. Можно дополнительно разделить эти молекулы на составляющие их атомы. Однако для этого требуются строгие химические процессы.

Например, молекулу воды можно разделить на водород и кислород, так как она содержит два атома водорода и один атом кислорода.
Медь относится к 11 группе периодической таблицы и помещается наравне с металлами. Он состоит только из атомов меди, которые составляют его основную единицу. Его нельзя далее разделить на какое-либо более простое вещество, и, следовательно, медь можно правильно назвать элементом.
Является ли медь чистым веществом?
Чистые вещества — это виды материи, состоящие только из частиц одного типа, атомов или молекул. Они имеют однородный состав и, таким образом, обладают специфическими физическими и химическими свойствами.
Кроме того, атомы или молекулы внутри чистого вещества всегда расположены определенным образом, т.е. имеют определенную структуру решетки.
Медь состоит только из атомов меди, которые расположены вместе определенным образом. Эти атомы составляют основную единицу меди и расположены в определенной структуре решетки.

Медь также обладает определенными физическими и химическими свойствами. Так как все эти свойства принадлежат чистым веществам, то Медь, безусловно, является чистым веществом.
Является ли медь смесью?
Смесь состоит из двух или более типов атомов или молекул, смешанных вместе в непостоянных соотношениях.
Смешанные атомы или молекулы не соединяются химически и могут быть легко разделены на составляющие их частицы с помощью простых физических процессов.
Определенной схемы расположения составляющих частиц нет. Физические и химические свойства смеси изменяются с изменением доли одной или нескольких составляющих ее частиц.
Смеси можно дополнительно разделить на гомогенные и гетерогенные смеси.
В гомогенных смесях атомы или молекулы распределены равномерно, из-за чего может быть невозможно визуально отличить их друг от друга. Например, соль в воде.
В гетерогенных смесях количество соединяющихся атомов или молекул не является постоянным по всей смеси, а также составляющие ее частицы можно различить визуально.
 Смесь сахара и соли является примером гетерогенной смеси.
Смесь сахара и соли является примером гетерогенной смеси.В случае меди присутствует только один тип атомов, которые химически связаны друг с другом и не могут быть разделены с помощью физических процессов.
Более того, эти атомы расположены по определенной схеме, что также обуславливает специфические физико-химические свойства меди. 9
Алмаз — это элемент Соединение Чистое вещество
Латунь Смесь
Бензин Однородная смесь
Молоко Однородная смесь
Решетчатая структура меди
Структура решетки элемента также известна как его кристаллическая структура. Он состоит из двух компонентов: решетки Браве и атомов.
Решетка Браве представляет собой пространство, в котором предполагается, что атомы расположены. Обычно его рассматривают в виде куба, в котором атомы располагаются на определенных позициях в определенных количествах.
Атомы внутри решетки Браве расположены под определенным углом и на расстоянии друг от друга.
 Другие параметры внутри этой структуры также остаются постоянными.
Другие параметры внутри этой структуры также остаются постоянными.Атомы в решетке Браве меди организованы в структуру гранецентрированной кубической решетки.
Это становится легко понять, если вы представите куб с маленькими шариками, размещенными в каждом углу этого куба, а также в центре каждой из его граней.
Здесь куб — это решетка Браве, а шарики — это атомы. Следовательно, гранецентрированная кубическая структура решетки меди выглядит следующим образом:
В приведенной выше структуре красные кружки обозначают атомы меди, расположенные под определенным углом и на определенном расстоянии друг от друга.
Свойства меди
Ниже перечислены несколько важных свойств меди:
• Медь представляет собой металл розовато-оранжевого цвета.
• Это очень хороший проводник тепла и электричества, благодаря чему он используется при изготовлении ряда кухонных принадлежностей и электроприборов.
• Температуры плавления и кипения меди составляют 1083 °C и 2595 °C соответственно.

• Медь устойчива к коррозии, но подвержена потускнению.
• Медь обладает высокой ковкостью и пластичностью.
• Атомы меди расположены в гранецентрированной кубической структуре решетки.
• Медь также используется для борьбы с биообрастанием, а ее противомикробные свойства делают ее идеальной для очистки воды.
Заключение
Медь состоит только из атомов одного типа и занимает определенное положение в периодической таблице. Следовательно, медь является элементом.
Медь является чистым веществом, так как состоит только из атомов одного типа, расположенных в определенном порядке.
Медь не является соединением или смесью, поскольку она не может быть далее разделена на различные атомы ни физическим, ни химическим способом.
Атомы меди расположены в гранецентрированной кубической решетке.
Медь — Энергетическое образование
Энергетическое образование
Меню навигации
ИСТОЧНИКИ ЭНЕРГИИ
ИСПОЛЬЗОВАНИЕ ЭНЕРГИИ
ЭНЕРГЕТИЧЕСКОЕ ВОЗДЕЙСТВИЕ
ИНДЕКС
Поиск
Рис. 1. Медь, атомный номер 29 и атомный вес 63,546. [1]
Рис. 2. Самородная медь (не сочетается с каким-либо другим элементом и встречается в природе), ок. размером 4 см. [2]
Медь ( Cu ) является 29-м -м -м элементом в периодической таблице и довольно часто встречается на Земле примерно в таком же количестве, как цинк и никель. [3] Известная своим отчетливым цветом (виден на рис. 2), медь была одним из первых металлов, с которыми когда-либо обращались люди.
 Данные свидетельствуют о том, что она использовалась более 11 000 лет. [4]
Данные свидетельствуют о том, что она использовалась более 11 000 лет. [4] Медь в больших количествах используется в электроэнергетике в виде проволоки из-за ее высокой электропроводности (см. таблицу ниже). [4] Его проводимость уступает только серебру, однако меди примерно в 860 раз больше на Земле, чем серебра, [3] , поэтому он намного дешевле. Хотя медь используется преимущественно в электропроводке, другие области применения меди включают сантехнику, валюту и ювелирные изделия. Медь слишком мягкая, чтобы использовать ее отдельно для большинства применений, но люди давно обнаружили, что ее можно смешивать с другими металлами для образования прочных сплавов. Самый известный пример — это смешивание меди с оловом для получения бронзы или цинка для получения латуни. [4]
Некоторые свойства меди:
63,546 Плотность (при 0 o C) 8,933 г/см 3 Температура кипения 2835 К Температура плавления 1357,8 К Электропроводность 6,30×10 7 σ Воплощенная энергия [6] 30-90 МДж/кг Использование меди
Использование меди в процентах (оценка) показано на рисунке ниже.
 [7]
[7] Электрика
Рис. 4. Медный провод. [8]
Медь является основным компонентом электропроводки. В одном автомобиле имеется около 1,5 км медной проводки общей массой около 20 кг в малолитражных автомобилях и 45 кг в роскошных и гибридных автомобилях. [9] Наряду с проводкой транспортных средств и другой электроникой медная проводка используется в производстве и передаче электроэнергии (кроме воздушных линий электропередач, которые сделаны из алюминия).
Помимо отличной электропроводности, медь также очень пластична, поэтому с ней очень легко работать. Конкретные примеры использования меди в электротехнике включают печатные платы, микросхемы, полупроводники, электромагниты, электродвигатели, ветряные турбины, фотогальванические элементы и многое другое. Практически любая проводка, кроме линий электропередач, выполнена из меди. [7]
Строительство
Рисунок 5: Обратите внимание на контраст старой меди (зеленый) и новой меди (медь) в этой обсерватории.
 [10]
[10] Медь является стандартным материалом для сантехники не только из-за ее высокой температуры плавления и коррозионной стойкости, но и потому, что она не допускает роста бактерий или вирусов. Он также пластичен и легко паяется; его легко сгибать и соединять.
Помимо сантехники, медь и ее сплавы используются в строительстве для изготовления теплообменников, трубопроводов, сельскохозяйственных систем водоснабжения, крыш, ручек, дверных ручек и других строительных материалов и многого другого. [7]
Видео
Видео ниже взято из проекта периодических видео Ноттингемского университета. [11] Они создали полный набор коротких видеороликов о каждом элементе периодической таблицы элементов.
Ссылки
- ↑ Сделано на основе информации Королевского химического общества. Доступно: http://www.rsc.org/periodic-table/element/29/copper.

- ↑ Wikimedia Commons [в сети], доступно: https://upload.wikimedia.org/wikipedia/commons/f/f0/NatCopper.jpg
- ↑ 3.0 3.1 PeriodicTable.com. (31 июля 2015 г.). Изобилие элементов в земной коре [онлайн], доступно: http://periodictable.com/Properties/A/CrustAbundance.v.log.html
- ↑ 4,0 4,1 4,2 4,3 Лаборатория Джефферсона. (31 июля 2015 г.). The Element Copper [онлайн], доступно: http://education.jlab.org/itselemental/ele029.html
- ↑ Химия на About.com. (31 июля 2015 г.). Таблица удельного электрического сопротивления и проводимости [онлайн], доступно: http://chemistry.about.com/od/moleculescompounds/a/Table-Of-Electrical-Resistivity-And-Conductivity.htm
- ↑ ЮНЕП. (19 августа 2015 г.). Экологические риски и проблемы антропогенных потоков и циклов металлов [Онлайн]. Доступно: https://d396qusza40orc.cloudfront.net/metals/3_Environmental_Challenges_Metals-Full%20Report_36dpi_130923.

