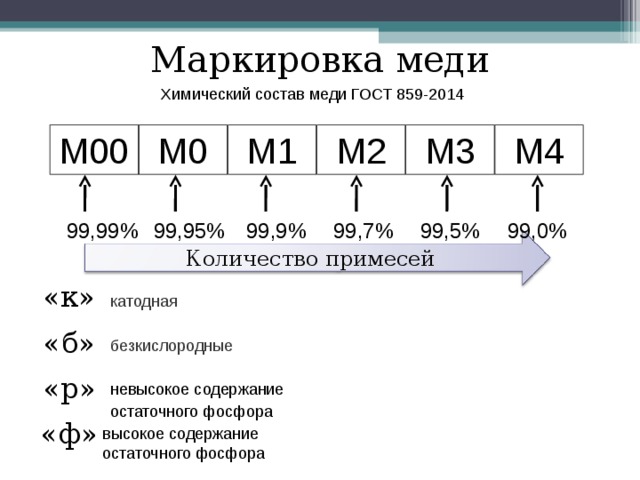
Медь химические свойства: Химические свойства меди
Содержание
Химические свойства меди
Медь
Химическая активность меди невелика. В сухой атмосфере медь практически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3. Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди. Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной. Патина предохраняет металл от дальнейшего разрушения.
При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем — оксид CuO.
В сухом воздухе и кислороде при нормальных условиях медь не окисляется. Но она достаточно легко вступает в реакции: уже при комнатной температуре с галогенами, например с влажным хлором образует хлорид CuCl2, при нагревании с серой образует сульфид Cu2S, с селеном. Но с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют, например, соляная и разбавленная серная кислоты. Но в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соответствующих солей:
Но с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют, например, соляная и разбавленная серная кислоты. Но в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соответствующих солей:
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O.
Кроме того, медь можно перевести в раствор действием водных растворов цианидов или аммиака:
2Cu + 8NH3·H2O + O2 = 2[Cu(NH3)4](OH)2 + 6H2O
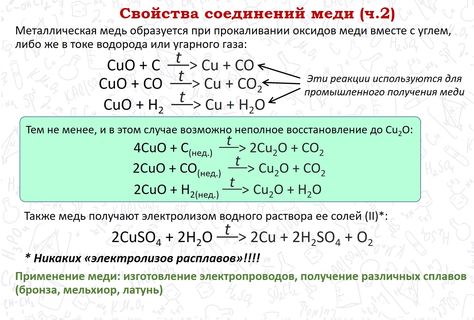
При нагревании металла на воздухе или в кислороде образуются оксиды меди: желтый или красный Cu2O и черный CuO. Повышение температуры способствует образованию преимущественно оксида меди(I) Cu2O. В лаборатории этот оксид удобно получать восстановлением щелочного раствора соли меди(II) глюкозой, гидразином или гидроксиламином:
2CuSO4 + 2NH2OH + 4NaOH = Cu2O + N2 + 2Na2SO4 + 5H2O
Эта реакция – основа чувствительного теста Фелинга на сахара и другие восстановители. К испытываемому веществу добавляют раствор соли меди(II) в щелочном растворе. Если вещество является восстановителем, появляется характерный красный осадок.
К испытываемому веществу добавляют раствор соли меди(II) в щелочном растворе. Если вещество является восстановителем, появляется характерный красный осадок.
Поскольку катион Cu+ в водном растворе неустойчив, при действии кислот на Cu2O происходит либо дисмутация, либо комплексообразование:
Cu2O + H2SO4 = Cu + CuSO4 + H2O
Cu2O + 4HCl = 2 H[CuCl2] + H2O
Оксид Cu2O заметно взаимодействует со щелочами. При этом образуется комплекс:
Cu2O + 2NaOH + H2O = 2Na[Cu(OH)2]
Оксиды меди не растворимы в воде и не реагируют с ней. Единственный гидроксид меди Cu(OH)2 обычно получают добавлением щелочи к водному раствору соли меди(II). Бледно-голубой осадок гидроксида меди(II), проявляющий амфотерные свойства (способность химических соединений проявлять либо основные, либо кислотные свойства), можно растворить не только в кислотах, но и в концентрированных щелочах. При этом образуются темно-синие растворы, содержащие частицы типа [Cu(OH)4]2–. Гидроксид меди(II) растворяется также в растворе аммиака:
При этом образуются темно-синие растворы, содержащие частицы типа [Cu(OH)4]2–. Гидроксид меди(II) растворяется также в растворе аммиака:
Cu(OH)2 + 4NH3*H2O = [Cu(NH3)4](OH)2 + 4H2O
Гидроксид меди(II) термически неустойчив и при нагревании разлагается:
Cu(OH)2 = CuO + H2O
Большой интерес к химии оксидов меди в последние два десятилетия связан с получением высокотемпературных сверхпроводников, из которых наиболее известен YBa2Cu3O7. В 1987 было показано, что при температуре жидкого азота это соединение является сверхпроводником. Главные проблемы, препятствующие его широкомасштабному практическому применению, лежат в области обработки материала. Сейчас наиболее перспективным считается изготовление тонких пленок.
Многие из халькогенидов меди – нестехиометрические соединения. Сульфид меди(I) Cu2S образуется при сильном нагревании меди в парах серы или в среде сероводорода. При пропускании сероводорода через водные растворы, содержащие катионы Cu2+, выделяется коллоидный осадок состава CuS. Однако, CuS – не простое соединение меди(II). Оно содержит группу S2 и лучше описывается формулой CuI2CuII(S2)S. Селениды и теллуриды меди проявляют металлические свойства, а CuSe2, CuTe2, CuS и CuS2 при низких температурах являются сверхпроводниками.
При пропускании сероводорода через водные растворы, содержащие катионы Cu2+, выделяется коллоидный осадок состава CuS. Однако, CuS – не простое соединение меди(II). Оно содержит группу S2 и лучше описывается формулой CuI2CuII(S2)S. Селениды и теллуриды меди проявляют металлические свойства, а CuSe2, CuTe2, CuS и CuS2 при низких температурах являются сверхпроводниками.
Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
2FeCl3 + Cu = CuCl2 + 2FeCl2
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu2+ легко образуют комплексы с аммиаком, например, состава [Cu(NH3)]2+. При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
Глава 2. Химические свойства меди и ее соединений
§1.
Химические свойства простого вещества
(ст. ок. = 0).
а)
Отношение к кислороду.
В
отличие от своих соседей по подгруппе
– серебра и золота, — медь непосредственно
реагирует с кислородом. Медь проявляет
к кислороду незначительную активность,
но во влажном воздухе постепенно
окисляется и покрывается пленкой
зеленоватого цвета, состоящей из основных
карбонатов меди:
В
сухом воздухе окисление идет очень
медленно, на поверхности меди образуется
тончайший слой оксида меди:
Внешне
медь при этом не меняется, так как оксид
меди (I)
как и сама медь, розового цвета. К тому
же слой оксида настолько тонок, что
пропускает свет, т.е. просвечивает.
По-иному медь окисляется при нагревании,
например, при 600-800 0C.
В первые секунды окисление идет до
оксида меди (I),
которая с поверхности переходит в оксид
меди (II)
черного цвета. Образуется двухслойное
окисное покрытие.
Qобразования
(Cu2O)
= 84935 кДж.
Рисунок
2. Строение оксидной пленки меди.
б)
Взаимодействие с водой.
Металлы
подгруппы меди стоят в конце
электрохимического ряда напряжений,
после иона водорода. Следовательно, эти
металлы не могут вытеснять водород из
воды. В то же время водород и другие
металлы могут вытеснять металлы подгруппы
меди из растворов их солей, например:
.
Эта
реакция окислительно-восстановительная,
так как происходит переход электронов:
Молекулярный
водород вытесняет металлы подгруппы
меди с большим трудом. Объясняется это
тем, что связь между атомами водорода
прочная и на ее разрыв затрачивается
много энергии. Реакция же идет только
с атомами водорода.
Медь
при отсутствии кислорода с водой
практически не взаимодействует. В
присутствии кислорода медь медленно
взаимодействует с водой и покрывается
зеленой пленкой гидроксида меди и
основного карбоната:
в)
Взаимодействие с кислотами.
Находясь
в ряду напряжений после водорода, медь
не вытесняет его из кислот. Поэтому
соляная и разбавленная серная кислота
на медь не действуют.
Однако
в присутствии кислорода медь растворяется
в этих кислотах с образованием
соответствующих солей:
Исключение
составляет только иодоводородная
кислота, которая вступает в реакцию с
медью с выделением водорода и образованием
очень устойчивого комплекса меди (I):
2Cu
+ 3HI
→ 2H[CuI2]
+H2↑
Медь
так же реагирует с кислотами –
окислителями, например, с азотной:
Cu
+ 4HNO3(конц. )
)
→
Cu(NO3)2+2NO2↑+2H2O
3Cu
+ 8HNO3(разбав.)
→
3Cu(NO3)2+2NO↑+4H2O
А
так же с концентрированной холодной
серной кислотой:
Cu
+ H2SO4(конц.)
→ CuO + SO2↑
+ H2O
C
горячей концентрированной серной
кислотой:
Cu
+ 2H2SO4(конц.,
горячая)
→ CuSO4
+ SO2↑
+ 2H2O
C
безводной серной кислотой при температуре
2000С
образуется сульфат меди (I):
2Cu
+ 2H2SO4(безводн. )
)
200
°C→
Cu2SO4↓
+ SO2↑
+ 2H2O
г)
Отношение к галогенам и некоторым другим
неметаллам.
Qобразования
(CuCl)
= 134300 кДж
Qобразования
(CuCl2)
= 111700 кДж
Медь
хорошо реагирует с галогенами, дает два
вида галогенидов: CuX
и CuX2..
При действии галогенов при комнатной
температуре видимых изменений не
происходит, но на поверхности вначале
образуется слой адсорбированных молекул,
а затем и тончайший слой галогенидов.
При нагревании реакция с медью происходит
очень бурно. Нагреем медную проволочку
или фольги и опустим ее в горячем виде
в банку с хлором – около меди появятся
бурые пары, состоящие из хлорида меди
(II)
CuCl2
с
примесью хлорида меди (I)
CuCl.
Реакция происходит самопроизвольно за
счет выделяющейся теплоты. Одновалентные
Одновалентные
галогениды меди получают при взаимодействии
металлической меди с раствором галогенида
двухвалентной меди, например:
При
этом монохлорид выпадает из раствора
в виде белого осадка на поверхности
меди.
Медь
так же достаточно легко ступает в реакции
с серой и селеном при нагревании
(300—400 °C):
2Cu
+S→Cu2S
2Cu
+Se→Cu2Se
А
вот с водородом, углеродом и азотом медь
не реагирует даже при высоких температурах.
д)
Взаимодействие с оксидами неметаллов
Медь
при нагревании может вытеснять из
некоторых оксидов неметаллов (например,
оксид серы (IV)
и оксиды азота (II,
IV))
простые вещества, образуя при этом
термодинамически более устойчивый
оксид меди (II):
4Cu+SO2
600-800°C →2CuO
+ Cu2S
4Cu+2NO2
500-600°C →4CuO
+ N2↑
2Cu+2NO
500-600°C →2CuO
+ N2↑
§2.
Химические свойства одновалентной меди
(ст.ок. = +1)
В
водных растворах ион Cu+
очень
неустойчив и диспропорционирует:
Cu+↔Cu0+Cu2+
Однако
медь в степени окисления (+1) может
стабилизироваться в соединениях с очень
низкой растворимостью или за счет
комплексообразовния [9].
а)
Оксид меди (I)
Cu2O
Амфотерный
оксид. Кристаллическое вещество
коричнево-красного цвета. В природе
встречается в виде минерала куприта.
Исскуственно может быть получен
нагреванием раствора соли меди (II)
с щелочью и каким-нибудь сильным
восстановителем, например, формалином
или глюкозой [11]. Оксид меди(I)
не реагирует с водой. Оксид меди(I)
переводится в раствор концентрированной
соляной кислотой с образованием
хлоридного комплекса:
Cu2O+4HCl→2H[CuCl2]+
H2O
Так
же растворим в концентрированном
растворе аммиака и солей аммония:
Cu2O+2NH4+→2[Cu(H2O)(NH3)]+
В
разбавленной серной кислоте
диспропорционирует на двухвалентную
медь и металлическую медь:
Cu2O+H2SO4(разбав. )
)
→CuSO4+Cu0↓+H2O
Также
оксид меди(I) вступает в водных растворах
в следующие реакции:
1.
Медленно окисляется кислородом
до гидроксида
меди(II):
2Cu2O+4H2O+O2→4Cu(OH)2↓
2.
Реагирует с разбавленными галогенводородными
кислотами с
образованием соответствующих галогенидов
меди(I):
Cu2O+2HГ→2CuГ↓
+H2O
(Г=Cl,
Br,
J)
3.Восстанавливается
до металлической меди типичными
восстановителями, например, гидросульфитом
натрия в
концентрированном растворе:
2Cu2O+2NaSO3→4Cu↓+Na2SO4+H2SO4
Оксид
меди(I) восстанавливается до металлической
меди в следующих реакциях:
1.
При нагревании до 1800 °C (разложение):
2Cu2O
—1800
°C
→2Cu
+O2
2.
При нагревании в токе водорода, монооксида
углерода,
с алюминиеми прочими типичными восстановителями:
Cu2O
+ H2
—>250°C→2Cu
+H2O
Cu2O
+ CO
—250-300°C→2Cu
+CO2
3Cu2O
+ 2Al
—1000°C→6Cu
+Al2O3
Также,
при высоких температурах оксид меди(I)
реагирует:
1.
C аммиаком (образуется нитрид
меди(I))
3Cu2O
+ 2NH3
—250°C→2Cu3N
+ 3H2O
2.
С оксидами щелочных металлов:
Cu2O+M2O-600-800°C
→2МCuO
(M= Li, Na, K)
При
этом образуются купраты меди (I).
Оксид
меди (I)
заметно реагирует с щелочами [9]:
Cu2O+2NaOH(конц.)
+H2O↔2Na[Cu(OH)2]
б)
Гидроксид меди (I)
CuOH
Гидроксид
меди(I) образует жёлтое вещество, не
растворяется в воде.
Легко
разлагается при нагревании или кипячении:
2CuOH
→ Cu2O
+ H2O
в)
Галогениды CuF,
CuСl,
CuBr
и CuJ
Все
эти соединения – белые кристаллические
вещества, плохо растворимые в воде, но
хорошо растворимые в избытке NH3,
цианидных ионов, тиосульфатных ионов
и иных сильных комплексообразователей.
Иод образует только соединениеCu+1J.
В газообразном состоянии образуются
циклы типа (CuГ)3
[10]. Обратимо растворимы в соответствующих
галогенводородных кислотах:
CuГ
+ HГ ↔ H[CuГ2]
(Г=Cl,
Br,
J)
Хлорид
и бромид меди (I)
неустойчивы во влажном воздухе и
постепенно превращаются в основные
соли меди (II):
4CuГ
+2H2O
+O2
→4Cu(OH)Г
(Г=Cl, Br)
г)
Прочие соединения меди (I)
1.
Ацетат меди (I) (СН3СООСu)
— соединение меди, имеет вид бесцветных
кристаллов. В воде медленно гидролизуется
до Сu2О,
на воздухе окисляется до ацетата
двухвалентной меди; Получают СН3СООСu
восстановлением (СН3СОО)2Сu
водородом или медью, сублимацией
(СН3СОО)2Сu
в вакууме или взаимодействием (NH3OH)SO4
с (СН3СОО)2Сu
в р-ре в присутствии Н3СООNH3.
Вещество токсично.
2.
Ацетиленид меди(I) — красно-коричневые,
иногда черные кристаллы. В сухом виде
кристаллы детонируют при ударе или
нагреве. Устойчивы во влажном состоянии.
При детонации в отсутствие кислорода
не образуется газообразных веществ.
Под действием кислот разлагается.
Образуется в виде осадка при
пропускании ацетилена в
аммиачные растворы солей
меди(I):
С2H2
+2[Cu(NH3)2](OH)
→Cu2C2↓
+2H2O+2NH3
Данная
реакция используется для качественного
обнаружения ацетилена.
3.
Нитрид меди — неорганическое соединение
с формулой Cu3N,
тёмно-зелёные кристаллы.
Разлагается
при нагревании:
2Cu3N
—300°C→6Cu
+N2↑
Бурно
реагирует с кислотами:
2Cu3N
+6HCl
—300°C→3Cu↓
+3CuCl2
+2NH3↑
§3.
Химические свойства двухвалентной меди
(ст.ок. = +2)
Наиболее
устойчивая степень окисления у меди и
самая характерная для нее.
а)
Оксид меди (II)
CuO
CuO
— основный оксид двухвалентной меди.
Кристаллы чёрного цвета, в обычных
условиях довольно устойчивые, практически
нерастворимые в воде. В природе встречается
в виде минерала тенорита (мелаконита)
чёрного цвета. Оксид меди(II) реагирует
с кислотами с
образованием соответствующих солей
меди(II) и воды:
CuO
+ 2HNO3→Cu(NO3)2
+H2O
При
сплавлении CuO со щелочами образуются
купраты меди (II):
CuO+2KOH—t°→K2CuO2
+H2O
При
нагревании до 1100 °C разлагается [9]:
4CuO-t°→2Cu2O
+ O2
б)
Гидроксид меди (II) Cu(OH)2
Гидроксид
меди(II) — голубое аморфное или кристаллическое
вещество, практически не растворимое
в воде. При нагревании до 70-90 °C порошка
При нагревании до 70-90 °C порошка
Cu(ОН)2
или его водных суспензий разлагается
до CuО и Н2О:
Cu(OH)2
→ CuO
+ H2O
Является
амфотерным гидроксидом. Реагирует с
кислотами с образованием воды и
соответствующей соли меди:
С
разбавленными растворами щелочей не
реагирует, в концентрированных
растворяется, образуя ярко-синие
тетрагидроксокупраты (II):
Гидроксид
меди(II) со слабыми кислотами образует
основные соли [11]. Очень легко растворяется
в избытке аммиака с образованием
аммиаката меди:
Cu(OH)2+4NH4OH→[Cu(NH3)4](OH)2+4H2O
Аммиакат
меди имеет интенсивный сине-фиолетовый
цвет, поэтому его используют в аналитической
химии для определения малых количеств
ионов Cu2+ в
растворе.
в)
Соли меди (II)
Простые
соли меди (II)
известны для большинства анионов, кроме
цианида и иодида, которые при взаимодействии
с катионом Cu2+
образуют ковалентные соединения меди
(I),
нерастворимые в воде.
Соли
меди (+2), в основном, растворимы в воде.
Голубой цвет их растворов связан с
образованием иона [Cu(H2O)4]2+.
Они часто кристаллизуются в виде
гидратов. Так, из водного раствора
хлорида меди (II)
ниже 150С
кристаллизуется тетрагидрат, при 15-260С
– тригидрат, свыше 260С
– дигидрат. В водных растворах соли
меди (II)
в небольшой степени подвержены гидролизу,
и из них часто осаждаются основные соли
[9].
1.
Пентагидрат сульфата меди (II)
(медный купорос)
Наибольшее
практическое значение имеет CuSO4*5H2O,
называемый медным купоросом. Сухая соль
имеет голубую окраску, однако при
несильном нагревании (2000С)
она теряет кристаллизационную воду.
Безводная соль белого цвета. При
дальнейшем нагревании до 7000С
она превращается в оксид меди, теряя
триоксид серы:
CuSO4—t°→CuO+SO3↑
Готовят
медный купорос растворением меди в
концентрированной серной кислоте. Эта
реакция описана в разделе «Химические
свойства простого вещества». Медный
купорос применяют при электролитическом
получении меди, в сельском хозяйстве
для борьбы с вредителями и болезнями
растений, для получения других соединений
меди [9].
2.
Дигидрат хлорида меди (II).
Это
темно-зеленые кристаллы, легкорастворимые
в воде. Концентрированные растворы
хлорида меди имеют зеленый цвет, а
разбавленные – голубой. Это объясняется
образованием хлоридного комплекса
зеленого цвета:
Cu2++4Cl—
→[CuCl4]2-
И
его дальнейшим разрушением и образованием
голубого аквакомплекса.
3.
Тригидрат нитрата меди (II).
Кристаллическое
вещество синего цвета. Получается при
растворении меди в азотной кислоте. При
нагревании кристаллы сначала теряют
воду, затем разлагаются с выделением
кислорода и диоксида азота, переходя в
оксид меди (II):
2Cu(NO3)2—t°→2CuO+4NO2↑+O2↑
4.
Карбонат гидроксомеди (II).
Карбонаты
меди малоустойчивы и в практике почти
не применяются. Некоторое значение для
получения меди имеет лишь основной
карбонат меди Cu2(OH)2CO3,
который встречается в природе в виде
минерала малахита. При нагревании легко
разлагается с выделением воды, оксида
углерода (IV)
и оксида меди (II):
Cu2(OH)2CO3—t°→2CuO+H2O↑+CO2↑
§4.
Химические свойства трехвалентной меди
(ст.ок. = +3)
Эта
степень окисления является наименее
стабильной для меди, и поэтому соединения
меди (III)
являются скорее исключениями, чем
«правилами». Тем не менее, некоторые
соединения трехвалентной меди существуют.
а)
Оксид меди (III) Cu2O3
Это
кристаллическое вещество, темно-гранатового
цвета. Не растворяется в воде.
Получается
окислением гидроксида
меди(II) пероксодисульфатом
калия в
щелочной среде при отрицательных
температурах:
2Cu(OH)2
+K2S2O8+2KOH
—-20°C→Cu2O3↓+2K2SO4+3H2O
Это
вещество разлагается при температуре
4000С:
Cu2O3—t°→2CuO+O2↑
Окисид
меди (III)
– сильный окислитель. При взаимодействии
При взаимодействии
с хлороводородом хлор восстанавливается
до свободного хлора [10]:
Cu2O3+6HCl—t°→2CuCl2+Cl2↑+3H2O
б)
Купраты меди (Ш)
Это
черные или синие вещества, в воде не
устойчивы, диамагнитны, анион – ленты
квадратов (dsp2).
Образуются при взаимодействии гидроксида
меди(II)
и гипохлорита щелочного металла в
щелочной среде [10]:
2Cu(OH)2
+ МClO
+ 2NaOH→2МCuO3
+NaCl
+3H2O
(M=Na—Cs)
в)
Калия гексафторкупрат(III)
Зеленое
вещество, парамагнитно.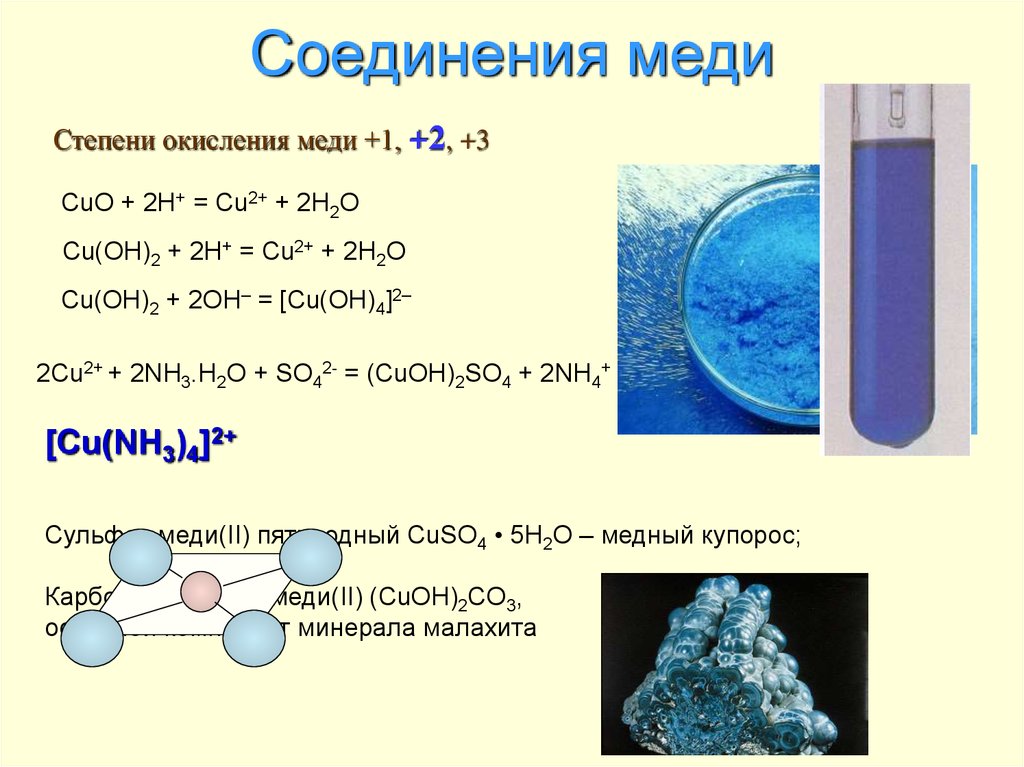 Октаэдрическое
Октаэдрическое
строение sp3d2.
Комплекс фторида меди CuF3,
который в свободном состоянии разлагается
при -600С.
Образуется нагреванием смеси хлоридов
калия и меди в атмосфере фтора:
3KCl
+ CuCl + 3F2 →
K3[CuF6] +
2Cl2
Разлагает
воду с образованием свободного фтора.
§5.
Соединения меди в степени окисления
(+4)
Пока
науке известно лишь одно вещество, где
медь в степени окисления +4, это
гексафторкупрат(IV) цезия – Cs2Cu+4F6
—
оранжевое кристаллическое вещество,
стабильное в стеклянных ампулах при
00С.
Бурно реагирует с водой. Получается
фторированием при высоком давлении и
температуре смеси хлоридов цезия и меди
[10]:
CuCl2
+2CsCl +3F2
—t°
р→
Cs2CuF6
+2Cl2
Таблица Самородная медь Медный купорос Изделия из меди
| История открытия:Латинское название меди Cuprum произошло от названия острова Кипр, где уже в III в. до н. э. существовали медные рудники и производилась выплавка меди. Слова медь и медный встречаются в древнейших русских литературных памятниках. Русское слово «медь» производят от греческого слова, означающего рудник, копь. Нахождение в природе, получение:Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Физические свойства:Чистая медь — тягучий вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Плотность 8,92 г/см3, температура плавления 1083,4°C, температура кипения 2567°C. Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20°C удельное сопротивление 1,68·10-3 Ом·м). Химические свойства: В химическом отношении медь является малоактивным металлом. Однако с галогенами она реагирует уже при комнатной температуре, например, с влажным хлором образует хлорид CuCl2. При нагревании медь взаимодействует и с серой, образуя сульфид Cu2S. Для меди характерны соединения со степенью окисления: +1 (менее стабильная) и +2 (более стабильная). В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Важнейшие соединения: Оксид меди(I) — Cu2O, имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию: Применение: — В электротехнике Медь является необходимым элементом для всех высших растений и животных, входя в состав многих ферментов. В крови головоногих и некоторых брюхоногих моллюсков медь выполняет ту же роль, что и железо в крови человека. В организме взрослого человека содержится до 80 мг меди и для восполнения потерь необходимо поступление меди в количестве 0,9 мг в день. При недостатке меди в организме снижается активность ферментных систем и замедляется белковый обмен и нарушается рост костных тканей. Жерновникова А., Третьякова М. Источники: Википедия: http://ru.wikipedia.org/wiki/Cu,
| ||||||||||
3.
 02: Физические и химические свойства
02: Физические и химические свойства
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 178121
Цели обучения
Отделить физические свойства от химических.
Вся материя имеет физические и химические свойства. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физическое свойство
Физическое свойство — это характеристика вещества, которую можно наблюдать или измерять без изменения идентичности вещества. Серебро — это блестящий металл, который очень хорошо проводит электричество. Из него можно формовать тонкие листы, это свойство называется ковкостью. Соль тусклая и ломкая и проводит электричество, когда она растворена в воде, что она делает довольно легко. Физические свойства вещества включают цвет, твердость, ковкость, растворимость, электропроводность, плотность, температуры плавления и температуры кипения.
Для элементов цвет не сильно отличается от одного элемента к другому. Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный. Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
| Вещество | Плотность при 25°C (г/см3) |
|---|---|
| кровь | 1,035 |
| жировые отложения | 0,918 |
| цельное молоко | 1,030 |
| масло кукурузное | 0,922 |
| майонез | 0,910 |
| мед | 1,420 |
- Твердость помогает определить, как можно использовать элемент (особенно металл).
 Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Рисунок \(\PageIndex{1}\): карандаш (слева) и кольцо с бриллиантом (справа). Оба являются формой углерода, но обладают очень разными физическими свойствами.
Точки плавления и кипения являются уникальными идентификаторами, особенно для соединений. Помимо получения некоторого представления об идентичности соединения, можно получить важную информацию о чистоте материала.
Химические свойства
Химические свойства вещества описывает его «потенциал» подвергаться некоторым химическим изменениям или реакциям в силу своего состава. Какие элементы, электроны и связи присутствуют, чтобы дать потенциал для химических изменений. Довольно сложно определить химическое свойство, не используя слово «изменение». В конце концов вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. В настоящее время это очень трудно сделать, и от вас не ожидается, что вы сможете это сделать. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
В конце концов вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. В настоящее время это очень трудно сделать, и от вас не ожидается, что вы сможете это сделать. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Рисунок \(\PageIndex{2}\): Сильная ржавчина на звеньях цепи возле моста Золотые Ворота в Сан-Франциско; он постоянно подвергался воздействию влаги и солевых брызг, что приводило к разрушению поверхности, растрескиванию и отслаиванию металла. Изображение использовано с разрешения (CC BY-SA 3.0; Marlith).
Химическое свойство железа заключается в том, что оно способно соединяться с кислородом с образованием оксида железа, химическое название ржавчины (Рисунок \(\PageIndex{2}\)). Более общим термином для ржавчины и других подобных процессов является коррозия. Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
| Физическая собственность | Химические свойства |
|---|---|
| Металлический галлий плавится при 30 o C | Железный металл ржавеет. |
| Ртуть — очень плотная жидкость. | Зеленый банан при созревании становится желтым. |
| Золото блестит. | Горит сухой лист бумаги. |
Пример \(\PageIndex{1}\)
Какое из следующих химических свойств железа?
- Железо разъедает во влажном воздухе
- Плотность = 7,874 г/см 3
- Железо в чистом виде мягкое.
- Железо плавится при 1808 К.
РАСТВОР
Железо разъедается на воздухе — единственное химическое свойство железа из списка.
Упражнение \(\PageIndex{1A}\)
Какое из перечисленных ниже физических свойств материи?
- коррозионная активность
- рН (кислотность)
- плотность
- воспламеняемость
- Ответ:
- с
Упражнение \(\PageIndex{1B}\)
Какое из следующих свойств является химическим?
- воспламеняемость
- температура плавления
- точка кипения
- плотность
- Ответ:
- и
Резюме
Физическое свойство – это характеристика вещества, которую можно наблюдать или измерять без изменения свойств вещества. Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
Авторы
Мариса Альвиар-Агню (Городской колледж Сакраменто)
Генри Эгнью (Калифорнийский университет в Дэвисе)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Показать страницу TOC
- № на стр.
- Теги
- химическая замена
- Химические свойства
- компаунд
- элемент
- гетерогенная смесь
- гомогенная смесь
- материя
- металл
- смеси
- неметалл
- фаза
- Физическое изменение
- Физические свойства
- полуметаллы
- источник-хим-156311
- источник-хим-171900
- источник-хим-177346
- источник-хим-177886
- источник-хим-64003
- состояние
- вещество
Расчет на медь | Природа Химия
Расчет на медь
Скачать PDF
Скачать PDF
- Опубликовано:
- Тибериу Г. Мога 1
Природа Химия
том 4 , страница 334 (2012)Процитировать эту статью
5523 Доступы
8 Цитаты
28 Альтметрический
Сведения о показателях
Предметы
- Неорганическая химия
Медь, обычно встречающаяся в повседневной жизни, на первый взгляд может показаться немного неинтересной. Tiberiu G. Moga рассказывает, как наука, тем не менее, не пренебрегла своим обещанием.
Tiberiu G. Moga рассказывает, как наука, тем не менее, не пренебрегла своим обещанием.
Предыстория © GETTY IMAGES
В конце финского эпоса «Калевала » герой Вяйнямёйнен отправляется в небеса, покидая царство смертных на медной лодке. Современные инженеры, кажется, приняли это близко к сердцу: корпуса кораблей облицованы материалами на основе меди, которые подавляют рост бактерий, ракушек и других нежелательных пассажиров. Сосуд Вяйнямёйнена — лишь один из примеров того, как красновато-коричневый блеск меди на протяжении всей истории стимулировал человеческое воображение.
Древним римлянам медь была известна как cuprum в связи с островом Кипр, где добывалась большая часть меди. В настоящее время слово «медь» обычно вызывает в воображении видения копеек, электропроводки или, возможно, Статуи Свободы, которая обязана своим зеленым цветом карбонату меди (II). Но, несмотря на свое, казалось бы, ничем не примечательное присутствие в повседневной жизни, медь постоянно играет активную роль в науке благодаря своим жизненно важным биологическим функциям и разнообразным химическим свойствам. Универсальность меди во многом обусловлена ее способностью осуществлять три различных химических процесса: катализ кислотой Льюиса, процессы с переносом одного электрона и реакции с переносом двух электронов.
Универсальность меди во многом обусловлена ее способностью осуществлять три различных химических процесса: катализ кислотой Льюиса, процессы с переносом одного электрона и реакции с переносом двух электронов.
При кислотном катализе Льюиса ионы Cu + или Cu 2+ объединяют разные молекулы и облегчают химическую реакцию между ними. Известным примером является катализируемое медью циклоприсоединение азид-алкин, известное как клик-химия. В этой реакции один из исходных материалов помечен азидным фрагментом, тогда как другой несет алкиновую группу; два сначала координируются с медью, затем ковалентно связываются друг с другом с образованием триазольного кольца 1 . Ни один переходный металл не является столь же эффективным катализатором, как медь, для этой стадии. Благодаря своей надежности и высокой селективности эта клик-реакция широко используется от полного синтеза природных продуктов и их производных до получения и модификации полимеров.
Другим примером катализа кислотой Льюиса, опосредованного ионами меди, является синтез циклических пептидов — класса соединений с многочисленными биологическими приложениями. Например, циклоспорин А и грамицидин S являются антибиотиками; октреотид и кальцитонин действуют на эндокринную систему; а эптифибатид помогает предотвратить образование тромбов и инсульты. Благодаря своему положительному заряду Cu 2+ (наряду с другими ионами) способен связываться с электронными парами атомов кислорода, азота и серы линейных предшественников пептидов, тем самым изгибая их в изогнутые формы, которые легче образуют замкнутые кольцевые структуры 2 .
Например, циклоспорин А и грамицидин S являются антибиотиками; октреотид и кальцитонин действуют на эндокринную систему; а эптифибатид помогает предотвратить образование тромбов и инсульты. Благодаря своему положительному заряду Cu 2+ (наряду с другими ионами) способен связываться с электронными парами атомов кислорода, азота и серы линейных предшественников пептидов, тем самым изгибая их в изогнутые формы, которые легче образуют замкнутые кольцевые структуры 2 .
Механически более сложные, чем катализ кислотой Льюиса, процессы переноса одного электрона, осуществляемые медью — чередующиеся между ее формами Cu + и Cu 2+ — незаменимы в биологии. В клеточном дыхании, при котором организм извлекает энергию из глюкозы, участвуют медьсодержащие ферменты митохондриальной мембраны. Эти ферменты окисляют глюкозу и восстанавливают кислород посредством ступенчатого одноэлектронного переноса, также образуя в процессе воду.
Другие ферменты, которые осуществляют медь-опосредованный перенос одного электрона, включают несколько менее известные, но также важные супероксиддисмутазу и тирозиназу 3 . Супероксиддисмутаза на основе меди и цинка защищает клетки от активных форм кислорода, превращая их в менее токсичную молекулу перекиси водорода, которая впоследствии сама превращается в кислород и воду. Медьсодержащая тирозиназа превращает тирозин в L-дофа, предшественник гормона адреналина, который опосредует реакцию «бей или беги» при остром стрессе. L-допа также используется для лечения болезни Паркинсона; он метаболизируется до дофамина, который обеспечивает связь между нервными клетками головного мозга.
Супероксиддисмутаза на основе меди и цинка защищает клетки от активных форм кислорода, превращая их в менее токсичную молекулу перекиси водорода, которая впоследствии сама превращается в кислород и воду. Медьсодержащая тирозиназа превращает тирозин в L-дофа, предшественник гормона адреналина, который опосредует реакцию «бей или беги» при остром стрессе. L-допа также используется для лечения болезни Паркинсона; он метаболизируется до дофамина, который обеспечивает связь между нервными клетками головного мозга.
Последним типом распространенного медного катализа являются реакции переноса двух электронов, также называемые реакциями сочетания, которые происходят в три этапа: окислительное присоединение, трансметаллирование и восстановительное отщепление. Сначала Cu(0) разрывает связь углерод-галоген с образованием связи углерод-медь и медь-галоген, при этом окисляясь до Cu 2+ . Затем ион галогенида вытесняется из центра металлической меди нуклеофилом или другой входящей группой. Наконец, связи углерод-медь и медь-нуклеофил расщепляются с образованием связи углерод-нуклеофил, и катализатор Cu(0) регенерируется 4 .
Наконец, связи углерод-медь и медь-нуклеофил расщепляются с образованием связи углерод-нуклеофил, и катализатор Cu(0) регенерируется 4 .
Реакции сочетания были впервые популяризированы с использованием палладиевых катализаторов и принесли Хеку, Негиши и Сузуки Нобелевскую премию по химии 2010 года. Эти реакции в настоящее время находят широкое применение в синтезе лекарств и, скорее всего, будут продолжать привлекать внимание. В качестве катализатора медь дает хорошие выходы в мягких условиях реакции и относительно устойчива к ядам, которые могут разрушить другие катализаторы, что делает ее желательной альтернативой палладию.
От синтеза фармпрепаратов до проектирования новых структур в нанотехнологиях 5 , медь постоянно заново открывается в качестве катализатора и универсального строительного блока. Эта тенденция не собирается ослабевать, что, возможно, свидетельствует о том, что использование меди может быть ограничено только чьей-то фантазией.
Это эссе было выбрано победителем нашего конкурса писателей, см. .
http://go.nature.com/oi187X
Ссылки
Adzima, B.J. et al. Природа Хим. 3 , 256–259 (2011).
КАС
СтатьяGoogle ученый
White, C.J. & Yudin, A.K. Nature Chem. 3 , 509–524 (2011).
КАС
СтатьяGoogle ученый
Липпард, С.Дж. и Берг, Дж.М. Принципы бионеорганической химии (Университетские научные книги, 1994).
Google ученый
Кар, А. и др. Орг. лат. 9 , 3405–3408 (2009).
Артикул
Google ученый
Амелут, Р.
 и др. Природа Хим. 3 , 382–387 (2011).
и др. Природа Хим. 3 , 382–387 (2011).КАС
СтатьяGoogle ученый
Ссылки на скачивание
Информация об авторе
Авторы и организации
Тибериу Г. Мога является студентом медицинского факультета Университета Торонто, здание медицинских наук, 1 King’s College Circle, Торонто, Онтарио, Канада M5S 1A8,
Тибериу Г. Мога
Авторы
- Тибериу Г. Мога
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Автор, ответственный за переписку
Тибериу Г. Мога.
Права и разрешения
Перепечатка и разрешения
Об этой статье
Дополнительная литература
Фотосинтезированные нанопояса из фенилацетилида меди с преимущественным фотокаталитически активным экспонированием граней
- Синлун Се
- Ю Цю
- Джинджун Лу
Корейский журнал химической инженерии (2018)
Что такое медь — Свойства медного элемента — Символ Cu
Что такое медь
Медь — это химический элемент с атомным номером 29 , что означает, что в атомной структуре 29 протонов и 29 электронов. Химический символ для меди равен Cu .
Химический символ для меди равен Cu .
Медь — мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов, таких как стерлинговое серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морского оборудования и монет, и константан, используемый в тензодатчиках и термопарах. для измерения температуры.
Copper – Properties
| Element | Copper | ||
|---|---|---|---|
| Atomic Number | 29 | ||
| Symbol | Cu | ||
| Element Category | Transition Metal | ||
| Phase при STP | Твердое вещество | ||
Атомная масса [а. е.м.] е.м.] | 63,546 | ||
| Плотность при STP [г/см3] | 8,92 | ||
| Электронная конфигурация | [AR] 3D10 4S1 | ||
| Возможные состояния окисления | +1,2 | ||
| Электроновое абонем 1,9 | |||
| 1 -я энергия ионизации [EV] | 7,7264 | ||
| Год открытия | Неизвестный | ||
| Discoverer | UNTONKIT0047 | Thermal properties | |
| Melting Point [Celsius scale] | 1084.62 | ||
| Boiling Point [Celsius scale] | 2927 | ||
| Thermal Conductivity [W/m K] | 401 | ||
| Специальное жар [J/G K] | 0,38 | ||
| Тепла слияния [KJ/MOL] | 13,05 | ||
| Опен вариза6 См. также: Свойства меди Атомная масса меди Атомная масса меди 63,546 ед. Обратите внимание, что каждый элемент может содержать больше изотопов, поэтому результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их распространенности. Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 х 10 -24 граммов. Одна единая атомная единица массы равна примерно масса одного нуклона (либо одного протона, либо одного нейтрона) и численно эквивалентна 1 г/моль. Для 12 C атомная масса точно равна 12u, поскольку из нее определяется единица атомной массы. Изотопная масса обычно отличается для других изотопов и обычно находится в пределах 0,1 ед от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в его основном ядерном состоянии составляет 62, | ед. Существуют две причины различия между массовым числом и изотопной массой, известной как дефект массы:
См. также: Массовое число Плотность медиПлотность меди 8,92 г/см 3 . Типичные плотности различных веществ при атмосферном давлении. Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, деленная на объем: ρ = m/V Другими словами, плотность (ρ) вещества представляет собой общую массу (m) этого вещества. См. также: Что такое плотность? Электроотрицательность меди 1,9 . Сродство к электрону В химии и атомной физике сродство к электрону атома или молекулы определяется как: изменение энергии (в кДж/моль) нейтрального атома или молекулы (в газовой фазе) при присоединении к атому электрона с образованием отрицательного иона . X + e – → X – + энергия Сродство = – ∆H Другими словами, это можно выразить как вероятность нейтрального атома получить электрон . Например, атом меди в газовой фазе отдает энергию, когда он получает электрон, образуя ион меди. Cu + e – → Cu – – ∆H = сродство = 118,4 кДж/моль Чтобы правильно использовать сродство к электрону, важно следить за знаками. При присоединении электрона к нейтральному атому выделяется энергия. Это сродство известно как сродство к первому электрону, и эти энергии отрицательны. По соглашению отрицательный знак показывает высвобождение энергии. Однако для присоединения электрона к отрицательному иону требуется больше энергии, что подавляет любое высвобождение энергии в процессе присоединения электрона. Это сродство известно как сродство ко второму электрону, и эти энергии положительны. Сродство неметаллов и сродство металлов
Электроотрицательность Электроотрицательность , символ χ, является химическим свойством, которое описывает тенденцию атома притягивать электроны к этому атому. Для этой цели чаще всего используется безразмерная величина , шкала Полинга , символ χ. Электроотрицательность меди: χ = 1,9 В общем случае на электроотрицательность атома влияет как его атомный номер, так и расстояние, на котором находятся его валентные электроны от заряженного ядра. Наиболее электроотрицательному атому, фтору, присвоено значение 4,0, а значения варьируются до цезия и франция, которые являются наименее электроотрицательными при 0,7. Первая энергия ионизации медиПервая энергия ионизации меди составляет 7,7264 эВ . Энергия ионизации , также называемая потенциалом ионизации , представляет собой энергию, необходимую для удаления электрона из нейтрального атома. X + энергия → X + + e − где X — любой атом или молекула, способная к ионизации, X + — атом или молекула, у которых удален электрон (положительный ион), и e — — удаленный электрон. Атому меди, например, требуется следующая энергия ионизации для удаления самого внешнего электрона. Cu + IE → Cu + + e − IE = 7,7264 эВ Чаще всего используется энергия ионизации, связанная с удалением первого электрона. n Энергия ионизации относится к количеству энергии, необходимой для удаления электрона из частиц с зарядом ( n -1). 1st ionization energy X → X + + e − 2nd ionization energy X + → X 2+ + e − 3rd ionization energy X 2 + → X 3+ + e − Энергия ионизации для различных элементов На каждый последующий удаленный электрон приходится энергия ионизации. Электроны, вращающиеся вокруг ядра, движутся по довольно четко определенным орбитам. Некоторые из этих электронов более прочно связаны в атоме, чем другие. Например, для удаления самого внешнего электрона из атома свинца требуется всего 7,38 эВ, а для удаления самого внутреннего электрона требуется 88 000 эВ. Как правило, энергия ионизации увеличивается при движении вверх по группе и при перемещении слева направо по периоду. Более того:
Например, для ионизации натрия требуется всего 496 кДж/моль или 5,14 эВ/атом. С другой стороны, неон, благородный газ, непосредственно предшествующий ему в таблице Менделеева, требует 2081 кДж/моль или 21,56 эВ/атом.
Медь – температура плавления и температура кипенияТемпература плавления меди 1084,62°C . Температура кипения меди: 2927°C . Обратите внимание, что эти точки связаны со стандартным атмосферным давлением. Температура кипения – насыщение В термодинамике насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданных температуре и давлении. Температура, при которой испарение (кипение) начинается при заданном давлении, называется температурой насыщения или точкой кипения . Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода от пара к жидкости, ее называют точкой конденсации. Точка плавления – насыщение В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии. Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Медь – удельная теплоемкость, скрытая теплота плавления, скрытая теплота парообразованияУдельная теплоемкость меди 0,38 Дж/г K . Скрытая теплота плавления меди составляет 13,05 кДж/моль . Скрытая теплота парообразования меди составляет 300,3 кДж/моль . Удельная теплоемкость Удельная теплоемкость или удельная теплоемкость – это свойство, связанное с внутренней энергией , которое очень важно в термодинамике. интенсивных свойства C V и C P определены для чистых, простых сжимаемых веществ в качестве частичных производных Entallpy U (T, V) и Entallpy H (T, V) и . , где индексы v и p обозначают переменные, удерживаемые фиксированными во время дифференцирования. Свойства c v и c p обозначаются как удельная теплоемкость (или теплоемкость ), потому что при определенных особых условиях они связывают изменение температуры системы с количеством энергии, добавленной в результате теплопередачи. Их единицы СИ составляют Дж/кг K или Дж/моль K . Различные вещества подвергаются воздействию различных величин за счет добавления тепла . При подводе к разным веществам определенного количества теплоты их температуры увеличиваются на разную величину. Теплоемкость является экстенсивным свойством материи, то есть пропорциональна размеру системы.
Скрытая теплота парообразования Обычно, когда материал меняет фазу с твердой на жидкую или с жидкой на газообразную, на это фазовое изменение затрачивается определенное количество энергии. В случае фазового перехода из жидкости в газ это количество энергии известно как энтальпия испарения (символ ∆H пар ; единица измерения: Дж), также известная как (скрытая) теплота парообразования или теплота испарения. В качестве примера см. рисунок, на котором описаны фазовые переходы воды. Скрытая теплота – это количество теплоты, добавляемое к веществу или отводимое от него для изменения фазы. Скрытая теплота плавления В случае перехода твердой фазы в жидкую изменение энтальпии, необходимое для изменения ее состояния, известно как энтальпия плавления (символ ∆H фьюз ; единица: Дж), также известная как (скрытая) теплота плавления . Скрытая теплота — это количество теплоты, добавляемое к веществу или отводимое от него для осуществления фазового перехода. Эта энергия разрушает межмолекулярные силы притяжения, а также должна обеспечивать энергию, необходимую для расширения системы ( pΔV работает ). Жидкая фаза имеет более высокую внутреннюю энергию, чем твердая фаза. Это означает, что к твердому телу должна быть подведена энергия, чтобы расплавить его, а энергия высвобождается из жидкости при ее замерзании, потому что молекулы в жидкости испытывают более слабые межмолекулярные силы и, следовательно, имеют более высокую потенциальную энергию (своего рода энергия диссоциации связи для межмолекулярные силы). |

 также:
также:





 Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов.
Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов. вещества, деленное на общий объем (V), занимаемый этим веществом. Стандартная единица СИ составляет килограмма на кубический метр ( кг/м 3 ). Стандартная английская единица измерения составляет фунта массы на кубический фут 9.0044 ( фунт/фут 3 ).
вещества, деленное на общий объем (V), занимаемый этим веществом. Стандартная единица СИ составляет килограмма на кубический метр ( кг/м 3 ). Стандартная английская единица измерения составляет фунта массы на кубический фут 9.0044 ( фунт/фут 3 ). Обратите внимание, что энергия ионизации измеряет тенденцию нейтрального атома сопротивляться потере электронов. Сродство к электрону измерить труднее, чем энергию ионизации.
Обратите внимание, что энергия ионизации измеряет тенденцию нейтрального атома сопротивляться потере электронов. Сродство к электрону измерить труднее, чем энергию ионизации. Электронное сродство металлов ниже, чем у неметаллов. Меркурий слабее всего притягивает лишний электрон.
Электронное сродство металлов ниже, чем у неметаллов. Меркурий слабее всего притягивает лишний электрон. Чем выше связанное число электроотрицательности, тем больше элемент или соединение притягивает к себе электроны.
Чем выше связанное число электроотрицательности, тем больше элемент или соединение притягивает к себе электроны.
 Помогает понять реакционную способность элементов (особенно металлов, которые теряют электроны).
Помогает понять реакционную способность элементов (особенно металлов, которые теряют электроны).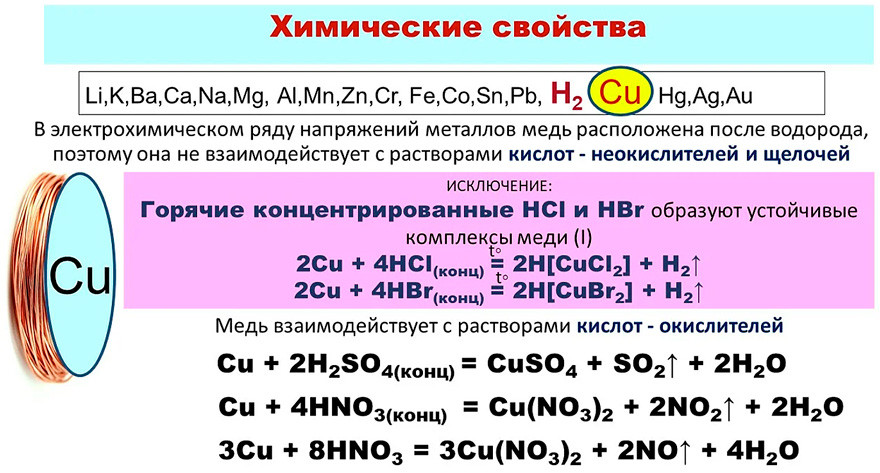
 Когда ее рассматривают как температуру обратного перехода из жидкого состояния в твердое, ее называют точкой замерзания или точкой кристаллизации.
Когда ее рассматривают как температуру обратного перехода из жидкого состояния в твердое, ее называют точкой замерзания или точкой кристаллизации. ) , соответственно:
) , соответственно: Теплоемкость C имеет единицу измерения энергии на градус или энергию на кельвин. При выражении того же явления в виде интенсивного свойства теплоемкость делится на количество вещества, массу или объем. Таким образом, количество не зависит от размера или степени выборки.
Теплоемкость C имеет единицу измерения энергии на градус или энергию на кельвин. При выражении того же явления в виде интенсивного свойства теплоемкость делится на количество вещества, массу или объем. Таким образом, количество не зависит от размера или степени выборки. Эта энергия разрушает межмолекулярные силы притяжения и должна обеспечить энергию, необходимую для расширения газа ( pΔV работа ). При добавлении скрытой теплоты изменения температуры не происходит. Энтальпия парообразования зависит от давления, при котором происходит это превращение.
Эта энергия разрушает межмолекулярные силы притяжения и должна обеспечить энергию, необходимую для расширения газа ( pΔV работа ). При добавлении скрытой теплоты изменения температуры не происходит. Энтальпия парообразования зависит от давления, при котором происходит это превращение.