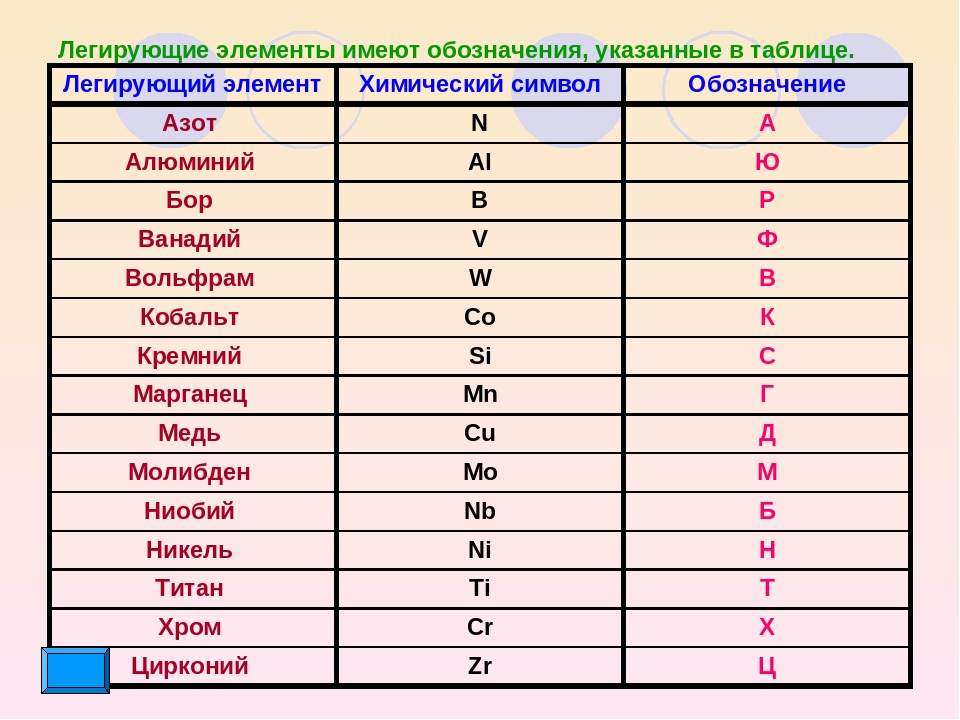
Медь как обозначается: Медь ТеплоЭнергоПласт
Содержание
Медь — Описание, происхождение, применение.
Медь (Cu от лат. Cuprum) — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
Медная монета (фото)
История
Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий
Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике.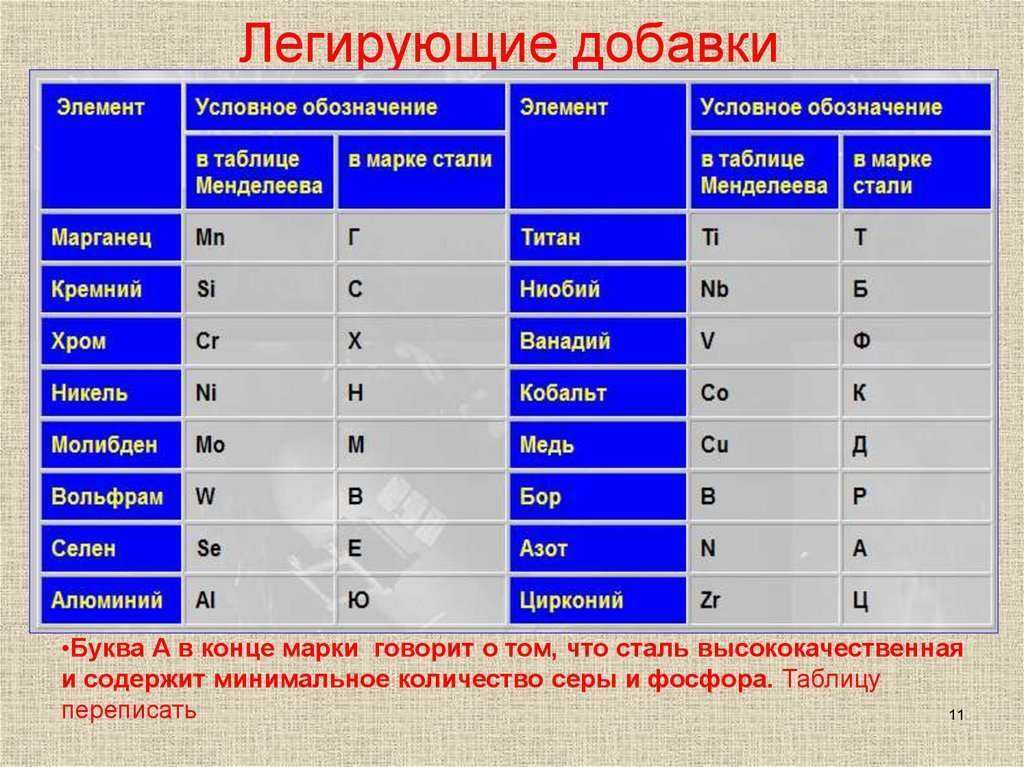
Происхождения названия меди
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр. ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник.
Слова медь и медный встречаются в древнейших русских литературных памятниках. Славянское *mědь «медь» не имеет чёткой этимологии, возможно, исконное слово. В. И. Абаев предполагал происхождение слова от названия страны Мидия: *Мѣдь из ир. Мādа- через посредство греч. Μηδία[8]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл».
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра, и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской. С Гумёшевским рудником Полевского, — крупнейшим в XVIII—XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломленным народным сознанием образом богини Венеры.
Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра, и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской. С Гумёшевским рудником Полевского, — крупнейшим в XVIII—XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломленным народным сознанием образом богини Венеры.
Медь в природе
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно.
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси).
Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси).
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства меди
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Атомная плотность меди (N0) = 8,52 * 10 28 (атом/м³).
Применение меди
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C: 0,01724-0,0180 мкОм·м/), медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %.
Теплообмен
Система охлаждения из меди на тепловых трубках в ноутбуке
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.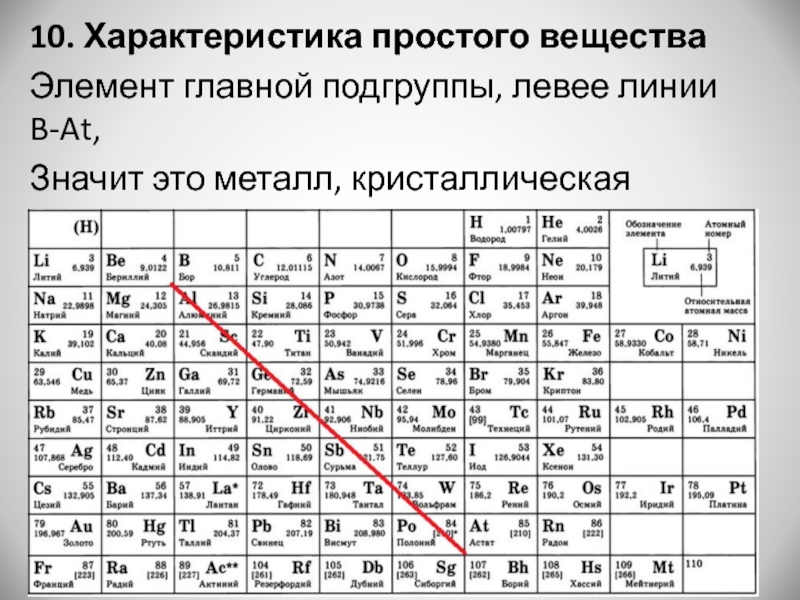
Для производства труб
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
Медные прутки (фото)
Медные трубы (фото)
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005, а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы на основе меди
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель, висмут и другие металлы. Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали).
Оба сплава являются общими названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель, висмут и другие металлы. Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали).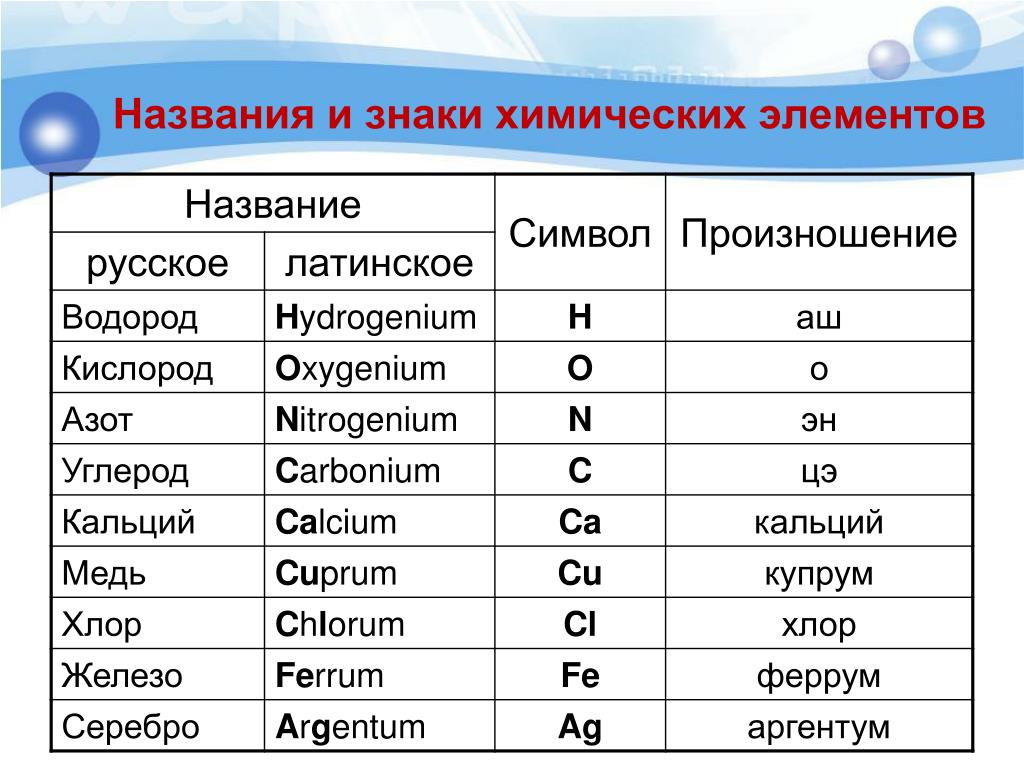 Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты. Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости.
Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты. Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости. Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 °C , обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 °C , обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Сплавы, в которых медь значима
Повреждённая пожаром дюралевая деталь дирижабля Гинденбург (LZ 129)
Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия-бария-меди (купрата) YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за того ,что медь является катализатором полимеризации ацетилена (образует соединения меди с ацетиленом), трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 510 и 578 нм.
Производство и добыча меди.
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн тонн. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:
Компания тыс. тонн %
Норильский никель 425 45 %
Уралэлектромедь 351 37 %
Русская медная компания 166 18 %
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское». Мировое производство меди в 2007 году составляло 15,4 млн т, а в 2008 году — 15,7 млн т .
Лидерами производства были:
Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.),
США (1,170/1,310),
Перу (1,190/1,220),
КНР (0,946/1,000),
Австралия (0,870/0,850),
Россия (0,740/0,750),
Индонезия (0,797/0,650),
Канада (0,589/0,590),
Замбия (0,520/0,560),
Казахстан (0,407/0,460),
Польша (0,452/0,430),
Мексика (0,347/0,270).
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается, что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Медный порошок (фото)
Современные способы добычи
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская Республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду (расположен в Чили). В зависимости от глубины залегания, руда добывается открытым или закрытым методом.
В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская Республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду (расположен в Чили). В зависимости от глубины залегания, руда добывается открытым или закрытым методом.
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её растворения в слабом растворе серной кислоты и последующего выделения металлической (черновой) меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки — 1450 °C.
С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит раствор раствор серной кислоты с медным купоросом. В ходе электролиза происходит повышение концентрации серной кислоты.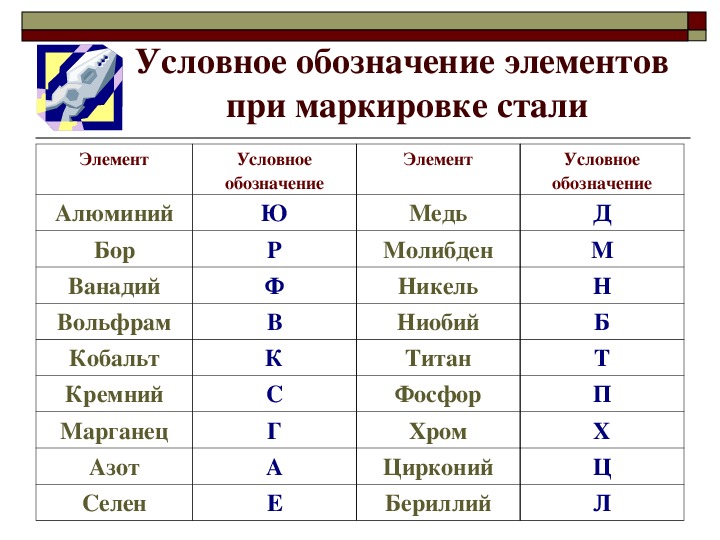 При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлама, который идёт на переработку с целью извлечения ценных металлов. При получении 1000 тонн электролитической меди можно получить до 3 кг серебра и 200 г золота. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлама, который идёт на переработку с целью извлечения ценных металлов. При получении 1000 тонн электролитической меди можно получить до 3 кг серебра и 200 г золота. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Гранулы меди (фото)
Медь на Кипре, в городе Лефке
Кипр ассоциировался с крупномасштабным производством меди в течение более чем пяти тысячелетий, и как предполагается, унаследовал своё имя от металла. (Название Cyprium -Copper появилось в римских произведениях раннего христианской эры, благодаря металлу, доставленному с Кипра).
Само слово cuprum непосредственно связано с Кипром, ведь уже в III веке до н. э. здесь уже существовали медные рудники. В периодической системе Менделеева, медь обозначается символом Cu (Cuprum – латинское).
Добыча и переработка меди проходила в районе города Лефке. Когда -то город Лефке был процветающим городом, центром индустрии меди, с современной медной разработкой месторождения, которая началась в 1921 году и в которой были задействованы более 5 700 человек. Компания занимающаяся производством, покинула Кипр в связи с событиями 1974 года, оставив приблизительно 10 миллионов тон отходов, которые до сих пор загрязняют окружающие земли, море и подземные водные резервы.
Сегодня, новая компания, North Cyprus Central Mining LT, турецкий энергетический гигант, вынашивает план в 200 миллионов долларов, цель которого возвратить Кипр к его истокам добычи меди. Гюриш Холдинг является имеет мульти миллионные инвестиции в индустрии меди, туризма и строительства.
Предполагают, что производство на Кипре, а именно в городе Лефке, сможет создать более 300 рабочих мест, из них более чем 90 % для местных жителей, — ведь по предварительным оценкам, это будет добыча и переработка более 500 000 тонн меди ежегодно.
Несмотря на то, что мэрия и общественное мнение населения города Лефке заявляют, что разработка станет «катастрофой для окружающей среды», Отчёты об Окружающем Воздействии, которые был предоставлены в Министерство Геологии и Промышленности говорят, что «все меры против нанесения вреда окружающей среды будут предприняты, загрязнение и другие экологические проблемы региона, оставленные после прошлого производства руды в 1974 году, учтены».
Два года исследовательских работ в регионе показали, что около 9.5 млн тон пирита (блестящие желтые, состоящий из минеральной дисульфида железа, кубические кристаллы) содержатся в бассейнах в тех местах, в которых когда то осуществлялась работа, возглавляемая американской компанией Cyprus Mines Corporation. Резервы были также обнаружены в районе Карадаг (1485 млн. тон) и в местечке Гази Лисе, к востоку от Лефке (2.97млн.тон).
Запрос в Министерство на разработку до сих пор не был одобрен, по всей видимости, в связи с оппозиционными выступлениями мэрии и населения Лефке, выступающими против открытия производства. По их словам, такие инвестиции убьют все надежды сделать регион Лефке инвестиционным привлекательным для туризма, образования и сельского хозяйства. Население города Лефке и окружающих регионов против таких инвестиций в их регионе. Останется ли регион нетронутым уголком природы, привлекающим туристов со многих стран мира, или станет промышленным центром по разработке меди — остаётся открытым вопросом, решение которого ожидается в ближайшее время.
По их словам, такие инвестиции убьют все надежды сделать регион Лефке инвестиционным привлекательным для туризма, образования и сельского хозяйства. Население города Лефке и окружающих регионов против таких инвестиций в их регионе. Останется ли регион нетронутым уголком природы, привлекающим туристов со многих стран мира, или станет промышленным центром по разработке меди — остаётся открытым вопросом, решение которого ожидается в ближайшее время.
Последовательность химических реакций
Превращение меди: последовательность химических реакций
- Цели
- Реакции
- Процедура
Цели
- Укажите разнообразие веществ, частью которых может быть элемент:
металл —> синий раствор —> синее твердое вещество —> черное твердое вещество —> синий раствор (снова) —> металл (снова).
- Сохранение массы и кротов:
- Мы должны добыть столько меди, сколько начали.
- Одинаковое количество меди на каждой стадии: одинаковое количество молей.
- Опыт работы со стандартными химическими методами: фильтрация и количественные переносы.
Реакции
Cu(тв) —> [Cu(H 2 O) 6 ] 2+ (водн.) —> Cu(OH) 2 (тв) —> CuO(тв) —> [Cu(H 2 O) 6 ] 2+ (водный) —> Cu(s)
- Металлическая медь «растворяется» в азотной кислоте (HNO 3 ). Фактически ион нитрата окисляет металлическую медь до иона меди (II), в то время как сам превращается в газ NO 2 в процессе; затем ион меди (II) связывается с шестью молекулами воды. Физическое изменение, которое вы должны наблюдать, заключается в исчезновении металла медного цвета по мере того, как раствор становится синим (от [Cu(H 2 O) 6 ] 2+ , иона гексааквамеди) и коричневого газа (NO 2 ) развивается.
Cu (т) + 4 H 3 O + (водн.) + 2 NO 3 — (водн.
 ) —> [Cu(H 2 O) 6 ] + 2 5 (водн.) + 2 NO 2 (г)
) —> [Cu(H 2 O) 6 ] + 2 5 (водн.) + 2 NO 2 (г) - Ион гидроксида (ОН — ) связывается с ионом меди (II) даже сильнее, чем вода. В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди, Cu(OH) 2 , синий осадок.
[Cu(H 2 O) 6 ] 2+ (водн.) + 2 OH — —> Cu(OH) 2 (т) + 6 H 2 O (ж)
- При нагревании гидроксида меди образуется оксид меди, CuO, a черный твердый.
Cu(OH) 2 (т) —> CuO (т) + H 2 O (ж)
- Оксид меди растворяется в кислоте, регенерируя ион меди (II), который снова связывается с вода.
CuO (т) + 2 H 3 O + (водн.) + 3 H 2 O (ж) —> [Cu(H 2 O) 6 ] 2+ (водн.)
- Наконец, металлический цинк восстанавливает гидратированный ион меди (II) обратно в металлическую медь, в то время как сам окисляется до ионов цинка (II).
 Мы видели эту реакцию раньше в лаборатории хлорида меди).
Мы видели эту реакцию раньше в лаборатории хлорида меди).[Cu(H 2 O) 6 ] 2+ (водн.) + Zn (тв.) —> Cu (тв.) + Zn 2+ (водн.) + 6 H 2 O ( тел.)
В то же время часть металлического цинка, находящегося в избытке, восстанавливает ионы гидроксония до H 2 .
Zn (т) + 2 H 3 O + (водн.) —> Zn 2+ (водн.) + H 2 (г) + 2 H 2 O (л)
- 4
- 4
- 4
Процедура
Я не буду подробно описывать процедуру шаг за шагом, но подчеркну некоторые аспекты безопасности и (выделено жирным шрифтом ) некоторые места, где наша процедура отличается от процедуры в лабораторном пакете.
- Преобразование Cu(s) в [Cu(H 2 O) 6 ] 2+ (водный)
- Возьмите кусок медной проволоки и взвесьте его с точностью до 0,01 г . Кусочки проволоки ближе к 0,50 г, чем к 0,35 г.
 Это нормально: используйте детали, которые мы предоставляем.
Это нормально: используйте детали, которые мы предоставляем. - Используйте около 4-5 мл концентрированного раствора HNO 3 .
- Будьте осторожны с азотной кислотой: как и другие сильные кислоты, она вызывает жжение при попадании на кожу и может повредить одежду; в отличие от большинства других кислот, он также окрашивает пораженный участок в желтый цвет.
- Если некоторое количество меди останется нерастворенным к моменту окончания производства газа, то поставьте химический стакан на горячие плиты в вытяжных шкафах, чтобы ускорить реакцию.
- Важно выполнять этот шаг в вытяжном шкафу, поскольку коричневый газ NO 2 является раздражителем. Держите смеси в вытяжном шкафу до тех пор, пока не добавите 10 мл дистиллированной воды после полного растворения меди.
- Возьмите кусок медной проволоки и взвесьте его с точностью до 0,01 г . Кусочки проволоки ближе к 0,50 г, чем к 0,35 г.
- Преобразование [Cu(H 2 O) 6 ] 2+ (водн.) в Cu(OH) 2 (s)
- Будьте осторожны при обращении с NaOH, так как это сильное основание, которое вызывает жжение при контакте с кожей.
 Добавьте по каплям раствор NaOH к раствору меди.
Добавьте по каплям раствор NaOH к раствору меди. - После образования синего осадка периодически проверяйте кислотность раствора, погружая палочку для перемешивания в раствор и касаясь ею красной лакмусовой бумажки. Старайтесь не переносить синий осадок на лакмусовую бумагу: это приведет к некоторой потере меди и, возможно, к ложному синему цвету на лакмусовой бумаге. Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавление 0034 — идет на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим убедиться, что вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
- Будьте осторожны при обращении с NaOH, так как это сильное основание, которое вызывает жжение при контакте с кожей.
- Преобразование Cu(OH) 2 (т) в CuO(т)
- Добавить воду в реакционную смесь, полученную на предыдущем этапе, и добавьте также один или два кипящих камня .

- Содержимое стакана нагреть, но не кипятить . Кипячение делает черный CuO настолько мелким, что этап фильтрации становится чрезмерно долгим. Нагревайте химический стакан, пока весь синий Cu(OH) 2 не исчезнет и не заменится черным CuO.
- Отфильтровать и промыть CuO, как описано в процедуре (часть C). Держите твердое вещество на фильтровальной бумаге, а фильтрат выбросьте.
- Добавить воду в реакционную смесь, полученную на предыдущем этапе, и добавьте также один или два кипящих камня .
- Преобразование CuO(s) обратно в [Cu(H 2 O) 6 ] 2+ (водный)
- Растворите CuO на фильтровальной бумаге, как описано в процедуре (часть D).
- Раствор серной кислоты вызывает коррозию и вызывает жжение кожи при контакте с ней.
- Преобразование [Cu(H 2 O) 6 ] 2+ (водный) обратно в Cu(s)
- Добавьте около 1 г Zn к синему раствору, полученному на предыдущем шаге, и после того, как раствор полностью потеряет свой синий цвет, вам может понадобиться добавить немного серной кислоты, чтобы прореагировать избыток Zn.

- Металлическую медь трижды промыть дистиллированной водой и перенести в чашку для выпаривания, как описано в процедуре (часть Е), а затем трижды промыть изопропанолом порциями по 5 мл. Промывка изопропанолом сократит время, необходимое для этапа сушки.
- Высушите медь над стаканом с кипящей водой, как описано в процедуре (Е). Взвесьте сухую медь и запишите массу. Вычислите процент восстановленной меди.
- Добавьте около 1 г Zn к синему раствору, полученному на предыдущем шаге, и после того, как раствор полностью потеряет свой синий цвет, вам может понадобиться добавить немного серной кислоты, чтобы прореагировать избыток Zn.
Химия меди
Химия меди
История
Информация о
история меди
доступен в Медном
Development Association, Inc., где они отмечают, что:
«В течение почти 5000 лет медь была единственным металлом, известным человеку.
Сегодня это один из наиболее часто используемых и повторно используемых наших современных
металлов.»
Люди впервые использовали медь около 10 000 лет назад.
Кулон, обнаруженный в Северном Ираке, как полагают, датируется
около 8700 г. до н.э. Доисторический человек, вероятно, использовал медь для оружия
изготовление. Древние египтяне, похоже, тоже ценили
Древние египтяне, похоже, тоже ценили
коррозионная стойкость металла. Они использовали медные полосы и
гвозди в судостроении и медные трубы использовались для транспортировки
вода. Некоторые из этих артефактов сохранились до наших дней в хорошем состоянии.
Оценка общего производства меди в Египте за 1500 лет.
составляет 10 000 тонн.
Спустя годы появились медные сплавы. Бронзы (медно-оловянные сплавы)
появились сначала, а гораздо позже — латунь (медно-цинковая
сплавы). В «бронзовом веке» широко использовались медь и
бронза для оружия, монет, домашней утвари, мебели и др.
предметы. Самый ранний известный пример использования латуни — римская монета.
отчеканены во время правления Августа 27 г. до н.э. — 14 г. н.э. Медь позже
сыграли важную роль в появлении электричества и сегодня
по-прежнему является одним из наших самых ценных материалов.
Использование соединений меди также восходит к периоду до 4000 г. до н.э.
Сульфат меди, например, был особенно важным соединением.
в ранние времена. Древние египтяне использовали его как морилку в своих
процесс окрашивания. Соединение также использовалось для изготовления мазей и
другие подобные препараты. Позже, лечебное использование медного купороса
возникла с его рецептом для легочных заболеваний. Медь
сульфат по-прежнему широко используется сегодня и не имеет вредных побочных эффектов.
последствия его 9Сообщалось о 0277 предписанных случаях использования.
Возникновение
Медь является 25-м -м -м наиболее распространенным элементом Земли, но
один из менее распространенных переходных металлов первого ряда. Это происходит как
мягкий красноватый металл, который можно найти в виде больших валунов
массой в несколько сотен тонн или в виде сульфидных руд. Последние
сложные смеси меди, железа и серы в сочетании с
другие металлы, такие как мышьяк, цинк и серебро. Медь
концентрация в таких рудах обычно составляет 0,5-2%.
Самая распространенная руда — халькопирит, CuFeS 2 , латунь
желтая руда, на долю которой приходится примерно 50% мировой добычи
месторождения меди. Многочисленные другие медные руды разных цветов
Многочисленные другие медные руды разных цветов
и составы есть. Примеры малахит,
Cu 2 CO 3 (OH) 2 , ярко-зеленая руда,
и красный рудный куприт Cu 2 O.
Международный центр экологических и ядерных наук (ICENS)
имеет текущую программу картографирования геохимического состава Ямайки.
«Геохимический атлас Ямайки» был опубликован в 1919 г.95 и доступен на Amazon или ICENS.
Результаты, полученные для меди, показаны ниже (любезно предоставлено профессором Г. К. Лалором).
Медь встречается в биологических системах в составе
простетическая группа некоторых белков. Для примера меди
содержащие белки см. статью родом из Университета
Лидса, факультет биохимии и молекулярной биологии Института Скриппса.
Красный пигмент в
мягкоклювая птица Т (о) урако
содержит медно-порфириновый комплекс. Пигмент сильно водный
растворим в щелочных условиях и был
сообщили в 1952
что попытки зоозащитников помыть птицу привели к тому, что вода
приобретают красноватый оттенок.
T(o)uracos, как говорят, единственные птицы, обладающие настоящим красным и зеленым цветом.
Как правило, цвет, который вы воспринимаете при наблюдении за птицами, обусловлен отражениями.
благодаря структуре пера. Красные и зеленые пигменты (турацин и тураковердин)
найденные в перьях T(o)uraco, оба содержат медь.
Свойства меди
Отличный сайт для поиска свойств элементов,
включая медь по адресу
Еще одна полезная ссылка на
Страницы геологического проекта
в унив. Невада, Рено.
Извлечение меди
Медь извлекают из руды двумя основными способами:
- Пирометаллургическим методом
- Гидрометаллургический метод
Пирометаллургический метод
Этот метод часто используется при добыче сульфидных руд.
Всего четыре основных этапа:
- Горнодобывающая и фрезерная промышленность
- Руда измельчается и измельчается в порошок
обычно содержащие менее 1% меди.
Минералы концентрируются в суспензию, которая составляет около 15%.
медь.
Минералы меди отделяют от бесполезного материала флотацией.
с использованием пенообразующих растворов. - Плавка
- Плавка медного концентрата и извлечение
нагреванием, потоком и добавлением кислорода. Сера, железо и другие
нежелательные элементы удаляются, и продукт называется
черновая медь. - Переработка
- Это заключительный этап процесса
получение высококачественной меди. Методы огневого и электрорафинирования
используются техники. Последний производит медь высокой чистоты.
пригодны для использования в электротехнике.
Гидрометаллургический метод — SX/EW
Экстракция растворителем/электровыделение является наиболее распространенным методом выщелачивания
процесс, используемый сегодня при восстановлении меди из химических
решения. Как следует из названия, метод включает в себя два основных
этапы:
Экстракция растворителем – процесс выщелачивания ионов меди
или иным образом извлекаемые из необработанной руды с использованием химических
агенты.
Электролиз – электролиз раствора, содержащего ионы металлов
таким образом, что ионы Cu в нем осаждаются на катоде и
после этого удаляется в элементарной форме.
Процесс состоит из следующих этапов:
- Выбирается выщелачивающий раствор для использования в
вымывание ионов Cu из руды. Обычными реагентами являются слабые кислоты.
например Н 2 SO 4 , H 2 SO 4 +
Fe 2 (SO 4 ) 3 , хлорангидрид
решения напр. FeCl 2 , хлорид аммония и аммоний
солевые композиции. - При нанесении на руду выбранный выщелачиватель растворяет
ионы меди, образующие выщелачивающий продукт, называемый «беременным
выщелачивающий раствор». - Затем выбирается органический экстрагент для удаления ионов Cu из
водный раствор. Предпочтительные органические экстрагенты состоят из
гидроксифенилоксимы, имеющие основную химическую формулу: - C 6 H 3 (R)(OH) CNOHR*, R=
C 9 H 19 или C 12 H 25 и
R*= H, CH 3 или C 6 H 5
Структура 5-нонилсалицилальдоксима |
Примерами таких экстрагентов являются 5-нонилсалицилальдоксим и
смесь этого соединения и 2-гидрокси-5-нонилацетофенона
оксим. Коммерчески доступные реагенты обычно содержат 5-10%
Коммерчески доступные реагенты обычно содержат 5-10%
оксима в 90-95% разбавитель нефти, такой как
керосин.
Перед смешиванием с выщелачивающим продуктом экстрагент
содержат мало или совсем не содержат меди и на данном этапе называются
«бесплодный органический экстрагент».
- Ионы меди переносятся из выщелачивающего раствора в
органический экстрагент при смешивании двух реагентов. Фаза
происходит разделение с образованием водной и органической фаз
называемые соответственно первой водной и первой органической фазами.
Первая водная фаза, «рафинат», является выщелачивателем.
лишен ионов меди, в то время как первой органической фазой является
«загруженный органический экстрагент», т.е. экстрагент с ионами меди
подарок. - Рафинат рециркулируется на площадку выщелачивания, в то время как
загруженный органический экстрагент смешивают с раствором электролита
называется «бедным электролитом» (т. е. не содержащим меди).
Типичными электролитами являются кислые растворы, такие как серная кислота,
H 2 SO 4 . Ионы меди, находившиеся в
Ионы меди, находившиеся в
органический экстрагент при этом растворяется в растворе электролита
чтобы получить медь, содержащую «богатый электролит». Здесь снова там
является фазовым разделением. Вторая органическая фаза – бесплодная.
органический экстрагент, а вторая водная фаза представляет собой «богатую
электролит». Бесплодный органический экстрагент затем рециркулируется для
повторное использование в применении к выщелачивающему продукту. - Завершающей стадией процесса является электролиз
кислый раствор ионов металлов. В результате растворенные ионы меди
наносятся на катод, и элементарная медь удаляется.
Таким образом, процесс восстановления завершен.
A Примечание о примесях
Присутствие взвешенных загрязнителей в системе SX/EW может
значительно снижает эффективность его работы. Такой
загрязняющие вещества могут попасть в систему из руды или
из окрестностей. Система подвержена загрязнению
от дождя, ветра и других сил окружающей среды с момента первого
защитная оболочка, в которой хранится выщелачивающий продукт, обычно
незакрытые и расположенные на открытом воздухе. Таким образом, твердые отходы в
Таким образом, твердые отходы в
в виде грязи, песка, каменной пыли, растительных остатков, минеральных остатков
и взвешенные вещества часто вводятся в систему в
ранних стадиях и сохраняется на последующих стадиях
процесс.
Воздействие этих загрязняющих веществ является значительным и
включают:
- увеличенное время разделения фаз на стадиях, когда органические и
водные растворители смешивают. - отсутствие полного разделения фаз после экстракции,
это приводит к потерям дорогостоящего органического экстрагента, т.к.
его остается в водном растворе. - снижение выхода по току и снижение
чистота гальванического изделия из меди при электролизе
этап.
В большинстве систем SX/EW этапы очистки были введены в
чтобы облегчить эту проблему. В
Патент США (номер 573341)
например, хотя бы часть
вторая органическая фаза фильтруется для удаления твердых примесей
перед повторным использованием при обработке выщелачивающего продукта. Переработанная органика
Переработанная органика
поэтому экстрагент содержит мало или совсем не содержит примесей, зависящих от
от того, была ли часть или вся вторая органическая фаза
отфильтровано. Установлено, что эта стадия фильтрации
значительно повышает эффективность работы, даже если
часть экстрагента подвергается обработке.
Использование меди и ее соединений
Медь на протяжении веков уступает по полезности только железу.
Металл и его соединения используются во всех сферах жизни от
электрооборудование для медицины и сельского хозяйства.
Использование металлической меди
Электротехническая промышленность является бенефициаром большинства
выход меди. Металл используется в производстве электротехники.
устройства, такие как катоды и провода.
Другое применение включает:
— Кровля
-Посуда
-Монеты
-Слесарная работа
-Сантехника
— Катушки холодильника и кондиционера
-Сплавы напр. бронза, латунь
Использование соединений меди
Соединения меди наиболее широко используются в сельском хозяйстве.
С момента открытия их токсичности для некоторых насекомых грибы
и водорослей эти соединения использовались в инсектицидах,
фунгицидов и предотвращения развития водорослей в питьевой воде
водохранилища. Поэтому они используются для борьбы с животными и
болезни растений. Удобрения также часто дополняются
соединения меди, т.е. медный купорос, чтобы увеличить почву
плодородие и, таким образом, стимулировать рост урожая.
Соединения меди также используются в фотографии и в качестве красителей.
для стекла и фарфора.
Медь для хорошего здоровья
Медь является одним из многих микроэлементов, необходимых для хорошего здоровья. Это
входит в состав простетических групп многих белков и ферментов и
таким образом, имеет важное значение для их надлежащего функционирования. Поскольку тело может
не синтезируют медь, ее необходимо принимать с пищей. Орехи, семечки,
злаки, мясо (например, печень) и рыба являются хорошими источниками
медь.
Медь также нашла применение в медицине. Он использовался с раннего
Он использовался с раннего
раз при лечении ран груди и очистке воды. Это
Недавно было высказано предположение, что медь помогает предотвратить
воспаление, связанное с артритом и такими заболеваниями.
Продолжаются исследования лекарственных средств, содержащих медь, для лечения
этого и других условий.
Для получения дополнительной информации о важности меди для здоровья и
дефицит меди см.:
MotherNature и/или исследования витаминов
Продукты
Соединения меди
Медь представляет собой множество соединений, многие из которых
цветной. Двумя основными степенями окисления меди являются +1 и
+2, хотя известны некоторые комплексы +3. Соединения меди(I)
предположительно диамагнитны по своей природе и обычно бесцветны,
за исключением случаев, когда цвет является результатом переноса заряда или
анион. Ион +1 имеет тетраэдрическую или плоскоквадратную геометрию. В
твердые соединения, медь (I) часто находится в более стабильном состоянии при
умеренные температуры.
Ион меди(II) обычно находится в более стабильном состоянии в водной среде.
решения. Соединения этого иона, часто называемые соединениями меди,
обычно бывают цветными. На них влияет
Искажения Яна Теллера
и демонстрируют широкий спектр стереохимии с
преобладают четырех-, пяти- и шестикоординационные соединения. +2
ион часто демонстрирует искаженную тетраэдрическую геометрию.
Галогениды меди
Известно, что все галогениды меди(I) существуют, хотя
фтор в чистом виде еще не получен. Медь
хлориды, бромиды и йодиды бесцветны, диамагнитны
соединения. Они кристаллизуются при обычных температурах с
структура цинковой обманки, в которой атомы Cu связаны тетраэдрически
до четырех галогенов. Соли хлорида и бромида меди (I)
получают кипячением кислого раствора ионов меди(II) в
избыток меди. При разбавлении белый CuCl или бледно-желтый
Производится CuBr. Добавление растворимого йодида в водную
раствор ионов меди(II) приводит к образованию
осадок йодида меди (I), который быстро разлагается до Cu (I)
и йод.
Галогениды меди(I) мало растворимы в воде и большая часть
медь в водном растворе находится в состоянии Cu(II). Несмотря на это,
плохая растворимость соединений меди(I) увеличивается при
присоединение галогенид-ионов. В таблице ниже показаны некоторые свойства
галогениды меди(I).
| Формула | Цвет | МП | БП | Структура |
|---|---|---|---|---|
| CuCl | белый | 430 | 1359 | — |
| CuBr | белый | 483 | 1345 | — |
| CuI | белый | 588 | 1293 | Цинковая смесь |
Получено восстановлением CuX 2 -> CuX;
за исключением F, который не был получен в чистом виде.
| Формула | Цвет | МП | БП | м (БМ) | Структура |
|---|---|---|---|---|---|
| CuF 2 | белый | 950разложение | — | 1,5 | |
| CuCl 2 | коричневый | 632 | 993разложить | 1,75 | CdCl 2 |
| CuBr 2 | черный | 498 | — | 1,3 |
Все четыре галогенида меди (II) известны, хотя иодид меди
быстро разлагается на йодид меди и йод. желтый
желтый
хлорид меди (II) и почти черный бромид меди (II).
обычные галогениды. Эти соединения принимают структуру с
бесконечные параллельные полосы квадрата CuX 4 шт. медь
хлориды и бромиды хорошо растворимы в воде и в донорных
растворители, такие как ацетон, спирт и пиридин.
Галогениды меди(II) являются умеренными окислителями из-за
Пара Cu(I)/Cu(II). В воде, где потенциал в значительной степени
аквакомплексов не так много
разница между ними, но в неводных средах окисляющая
(галогенирование) мощность увеличивается в последовательности; CuF 2
<< CuCl 2 << CuBr 2 .
Они могут быть получены прямой реакцией с соответствующими
галогены:
Cu + F 2 → CuF 2 ;
Cu + Cl 2 / 450°C → CuCl 2 ;
Cu + Br 2 → CuBr 2
В качестве альтернативы они могут быть получены из CuX 2 .aq путем
нагрев -> CuX 2
Оксиды меди
Оксиды меди(I) более стабильны, чем оксиды меди(II) при
высокие температуры. Оксид меди(I) встречается в самородном виде в виде красного
Оксид меди(I) встречается в самородном виде в виде красного
куприт. В лаборатории снижение
Решение Фелинга
с восстанавливающим сахаром, таким как глюкоза, дает красный осадок.
Тест достаточно чувствителен, чтобы даже 1 мг сахара произвел
характерный красный цвет соединения. Закись меди может
также может быть приготовлен в виде желтого порошка контролируемым восстановлением
щелочная соль меди(II) с гидразином. Термическое разложение
оксид меди (II) также дает оксид меди (I), поскольку последний имеет
большая термическая стабильность. Таким же способом можно приготовить
соединение из нитрата меди (II), карбоната и
гидроксид.
Оксид меди(II) встречается в природе в виде тенорита. Этот черный
Кристаллическое твердое вещество можно получить пиролизом
нитратные, гидроксидные или карбонатные соли. Он также образуется при
порошкообразную медь нагревают на воздухе или в кислороде. В таблице ниже показано
некоторые характеристики оксидов меди.
| Формула | Цвет | Степень окисления | МП |
|---|---|---|---|
| CuO | черный | Медь 2+ | 1026разложить |
| Медь 2 О | красный | Медь + | 1230 |
Окислительно-восстановительная химия меди
Cu 2+ + e- → Cu + E=0,15 В
Cu + + e- → Cu E=0,52 В
Cu 2+ + 2e- → Cu E=0,34 В
При рассмотрении этих данных будет видно, что любой окислитель
достаточно силен, чтобы преобразовать Cu в Cu + , более чем достаточно силен, чтобы
преобразовать Cu + в Cu 2+ (0,52 по сравнению с 0,14 В). Это не
Это не
поэтому ожидается, что любые стабильные соли Cu + будут существовать в
водный раствор.
Также может иметь место диспропорционирование:
2Cu + → Cu 2+ + Cu E=0,37 В или
К=10 6
Координационные комплексы
Реакция ЭДТА 4- с медью(II) дала комплекс
где ЭДТА оказалась пентадентатной, а НЕ гексадентатной, в отличие от
другие ионы M(II).
Cu(ЭДТА) 2-
Структура иона [Cu(ox) 2 ] 2- может быть описана
в виде плоского квадрата или в виде искривленного октаэдра, когда упаковка в
рассматривается кристаллическая решетка. В случае с натриевой солью
отдельные блоки параллельны в ячейке с медью
связаны с атомами кислорода, координированными с медью в
единицы, расположенные как сверху, так и снизу, тогда как в
калиевой соли, единицы не параллельны и при взгляде на три
ед. центральный находится почти под прямым углом к двум другим.
Здесь медь связана с одним из некоординированных атомов кислорода.
в единицах выше и ниже его.
Na+ и K+ соли [Cu(ox) 2 ] 2-
Cu(OH) 2 реагирует с NH 3 с образованием раствора
который растворяет целлюлозу. Это эксплуатируется в
промышленная подготовка района. Решения содержат
тетраммины и пентамины. С пиридином взаимодействуют только тетрамины.
сформированный например Cu(py) 4 SO 4 .
Широко изучена реакция меди(II) с аминокислотами.
Почти во всех случаях продукт содержит группы в транс
конфигурация, которая, как ожидается, будет более стабильной. В случае
глицина первым осаждается всегда цис-изомер .
который превращается в транс- при нагревании.
См.
Лабораторное руководство для C31L
Больше подробностей.
Аналитическое определение меди(II)
Полезный реагент для аналитического определения
ион меди(II) представляет собой натриевую соль N,N-диэтилдитиокарбамата.
