Медь как вещество: Медь и виды ее сплавов
Содержание
Глава 1. Медь – простое вещество
§1. Электронное строение. Степени окисления.
Медь
— элемент первой группы побочной
подгруппы четвёртого периода периодической
системы химических элементов Д. И.
Менделеева, с атомным номером 29.
Обозначается символом Cu (лат. Cuprum).
Электронное
строение атома: 1s22s22p63s23p63d104s1.
Подобно атомам щелочных металлов, атомы
меди имеют в наружном слое один электрон,
но в отличие от атомов щелочных металлов,
предпоследний электронный слой содержит
восемнадцать электронов. Медь –
предпоследний член первой декады
d-элементов.
Поэтому у меди наблюдается так называемый
«провал электрона» — конфигурация
наружного электронного слоя 3d104s1
устойчивее,
чем 3d94s2.
Элемент | Радиус | Энергия Э0→Э | Радиус | Стандартный Э++e—→Э0, |
K | 0. | 4.18 | 0.149 | -2.925 |
Cu | 0.128 | 7.73 | 0.098 | +0.52 |
Сравнивая
медь с металлом главной подгруппы того
же периода — калием, можно видеть, что
радиус атома и иона меди почти в два
раза меньше соответственно атома и иона
калия. Это обуславливает значительно
бóльшую плотность, высокие температуры
плавления, так как меньшие по размеру
атомы располагаются в кристаллической
решетке более плотно, вследствие чего
силы притяжения между ними велики.
Малый
радиус объясняет так же более высокие
значения энергии ионизации меди, чем
калия. Это приводит к большим различиям
в химических свойствах этих металлов
одного периода и одной группы. Медь –
малоактивный металл, в ряду напряжений
стоит после водорода, в отличие от калия
– одного из самых активных металлов. В
В
то же время, восмнедцатиэлектронный
наружный слой, устойчивый у других
элементов, здесь еще не вполне
стабилизируется, и способен к частичной
потере электронов. Так, медь, наряду с
однозарядными катионами образует и
двухзарядные, которые для нее наиболее
характерны. Так же известны соединения
со степенью окисления +3 в составе анионов
или в комплексных соединений.
§2. Нахождение в природе. Месторождения.
Металлы
подгруппы меди обладают небольшой
химической активностью, поэтому они
находятся частично в виде химических
соединений, а частично в свободном виде,
особенно золото.
Медь
в далекие геологические эпохи, очевидно,
находилась только в виде сернистых
соединений – халькопирита
(или)
и халькозина.
Объясняется это тем, что медь обладает
довольно большим химическим сродством
к сере, в настоящее время сульфиды –
наиболее распространенные минералы
меди. При высоких температурах, например,
в районах вулканической деятельности,
под действием избытка кислорода
происходило превращение сульфидов меди
в окислы, например:
При
температуре ниже 10000C
происходило образование окиси меди,
которая в небольших количествах
встречается в природе:
.
Самородная
(металлическая) медь, очевидно, возникла
в природе при сильном нагревании частично
окисленных сернистых руд. Можно
представить, что после землетрясений,
грандиозных извержений окисленные
минералы меди были погребены под толстым
слоем горных пород и нагревались за
счет земного тепла. При этом происходило
взаимодействие окислов с сульфидами:
.
Подобные
процессы протекают при выплавке меди
на металлургических заводах. Такие
природные “металлургические заводы”
выплавляют громадные количества меди:
самый крупный из найденных самородков
весил 420 т. По-видимому, в меньших масштабах
взаимодействие окислов некоторых
металлов с сульфидами идет и в настоящее
время, например, в районе некоторых
Курильских островов.
Некоторые
другие минералы меди получились из
окисных руд. Например, под действием
влаги и двуокиси углерода происходила
гидратация окиси меди и образование
основных карбонатов:
.
В
лаборатории мы эти процессы не наблюдаем,
так как они идут медленно. В “лаборатории”
природы сроки в несколько тысяч лет
совершенно незначительны. В дальнейшем
под влиянием давления вышележащих
горных пород и некоторого нагревания
происходило уплотнение основного
карбоната меди, и он превратился в
изумительный по красоте минерал –
малахит. Особенно красив полированный
малахит. Он бывает окрашен от светло-зеленого
до темно-зеленого цвета. Переходы
оттенков причудливы и создают
фантастический рисунок на поверхности
камня.
Переход
нерастворимых сульфидных соединений
меди в раствор мог осуществляться за
счет взаимодействия растворов сульфата
железа (III):
.
Растворы
сульфата железа, как указано выше,
получаются в природе при действии воды,
насыщенной кислородом, на пирит. Эти
процессы медленно идут в природе и в
настоящее время. [1, с.8-10]
Медь
входит более чем в 198 минералов, из
которых для промышленности важны лишь
17. Для производства меди наибольшее
Для производства меди наибольшее
значение имеют халькопирит (он же –
медный колчедан) CuFeS2,
халькозин (медный блеск) Cu2S,
ковеллин CuS,
борнит (пестрая медная руда) Cu5FeS4.
Иногда встречается и самородная медь.
Распространение меди в земной коре
–4,7*103%
по массе (1015
— 1016
тонн).
[3]
Соединения
меди распределены в земной коре
неравномерно, что объясняется различием
в геологических условиях, сложившихся
в различных местах земного шара.
Богатейшие месторождения меди имеются
в Конго (Катангский пояс). Материалы,
собранные археологами о древнейших
месторождениях датируются тысячелетиями
до новой эры. Древнейшие выработки меди
на территории нашей страны найдены в
Закавказье, на побережье Балхаша, в
многочисленных пунктах Сибири.
Планомерные
поиски месторождений меди начинаются
при Иване III, Иване Грозном и особенно
при Петре I. При Иване Грозном в Олонецкий
При Иване Грозном в Олонецкий
уезд был послан новгородский гость
(купец) Семен Гаврилов “для сыску медные
руды”, где она и была найдена. В 1652 г.
Казанский воевода сообщил царю: “Медные
руды… сыскано много и заводы к медному
делу заводим”. [2, с.26] Из документов
следует, что с 1562 по 1664 г. было послано
из “Казани к Москве чистыя меди 4641 пуд.
6 гривенков”. В 1702 г. стала выходить
первая русская газета “Ведомости”,
которую, очевидно, редактировал Петр
I. 2 января 1703 г. в ней писали: “Из Казани
пишут. На реке Соку нашли много нефти и
медной руды, из той руды меди выплавили
изрядно, отчего чают не малую прибыль
Московскому государству”. [2, с.27]
В
начале этого столетия главнейшими
месторождениями, которые разрабатывались,
были: в районе Северного Урала –
Богословский завод, в районе Нижнего
Тагила – Выйский завод, а на Кавказе –
Калакентский и Кедабекский заводы.
В
наше время известны месторождения меди
на восточном склоне Урала, Средней Азии,
Закавказье и т. д.
д.
Большое
количество меди и других ископаемых
находится на дне океанов, которое покрыто
так называемыми конкрециями – скоплениями
в виде камней округлой неправильной
формы. Они содержат в среднем 0,5% меди.
По подсчетам ученых запасы этой ценной
и своеобразной руды составляют 5 млрд.
тонн. [1, с.16-18]
МЕДЬ | Энциклопедия Кругосвет
МЕДЬ – элемент 11 группы Периодической системы, плотность 8,9 г см–3, один из первых металлов, ставших известными человеку. Считают, что медь начали использовать около 5000 до н.э. В природе медь изредка встречается в виде металла. Из медных самородков, возможно, с помощью каменных топоров, были изготовлены первые металлические орудия труда. У индейцев, живших на его берегах оз. Верхнее (Сев. Америка), где есть очень чистая самородная медь, способы ее холодной обработки были известны до времен Колумба.
Около 3500 до н.э. на Ближнем Востоке медь научились извлекать из руд, ее получали восстановлением углем. Медные рудники были и в Древнем Египте. Известно, что глыбы для знаменитой пирамиды Хеопса обрабатывали медным инструментом.
Медные рудники были и в Древнем Египте. Известно, что глыбы для знаменитой пирамиды Хеопса обрабатывали медным инструментом.
К 3000 до н.э. в Индии, Месопотамии и Греции для выплавки более твердой бронзы в медь стали добавлять олово. Открытие бронзы могло произойти случайно, однако ее преимущества по сравнению с чистой медью быстро вывели этот сплав на первое место. Так начался «бронзовый век».
Изделия из бронзы были у ассирийцев, египтян, индусов и других народов древности. Однако цельные бронзовые статуи древние мастера научились отливать не раньше 5 в. до н.э. Около 290 до н.э. Харесом в честь бога солнца Гелиоса был создан Колосс Родосский. Он имел высоту 32 м и стоял над входом во внутреннюю гавань древнего порта острова Родоса в восточной части Эгейского моря. Гигантская бронзовая статуя была разрушена землетрясением в 223 н.э. (см. также СЕМЬ ЧУДЕС СВЕТА).
Предки древних славян, жившие в бассейне Дона и в Приднепровье, применяли медь для изготовления оружия, украшений и предметов домашнего обихода. Русское слово «медь», по мнению некоторых исследователей, произошло от слова «мида», которое у древних племен, населявших Восточную Европу, обозначало металл вообще.
Русское слово «медь», по мнению некоторых исследователей, произошло от слова «мида», которое у древних племен, населявших Восточную Европу, обозначало металл вообще.
Символ Cu происходит от латинского aes cyproum (позднее, Cuprum), так как на Кипре (Cyprus) находились медные рудники древних римлян.
Относительное содержание меди в земной коре составляет 6,8·10–3%. Самородная медь встречается очень редко. Обычно элемент находится в виде сульфида, оксида или карбоната. Важнейшими рудами меди являются халькопирит CuFeS2, который, по оценкам, составляет около 50% всех месторождений этого элемента, медный блеск (халькоцит) Cu2S, куприт Cu2O и малахит Cu2CO3(OH)2. Большие месторождения медных руд найдены в различных частях Северной и Южной Америк, в Африке и на территории нашей страны. В 18–19 вв. близ Онежского озера добывали самородную медь, которую отправляли на монетный двор в Петербург. Открытие промышленных месторождений меди на Урале и в Сибири связано с именем Никиты Демидова.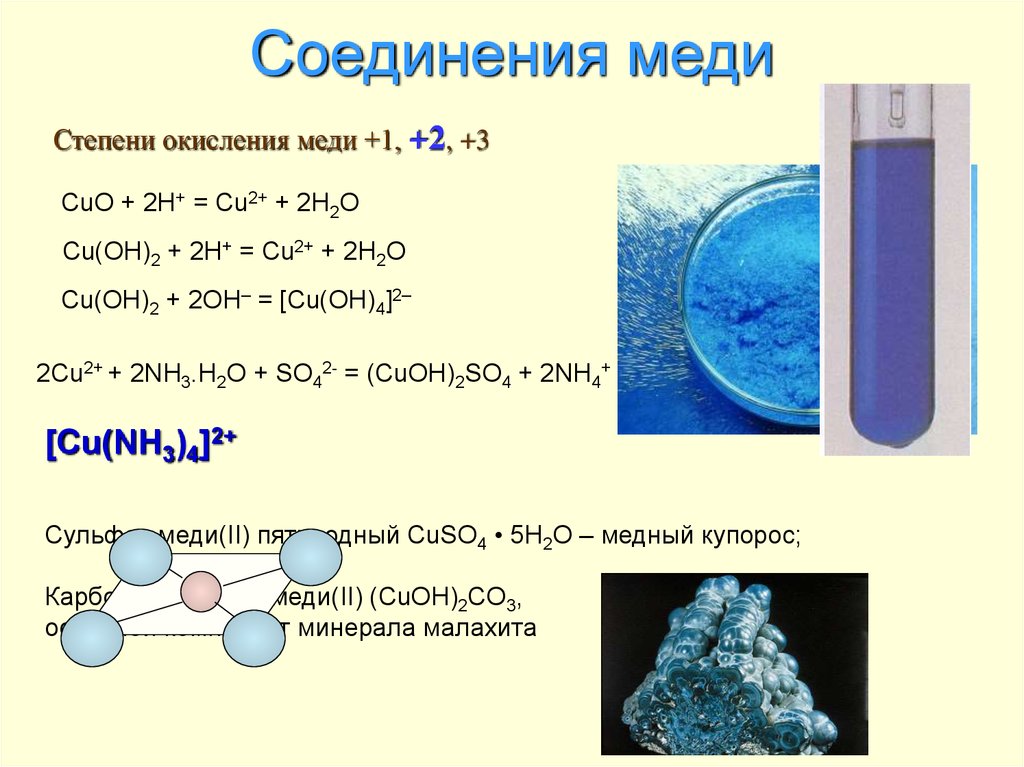 Именно он по указу Петра I в 1704 начал чеканить медные деньги.
Именно он по указу Петра I в 1704 начал чеканить медные деньги.
Богатые месторождения меди давно выработаны. Сегодня почти весь металл добывается из низкосортных руд, содержащих не более 1% меди. Некоторые оксидные руды меди могут быть восстановлены непосредственно до металла нагреванием с коксом. Однако большая часть меди производится из железосодержащих сульфидных руд, что требует более сложной переработки. Эти руды сравнительно бедные, и экономический эффект при их эксплуатации может обеспечиваться лишь ростом масштабов добычи. Руду обычно добывают в огромных карьерах, где используются экскаваторы с ковшами до 25 м3 и грузовики грузоподъемностью до 250 т. Сырье размалывают и концентрируют (до содержания меди 15–20%) с использованием пенной флотации, при этом серьезной проблемой является сброс многих миллионов тонн тонко измельченных отходов в окружающую среду (см. ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ). К концентрату добавляют кремнезем, а затем смесь нагревают в отражательных печах (доменные печи для тонко измельченной руды неудобны) до температуры 1400° С, при которой она плавится. Суммарное уравнение протекающих реакций можно представать в виде:
Суммарное уравнение протекающих реакций можно представать в виде:
2CuFeS2 + 5O2 + 2SiO2 = 2Cu + 2FeSiO3 + 4SO2
Cu+I + 1e– = Cu0 |
FeIII + 1e– = FeII | –10e–
2S–II – 12e– = 2SIV |
O2 + 4e– = 2O–II
Большую часть полученной черновой меди очищают электрохимическим методом, отливая из нее аноды, которые затем подвешивают в подкисленном растворе сульфата меди CuSO4, а катоды покрывают листами очищенной меди. В процессе электролиза чистая медь осаждается на катодах, а примеси собираются около анодов в виде анодного шлама, который является ценным источником серебра, золота и других драгоценных металлов.
Около 1/3 используемой меди представляет собой вторичную медь, выплавленную из лома. Годовое производство нового металла составляет около 8 млн. т. Лидируют по производству меди Чили (22%), США (20%), СНГ (9%), Канада (7,5%), Китай (7,5%) и Замбия (5%).
Лидируют по производству меди Чили (22%), США (20%), СНГ (9%), Канада (7,5%), Китай (7,5%) и Замбия (5%).
Главное применение металла – в качестве проводника электрического тока. Кроме того, медь используется в монетных сплавах, поэтому ее часто называют «монетным металлом». Она также входит в состав традиционных бронзы (сплавы меди с 7–10% олова) и латуни (сплав меди с цинком) и специальных сплавов, таких как монель (сплав никеля с медью). Металлообрабатывающий инструмент из медных сплавов не искрит и может использоваться во взрывоопасных цехах. Сплавы на основе меди служат для изготовления духовых инструментов и колоколов.
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро- и теплопроводности медь уступает только серебру. Металлическая медь, как и серебро, обладает антибактериальными свойствами.
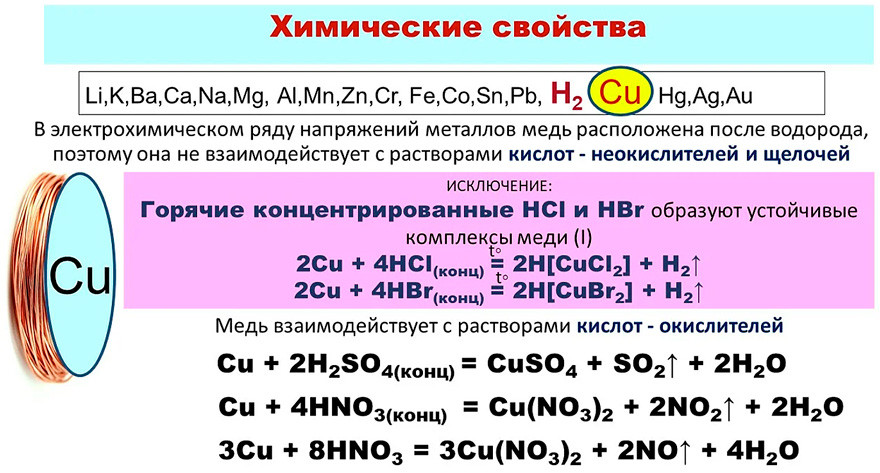
Медь устойчива в чистом сухом воздухе при комнатной температуре, однако при температуре красного каления образует оксиды. Она реагирует также с серой и галогенами. В атмосфере, содержащей соединения серы, медь покрывается зеленой пленкой основного сульфата. В электрохимическом ряду напряжений медь находится правее водорода, поэтому она практически не взаимодействует с неокисляющими кислотами. Металл растворяется в горячей концентрированной серной кислоте, а также в разбавленной и концентрированной азотной кислоте. Кроме того, медь можно перевести в раствор действием водных растворов цианидов или аммиака:
Она реагирует также с серой и галогенами. В атмосфере, содержащей соединения серы, медь покрывается зеленой пленкой основного сульфата. В электрохимическом ряду напряжений медь находится правее водорода, поэтому она практически не взаимодействует с неокисляющими кислотами. Металл растворяется в горячей концентрированной серной кислоте, а также в разбавленной и концентрированной азотной кислоте. Кроме того, медь можно перевести в раствор действием водных растворов цианидов или аммиака:
2Cu + 8NH3·H2O + O2 = 2[Cu(NH3)4](OH)2 + 6H2O
В соответствии с положением меди в Периодической системе, ее единственная устойчивая степень окисления должна быть (+I), но это не так. Медь способны принимать более высокие степени окисления, причем наиболее устойчивой, особенно в водных растворах, является степень окисления (+II). В биохимических реакциях переноса электрона, возможно, участвует медь(III). Эта степень окисления редко встречается и очень легко понижается под действием даже слабых восстановителей. Известно несколько соединений меди(+IV).
Известно несколько соединений меди(+IV).
При нагревании металла на воздухе или в кислороде образуются оксиды меди: желтый или красный Cu2O и черный CuO. Повышение температуры способствует образованию преимущественно оксида меди(I) Cu2O. В лаборатории этот оксид удобно получать восстановлением щелочного раствора соли меди(II) глюкозой, гидразином или гидроксиламином:
2CuSO4 + 2NH2OH + 4NaOH = Cu2O + N2 + 2Na2SO4 + 5H2O
Эта реакция – основа чувствительного теста Фелинга на сахара и другие восстановители. К испытываемому веществу добавляют раствор соли меди(II) в щелочном растворе. Если вещество является восстановителем, появляется характерный красный осадок.
Поскольку катион Cu+ в водном растворе неустойчив, при действии кислот на Cu2O происходит либо дисмутация, либо комплексообразование:
Cu2O + H2SO4 = Cu + CuSO4 + H2O
Cu2O + 4HCl = 2 H[CuCl2] + H2O
Оксид Cu2O заметно взаимодействует со щелочами. При этом образуется комплекс:
При этом образуется комплекс:
Cu2O + 2NaOH + H2O 2Na[Cu(OH)2]
Для получения оксида меди(II) CuO лучше всего использовать разложение нитрата или основного карбоната меди(II):
2Cu(NO3)2 = 2CuO + 4NO2 + O2
(CuOH)2CO3 = 2CuO + CO2 + H2O
Оксиды меди не растворимы в воде и не реагируют с ней. Единственный гидроксид меди Cu(OH)2 обычно получают добавлением щелочи к водному раствору соли меди(II). Бледно-голубой осадок гидроксида меди(II), проявляющий амфотерные свойства (способность химических соединений проявлять либо основные, либо кислотные свойства), можно растворить не только в кислотах, но и в концентрированных щелочах. При этом образуются темно-синие растворы, содержащие частицы типа [Cu(OH)4]2–. Гидроксид меди(II) растворяется также в растворе аммиака:
Cu(OH)2 + 4NH3.H2O = [Cu(NH3)4](OH)2 + 4H2O
Гидроксид меди(II) термически неустойчив и при нагревании разлагается:
Cu(OH)2 = CuO + H2O
Есть сведения о существовании темно-красного оксида Cu2O3, образующегося при действии K2S2O8 на Cu(OH)2. Он является сильным окислителем, при нагревании до 400° С разлагается на CuO и О2.
Он является сильным окислителем, при нагревании до 400° С разлагается на CuO и О2.
Большой интерес к химии оксидов меди в последние два десятилетия связан с получением высокотемпературных сверхпроводников, из которых наиболее известен YBa2Cu3O7. В 1987 было показано, что при температуре жидкого азота это соединение является сверхпроводником. Главные проблемы, препятствующие его широкомасштабному практическому применению, лежат в области обработки материала. Сейчас наиболее перспективным считается изготовление тонких пленок.
Многие из халькогенидов меди – нестехиометрические соединения. Сульфид меди(I) Cu2S образуется при сильном нагревании меди в парах серы или в среде сероводорода. При пропускании сероводорода через водные растворы, содержащие катионы Cu2+, выделяется коллоидный осадок состава CuS. Однако, CuS – не простое соединение меди(II). Оно содержит группу S2 и лучше описывается формулой CuI2CuII(S2)S. Селениды и теллуриды меди проявляют металлические свойства, а CuSe2, CuTe2, CuS и CuS2 при низких температурах являются сверхпроводниками.
Селениды и теллуриды меди проявляют металлические свойства, а CuSe2, CuTe2, CuS и CuS2 при низких температурах являются сверхпроводниками.
При нагревании меди с галогенами можно синтезировать безводные дифторид, дихлорид и дибромид. Растворы галогенидов меди(II) удобнее получать взаимодействием металла, его оксида, гидроксида или карбоната с соответствующей галогеноводородной кислотой. Из водных растворов всегда выделяются кристаллогидраты.
Попытки получить иодид меди(II) приводят к образованию иодида меди(I) CuI:
2Cu2+ + 4I– = 2CuI + I2
При этом раствор и осадок окрашиваются в бурый цвет за счет присутствия иода. Образовавшийся иод можно удалить действием тиосульфат-иона:
I2 + 2SO3S2– = 2I– + S4O62–
Однако при добавлении избытка тиосульфат-иона иодид меди(I) растворяется:
CuI + 2SO3S2– = [Cu(SO3S)2]3– + I–
Точно так же попытки получить цианид меди(II) приводят к образованию CuCN. С другой стороны, с электроотрицательным фтором не удается получить соль меди(I). Три других галогенида меди(I), представляющие собой белые нерастворимые соединения, осаждаются из водных растворов при восстановлении галогенидов меди(II).
С другой стороны, с электроотрицательным фтором не удается получить соль меди(I). Три других галогенида меди(I), представляющие собой белые нерастворимые соединения, осаждаются из водных растворов при восстановлении галогенидов меди(II).
В водных растворах бесцветный ион меди(I) очень неустойчив и диспропорционирует
2CuI CuII + Cu(р)
Возможно, причиной этого является размер атома. Ион CuII меньше, чем CuI, и, имея вдвое больший заряд, намного сильнее взаимодействует с водой (теплоты гидратации составляют ~2100 и ~580 кДж моль–1, соответственно). Разница является существенной, так как она перевешивает вторую энергию ионизации для меди. Это делает ион CuII более стабильным в водном растворе (и ионных твердых веществах), чем CuI, несмотря на устойчивую конфигурацию d10 последнего. Тем не менее, CuI может стабилизироваться в соединениях с очень низкой растворимостью или за счет комплексообразования. Комплексы легко образуются в водном растворе при взаимодействии Cu2O с соответствующими лигандами. В водных растворах хлоро- и амминкомплексы меди(I) медленно окисляются кислородом воздуха до соответствующих соединений меди(II).
Комплексы легко образуются в водном растворе при взаимодействии Cu2O с соответствующими лигандами. В водных растворах хлоро- и амминкомплексы меди(I) медленно окисляются кислородом воздуха до соответствующих соединений меди(II).
Катион меди(II), напротив, в водном растворе вполне устойчив. Соли меди(II), в основном, растворимы в воде. Голубой цвет их растворов связан с образованием иона [Cu(H2O)4]2+. Они часто кристаллизуются в виде гидратов. Водные растворы в небольшой степени подвержены гидролизу и из них часто осаждаются основные соли. Основный карбонат есть в природе – это минерал малахит, основные сульфаты и хлориды образуются при атмосферной коррозии меди, а основный ацетат (ярь-медянка) используется в качестве пигмента.
Ярь-медянка известна со времен Плиния Старшего (23–79 н.э.). В русских аптеках ее начали получать в начале 17 в. В зависимости от способа получения она может быть зеленого или голубого цвета. Ею были окрашены стены царских палат в Коломенском в Москве.
Наиболее известную простую соль – пентагидрат сульфата меди(II) CuSO4·5H2O – часто называют медным купоросом. Слово купорос, по-видимому, происходит от латинского Cipri Rosa – роза Кипра. В Росси медный купорос называли синим, кипрским, затем турецким. То, что купорос содержит медь, было впервые установлено в 1644 Ван Гельмонтом. В 1848 Р.Глаубер впервые получил медный купорос из меди и серной кислоты. Сульфат меди широко используется в электролитических процессах, при очистке воды, для защиты растений. Он является исходным веществом для получения многих других соединений меди.
Тетрааммины легко образуются при добавлении аммиака к водным растворам меди(II) до полного растворения первоначально выпавшего осадка. Темно-синие растворы тетраамминов меди растворяют целлюлозу, которую можно вновь осадить при подкислении, что используется в одном из процессов для получения вискозы. Приливание этанола к раствору вызывает осаждение [Cu(NH3)4]SO4·H2O. Перекристаллизация тетраамминов из концентрированного раствора аммиака приводит к образованию фиолетово-синих пентаамминов, однако пятая молекула NH3 легко теряется. Гексааммины можно получить только в жидком аммиаке, и их хранят в атмосфере аммиака.
Перекристаллизация тетраамминов из концентрированного раствора аммиака приводит к образованию фиолетово-синих пентаамминов, однако пятая молекула NH3 легко теряется. Гексааммины можно получить только в жидком аммиаке, и их хранят в атмосфере аммиака.
Медь(II) образует плоско-квадратный комплекс с макроциклическим лигандом фталоцианином. Его производные используются для получения ряда пигментов от синего до зеленого, которые устойчивы вплоть до 500° С и широко используются в чернилах, красках, пластиках и даже в цветных цементах.
Медь имеет важное биологическое значение. Ее окислительно-восстановительные превращения участвуют в различных биохимических процессах растительного и животного мира.
Высшие растения легко переносят сравнительно большое поступление соединений меди из внешней среды, низшие же организмы, наоборот, чрезвычайно чувствительны к этому элементу. Самые незначительные следы соединений меди их уничтожают, поэтому растворы сульфата меди или их смеси с гидроксидом кальция (бордосская жидкость) применяют как противогрибковые средства.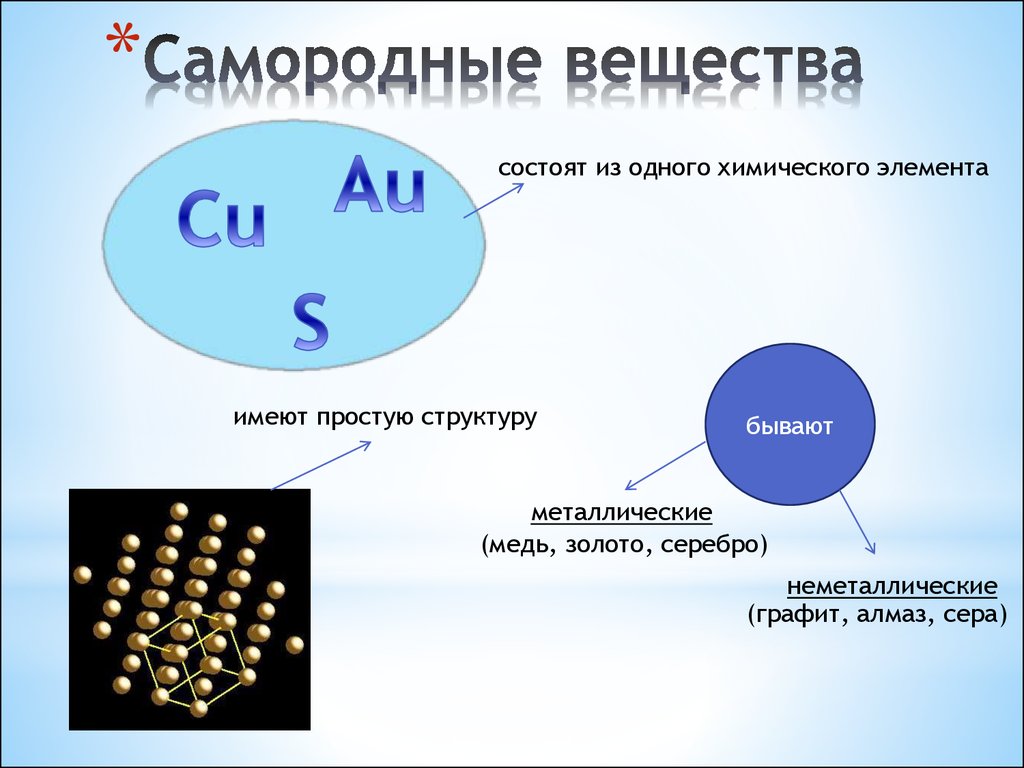
Из представителей животного мира наибольшие количества меди содержатся в телах осьминогов, устриц и других моллюсков. В их крови она играет ту же роль, что железо в крови других животных. В составе белка гемоцианина она участвует в переносе кислорода. Неокисленный гемоцианин бесцветен, а в окисленном состоянии он приобретает голубовато-синюю окраску. Поэтому не зря говорят, что у осьминогов – голубая кровь.
Организм взрослого человека содержит около 100 мг меди, сосредоточенной, в основном, в белках, только содержание железа и цинка выше. Ежедневная потребность человека в меди составляет около 3–5 мг. Дефицит меди проявляется в анемии, однако избыток меди также опасен для здоровья.
Елена Савинкина
Список препаратов с МЕДИ СУЛЬФАТ БЕЗВОДНЫЙ
Международное наименование INN:
Ph.Eur.
Многокомпонентые препараты
торговые наименования многокомпонентых препаратов, в состав которых входит
активное вещество МЕДИ СУЛЬФАТ БЕЗВОДНЫЙ
Капли Береш Плюс | Капли д/приема внутрь: фл. рег. №: П N014202/01-2002 Дата перерегистрации: 26.03.12 | BERES Pharmaceuticals (Венгрия) контакты: (Венгрия) | ||
Максамин Форте | Таб. рег. №: П N014644/01-2002 | ANGLO-FRENCH DRUGS and INDUSTRIES (Индия) контакты: (Индия) | ||
Менопейс | Капс.: 30 шт. рег. №: П N015844/01 | VITABIOTICS (Великобритания) Произведено: THOMPSON & CAPPER (Великобритания) | ||
Мульти-табс® Перинатал | Таб. рег. №: П N014384/01 Дата перерегистрации: 03.09.19 | ПФАЙЗЕР ИННОВАЦИИ (Россия) Произведено: PFIZER CONSUMER MANUFACTURING ITALY (Италия) | ||
Олиговит | Драже: 30 шт. рег. №: П N014434/01-2003 | GALENIKA (Сербия) | ||
Перфектил | Капс.: 30 шт. рег. №: П N015861/01 | VITABIOTICS (Великобритания) | ||
Прегнакеа | Капс. рег. №: П N015408/01 | VITABIOTICS (Великобритания) | ||
Супрадин® | Таб. шипучие: 10 или 20 шт. рег. №: П N015220/01 Дата перерегистрации: 12. Таб., покр. оболочкой: 30 или 60 шт. рег. №: П N016098/01 Дата перерегистрации: 04.07.16 | БАЙЕР (Россия) Произведено: DELPHARM GAILLARD (Франция) DRAGENOPHARM APOTHEKER PUSCHL (Германия) контакты: (Германия) | ||
Элевит® Пронаталь | Таб. рег. №: П N015935/01 Дата перерегистрации: 03.12.18 | БАЙЕР (Россия) Произведено: ROTTENDORF PHARMA (Германия) контакты: (Германия) |
Описания препаратов с недействующими рег. уд. или не поставляемые на рынок РФ
Витатресс® | Таб. рег. №: Р N000793/01 | ВЕРОФАРМ (Россия) | ||
Витрум® Вижн | Таб., покр. пленочной оболочкой: 30, 60, 90 или 120 шт. рег. №: П N015480/01 | UNIPHARM (США) | ||
Джунгли с минералами | Таб. рег. №: П N014490/01 Дата перерегистрации: 30.05.16 | БАЙЕР (Россия) Произведено: SAGMEL, (США) | ||
Мульти-Табс® Классик | Таб. рег. №: П N012067/01 | FERROSAN (Дания) | ||
Мульти-Табс® Макси | Таб., покр. оболочкой: 30 или 90 шт. рег. №: П N012073/01 | FERROSAN (Дания) | ||
Оксиасе® | Капс. рег. №: П N013357/01-2001 | UNIQUE PHARMACEUTICAL Laboratories (Индия) Отделение фирмы: J.B. Chemicals & Pharmaceuticals (Индия) | ||
Теравит | Таб. рег. №: П N014576/01 Дата перерегистрации: 04.07.16 | БАЙЕР (Россия) Произведено: SAGMEL, (США) | ||
Теравит Тоник | Таб. рег. №: ЛСР-002351/08 Дата перерегистрации: 06.06.16 | БАЙЕР (Россия) Произведено: SAGMEL, (США) | ||
Фарматон Витал | Капс. рег. №: П N008544 | САНОФИ РОССИЯ (Россия) | ||
Фарматон Витал | Капс.: 30 или 100 шт. рег. №: П-8-242 N008544 | PHARMATON (Швейцария) |
Медь
Медь широко используется, особенно в электропроводке. Хотя в целом в чеканке используется лишь небольшое количество меди, это, тем не менее, означает, что мы прикасаемся к меди каждый раз, когда берем монету в руки. Медь образует сплавы более свободно, чем большинство металлов, и с широким спектром легирующих элементов, включая цинк, олово, никель и алюминий. Эти металлы добавляются для увеличения прочности и повышения стойкости к износу и коррозии, но они также влияют на цвет сплава.
Хотя в целом в чеканке используется лишь небольшое количество меди, это, тем не менее, означает, что мы прикасаемся к меди каждый раз, когда берем монету в руки. Медь образует сплавы более свободно, чем большинство металлов, и с широким спектром легирующих элементов, включая цинк, олово, никель и алюминий. Эти металлы добавляются для увеличения прочности и повышения стойкости к износу и коррозии, но они также влияют на цвет сплава.
Использование меди
Рисунок 1 Использование меди.
| Рисунок 2 Статуя Свободы была недавно отреставрирована после более чем векового воздействия погодных условий. Медная кожа была цела, только факел требовал внимания. С любезного разрешения The Copper Development Association. |
В Великобритании медь в основном используется для изготовления полуфабрикатов (называемых полуфабрикатами), которые изготавливаются из рафинированного металла либо в виде чистой меди, либо в виде медных сплавов. Они могут быть в виде проволоки, стержня, прутка, пластины, листа, полосы, фольги или трубки. Более половины меди продается в виде кабелей, проводов и труб. Большая часть остального превращается в сплавы.
Они могут быть в виде проволоки, стержня, прутка, пластины, листа, полосы, фольги или трубки. Более половины меди продается в виде кабелей, проводов и труб. Большая часть остального превращается в сплавы.
На сегодняшний день наибольшая часть меди используется в электропроводке, печатных платах, генераторах, электродвигателях и трансформаторах. Например, в среднем автомобиле около мили медной проводки массой 1 кг. Новый Boeing 787 (Dreamliner) имеет около 120 миль проводки при массе 4 тонны.
Медь также используется в автомобилях в различных электронных устройствах, таких как датчики для контроля и контроля температуры и скорости.
Много меди используется в зданиях, не только в медных трубах и электропроводке, но и в облицовке, что приводит к очень привлекательному цвету. Он также используется в холодильниках и кондиционерах из-за простоты изготовления и тепловых свойств.
Годовое производство (Первичная медь)
| Мир | 18,9 млн тонн 1 |
| Чили | 5,7 млн тонн 2 |
| Китай | 1,8 млн тонн 2 |
| Перу | 1,6 млн тонн 2 |
| США | 1,8 млн тонн 2 |
| Конго (Киншаса) | 1,0 млн тонн 2 |
Данные:
1 International Copper Study Group, 2015.
2 U.S. Geological Survey, Mineral Commodity Summaries, 2016.
Производство меди
присутствует в виде сульфидного минерала, например, халькопирит (CuFeS 2 ) (наиболее распространенная медная руда), борнит (Cu 5 FeS 4 ) и халькоцит (Cu 2 S). Эти руды обычно содержат только около 0,5-2% меди. Остальная часть первичной продукции поступает из руд, в которых медь присутствует в виде силикатов, сульфатов, карбонатов и оксидов, которые образовались в результате выветривания и окисления сульфидных минералов. Около 30% всего производства меди извлекается из вторичного сырья и отходов, которые перерабатываются.
Крупные месторождения руд находятся в Чили, западной части США, Канаде, Замбии, Демократической Республике Конго и России.
Рис. 3. Шахта Бингем-Каньон в штате Юта, США. Это крупнейший в мире открытый медный рудник.
С любезного разрешения Тиффани Беверидж.
Производство меди происходит в три этапа:
а) обогащение руды
б) превращение сульфидов и других соединений меди в медь
в) очистка меди
(а) обогащение руды
Руда обогащается пенной флотацией (рис. 4). Измельченная руда смешивается с нефтью и перемешивается с водой в большом резервуаре, в который добавлено моющее средство.
4). Измельченная руда смешивается с нефтью и перемешивается с водой в большом резервуаре, в который добавлено моющее средство.
Через смесь продувается сжатый воздух, легкие частицы сульфида меди поднимаются наверх и плавают в пене. Более тяжелые глины и другие силикаты оседают на дно резервуара. Этот остаток известен как «пустая порода». Медная пена снимается.
Рис. 4 Обогащение медной руды пенной флотацией.
(b) Конверсия сульфидов и других соединений меди в медь
Конверсия осуществляется несколькими методами:
i) обжигом медных сульфидных руд
ii) процессом выщелачивания
iii) бактериальным методом
(i) Обжигом медных сульфидных руд
Обогащенная руда обжигается при достаточном количестве воздуха, достаточном для превращения сульфида железа в железо(ll ) оксид:
Затем твердую смесь смешивают с карбонатом кальция (известняком), кремнеземом (песком) и нагревают до 1300 К. Железо образует силикатный шлак, а сульфид меди(I) плавится и опускается на дно печи. . Он известен как медный штейн.
. Он известен как медный штейн.
В недавно разработанном процессе Isasmelt обогащенная руда (концентраты), известняк и кремнезем вместе с твердым топливом (углем) смешиваются и прессуются в окатыши. Они подаются в печь, в которой есть фурма, по которой закачивается природный газ (метан) и нефть с воздухом, обогащенным кислородом. Более экономично использовать чистый кислород или воздух, обогащенный кислородом, а не воздух, поскольку это увеличивает скорость реакции и означает, что можно использовать более мелкие химические установки и снизить стоимость топлива. Кроме того, это облегчает обеспечение того, чтобы никакие газы, такие как диоксид серы, не выбрасывались и не загрязняли атмосферу. На участке построены кислородные установки.
Рисунок 5 Производство меди с использованием процесса Isasmelt.
Эта смесь перекачивается со скоростью, которая вызывает турбулентность и способствует очень быстрой реакции. Процесс очень эффективен, и большое количество сырья может быть переработано в относительно небольших печах.
Медный штейн и шлак сливаются в другую печь для осаждения и разделения.
Медный штейн затем направляют в другую печь и вдувают воздух или воздух, обогащенный кислородом, для получения металлической меди:
Двуокись серы часто на месте превращают в серную кислоту.
Эта нечистая медь ( ca 99%) известна как черновая медь. Его нагревают до тех пор, пока он не расплавится, и вводят дополнительное количество воздуха для удаления нежелательной серы. Затем следует закачка метана для удаления кислорода. Этот процесс известен как огневое рафинирование. Затем все еще нечистая медь отливается в аноды для электрорафинирования.
(ii) Процесс выщелачивания
Медь получают из руды путем обработки руды раствором хлорида меди(II) и хлорида железа(III):
Медь извлекают в виде хлорида меди(l). Чтобы сохранить соединение в растворе, добавляют хлорид натрия. В присутствии избытка хлорид-иона образуется комплексный ион [CuCl 2 ] — , растворимый в воде:
Наконец, нечистую медь получают электролизом раствора [CuCl 2 ] — ионы в металл:
Хлорид меди (II) затем рециркулируют.
(iii) Бактериальный метод
Значительное количество меди, производимой в США, получают с использованием бактерий. Подкисленная вода распыляется на отходы добычи меди, которые содержат низкие уровни меди. По мере того как вода просачивается сквозь щебень, бактерия Thiobadllus ferrooxidans, живущая в присутствии кислоты и серы, расщепляет содержащиеся в породе сульфиды железа и превращает железо(II) в ионы железа(III). Ион железа (III), в свою очередь, окисляет сульфид-ион сульфидов меди до сульфата, оставляя ион меди (II) в растворе. Эта насыщенная медью вода извлекается на дне штабеля, а металлическая медь получается восстановлением железным ломом:
(c) Очистка меди
Какой бы метод производства меди из руды ни использовался, ее окончательная очистка осуществляется электролизом (рис. 6).
Плиты нечистой меди (черновой меди) вместе с тонкими листами чистой металлической меди или нержавеющей стали или титана погружают в раствор сульфата меди(II) (0,3 моль дм -3 ) и серной кислоты (2 моль дм -3 ). Чистые медные или стальные листы составляют катод (рис. 7) электролизера, а нечистые пластины — анод. Это означает, что ионы меди образуются на аноде (происходит окисление) и переходят в раствор:
Чистые медные или стальные листы составляют катод (рис. 7) электролизера, а нечистые пластины — анод. Это означает, что ионы меди образуются на аноде (происходит окисление) и переходят в раствор:
Рисунок 6 Очистка меди электролизом.
Ионы мигрируют к катоду, восстанавливаются до чистой меди и осаждаются на катоде. Время от времени с катода соскабливают чистую медь.
Многие примеси из медного анода, такие как золото, серебро, платина и олово, нерастворимы в растворе электролита и поэтому не осаждаются на катодах. Вместо этого они осаждаются в виде «анодного шлама» на дне резервуара, который периодически удаляют и отправляют на переработку. Другие металлы, напр. железо и никель растворимы, поэтому электролит необходимо постоянно очищать, чтобы предотвратить чрезмерное осаждение этих элементов на катоде. Медь чистотой не ниже 9Таким образом получают 9,99%.
Полученная медь будет преобразована в удобные формы (такие как листы, проволока, стержень, трубы и т. д.) для использования в производстве.
д.) для использования в производстве.
Рис. 7 Катоды из чистой меди на нефтеперерабатывающем заводе в Канаде.
С любезного разрешения Anglo American.
Вторичное производство
Медь и сплавы с высоким содержанием меди перерабатываются для получения чистой меди. Металлы нагреваются воздухом, обогащенным кислородом, который окисляет большинство металлов, но не медь или какие-либо драгоценные металлы, образуя шлак, который можно удалить. Описанный выше процесс Isasmelt часто используется для производства вторичной меди.
Оставшаяся медь, чистота которой составляет около 99%, отливается в аноды и дополнительно очищается с помощью электролитического метода, описанного выше.
По оценкам, во всем мире около 33% новых изделий из меди производится из переработанной меди, при этом в некоторых странах показатели переработки значительно выше, например в Северной Америке (31%) и странах Западной Европы (47%). Около половины этого количества приходится на лом заводов и литейных заводов, производящих медные изделия, который затем просто переплавляют и отливают. Другая половина поступает из «старого лома», например, из электрических кабелей и сантехники.
Другая половина поступает из «старого лома», например, из электрических кабелей и сантехники.
Данные из:
The World Copper Factbook, 2015; International Copper Study Group
Рис. 8 Блок-схема, обобщающая процессы, используемые для производства меди из руды.
Медные сплавы
Многие широко используемые сплавы содержат медь в качестве преобладающего металла с различными количествами других элементов (таблица 1).
| Сплав | Медь в сплаве с | Применение |
|---|---|---|
| Латунь | цинк | винты, провода, детали сантехники, электрические соединители, музыкальные инструменты, дверная фурнитура и украшения |
| Бронза | олово | статуи, подшипники, электрические разъемы, пружины, зажимы |
| Фосфористая бронза | , фосфор | прецизионные подшипники, пружины, тарелки, инструментальные струны |
| Алюминиевая бронза | олово, алюминий (железо, никель, кремний) | Инструменты, высокотемпературные компоненты авиационных и автомобильных двигателей |
| Мельхиор | никель (железо, марганец) | монеты, внешние компоненты в морской среде |
| Нейзильбер | никель, цинк | столовые приборы, ключи, молнии, монеты, духовые и духовые инструменты, медиаторы для банджо |
Таблица 1 Важные сплавы меди и их применение.
| Рисунок 9 Этот саксофон изготовлен из медного сплава. С любезного разрешения Мэтью Уоддингтона. |
В монетах евро используется медь четырьмя различными способами. Монеты номиналом от 1 до 5 центов изготовлены из стали с медным покрытием. Монеты номиналом от 10 до 50 центов изготовлены из скандинавского золота (89% меди с добавлением алюминия, цинка и олова). Монеты номиналом 1 и 2 евро состоят из двух сплавов. Внутренняя часть монеты золотого цвета изготовлена из 75% меди с добавлением цинка и никеля, а внешняя часть серебряного цвета представляет собой сплав 75% меди и 25% никеля.
Исследования показали, что бактерии не могут долго выживать на медной поверхности, и одно из преимуществ использования медных сплавов для изготовления духовых или духовых музыкальных инструментов заключается в том, что они менее склонны к росту плесени и бактерий, несмотря на регулярное воздействие влаги. , теплое, насыщенное бактериями дыхание. Этот эффект проявляется, если доля меди в сплаве составляет 65 % и более, и основан на способности ионов меди нарушать транспорт электронов в системах дыхания бактериальных клеток. Медь также может связываться с фосфатными группами в клеточной ДНК, вызывая распутывание двойной спирали.
, теплое, насыщенное бактериями дыхание. Этот эффект проявляется, если доля меди в сплаве составляет 65 % и более, и основан на способности ионов меди нарушать транспорт электронов в системах дыхания бактериальных клеток. Медь также может связываться с фосфатными группами в клеточной ДНК, вызывая распутывание двойной спирали.
Дата последнего изменения: 2 октября 2016 г.
Последовательность химических реакций
Превращение меди: последовательность химических реакций
- Цели
- Реакции
- Процедура
Цели
- Укажите разнообразие веществ, частью которых может быть элемент:
металл —> синий раствор —> синее твердое вещество —> черное твердое вещество —> синий раствор (снова) —> металл (снова).
- Сохранение массы и кротов:
- Мы должны добыть столько меди, сколько начали.
- Одинаковое количество меди на каждой стадии: одинаковое количество молей.
- Опыт работы со стандартными химическими методами: фильтрация и количественные переносы.
Реакции
Cu(тв) —> [Cu(H 2 O) 6 ] 2+ (водн.) —> Cu(OH) 2 (тв) —> CuO(тв) —> [Cu(H 2 O) 6 ] 2+ (водный) —> Cu(s)
- Металлическая медь «растворяется» в азотной кислоте (HNO 3 ). Фактически ион нитрата окисляет металлическую медь до иона меди (II), в то время как сам превращается в газ NO 2 в процессе; затем ион меди (II) связывается с шестью молекулами воды. Физическое изменение, которое вы должны наблюдать, это исчезновение металла медного цвета по мере того, как раствор становится синим (из [Cu(H 2 O) 6 ] 2+ , ион гексааквамеди) и выделяется коричневый газ (NO 2 ).
Cu (т) + 4 H 3 O + (водн.) + 2 NO 3 — (водн.
 ) —> [Cu(H 2 O) 6 ] 2 2 5 (водн.) + 2 NO 2 (г)
) —> [Cu(H 2 O) 6 ] 2 2 5 (водн.) + 2 NO 2 (г) - Ион гидроксида (ОН — ) связывается с ионом меди (II) даже сильнее, чем вода. В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди Cu(OH) 2 , синий осадок.
[Cu(H 2 O) 6 ] 2+ (водн.) + 2 OH — —> Cu(OH) 2 (т) + 6 H 2 O (л)
- При нагревании гидроксида меди образуется оксид меди CuO, твердое вещество черного цвета.
Cu(OH) 2 (т) —> CuO (т) + H 2 O (ж)
- Оксид меди растворяется в кислоте, регенерируя ион меди (II), который снова связывается с вода.
CuO (т) + 2 H 3 O + (водн.) + 3 H 2 O (ж) —> [Cu(H 2 O) 6 ] 2+ (водн.)
9033 гидратированный ион меди (II) снова превращается в металлическую медь, в то время как сам он окисляется до ионов цинка (II). Мы видели эту реакцию раньше в лаборатории хлорида меди).
Мы видели эту реакцию раньше в лаборатории хлорида меди).
[Cu(H 2 O) 6 ] 2+ (водн.) + Zn (тв.) —> Cu (тв.) + Zn 2+ (водн.) + 6 H 2 O ( тел.)
В то же время часть металлического цинка, находящегося в избытке, восстанавливает ионы гидроксония до H 2 .
Zn (т) + 2 H 3 O + (водн.) —> Zn 2+ (водн.) + H 2 (г) + 2 H 2 O (л)
4
4
4 2 (г) + 2 H
Процедура
Я не буду подробно описывать процедуру шаг за шагом, но подчеркну некоторые моменты безопасности и (выделено жирным шрифтом ) некоторые места, где наша процедура отличается от той, что в лабораторном пакете.
- Преобразование Cu(s) в [Cu(H 2 O) 6 ] 2+ (водный)
- Возьмите кусок медной проволоки и взвесьте его с точностью до 0,01 г .
 Кусочки проволоки ближе к 0,50 г, чем к 0,35 г. Это нормально: используйте детали, которые мы предоставляем.
Кусочки проволоки ближе к 0,50 г, чем к 0,35 г. Это нормально: используйте детали, которые мы предоставляем. - Используйте около 4-5 мл концентрированного раствора HNO 3 .
- Будьте осторожны с азотной кислотой: как и другие сильные кислоты, она вызывает жжение при попадании на кожу и может повредить одежду; в отличие от большинства других кислот, он также окрашивает пораженный участок в желтый цвет.
- Если некоторое количество меди останется нерастворенным к моменту окончания производства газа, поставьте химический стакан на горячие плиты в вытяжных шкафах, чтобы ускорить реакцию.
- Важно выполнять этот шаг в вытяжном шкафу, поскольку коричневый газ NO 2 вызывает раздражение. Держите смеси в вытяжном шкафу до тех пор, пока не добавите 10 мл дистиллированной воды после полного растворения меди.
- Возьмите кусок медной проволоки и взвесьте его с точностью до 0,01 г .
- Преобразование [Cu(H 2 O) 6 ] 2+ (водн.) в Cu(OH) 2 (s)
- Будьте осторожны при обращении с NaOH, так как это сильное основание, которое вызывает жжение при контакте с кожей.
 Добавьте по каплям раствор NaOH к раствору меди.
Добавьте по каплям раствор NaOH к раствору меди. - После образования синего осадка периодически проверяйте кислотность раствора, погружая палочку для перемешивания в раствор и касаясь ею красной лакмусовой бумажки. Старайтесь не переносить синий осадок на лакмусовую бумагу: это приведет к некоторой потере меди и, возможно, к ложному синему цвету на лакмусовой бумаге. Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавление 0051 — идет на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим, чтобы вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
- Будьте осторожны при обращении с NaOH, так как это сильное основание, которое вызывает жжение при контакте с кожей.
- Превращение Cu(OH) 2 (т) в CuO(т)
- Добавьте воду в реакционную смесь, полученную на предыдущем этапе, и добавьте также один или два кипящих камня .

- Содержимое стакана нагреть, но не кипятить . Кипячение делает черный CuO настолько мелким, что этап фильтрации становится чрезмерно долгим. Нагревайте химический стакан до тех пор, пока весь синий Cu(OH) 2 не исчезнет и не заменится черным CuO.
- Отфильтруйте и промойте CuO, как описано в процедуре (часть C). Держите твердое вещество на фильтровальной бумаге, а фильтрат выбросьте.
- Добавьте воду в реакционную смесь, полученную на предыдущем этапе, и добавьте также один или два кипящих камня .
- Преобразование CuO(s) обратно в [Cu(H 2 O) 6 ] 2+ (водн.)
- Растворите CuO на фильтровальной бумаге, как описано в процедуре (часть D).
- Раствор серной кислоты вызывает коррозию и вызывает жжение кожи при контакте с ней.
- Преобразование [Cu(H 2 O) 6 ] 2+ (водный) обратно в Cu(s)
- Добавьте примерно 1 г Zn в синий раствор, полученный на предыдущем шаге, и после того, как раствор полностью потеряет свой синий цвет, вам может понадобиться добавить немного серной кислоты, чтобы прореагировать избыток Zn.

- Металлическую медь трижды промыть дистиллированной водой и перенести в чашку для выпаривания, как описано в процедуре (часть Е), а затем трижды промыть изопропанолом порциями по 5 мл. Промывка изопропанолом сократит время, необходимое для этапа сушки.
- Высушите медь над стаканом с кипящей водой, как описано в процедуре (E). Взвесьте сухую медь и запишите массу. Вычислите процент восстановленной меди.
- Добавьте примерно 1 г Zn в синий раствор, полученный на предыдущем шаге, и после того, как раствор полностью потеряет свой синий цвет, вам может понадобиться добавить немного серной кислоты, чтобы прореагировать избыток Zn.
21.12A: Медный металл — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 34468
- Роберт Дж. Ланкашир
- Университет Вест-Индии в Моне
Информация об истории меди доступна в Ассоциации развития меди, Inc. , где они отмечают, что: «В течение почти 5000 лет медь была единственным металлом, известным человеку. металлы». Люди впервые использовали медь около 10 000 лет назад. Считается, что медный кулон, обнаруженный в Северном Ираке, датируется примерно 8700 годом до нашей эры. Доисторический человек, вероятно, использовал медь для изготовления оружия. Древние египтяне, похоже, тоже ценили коррозионную стойкость металла. Они использовали медные ленты и гвозди в судостроении, а медные трубы использовались для подачи воды. Некоторые из этих артефактов сохранились до наших дней в хорошем состоянии. По оценкам, общий объем производства меди в Египте за 1500 лет составляет 10 000 тонн.
, где они отмечают, что: «В течение почти 5000 лет медь была единственным металлом, известным человеку. металлы». Люди впервые использовали медь около 10 000 лет назад. Считается, что медный кулон, обнаруженный в Северном Ираке, датируется примерно 8700 годом до нашей эры. Доисторический человек, вероятно, использовал медь для изготовления оружия. Древние египтяне, похоже, тоже ценили коррозионную стойкость металла. Они использовали медные ленты и гвозди в судостроении, а медные трубы использовались для подачи воды. Некоторые из этих артефактов сохранились до наших дней в хорошем состоянии. По оценкам, общий объем производства меди в Египте за 1500 лет составляет 10 000 тонн.
Спустя годы появились медные сплавы. Сначала появились бронзы (сплавы меди и олова), а гораздо позже — латуни (сплавы меди и цинка). В «бронзовом веке» медь и бронза широко использовались для изготовления оружия, монет, домашней утвари, мебели и других предметов. Самым ранним известным примером использования латуни является римская монета, отчеканенная во время правления Августа с 27 г. до н.э. по 14 г. н.э. Позже медь сыграла важную роль в появлении электричества и сегодня по-прежнему остается одним из самых ценных материалов.
до н.э. по 14 г. н.э. Позже медь сыграла важную роль в появлении электричества и сегодня по-прежнему остается одним из самых ценных материалов.
Использование соединений меди также восходит к периоду до 4000 г. до н.э. Сульфат меди, например, был особенно важным соединением в ранние времена. Древние египтяне использовали его в качестве протравы в процессе окрашивания. Соединение также использовалось для изготовления мазей и других подобных препаратов. Позже медный купорос стал применяться в лечебных целях с его назначением при легочных заболеваниях. Сульфат меди по-прежнему широко используется сегодня, и о вредных побочных эффектах его применения не сообщалось.
Возникновение
Медь является 25-м -м -м наиболее распространенным элементом Земли, но одним из менее распространенных переходных металлов первого ряда. Он встречается в виде мягкого красноватого металла, который можно найти в виде больших валунов весом в несколько сотен тонн или в виде сульфидных руд. Последние представляют собой сложные смеси меди, железа и серы в сочетании с другими металлами, такими как мышьяк, цинк и серебро. Концентрация меди в таких рудах обычно составляет 0,5-2%.
Последние представляют собой сложные смеси меди, железа и серы в сочетании с другими металлами, такими как мышьяк, цинк и серебро. Концентрация меди в таких рудах обычно составляет 0,5-2%.
Самая распространенная руда — халькопирит, CuFeS 2 , медно-желтая руда, на долю которой приходится примерно 50% мировых месторождений меди. Существует множество других медных руд разного цвета и состава. Примерами являются малахит Cu 2 CO 3 (OH) 2 , ярко-зеленая руда и красный рудный куприт Cu 2 O.
Медь встречается в биологических системах как часть простетической группы. определенных белков. Примеры белков, содержащих медь, см. в статье Университета Лидса, факультета биохимии и молекулярной биологии Института Скриппса. Красный пигмент мягкоклювой птицы T(o)uraco содержит медно-порфириновый комплекс. Пигмент хорошо растворяется в воде в щелочных условиях, о чем сообщалось в 1952, попытки работников зоопарка помыть птицу привели к тому, что вода окрасилась в красный цвет. Говорят, что Т(о)урако — единственные птицы, обладающие настоящим красным и зеленым цветом. Как правило, цвет, который вы воспринимаете, наблюдая за птицами, обусловлен отражениями, создаваемыми структурой пера. Красный и зеленый пигменты (турацин и тураковердин), содержащиеся в перьях Т(о)урако, содержат медь.
Говорят, что Т(о)урако — единственные птицы, обладающие настоящим красным и зеленым цветом. Как правило, цвет, который вы воспринимаете, наблюдая за птицами, обусловлен отражениями, создаваемыми структурой пера. Красный и зеленый пигменты (турацин и тураковердин), содержащиеся в перьях Т(о)урако, содержат медь.
Рисунок 2: Мягкоклювая птица T(o)uraco
Добыча меди
Медь извлекается из руды двумя основными способами:
- Пирометаллургический метод
- Гидрометаллургический метод
Пирометаллургический метод
Этот метод часто используется при добыче сульфидных руд. Существует четыре основных этапа:
- Добыча полезных ископаемых и измельчение: руда дробится и измельчается в порошок, обычно содержащий менее 1% меди. Минералы концентрируются в суспензию, содержащую около 15% меди. Минералы меди отделяют от бесполезного материала флотацией с использованием пенообразующих растворов.
- Плавка: Плавка медного концентрата и экстракция путем нагревания, флюса и добавления кислорода.
 Сера, железо и другие нежелательные элементы удаляются, и продукт называется черновой медью.
Сера, железо и другие нежелательные элементы удаляются, и продукт называется черновой медью. - Рафинирование: это заключительный этап процесса получения высококачественной меди. Используются методы огневого и электрорафинирования. Последний производит медь высокой чистоты, пригодную для использования в электротехнике.
Гидрометаллургический метод – SX/EW
Экстракция растворителем/Электровыделение – наиболее распространенный процесс выщелачивания, используемый сегодня для извлечения меди из химических растворов. Как следует из названия, метод включает в себя два основных этапа:
- Экстракция растворителем – процесс, при котором ионы меди выщелачиваются или иным образом извлекаются из сырой руды с использованием химических реагентов.
- Электровыделение — электролиз раствора, содержащего ионы металла, так что ионы меди в нем осаждаются на катоде, а затем удаляются в виде элемента.
Процесс происходит в следующие этапы:
- Выщелачивающий раствор (выщелачивающий раствор) выбирают для выщелачивания ионов Cu из руды.
 Обычными реагентами являются слабые кислоты, т.е. Н 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , растворы кислых хлоридов, например FeCl 2 , композиции хлорида аммония и соли аммония.
Обычными реагентами являются слабые кислоты, т.е. Н 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , растворы кислых хлоридов, например FeCl 2 , композиции хлорида аммония и соли аммония. - При нанесении на руду выбранный выщелачиватель растворяет присутствующие ионы меди с образованием выщелачивающего продукта, называемого «содержащим выщелачивающим раствором».
- Затем выбирается органический экстрагент для удаления ионов меди из водного раствора. Предпочтительные органические экстрагенты состоят из гидроксифенилоксимов, имеющих основную химическую формулу:
- C 6 H 3 (R)(OH) CNOHR*, R= C 9 H 19 или C 12 H 25 и R* или C 3 , CH 6 Н 5
Примерами таких экстрагентов являются 5-нонилсалицилальдоксим и смесь этого соединения и 2-гидрокси-5-нонилацетофеноноксима. Имеющиеся в продаже реагенты обычно содержат 5-10% оксима в 90-95%-ном нефтяном разбавителе, таком как керосин.
Имеющиеся в продаже реагенты обычно содержат 5-10% оксима в 90-95%-ном нефтяном разбавителе, таком как керосин.
Перед смешиванием с выщелачивающим продуктом экстрагент будет содержать мало меди или совсем не содержать ее, и на этой стадии его называют «бесплодным органическим экстрагентом».
- Ионы меди переходят из выщелачивающего раствора в органический экстрагент при смешивании двух реагентов. Происходит разделение фаз с получением водной и органической фаз, называемых соответственно первой водной и первой органической фазами. Первая водная фаза, «рафинат», представляет собой выщелачиватель, лишенный ионов меди, в то время как первая органическая фаза представляет собой «загруженный органический экстрагент», т.е. экстрагент с присутствующими ионами меди.
- Рафинат рециркулируется на площадку выщелачивания, в то время как загруженный органический экстрагент смешивается с раствором электролита, называемым «тощим электролитом» (т.е. не содержащим меди).
 Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту.
Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту. - Заключительной стадией процесса является электролиз кислого раствора ионов металлов. В результате растворенные ионы меди оседают на катоде, а элементарная медь удаляется. Таким образом, процесс восстановления завершен.
Примечание о примесях
Присутствие взвешенных загрязняющих веществ в системе SX/EW может значительно снизить эффективность ее работы. Такие загрязнители могут попасть в систему из руды или из окружающей среды. Система восприимчива к загрязнению дождем, ветром и другими факторами окружающей среды, поскольку первая защитная оболочка, в которой хранится выщелачивающий продукт, обычно не накрыта и расположена на открытом воздухе. Таким образом, твердые отходы в виде грязи, песка, каменной пыли, растительных остатков, минеральных остатков и взвешенных веществ часто попадают в систему на ранних стадиях и сохраняются на последующих стадиях процесса.
Система восприимчива к загрязнению дождем, ветром и другими факторами окружающей среды, поскольку первая защитная оболочка, в которой хранится выщелачивающий продукт, обычно не накрыта и расположена на открытом воздухе. Таким образом, твердые отходы в виде грязи, песка, каменной пыли, растительных остатков, минеральных остатков и взвешенных веществ часто попадают в систему на ранних стадиях и сохраняются на последующих стадиях процесса.
Воздействие этих загрязняющих веществ значительно и включает:
- увеличение времени разделения фаз на стадиях, когда органические и водные растворители смешиваются.
- снижение выхода по току и снижение чистоты гальванического изделия из меди на стадии электролиза.
Отсутствие полного разделения фаз после экстракции приводит к потерям дорогостоящего органического экстрагента, так как большая его часть остается в водном растворе.
В большинстве систем SX/EW для решения этой проблемы введены этапы очистки. В патенте США (номер 573341), например, по меньшей мере часть второй органической фазы фильтруется для удаления твердых загрязняющих примесей перед повторным использованием при обработке выщелачивающего продукта. Таким образом, рециркулируемый органический экстрагент содержит мало или совсем не содержит примесей в зависимости от того, была ли отфильтрована часть второй органической фазы или вся вторая органическая фаза. Было обнаружено, что эта стадия фильтрации значительно повышает эффективность работы, даже когда обрабатывается только часть экстрагента.
В патенте США (номер 573341), например, по меньшей мере часть второй органической фазы фильтруется для удаления твердых загрязняющих примесей перед повторным использованием при обработке выщелачивающего продукта. Таким образом, рециркулируемый органический экстрагент содержит мало или совсем не содержит примесей в зависимости от того, была ли отфильтрована часть второй органической фазы или вся вторая органическая фаза. Было обнаружено, что эта стадия фильтрации значительно повышает эффективность работы, даже когда обрабатывается только часть экстрагента.
Использование меди и ее соединений
Медь уступает по полезности только железу на протяжении веков. Металл и его соединения используются во всех сферах жизни от электротехники до медицины и сельского хозяйства.
Использование металлической меди
Электротехническая промышленность является бенефициаром большей части производства меди в мире. Металл используется в производстве электрических приборов, таких как катоды и провода. Другое использование включает:
Другое использование включает:
- Кровля
- Посуда
- Монеты
- Металлообработка
- Сантехника
- Змеевики для холодильников и кондиционеров
- Сплавы напр. бронза, латунь
Использование соединений меди
Соединения меди наиболее широко используются в сельском хозяйстве. С тех пор как была обнаружена их токсичность для некоторых насекомых, грибков и водорослей, эти соединения использовались в инсектицидах, фунгицидах и для предотвращения развития водорослей в резервуарах с питьевой водой. Поэтому они используются для борьбы с болезнями животных и растений. Удобрения также часто дополняют соединениями меди, т.е. медный купорос для повышения плодородия почвы и, следовательно, ускорения роста сельскохозяйственных культур. Соединения меди также используются в фотографии и в качестве красителей для стекла и фарфора.
Медь для хорошего здоровья
Медь является одним из многих микроэлементов, необходимых для хорошего здоровья. Он является частью простетических групп многих белков и ферментов и, таким образом, необходим для их правильного функционирования. Поскольку организм не может синтезировать медь, ее необходимо принимать с пищей. Орехи, семечки, крупы, мясо (например, печень) и рыба являются хорошими источниками меди.
Он является частью простетических групп многих белков и ферментов и, таким образом, необходим для их правильного функционирования. Поскольку организм не может синтезировать медь, ее необходимо принимать с пищей. Орехи, семечки, крупы, мясо (например, печень) и рыба являются хорошими источниками меди.
Медь также нашла применение в медицине. С давних времен он использовался для лечения ран грудной клетки и очистки воды. Недавно было высказано предположение, что медь помогает предотвратить воспаление, связанное с артритом и другими подобными заболеваниями. Продолжаются исследования лекарственных средств, содержащих медь, для лечения этого и других заболеваний.
Соединения меди
Медь содержит множество соединений, многие из которых окрашены. Двумя основными степенями окисления меди являются +1 и +2, хотя известны некоторые комплексы +3. Ожидается, что соединения меди (I) будут диамагнитными по своей природе и обычно бесцветны, за исключением случаев, когда цвет возникает в результате переноса заряда или аниона. Ион +1 имеет тетраэдрическую или плоскоквадратную геометрию. В твердых соединениях медь (I) часто находится в более стабильном состоянии при умеренных температурах.
Ион +1 имеет тетраэдрическую или плоскоквадратную геометрию. В твердых соединениях медь (I) часто находится в более стабильном состоянии при умеренных температурах.
Ион меди(II) обычно находится в более стабильном состоянии в водных растворах. Соединения этого иона, часто называемые соединениями меди, обычно окрашены. На них влияют искажения Ян-Теллера, и они демонстрируют широкий спектр стереохимии с преобладанием четырех-, пяти- и шестикоординационных соединений. Ион +2 часто имеет искаженную тетраэдрическую геометрию.
Галогениды меди
Известно, что все галогениды меди(I) существуют, хотя фторид еще не был получен в чистом виде. Хлорангидриды, бромиды и йодиды меди — бесцветные диамагнитные соединения. Они кристаллизуются при обычных температурах со структурой цинковой обманки, в которой атомы Cu тетраэдрически связаны с четырьмя галогенами. Соли хлорида и бромида меди (I) получают кипячением кислого раствора ионов меди (II) в избытке меди. При разбавлении образуется белый CuCl или бледно-желтый CuBr. Добавление растворимого йодида к водному раствору ионов меди(II) приводит к образованию осадка йодида меди(I), который быстро разлагается на Cu(I) и йод.
При разбавлении образуется белый CuCl или бледно-желтый CuBr. Добавление растворимого йодида к водному раствору ионов меди(II) приводит к образованию осадка йодида меди(I), который быстро разлагается на Cu(I) и йод.
Галогениды меди(I) умеренно растворимы в воде, и большая часть меди в водном растворе находится в состоянии Cu(II). Тем не менее, плохая растворимость соединений меди (I) увеличивается при добавлении ионов галогенидов. В таблице ниже показаны некоторые свойства галогенидов меди (I).
| Формула | цвет | МП | БП | м (БМ) | Структура |
|---|---|---|---|---|---|
| CuF 2 | белый | 950разложение | — | 1,5 | |
| CuCl 2 | коричневый | 632 | 993разложение | 1,75 | CdCl 2 |
| CuBr 2 | черный | 498 | — | 1,3 |
Известны все четыре галогенида меди(II), хотя йодид меди быстро разлагается на йодид меди и йод. Желтый хлорид меди (II) и почти черный бромид меди (II) являются обычными галогенидами. Эти соединения имеют структуру с бесконечными параллельными квадратными полосами CuX 4 единиц. Хлорангидриды и бромиды меди хорошо растворимы в воде и донорных растворителях, таких как ацетон, спирт и пиридин.
Желтый хлорид меди (II) и почти черный бромид меди (II) являются обычными галогенидами. Эти соединения имеют структуру с бесконечными параллельными квадратными полосами CuX 4 единиц. Хлорангидриды и бромиды меди хорошо растворимы в воде и донорных растворителях, таких как ацетон, спирт и пиридин.
Галогениды меди(II) являются умеренными окислителями из-за пары Cu(I)/Cu(II). В воде, где потенциал в значительной степени равен потенциалу аквакомплексов, большой разницы между ними нет, но в неводных средах окислительная (галогенирующая) способность возрастает в ряду;
\[\ce{CuF2 \ll CuCl2 \ll CuBr2}\]
Могут быть получены прямой реакцией с соответствующими галогенами:
\[\ce{Cu + F2 → CuF2}\]
\[\ce{Cu + Cl2 / 450 C → CuCl2}\]
\[\ce{Cu + Br2 → CuBr2}\]
В качестве альтернативы их можно получить из CuX 2 .aq путем нагревания -> CuX 2
| Формула | цвет | МП | БП | Структура |
|---|---|---|---|---|
| CuCl | белый | 430 | 1359 | — |
| CuBr | белый | 483 | 1345 | — |
| CuI | белый | 588 | 1293 | Цинковая смесь |
Получено восстановлением CuX 2 -> CuX;
, за исключением F, который не был получен в чистом виде.
Обратите внимание, что CuI 2 не был выделен из-за легкости восстановления до CuI.
Оксиды меди
Оксиды меди(I) более стабильны, чем оксиды меди(II) при высоких температурах. Оксид меди(I) встречается в самородном виде в виде красного куприта. В лаборатории восстановление раствора Фелинга восстанавливающим сахаром, таким как глюкоза, дает красный осадок. Тест достаточно чувствителен даже для 1 мг сахара, чтобы получить характерный красный цвет соединения. Закись меди также можно получить в виде желтого порошка контролируемым восстановлением щелочной соли меди (II) гидразином. Термическое разложение оксида меди(II) также дает оксид меди(I), так как последний обладает большей термической стабильностью. Тот же метод можно использовать для получения соединения из нитрата, карбоната и гидроксида меди (II).
Оксид меди(II) встречается в природе в виде тенорита. Это черное кристаллическое твердое вещество может быть получено пиролизом нитратных, гидроксидных или карбонатных солей. Он также образуется при нагревании порошкообразной меди на воздухе или в кислороде. В таблице ниже приведены некоторые характеристики оксидов меди.
Он также образуется при нагревании порошкообразной меди на воздухе или в кислороде. В таблице ниже приведены некоторые характеристики оксидов меди.
| Формула | цвет | Степень окисления | МП |
|---|---|---|---|
| CuO | черный | Медь 2+ | 1026разложение |
| Медь 2 О | красный | Медь + | 1230 |
Окислительно-восстановительная химия меди
Cu 2+ + e- → Cu + E=0,15 В
Cu + + e- → Cu E=0,52 В
Cu 2+ + 2e- → Cu E=0,34 В
При рассмотрении этих данных будет видно, что любой окислитель, достаточно сильный для превращения Cu в Cu + , более чем достаточно силен для превращения Cu + в Cu 2+ (0,52 по сравнению с 0,14 В). Поэтому не ожидается, что какие-либо стабильные соли Cu + будут существовать в водном растворе.
Поэтому не ожидается, что какие-либо стабильные соли Cu + будут существовать в водном растворе.
Также может произойти диспропорционирование:
2Cu + → Cu 2+ + Cu E=0,37 В или K=10 6
Координационные комплексы
Реакция ЭДТА 4- с медью(II) дала комплекс, в котором ЭДТА оказался пентадентатным, а НЕ гексадентатным, в отличие от других ионов M(II).
Cu(ЭДТА) 2-
Структура иона [Cu(ox) 2 ] 2- может быть описана как квадратно-плоская или как искаженный октаэдр, если рассматривать упаковку в кристаллической решетке . В случае соли натрия отдельные единицы параллельны в ячейке с медью, связанной с атомами кислорода, координированными с медью в единицах, расположенных как вверху, так и внизу, тогда как в соли калия единицы не параллельны и если смотреть в трех единицах центральная находится почти под прямым углом к двум другим. Здесь медь связана с одним из некоординированных атомов кислорода в единицах выше и ниже ее.
Здесь медь связана с одним из некоординированных атомов кислорода в единицах выше и ниже ее.
Na+ и K+ соли [Cu(ox) 2 ] 2-
Cu(OH) 2 реагирует с NH 3 с образованием раствора, растворяющего целлюлозу. Это используется в промышленной подготовке района. Растворы содержат тетраммины и пентамины. С пиридином образуются только тетрамины, например, Cu(py) 4 SO 4 .
Взаимодействие меди(II) с аминокислотами широко изучено. Почти во всех случаях продукт содержит группы в -транс-, которая, как ожидается, будет более стабильной. В случае глицина первым осаждаемым продуктом всегда является цис- изомер, который при нагревании превращается в транс-. Для получения более подробной информации см. лабораторное руководство для C31L.
Аналитическое определение меди(II)
Полезным реагентом для аналитического определения иона меди(II) является натриевая соль N,N-диэтилдитиокарбамата.

 236
236 30 мл или 100 мл с капельницей
30 мл или 100 мл с капельницей 08.10
08.10 , покр. пленочной оболочкой: 30 или 60 шт.
, покр. пленочной оболочкой: 30 или 60 шт.
 : 30 шт.
: 30 шт. 01.17
01.17 , покр. пленочной оболочкой: 30 или 100 шт.
, покр. пленочной оболочкой: 30 или 100 шт. , покр. оболочкой: 30 или 50 шт.
, покр. оболочкой: 30 или 50 шт. жевательные: 30 или 60 шт.
жевательные: 30 или 60 шт. , покр. оболочкой: 30, 60, 90 или 100 шт.
, покр. оболочкой: 30, 60, 90 или 100 шт. : 30 или 100 шт.
: 30 или 100 шт. , покр. оболочкой: 30 шт.
, покр. оболочкой: 30 шт. , покр. пленочной оболочкой: 30 или 60 шт.
, покр. пленочной оболочкой: 30 или 60 шт. : 30 или 100 шт.
: 30 или 100 шт.