Медь конфигурация: Таблица менделеева — Электронный учебник K-tree
Содержание
Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную
электронную конфигурацию.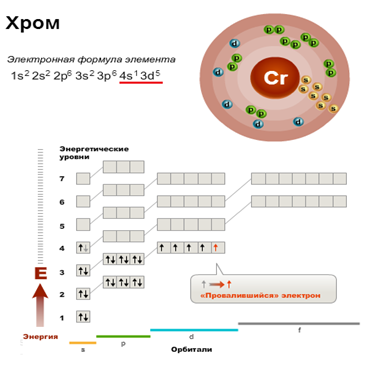
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев
сайта.
Строение атома и электронные конфигурации 1.0
На этой странице вы узнаете
- Чем атом похож на Солнечную систему?
- Один водород, но три лучше: что такое изотопы?
- Как умеет скакать электрон?
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц. У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.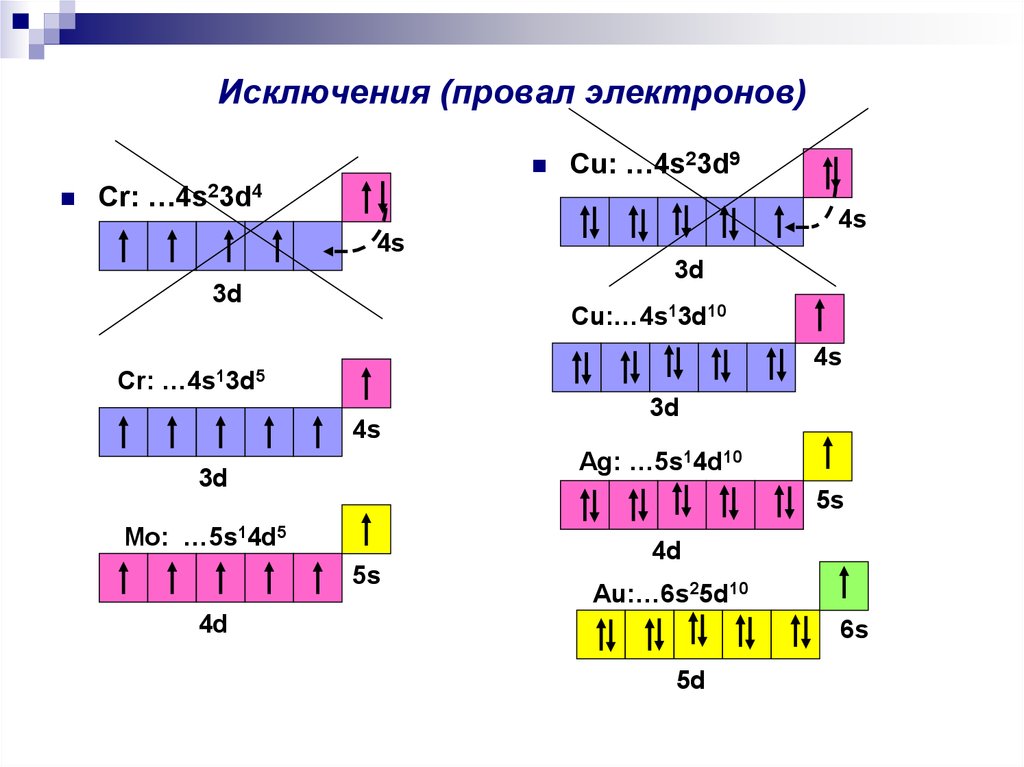
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
| Чем атом похож на Солнечную систему? Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. |
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.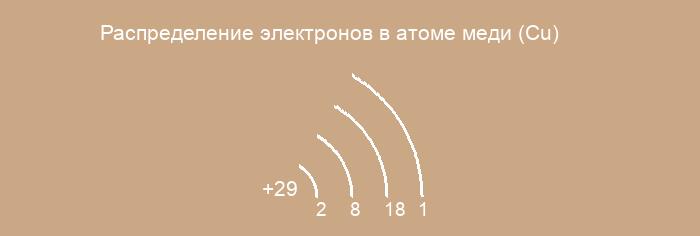
Каждая из элементарных частиц в атоме имеет свой заряд и массу:
Характеристика элементарных частиц
Из таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.
Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий.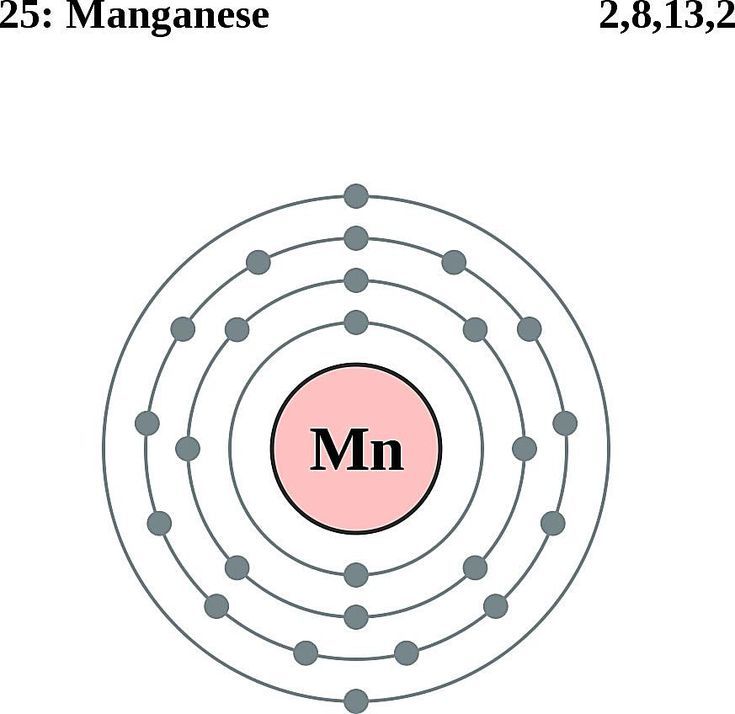 Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
| Один водород, но три лучше: что такое изотопы? Изотопы — атомы одного химического элемента с разным числом нейтронов: равные заряды ядра, равное число e и p, но разное число n! |
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
| Порядковый номер элемента = число протонов в ядре = заряд ядра атома = число электронов в атоме (№ элемента = p = Z = ē) Число нейтронов = массовое число – порядковый номер (n = Ar — № элемента) |
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.

- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.
На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.
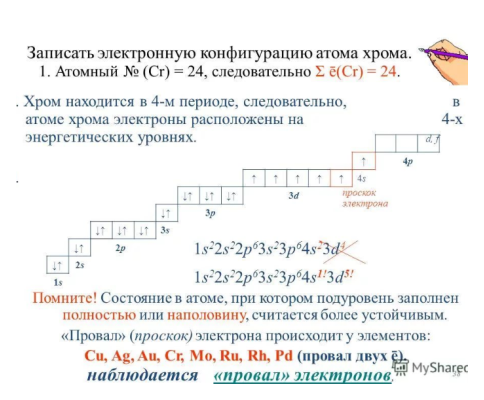
Атомные подуровни заполняются электронами в порядке увеличения их энергии.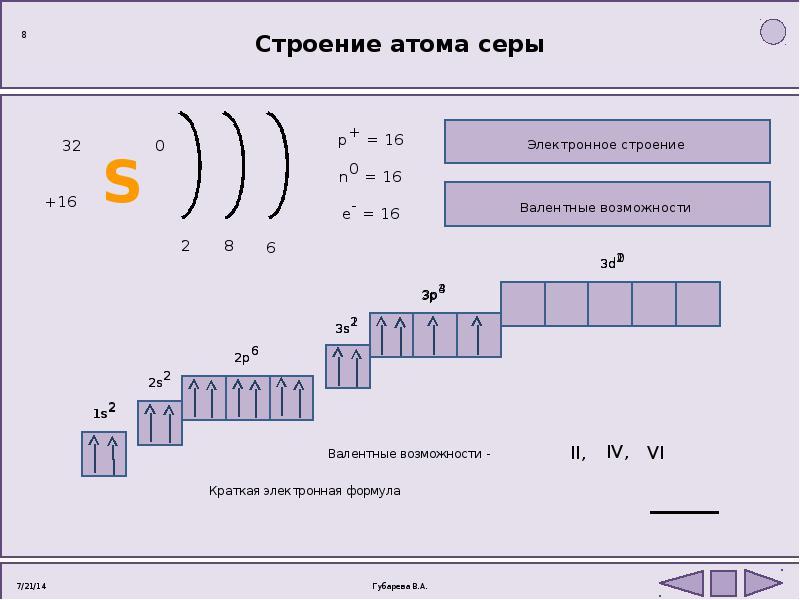 Этот порядок выглядит следующим образом:
Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
Проскок электрона
| Как умеет скакать электрон? Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация. |
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень.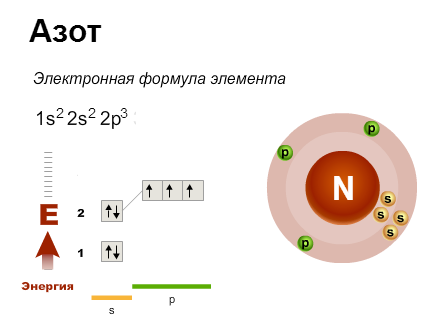 В результате, конфигурация меди выглядит как 3d104s11
В результате, конфигурация меди выглядит как 3d104s11
| Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9. Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.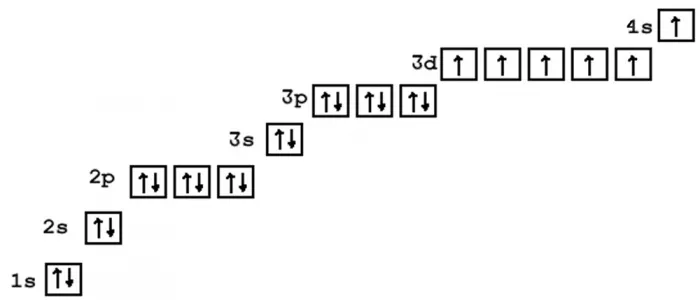
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.
Проверь себя
Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
- Натрия
- Алюминия
- Ксенона
- Меди
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
Какова электронная конфигурация меди (Cu, Cu+ и Cu2+)?
Chemistry Wall » Неорганическая химия » Атомная структура » Какова электронная конфигурация меди (Cu, Cu+ и Cu2+)?
Написано CM Jana Последнее обновление
В этой статье объясняется электронная конфигурация меди и как написать электронную конфигурацию атома меди (Cu).
Электронная конфигурация меди
Электронная конфигурация атома меди (Cu) (атомный номер 29))
Атомный номер меди (Cu) = 29
Итак, давайте начнем писать электронную конфигурацию меди (Cu) на основе принципа Ауфбау. Согласно принципу Ауфбау, «орбитали заполняются электронами в порядке возрастания их энергии, т. е. орбитали с наименьшей энергией заполняются первыми, а орбитали с наибольшей энергией заполняются в конце». Порядок заполнения орбиты показан на следующей диаграмме.
- Согласно принципу Ауфбау, первые два электрона меди (Cu) заняты на 1s-орбитали.
- Затем следующие два электрона меди (Cu) занимают 2s-орбиталь.
- И следующие 6 электронов для меди (Cu) перейдут на 2р-орбиталь.
- Затем следующие два электрона идут в тройках.
- Далее следующие 6 электронов перейдут на 3р-орбиталь.

- Следуя тому же правилу принципа Ауфбау, из оставшихся 11 электронов два электрона размещены на 4s-орбитали, а 9 электронов размещены на 3d-орбитали. Таким образом, ожидаемая электронная конфигурация меди (Cu) будет следующей:
The expected electronic configuration of Copper (Cu): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9
However, половина – заполнены или полностью заполнены орбитали более стабильны из-за симметричного распределения электронов. Следовательно, один из 4s 2 электронов атома меди (Cu) перескакивает на 3d 9 для достижения полностью -заполненной трехмерной орбитали. Таким образом, правильная электронная конфигурация атома Меди (Cu) будет следующей:
Правильная электронная конфигурация Меди (Cu): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10
Окончательный ответ
Электронная конфигурация атома меди (Cu) (29): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10
This electronic configuration also can be written as [Ar] 4s 1 3d 10
Electronic Configuration of Cu
+ (Atomic Number 28)
The atomic number of the Cu + is 28.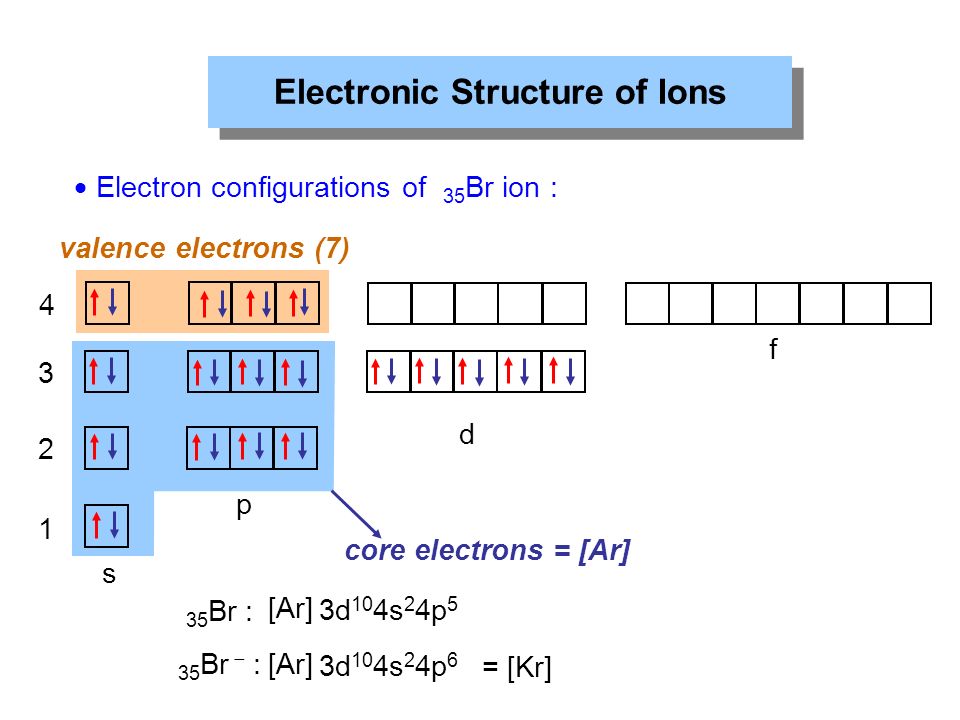
The electronic configuration of Cu + : 1s 2 2s 2 2p 6 3S 2 3P 6 3D 10
Электронная конфигурация CU
2+ (атомный номер 27)
. Электронное число 2 IS 27.
CU 2+ : 1S 2 2S 2 2P 6 3S 2 3P 6 3D
Файлена по номеру: ATOMIC
9030
. СМ Яна. Я основатель chemwall.com. Я защитил докторскую диссертацию. в вычислительной химии. Вы также можете найти меня на сайтах uppercareers.com и wpnewblogger.com. Подпишитесь на меня в Твиттере @cmjanaofficial
Взаимодействие с читателем
Медь(Cu) Электронная конфигурация и орбитальная диаграмма
Медь является 29-м элементом в периодической таблице, и ее символ — «Cu». Общее число электронов в меди равно двадцати девяти. Эти электроны расположены по определенным правилам разных орбит. Расположение электронов на различных орбитах и орбиталях атома в определенном порядке называется электронной конфигурацией. Электронная конфигурация атома меди может быть выполнена двумя способами.
Общее число электронов в меди равно двадцати девяти. Эти электроны расположены по определенным правилам разных орбит. Расположение электронов на различных орбитах и орбиталях атома в определенном порядке называется электронной конфигурацией. Электронная конфигурация атома меди может быть выполнена двумя способами.
- Электронная конфигурация по орбите (принцип Бора)
- Электронная конфигурация по орбитали (принцип Ауфбау)
Электронная конфигурация по орбитали следует другим принципам. Например, принцип Ауфбау, принцип Хунда и принцип запрета Паули. Электронная конфигурация и орбитальная диаграмма меди являются основной темой этой статьи. Также обсуждались валентность и валентные электроны меди, образование соединений и образование связей. Надеюсь, прочитав эту статью, вы узнаете об этом подробно.
Содержание
Электронная конфигурация атома меди на орбите
Ученый Нильс Бор первым дал представление об орбите атома. Он представил модель атома в 1913 году.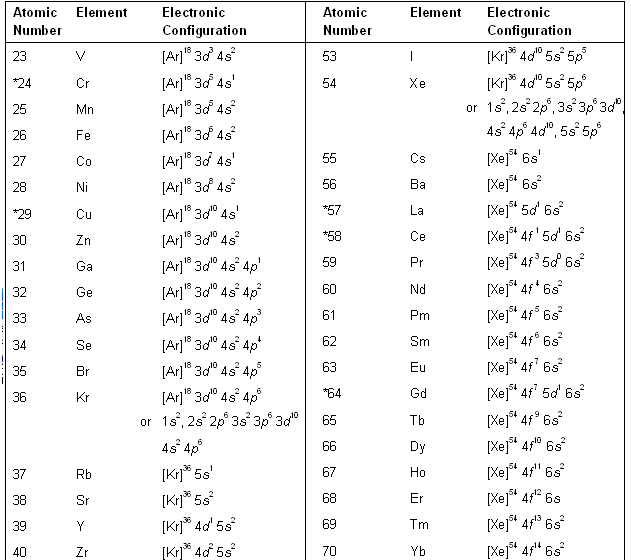 Там дается полное представление об орбите. Электроны атома вращаются вокруг ядра по определенной круговой траектории. Эти круговые пути называются орбитами (оболочками). Эти орбиты выражаются через n. [n = 1,2,3,4 . . . Порядковый номер орбиты]
Там дается полное представление об орбите. Электроны атома вращаются вокруг ядра по определенной круговой траектории. Эти круговые пути называются орбитами (оболочками). Эти орбиты выражаются через n. [n = 1,2,3,4 . . . Порядковый номер орбиты]
K — название первой орбиты, L — второй, M — третьей, N — название четвертой орбиты. Электронная удерживающая способность каждой орбиты составляет 2n 2 .
| Shell Number (n) | Shell Name | Electrons Holding Capacity (2n 2 ) | ||||
| 1 | K | 2 | ||||
| 2 | L | 8 | ||||
| 3 | M | 18 | ||||
| 4 | N | 32 |
| Orbit Number | Value of ‘l’ | Number of subshells | Number of orbital | Subshell name | Electrons holding capacity | Electron configuration |
| 1 | 0 | 1 | 1 | 1s | 2 | 1s 2 |
| 2 | 0 1 | 2 | 1 3 | 2s 2p | 2 6 | 2s 2 2p 6 |
| 3 | 0 1 2 | 3 | 1 3 5 | 3s 3p 3d | 2 6 10 | 3s 2 3p 6 3d 10 |
| 4 | 0 1 2 3 | 4 | 1 3 5 7 | 4s 4p 4d 4f | 2 6 10 14 | 4s 2 4p 6 4d 10 4f 14 |
Orbital number of the subshell
Например,
- Если n = 1,
(n – 1) = (1–1) = 0
Следовательно, значение «l» равно 0. Таким образом, уровень подэнергии равен 1 с.
Таким образом, уровень подэнергии равен 1 с. - Если n = 2,
(n – 1) = (2–1) = 1.
Следовательно, значение «l» равно 0, 1. Таким образом, подэнергетические уровни равны 2s и 2p. - Если n = 3,
(n – 1) = (3–1) = 2.
Следовательно, значение ‘l’ равно 0, 1, 2. Итак, подэнергетические уровни 3s, 3p, и 3д. - Если n = 4,
(n – 1) = (4–1) = 3
Следовательно, значение ‘l’ равно 0, 1, 2, 3. Итак, подэнергетические уровни 4s, 4p , 4d и 4f. - Если n = 5,
(n – 1) = (n – 5) = 4.
Следовательно, l = 0,1,2,3,4. Количество подоболочек будет 5, но 4s, 4p, 4d и 4f в этих четырех подоболочках можно расположить электроны всех элементов таблицы Менделеева.
| Название подсэлл | Имя Источник | Значение ‘L’ | Значение ‘M’ (0 до ± L) 9 1111111111111111111111111111111111111114.  ) ) | Electrons holding capacity 2(2l+1) | |
| s | Sharp | 0 | 0 | 1 | 2 |
| p | Principal | 1 | − 1, 0, +1 | 3 | 6 |
| d | Diffuse | 2 | −2, −1, 0, +1, +2 | 5 | 10 |
| f | Fundamental | 3 | −3, −2, −1, 0, +1, +2, +3 | 7 | 14 |
Количество электронов на орбитали
Орбитальный номер s-подоболочки один, три в p-подоболочка, пять в d-подоболочке и семь в f-подоболочке. Каждая орбиталь может иметь максимум два электрона. Подэнергетический уровень «s» может содержать максимум два электрона, «p» может содержать максимум шесть электронов, «d» может содержать максимум десять электронов, а «f» может содержать максимум четырнадцать электронов.
Каждая орбиталь может иметь максимум два электрона. Подэнергетический уровень «s» может содержать максимум два электрона, «p» может содержать максимум шесть электронов, «d» может содержать максимум десять электронов, а «f» может содержать максимум четырнадцать электронов.
Электронная конфигурация через принцип Aufbau
Aufbau — это немецкое слово, означающее наращивание. Основными сторонниками этого принципа являются ученые Нильс Бор и Паули. Метод Ауфбау заключается в том, чтобы выполнить конфигурацию электрона через подэнергетический уровень. Принцип Ауфбау заключается в том, что электроны, присутствующие в атоме, сначала завершат орбиталь с самой низкой энергией, а затем постепенно продолжат завершать орбиталь с более высокой энергией.
Энергия орбитали рассчитывается по значению главного квантового числа «n» и азимутального квантового числа «l». Орбиталь, для которой значение (n + l) ниже, является орбиталью с низкой энергией, и электрон выйдет на эту орбиталь первым.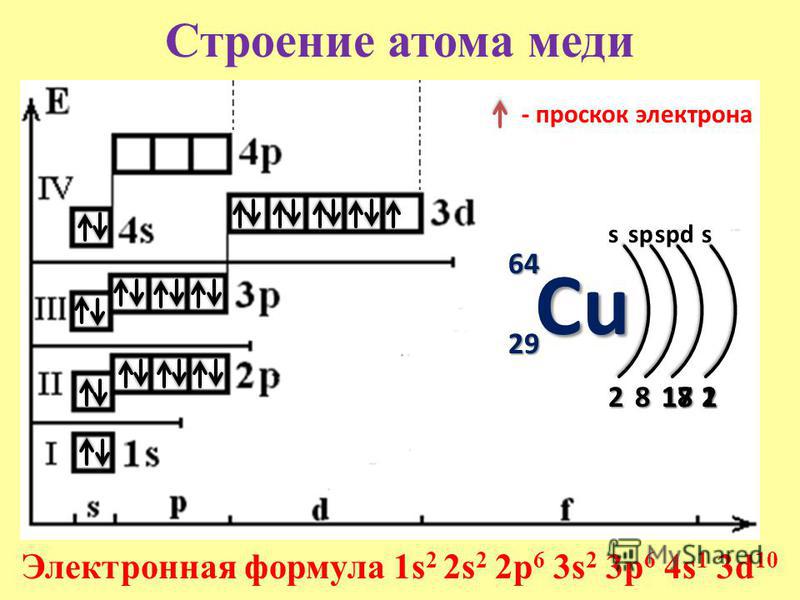
| Orbital | Orbit (n) | Azimuthal quantum number (l) | Orbital energy (n + l) |
| 3d | 3 | 2 | 5 |
| 4s | 4 | 0 | 4 |
Энергия орбитали
Здесь энергия 4s-орбитали меньше энергии 3d. Таким образом, электрон сначала попадет на 4s-орбиталь, а затем перейдет на 3d-орбиталь, когда 4s-орбиталь будет заполнена. Метод ввода электронов на орбитали по принципу Ауфбау: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
Первые два электрона меди выходят на 1s-орбиталь. На s-орбитали может быть максимум два электрона.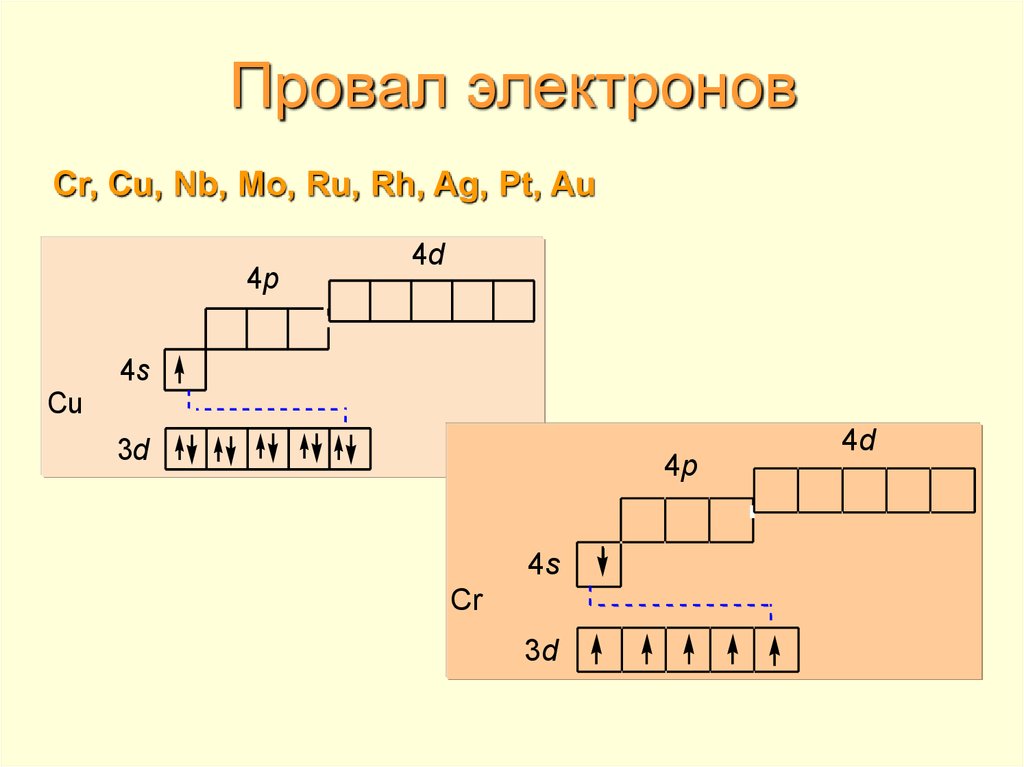 Следовательно, следующие два электрона переходят на 2s-орбиталь. На p-орбитали может быть максимум шесть электронов. Итак, следующие шесть электронов переходят на 2р-орбиталь.
Следовательно, следующие два электрона переходят на 2s-орбиталь. На p-орбитали может быть максимум шесть электронов. Итак, следующие шесть электронов переходят на 2р-орбиталь.
Вторая орбита заполнена. Итак, оставшиеся электроны выйдут на третью орбиту. Тогда два электрона выйдут на 3s-орбиталь, а следующие шесть электронов окажутся на 3p-орбитали третьей орбитали. Теперь орбиталь 3p заполнена. Итак, следующие два электрона перейдут на 4s-орбиталь, а оставшиеся девять электронов перейдут на 3d-орбиталь.
Электронная конфигурация меди
Но орбиталь хочет быть наполовину или полностью заполненной электронами. Потому что атом может находиться в более стабильном состоянии, когда орбиталь заполнена наполовину и полностью заполнена. Следовательно, электрон с 4s-орбиталью завершает полностью заполненную 3d-орбиталь, перескакивая на 3d-орбиталь. Таким образом, полная электронная конфигурация меди будет следующей: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 8 1
7 1.
7
Примечание: Короткая электронная конфигурация меди [Ar] 3d 10 4s 1 . При записи электронной конфигурации вы должны писать последовательно.
Электронная конфигурация для иона меди (Cu + , Cu 2+ )Как написать орбитальную диаграмму для меди?
Чтобы построить орбитальную диаграмму атома, вам сначала нужно знать принцип Хунда и принцип запрета Паули. Принцип Хунда состоит в том, что электроны на разных орбиталях с одинаковой энергией будут располагаться таким образом, чтобы они могли находиться в неспаренном состоянии максимального числа, и спин неспаренных электронов был бы однонаправленным.
Принцип запрета Паули состоит в том, что значения четырех квантовых чисел двух электронов в атоме не могут быть одинаковыми. Чтобы написать орбитальную диаграмму меди (Cu), вы должны сделать электронную конфигурацию меди. О чем подробно говорилось выше. 1s — ближайшая к ядру орбиталь с наименьшей энергией. Следовательно, электрон сначала выйдет на 1s-орбиталь.
Согласно принципу Хунда, первый электрон войдет по часовой стрелке, а следующий электрон войдет на 1s-орбиталь против часовой стрелки. Орбиталь 1s теперь заполнена двумя электронами. Затем следующие два электрона перейдут на 2s-орбиталь точно так же, как и на 1s-орбиталь.
Медная орбитальная диаграмма
Следующие три электрона войдут на 2p-орбиталь по часовой стрелке, а следующие три электрона войдут на 2p-орбиталь в направлении против часовой стрелки. Затем следующие два электрона перейдут на 3s-орбиталь, как и на 1s-орбиталь, а затем следующие шесть электронов перейдут на 3p-орбиталь, как и на 2p-орбиталь.
Теперь орбиталь 3p заполнена. Следовательно, следующие пять электронов войдут на 3d-орбиталь по часовой стрелке, а следующие пять электронов войдут в 3d-орбиталь против часовой стрелки. Трехмерная орбиталь теперь заполнена. Итак, следующий электрон выйдет на 4s-орбиталь по часовой стрелке. Это наглядно показано на рисунке орбитальной диаграммы меди.
Атомная орбитальная диаграмма для медииона меди (CU
+ , CU 2+ ) Конфигурация электрона
. СПАСИТЕЛЬНОЕ СОСТОЯНИЕ ЭЛЕКТРОНА МЕППИ 3p 6 3d 10 4s 1 . Эта электронная конфигурация показывает, что на последней оболочке меди есть электрон, а на d-орбитали всего десять электронов. Следовательно, валентные электроны меди едины.
Следовательно, валентные электроны меди едины.
Существует два типа ионов меди. Атом меди имеет ионы Cu + и Cu 2+ . Атом меди отдает электрон на 4s-орбитали, образуя ион меди (Cu + ).
CU — E — → CU +
Здесь, конфигурация электронов иона меди (CU + ) — 1S 2 2S 2 2P 6 2 2 2 2P 6 2 2 2 2P 6 2 2 2 2P 6 2 2 2 2P 6 2 2 2 2P 6 2 2 2 2. 3д 10 . С другой стороны, атом меди отдает электрон на 4s-орбитали и электрон на 3d-орбитали, чтобы преобразовать ион меди (Cu 2+ ).
Атомный номер, атомный вес и заряд иона меди. 6 3s 2 3p 6 3d 9 . Атомы меди проявляют степени окисления +1 и +2. Степень окисления элемента изменяется в зависимости от образования связи.

 0003
0003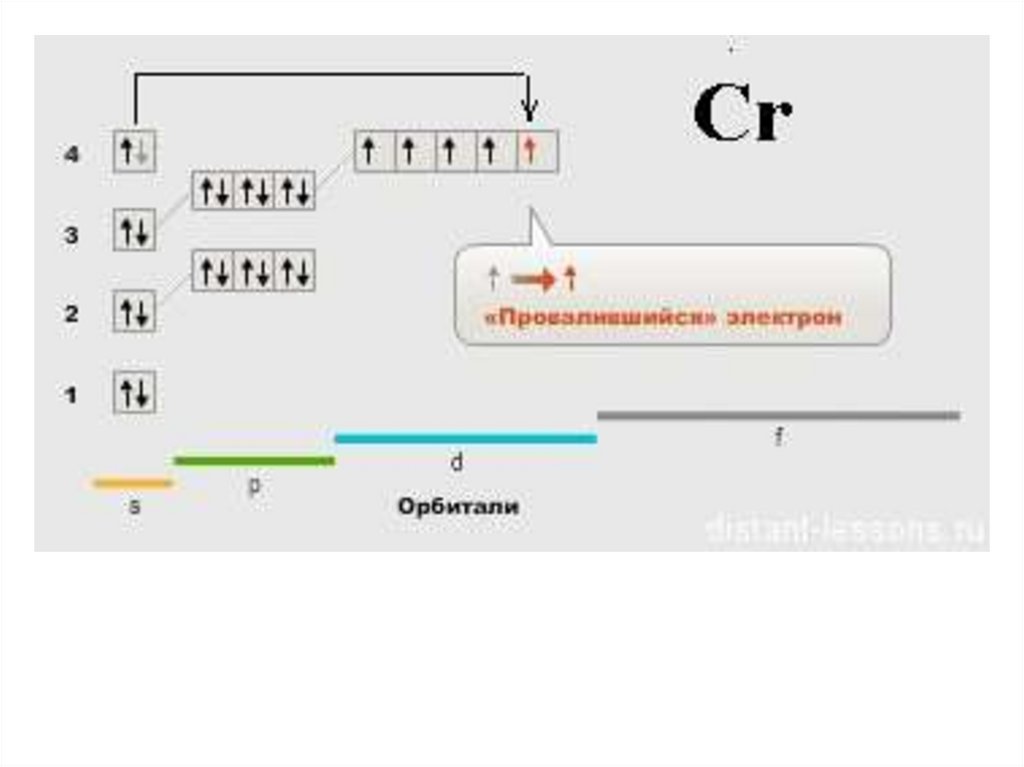 Следовательно, порядок числа электронов в каждой оболочке атома меди(Cu) равен 2, 8, 18, 1,9.0003
Следовательно, порядок числа электронов в каждой оболочке атома меди(Cu) равен 2, 8, 18, 1,9.0003