Медь конфигурация: 9 фактов, которые вы должны знать! —
Содержание
9 фактов, которые вы должны знать! —
By Вишнуприя Тадури
Медь, переходный металл с символом Cu и атомным номером 29, является элементом d-блока в периодической таблице. Обсудим электронную конфигурацию Cu.
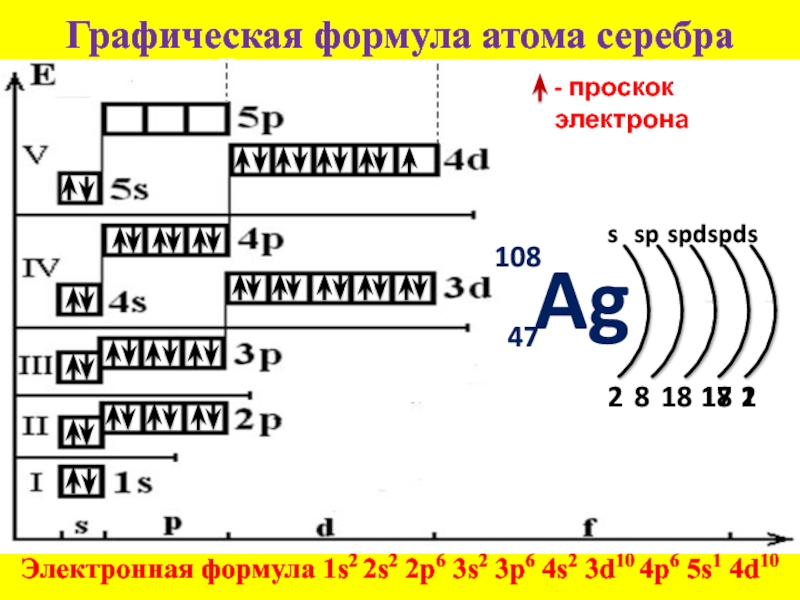
Электронная конфигурация меди: 1s2 2s2 2p6 3s2 3p6 4s1 3d10.Cu имеет уникальную полностью заполненную трехмерную конфигурацию в основном состоянии и поэтому обладает уникальными физическими и химическими свойствами. Он имеет типичную ГЦК-структуру и представляет собой металл красновато-коричневого цвета с отличной тепло- и электропроводностью.
Медь содержится в большом количестве в различных минералах. Давайте сосредоточимся на уникальной электронной конфигурации Cu в основном состоянии, а также на орбитальной диаграмме и электронных обозначениях.
Давайте сосредоточимся на уникальной электронной конфигурации Cu в основном состоянии, а также на орбитальной диаграмме и электронных обозначениях.
Как написать медно-электронную конфигурацию
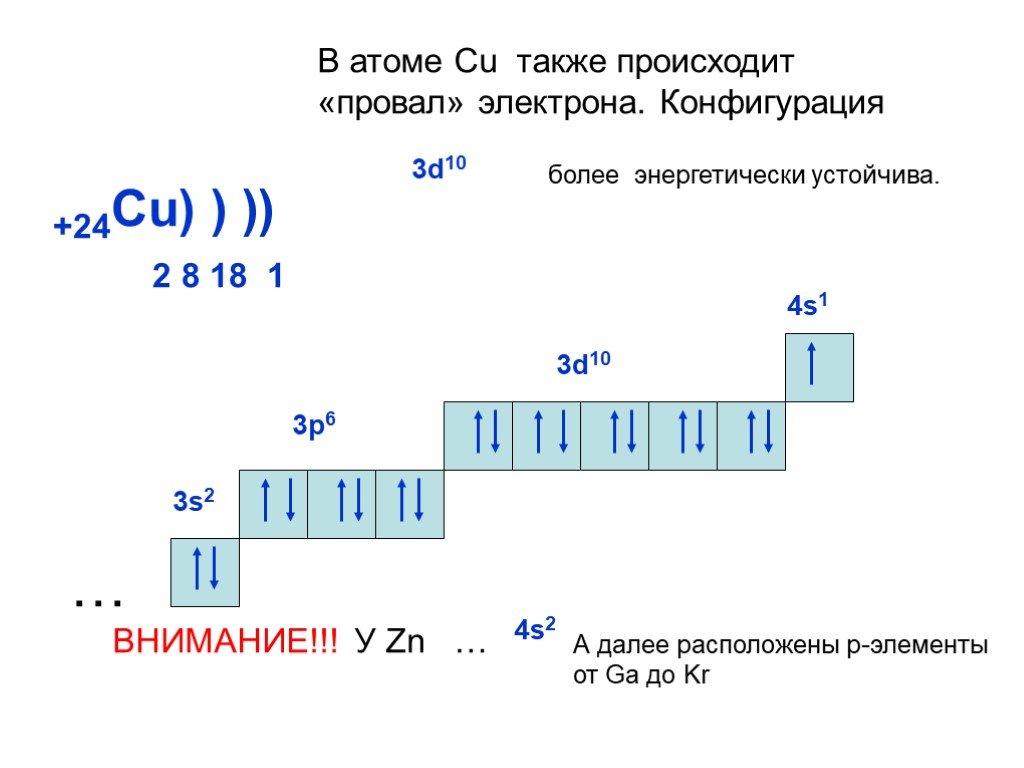
Медь является элементом четвертого периода 11-й группы и имеет 29 электронов.
- Первым шагом является указание энергетического уровня электронов и количества электронов, присутствующих на каждой орбитали (s, p, d, f). Cu имеет 4 электронных уровня и 3 орбитали за счет возрастания энергии оболочек по закону Принцип ауфбау.
- Электронная конфигурация меди записывается как – 1s2 2s2 2p6 3s2 3p6 4s2 3d9
- В подоболочке 9d 3 электронов.
 Следовательно, один из 4s-электронов перемещается на подоболочку 3d, чтобы обрести устойчивость. Электронная конфигурация меди после Правило Хунда Принцип исключения Паули есть – 1с2 2s2 2p6 3s2 3p6 4s1 3d10
Следовательно, один из 4s-электронов перемещается на подоболочку 3d, чтобы обрести устойчивость. Электронная конфигурация меди после Правило Хунда Принцип исключения Паули есть – 1с2 2s2 2p6 3s2 3p6 4s1 3d10
- Мы видим, что электрон с 4s-орбитали переходит на 3d-орбиталь (поскольку полностью заполненная d-подоболочка более стабильна), даже если он находится на более высоком энергетическом уровне. Это исключение из принципа Ауфбау известно как «исключение Ауфбау» или «аномалия Ауфбау».
- Окончательная электронная конфигурация Cu, соответствующая всем трем правилам, такова: 1s2 2s2 2p6 3s2 3p6 4s1 3d10
Диаграмма конфигурации медных электронов
Диаграмма электронной конфигурации Cu, расположенная в соответствии с восходящими энергетическими уровнями в соответствии с принципом Ауфбау, со стрелками, указывающими электроны, выглядит следующим образом:Диаграмма электронной конфигурации Cu
Обозначение конфигурации медных электронов
Обозначение электронной конфигурации меди: [Ar]. 4s1 3d10. В обозначениях [Ar] представляет собой электронную конфигурацию аргона, которая является предыдущей благородный газ. Таким образом, обозначение указывает на то, что 18 электронов Ar присутствуют в конфигурации меди, а добавляются только оставшиеся 11 электронов.
4s1 3d10. В обозначениях [Ar] представляет собой электронную конфигурацию аргона, которая является предыдущей благородный газ. Таким образом, обозначение указывает на то, что 18 электронов Ar присутствуют в конфигурации меди, а добавляются только оставшиеся 11 электронов.
Электронная конфигурация меди без сокращений
Полная электронная конфигурация меди записывается как 1s2 2s2 2p6 3s2 3p6 3d10 4s1. Таким образом, в Cu электронов на оболочку равно 2, 8, 18, 1. Подоболочка 4s в Cu заполнена лишь частично, а подоболочка 3d заполнена полностью. Это исключение из нормального порядка заполнения электронами.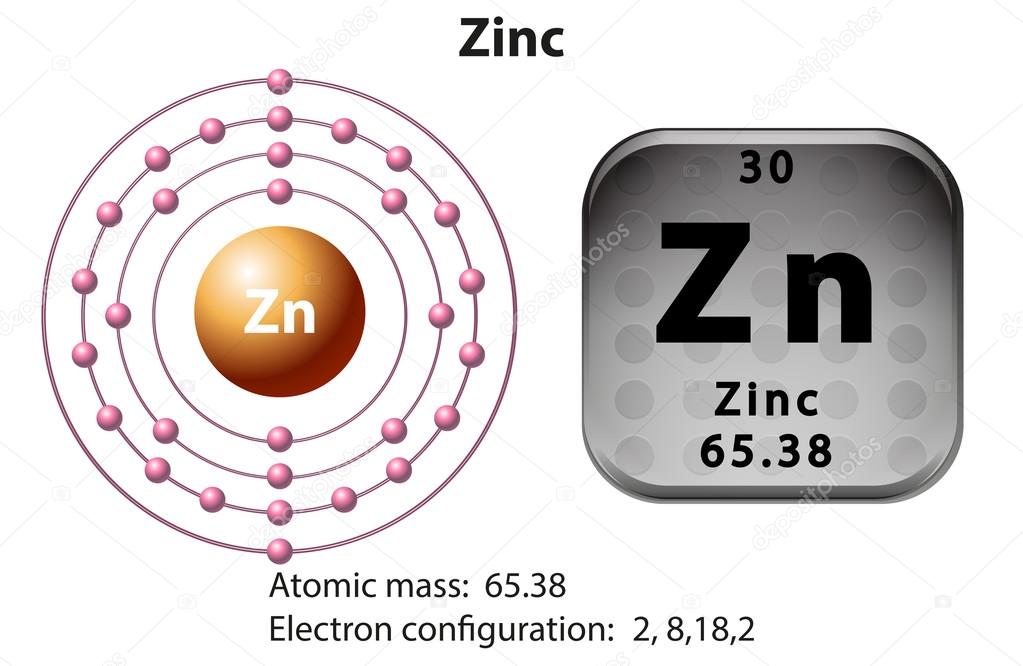
Медно-электронная конфигурация в основном состоянии
- Электронная конфигурация меди в основном состоянии записывается как 1s2 2s2 2p6 3s2 3p6 3d10 4s1
- Медь является элементом d-блока. Тот факт, что энергия подоболочки 3d в Cu немного ниже, чем у подоболочки 4s, приводит к тому, что электроны сначала заполняют подоболочку 3d. Более того, полностью заполненная трехмерная орбиталь более стабильна.
Электронная конфигурация меди в основном состоянии
Возбужденное состояние электронной конфигурации меди
Наиболее распространенная электронная конфигурация меди в возбужденном состоянии: [Ар] 3d9 4s2. Это возбужденное состояние возникает, когда один электрон из 3d переходит в 4s, при этом общее количество электронов в атоме Cu остается прежним.
Это возбужденное состояние возникает, когда один электрон из 3d переходит в 4s, при этом общее количество электронов в атоме Cu остается прежним.
Медная орбитальная диаграмма основного состояния
Орбитальная диаграмма меди в основном состоянии представляет собой распределение 29 электронов на различных атомных орбиталях атома Cu.
- K-оболочка содержит 2 электрона (1s2)
- L-оболочка содержит 8 электронов (2s22p6)
- М-оболочка содержит 18 электронов (3s23p63d10)
- N-оболочка содержит 1 электрон (4s1)
- Орбитальная диаграмма меди будет –
Орбитальная диаграмма меди в основном состоянии
Медь 1-ионная электронная конфигурация
- Электронная конфигурация иона меди 1 такова: [Ар] 3d10.
- Компания 3d10 конфигурация дает ион меди ( Cu1+) стабильная электронная конфигурация и, таким образом, +1 является наибольшей степенью окисления Cu в химических реакциях.
Исключение конфигурации медных электронов
Медь демонстрирует исключение из ожидаемой электронной конфигурации, основанной на порядке заполнения атомных орбиталей.
- Энергии 3d- и 4s-орбиталей в меди очень близки, поэтому из-за межэлектронного отталкивания 3d-подоболочка сначала заполняется до 4s-подоболочки.
- В основном состоянии электронная конфигурация Cu имеет вид [Ar]. 4s1 3d10, а не ожидаемый [Ar] 4s2 3d9 конфигурация по принципу Ауфбау.

- Вместо этого 4s-орбиталь заполнена лишь частично, и один из ее электронов перемещается в подоболочку 3d, чтобы полностью заполнить ее, что приводит к более стабильной конфигурации.
- Это исключение из принципа Ауфбау известно как «инверсия принципа Ауфбау».
Заключение
Медь является исключительным металлом благодаря своей отличительной конфигурации. Вторая энергия ионизации меди значительно выше первой, так как для удаления второго электрона необходимо ворваться в полностью заполненную подоболочку 3d. Он используется в основном в электропроводке и теплообменниках.
Строение атома и электронные конфигурации 1.0
На этой странице вы узнаете
- Чем атом похож на Солнечную систему?
- Один водород, но три лучше: что такое изотопы?
- Как умеет скакать электрон?
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц. У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).

Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
| Чем атом похож на Солнечную систему? Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. |
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:
Характеристика элементарных частиц
Из таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.
Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
| Один водород, но три лучше: что такое изотопы? Изотопы — атомы одного химического элемента с разным числом нейтронов: равные заряды ядра, равное число e и p, но разное число n! |
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
| Порядковый номер элемента = число протонов в ядре = заряд ядра атома = число электронов в атоме (№ элемента = p = Z = ē) Число нейтронов = массовое число – порядковый номер (n = Ar — № элемента) |
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.
На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
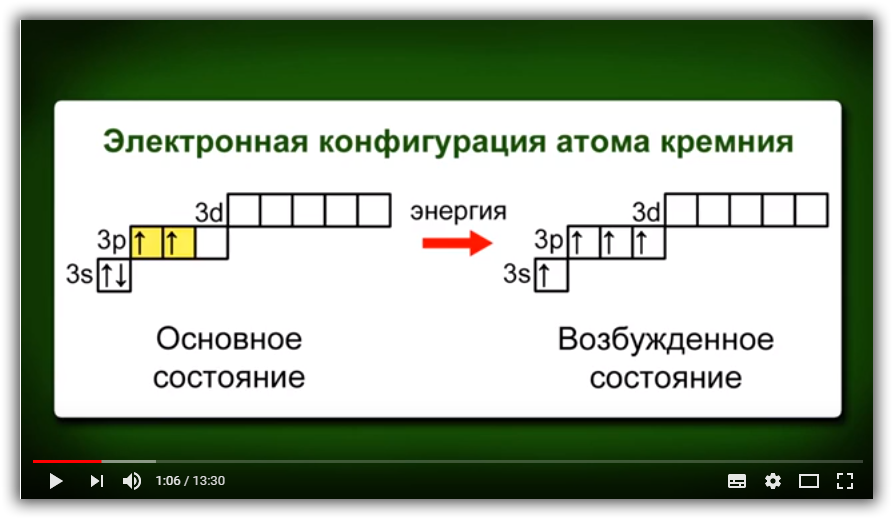
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.
Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
Проскок электрона
| Как умеет скакать электрон? Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация. |
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s11
В результате, конфигурация меди выглядит как 3d104s11
| Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9. Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.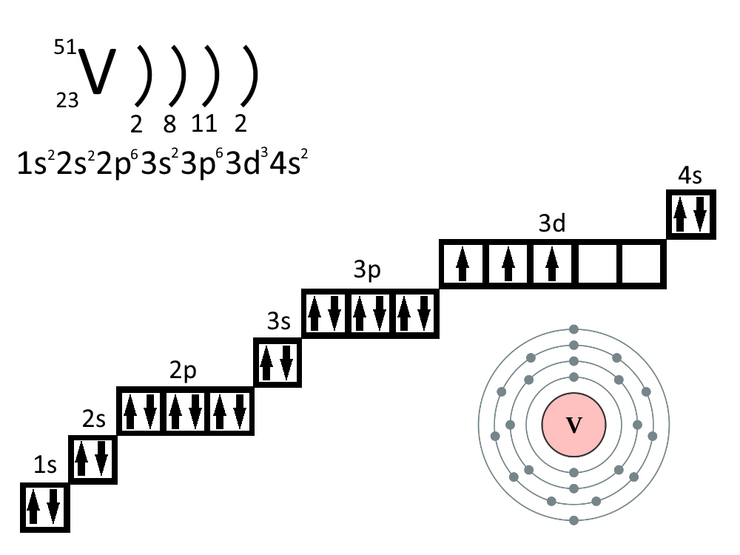
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.

Проверь себя
Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
- Натрия
- Алюминия
- Ксенона
- Меди
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
Какова электронная конфигурация меди (Cu, Cu+ и Cu2+)?
ГЛАВНАЯ » Изучение химии » Неорганическая химия » Какова электронная конфигурация меди (Cu, Cu+ и Cu2+)?
Написано CM Jana Последнее обновление
В этой статье объясняется электронная конфигурация меди и как написать электронную конфигурацию атома меди (Cu).
Электронная конфигурация атома меди (Cu) (атомный номер 29)
Атомный номер меди (Cu) = 29
Итак, давайте начнем писать электронную конфигурацию меди (Cu) на основе принципа Ауфбау. Согласно принципу Ауфбау, «орбитали заполняются электронами в порядке возрастания их энергии, т. е. орбитали с наименьшей энергией заполняются первыми, а орбитали с наибольшей энергией заполняются в конце». Порядок заполнения орбиты показан на следующей диаграмме.
- Согласно принципу Ауфбау, первые два электрона меди (Cu) заняты на 1s-орбитали.
- Затем следующие два электрона меди (Cu) занимают 2s-орбиталь.
- И следующие 6 электронов для меди (Cu) перейдут на 2р-орбиталь.
- Затем следующие два электрона идут в тройках.
- Далее следующие 6 электронов уйдут на 3р-орбиталь.
- Следуя тому же правилу принципа Ауфбау, из оставшихся 11 электронов два электрона размещены на 4s-орбитали, а 9 электронов размещены на 3d-орбитали.
 Таким образом, ожидаемая электронная конфигурация меди (Cu) будет следующей:
Таким образом, ожидаемая электронная конфигурация меди (Cu) будет следующей:
Ожидаемая электронная конфигурация меди (Cu): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9
Однако половина — заполненных или полностью заполненных орбиталей более стабильны из-за симметричного распределения электронов. Следовательно, один из 4s 2 электронов атома меди (Cu) перескакивает на 3d 9 для достижения полностью -заполненной трехмерной орбитали. Таким образом, правильная электронная конфигурация атома Меди (Cu) будет следующей:
Правильная электронная конфигурация Меди (Cu): 1s 2 2s 2 2p 6 3s 2 3 шт. 6 4s 1 3d 10
Окончательный ответ
Электронная конфигурация атома меди (Cu) (29) 035 10
Эта электронная конфигурация также может быть записана как [Ar] 4s 1 3d 10
Электронная конфигурация Cu
+ (атомный номер 28)
Атомный номер Cu + равен 28.
900 02 Электронная конфигурация Cu + : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10
Электронная конфигурация Cu 90 035 2+
(Атомный номер 27)
Атомный номер Cu 2+ равен 27.
Электронная конфигурация Cu 2+ : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9
Рубрики: Неорганическая химия
О КМ Яна
Привет, я СМ Яна. Здесь я люблю делиться свежими статьями, связанными с высшим образованием и вариантами карьеры. Вы также можете найти меня на сайтах chemistrywall.com, wpnewblogger.com. Подпишитесь на меня в Твиттере @cmjanaofficial
9 фактов, которые вы должны знать! —
Вишнуприя Тадури
Медь, переходный металл с символом Cu и атомным номером 29, является элементом d-блока в периодической таблице. Обсудим электронную конфигурацию Cu.
Обсудим электронную конфигурацию Cu.
Электронная конфигурация меди: 1с 2 2с 2 2п 6 900 1 3д 10 . Cu имеет уникальную полностью заполненную трехмерную конфигурацию в основном состоянии и поэтому обладает уникальными физическими и химическими свойствами. Он имеет типичную ГЦК-структуру и представляет собой металл красновато-коричневого цвета с отличной тепло- и электропроводностью.
Медь в изобилии содержится в различных минералах. Давайте сосредоточимся на уникальной электронной конфигурации Cu в основном состоянии, а также на орбитальной диаграмме и электронных обозначениях.
Как записать электронную конфигурацию меди
Медь является элементом четвертого периода 11-й группы и имеет 29 электронов.
- Первым шагом является указание энергетического уровня электронов и количества электронов, присутствующих на каждой орбитали (s, p, d, f). Cu имеет 4 электронных уровня и 3 орбитали, исходя из возрастания энергии оболочек по Принцип Ауфбау .
- Электронная конфигурация меди записывается как – 1с 2 2с 2 2p 6 3s 2 3p 6 4s 2 3d 9 9003 0
- В подоболочке 3d 9 электронов. Следовательно, один из 4s-электронов перемещается на подоболочку 3d, чтобы обрести устойчивость. Электронная конфигурация меди согласно правилу Хунда и принципу исключения Паули – 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10
- Мы видим, что электрон с 4s-орбитали переходит на 3d-орбиталь (поскольку полностью заполненная d-подоболочка более стабильна), хотя и находится на более высоком энергетическом уровне.
 Это исключение из принципа Ауфбау известно как «исключение Ауфбау» или «аномалия Ауфбау».
Это исключение из принципа Ауфбау известно как «исключение Ауфбау» или «аномалия Ауфбау».
- Окончательная электронная конфигурация Cu по всем трем правилам: 2 2p 6 3s 2 3p 6 4s 1 3d 10 9 0030
Схема конфигурации медных электронов
Диаграмма электронной конфигурации меди, расположенная в соответствии с восходящими энергетическими уровнями в соответствии с принципом Ауфбау, со стрелками, указывающими на электроны, выглядит следующим образом: Обозначение электронной конфигурации меди: [Ar] 4s 1 3d 10 . В обозначениях [Ar] представляет собой электронную конфигурацию аргона, которая является предыдущим благородный газ .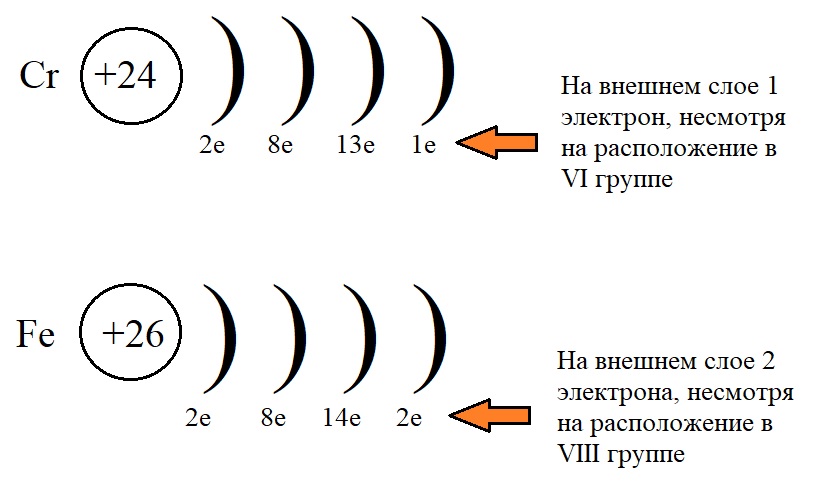 Таким образом, обозначение указывает на то, что 18 электронов Ar присутствуют в конфигурации меди, а добавляются только оставшиеся 11 электронов.
Таким образом, обозначение указывает на то, что 18 электронов Ar присутствуют в конфигурации меди, а добавляются только оставшиеся 11 электронов.
Электронная конфигурация меди без сокращений
Полная электронная конфигурация меди записывается как 1s 2 9002 9 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 . Таким образом, в Cu электронов на оболочку равно 2, 8, 18, 1. Подоболочка 4s в Cu заполнена лишь частично, а подоболочка 3d заполнена полностью. Это исключение из нормального порядка заполнения электронами.
Электронная конфигурация меди в основном состоянии
- Электронная конфигурация меди в основном состоянии записывается как 1с 2 2с 2 2п 6 900 10 4s 1
- Медь является элементом d-блока.
 Тот факт, что энергия подоболочки 3d в Cu немного ниже, чем у подоболочки 4s, приводит к тому, что электроны сначала заполняют подоболочку 3d. Более того, полностью заполненная трехмерная орбиталь более стабильна.
Тот факт, что энергия подоболочки 3d в Cu немного ниже, чем у подоболочки 4s, приводит к тому, что электроны сначала заполняют подоболочку 3d. Более того, полностью заполненная трехмерная орбиталь более стабильна.
Электронная конфигурация меди в основном состоянии
Электронная конфигурация меди в возбужденном состоянии
9 4с 2 . Это возбужденное состояние возникает, когда один электрон из 3d переходит в 4s, при этом общее количество электронов в атоме Cu остается прежним.
Орбитальная диаграмма меди в основном состоянии
Орбитальная диаграмма меди в основном состоянии представляет собой распределение 29 электронов на различных атомных орбиталях атома Cu.
- K-оболочка содержит 2 электрона (1s 2 )
- L-оболочка содержит 8 электронов (2s 2 2р 6 )
- М-оболочка содержит 18 электронов (3s 2 3p 6 3d 10 )
- N-оболочка содержит 1 электрон (4s 1 )
- Орбитальная Диаграмма меди будет:0030 [Ar] 3d 10 .

- Конфигурация 3d 10 дает ион меди (Cu 1+ ) имеет стабильную электронную конфигурацию и, таким образом, +1 является наиболее высокой степенью окисления Cu в химических реакциях.
Исключение электронной конфигурации меди
Медь демонстрирует исключение из ожидаемой электронной конфигурации, основанное на порядке заполнения атомных орбиталей.
- Энергии 3d- и 4s-орбиталей в меди очень близки, поэтому из-за межэлектронного отталкивания 3d-подоболочка сначала заполняется до 4s-подоболочки.
- Электронная конфигурация Cu в основном состоянии [Ar] 36 вместо ожидаемого [Ar] 4s 2 3d 9 Конфигурация по принципу Ауфбау.