Медь описание химического элемента: строение атома, получение, физические и химические свойства — урок. Химия, 11 класс.
Содержание
Краткий спектр жизненно необходимых химических элементов в ВОЛОСАХ (9 элементов: кальций, медь, железо, йод, магний, селен, цинк, кремний, германий) с заключением
Артикул: 6252
Анализ доступен:
Медицинский центр на площади Стачек, 5Медицинский центр на Богатырском пр., 4Лабораторный терминал на пр. Александровской Фермы, 8Лабораторный терминал на пр. Наставников, 36к2Лабораторный терминал на ул. Будапештская, 6Медицинский центр на Пулковском шоссе, 28А Медицинский центр на Кондратьевском пр., 62к3Медицинский центр на пр. Просвещения, 14к4Медицинский центр на ул. Моисеенко, 5Лабораторный терминал на ул. Олеко Дундича, 8, к. 2Лабораторный терминал на ул. Пестеля, 25АМедицинский центр на Ленинском пр., 88Лабораторный терминал на ул. Турку, 5/13г. Санкт-Петербург, Выездная службаМедицинский центр на ул. Савушкина, д. 14
Наставников, 36к2Лабораторный терминал на ул. Будапештская, 6Медицинский центр на Пулковском шоссе, 28А Медицинский центр на Кондратьевском пр., 62к3Медицинский центр на пр. Просвещения, 14к4Медицинский центр на ул. Моисеенко, 5Лабораторный терминал на ул. Олеко Дундича, 8, к. 2Лабораторный терминал на ул. Пестеля, 25АМедицинский центр на Ленинском пр., 88Лабораторный терминал на ул. Турку, 5/13г. Санкт-Петербург, Выездная службаМедицинский центр на ул. Савушкина, д. 14
Цена:
3 465 ₽
В корзину
Цена указывается без учета стоимости
взятия биоматериала
Определение концентрации жизненно необходимых химических элементов, используемое для оценки нутриентного статуса и диагностики интоксикации организма.
Синонимы: анализ на жизненно необходимые химические элементы/ calcium, copper, iron, iodine, magnesium, selenium, zinc, silicon, germanium
* актуальную информацию уточняйте в контактном центре по тел. 8 (812) 600-42-00
Накануне забора пробы волос пациент должен вымыть голову обычным косметическим шампунем, не содержащим добавок микроэлементов (в лечебных и некоторых косметических средствах для мытья волос содержатся цинк, селен и др. МЭ) и не должен пользоваться лечебными средствами наружного применения
МЭ) и не должен пользоваться лечебными средствами наружного применения
Похожие анализы
Кадмий в сыворотке
7 дней
от 1 040 ₽
В корзину
Исследование литогенных субстанций с расчетом на креатинин в разовой порции мочи
7 дней (кроме субботы, воскресенья)
от 2 060 ₽
В корзину
Свинец в цельной крови
7 дней
от 830 ₽
В корзину
Анализ минерального состава и структуры мочевых камней и их фрагментов (Инфракрасная спектроскопия)*
до 9 дней
от 2 310 ₽
В корзину
Анионный и катионный состав суточной мочи (калий, натрий, кальций, магний, аммоний, сульфат, фосфат, хлорид, щавелевая кислота, лимонная кислота, мочевая кислота)
до 8 дней
от 3 675 ₽
В корзину
Краткий спектр токсических химических элементов в НОГТЯХ (9 элементов: свинец, ртуть, талий, кадмий, мышьяк, стронций, берилий, алюминий, никель) с заключением
5-6 дней
от 3 150 ₽
В корзину
Краткий спектр токсических химических элементов в ВОЛОСАХ (9 элементов: свинец, ртуть, талий, кадмий, мышьяк, стронций, берилий, алюминий, никель) с заключением
5-6 дня
от 3 150 ₽
В корзину
Краткий спектр жизненно необходимых химических элементов в НОГТЯХ (9 элементов: кальций, медь, железо, йод, магний, селен, цинк, кремний, германий) с заключением
5-6 дней
от 3 150 ₽
В корзину
Краткий спектр жизненно необходимых химических элементов в ВОЛОСАХ (9 элементов: кальций, медь, железо, йод, магний, селен, цинк, кремний, германий) с заключением
5-6 дней
от 3 150 ₽
В корзину
Полный спектр химических элементов в НОГТЯХ (35 элементов) с заключением
5-6 дней
от 4 990 ₽
В корзину
Полный спектр химических элементов в ВОЛОСАХ (35 элементов) с заключением
5-6 дней
от 4 990 ₽
В корзину
Токсические химические элементы в ВОЛОСАХ с заключением
5-6 дней
от 3 715 ₽
В корзину
Жизненно необходимые химические элементы в ВОЛОСАХ с заключением (18 элементов: бор, кальций, кобальт, хром, медь, железо, йод , калий, магний, марганец, молибден, натрий, фосфор, селен, ванадий, цинк , кремний, германий)
5-6 дней
от 3 715 ₽
В корзину
Ртуть (моча)
14-21 день
от 750 ₽
В корзину
Церулоплазмин (сыворотка крови)
1 день
от 555 ₽
В корзину
Цинк (сыворотка крови)
2 дня
от 495 ₽
В корзину
Селен (сыворотка крови)
7 дней
от 1 540 ₽
В корзину
Ртуть (кровь)
14-21 день
от 750 ₽
В корзину
Медь (суточная моча)
7 дней
от 1 385 ₽
В корзину
Медь (сыворотка крови)
2 дня
от 420 ₽
В корзину
Кальций общий (суточная моча)
1 день
от 170 ₽
В корзину
Комплексное исследование фосфорно-кальциевого обмена (кровь и суточная моча)
1 день
от 1 575 ₽
В корзину
Фосфор неорганический (разовая порция)
1 день
от 135 ₽
В корзину
Железо
1 день
от 160 ₽
В корзину
Фосфор неорганический
1 день
от 175 ₽
В корзину
Магний (суточная моча)
1 день
от 135 ₽
В корзину
Магний
1 день
от 220 ₽
В корзину
Кальций общий
1 день
от 190 ₽
В корзину
Анализ доступен в этих центрах:
Медицинский центр на Богатырском пр. , 4
, 4
Медицинский центр на площади Стачек, 5
Медицинский центр на ул. Моисеенко, 5
Медицинский центр на пр. Просвещения, 14к4
Медицинский центр на ул. Савушкина, д. 14
14
Лабораторный терминал на ул. Турку, 5/13
Медицинский центр на Охтинской аллее, 4 (Мурино, Лен. обл.)
Лабораторный терминал на ул. Пестеля, 25А
Лабораторный терминал на ул. Олеко Дундича, 8, к. 2
Олеко Дундича, 8, к. 2
Лабораторный терминал на ул. Будапештская, 6
Медицинский центр на Пулковском шоссе, 28А
Лабораторный терминал на пр. Наставников, 36к2
Лабораторный терминал на пр. Александровской Фермы, 8
Александровской Фермы, 8
Медицинский центр на Ленинском пр., 88
Медицинский центр на Кондратьевском пр., 62к3
Клиника ОРТОКРОСС на 5-ой линии В. О., д. 8А (официальный партнёр)
Лабораторный терминал на Кронверкском пр. , 31 (официальный партнёр)
, 31 (официальный партнёр)
Клиника “ПулковоСтом” на Пулковском шоссе, д.26, к.6. (официальный партнёр)
Лабораторный терминал на ул. Савушкина, 124 (официальный партнёр)
Катоды медные
Назначение и описание
Катоды медные выпускаются по ГОСТ 546, химический состав соответствует ГОСТ 859.
Предназначены для изготовления проволоки, шин, катанки, медных электролитических порошков.
Химический состав
|
Элемент |
Массовая доля, % | |||
|
М1к |
М0к |
М00к | ||
|
Cu |
Медь, не менее |
99,95 |
99,97 |
–* |
|
Примеси, не более: | ||||
|
Bi |
Висмут |
0,001 |
0,0005 |
0,0003** |
|
Sn |
Олово |
0,002 |
0,001 |
– |
|
Ni |
Никель |
0,002*** | ||
|
Fe |
Железо |
0,003 |
0,001 | |
|
Zn |
Цинк |
– | ||
|
As |
Мышьяк |
0,002 |
0,0005 | |
|
P |
Фосфор |
0,0015**** | ||
|
Sb |
Сурьма |
0,0004 | ||
|
Pb |
Свинец |
0,003 |
0,0005 | |
|
Ag |
Серебро |
0,002 |
0,002 | |
|
S |
Cера |
0,004 |
0,0015 | |
|
O2 |
Кислород |
0,02 |
0,015 |
– |
Примечания:
* Знак «–» означает, что данный элемент определяется, но не нормируется.
** Сумма висмута, селена и теллура. Максимальное содержание каждого элемента не должно превышать 0,0002 %.
*** Сумма никеля, цинка, кремния, олова, железа, кобальта.
**** Сумма фосфора, хрома, марганца, мышьяка, кадмия, сурьмы
Упаковка и транспортировка
Катоды формируют в пакеты массой не более 1500 кг и высотой не более 500 мм в соответствии с требованиями ГОСТ 21399. Транспортируют всеми видами крытых транспортных средств.
Гарантийный срок хранения
Срок хранения не ограничен.
Качество
Система менеджмента качества АО «Уралэлектромедь» сертифицирована компанией LRQA на соответствие требованиям ISO 9001:2008.
Системы экологического менеджмента, управления охраной труда и промышленной безопасностью, энергетического менеджмента сертифицированы Ассоциацией по сертификации Русский Регистр на соответствие требованиям международных стандартов ISO 14001:2004, OHSAS 18001:2007, ISO 50001:2011.
Катоды медные АО «Уралэлектромедь» зарегистриров
аны на Лондонской бирже металлов: в 2010 г. под брендом UMMC — отделения электролиза ЦЭМ, в 2013 г. под брендом UMMC II — отделения безосновной технологии нового ЦЭМ.
Продукция зарегистрирована в соответствии с европейским регламентом о безопасности химической продукции REACH.
По вопросам приобретения продукции:
-
Начальник отдела продаж медной продукции ОАО «УГМК» Плотникова Яна Евгеньевна +7 (34368) 9-69-13
Медь – полная информация об элементах
Введение:
Медь считается переходным элементом, в котором задействована d-орбиталь. Он принадлежит к группе 11 th и 4-му периоду таблицы Менделеева. Происхождение названия этого металла может быть получено из aes cyprium , позже измененного на cuprum (латиница). Медь произошла от этого латинского слова. Большинство металлов в d-блоке являются проводниками, изоляторами, а также полупроводниками, которые могут проводить или не проводить электричество.
Медь произошла от этого латинского слова. Большинство металлов в d-блоке являются проводниками, изоляторами, а также полупроводниками, которые могут проводить или не проводить электричество.
По сути, медь — это химический элемент с символом Cu и атомным номером 29. Он считается переходным элементом, который действует как проводник, поскольку он обладает свободными электронами, способными проводить тепло или электричество. Это мягкий, ковкий и пластичный металл, который имеет блестящий вид и может быть преобразован в листы и проволоку. Медь находит широкое применение в строительных материалах, а также может использоваться в сплавах с различными металлами. Также используются датчики и термопары.
Медь считается незаменимым элементом в качестве микроэлемента пищевых волокон. Медь считается важным ключевым компонентом дыхательного цитохромного комплекса в виде цитохром с-оксидазы. У моллюсков и ракообразных гемоцианин представляет собой дыхательные пигменты крови, обогащенные медью в качестве центрального атома. Медь заменена железосодержащим пигментом гемоглобином. Взрослый организм содержит медь в количестве от 1,4 до 2,1 мг на вес.
Медь заменена железосодержащим пигментом гемоглобином. Взрослый организм содержит медь в количестве от 1,4 до 2,1 мг на вес.
История и открытие меди:
В исторические времена, около 10 000 лет назад люди впервые использовали медь. По крайней мере, пять миллионов лет назад медь была единственным металлом, известным людям, и она обладала всеми качествами, которыми обладает хороший металл. В 8700 г. до н.э. в Северном Ираке был обнаружен медный кулон. До 4000 г. до н.э. золото стало вторым известным людям металлом, обладающим всеми качествами, присущими металлу.
Затем в 3000 г. до н.э. началось сплавление меди с мышьяком и оловом. К 5000 г. до н.э. медь также была обнаружена в металлургических операциях. За последние 8000 лет назад медь также очищалась и производилась путем выплавки различных руд. Другой археолог обнаруживает медь, датируемую 4500 г. до н.э., которая была зарыта в землю в средние века в древней деревне в Израиле.
Он также, вероятно, был извлечен методом радиоуглеродного анализа, который был установлен в Олдерли Эджин Чесире в Великобритании с 189 г. от 0 до 2280 г. до н.э. В бронзовом веке медь сплавляли с оловом, чтобы получить бронзовый металл. Шумерские и египетские артефакты из сплава меди и бронзы датируются 3000 г. до н.э. В Греции медь была известна под названием Халкос. Это был важный ресурс для римлян, греков и других древних людей. Римляне использовали его как денежную массу в 3 веке.
от 0 до 2280 г. до н.э. В бронзовом веке медь сплавляли с оловом, чтобы получить бронзовый металл. Шумерские и египетские артефакты из сплава меди и бронзы датируются 3000 г. до н.э. В Греции медь была известна под названием Халкос. Это был важный ресурс для римлян, греков и других древних людей. Римляне использовали его как денежную массу в 3 веке.
Великая медная гора была шахтой в Фалуне, Швеция, которая работала с 10 века по 1992 год. Мировое потребление меди удовлетворяется в 17 веке.
Наличие меди:
Около 50 частей на миллион (млн) меди присутствует в земной коре, а также образуется в массивных звездах. Естественно, медь встречается в различных минералах, включая самородную медь, сульфиды меди, халькопирит, борнит, дигенит, ковеллит, халькоцит, сульфосоли меди и их оксид.
Самая большая масса элементарной меди обнаружена в Мичигане, США, весом 420 тонн. Размер самого крупного обнаруженного кристалла самородной меди составляет 4,4 * 3,2 * 32 см. Это 25-й по распространенности элемент в земной коре. Во всем мире в больших количествах присутствует медь, которую люди использовали для проведения проводов.
Во всем мире в больших количествах присутствует медь, которую люди использовали для проведения проводов.
Атомные и физические свойства:
Медь обладает некоторыми атомными и физическими свойствами. Физические свойства можно определить как изменения физического состояния материи. Но атомные свойства относятся к изменению периодических свойств атома. Некоторые из важных физических свойств меди обсуждаются ниже;
| ФИЗИЧЕСКИЕ СВОЙСТВА | МЕДЬ (Cu) |
| 1. Фаза на СТП | Твердый |
| 2. Температура плавления | 1357 K, 1084 °C, 1984 |
| 3. Температура кипения | 2835 K, 2562 °C, 4643 |
| 4. Плотность | 8,96 г /см 3 |
5. Теплота плавления Теплота плавления | 13,26 кДж/моль |
| 6. Теплота парообразования | 300,4 кДж/моль моль |
| 7. Молярная теплоемкость | 24,40 кДж/ моль |
| 8. Степень окисления | -2, 0, +1, +2, +3, +4 |
| 9. Электроотрицательность | 1,90 (шкала Полинга) |
| 10. Энергия ионизации | 745,5 кДж/ моль |
| 11. Атомный радиус | 128 пм |
| 12. Радиус Ван-дер-Ваальса | 140 пм | 13. Кристаллическая структура | Гранецентрированная кубическая |
14. Магнитное упорядочение Магнитное упорядочение | диамагнетик |
| 15. Теплопроводность | 401 Вт/(м-K) |
Основные свойства меди
Электронная конфигурация меди:
уровень их энергии . Электронная конфигурация меди:
Cu = [Ar] 4d 10 , 3s 1
Эта электронная конфигурация имеет исключение, заключающееся в том, что все электроны должны заполниться в соответствии с их энергетическим уровнем. Таким образом, электроны остаются стабильными, когда они сначала заполняют более низкие энергетические орбиты. Подоболочка или оболочка, близкая к ядру, имеет более низкую энергию. Так что на более низкой орбите ускорение меньше из-за низкой энергии, и электрон чувствует себя стабильно. Также для достижения симметрии электроны должны заполнить сначала d-орбиталь, а затем s-орбиталь из-за достижения стабильности и достижения симметрии. Что касается стабильности, также заметно, что полностью заполненная орбиталь более стабильна, чем полузаполненная или частично заполненная орбиталь.
Если говорить о трендах меди в группах и периодах тогда:
- Атомный размер меди мал из-за сильной силы притяжения между ядром и внешней оболочкой.
- Значение энергии ионизации увеличивается. Из-за его небольшого размера электрон трудно вывести из самой внешней оболочки из-за сильной силы притяжения между ядром и электронами.
- Сродство к электрону увеличивается. Увеличение энергии ионизации вызывает увеличение величины сродства к электрону, так как из-за большой силы притяжения и малого размера атома трудно внедрить электрон в самую внешнюю оболочку.
- Электроотрицательность увеличивается. По двум вышеуказанным причинам делается вывод, что его способность притягивать общую пару электронов увеличивается.
- Также увеличивается экранирующий эффект, но эффективный ядерный заряд уменьшается.
Химическая активность и реакции:
Медь не вступает в реакцию с водой. Все металлы в периодической таблице перечислены в соответствии с их химической активностью. Например, натрий слишком активен, поэтому в воде взрывается. Некоторые, такие как золото, серебро и т. д., кажутся неизменными, потому что все они менее реактивны или нереактивны. Медь имеет низкую реакционную способность, поэтому низкая реакционная способность связана с ковкостью, что делает ее идеальной для проводимости. Из-за их меньшей реакционной способности они используются в архитектуре, для сохранения подвергшихся коррозии статуй, а также в процессе патинирования (это покрытие патиной на поверхности металла, статуй и т. д.). Он медленно реагирует с кислородом воздуха, образуя коричнево-черный слой оксида меди, который предотвращает ржавление и коррозию.
Например, натрий слишком активен, поэтому в воде взрывается. Некоторые, такие как золото, серебро и т. д., кажутся неизменными, потому что все они менее реактивны или нереактивны. Медь имеет низкую реакционную способность, поэтому низкая реакционная способность связана с ковкостью, что делает ее идеальной для проводимости. Из-за их меньшей реакционной способности они используются в архитектуре, для сохранения подвергшихся коррозии статуй, а также в процессе патинирования (это покрытие патиной на поверхности металла, статуй и т. д.). Он медленно реагирует с кислородом воздуха, образуя коричнево-черный слой оксида меди, который предотвращает ржавление и коррозию.
Рисунок: Таблица, показывающая реакционную способность металлов, а также меди
Химия патинирования:
Патинирование – это, по сути, покрытие патиной антикварных предметов. Патина — это в основном вещество или лак, представляющий собой смесь хлоридов, сульфидов, сульфатов и карбонатов меди, действие которых зависит от условий окружающей среды. Патина может быть разных цветов:
Патина может быть разных цветов:
- Патина нитрата меди (сине-зеленая)
- Патина сульфида аммония (сине-черная)
- Патина серы печени (коричнево-черная)
При патинировании очень важно получить патину, поэтому патина образуется и производится в результате следующих реакций:
- Медь окисляется до оксида меди красного или розового цвета. При окислении меди образующийся оксид меди на самом деле является оксидом меди (I).
4Cu + O 2 → 2Cu 2 O
- Оксид меди (I) снова реагирует с кислородом и окисляется с образованием меди (II ) оксиды черного цвета.
2Cu 2 O + O 2 → 4CuO
- Если при сжигании окаменелостей получается сера. Эта полученная сера прореагировала с серой с образованием меди (II) OH)2, Cu3(CO3)2(OH)2 и Cu2SO4(OH)6. Все эти образовавшиеся продукты содержат патину, которая используется для покрытия слоя, называемого патинированием.
 В основном патинирование производится методом состаривания. Патина наносится непосредственно на тот материал, который мы хотим защитить от ржавчины и коррозии.
В основном патинирование производится методом состаривания. Патина наносится непосредственно на тот материал, который мы хотим защитить от ржавчины и коррозии.
Рисунок : патинирование статуи, покрытой патиной
Соединения меди:
Медь может образовывать связи с оксидами, хлоридами и сульфидами. Два элемента медь и кислород могут образовывать оксиды меди. Очень уникальная реакция между медью и кислородом может привести к образованию оксидов меди. Он может образовывать оксиды меди (I), оксиды меди (II), сульфаты меди и многие другие соединения меди. Теперь мы обсудим различные соединения меди:
Оксид меди (I):
Его также называют закисью меди с формулой Cu 2 O. Это твердое вещество красного цвета, внешний вид которого может зависеть от размера присутствующих в нем частиц. получают несколькими способами:
- Образуется, когда четыре моля меди и один моль кислорода реагируют друг с другом, образуя Cu 2 O (оксид меди (I)).

4Cu + O 2 → 2Cu 2 O
- Оксид меди (I) также производится на основе тестов Фелинга и Бенедикта. Оба теста используются для различения восстанавливающих сахаров как альдегидов, так и кетонов.
- Тест Фелинга происходит, когда глюкоза или фруктоза при восстановлении сахара могут вступать в реакцию с 2 молями меди и 5 молями иона ОН-, давая кирпично-красные осадки Cu 2 O вместе с тремя молями воды.
C 6 H 12 O 6 + 2Cu + 5OH → C 6 H 11 O 7 9 0208 + Cu 2 O + 3H 2 O
- Тест Бенедикта может производить и формировать Cu 2 O, когда альдегид вступает в реакцию с Cu, он дает карбоновую кислоту вместе с кирпично-красными осадками Cu 2 O.
CH 2 OH + Cu 2+ → CH 3 СООН + Cu 2 O (кирпично-красный ppts. )
)
Оксиды меди (I) обладают следующими свойствами :
- Они являются твердыми веществами и проявляют диамагнитное поведение, потому что они имеют спаренные электроны на своих связывающих молекулярных орбиталях.
- В координационной сфере эти оксиды имеют тетраэдрическую геометрию с валентным углом 109.5 градусов.
- Из-за тетраэдрической геометрии это полиморф SiO2.
- Они растворяются в концентрированном растворе аммиака с образованием бесцветного комплекса [Cu(Nh4)2]+.
- Растворяется в растворе HCl с образованием CuCl2-.
- Cu2O является наиболее изученным материалом, который используется в качестве полупроводниковых диодов.
Оксиды меди (II):
Оксид меди (II) представляет собой неорганическое соединение с формулой CuO. Это черное твердое вещество, являющееся продуктом добычи меди. Его получают методом пирометаллургии, который является одним из важнейших этапов извлечения и выделения меди. Оксиды меди (II) , приготовленный по:
Оксиды меди (II) , приготовленный по:
- Руды в нечистой форме реагируют с водной смесью карбамата аммония, аммиака и кислорода с получением аминов меди (I). Эти амины разлагаются водяным паром с образованием CuO.
- Также образуется при нагревании меди на воздухе при 300°C – 800°C.
2Cu + O 2 → 2CuO
- Его также получают нагреванием меди до нитрата, меди до гидроксида и основной меди до карбонатов:
2Cu(NO 3 ) 2 → 2CuO + 4NO 2 + O 2
Оксиды меди (II) также прореагировал с минеральными кислотами. Химические реакции оксидов меди (II) следующие:
CuO + 2HNO 3 → Cu(NO 3 ) 2 + H 2 O
CuO + 2HCl → CuCl 2 + H 2 O
CuO + H 2 SO 4 → CuSO 4 + H 2 O
Все соединения меди могут иметь некоторые из следующих применений. Таким образом, для этой цели CuO может обладать некоторыми из следующих применений :
Таким образом, для этой цели CuO может обладать некоторыми из следующих применений :
- Используется в пиротехнике и фейерверках.
- Используется в элементах Эдисона-Лаланда и литиевых батареях.
- Используется в качестве пигмента в керамике.
Перекись меди:
Это неорганическое соединение с формулой CuO 2 . Имеет темно-оливково-зеленый цвет. Это оксид меди (II) с двумя атомами кислорода в качестве пероксидных единиц. это получен реакцией холодного раствора перекиси водорода и реактива Швейцера.
- Реагент Швейзера — это в основном комплекс металлов с формулой [Cu (NH 3 ) 4 (H 2 O) 2 ] (OH) 2 . Это темно-синее соединение, которое используется для очистки целлюлозы.
- Его также готовят из гидроксида меди и разбавленного раствора аммиака.
- Он также может образовываться в результате очень медленной реакции оксида меди с холодной перекисью водорода.

Обладает некоторыми свойствами :
- При разложении влажного пероксида меди при температуре 6 градусов он гораздо более стабилен, чем сухой.
- Его молярная масса составляет 95,94 г/моль.
- Разлагается на другие кислород и другие оксиды меди.
Хлорид меди (II):
Его также называют хлоридом меди. В безводной форме он имеет желтовато-зеленый цвет, но при поглощении влаги образует сине-зеленый дигидрат. CuCl 2 в безводной форме может иметь структуру йодида кадмия.
Водный раствор, полученный из хлоридов меди (II), содержит широкий спектр различных комплексов, которые зависят от температуры, давления и присутствия дополнительного иона хлорида.
Хлорид меди (II) может участвовать во многих реакциях. Так же, как гидролиз, окислительно-восстановительная реакция и координационные комплексы.:
- Первая реакция, которую они дают, это гидролиз . При гидролизе хлорид меди реагирует с сильным основанием NaOH с образованием осадка гидроксида меди и соли NaCl.

CuCl 2 + 2NaOH → Cu(OH) 2 + 2NaCl
- Хлорид меди также дает окислительно-восстановительную реакцию. В первой реакции при температуре 1000 градусов он разлагается до газа Cucl и Cl 2 .
2CuCl 2 → 2CuCl + Cl 2
- Он также реагирует с некоторыми металлами с образованием CuCl. CuCl 2 восстанавливается SO 2 в CuCl, HCl и серной кислоте.
2 CuCl 2 + SO 2 + 2 H 2 O → 2 CuCl + 2 HCl + H 2 SO 4
- CuCl 2 реагирует с HCl или другим хлоридом источники образования сложных ионов. Он также образует димер красных, зеленых и желтых комплексных ионов.
CuCl 2 + Cl – ⇌ CuCl 3 –
CuCl 2 + 2Cl ⇌ CuCl 4 2-
- CuCl 2 также образует координационные комплексы с такими лигандами, как аммиак, пиридин и оксид трифенилфосфина.

CuCl 2 + 2 C 5 H 5 N → [CuCl 2 (C 5 9020 8 H 5 N) 2 ] (тетрагональный)
CuCl 2 + 2 (C 6 H 5 ) 3 PO → [CuCl 2 ((C 6 H 5 ) 3 PO) 2 ] (тетраэдрический)
Имеет следующие применений . Он имеет множество применений в повседневной жизни.
- Действует как сокатализатор в процессе Wacker. В этом процессе этен превращается в этанол. В этом процессе PdCl2 восстанавливается до Pd, а CuCl2 снова окисляется до PdCl2. Все эти шаги включены в процесс Wreckers.
C 2 H 4 + PdCl 2 + H 2 O → CH 3 CHO + Pd + 2 HCl
Pd + 2 CuCl 2 → 2 CuCl + PdCl 2
9 0009 4 CuCl + 4 HCl + O 2 → 4 CuCl 2 + 2 H 2 O
- Он также действует как катализатор при производстве хлора.
 Процесс Дикона связан с производством хлора.
Процесс Дикона связан с производством хлора.
4 HCl + O 2 → 2 Cl 2 + 2 H 2 O
- Он также используется в производстве и синтезе различных органических соединений.
Сульфат меди:
Это неорганическое соединение, имеющее химическую формулу CuSO4. Он ярко-синего цвета. Его получают в промышленности при обработке металлической меди горячей концентрированной серной кислотой. Его также получают путем медленного выщелачивания низкосортной медной руды в воздух.
Коммерчески сульфат меди обычно составляет 98%. Чистый безводный сульфат меди содержит 39% меди и 61% сульфата по массе.
Также получают следующими способами:
- Путем нагревания медного лома, извлеченного из руд, с серой с образованием сульфида меди, который затем окисляют до сульфата меди.
- При нагревании сульфидных руд меди образуется оксид меди, который обрабатывается серной кислотой с образованием сульфата меди.

Коммерчески сульфат меди присутствует в кристаллической форме. Четыре самых распространенных сорта в зависимости от размера диаметра:
- Крупный кристалл (от 10 до 40 мм)
- Мелкий кристалл (от 2 до 10 мм)
- Гранулированные и снежные кристаллы (менее 2 мм)
- Унесенный ветром порошок (менее 0,15 мм)
90 004 Сульфат меди также обладает некоторым Применение:
- Используется как фунгицид и гербицид.
- Действует как аналитический реагент.
- Занимается вискозным производством.
- Используется в процессе сухого травления.
Изотопы меди:
Изотопы — это элементы или группы элементов, имеющие одинаковый атомный номер, но разные массовые числа. Итак, у меди есть два стабильных изотопа. 63 Медь и 65 Медь. Он содержит 27 радиоизотопов. Наиболее распространенным изотопом является 63 Cu, который содержит 69% встречающейся в природе меди. Он имеет относительное содержание 68,94%, а 65Cu имеет относительное содержание 31,06%.
Он имеет относительное содержание 68,94%, а 65Cu имеет относительное содержание 31,06%.
63 Cu имеет 29 протонов и 34 нейтрона в ядре, но 65 Cu может иметь 29протоны и 36 нейтронов. 64Cu и 67Cu — нестабильные изотопы меди, период полураспада которых (t 1/2 ) составляет 12,70 ч и 61,83 ч. Наименее стабильными изотопами меди являются 54 Cu, период полураспада которых составляет примерно 75 нс.
Изотопы меди обладают следующими медицинскими применениями :
- 63 Cu, 62 Cu, 61 Cu и 60Cu используются в диагностических целях.
- 67Cu и 64Cu используются для таргетной терапии.
- 64Cu также используется для ПЭТ-визуализации биологических молекул.
| ИЗОТОПЫ | ПЕРИОД ПОЛУРАСПАДА (t 1/2 ) | NU ЯСНЫЙ СПИН | ЯДЕРНЫЙ МАГНИТНЫЙ МОМЕНТ |
| 59 Cu | 1,36 м | 3/2 | – |
| 60 Cu | 13,7 м | 2 | 1. 219 219 |
| 61 Cu | 3,35 ч | 3/2 | 2,14 |
| 62 Cu | 9,7 4 м | 1 | -0,380 |
| 64 Cu | 12,701 ч | 1 | -0,217 |
| 66 Cu | 5,09 м | 1 | -0,282 | 67 Cu | 2.580d | 3/2 | – |
| 68 Cu | 31s | 1 | – |
| 69 Cu | 2,8 м | 3/2 | – |
Некоторая основная информация о некоторых радиоизотопах
Извлечение и очистка меди:
Экстракция означает извлечение исходной меди из руды, а очистка означает ее очистку от примесей. Способ добычи меди зависит от природы руды. Экстракция и очистка имеют некоторые из следующих стадий:
Способ добычи меди зависит от природы руды. Экстракция и очистка имеют некоторые из следующих стадий:
Добыча меди:
Около 200 лет назад Великобритания была крупнейшим в мире источником добычи меди, но сейчас это крупнейший источник добычи в Индонезии и Чили. Они производят тонн меди в год. В основном основными рудами меди являются сульфиды и оксиды. Когда медь добывается в виде руды, она содержит пустую породу и другие металлы со следующими процентными содержаниями:
- Борнит = Содержит 63% меди.
- Малахит = содержит 58% меди.
- Азурит = содержит 55% меди.
- Халькопирит = Содержит 35% меди.
Элемент меди встречается повсюду в земной коре. Они также встречаются в осадочных и магматических породах. Около 10 км земной коры в каждой тонне породы содержится 33 г меди. Медь можно извлечь из руд следующими способами, которые обсуждаются в полной статье о никеле. Медь также можно добывать следующими способами:
- Подземный: В этой вертикальной шахте руда погружается в землю и пробивает горизонтальные туннели в земле.

- Один карьер: Около 90% руды добывается этим процессом. В этом процессе руды добываются после удаления поверхностного слоя. Полученная руда реагирует с серной кислотой. Руда растворяет медь с образованием сульфата меди. Затем медь извлекают из электролитического рафинирования.
- Процесс пенной флотации.
- Гравитационное разделение.
- Магнитное разделение.
Стадия 1: Дробление и измельчение:
Полученная руда затем дробится и измельчается. Это первый этап, на котором нечистая руда измельчается и измельчается в дробилке. Это делает его готовым к отделению нечистых веществ в процессе пенной флотации.
Стадия 2: Процесс пенной флотации
В этом процессе руда в виде порошка смешивается с парафиновым маслом, чтобы сделать частицы меди водоотталкивающими. Затем его переносят в промывочную ванну, содержащую пенообразователь, который образует в нем много пузырьков. При пропускании через них потока воздуха ионы меди перемещаются вверх к поверхности воды вместе с пузырьками.
А осадочный материал остается на дне в виде пустой породы. Затем верхняя часть меди снимается из контейнера. Затем эту снятую медь обжигают, чтобы сделать ее сухой, а смесь воды и парафина снова используют.
Этот процесс дает 25% меди по массе. Поэтому необходимо провести процесс флотации пены. Обезжиренная медь также транспортируется по всему миру.
Этап 3: Обжиг
Это самый важный этап, на котором медный минерал превращается в металлическую медь. На этом этапе в качестве сырья берется халькопирит, а это означает, что в его процессе удаляются железо и сера. В этом процессе используются два основных метода:
- Халькопирит CuFeS2 превращается в оксид меди.
- Часть серы удаляется в виде двуокиси серы.
2CuFeS 2 (т) + 3O 2 (г) → 2FeO(т) + 2CuS(т) + 2SO 2 (г)
900 04 Эта реакция происходит, когда концентрированная руда из пенной флотации процесс нагревается при температуре 500°C – 700°C. Продукт, полученный при обжиге, называют кальцином. Поскольку SO 2 опасен, его необходимо удалить.
Продукт, полученный при обжиге, называют кальцином. Поскольку SO 2 опасен, его необходимо удалить.
Этап 4: Плавка:
Теперь в этом процессе выполняется дополнительный нагрев. Полученный огарок нагревают при 1200°С с кремнеземом и известняком. Когда он вступает в реакцию с кремнеземом, он плавится и образует ненужную массу, называемую железосиликатным шлаком FeO. SiO2 плавает на поверхности жидкости. Плавающий материал дополнительно собирается.
После нагревания при плавлении смешивается с жидкостью. Так, железосиликатный шлак плавает на воде, а медь остается в воде. Эта остаточная смесь воды и меди называется штейном.
FeO(s) + SiO 2 (s)→ FeO.SiO 2 (железосиликатный шлак)
Стадия 5: Преобразование штейна в черновую медь:
Жидкая смесь производится как матовый далее окисляется воздухом с образованием черновой меди. Штейн из плавильных заводов заливают в формы для литья анодов. Происходят следующие реакции:
- При окислении оксида железа сульфид железа высвобождается с образованием шлака из силиката железа.

2FeS(ж) + 3O 2 + SiO 2(л) → 2FeO.SiO 2 + 2SO 2 (ж)
- При восстановлении происходит образование сульфида меди.
Cu 2 S(ж) + O 2 (ж) → 2Cu(ж) + SO 2
Этап 6: Отливка анода:
900 04 Литье анодов – одна из важнейших процедур в котором чисто 9получается 9% меди. Слово «волдырь» означает образование пузырьков диоксида серы вместе с медью. Это значит, что медь остается внизу, а сернистый газ идет пузырьками вверх.
Анодное литье представляет собой поворотный стол, состоящий из небольших форм. Поэтому расплавленная медь заливается в это огромное колесо, и оно очень медленно движется по круговой орбите к следующей форме. Более того, через некоторое время медь остывает и затвердевает на аноде. Формы содержат небольшие опорные рычаги, которые используются для подъема затвердевающей меди.
Этап 7: Электролитическое рафинирование:
Черновая медь содержит в основном 99% меди, но на современном рынке ее очистки недостаточно. Таким образом, он снова очищается с помощью электролитического рафинирования. Эта очистка осуществляется в электролизере. Этот вид аффинажа позволяет получить высококачественную и чистую медь.
Таким образом, он снова очищается с помощью электролитического рафинирования. Эта очистка осуществляется в электролизере. Этот вид аффинажа позволяет получить высококачественную и чистую медь.
В электролизере должно быть два электрода: анод и катод. Черновая медь в виде листов или затвердевшая медь действует как анод, имеющий положительный заряд, а любой другой металл действует как катод, имеющий отрицательный заряд. В этом электролите используется водная смесь 3-4% сульфата меди и 11-16% серной кислоты.
Аппарат состоит из электродов, в которых между катодами подвешены аноды. При этом прикладывается необходимая для этого процесса разность потенциалов 0,2-0,4 вольта. При прохождении тока через электроды ионы меди с анода выделяются и попадают в электролит в виде Cu 2+ .
Затем катод испускает два электрона, и ионы меди забирают два электрона, образуя атом меди Cu. Реакция на аноде и катоде следующая:
НА КАТОДЕ: Cu 2+ (водн. ) + 2e − → Cu (s)
) + 2e − → Cu (s)
НА АНОДЕ: 900 10 Cu (т) → Cu 2+ (водн. ) + 2e −
Рисунок: Электролитическое рафинирование меди
Использование меди:
Медь имеет несколько применений:
- Это традиционный металл, используемый для изготовления монет наряду с серебром и золотом.
- Все оружейные металлы содержат медь.
- Большая часть меди используется в электрическом оборудовании, таком как провода и двигатели, поскольку она является хорошим проводником электричества.
- Используется на строительных площадках и в теплообменниках для выравнивания температуры оборудования.
- Сульфат меди используется в сельском хозяйстве для уничтожения грибков, вредителей и многих других трав.
- Соединение меди используется в химическом тесте для обнаружения сахара.
- Он регулирует ферменты для передачи энергии.
- Генетические заболевания могут повлиять на способность правильно использовать медь.

- Комплексы меди обнаружены в гемолимфе моллюсков и ракообразных.
Показать схему извлечения и очистки Cu:
Итого
Доли
Медь (Cu) — атомный номер 29
Произнесенный
KOP-er
9000 4
Медь — красновато-оранжевый металл с атомным номером 29. в периодической таблице. Это переходный металл, расположенный в 11-й группе периодической таблицы. Он имеет обозначение Cu.
Медь (Cu) — мягкий и ковкий металл с высокой тепло- и электропроводностью. В отличие от многих переходных металлов, он имеет розовато-оранжевый цвет. Он имеет широкий спектр применения, но в основном в качестве электрического проводника и строительного материала из-за его прочности и низкой стоимости. Медь — один из немногих металлов на Земле, который естественным образом встречается в земной коре. Благодаря своему относительному изобилию в земной коре он уже много лет широко используется человеком. Впервые он был использован около 8000 г. до н. э., что привело к созданию бронзы, когда ее плавили с оловом около 3500 г. до н.э. Название «медь» происходит от древнеанглийского Coper, происхождение которого можно проследить до латинского Cuprum. Соли меди широко используются в промышленности, например, сульфат меди в виде светло-голубого раствора или оксид меди в виде черного или зеленого порошка в зависимости от степени его окисления. Медь широко используется в биологических соединениях, содержащихся в ферментах и крови. Он также используется в антимикробных приложениях для уничтожения бактерий. Он находится в группе 11 и имеет температуру плавления 1084°C и точку кипения 2562°C, являясь твердым металлом при комнатной температуре.
э., что привело к созданию бронзы, когда ее плавили с оловом около 3500 г. до н.э. Название «медь» происходит от древнеанглийского Coper, происхождение которого можно проследить до латинского Cuprum. Соли меди широко используются в промышленности, например, сульфат меди в виде светло-голубого раствора или оксид меди в виде черного или зеленого порошка в зависимости от степени его окисления. Медь широко используется в биологических соединениях, содержащихся в ферментах и крови. Он также используется в антимикробных приложениях для уничтожения бактерий. Он находится в группе 11 и имеет температуру плавления 1084°C и точку кипения 2562°C, являясь твердым металлом при комнатной температуре.
Загрузите медь в виде изображения для печати и с полным масштабированием
Получите бесплатную загрузку здесь (JPEG, PDF, SVG)
Часто задаваемые вопросы
Какова температура плавления меди?
Медь имеет температуру плавления 1083°C, что означает, что при 1083°C она превратится в жидкость.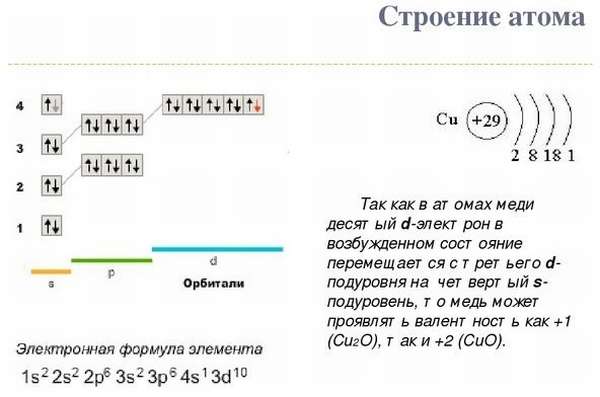
Какова температура кипения меди?
Медь имеет температуру кипения 2567°C, что означает, что при 2567°C она превратится в газ.
Что такое электроотрицательность меди?
Электроотрицательность меди 1,9. Электроотрицательность — это мера того, насколько сильно атомы притягивают к себе связывающие электроны.
Открыт
Известен древним.
Дата открытия
9000 г. до н.э.
Что такое Теплота испарения меди?
Медь имеет теплоту парообразования 300,3 кДж/моль.
Применение
Наиболее часто используется в качестве электрического проводника. Также используется в производстве водопроводных труб. Его сплавы используются в ювелирных изделиях и монетах.
Источники
Чистая медь редко встречается в природе. Обычно встречается в сульфидах, таких как халькопирит (CuFeS2), ковелин (CuS), халькозин (Cu2S) или оксиды, такие как куприт (Cu2O).
Об авторе
Натан М.

Автор
Натан имеет степень бакалавра биомедицинской химии в Уорикском университете и степень бакалавра биомедицинских наук в Университете Вулверхэмптона, Великобритания. Предмет Натана варьируется от общей химии до органической химии. Натан также создал учебную программу «Разрушение атома» на странице курса.
Цитата
«Медь» Опубликовано 30 декабря 2019 г. https://breakingatom.com/elements/copper
29
Протоны
29
Электроны 90 016
35
Нейтроны
Символ элемента
Cu
Атомный вес
63,546
Атомный номер
29
Состояние
Твердое вещество
Температура плавления
Неизвестно
1083
°C
Температура кипения
2567
Неизвестно
°C
Теплота испарения
300.3
Неизвестно
кДж/моль
Кристалл Структура
Кубическая: гранецентрированная
Теплопроводность
4,01
Неизвестно
Вт/см·К
Корпуса
2,8,18,1
Группа
Переходный металл
Период
4
Блок
D Блок 9001 6
Орбитали
[Ar] 3d10 4s1 96/см Ом
Первый потенциал ионизации
7,7264 В
Второй потенциал ионизации
20,292 В
Третий потенциал ионизации
36,83 В 9 0016
Ионный радиус
.
