Медь описание вещества: Медь-описание | Электрод-Сервис
Содержание
Медь — Описание, происхождение, применение.
Медь (Cu от лат. Cuprum) — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
Медная монета (фото)
История
Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий
Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике.
Происхождения названия меди
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр. ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник.
Слова медь и медный встречаются в древнейших русских литературных памятниках. Славянское *mědь «медь» не имеет чёткой этимологии, возможно, исконное слово. В. И. Абаев предполагал происхождение слова от названия страны Мидия: *Мѣдь из ир. Мādа- через посредство греч. Μηδία[8]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл».
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра, и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской. С Гумёшевским рудником Полевского, — крупнейшим в XVIII—XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломленным народным сознанием образом богини Венеры.
Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра, и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской. С Гумёшевским рудником Полевского, — крупнейшим в XVIII—XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломленным народным сознанием образом богини Венеры.
Медь в природе
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно.
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси).
Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси).
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства меди
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок.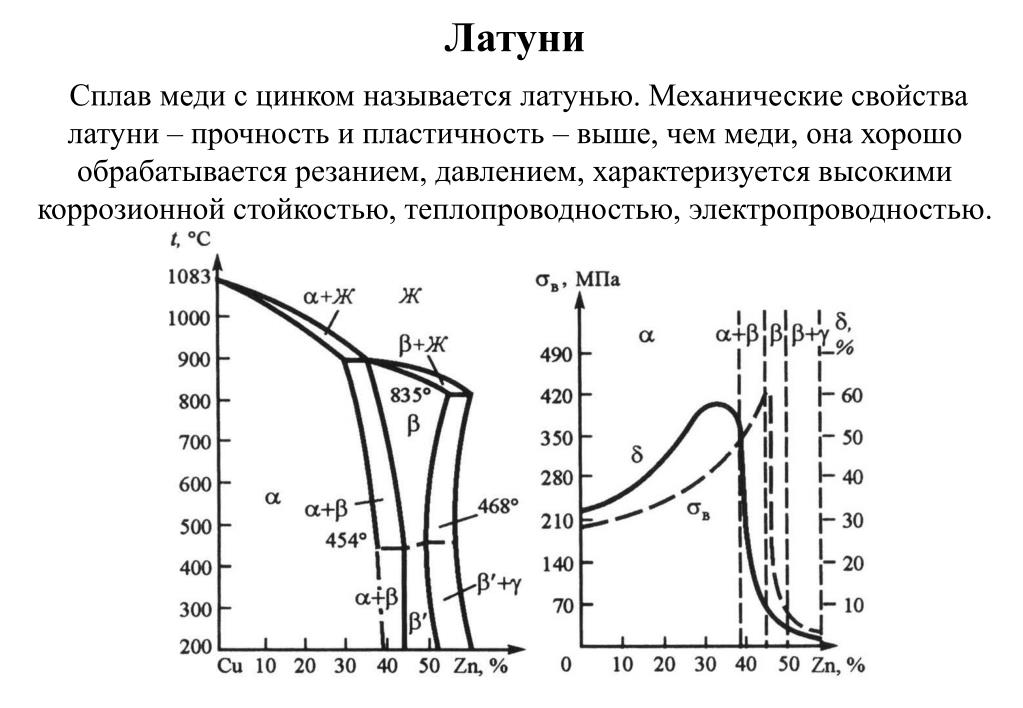 Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Атомная плотность меди (N0) = 8,52 * 10 28 (атом/м³).
Применение меди
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C: 0,01724-0,0180 мкОм·м/), медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %.
Теплообмен
Система охлаждения из меди на тепловых трубках в ноутбуке
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Для производства труб
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
Медные прутки (фото)
Медные трубы (фото)
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005, а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы на основе меди
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель, висмут и другие металлы. Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали).
Оба сплава являются общими названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель, висмут и другие металлы. Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты. Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости.
Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты. Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости. Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 °C , обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 °C , обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Сплавы, в которых медь значима
Повреждённая пожаром дюралевая деталь дирижабля Гинденбург (LZ 129)
Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия-бария-меди (купрата) YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за того ,что медь является катализатором полимеризации ацетилена (образует соединения меди с ацетиленом), трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 510 и 578 нм.
Производство и добыча меди.
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн тонн. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:
Компания тыс. тонн %
Норильский никель 425 45 %
Уралэлектромедь 351 37 %
Русская медная компания 166 18 %
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское». Мировое производство меди в 2007 году составляло 15,4 млн т, а в 2008 году — 15,7 млн т .
Лидерами производства были:
Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.),
США (1,170/1,310),
Перу (1,190/1,220),
КНР (0,946/1,000),
Австралия (0,870/0,850),
Россия (0,740/0,750),
Индонезия (0,797/0,650),
Канада (0,589/0,590),
Замбия (0,520/0,560),
Казахстан (0,407/0,460),
Польша (0,452/0,430),
Мексика (0,347/0,270).
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается, что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Медный порошок (фото)
Современные способы добычи
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская Республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду (расположен в Чили). В зависимости от глубины залегания, руда добывается открытым или закрытым методом.
В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская Республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду (расположен в Чили). В зависимости от глубины залегания, руда добывается открытым или закрытым методом.
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её растворения в слабом растворе серной кислоты и последующего выделения металлической (черновой) меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки — 1450 °C.
С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит раствор раствор серной кислоты с медным купоросом. В ходе электролиза происходит повышение концентрации серной кислоты. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлама, который идёт на переработку с целью извлечения ценных металлов. При получении 1000 тонн электролитической меди можно получить до 3 кг серебра и 200 г золота. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлама, который идёт на переработку с целью извлечения ценных металлов. При получении 1000 тонн электролитической меди можно получить до 3 кг серебра и 200 г золота. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Гранулы меди (фото)
Соединения меди | справочник Пестициды.ru
Показать все
Содержание:
- История
- Действие на вредные организмы
- Механизм действия
- Устойчивые виды
- Инсектицидные и акарицидные свойства
- Применение
- Баковые смеси
- Фитотоксичность
- Токсикологические свойства и характеристики
- Энтомофаги и полезные виды
- Теплокровные
- В почве
- В продукции
- Симптомы отравления
Пестициды, содержащие медь, широко применяются для защиты садов и виноградников от вредителей и болезней, а также в качестве протравителей семян. Соединения меди являются одной из наиболее важных групп фунгицидов, используемых самостоятельно и в смеси с другими органическими препаратами.[6]
Соединения меди являются одной из наиболее важных групп фунгицидов, используемых самостоятельно и в смеси с другими органическими препаратами.[6]
Более ста лет они находят применение в борьбе с ложномучнисторосяными и несовершенными грибами, вызывающими пятнистости вегетативных органов растений. Это основная группа препаратов в системе антирезистентной программы к системным фунгицидам.[2]
История
В 1761 г. Шалтесом или в 1783 г. Тессиром был предложен сульфат меди для протравливания семян пшеницы. В 1807 г. Превост опубликовал данные о головневых болезнях пшеницы и борьбе с ними, а также о влиянии сульфата меди и температуры на прорастание хламидоспор головни. Таким образом, были заложены основы лабораторных испытаний фунгицидов.[3] Во Франции в 1887 г. А.Милярде и У.Гейон предложили смесь раствора с известковым молоком (бордоская жидкость), которую до сих пор применяют в защите растений.[2]
Бордоская смесь
Бордоская смесь
Установка, применяемая для приготовления бордоской жидкости в начале прошлого века.
Использовано изображение: [8]
Действие на вредные организмы
Все препараты на основе солей меди являются контактными фунгицидами защитного действия. Они активно подавляют прорастание конидий и спор грибов только в момент прорастания в капле воды и обладают бактерицидными свойствами. Для обеспечения высокой эффективности препараты меди должны быть нанесены на растения до начала прорастания конидий или спор патогена. Большое значение имеет равномерное и тщательное покрытие всего растения. Продолжительность защитного действия зависит от метеорологических условий (осадки), качества препаративной формы (размер частиц, прилипаемость) и скорости роста растения. Обычно защитное действие длится не более 10 дней.[7]
. Активность медьсодержащих фунгицидов основана на способности ионов меди взаимодействовать с сульфгидрильными группами коферментов и ферментов, а также с аминогруппами грибной клетки, вызывая денатурацию и осаждение белков. Кроме того, эти фунгициды, являясь сильными окислителями, могут ускорять внутриклеточные окислительные процессы.[3]
Кроме того, эти фунгициды, являясь сильными окислителями, могут ускорять внутриклеточные окислительные процессы.[3]
Важная роль в фунгитоксичности принадлежит сорбционной способности протоплазмы клеток грибов и переходу ионов меди в раствор из осадка на листьях. Растворенная медь адсорбируется спорами, вследствие чего равновесие нарушается, и часть меди снова переходит в растворимое состояние. Данный процесс происходит до тех пор, пока спорой не кумулируется токсическая доза. Переводу меди в раствор способствуют аммонийные соли, углекислота и другие вещества, присутствующие в атмосфере, росе, осадках, выделениях листьев, спор грибов.[3]
Как и все препараты контактного действия, медьсодержащие соединения не проникают внутрь листа, поэтому не могут вызвать гибель находящихся там гиф и мицелия гриба. Они взаимодействуют в основном со спорами, препятствуя их прорастанию.[1]
Биологические свойства медьсодержащих препаратов определяются способностью ионов меди активно реагировать с ферментными и липопротеиновыми комплексами живых клеток и вызывать необратимые изменения (коагуляцию) протоплазмы. Ионы меди, поступившие в достаточно высокой концентрации в клетки патогена, взаимодействуют с различными ферментами, содержащими имидазольные, карбоксильные и тиольные группы, и подавляют их активность. Прежде всего, при этом ингибируются процессы, которые входят в дыхательный цикл, в частности, процесс превращения пировиноградной кислоты в ацетилфермент А. Также они вызывают неспецифическую денатурацию белков. Их избирательность по отношению к полезным организмам зависит от количества ионов меди, поступивших в клетки и накопившихся в них. Конидии и споры грибов, прорастающие на поверхности растений в капле воды, способны внутри своей клетки накапливать ионы меди, создавая концентрацию в 100 и более раз выше, чем в растительных клетках или снаружи.[7]
Ионы меди, поступившие в достаточно высокой концентрации в клетки патогена, взаимодействуют с различными ферментами, содержащими имидазольные, карбоксильные и тиольные группы, и подавляют их активность. Прежде всего, при этом ингибируются процессы, которые входят в дыхательный цикл, в частности, процесс превращения пировиноградной кислоты в ацетилфермент А. Также они вызывают неспецифическую денатурацию белков. Их избирательность по отношению к полезным организмам зависит от количества ионов меди, поступивших в клетки и накопившихся в них. Конидии и споры грибов, прорастающие на поверхности растений в капле воды, способны внутри своей клетки накапливать ионы меди, создавая концентрацию в 100 и более раз выше, чем в растительных клетках или снаружи.[7]
Бордоская смесь обладает репеллентными свойствами для многих насекомых.[3]
. Бордоская смесь не эффективна против пероноспороза махорки и табака, а также против настоящих мучнистых рос. [5]
[5]
. Бордоская смесь подавляет листоблошек на картофеле. Проявляет овицидное действие.[3]
Бордосская жидкость
Бордосская жидкость
Применение
Медьсодержащие соединения используются для предупреждения заболеваний растений. Их применяют заранее, до появления массового заражения.[1]
Соединения меди активно подавляют развитие пятнистостей винограда, сахарной свеклы, ложных мучнистых рос, макроспориоза и фитофтороза картофеля, монилиоза, ржавчины, парши семечковых, кластероспороза и коккомикоза косточковых плодовых культур, а также сдерживают развитие настоящей мучнистой росы и ряда бактериозов.[7]
. Бордоскую жидкость нельзя смешивать с фосфорорганическими инсектицидами и другими препаратами, которые разлагаются в щелочной среде.[4]
Хлорокись меди входит в состав многих комбинированных фунгицидов. [2] Суспензию можно применять совместно с большинством пестицидов, но нельзя смешивать с препаратами, содержащими известь. Средство применяется также в смеси с антииспарителями.[1]
[2] Суспензию можно применять совместно с большинством пестицидов, но нельзя смешивать с препаратами, содержащими известь. Средство применяется также в смеси с антииспарителями.[1]
. Фитотоксичность особенно проявляется в годы с повышенной влажностью воздуха и продолжительным периодом выпадения осадков, а также в период активного роста растений. Кроме того, многолетнее использование медьсодержащих фунгицидов (при их накоплении в почве) отрицательно действует на деревья, вызывая сильное опадение листьев и завязей в начале лета.[1]
Фитотоксичность препаратов меди зависит от концентрации меди в растворе на поверхности растений и способности стеблей и листьев поглощать ее ионы.[7]
В связи с тем, что фитотоксичность сильнее проявляется в период активного роста растений, рекомендуется чередование обработок медьсодержащими препаратами с обработками органическими средствами. Перед цветением растений и во время него следует применять органические препараты, безопасные для цветков и стимулирующие рост побегов и листьев. Перед созреванием плодов используют хлорокись меди. Она менее фитотоксична, чем бордоская жидкость, но хуже удерживается на растениях.[4]
Перед созреванием плодов используют хлорокись меди. Она менее фитотоксична, чем бордоская жидкость, но хуже удерживается на растениях.[4]
Токсикологические свойства и характеристики
. Бордоская смесь не является ядовитой для хищных клещей, личинок и имаго златоглазок, кокцинеллид, хищных галлиц и таких перепончатокрылых, как их невмониды, афелиниды, птеромалиды.[3]
Хлорокись меди не токсична для яиц златоглазки, умеренно токсична для ее личинок и имаго; высокотоксична для перепончатокрылых из семейства трихограмматид.[3]
. Препараты меди ядовиты для человека и теплокровных животных. Доза 10 г является абсолютно смертельной для человека. Дозы 0,2-0,5 г вызывают рвоту.[6]
. Соединения меди стабильны во внешней среде, активно участвуют в кругообороте веществ в природе, переходят из почвы в растения, употребляемые человеком и животными. Установлено, что применение бордоской жидкости для опрыскивания яблоневого сада и виноградников, ранее не обрабатываемых никакими пестицидами, приводило к увеличению содержания меди в почве.[6]
Установлено, что применение бордоской жидкости для опрыскивания яблоневого сада и виноградников, ранее не обрабатываемых никакими пестицидами, приводило к увеличению содержания меди в почве.[6]
Поведение попавших в почву медьсодержащих пестицидов зависит в основном от типа почвы, ее физико-химических свойств, содержания гумуса, влажности. При внесении пестицидов в почву, а также при различных способах обработки наземных частей растений могут загрязняться как открытые водоемы, так и подземные источники водоснабжения. В воде колодца, питающегося грунтовыми водами и расположенного на супесчаной почве, количество меди за вегетационный период повысилось в 10 раз.[6]
Установлено также, что медь и ее соединения оказывают бактерицидное действие на микроорганизмы почвы и водоемов, что может привести к угнетению почвенной микрофлоры и процессов минерализации органических веществ.[6]
. Установлено, что при применении медьсодержащих пестицидов загрязняются также плоды. Так, концентрация меди в яблоках, обработанных 1%-ной бордоской жидкостью, составляла 4,14 мг/кг, в то время как в плодах, отобранных на контрольном участке, содержалось 0,93 мг/кг.[6]
Так, концентрация меди в яблоках, обработанных 1%-ной бордоской жидкостью, составляла 4,14 мг/кг, в то время как в плодах, отобранных на контрольном участке, содержалось 0,93 мг/кг.[6]
. Соли меди при непосредственном воздействии на ткани образуют с тканевыми белками альбуминаты, что обуславливает их вяжущее и прижигающее действие. Они сильно раздражают слизистые оболочки желудочно-кишечного тракта, а также верхних дыхательных путей.[6]
Клиническая картина отравления человека при попадании соединений меди в желудочно-кишечный тракт характеризуется неприятным металлическим и вяжущим вкусом во рту, обильным слюнотечением, тошнотой, рвотой. Рвотные массы окрашены в зеленый или сине-зеленый цвет. Отмечаются схваткообразные боли в животе. Резко выражено гемолитическое действие с быстрым появлением билирубина в плазме и моче, отмечается желтуха, иногда уремия, обнаруживается белок в моче, развивается слабость, головокружение, затрудненное дыхание. [6]
[6]
При поступлении солей меди (СuCO3, CuSO4) через дыхательные пути развивается симптомокомплекс «меднопротравной» лихорадки. Описаны случаи отравления работающих на протравливании зерна углекислой медью. Явления интоксикации начинались с сильного озноба, продолжающегося несколько часов, повышения температуры тела (до 39). При тяжелой форме интоксикации заболевание может длиться три-четыре дня.[6]
Соединения меди могут оказывать также местнораздражающее действие на кожу: иногда появляется мелкая красная сыпь с зудом, экзема, кожная пурпура.[6]
Особенно опасным является поступление солей меди в виде пыли в дыхательные пути. При этом наблюдаются признаки раздражения слизистой оболочки верхних дыхательных путей, сильный бронхиальный кашель в сочетании с рвотой и болями в желудке, носовые кровотечения. Хроническая токсичность соединений меди не выражена.[7]
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Белов Д.А. Химические методы и средства защиты растений в лесном хозяйстве и озеленении: Учебное пособие для студентов. –М.: МГУЛ, 2003. – 128 с
2.
Ганиев М.М., Недорезков В.Д. Химические средства защиты растений. – М.: КолосС, 2006. – 248 с.
3.
Голышин Н. М. Фунгициды. — М.: Колос, 1993. -319 с.: ил.
4.
Груздев Г.С. Химическая защита растений. Под редакцией Г.С. Груздева — 3-е изд., перераб. и доп. — М.: Агропромиздат, 1987. — 415 с.: ил.
5.
Зинченко В.А. Химическая защита растений: средства, технология и экологическая безопасность. – М.: «КолосС», 2012. – 127 с.
6.
Медведь Л.И. Справочник по пестицидам (гигиена применения и токсикология) / Коллектив авторов, под ред. академика АМН СССР, профессора Медведя Л.И. -К.: Урожай, 1974. 448 с.
7.
Попов С.Я. Основы химической защиты растений. Попов С.Я., Дорожкина Л.А., Калинин В.А./ Под ред. профессора С.Я Попова. — М.: Арт-Лион, 2003. — 208 с.
Изображения (переработаны):
8.
Altus Lacy Quaintance, Cornelius Lott Shear U.S. Dept. of Agriculture, 1907. Иллюстрации из книги
СвернутьСписок всех источников
Церулоплазмин (Coeruloplasmin) — цена анализа в Ереване в ИНВИТРО
Исследуемый материал
Сыворотка крови
Метод определения
Иммунотурбидиметрия.
Медьсодержащий белок плазмы, играющий важную роль в метаболизме меди и железа и в механизмах прооксидантных / антиоксидантных реакций.
Впервые описан в 1944 г. Холмбергом и Лауреллом. Церулоплазмин – белок фракции α2-глобулинов плазмы, в котором содержится около 95% общего количества меди сыворотки крови: на одну молекулу церулоплазмина приходится 6 — 8 атомов меди. Высокое содержание меди придаёт ему голубой цвет («небесно-голубой белок плазмы»). Синтезируется церулоплазмин преимущественно паренхиматозными клетками печени и, в меньшей степени, макрофагами и лимфоцитами. Сначала образуется пептидная цепь, затем добавляется медь от внутриклеточной АТФазы (фермент отсутствует при болезни Вильсона-Коновалова). Роль церулоплазмина в транспорте самой меди не очень значительна, поскольку оборот меди в нём медленный (основную роль в транспорте меди играют альбумин и транскупреин).
Синтезируется церулоплазмин преимущественно паренхиматозными клетками печени и, в меньшей степени, макрофагами и лимфоцитами. Сначала образуется пептидная цепь, затем добавляется медь от внутриклеточной АТФазы (фермент отсутствует при болезни Вильсона-Коновалова). Роль церулоплазмина в транспорте самой меди не очень значительна, поскольку оборот меди в нём медленный (основную роль в транспорте меди играют альбумин и транскупреин).
В качестве биомаркёра состояния обмена меди в организме церулоплазмин информативен в условиях её выраженного дефицита. Синтез церулоплазмина заметно стимулируется эстрогенами (беременность, терапия эстрогенами). Церулоплазмин относится к острофазным реактантам. Концентрация его в крови повышается во время воспаления, инфекции, травматических состояний — в результате активации транскрипции гена церулоплазмина α-интерфероном и цитокинами. Рост уровня церулоплазмина относительно медленный – пик на 4 — 20 днях после острого инсульта.
Основная физиологическая роль церулоплазмина определяется его участием в окислительно-восстановительных реакциях. Действуя как ферроксидаза, церулоплазмин выполняет важнейшую роль в регуляции ионного состояния железа — окислении Fe2+ в Fe3+. Это делает возможным включение железа в трансферрин без образования токсических продуктов железа. Поддержание нормального транспорта и метаболизма железа — жизненно важная функция церулоплазмина. При дефиците железа происходит активация транскрипции гена церулоплазмина гипоксия-индуцибельным фактором-1 (HIF-1), который также активирует гены эритропоэтина, трансферрина и его рецептора.
Действуя как ферроксидаза, церулоплазмин выполняет важнейшую роль в регуляции ионного состояния железа — окислении Fe2+ в Fe3+. Это делает возможным включение железа в трансферрин без образования токсических продуктов железа. Поддержание нормального транспорта и метаболизма железа — жизненно важная функция церулоплазмина. При дефиците железа происходит активация транскрипции гена церулоплазмина гипоксия-индуцибельным фактором-1 (HIF-1), который также активирует гены эритропоэтина, трансферрина и его рецептора.
Церулоплазмин может действовать как прооксидант или как антиоксидант в зависимости от наличия других факторов. В присутствии супероксида (например, в воспаленном сосудистом эндотелии), он выступает катализатором окисления липопротеидов низкой плотности. На основании результатов эпидемиологических исследований, церулоплазмин рассматривается как независимый фактор риска сердечно-сосудистых заболеваний.
Первичный генетический дефицит церулоплазмина в гомозиготной форме вызывает тяжёлые нарушения метаболизма железа, во многом сходные с картиной гемохроматоза. Транспорт меди при этом страдает в меньшей степени. Клиническая картина включает блефароспазм, дегенерацию сетчатки, диабет, деменцию, экстрапирамидные расстройства. Вторичный дефицит церулоплазмина (вследствие нарушения включения меди в его молекулу при синтезе) – гораздо более частое явление. Дефицит меди в диете (неадекватная диета, парентеральное питание, мальабсорбция, терапия пенициламином) ассоциирован с нейтропенией, тромбоцитопенией, низким железом сыворотки, гипохромной нормо- или макроцитарной анемией, резистентной к терапии железом.
Транспорт меди при этом страдает в меньшей степени. Клиническая картина включает блефароспазм, дегенерацию сетчатки, диабет, деменцию, экстрапирамидные расстройства. Вторичный дефицит церулоплазмина (вследствие нарушения включения меди в его молекулу при синтезе) – гораздо более частое явление. Дефицит меди в диете (неадекватная диета, парентеральное питание, мальабсорбция, терапия пенициламином) ассоциирован с нейтропенией, тромбоцитопенией, низким железом сыворотки, гипохромной нормо- или макроцитарной анемией, резистентной к терапии железом.
Болезнь Менкеса («болезнь курчавых волос») – связанная с Х-хромосомой генетическая аномалия, вызывающая нарушение поступления меди из желудочно-кишечного тракта в сосудистое пространство (отсутствует АТФаза, участвующая в механизмах транспорта меди в кровь). Соответственно, медь не поступает в печень и недоступна для включения в церулоплазмин, уровень его снижен. Клинически заболевание проявляется в задержке роста, нарастающей неврологической дегенерации. Характерны изменения волос (курчавые редкие и ломкие). Летальный исход при отсутствии лечения в течение первых 5 лет жизни.
Характерны изменения волос (курчавые редкие и ломкие). Летальный исход при отсутствии лечения в течение первых 5 лет жизни.
Болезнь Вильсона-Коновалова (гепатолентикулярная дегенерация) — дефект гена 13 хромосомы, приводящий к отсутствию печёночной АТФазы, участвующей в механизме включения меди в церулоплазмин, нарушается и экскреция меди с желчью. Симптомы могут проявиться в 20 — 30 лет, но также и раньше или позже. В отличие от дефицита церулоплазмина, связанного с медьдефицитной диетой, и болезни Менкеса, в этом состоянии в организме наблюдается избыток меди и её отложение в тканях, включая печень, мозг, периферию радужной оболочки глаз (характерные кольца). Развиваются нарушения функции печени, сходные с острыми или хроническими гепатитами, дегенеративные изменения ЦНС и неврологические нарушения, изменения функции почек, реже – гематологические изменения (гемолиз, связанный с токсическим действием свободной меди). Выделение меди с мочой увеличивается в 5 — 10 раз. Уровень церулоплазмина низкий (за исключением иногда случаев, связанных с беременностью и воспалением).
-
Зайчик А. Ш., Чурилов, Л. П. Основы патохимии. — СПб.: ЭЛБИ-СПб. 2001. — с. 417 — 418.
-
Радченко В. Г., Шабров А. В., Зиновьева Е. Н. Основы клинической гепатологии: заболевания печени и билиарной системы. – М.: Диалект Бином, 2005. – 864 с.
-
Burtis C., Ashwood E., Bruns D. Tietz textbook of clinical chemistry and molecular diagnostics. Elsevir Inc., 2006. — 2412 p.
-
Martin F., Linden T., Katschinski D. M. et al. Copper-dependent activation of hypoxia-inducible factor (HIF)-1: implications for ceruloplasmin regulation. Blood, 15 June 2005, vol. 105, №. 12, p. 4613 — 4619.
-
Fox P. L., Mazumder B., Ehrenwald E., Mukhopadhyay C. K. Ceruloplasmin and cardiovascular disease. Free Radic Biol Med. Jun 15 2000, 28(12), p. 1735 — 44.
Свойства металлов Научный урок
Для большинства людей металл — это другое слово, обозначающее железо, сталь или подобное твердое блестящее вещество.
Но соответствует ли это определение истинным свойствам металлов?
Да… и нет.
Прежде чем мы объясним, вы должны знать, что большинство элементов в таблице Менделеева — это металлы.
Металлы находятся в центре и слева в таблице Менделеева. Их можно дополнительно классифицировать как щелочные металлы, щелочноземельные металлы, переходные металлы и основные металлы.
Урок науки о металлах
Свойства металлов
Элемент — это вещество, состоящее из одного вида атомов; его нельзя разделить на более простые части. Например, элемент гелий (вспомните воздушные шары) состоит исключительно из атомов гелия.
Элементы обычно классифицируются как металлы или неметаллы (хотя некоторые элементы имеют характеристики обоих; они называются металлоиды ).
Три свойства металлов:
- Блеск: Металлы блестят при резке, царапании или полировке.

- Пластичность: Металлы прочные, но податливые, что означает, что их можно легко согнуть или придать им форму. На протяжении веков кузнецы могли придавать металлическим предметам форму, нагревая металл и отбивая его молотком. Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичны , что означает, что их можно вытягивать для изготовления проволоки.
- Проводимость: Металлы являются отличными проводниками электричества и тепла. Поскольку они также пластичны, они идеально подходят для электропроводки. (Вы можете проверить это с помощью некоторых предметов домашнего обихода. Продолжайте читать, чтобы узнать, как!)
Дополнительные свойства металлов
Высокая температура плавления : Большинство металлов имеют высокие температуры плавления, и все, кроме ртути, твердые при комнатной температуре.
Звонкий : Металлы часто издают звенящий звук при ударе.
Реактивность : Некоторые металлы претерпевают химическое изменение (реакцию) сами по себе или с другими элементами и выделяют энергию. Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они находятся. Наиболее реакционноспособными металлами являются калий и натрий. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Другие металлы вообще не реагируют с другими металлами. Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и электропроводки.
Пять групп металлов:
Благородные металлы встречаются в виде чистых металлов, потому что они нереакционноспособны и не соединяются с другими элементами с образованием соединений. Поскольку они настолько нереактивны, они не подвержены коррозии. Это делает их идеальными для ювелирных изделий и монет.
Благородные металлы включают медь, палладий, серебро, платину и золото.
Щелочные металлы очень реакционноспособны. Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было резать ножом. Калий и натрий — два щелочных металла.
Щелочноземельные металлы встречаются в соединениях со многими различными минералами. Они менее реакционноспособны, чем щелочные металлы, а также тверже и имеют более высокие температуры плавления. В эту группу входят кальций, магний и барий.
Переходные металлы — это то, о чем мы обычно думаем, когда думаем о металлах. Они твердые и блестящие, прочные и легко поддаются формовке. Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Бедные металлы довольно мягкие, и большинство из них не используются сами по себе. Однако они становятся очень полезными при добавлении к другим веществам.
К бедным металлам относятся алюминий, галлий, олово, таллий, сурьма и висмут.
Сплавы: сильные комбинации
Свойства этих различных металлов можно комбинировать, смешивая два или более из них вместе. Полученное вещество называется сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковородки, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Другие сплавы, такие как латунь (медь и цинк) и бронза (медь и олово), легко поддаются обработке и выглядят красиво. Бронза также часто используется в судостроении, потому что она устойчива к коррозии в морской воде.
Титан намного легче и менее плотный, чем сталь, но такой же прочный; и хотя он тяжелее алюминия, он вдвое прочнее. Он также очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Он также очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Золото как чистый металл настолько мягкое, что его всегда смешивают с другим металлом (обычно серебром, медью или цинком), когда из него делают украшения. Чистота золота измеряется в карат. Самое чистое, что вы можете получить в ювелирных изделиях, составляет 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное в ювелирных изделиях, представляет собой сплав золота и платины или палладия.
Металл из руды
Руды – это горные породы или минералы, из которых можно извлечь ценное вещество – обычно металл. Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и бокситы (алюминий). Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.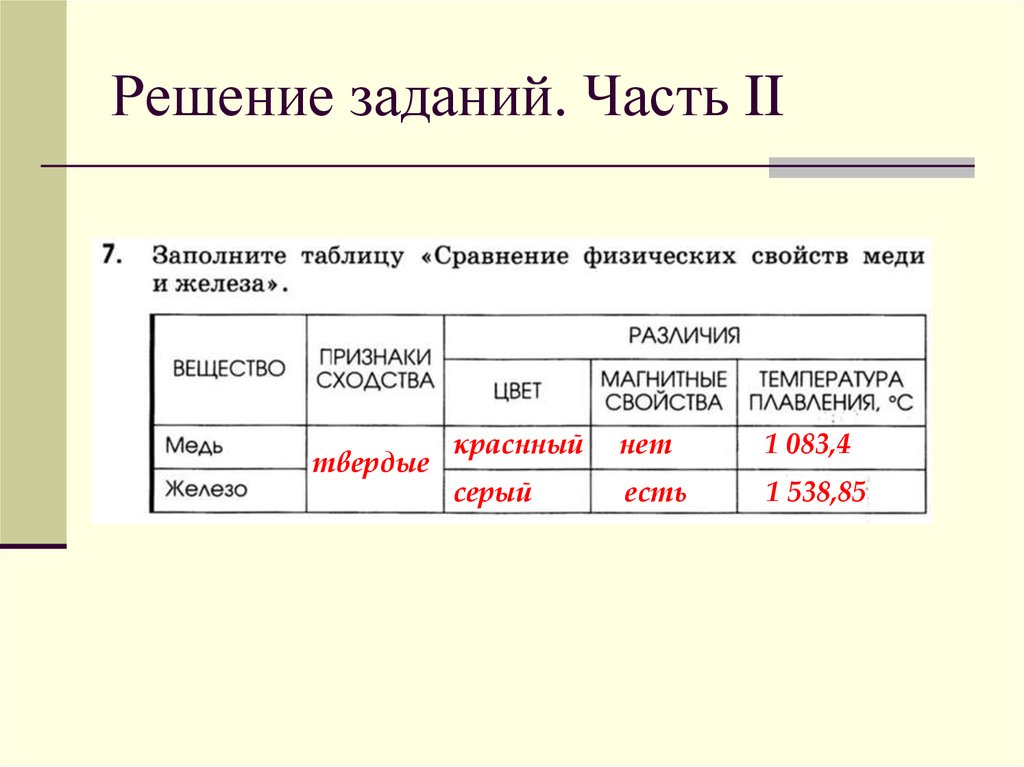
Существует несколько процессов переработки железа из руды. Более старый процесс заключается в сжигании железной руды с использованием древесного угля (углерода) и кислорода, подаваемого с помощью мехов. Углерод и кислород, включая кислород в руде, соединяются и выходят из железа. Однако железо не нагревается настолько, чтобы полностью расплавиться, и содержит силикаты, оставшиеся от руды. Его можно нагреть и выковать, чтобы сформировать кованое железо .
В более современном процессе используется доменная печь для нагрева железной руды, известняка и кокса (угольный продукт, а не безалкогольный напиток). В результате реакции железо отделяется от кислорода в руде. Этот «чугун» необходимо дополнительно смешать для создания кованого железа. Его также можно использовать для другой важной цели: при нагревании с углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Принимая во внимание процесс, неудивительно, что железо не использовалось примерно до 1500 г. до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а сплав бронзы, как полагают, был открыт шумерами около 3500 г. до н.э. Но алюминий, один из самых важных металлов в современном использовании, не был открыт до 1825 года нашей эры и не использовался до 20-го века!
до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а сплав бронзы, как полагают, был открыт шумерами около 3500 г. до н.э. Но алюминий, один из самых важных металлов в современном использовании, не был открыт до 1825 года нашей эры и не использовался до 20-го века!
Коррозия: обработка и предотвращение
Видели ли вы когда-нибудь кусок серебра, который потерял свой блеск, или железо с красноватой ржавчиной на нем или даже отверстия в нем, вызванные коррозией? Это происходит, когда кислород (обычно из воздуха) реагирует с металлом. Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такому химическому разрушению или коррозии .
Когда кислород реагирует с металлом, он образует оксид на поверхности металла. Для некоторых металлов, таких как алюминий, это хорошо. Оксид обеспечивает защитный слой, который предотвращает дальнейшую коррозию металла.
Железо и сталь, с другой стороны, имеют серьезные проблемы, если они не обработаны для предотвращения коррозии. Красноватый оксидный слой, который образуется на железе или стали при взаимодействии с кислородом, называется ржавчиной . Слой ржавчины постоянно отслаивается, подвергая коррозию большую часть металла, пока металл не будет проеден насквозь.
Одним из распространенных способов защиты железа является покрытие его специальной краской, которая предотвращает реакцию кислорода с металлом под краской. Другим методом является гальванизация : в этом процессе сталь покрывается цинком. Кислород, молекулы воды и углекислый газ в воздухе реагируют с цинком, образуя слой карбоната цинка, защищающий от коррозии. Осмотрите свой дом, двор и гараж на предмет коррозии, а также оцинковки и других средств защиты металла от ржавчины.
Технология: фейерверк и химия
Если вы посмотрите фейерверк на Четвертое июля, вы увидите красивые сочетания цветов и искр.
Как работает этот удивительный пиротехнический дисплей? Короткий ответ: химия. Более длинный включает в себя повторение свойств металлов.
Одним из ключевых ингредиентов петард, наземных и воздушных фейерверков (которые взрываются в небе) является черный порох , изобретенный китайцами около 1000 лет назад. Это смесь нитрата калия (селитры), древесного угля и серы в соотношении 75:15:10. Черный порох используется для запуска антенн, а также вызывает взрывы, необходимые для создания специальных эффектов, таких как шум или цветной свет.
В бенгальских огнях черный порох смешивается с металлическим порошком и другими химическими соединениями в форме, которая будет медленно гореть сверху донизу. В простых ракетах для фейерверков черный порох находится в трубке вокруг взрывателя. Когда горит, порох создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем вызывая взрыв соединений внутри него в воздухе.
Более сложные снаряды для фейерверков запускаются из миномета, трубки с черным порохом, который при поджигании вызывает реакцию отрыва. Затем взрыватель снаряда фейерверка загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда приводит к разрыву зарядов спецэффектов.
Затем взрыватель снаряда фейерверка загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда приводит к разрыву зарядов спецэффектов.
Яркая, красочная часть фейерверка вызвана «возбужденными» электронами в атомах различных соединений металлов и солей. Эти соединения находятся в маленьких шариках, называемых звездами , и сделаны из того же соединения, что и бенгальский огонь.
Металлы как красители
Различные металлы горят разными цветами; например, если зажечь соединение меди, его пламя будет сине-зеленого цвета. Кальций горит красным, а калий — фиолетовым. В фейерверках металлы объединяются для создания разных цветов.
Когда звездные соединения внутри фейерверка нагреваются, возбужденные атомы выделяют световую энергию. Этот свет делится на две категории: накаливания и люминесценции. Лампа накаливания — это свет, создаваемый теплом: в фейерверках химически активные металлы, такие как алюминий и магний, вызывают вспышку очень яркого света, когда они нагреваются — иногда при температуре более 5000 ° F!
Менее реакционноспособные соединения не так сильно нагреваются, что приводит к более тусклым искрам. Люминесценция , с другой стороны, производится из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они прыгают обратно на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Люминесценция , с другой стороны, производится из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они прыгают обратно на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Хлорид бария — химическое соединение, придающее фейерверкам люминесцентный зеленый цвет, а хлорид меди — синий. Для любого типа света важно использовать чистые ингредиенты, так как следы других соединений затемняют цвет.
Дополнительная литература о металлах:
- Скульптура с вращающейся проволокой
- Проекты Ярмарки химических наук
- Проекты Ярмарки научных наук по физике
- Проекты круглых наук Что такое Density
- Скачать
- Электронная почта
- Печать
- Добавить в закладки или поделиться
- Плотность — это характеристическое свойство вещества.
- Плотность вещества представляет собой отношение между массой вещества и тем, сколько места оно занимает (объем).
- Масса атомов, их размер и то, как они расположены, определяют плотность вещества.
- Плотность равна массе вещества, деленной на его объем; Д = м/об.
- Объекты с одинаковым объемом, но разной массой имеют разную плотность.
- Кубики с пометкой A–H, которыми вы поделитесь с другими группами
- Весы для измерения в граммах
- Калькулятор
- Медный куб и алюминиевый куб одного объема
- Весы
Продемонстрируйте, что кубы одного объема, но сделанные из разных металлов, имеют разную массу.
Вопрос для расследования
Имеют ли кубы одинакового размера и формы одинаковую массу?
Материалы для демонстрации
- Медный куб и алюминиевый куб одного объема
- Весы
Процедура
Поместите медный и алюминиевый кубик на противоположные стороны простых весов.

Ожидаемые результаты
Медный куб будет иметь большую массу, чем алюминиевый куб.
Обсудите, почему медный куб имеет большую массу, чем алюминиевый куб.
Скажите учащимся, что оба куба имеют одинаковый размер и оба сплошные, без полых участков. Объясните, что алюминиевый куб состоит только из атомов алюминия, а медный куб состоит только из атомов меди.
Спросите студентов:
- Как могут два объекта одинакового размера и формы иметь разную массу?
- Помогите учащимся понять, что разница в массе должна иметь какое-то отношение к атомам в каждом кубе. Есть три возможных объяснения атомов меди и алюминия в кубах, которые могли бы объяснить разницу в массе.
- Атомы меди могут иметь большую массу, чем атомы алюминия.
- Атомы меди могут быть меньше, поэтому в том же объеме может поместиться больше атомов.
- Атомы меди и алюминия могут располагаться по-разному, поэтому в кубе одного размера помещается больше атомов меди.

Объясните, что любое из этих объяснений по отдельности или два или три вместе могут быть причиной того, что медный куб имеет большую массу.
Раздайте каждому учащемуся лист с заданиями.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Спроектируйте иллюстрацию и используйте изображения атомов меди и алюминия, чтобы представить понятие плотности.
Предложите учащимся обратиться к изображению медных и алюминиевых кубиков и их атомов на рабочих листах.
Покажите учащимся изображение Атомы алюминия и меди
Укажите, что атомы меди немного меньше атомов алюминия. Этот меньший размер означает, что больше атомов меди может поместиться в том же объеме пространства.
 Итак, медный куб содержит больше атомов, чем алюминиевый. Хотя они меньше, отдельные атомы меди на самом деле имеют большую массу, чем отдельные атомы алюминия. Комбинация большего количества атомов, каждый из которых имеет большую массу, заставляет медный куб весить больше, чем алюминиевый куб того же размера и формы.
Итак, медный куб содержит больше атомов, чем алюминиевый. Хотя они меньше, отдельные атомы меди на самом деле имеют большую массу, чем отдельные атомы алюминия. Комбинация большего количества атомов, каждый из которых имеет большую массу, заставляет медный куб весить больше, чем алюминиевый куб того же размера и формы.Объясните учащимся, что такое представление о том, насколько тяжело что-то соотносится с объемом занимаемого им пространства, называется плотностью. Плотность объекта – это отношение массы объекта к его объему. Уравнение плотности: Плотность = масса/объем или D = m/v. Каждое вещество имеет свою характерную плотность из-за размера, массы и расположения его атомов или молекул.
Покажите анимацию и продемонстрируйте, как измерить объем и массу куба.
Объясните учащимся, что объем — это мера пространства, которое занимает объект. Он всегда в трех измерениях. Чтобы найти объем объекта, такого как куб или коробка, вы измеряете длину, ширину и высоту, а затем умножаете их (V = l × w × h).
 Если измерять в сантиметрах, ответ будет в кубических сантиметрах (см 3 ).
Если измерять в сантиметрах, ответ будет в кубических сантиметрах (см 3 ).Примечание. Студенты часто путают объем и площадь. Проверьте их понимание, чтобы убедиться, что они знают разницу. Убедитесь, что они понимают, что площадь измеряется в двух измерениях (длина × ширина) с ответом в см 2 . Площадь – это мера количества поверхности. Но объем измеряется в трех измерениях (длина × ширина × высота) с ответом в см 3 . Объем — это мера всего объекта, включая поверхность и все пространство, занимаемое объектом.
Показать анимационный куб.
Пока проигрывается анимация, вы можете продемонстрировать процесс измерения с помощью куба и линейки. Попросите учащихся измерить вместе с вами, чтобы подтвердить объем кубиков.
- Том
- Кубики по 2,5 сантиметра с каждой стороны. Покажите учащимся, что для вычисления объема нужно умножить длину (2,5 см) × ширину (2,5 см) × высоту (2,5 см), чтобы получить 15,625 см 3 .
 Округление этого числа до 15,6 см 3 будет достаточно точным и упростит расчеты плотности. Запишите объем куба в кубических сантиметрах (см 3 ).
Округление этого числа до 15,6 см 3 будет достаточно точным и упростит расчеты плотности. Запишите объем куба в кубических сантиметрах (см 3 ). - Масса
- Продемонстрируйте, как использовать весы, которые учащиеся будут использовать для измерения массы куба. Запишите массу кубика в граммах (г).
- Плотность
- Покажите учащимся, как рассчитать плотность путем деления массы на объем. Укажите, что ответ будет в граммах на кубический сантиметр (г/см 3 ).
Предложите учащимся вычислить плотность восьми различных кубов и использовать характеристическое свойство плотности, чтобы правильно их идентифицировать.
Группам учащихся не нужно будет измерять объем кубов. Объем каждого куба одинаков, 15,6 см 3 и указан в таблице на листе с заданиями. Им нужно будет измерить массу каждого из восьми различных кубов и рассчитать их плотность. Учащиеся будут использовать свои значения плотности для идентификации каждого куба.

Примечание. Плотность, рассчитанная учащимися, может не совпадать с плотностью, указанной в этой таблице. Однако их расчеты будут достаточно точными, чтобы они могли идентифицировать большинство кубов.
Вопрос для расследования
Можете ли вы использовать плотность, чтобы идентифицировать восемь кубов, сделанных из разных материалов?
Материалы для класса
- Набор из восьми кубиков одинакового объема
- Калькулятор
Подготовка учителей
С помощью куска малярной ленты и перманентного маркера отметьте восемь кубиков буквами A–H.
Материалы для каждой группы
- Кубики с пометкой A–H, которыми вы поделитесь с другими группами
- Весы для измерения в граммах
- Калькулятор
Процедура
- Объем каждого куба указан в таблице. Это 15,6 см 3 .
- Найдите массу в граммах каждого кубика с помощью весов или весов.
 Запишите эту массу в таблицу.
Запишите эту массу в таблицу. - Обменивайтесь кубиками с другими группами, пока не измерите массу всех восьми кубиков.
Рассчитайте плотность по формуле D = m/v и запишите ее на графике.
Таблица 1. Объем, масса и плотность для неизвестных A–H Образец Объем (см 3 ) Масса (г) Плотность (г/см 3 ) Материал А 15,6 Б 15,6 С 15,6 Д 15,6 Е 15,6 Ф 15,6 Г 15,6 Н 15,6 Таблица 2.  Приблизительные плотности различных материалов.
Приблизительные плотности различных материалов.Материал Приблизительная плотность (г/см 3 ) Алюминий 2,9 Латунь 8,8 Медь 9,3 Сталь 8,2 ПВХ 1,3 Нейлон 1,2 Дуб 0,7–0,9 Сосна или тополь 0,4–0,6 - Сравните найденное вами значение плотности с данным значением в таблице ниже, чтобы определить, из какого материала сделан куб. Напишите название материала в таблице для кубов A–H.
Ожидаемые результаты: Значения плотности учащихся для каждого куба не будут точными, но будут достаточно близкими, чтобы они могли идентифицировать каждый из кубов.
 Вы можете заметить, что приблизительные плотности, указанные для каждого куба в этом уроке, немного отличаются от тех, которые указаны в наборе кубов. Большая часть этой разницы, вероятно, связана со значением объема каждого куба. Поскольку вполне вероятно, что это кубы со стороной 1 дюйм, каждая сторона должна быть 2,54 см. Мы округлим до 2,5 см, потому что учащиеся могут легко сделать это измерение.
Вы можете заметить, что приблизительные плотности, указанные для каждого куба в этом уроке, немного отличаются от тех, которые указаны в наборе кубов. Большая часть этой разницы, вероятно, связана со значением объема каждого куба. Поскольку вполне вероятно, что это кубы со стороной 1 дюйм, каждая сторона должна быть 2,54 см. Мы округлим до 2,5 см, потому что учащиеся могут легко сделать это измерение.Обсудите, как масса, размер и расположение атомов и молекул влияют на плотность металла, пластика и дерева
Объясните учащимся, что каждое вещество имеет свою плотность из-за атомов и молекул, из которых оно состоит. Кубики из металла, пластика и дерева, которые измеряли учащиеся, имеют свою уникальную плотность. В общем, плотность металла, пластика и дерева можно объяснить, глядя на размер и массу атомов и на то, как они расположены.
- Металл
- Проецирование изображения Металл
- Наиболее распространенные металлы, такие как алюминий, медь и железо, имеют большую плотность, чем пластик или дерево.
 Атомы, из которых состоят металлы, как правило, тяжелее атомов пластика и дерева, и они расположены ближе друг к другу. Разница в плотности между различными металлами обычно связана с размером и массой атомов, но расположение атомов в большинстве металлов в основном одинаково.
Атомы, из которых состоят металлы, как правило, тяжелее атомов пластика и дерева, и они расположены ближе друг к другу. Разница в плотности между различными металлами обычно связана с размером и массой атомов, но расположение атомов в большинстве металлов в основном одинаково. - Пластик
- Проецирование изображения Пластик
- Большинство пластмасс менее плотны, чем металл, но могут иметь такую же плотность, как древесина. Пластмассы состоят из отдельных молекул, связанных вместе в длинные цепочки, называемые полимерами. Эти полимерные цепи расположены и упакованы вместе, чтобы сделать пластик. Один распространенный пластик, полиэтилен, состоит из множества отдельных молекул, называемых этиленом, которые связаны друг с другом, образуя длинные полимерные цепи. Как и большинство пластиков, полимеры полиэтилена состоят из атомов углерода и водорода.
- Атомы углерода и водорода очень легкие, что придает пластикам относительно низкую плотность. Пластмассы могут иметь разную плотность, потому что к углеродно-водородным цепочкам могут присоединяться разные атомы.
 Плотность различных пластиков также зависит от плотности упаковки этих полимерных цепей.
Плотность различных пластиков также зависит от плотности упаковки этих полимерных цепей. - Древесина
- Проецирование изображения Дерево
- Древесина состоит в основном из атомов углерода, водорода и кислорода, связанных вместе в молекулу, называемую глюкозой. Эти молекулы глюкозы связаны вместе, образуя длинные цепи, называемые целлюлозой. Множество молекул целлюлозы, сложенных вместе, придают древесине ее структуру и плотность.
В целом плотность дерева и пластика одинакова, потому что они состоят из одинаковых атомов, расположенных в длинные цепочки. Разница в плотности в основном основана на расположении и упаковке полимерных цепей. Кроме того, поскольку древесина происходит от живого существа, на ее плотность влияет структура растительных клеток и других веществ, из которых состоит древесина.
Спросите студентов:
Размер, масса и расположение атомов влияют на плотность вещества.
- Как эти факторы могут работать вместе, чтобы вещество имело высокую плотность?
- Вещество с более мелкими и массивными атомами, расположенными близко друг к другу, будет иметь более высокую плотность.

- Как эти факторы могут работать вместе, чтобы вещество имело низкую плотность?
- Вещество с более крупными и легкими атомами, которые находятся дальше друг от друга, будет иметь меньшую плотность.
Предложите учащимся объяснить на молекулярном уровне, почему два блока из разных материалов, имеющих одинаковую массу, могут иметь разную плотность.
Напомните учащимся, что они рассматривали кубики одинакового объема, но разной массы. Обратите внимание на то, что в их рабочих листах есть рисунки двух блоков (образец A и образец B), сделанных из разных веществ, которые имеют одинаковую массу, но разные объемы.
Спросите студентов:
- Какова плотность образца А?
- Объем = 5 × 5 × 4 = 100 см 3
- Масса = 200 г
- Плотность = 200 г/100 см 3 = 2 г/см 3
- Какова плотность образца B?
- Объем = 5 × 5 × 2 = 50 см 3
- Масса = 200 г
- Плотность = 200 г/50 см 3 = 4 г/см 3
Приведите два возможных объяснения того, почему один образец более плотный, чем другой.

Подсказка: размер, масса и расположение молекул влияют на плотность вещества. Есть несколько возможных ответов на вопрос, почему образец B более плотный, чем образец A.
- Атомы образца B могут иметь большую массу, чем атомы образца A.
- Атомы образца B могут быть меньше атомов образца A, поэтому в том же объеме может поместиться больше атомов.
- Атомы образца B могут быть расположены по-разному, поэтому в кубе одного размера помещается больше атомов образца B, чем атомов образца A.
Любое из этих объяснений по отдельности или любое их сочетание может быть причиной того, что Образец B более плотный, чем Образец A.
- Драгоценные металлы : включает золото, серебро, платину и бриллианты. Около 90 процентов всего производства золота приходится на золотые прииски. Остальные 10 процентов производятся как побочный продукт добычи других металлов, таких как медь и никель. Драгоценные металлы продаются на мировых рынках и используются в самых разных областях: от ювелирных изделий до электроники и автомобильных каталитических нейтрализаторов.
- Неблагородные металлы : Это в основном означает медь, свинец и цинк, которые имеют более низкую стоимость. Рафинированные формы этих металлов обычно продаются на мировых рынках. Это основные строительные материалы для большей части окружающего нас мира.
- Черные металлы : Металлы с высоким содержанием железа, включая все виды стали. Хром, кобальт, марганец и молибден обычно включаются в эту группу, поскольку их основное применение заключается в улучшении свойств стали.
- Цветные металлы : сюда входят алюминий, медь, свинец, магний, никель, олово и цинк, поскольку их основное применение не связано с производством стали. Обратите внимание, что есть некоторое совпадение с группой неблагородных металлов — выбор группы зависит от контекста.
- Редкоземельные металлы : На самом деле это не такие уж редкие металлы, но их добыча сложна и трудна. К ним относятся скандий, иттрий, лантан и 14 элементов (лантаноидов), следующих за лантаном в периодической таблице.
 Они широко используются, хотя и в небольшом объеме, в производстве стекла, керамики, глазури, магнитов, лазеров и телевизионных трубок, а также при переработке нефти.
Они широко используются, хотя и в небольшом объеме, в производстве стекла, керамики, глазури, магнитов, лазеров и телевизионных трубок, а также при переработке нефти. - Сплавы : они изготавливаются путем смешивания двух или более металлических элементов с образованием нового уникального вещества, химические и физические свойства которого отличаются от составляющих его частей. Более 90 процентов металлов, используемых сегодня, представляют собой сплавы.
- Транспортировка : С точки зрения транспортировки наиболее важными классификациями являются те, которые определяют физико-химические свойства, такие как воспламеняемость, взрывоопасность и коррозионная активность по отношению к другим металлам. Например, ртуть вызывает коррозию алюминия, поэтому ее использование в самолетах запрещено. Класс опасности определяет, как можно безопасно транспортировать продукт (например, для упакованных товаров он определяет, какие бочки можно использовать). Отсутствие подходящей упаковки может помешать транспортировке товаров к покупателям или другим объектам, что имеет серьезные последствия для торговли. Различные виды транспорта могут иметь разные критерии, например, морской транспорт определяется Международной морской организацией (ИМО).

5? | Глава 3: Плотность
Пропустить навигацию
Тебе это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Спасибо!
Урок 3.1
Основные понятия
Резюме
Учащиеся увидят медный и алюминиевый кубы одинакового объема, поставленные на весы. Они увидят, что медь имеет большую массу. Студенты попытаются разработать объяснение на молекулярном уровне того, как это может быть. Затем учащимся раздаются кубики из разных материалов одинакового объема. Учащиеся определяют плотность каждого кубика и определяют вещество, из которого он сделан.
Задача
Учащиеся смогут рассчитать плотность различных кубов и использовать эти значения для определения вещества, из которого состоит каждый куб. Учащиеся смогут объяснить, что размер, масса и расположение атомов или молекул вещества определяют его плотность.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и ваши ученики носите подходящие защитные очки.
Материалы для каждой группы
Демонстрационные материалы
Примечания к материалам
Кубики
Для этого урока вам понадобится набор кубиков из разных материалов одинакового объема. Эти наборы кубиков доступны от различных поставщиков. Компания Flinn Scientific продает набор кубов плотности, номер продукта AP6058. В набор входит 10 кубиков: 4 металлических, 3 пластиковых и 3 деревянных. Студентам будет легче, если вы уменьшите число до 8, используя все образцы металла, но только два деревянных и два пластиковых кубика. Мы предлагаем использовать нейлоновый (не совсем белый, наименее плотный) пластиковый куб и пластиковый куб из ПВХ (серый, наиболее плотный). В качестве дерева мы предлагаем использовать дуб (более темный и плотный) и либо сосну, либо тополь (более светлый, менее плотный). В упражнении каждая группа должна будет измерить массу каждого из восьми кубиков. Группам необходимо измерить и записать свои данные для куба и передать их другой группе, пока каждая группа не использует каждый из кубов.
Эти наборы кубиков доступны от различных поставщиков. Компания Flinn Scientific продает набор кубов плотности, номер продукта AP6058. В набор входит 10 кубиков: 4 металлических, 3 пластиковых и 3 деревянных. Студентам будет легче, если вы уменьшите число до 8, используя все образцы металла, но только два деревянных и два пластиковых кубика. Мы предлагаем использовать нейлоновый (не совсем белый, наименее плотный) пластиковый куб и пластиковый куб из ПВХ (серый, наиболее плотный). В качестве дерева мы предлагаем использовать дуб (более темный и плотный) и либо сосну, либо тополь (более светлый, менее плотный). В упражнении каждая группа должна будет измерить массу каждого из восьми кубиков. Группам необходимо измерить и записать свои данные для куба и передать их другой группе, пока каждая группа не использует каждый из кубов.
Весы
Для демонстрации используйте простые пластиковые двусторонние весы, которые выглядят как качели. Одним из самых дешевых является весы Delta Education Primary Balance (21 дюйм), номер продукта WW020-0452. Предложите учащимся использовать любые весы, которые могут измерять в граммах.
Предложите учащимся использовать любые весы, которые могут измерять в граммах.
Метрическая линейка
Учащиеся будут использовать метрическую линейку в основной части задания, когда вместе с вами будут измерять длину, ширину и высоту куба.
Об этом уроке
Это первый урок, на котором учащиеся видят модели более сложных молекул, чем молекула воды. Некоторые из этих молекул могут выглядеть немного пугающе. Сообщите учащимся, что им не нужно запоминать или рисовать эти молекулы. Для целей этой главы учащимся нужно думать только о размере и массе атомов, составляющих молекулу, и о том, как они расположены в веществе.
ICMM — Металлы и минералы
Считается, что существует более 4000 различных минералов, многие из которых содержат металлические элементы.
Минералы – это твердые природные неорганические вещества, обнаруженные в земной коре. Они имеют уникальный химический состав и кристаллическую структуру.
Они имеют уникальный химический состав и кристаллическую структуру.
Металлы — это элементарные вещества, такие как золото, серебро и медь. В твердом состоянии они кристаллические и естественным образом встречаются в минералах. Они часто являются хорошими проводниками электричества и тепла, блестящими и податливыми. Металлы, которые мы используем изо дня в день, преобразуются из металлических руд в их окончательную форму. Обычно для этого требуется использование химикатов и специальной технологии.
Общие группы металлов
Металлы часто группируют по их свойствам или функциям.
Легирующие элементы обычно добавляют к чистым металлам для повышения их прочности или улучшения свойств, таких как коррозионная стойкость, износостойкость и способность к резанию. Высокие промышленные требования, такие как стойкость к экстремальным температурам, прочность для приложений с высоким давлением, сопротивление усталости, снижение веса или ударная вязкость, часто в сочетании, привели к разработке широкого спектра сплавов.
Наиболее распространенные сплавы широко классифицируются как стали. Эти характерно прочные сплавы, образованные из железа и углерода, можно смешивать с другими элементами для дальнейшего повышения производительности и долговечности. Например, автомобиль содержит более 10 различных стальных сплавов для кузовных деталей, шестерен, приводов, коленчатых валов, клапанов и так далее.
Эти характерно прочные сплавы, образованные из железа и углерода, можно смешивать с другими элементами для дальнейшего повышения производительности и долговечности. Например, автомобиль содержит более 10 различных стальных сплавов для кузовных деталей, шестерен, приводов, коленчатых валов, клапанов и так далее.
Эксперты прогнозируют, что потребность в более энергоэффективных системах, информационных технологиях и освоении космоса станет основной движущей силой разработки новых сплавов.
Металлы и минералы будут оказывать опасное воздействие только при определенных условиях (известных как путь воздействия). Например, пары припоя очень токсичны при вдыхании, но совершенно безопасны при попадании на кожу. Классификация опасности химического вещества основана на присущей ему опасности. Он не рассматривает нормальные условия использования, когда нет реальных обстоятельств, при которых воздействие может причинить вред. Промышленность в течение многих лет утверждала, что это необходимо решать.
Способ классификации металлов и полезных ископаемых оказывает непосредственное влияние на то, как и где они могут использоваться, поскольку классификация формирует основу для других регулирующих мер.
Соответствие Согласованной на глобальном уровне системе классификации и маркировки химических веществ ЕЭК ООН (СГС) является законодательным требованием во все большем числе стран. При внедрении СГС обеспечивает стандартизированный, современный и универсальный формат для передачи информации об опасностях пользователям посредством предоставления паспортов безопасности и этикеток опасных продуктов. Операторам в последующих секторах необходим доступ к актуальной информации, чтобы они могли обеспечить безопасность своих работников, объектов, клиентов и окружающей среды.
Как ICMM повышает производительность
Члены компании ICMM обязуются оценивать опасность продуктов горнодобывающей промышленности в соответствии с СГС (или аналогичными соответствующими нормативными системами) и сообщать информацию с помощью паспортов безопасности и маркировки в зависимости от обстоятельств.
Члены ICMM также работают над разработкой методологий испытаний, ориентированных на металлы, чтобы гарантировать точную оценку профилей опасности металлов и минералов. Полученная информация позволяет эффективно и безопасно использовать металлы и минералы.
