Меди основные свойства: Электротехническая медь, основные характеристики
Содержание
Получение и химические реакции меди
Нахождение в природе.
Медь встречается главным образом в виде сульфидных соединений. Наиболее важные минералы — медный блеск Cu2S, медный колчедан (халькопирит) CuFeS2 и борнит Cu3FeS2 входят в состав так называемых полиметаллических сульфидных руд. Реже встречаются кислородсодержащие соединения: малахит (основной карбонат меди) СuСО3 • Сu(ОН)2, азурит 2СuСО3 • Сu(ОН)2 и куприт СuO2.
Физические свойства.
Медь — металл красного цвета, плавится при температуре 1083°С, кипит при 2877°С. Чистая медь довольно мягка, легко поддается прокатке и вытягиванию. Примеси увеличивают твердость меди. Медь отличается очень высокой электро- и теплопроводностью. Примеси мышьяка и сурьмы значительно уменьшают электропроводность меди. Медь образует различные сплавы (латуни, бронзы и др.).
Химические свойства.
Медь относится к числу малоактивных металлов. На холоду она очень слабо взаимодействует с кислородом воздуха, покрываясь пленкой оксида, которая препятствует дальнейшему окислению меди. При нагревании медь окисляется полностью:
На холоду она очень слабо взаимодействует с кислородом воздуха, покрываясь пленкой оксида, которая препятствует дальнейшему окислению меди. При нагревании медь окисляется полностью:
2Cu + O2 = 2СuО
Сухой хлор на холоду не взаимодействует с медью, однако в присутствии влаги реакция проходит довольно энергично:
Сu + Сl2 = СuС12.
При нагревании медь довольно энергично взаимодействует с серой:
Си + S = CuS.
Медь может растворятся только в кислотах-окислителях. В концентрированной серной кислоте она растворяется только при нагреваний, a в азотной — и на холоду:
Сu+ 2H2SO4 = CuSO4 + SO2 + 2Н2O,
ЗСu + 8HNO3(Разбавл.) = 3Cu(NO3)2 + 2NO + 4Н2O,
Сu + 4HNO3(Конц .) = Cu(NO3)2+ 2NO + 2Н2O.
Получение.
Процесс получения меди состоит из нескольких стадий. Сначала сульфидную руду обжигают. При этом часть меди превращается в оксид:
При этом часть меди превращается в оксид:
4CuFeS2 + 13O2 = 4CuO + 2Fe203 + 8SO2.
Затем проводят плавку на штейн и получают сульфид меди (I). При этом к огарку прибавляют кокс и песок для образования шлака:
2CuO + FeS + С + SiO2 = Cu2S + FeSi03 + СО
или
CuO + FeO + CuS + С + SiO2 = Cu2S + FeSiO3+ CO.
Далее штейн подвергают конвертерной плавке:
9Cu2 S + 3O2 = 2Cu2 O + 2SO2 ,
2CuO2 + Cu2 S = 6Cu + SO2 .
Получаемая медь называется черновой.
Очищают медь рафинированием. Электролитом служит раствор сульфата меди, анодом — медные болванки ,катодом — пластинка чистой меди. При пропускании электрического тока через электролит медь анода растворяется, а на катоде выделяется чистая медь.
Оксид меди
Обладает основными свойствами. Он может взаимодействовать с кислотами и кислотными оксидами:
CuO + H2SО4 = CuSО4 + Н2О,
CuO + SО3 = CuSО4.
Оксид меди не растворим в воде. При нагревании оксида меди и присутствии восстановителя довольно легко происходит его восстановление:
CuO + Н2 = Сu + Н2O,
СuО + СО = Сu + СO2.
Оксид меди получают окислением меди при нагревании или прокаливанием гидроксида меди:
2Сu + O2 = 2СuО,
Cu(OH)2 = CuO + Н2O.
Оксид меди встречается в природе в продуктах выветривания некоторых медных руд. Он используется в производстве стекла и эмалей как зеленый и синий красители (медно-рубиновое стекло), как окислитель в органическом анализе и в медицине.
Гидроксид меди
Гидроксид меди Сu(ОН)2. Выпадает в виде осадка при действии на растворы солей меди (II) растворов щелочей (но не аммиака):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4.
При действии аммиака на соли меди (II) сначала выпадает гидроксид меди, который очень легко растворяется в избытке аммиака с образованием аммиаката меди:
Cu(OH)2 + 4NH4OH = [Cu(NH3)4](OH)2 + 4Н2O
или
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2.
Аммиакат меди окрашен в интенсивный сине-фиолетовый цвет, Поэтому он позволяет обнаружить малые количества ионов меди (П) в растворе. Эта реакция применяется в аналитической химии.
Гидроксид меди обладает очень слабо выраженными амфотерными свойствами. В кислотах он растворяется легко, в концентрированных растворах щелочей — с большим трудом. В первом случае образуются соли меди, во втором — гидроксокупраты:
Сu(ОH)2 + 2NaOH = Na2[Cu(OH)4].
Гидроксид меди может восстанавливаться до гемиоксида меди при нагревании С различными не очень сильными восстановителями: альдегидами, сахарами, гидразином, гидроксиламином и др.:
2Cu(OH)2 + R—СНО → Cu2O + R—COOH + 2H2O.
Гемиоксид, или оксид меди (I)
Гемиоксид, или оксид меди (I), Си20. Обладает только основными свойствами. Часть солей меди (I) хорошо растворима, но довольно неустойчива и легко окисляется кислородом воздуха. Устойчивыми соединениями меди (I) являются, как правило, либо нерастворимые соединения (Cu2S, Cu2O, Cu2I2), либо комплексные соединения (Cu(NH3)+2 и др.). Гемиоксид меди применяется для изготовления купроксных выпрямителей переменного тока.
Устойчивыми соединениями меди (I) являются, как правило, либо нерастворимые соединения (Cu2S, Cu2O, Cu2I2), либо комплексные соединения (Cu(NH3)+2 и др.). Гемиоксид меди применяется для изготовления купроксных выпрямителей переменного тока.
При растворении гемиоксида меди в кислородсодержащих кислотах, например серной, образуются соли меди (II) и медь:
Cu2O + H2SO4 = CuSO4 + Сu + Н2O,
а при растворении в галогеноводородных кислотах — соли меди (I):
Cu20 + 2НС1 = 2СuС1 + Н2O.
Многие соли меди (II) хорошо растворимы в воде, но подвержены гидролизу, поэтому в растворе всегда должен быть небольшой избыток кислоты. Нерастворимыми солями меди (II) являются сульфид CuS, карбонат (основной карбонат) СuСO3• Сu(ОН)2 • 0,5Н2О, оксалат СuС2O4 и фосфат Сu3(РO4)2.
Под действием восстановителей соли меди (II) в кислом растворе могут восстанавливаться до солей меди (I):
2CuSO4 + 4KI = 2K2SO4 + Cu2I2 + I2
Аммиачные растворы солей меди (I) могут взаимодействовать с ацетиленом, образуя ацетиленид меди;
СН≡СН + 2CuCl = Cu2C2 + 2НС1.
Литература [3]
Таблица Самородная медь Медный купорос Изделия из меди
| История открытия:Латинское название меди Cuprum произошло от названия острова Кипр, где уже в III в. до н. э. существовали медные рудники и производилась выплавка меди. Слова медь и медный встречаются в древнейших русских литературных памятниках. Русское слово «медь» производят от греческого слова, означающего рудник, копь. Нахождение в природе, получение:Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Физические свойства:Чистая медь — тягучий вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Плотность 8,92 г/см3, температура плавления 1083,4°C, температура кипения 2567°C. Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20°C удельное сопротивление 1,68·10-3 Ом·м). Химические свойства: В химическом отношении медь является малоактивным металлом. Однако с галогенами она реагирует уже при комнатной температуре, например, с влажным хлором образует хлорид CuCl2. При нагревании медь взаимодействует и с серой, образуя сульфид Cu2S. Для меди характерны соединения со степенью окисления: +1 (менее стабильная) и +2 (более стабильная). В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Важнейшие соединения: Оксид меди(I) — Cu2O, имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию: Применение: — В электротехнике Медь является необходимым элементом для всех высших растений и животных, входя в состав многих ферментов. В крови головоногих и некоторых брюхоногих моллюсков медь выполняет ту же роль, что и железо в крови человека. В организме взрослого человека содержится до 80 мг меди и для восполнения потерь необходимо поступление меди в количестве 0,9 мг в день. При недостатке меди в организме снижается активность ферментных систем и замедляется белковый обмен и нарушается рост костных тканей. Жерновникова А., Третьякова М. Источники: Википедия: http://ru.wikipedia.org/wiki/Cu,
| ||||||||||
Медь и медные сплавы.
 Общая информация
Общая информация
Введение в медь и ее сплавы
Медь является старейшим металлом, используемым человеком. Его использование восходит к доисторическим временам. Медь добывалась более 10 000 лет, а медный кулон, найденный в современном Ираке, датируется 8700 г. до н.э. К 5000 г. до н.э. медь выплавляли из простых оксидов меди.
Медь встречается в виде самородного металла и в минералах куприте, малахите, азурите, халькопирите и борните. Он также часто является побочным продуктом производства серебра. Сульфиды, оксиды и карбонаты являются наиболее важными рудами.
Медь и медные сплавы являются одними из самых универсальных доступных конструкционных материалов. Сочетание физических свойств, таких как прочность, проводимость, коррозионная стойкость, обрабатываемость и пластичность, делает медь подходящей для широкого спектра применений. Эти свойства могут быть дополнительно улучшены за счет изменения состава и методов производства.
Медь в основном используется в строительной отрасли. В строительной отрасли использование материалов на основе меди широко. Применение меди в строительной отрасли включает:
В строительной отрасли использование материалов на основе меди широко. Применение меди в строительной отрасли включает:
~ Кровля
~ Облицовка
~ Водосточные системы
~ Системы отопления
~ Водопроводные трубы и фитинги
~ Нефтегазопроводы
~ Электропроводка
Использование меди
Строительная промышленность является крупнейшим потребителем медных сплавов. В следующем списке представлена разбивка потребления меди по отраслям в годовом исчислении:
~ Строительная промышленность – 47%
~ Электронная продукция – 23%
~ Транспорт – 10%
~ Потребительские товары – 11%
~ Промышленное оборудование – 9%
Существует около 370 коммерческих составов для медных сплавов. Наиболее распространенным сплавом, как правило, является C106/CW024A – стандартный сорт меди для водопроводных труб.
Мировое потребление меди и медных сплавов в настоящее время превышает 18 миллионов тонн в год.
Области применения
Медь и медные сплавы могут использоваться в необычайно широком диапазоне применений. Некоторые из областей применения меди включают:
~ Линии электропередачи
~ Архитектурные применения
~ Кулинарная посуда
~ Зажишки зажигания
~ Электрическая проводка, кабели и шины
~ провода с высокой проводимостью
~ Электроды
~ Теплоистряки
~ У всеоттрайные. ~ Медные тигли с водяным охлаждением
Кроме того, медные сплавы – латунь и бронза могут использоваться во многих других областях
Структура
Медь имеет гранецентрированную кубическую (ГЦК) кристаллическую структуру. Медь и ее сплавы имеют желтый/золотой/красный цвет, а при полировке приобретают яркий металлический блеск.
Переработка
Медные сплавы хорошо подходят для переработки. Около 40% годового потребления медных сплавов приходится на переработанные медные материалы.
Степень переработки латуни для свободной обработки (CZ121/CW614N) особенно высока, поскольку чистая/сухая стружка имеет высокую ценность, что способствует расчету рентабельности при выборе материала.
Свойства медных сплавов
Основные свойства медных сплавов
Медь – прочный, пластичный и ковкий материал. Эти свойства делают медь чрезвычайно подходящей для формовки труб, волочения проволоки, прядения и глубокой вытяжки. Другие ключевые свойства меди и ее сплавов включают:
~ Отличная теплопроводность
~ Отличная электропроводность
~ Хорошая коррозионная стойкость
~ Хорошая устойчивость к биологическим переворотам
~ Хорошая механизм
~ Удерживание механических и электрических свойств при криогенных температурах
~ Несагнические
Другие свойства
~ Медные и медные аллее. Они могут передаваться контактным путем, поэтому их следует держать подальше от пищевых продуктов, хотя в некоторых кастрюлях используются эти металлы.
~ Большинство коммерчески используемых металлов имеют металлический белый или серебристый цвет. Медь и медные сплавы имеют желтый/золотой/красный цвет.
Температура плавления
Температура плавления чистой меди составляет 1083ºC.
Коррозионная стойкость
Все медные сплавы устойчивы к коррозии пресной водой и паром. В большинстве сельских, морских и промышленных атмосфер медные сплавы также устойчивы к коррозии. Медь устойчива к солевым растворам, почвам, неокисляющим минералам, органическим кислотам и щелочным растворам. Влажный аммиак, галогены, сульфиды, растворы, содержащие ионы аммиака и окисляющие кислоты, такие как азотная кислота, воздействуют на медь. Медные сплавы также имеют плохую устойчивость к неорганическим кислотам.
Коррозионная стойкость медных сплавов обусловлена образованием липкой пленки на поверхности материала. Эти пленки относительно невосприимчивы к коррозии, поэтому защищают основной металл от дальнейшего воздействия.
Медно-никелевые сплавы, алюминиевая латунь и алюминиевая бронза демонстрируют превосходную стойкость к коррозии в морской воде.
Электропроводность
Электропроводность меди уступает только серебру. Электропроводность меди равна 9.7% проводимости серебра. Из-за своей гораздо более низкой стоимости и большей распространенности медь традиционно была стандартным материалом, используемым для передачи электроэнергии.
Однако соображения веса означают, что большая часть воздушных линий электропередач высокого напряжения теперь использует алюминий, а не медь. По весу проводимость алюминия примерно в два раза больше, чем у меди. Используемые алюминиевые сплавы имеют низкую прочность и должны быть усилены оцинкованной или покрытой алюминием высокопрочной стальной проволокой в каждой пряди.
Хотя добавление других элементов улучшает такие свойства, как прочность, электропроводность несколько снижается. Например, добавление кадмия в количестве 1% может увеличить прочность на 50%. Однако это приведет к соответствующему снижению электропроводности на 15%.
Однако это приведет к соответствующему снижению электропроводности на 15%.
Окисление поверхности/патинирование
Большинство медных сплавов образуют сине-зеленую патину при воздействии элементов на открытом воздухе. Типичным для этого является цвет Медной статуи Свободы в Нью-Йорке. Некоторые медные сплавы темнеют после длительного воздействия элементов и приобретают цвет от коричневого до черного.
Лаковые покрытия могут использоваться для защиты поверхности и сохранения первоначального цвета сплава. Акриловое покрытие с бензотриазолом в качестве добавки прослужит несколько лет в большинстве наружных условий без истирания.
Предел текучести
Предел текучести медных сплавов четко не определен. В результате, как правило, сообщается либо о 0,5% удлинении под нагрузкой, либо о смещении 0,2%.
Чаще всего предел текучести отожженного материала при растяжении на 0,5% соответствует приблизительно одной трети предела прочности при растяжении. Упрочнение холодной обработкой означает, что материал становится менее пластичным, а предел текучести приближается к пределу прочности при растяжении.
Упрочнение холодной обработкой означает, что материал становится менее пластичным, а предел текучести приближается к пределу прочности при растяжении.
Соединение
Для соединения большинства медных сплавов можно использовать такие широко используемые процессы, как пайка и сварка. Пайка часто используется для электрических соединений. Сплавы с высоким содержанием свинца непригодны для сварки.
Медь и медные сплавы также могут быть соединены с помощью механических средств, таких как заклепки и винты.
Горячая и холодная обработка
Хотя медь и медные сплавы могут подвергаться механической обработке, они могут подвергаться как горячей, так и холодной обработке.
Пластичность можно восстановить отжигом. Это может быть сделано либо с помощью специального процесса отжига, либо путем случайного отжига посредством процедур сварки или пайки.
Отпуск
Медные сплавы могут быть указаны в соответствии со степенями отпуска. Отпуск придается холодной обработкой и последующими степенями отжига.
Отпуск придается холодной обработкой и последующими степенями отжига.
Типичные состояния сплавов меди:
~ Мягкий
~ Полутвердый
~ Твердый
~ Пружина
~ Дополнительная пружина.
Предел текучести медного сплава в твердом состоянии составляет примерно две трети предела прочности материалов.
Литье
Характер процесса литья означает, что большинство литых медных сплавов имеют более широкий диапазон легирующих элементов, чем деформируемые сплавы.
Кованые медные сплавы
Кованые медные сплавы производятся с использованием множества различных методов производства. Эти методы включают такие процессы, как прокатка, экструзия, волочение и штамповка. За такими процессами может следовать отжиг (размягчение), холодная обработка давлением, закалка путем термической обработки или снятие напряжений для достижения желаемых свойств.
Обычное применение меди в нашей повседневной жизни
На протяжении тысячелетий медь была настолько широко распространена, что большинство людей сталкиваются с ней, даже не замечая этого. Древние египтяне использовали медь для дезинфекции ран и хирургических инструментов, а самое раннее оружие из медного сплава датируется серединой 5-го тысячелетия до нашей эры. От строительных инструментов до биологии, медь является неотъемлемой частью человеческой жизни. Нам даже нужно 1,2 миллиграмма меди в день, чтобы помочь ферментам передавать энергию внутри наших клеток. Вот несколько фактов об обычном использовании меди сегодня:
Древние египтяне использовали медь для дезинфекции ран и хирургических инструментов, а самое раннее оружие из медного сплава датируется серединой 5-го тысячелетия до нашей эры. От строительных инструментов до биологии, медь является неотъемлемой частью человеческой жизни. Нам даже нужно 1,2 миллиграмма меди в день, чтобы помочь ферментам передавать энергию внутри наших клеток. Вот несколько фактов об обычном использовании меди сегодня:
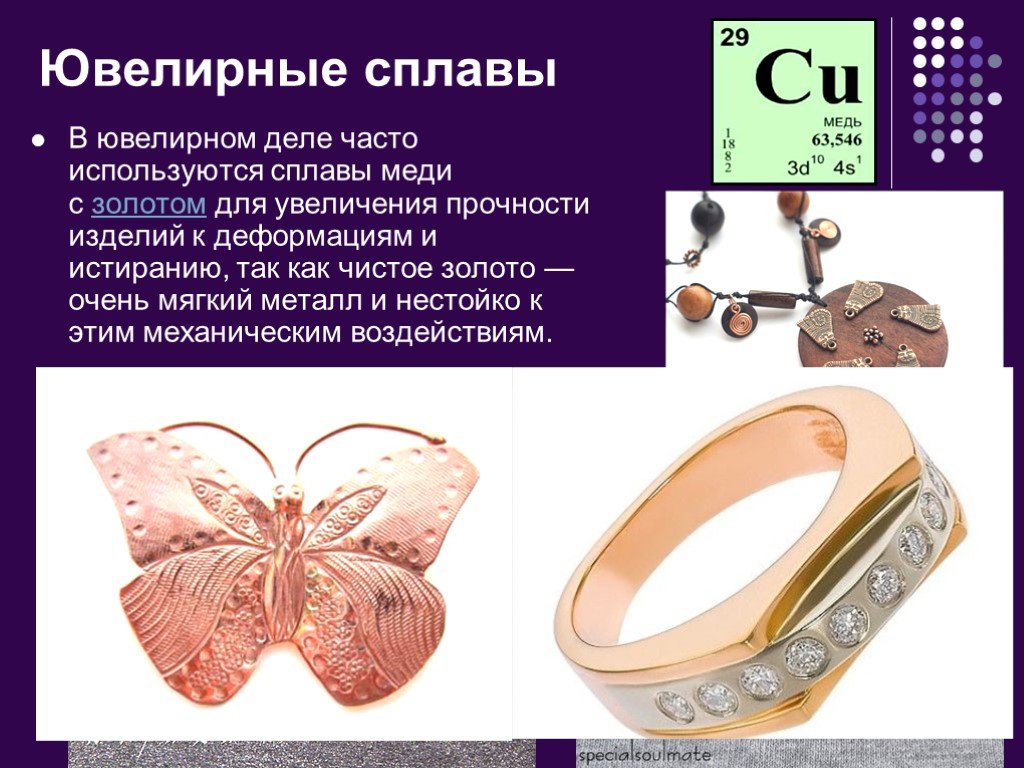
1. Медные сплавы, используемые в ювелирных изделиях
Медь представляет собой легко формуемый основной металл, который часто добавляют к драгоценным металлам для улучшения их эластичности, гибкости, твердости, цвета и устойчивости к коррозии.
Сплавы золота
Золото является одним из наиболее распространенных сплавов металлов с медью. В большинстве ювелирных магазинов вы найдете:
- Желтое золото 18 карат
- Палладиевое белое золото 18 карат
- Розовое золото 18 карат
- Розовое золото 18 карат
- Светло-зеленое золото 18 карат
На самом деле желтое золото 18 карат является наиболее часто используемым золотым сплавом в ювелирном деле.
Стерлинговое серебро
Стерлинговое серебро также представляет собой медный сплав, используемый для изготовления посуды, посуды и украшений. Это более твердый сплав, чем золото, что делает его очевидным выбором для:
- Украшения для тела
- Пряжки для ремня
- Запонки
- Браслеты
- Кольца
- Ожерелья
Многие украшения из стерлингового серебра также не вызывают раздражения благодаря гипоаллергенным свойствам меди.
2. Использование меди в медицине
Как задокументировали египтяне, известно, что медь убивает многие микробы при контакте. Доктор Билл Кивил из Университета Саутгемптона обнаружил, что MRSA (устойчивый к антибиотикам штамм бактериального стафилококка) не может выжить на медных поверхностях, как на платиновых металлах, часто используемых в больничных перилах, дверных ручках и кроватях. С помощью его исследований в больницах по всему миру устанавливают медные сенсорные поверхности, чтобы остановить распространение бактериальных инфекций в больницах.
3. Использование меди в бытовых услугах
Медная проволока, трубки и трубопроводы по-прежнему являются одними из наиболее часто используемых строительных материалов в сантехнической и электротехнической промышленности. Вот некоторые из его наиболее распространенных применений:
- Детали двигателя : Медь проводит тепло и электричество более эффективно, чем многие другие металлы
- Электропроводка : Медь пластична, что означает, что ее можно сбивать в листы и растягивать в провода, не ломая
- Медный трубопровод типа M : этот трубопровод хорошо подходит для жилых домов, поскольку он тонкий и доступный по цене
- Промышленное оборудование : для облегчения теплообмена
- Медная кровля : долговечная с минимальным уходом
- Сантехника : его антимикробные свойства и пластичность делают его идеальным выбором для промышленного использования
Как добывают медь
Мы добываем медь на крупных карьерах в Чили и Перу.

 также:
также: