Обозначение полярности: Как определить обратную и прямую полярность аккумулятора?
Содержание
Как определить обратную и прямую полярность аккумулятора?
У автомобильных аккумуляторов бывает полярность двух видов: прямая и обратная. Иногда продавцы аккумуляторов говорят «аккумулятор с правым плюсом» или «аккумулятор с левым плюсом». Во всех этих случаях речь идет о расположении положительной и отрицательной клемм аккумулятора (полюсных выводов).
Для правильно определения полярности аккумулятора в легковом автомобиле, его необходимо развернуть к себе, как на рисунке:
Непосредственно на выводах, либо рядом с ними обязательно должны быть значки «+» и «-», которые обозначают полюса.
- Если плюс справа, то это аккумулятор обратной полярности. Ее могут называть также «евро полярность» или обозначать «0» или «R».
- Если плюс слева, то это прямая полярность. Ее могут называть также «стандартная, «1» или «L».
Как правило, на отечественных легковых автомобилях установлены аккумуляторы, имеющие прямую полярность. На иномарках же в ходу обратная полярность.
На иномарках же в ходу обратная полярность.
Совсем иначе обстоит дело с полярностью у аккумуляторов для грузовиков, автобусов, строительной и специальной техники емкостью более 110 Ач:
- «3» — «+» слева (евро, обратная). Для европейских грузовиков.
- «4» — «+» справа (стандартная, прямая). Для российских грузовиков.
Еще одна особенность АКБ — исполнение корпуса. Различают два основных:
— для азиатских автомобилей (китайских, корейских, японских, некоторых американских). У них клеммы выступают над крышкой корпуса. Они выше, чем европейские АКБ.
— для европейских авто. Клеммы утоплены в крышку аккумулятора. Они ниже азиатских АКБ.
Несколько слов об уходе за клеммами АКБ.
Уход за полюсными выводами аккумуляторной батареи сводится к выявлению и уничтожению следов коррозии. Следы коррозии выглядят как порошкообразные отложения белого или желтоватого цвета.
Для обработки клемм нужно:
- Снять аккумулятор с автомобиля.

- Обработать выводы батареи раствором воды с содой.
- Начнется реакция с образованием пузырьков. Выводы станут коричневого цвета.
- При необходимости зачистить выводы металлической щеткой.
- После завершения реакции вытереть полюсные выводы и саму батарею смоченной в холодной воде тряпкой и просушить аккумулятор.
- Поставить АКБ в гнездо на автомобиль.
- Нанести тонкий слой вазелина на клеммы и выводы. Это предотвратит дальнейшее образование коррозии.
- При выключенном зажигании подсоединить провода к полюсным выводам аккумулятора.
Отзывы о нас
Юрий
03.12.2022
профессиональный подход. подобрали нужный аккумулятор по марке авто. доставили в назначенный срок. молодцы.
читать дальше
Юлия
02.09.2021
Большое спасибо, ребятам!!! По телефону все доступно рассказали, через час уже приехали и установили!!! Приятное,…
читать дальше
Обозначение L и N в электрике
Каждый раз, пытаясь подключить люстру или бра, датчик освещенности или движения, варочную панель или вытяжной вентилятор, терморегулятор теплого пола или блок питания светодиодной ленты, а также любое другое электрооборудование, вы можете увидеть следующие маркировки возле клемм подключения – L и N.
Давайте разберемся, о чем говорят обозначения L и N в электрике.
Как вы, наверное, сами догадались это не просто произвольные символы, каждый из них несет конкретное значение и выполняет роль подсказки, для правильного подключения электроприбора к сети.
« L » — Эта маркировка пришла в электрику из английского языка, и образована она от первой буквы слова «Line» (линия) – общепринятого названия фазного провода. Также, если вам удобнее, можно ориентироваться на такие понятия английских слов как Lead (подводящий провод, жила) или Live (под напряжением).
Соответственно обозначением L маркируются зажимы и контактные соединения, предназначенные для подключения фазного провода. В трехфазной сети, буквенно-цифровая идентификация (маркировка) фазных проводников «L1», «L2» и «L3».
По современным стандартам (ГОСТ Р 50462-2009 (МЭК 60446:2007), действующим в России, цвета фазных проводов – коричневый или черный. Но зачастую, может встречаться белый, розовый, серый или провод любого другого цвета, кроме синего, бело-синего, голубого, бело-голубого или желто-зеленого.
Но зачастую, может встречаться белый, розовый, серый или провод любого другого цвета, кроме синего, бело-синего, голубого, бело-голубого или желто-зеленого.
«N» — маркировка, образованная от первой буквы слова Neutral (нейтральный) – общепринятое название нулевого рабочего проводника, в России называемого чаще просто нулевым проводником или коротко Ноль (Нуль). В связи с этим, удачно подходит английское слово Null (нулевой), можно ориентироваться на него.
Обозначением N в электрике маркируются зажимы и контактные соединения для подключения нулевого рабочего проводника/нулевого провода. При этом это правило действует как в однофазной, так и трехфазной сети.
Цвета провода, которыми маркируется нулевой провод (нуль, ноль, нулевой рабочий проводник) строго синий (голубой) или бело-синий (бело-голубой).
Если уж мы говорим об обозначениях L и N в электрике, нельзя не отметить еще вот такой знак — , который также, практически всегда можно увидеть совместно с этими двумя маркировками. Таким значком отмечены зажимы, клеммы или контактные соединения для подключения провода защитного заземления (PE – Protective Earthing), он же нулевой защитный проводник, заземление, земля.
Таким значком отмечены зажимы, клеммы или контактные соединения для подключения провода защитного заземления (PE – Protective Earthing), он же нулевой защитный проводник, заземление, земля.
Общепринятая цветовая маркировка нулевого защитного провода – желто-зеленый. Эти два цвета зарезервированы только для заземляющих проводов и не встречаются при обозначении фазных или нулевых.
К сожалению, нередко, электропроводка в наших квартирах и домах выполнена с несоблюдением всех строгих стандартов и правил цветовой и буквенно-цифровой маркировки для электрики. И знать предназначение маркировок L и N у электрооборудования, порой, недостаточно, для правильного подключения. Поэтому, обязательно прочитайте нашу статью «Как определить фазу, ноль и заземление самому, подручными средствами?», если у вас есть какие-то сомнения, этот материал будет как нельзя кстати.
Символы блока питания
На паспортной табличке блока питания сверхнизкого напряжения (ELVPSU) показаны различные символы и аббревиатуры, обозначающие номинальные параметры, класс, изоляцию, полярность и другие данные по электробезопасности и соответствию электромагнитной совместимости.
Обозначения полярности адаптера постоянного тока
Обозначение полярности на заводской табличке источника питания переменного тока в постоянный указывает, является ли центр (или конец) выходного штекера положительным (+) или отрицательным (-). Важно использовать источник питания с правильной полярностью для хост-устройства. Неправильная полярность может привести к неправильной работе или повреждению оборудования.
Центр Положительный.
Указывает, что центр (наконечник) выходного штекера является положительным (+), а корпус выходного штекера — отрицательным (-).
Центр Негатив.
Указывает, что центр (наконечник) выходного штекера отрицательный (-), а корпус выходного штекера положительный (+).
СОКРАЩЕНИЯ
Следующие сокращения, используемые в сочетании с числовым значением, используются для определения номинальных электрических характеристик блока питания.
| В | вольт | Гц | Гц |
| А | ампер | ПРИ | ввод |
| мА | миллиампер | СЕК | выход |
| ВА | вольт ампер | DC | постоянный ток |
| В переменного тока | В переменного тока | АС | переменный ток |
| Ш | Вт | ~ | однофазный (переменный ток) |
ДРУГИЕ СИМВОЛЫ
Эти символы используются для обозначения типа конструкции и характеристик безопасности и/или отказоустойчивости блока питания
Постоянный ток
Конструкция класса II.
Плавкая вставка
Корпус или сердечник
Защитное заземление
Изолирующий трансформатор
Безопасный изолирующий трансформатор
Трансформатор безопасности
Трансформатор без короткого замыкания.
Имеет соответствующее внешнее защитное устройство.
Трансформатор с защитой от короткого замыкания.
Есть два типа. Внутренний тип является устойчивым к переохлаждению при условии, что повышение температуры не превышает указанного предела. Несобственный тип оснащен внешним защитным устройством.
Отказоустойчивый трансформатор
Символ трансформатора без защиты от короткого замыкания или трансформатора с защитой от короткого замыкания можно комбинировать либо с символом изолирующего трансформатора, либо с символом безопасного изолирующего трансформатора для получения составного символа. В этом примере символ защиты от короткого замыкания используется в сочетании с символом безопасного разделительного трансформатора.
C-Tick
Знак C-Tick появляется на продуктах, которые должны соответствовать австралийским требованиям электромагнитной совместимости и австралийским стандартам радиосвязи. Это означает, что продукт может быть легально продан в Австралии.
Знак соответствия нормативным требованиям
RCM может использоваться в качестве альтернативной маркировки для демонстрации соответствия стандартам электробезопасности и электромагнитной совместимости
6.2 Электроотрицательность и полярность – основы химии
Перейти к содержанию
Глава 6: Химическая связь и молекулярная геометрия
Результаты обучения
- Дайте определение электроотрицательности и оцените полярность
Соединения, содержащие ковалентные связи, обладают физическими свойствами, отличными от ионных соединений. Поскольку притяжение между электрически нейтральными молекулами слабее, чем между электрически заряженными ионами, ковалентные соединения обычно имеют гораздо более низкие температуры плавления и кипения, чем ионные соединения. На самом деле многие ковалентные соединения представляют собой жидкости или газы при комнатной температуре, и в своем твердом состоянии они обычно намного мягче, чем ионные твердые вещества. Кроме того, в то время как ионные соединения являются хорошими проводниками электричества при растворении в воде, большинство ковалентных соединений нерастворимы в воде; поскольку они электрически нейтральны, они являются плохими проводниками электричества в любом состоянии.
На самом деле многие ковалентные соединения представляют собой жидкости или газы при комнатной температуре, и в своем твердом состоянии они обычно намного мягче, чем ионные твердые вещества. Кроме того, в то время как ионные соединения являются хорошими проводниками электричества при растворении в воде, большинство ковалентных соединений нерастворимы в воде; поскольку они электрически нейтральны, они являются плохими проводниками электричества в любом состоянии.
Чистые и полярные ковалентные связи
Если атомы, образующие ковалентную связь, идентичны, как в [латексе]\ce{h3}[/латексе], [латексе]\се{Cl2}[/латексе] и других двухатомных молекулах, то электроны в связь должна быть разделена поровну. Мы называем это . Электроны, разделяемые чистыми ковалентными связями, имеют равную вероятность оказаться рядом с каждым ядром.
В случае [латекса]\ce{Cl2}[/latex] каждый атом начинается с семи валентных электронов, и каждый [латекс]\ce{Cl}[/латекс] делит один электрон с другим, образуя один ковалентная связь:
[латекс]\ce{Cl}+\ce{Cl}\rightarrow \ce{Cl2}[/латекс]
Общее количество электронов вокруг каждого отдельного атома состоит из шести несвязывающих электронов и двух общих (т. е. связывающих) электронов, что соответствует восьми общим электронам, что соответствует количеству валентных электронов в благородном газе аргоне. Поскольку связывающие атомы идентичны, [латекс]\ce{Cl2}[/латекс] также имеет чисто ковалентную связь.
е. связывающих) электронов, что соответствует восьми общим электронам, что соответствует количеству валентных электронов в благородном газе аргоне. Поскольку связывающие атомы идентичны, [латекс]\ce{Cl2}[/латекс] также имеет чисто ковалентную связь.
Рис. 6.2.1 (а) Распределение электронной плотности в молекуле HCl неравномерно. Электронная плотность больше вокруг ядра хлора. Маленькие черные точки в центре зеленых сфер указывают на расположение ядер водорода и хлора в молекуле. (b) Символы [латекс]\дельта+[/латекс] и [латекс]\дельта-[/латекс] указывают на полярность связи [латекс]\се{Н-Cl}[/латекс].
Когда атомы, связанные ковалентной связью, различны, связывающие электроны являются общими, но уже не поровну. Вместо этого связывающие электроны больше притягиваются к одному атому, чем к другому, что приводит к смещению электронной плотности в сторону этого атома. Это неравное распределение электронов известно как и характеризуется частичным положительным зарядом на одном атоме и частичным отрицательным зарядом на другом. Атом, сильнее притягивающий электроны, приобретает частичный отрицательный заряд и наоборот. Например, электроны связи [латекс]\ce{H-Cl}[/латекс] молекулы хлористого водорода проводят больше времени вблизи атома хлора, чем вблизи атома водорода. Так, в молекуле [латекс]\ce{HCl}[/латекс] атом хлора несет частичный отрицательный заряд, а атом водорода – частичный положительный. На рис. 6.2.1 показано распределение электронов в связи [латекс]\ce{H-Cl}[/латекс]. Обратите внимание, что заштрихованная область вокруг [латекс]\ce{Cl}[/латекс] намного больше, чем вокруг [латекс]\се{Н}[/латекс]. Сравните это с равномерным распределением электронов в неполярной связи [латекс]\ce{h3}[/латекс].
Атом, сильнее притягивающий электроны, приобретает частичный отрицательный заряд и наоборот. Например, электроны связи [латекс]\ce{H-Cl}[/латекс] молекулы хлористого водорода проводят больше времени вблизи атома хлора, чем вблизи атома водорода. Так, в молекуле [латекс]\ce{HCl}[/латекс] атом хлора несет частичный отрицательный заряд, а атом водорода – частичный положительный. На рис. 6.2.1 показано распределение электронов в связи [латекс]\ce{H-Cl}[/латекс]. Обратите внимание, что заштрихованная область вокруг [латекс]\ce{Cl}[/латекс] намного больше, чем вокруг [латекс]\се{Н}[/латекс]. Сравните это с равномерным распределением электронов в неполярной связи [латекс]\ce{h3}[/латекс].
Иногда мы обозначаем положительные и отрицательные атомы в полярной ковалентной связи, используя строчную греческую букву «дельта», [латекс]\дельта[/латекс], со знаком плюс или минус, чтобы указать, имеет ли атом частичный положительный заряд ([латекс]\дельта{+}[/латекс]) или частичный отрицательный заряд ([латекс]\дельта{-}[/латекс]).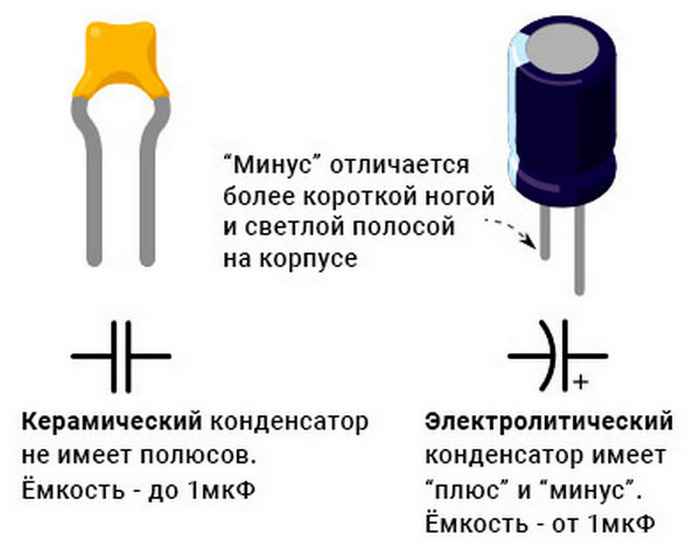 Этот символизм показан для молекулы [латекс]\ce{H-Cl}[/латекс] на рис. 6.2.1.
Этот символизм показан для молекулы [латекс]\ce{H-Cl}[/латекс] на рис. 6.2.1.
Электроотрицательность
Является ли связь неполярной или полярной ковалентной, определяется свойством связывающих атомов, называемым . Электроотрицательность — это мера тенденции атома притягивать к себе электроны (или плотность электронов). Он определяет, как общие электроны распределяются между двумя атомами в связи. Чем сильнее атом притягивает электроны своих связей, тем больше его электроотрицательность. Электроны в полярной ковалентной связи смещаются в сторону более электроотрицательного атома; таким образом, более электроотрицательным является атом с частичным отрицательным зарядом. Чем больше разница в электроотрицательности, тем более поляризовано распределение электронов и тем больше парциальные заряды атомов.
На рис. 6.2.2 показаны значения электроотрицательности элементов, предложенные одним из самых известных химиков двадцатого века Линусом Полингом (рис. 6.2.3). Как правило, электроотрицательность увеличивается слева направо по периоду в периодической таблице и уменьшается по группе. Таким образом, неметаллы, расположенные вверху справа, обычно имеют самую высокую электроотрицательность, причем фтор является самым электроотрицательным элементом из всех (EN = 4,0). Металлы, как правило, менее электроотрицательны, а металлы группы 1 имеют самую низкую электроотрицательность. Обратите внимание, что благородные газы исключены из этого рисунка, потому что эти атомы обычно не делят электроны с другими атомами, поскольку они имеют полную валентную оболочку. (Хотя соединения инертных газов, такие как [латекс]\ce{XeO2}[/латекс], действительно существуют, они могут образовываться только в экстремальных условиях и, таким образом, не вписываются в общую модель электроотрицательности.)
6.2.3). Как правило, электроотрицательность увеличивается слева направо по периоду в периодической таблице и уменьшается по группе. Таким образом, неметаллы, расположенные вверху справа, обычно имеют самую высокую электроотрицательность, причем фтор является самым электроотрицательным элементом из всех (EN = 4,0). Металлы, как правило, менее электроотрицательны, а металлы группы 1 имеют самую низкую электроотрицательность. Обратите внимание, что благородные газы исключены из этого рисунка, потому что эти атомы обычно не делят электроны с другими атомами, поскольку они имеют полную валентную оболочку. (Хотя соединения инертных газов, такие как [латекс]\ce{XeO2}[/латекс], действительно существуют, они могут образовываться только в экстремальных условиях и, таким образом, не вписываются в общую модель электроотрицательности.)
Рисунок 6.2.2 Значения электроотрицательности, полученные Полингом, следуют предсказуемым периодическим трендам с более высокими значениями электроотрицательности в верхнем правом углу таблицы Менделеева.
Электроотрицательность против сродства к электрону
Мы должны быть осторожны, чтобы не спутать электроотрицательность и сродство к электрону. Сродство элемента к электрону — измеримая физическая величина, а именно энергия, выделяющаяся или поглощаемая при присоединении электрона изолированным атомом газовой фазы, измеряемая в кДж/моль. С другой стороны, электроотрицательность описывает, насколько сильно атом притягивает электроны в связи. Это безразмерная величина, которая рассчитывается, а не измеряется. Полинг получил первые значения электроотрицательности, сравнив количество энергии, необходимое для разрыва различных типов связей. Он выбрал произвольную относительную шкалу от 0 до 4,9.0003
Портрет химика: Лайнус Полинг
Рисунок 6.2.3. Лайнус Полинг (1901–1994) внес важный вклад в область химии. Он также был видным активистом, освещавшим вопросы, связанные со здоровьем и ядерным оружием.
Лайнус Полинг, показанный на рис. 6.2.3, — единственный человек, получивший две неразделенные (индивидуальные) Нобелевские премии: одну по химии в 1954 г.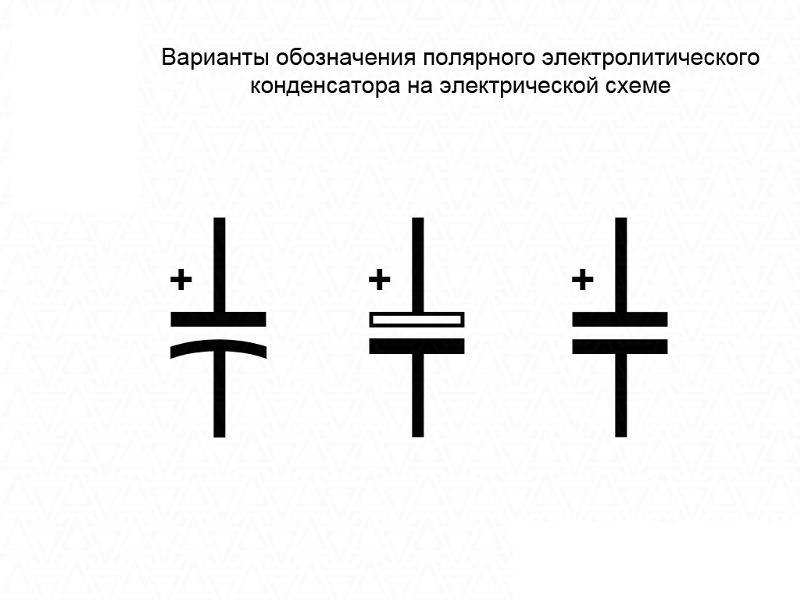 за работу о природе химических связей и одну в области мира в 1962 г. за оппозицию оружие массового поражения. Он разработал множество теорий и концепций, лежащих в основе нашего нынешнего понимания химии, включая электроотрицательность и резонансные структуры.
за работу о природе химических связей и одну в области мира в 1962 г. за оппозицию оружие массового поражения. Он разработал множество теорий и концепций, лежащих в основе нашего нынешнего понимания химии, включая электроотрицательность и резонансные структуры.
Полинг также участвовал во многих других областях, помимо химии. Его исследования серповидноклеточной анемии выявили причину заболевания — наличие генетически унаследованного аномального белка в крови — и проложили путь к области молекулярной генетики. Его работа также сыграла ключевую роль в сдерживании испытаний ядерного оружия; он доказал, что радиоактивные осадки в результате ядерных испытаний представляют опасность для здоровья населения.
Электроотрицательность и тип связи
Абсолютное значение разности электроотрицательностей (ΔEN) двух связанных атомов обеспечивает грубую меру ожидаемой полярности связи и, следовательно, типа связи. Когда разница очень мала или равна нулю, связь является ковалентной и неполярной. Когда он большой, связь является полярной ковалентной или ионной. Абсолютные значения разностей электроотрицательностей между атомами в связях [латекс]\ce{H-H}[/латекс], [латекс]\ce{H-Cl}[/латекс] и [латекс]\ce{Na- Cl}[/латекс] 0 (неполярный), 0,9(полярная ковалентная) и 2,1 (ионная) соответственно. Степень, в которой электроны разделены между атомами, варьируется от полностью равного (чистая ковалентная связь) до полного отсутствия (ионная связь). На рис. 6.2.4 показана зависимость между разностью электроотрицательностей и типом связи.
Когда он большой, связь является полярной ковалентной или ионной. Абсолютные значения разностей электроотрицательностей между атомами в связях [латекс]\ce{H-H}[/латекс], [латекс]\ce{H-Cl}[/латекс] и [латекс]\ce{Na- Cl}[/латекс] 0 (неполярный), 0,9(полярная ковалентная) и 2,1 (ионная) соответственно. Степень, в которой электроны разделены между атомами, варьируется от полностью равного (чистая ковалентная связь) до полного отсутствия (ионная связь). На рис. 6.2.4 показана зависимость между разностью электроотрицательностей и типом связи.
Рис. 6.2.4. По мере увеличения разницы электроотрицательностей между двумя атомами связь становится более ионной.
Грубое приближение различий электроотрицательности, связанных с ковалентными, полярными ковалентными и ионными связями, показано в таблице 6.2.1. Однако эта таблица является лишь общим руководством со многими исключениями. Например, атомы [латекс]\се{Н}[/латекс] и [латекс]\се{F}[/латекс] в [латексе]\се{HF}[/латекс] имеют разность электроотрицательностей 1,9. , а атомы [латекс]\се{N}[/латекс] и [латекс]\се{Н}[/латекс] в [латекс]\се{Nh4}[/латекс] различаются на 0,9, но оба эти соединения образуют связи, которые считаются полярными ковалентными. Точно так же атомы [латекс]\ce{Na}[/латекс] и [латекс]\се{Cl}[/латекс] в [латексе]\се{NaCl}[/латекс] имеют разность электроотрицательностей 2,1, и атомы Mn и I в [латексе]\ce{MnI2}[/латексе] имеют разницу в 1,0, однако оба этих вещества образуют ионные соединения.
, а атомы [латекс]\се{N}[/латекс] и [латекс]\се{Н}[/латекс] в [латекс]\се{Nh4}[/латекс] различаются на 0,9, но оба эти соединения образуют связи, которые считаются полярными ковалентными. Точно так же атомы [латекс]\ce{Na}[/латекс] и [латекс]\се{Cl}[/латекс] в [латексе]\се{NaCl}[/латекс] имеют разность электроотрицательностей 2,1, и атомы Mn и I в [латексе]\ce{MnI2}[/латексе] имеют разницу в 1,0, однако оба этих вещества образуют ионные соединения.
Лучшее руководство по ковалентному или ионному характеру связи — рассмотреть типы вовлеченных атомов и их относительное положение в периодической таблице. Связи между двумя неметаллами обычно ковалентны; связь между металлом и неметаллом часто ионная.
Некоторые соединения содержат как ковалентные, так и ионные связи. Атомы в многоатомных ионах, таких как [латекс]\ce{OH-}[/latex], [латекс]\ce{NO3-},[/latex] и [латекс]\ce{Nh5+},[/latex] удерживаются вместе полярными ковалентными связями. Однако эти многоатомные ионы образуют ионные соединения, соединяясь с ионами противоположного заряда. Например, нитрат калия, [латекс]\ce{KNO3}[/латекс], содержит катион [латекс]\се{K+}[/латекс] и многоатомный [латекс]\се{NO3-}[/латекс] анион. Таким образом, связь в нитрате калия ионная, возникающая в результате электростатического притяжения между ионами [латекс]\ce{K+}[/latex] и [латекс]\ce{NO3-},[/latex], а также ковалентная между атомы азота и кислорода в [латекс]\ce{NO3-}[/латекс].
Например, нитрат калия, [латекс]\ce{KNO3}[/латекс], содержит катион [латекс]\се{K+}[/латекс] и многоатомный [латекс]\се{NO3-}[/латекс] анион. Таким образом, связь в нитрате калия ионная, возникающая в результате электростатического притяжения между ионами [латекс]\ce{K+}[/latex] и [латекс]\ce{NO3-},[/latex], а также ковалентная между атомы азота и кислорода в [латекс]\ce{NO3-}[/латекс].
Пример 6.2.1: Электроотрицательность и полярность связи
Полярность связи играет важную роль в определении структуры белков. Используя значения электроотрицательности на рис. 7.6, расположите следующие ковалентные связи — все они обычно встречаются в аминокислотах — в порядке возрастания полярности. Затем обозначьте положительные и отрицательные атомы, используя символы [латекс]\дельта{+}[/латекс] и [латекс]\дельта{-}[/латекс]:
[латекс]\се{С-Н, С-N, С-О, N-H, O-H, S-H}[/latex]
Показать решение
Полярность этих связей возрастает по мере увеличения абсолютного значения разности электроотрицательностей. Атом с обозначением [латекс]\дельта{-}[/латекс] является более электроотрицательным из двух. В таблице 1 эти связи показаны в порядке возрастания полярности.
Атом с обозначением [латекс]\дельта{-}[/латекс] является более электроотрицательным из двух. В таблице 1 эти связи показаны в порядке возрастания полярности.
| Таблица 6.2.1 Полярность связи и разница электроотрицательности | ||
|---|---|---|
| Облигация | [латекс]\Дельта[/латекс]EN | Полярность |
| [латекс]\ce{C-H}[/латекс] | 0,4 | [латекс]\stackrel{\delta -}{\ce{C}}-\stackrel{\delta\text{+}}{\ce{H}}[/latex] |
| [латекс]\ce{SH}[/латекс] | 0,4 | [латекс]\stackrel{\delta -}{\ce{S}}-\stackrel{\delta\text{+}}{\ce{H}}[/latex] |
| [латекс]\ce{CN}[/латекс] | 0,5 | [латекс]\stackrel{\delta \text{+}}{\ce{C}}-\stackrel{\delta -}{\ce{N}}[/latex] |
| [латекс]\ce{NH}[/латекс] | 0,9 | [латекс]\stackrel{\delta -}{\ce{N}}-\stackrel{\delta \text{+}}{\ce{H}}[/latex] |
| [латекс]\ce{CO}[/латекс] | 1,0 | [латекс]\stackrel{\delta \text{+}}{\ce{C}}-\stackrel{\delta -}{\ce{O}}[/latex] |
| [латекс]\ce{OH}[/латекс] | 1,4 | [латекс]\stackrel{\delta -}{\ce{O}}-\stackrel{\delta \text{+}}{\ce{H}}[/latex] |
Проверьте свои знания
Ключевые понятия и сводка
Ковалентные связи образуются, когда электроны распределяются между атомами и притягиваются ядрами обоих атомов.
