Описание физических свойств меди: Опишите физические свойства: а)Меди;б)Воды;в)Соли — ответ на Uchi.ru
Содержание
Медь. Физические свойства — презентация онлайн
«Медь» — от латинского «mеdаlinо»- рудник.
Латинское название меди «cuprum» — от названия острова
Кипр, где в древности были древние рудники.
Греческое название «халькос» — от главного города
острова Эвбея в Эгейском море — порта Халькис. Вблизи
него находилось небольшое месторождение меди,
откуда ее впервые стали добывать древние греки.
МЕДЬ химический элемент
с атомным номером 29,
атомная масса 63,546.
Простое вещество медь — красивый
розовато-красный пластичный металл.
В периодической системе Менделеева медь расположена в
четвертом периоде и входит в группу IВ, к которой относятся
такие благородные металлы, как серебро и золото.
3. Нахождение в природе В земной коре содержание меди в земной коре составляет 0,01%, что позволяет ей занимать лишь 23-е место
среди всех элементов.
Очень редко медь встречается в самородном виде (самый
крупный самородок в 420 тонн найден в Северной Америке).
Различных руд меди много, а вот богатых месторождений на
земном шаре мало, к тому же медные руды добывают уже многие
сотни лет, так что некоторые месторождения полностью
исчерпаны. В морской воде содержится примерно 1·10-8 % меди.
Медь. Кондопожский р-н,
Карелия, Россия.
Медь. Район п. Домбаровский, Ю. Урал,
Оренбургская обл., Россия.
Медь. Рубик м-ние, Албания. ~8 см.
Медь. Остров Медный,
Командорские о-ва,
Россия. Около 10 см.
Медь. Итауз, Джезказган, Казахстан
Медь. Самородок «Медвежья шкура» весом 860 кг
(по другим данным — 842 кг).Добыт в Степановский р-ке Попова,
быв. Каркаралинский уезд, Казахстан. Владельцами рудника
принесен в дар Александру II, который в 1858 г. распорядился
направить его в Горный музей (Санкт-Петербург).
6. Физические свойства
.
Физические свойства
Медь — золотисто-розовый пластичный металл, на
воздухе быстро покрывается оксидной плёнкой, которая
придаёт ей характерный интенсивный желтовато-красный
оттенок. Тонкие плёнки меди на просвет имеют зеленоватоголубой цвет.
Тонкие плёнки меди на просвет имеют зеленоватоголубой цвет.
Наряду с осмием, цезием и золотом, медь — один из
четырёх металлов, имеющих явную цветовую окраску,
отличную от серой или серебристой у прочих металлов.
Этот цветовой оттенок объясняется наличием
электронных переходов между заполненной третьей и
полупустой четвёртой атомными орбиталями:
энергетическая разница между ними соответствует
длине волны оранжевого света. Тот же механизм
отвечает за характерный цвет золота.
Медь —металл, мягкий и ковкий, ее
температура плавления 1083° С, обладает
высокой тепло и электропроводностью
(занимает второе место по электропроводности среди металлов после серебра).
Медь имеет относительно большой температурный коэффициент сопротивления и
в широком диапазоне температур слабо
зависит от температуры.
Медь является диамагнетиком. (Диамагне́тики —
вещества, намагничивающиеся против
направления внешнего магнитного поля. В отсутствие
внешнего магнитного поля диамагнетики немагнитны. )
)
Медь образует кубическую гранецентрированную решётку.
8. Получение
Медь получают из медных руд и минералов.
Основные методы получения меди —
пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод заключается в получении
меди из сульфидных руд, (например CuFeS2).
Гидрометаллургический метод заключается в
растворении минералов меди в разбавленной серной
кислоте или в растворе аммиака; из полученных
растворов медь вытесняют металлическим железом.
Электролиз раствора сульфата меди:
9. Химические свойства
Степени окисления
В соединениях медь проявляет две степени окисления:
+1 и +2.
Первая из них неустойчива.Её соединения бесцветны.
Более устойчива степень окисления +2, которая даёт соли
синего и сине-зелёного цвета.
В необычных условиях можно получить соединения со
степенью окисления +3 и даже +5.
Медь — малоактивный металл, в электрохимическом ряду
напряжений она стоит правее водорода. Она не
Она не
взаимодействует с водой, растворами щелочей, соляной и
разбавленной серной кислотой. Однако в кислотах —
сильных окислителях (например, азотной и
концентрированной серной) — медь растворяется:
Сu + 4НМО3 — Сu(NO3)2 + 2NO+ 2Н2О конц.
Медь обладает достаточно высокой стойкостью к коррозии.
Однако во влажной атмосфере, содержащей углекислый газ
медь покрывается зеленоватым налетом основного карбоната
меди:
2Сu + O2 + СO2 + Н2O = СU(ОН)2 • СuСО3
Является слабым восстановителем, не вступает в реакцию
с водой и разбавленной соляной кислотой. Переводится
в раствор кислотами-неокислителями или гидратом аммиака в
присутствии кислорода, цианидом калия.
Окисляется концентрированными серной и азотной
кислотами, «царской
водкой», кислородом, галогенами, оксидами неметаллов.
Вступает в реакцию при нагревании с галогеноводородами.
Медь (II) образует устойчивые оксид СuО и гидроксид Си(ОН)2.
Этот гидроксид амфотерен, хорошо растворяется в кислотах
Сu(ОН)2 + 2НСl = СuСl2 + 2Н2О и в концентрированных
щелочах. Соли меди (II) нашли широкое применение в народном
Соли меди (II) нашли широкое применение в народном
хозяйстве. Особенно важным является медный купорос —
кристаллогидрат сульфата меди (II) СuSО4 • 5Н2.
Медь – первый металл,
Который впервые стал использовать человек в древности за
несколько тысячелетий до
нашей эры.
Первые медные орудия изготовлялись из самородной
меди, которая встречается
довольно часто.
Но в виду того, что медь – мягкий металл, медь в
древности не смогла вытеснить каменные орудия
труда. Лишь когда человек научился плавить медь и
изобрел бронзу (сплав меди с оловом), металл
заменил камень.
Широкое использование меди началось
в IV тысячелетии до н.э.
12. Применение. В электротехнике:
Из-за низкого удельного сопротивления (уступает
лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или
других проводников. Медные провода, в свою очередь, также
используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.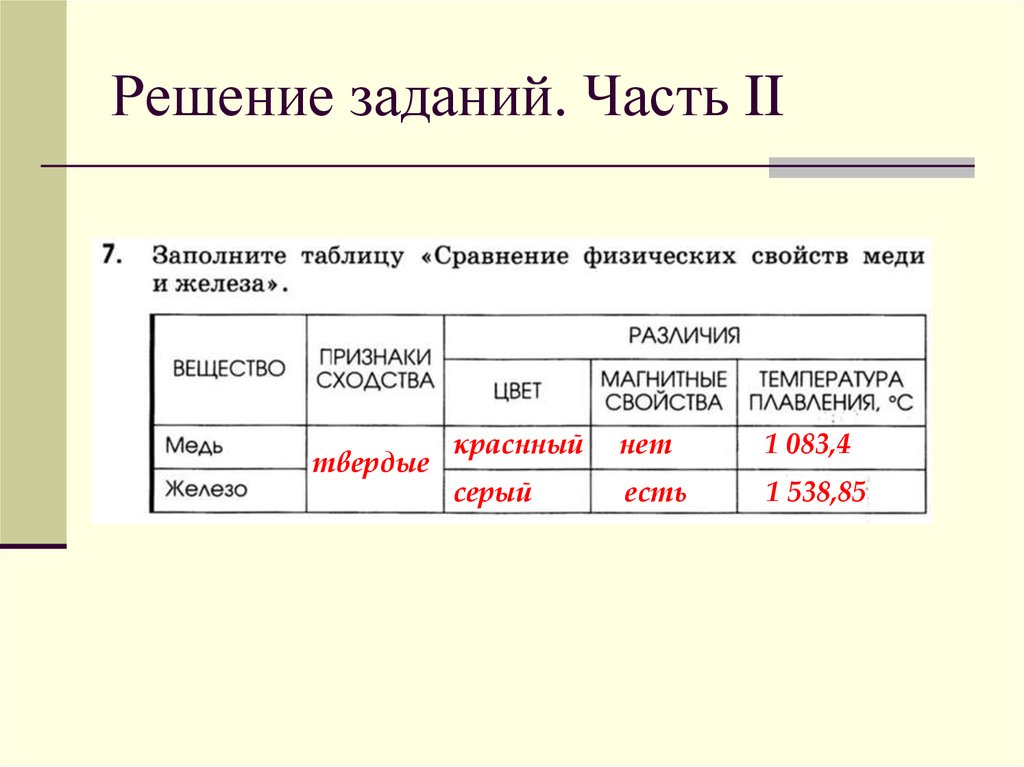 Для этих целей металл должен быть очень чистый:
Для этих целей металл должен быть очень чистый:
примеси резко снижают электрическую проводимость.
Например, присутствие в меди 0,02 % алюминия снижает её
электрическую проводимость почти на 10 %.
13. Применение. Теплообмен:
Другое полезное качество меди — высокая
теплопроводность. Это позволяет применять её в
различных теплоотводных устройствах,
теплообменниках, к числу которых относятся и широко
известные радиаторы охлаждения, кондиционирования
и отопления, компьютерных кулерах, тепловых трубках.
14. Применение. Для производства труб:
В связи с высокой механической прочностью и
пригодностью для механической обработки, медные
бесшовные трубы круглого сечения получили широкое
применение для транспортировки жидкостей и газов: во
внутренних системах водоснабжения, отопления,
газоснабжения, системах кондиционирования и холодильных
агрегатах.
В ряде стран трубы из меди являются основным
материалом, применяемым для этих целей: во Франции,
Великобритании и Австралии для газоснабжения зданий, в
Великобритании, США, Швеции и Гонконге для
водоснабжения, в Великобритании и Швеции для отопления.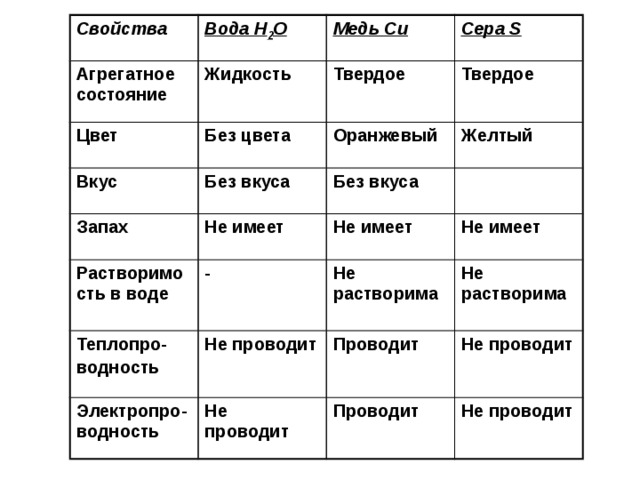
Кроме того, трубопроводы из меди и сплавов меди широко
используются в судостроении и энергетике для
транспортировки жидкостей и пара.
Применение. Сплавы:
Очень важная область применения меди — производство
медных сплавов.
Со многими металлами медь образует так называемые
твердые растворы, которые похожи на обычные растворы
тем, что в них атомы одного компонента (металла)
равномерно распределены среди атомов другого.
Большинство сплавов меди — это твердые растворы.
Сплав меди, известный с древнейших времен, — бронза —
содержит 4—30% олова (обычно 8—10%). Интересно, что
бронза по своей твердости превосходит отдельно взятые
чистые медь и олово. Бронза более легкоплавка по
сравнению с медью. До наших дней сохранились изделия из
бронзы мастеров Древнего Египта, Греции, Китая. Из бронзы
отливали в средние века орудия и многие другие изделия.
Знаменитые Царь-пушка (рис. 35) и Царь-колокол в
Московском Кремле также отлиты из сплава меди с оловом.
В бронзу и латунь помимо олова и цинка
входят никель, висмут и другие металлы.
Большое количество латуни идёт на изготовление гильз
артиллерийских боеприпасов и оружейных гильз, благодаря
технологичности и высокой пластичности.
Для деталей машин используют сплавы меди с цинком,
оловом, алюминием, кремнием и др. из-за их большей
прочности. Медные сплавы (кроме бериллиевой бронзы и
некоторых алюминиевых бронз) не изменяют механических
свойств при термической обработке, и их механические
свойства и износостойкость определяются только
химическим составом и его влиянием на структуру.
Основное преимущество медных сплавов — низкий
коэффициент трения, сочетающийся для многих сплавов
с высокой пластичностью и хорошей стойкостью против
коррозии в ряде агрессивных сред и хорошей
электропроводностью.
Медно никелевый сплав (мельхиор) используются для
чеканки разменной монеты.
Медноникелевые сплавы, в том числе и так называемый
«адмиралтейский» сплав, широко используются в
судостроении (трубки конденсаторов отработавшего пара
турбин, охлаждаемых забортной водой) и областях
применения, связанных с возможностью агрессивного
воздействия морской воды из-за высокой коррозионной
устойчивости.
Медь является важным компонентом твёрдых припоев —
сплавов с температурой плавления 590—880 градусов
Цельсия, обладающих хорошей адгезией к большинству
металлов, и применяющихся для прочного соединения
разнообразных металлических деталей, особенно, из
разнородных металлов, от трубопроводной арматуры до
жидкостных ракетных двигателей
18. Другие сферы применения
Медь — самый широко употребляемый катализатор
полимеризации ацетилена.
Широко применяется медь в архитектуре. Кровли и
фасады из тонкой листовой меди из-за автозатухания
процесса коррозии медного листа служат безаварийно по
100—150 лет.
Прогнозируемым новым массовым применением меди
обещает стать её применение в качестве бактерицидных
поверхностей в лечебных учреждениях для снижения
внутрибольничного бактериопереноса: дверей, ручек,
водозапорной арматуры, перил, поручней кроватей,
столешниц — всех поверхностей, к которым прикасается
рука человека.
Пары меди используются в лазерах.
19. Применение меди.
20. Биологическая роль Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального
развития. В
растениях и животных содержание меди варьируется от 10-15 до 10-3
%. Мышечная ткань человека содержит 1·10-3 % меди, костная ткань
— (1-26) ·10-4%, в крови присутствует 1,01 мг/л меди.
Всего в организме среднего человека (масса тела 70 кг)
содержится 72 мг меди.
Основная роль меди в тканях растений и животных — участие в
ферментативном катализе. Медь служит активатором ряда реакций и
входит в состав медьсодержащих ферментов, прежде всего оксидаз,
катализирующих реакции биологического окисления.
Сульфат меди и другие соединения меди используют в сельском
хозяйстве в качестве микроудобрений и для борьбы с различными
вредителями растений.
Однако при использовании соединений меди, при работах с ними
нужно учитывать, что они ядовиты. Попадание солей меди в организм
Попадание солей меди в организм
приводит к различным заболеваниям человека. ПДК для аэрозолей
меди составляет 1 мг/м3, для питьевой воды содержание меди
должно быть не выше 1,0 мг/л.
Медь и здоровье
Организму человека медь необходима для образования
различных протеинов и ферментов.
Медь нужна:
Для синтеза гемоглобина
Для образования костей
Для функционирования системы кровообращения
Для функционирования центральной нервной системы
Для получения энергии из клеток
Последние исследования показали, что весьма близко к истине предположение
о том, что питание с недостаточным содержанием меди повышает риск
сердечно-сосудистых заболеваний. Дефицит меди в организме может привести
к таким тяжелым последствиям как порок развития костей, малокровие и
мозговая недостаточность.
Дальнейшими последствиями являются:
Блокировка клеточного дыхания
Остановка образования мочевой кислоты
Неправильное образование нейромедиаторов
Остановка образования пигментов (белые волосы)
Нарушение окислительно-восстановительного баланса
Человек вместе с пищей должен получать определенное
количество меди для достаточного насыщения организма
этим элементом.
Ежедневная потребность взрослого человека в меди
составляет 2-3 мг.
К продуктам с высоким содержанием меди относятся:
Шоколад, белая и зеленая фасоль, рыба, орехи
А ниже перечисленные продукты наоборот содержат
медь лишь в малом количестве:
Сыр, молоко, белый хлеб, говядина и баранина
В наши дни применение медных изделий широко
распространено.
В Средней Азии носят медные изделия и практически не
болеют ревматизмом. В Египте и Сирии медные изделия носят
даже дети. Во Франции с помощью меди лечат расстройства
слуха. В США медные браслеты носят как средства от артрита.
В китайской медицине используются аппликации медных
дисков на активные точки. А в Непале медь считают
священным металлом.
Медетерапия (лечение медью) – один из видов народной
медицины. В детстве прикладывая по совету бабушки медный
пятак на шишку, мы уменьшали боль и воспаление, хотя в 5-ти
копеечной монете, выпущенной в советское время,
содержание меди было невелико. В медетерапии
В медетерапии
используются изделия с содержанием меди не менее 99,9%.
Самым простым, эффективным, эстетически красивым и
практичным средством в медетерапии является медный
браслет, разрешенный и рекомендуемый МинЗдравом РФ
24. Интересные факты
Индейцы культуры Чонос (Эквадор) ещё в XV—
XVI веках выплавляли медь с содержанием 99,5 % и
употребляли её в качестве монеты в виде топориков 2 мм по
сторонам и 0,5 мм толщиной. Данная монета ходила по всему
западному побережью Южной Америки, в том числе и в
государстве Инков.
В Японии медным трубопроводам для газа в зданиях
присвоен статус «сейсмостойких».
Инструменты, изготовленные из меди и её сплавов не создают
искр, а потому применяются там, где существуют особые
требования безопасности (огнеопасные, взрывоопасные
производства).
Польские учёные установили, что в тех водоёмах, где
присутствует медь, карпы отличаются крупными размерами. В
прудах или озёрах, где меди нет, быстро развивается грибок,
который поражает карпов.
Спасибо
за внимание!
Характеристики основных физико-механических и физико-химических свойств, температуры литья и горячей обработки меди
Атомное строение меди
Медь в Периодической системе имееет атомный номер 29 является первым элементом 1B группы или первым элементом одиннадцатой группы. Электроннная конфигурация свободного атома в нормальном состоянии (OK) ls22s22p63s23p63d104s1.
Медь изоморфна и кристаллизуется с образованием гранецентрированной кубической решетки типа A1. Период решетки меди при 18°С равен 0,36074нм; с повышением температуры он возрастает.
Элементы, находящиеся в твердом растворе, изменяют период решетки меди. Чем больше разница в размерах атомов меди и растворенного элемента, тем больше эти изменения.
| T, °K | 0 | 291 | 573 | 773 | 944 | 1044 | 1144 |
| Период решетки, нм | 0,35957 | 0,36074 | 0,36260 | 0,36308 | 0,36526 | 0,36603 | 0,36683 |
Атомный радиус по Гольдшмидту для координационного числа 12 составляет 0,12773нм, межатомное расстояние 0,25546нм.
Большинство физических свойств зависит от чистоты и состояния меди.
Атомный номер | 29 |
Относительная атомная масса | 63,54 |
Решетка | Кубическая гранецентрированная ( α = 3,6080 Å) |
Плотность г/см2 | 8,94 |
| Температура плавления, °С | 1083 |
Скрытая теплота плавления, кал/г | 50,6 |
Температура кипения, °С | 2595 |
Скрытая теплота испарения, кал/г | 1290 |
Теплопроводность, кал / (см·с·°С), при: | 0,941 |
100° С | 0,900 |
700°С | 0,840 |
Удельная теплоемкость, кал/(г·°С), при: | 0,092 |
600° С | 0,103 |
1000° С | 0,112 |
Коэффициент линейного расширения α · 10-6, 1/° С, при: | 16,7 |
25—300° С | 17,7 |
0 — 600° С | 18,6 |
0—900° С | 19,3 |
Отражательная способность, %, при λ= 5500 Å | 61 |
Излучательная способность, % (λ = 6650 Å), при: | 9,6 |
1080° С | 11,7 |
1100° С | 15,0 |
Удельное электросопротивление, Ом·мм2/м, при: 20° С | 0,0178 |
500° С | 0,053 |
Электропроводность, м/(Om·мм2) при 20°С | 57 |
Температурный коэффициент электросопротивления,1/°С, | 3,93·10-3 |
Мощность излучаемой энергии, Вт/см2, при: | 0,05 |
227°С | 0,11 |
1227°С | 4,26 |
Работа выхода, э·В | 4,46 |
Сжатие объема при затвердевании, % | 4,05-4,2 |
Вязкость при 1145° С, г/(см·с) | 0,0341 |
Поверхностное натяжение, дин/см | 1178 |
Нормальный потенциал по отношению к водородному электроду, В | +0,34 |
Предел прочности, кгс/мм2: | 20-25 |
твердой меди | 40-49 |
Относительное удлинение, %: | 60 |
твердой меди | 6 |
Твердость по Бринелю, кгс/мм2: | 45 |
твердой меди | 110 |
Предел текучести, кгс/мм2: | |
мягкой меди | 9-15 |
твердой меди | 30-45 |
Ударная вязкость, кгс·м/см2 | 10-18 |
Сопротивление сжатию, кгс/мм2 | 55-65 |
Предел прочности на срез, кгс/мм2: | 15 |
твердой меди | 21 |
Предел ползучести кгс/мм2, при: | 7 |
200° С | 5 |
400° С | 1,4 |
Модуль сдвига, кгс/мм2 | 4240 |
Модуль упругости, кгс/мм2: | 11700—12600 |
твердой меди | 12200—13500 |
Температура рекристаллизации,° С | 180-300 |
Температура горячей деформации ° С | 1050—750 |
Температура литья ° С | 1150 — 1250 |
Линейная усадка, % | 2,1 |
Травитель после отжига на воздухе | 10%-ная серная кислота |
Характеристики упругости
Упругие свойства меди характеризуется модулем нормальной упругости Е (модуль Юнга), сдвига G и объемного сжатия Есж, а также величиной отношения поперечной и продольной упругой деформации, т. е. коэффициентом Пуассона μ. Эти характеристики упругих свойств связаны между собой. Для большинства металлов абсолютное значение коэффициента Пуассона мало отличается от 1/3. Для меди оно составляет :
е. коэффициентом Пуассона μ. Эти характеристики упругих свойств связаны между собой. Для большинства металлов абсолютное значение коэффициента Пуассона мало отличается от 1/3. Для меди оно составляет :
μ = 0,33 Есж = E G ≅ 3/8E
Статистически усредненные значения характеристик упругости меди при 20°С по данным многочисленных исследований представлены с указанием стандартных отклонений:
Е= 123,5 ± 0,7 ГПа
Есж = 140,2 ± 3,9 ГПа
G = 45,4 ± 1,2 ГПа;
μ = 0,33 ± 0,09
Константы упругости монокристаллов меди зависят от кристаллографических направлений. У поликристаллов квазиизотропной меди вследствие произвольной ориентации зерен эти константы усредняются.
| Состояние | Направление кристаллической решетки | Е, ГПа | G, ГПа | Есж, ГПа | м |
| <111> | 159 | 33,8 | — | — | |
| Монокристаллическое | <100> | 77,5 | 61,0 | — | — |
| <110> | 126 | 38,0 | — | — | |
| Поликристаллическое | — | 115—125 | 42—46 | 139 | 0,32—0,34 |
Значения модулей Е и G в интервале температур 300—1300°К уменьшаются по линейному закону. Лишь в области низких температур наблюдается отклонение от равномерного изменения модулей.
Лишь в области низких температур наблюдается отклонение от равномерного изменения модулей.
| Т. к | 4,2 | 100 | 200 | 300 | 500 | 700 | 900 | 1100 | 1300 |
| Е, ГПа | 141 | 139 | 134 | 128 | 115 | 103 | 89,7 | 76,8 | 63,7 |
| G, ГПа | 50 | 49,5 | 47,3 | 44,7 | 37,8 | 31,0 | 24,1 | 18,5 | 11,5 |
Плотность
В качестве международного стандарта (IACS) плотность меди равна 8890кг/м3, при температуре 20°С.
Плотность меди различных марок при температуре 20°С имеет небольшие различия:
| Марка | Плотность, кг/м3 |
| Медь бескислородная М00б | 8963 ± 3 |
| Медь бескислородная М00б | 8950 |
| Медь, раскисленная фосфором М2р (0,04%Р) | 8930 |
.
Литая медь имеет плотность 8920кг/м3. Холодная деформация отожженной меди уменьшает ее плотность вследствие увеличения концентрации вакансий, дислоцированных атомов, дислокаций и других дефектов тонкой структуры. Возврат и рекристаллизация при нагреве наклепанного металла повышают плотность меди до исходного значения.
При нагреве плотность меди уменьшается вследствие расширения решетки, при плавлении она снижается на 5%.
| T, °C | 20 | 600 | 700 | 800 | 900 | 1000 | 1100 | 1200 | 1300 | 1400 |
| Плотность, кг/м3 | 8890 | 8680 | 8610 | 8550 | 8470 | 8400 | 7960 | 7860 | 7770 | 7700 |
Что такое медь? — Определение, возникновение, свойства, использование
Соли меди(II) представляют собой широко встречающиеся соединения, которые часто придают синий или зеленый цвет минералам, таким как азурит, малахит и бирюза, и исторически широко использовались в качестве пигментов. Медь, используемая в строительстве, обычно для кровли, окисляется с образованием зеленой зелени. Соединения меди используются для изготовления бактериостатических средств, фунгицидов и консервантов для древесины.
Медь, используемая в строительстве, обычно для кровли, окисляется с образованием зеленой зелени. Соединения меди используются для изготовления бактериостатических средств, фунгицидов и консервантов для древесины.
Это мягкий, ковкий и пластичный металл с высокой тепло- и электропроводностью. Цвет свежеобнаженной поверхности чистой меди розовато-оранжевый. Медь используется в качестве проводника тепла и электричества, строительного материала и компонента нескольких металлических сплавов, включая стерлинговое серебро в ювелирных изделиях, мельхиор в морском оборудовании и монетах, а также константан в термометрах и термопарах.
Медь имеет химический символ Cu и атомный номер 29. Медь требуется всем живым организмам в качестве микроэлемента в рационе, поскольку она является компонентом комплекса дыхательных ферментов цитохром-с-оксидазы. Медь в основном содержится в печени, мышцах и костях человека.
Наличие меди
- Медь образуется в массивных звездах и содержится в земной коре в концентрации около 50 ppm.

- Медь содержится в различных минералах, включая самородную медь, сульфиды меди, такие как халькопирит, борнит, дигенит, ковеллит и халькоцит, сульфосоли меди, карбонаты меди, такие как азурит и малахит, а также медь (I) или медь (II) оксиды, такие как куприт.
- Медь является 25-м -м -м самым распространенным элементом в земной коре, на долю которого приходится 50 частей на миллион (ppm), по сравнению с 75 частями на миллион для цинка и 14 частями на миллион для свинца.
Свойства меди
- Медь представляет собой красноватый металл с гранецентрированной кубической кристаллической структурой.
- Благодаря своей полосчатой структуре он отражает красный и оранжевый свет и поглощает другие частоты в видимом спектре, придавая ему красивый красноватый цвет.
- Он податлив, пластичен и является отличным проводником тепла и электричества.
- Он мягче цинка и может быть отполирован до блестящего блеска.
- Медь представляет собой металл с низкой химической активностью.

- Во влажном воздухе образует на поверхности зеленоватую пленку, называемую патиной, которая защищает металл от дальнейшего окисления.
Использование меди
Сульфат меди широко используется в качестве яда в сельском хозяйстве и в качестве альгицида при очистке воды. Хотя многие люди не думают, что медь используется для чего-либо, кроме монет, она является важным компонентом в производстве бронзы.
Медь была первым металлом, над которым работали люди в истории. Бронзовый век был назван в честь открытия, что его можно закалить с небольшим количеством олова, чтобы образовать легированную бронзу. Он используется в широком спектре продуктов, включая банки, фольгу для приготовления пищи и кастрюли, а также электрические кабели, самолеты и космические аппараты.
Электропроводность особенно важна, поскольку на проволоку приходится более половины мирового потребления меди. Химическое осаждение из паровой фазы, которое используется в производстве полупроводников, представляет собой процесс осаждения тонких медных пленок из газофазного прекурсора. Медь в основном используется в виде сплава золота и серебра, и ее часто покрывают тем или иным сплавом.
Медь в основном используется в виде сплава золота и серебра, и ее часто покрывают тем или иным сплавом.
Медь в основном используется в электрооборудовании (60%) и строительстве (20%), а также в промышленном оборудовании, таком как теплообменники (15%) и сплавы (5%). Бронза, латунь (медно-цинковый сплав), медь-олово-цинк, который был достаточно прочным для изготовления ружей и пушек и был известен как бронза, а также медь и никель, известный как мельхиор, который был предпочтительным металлом для мелких купюр. монеты, являются основными давно зарекомендовавшими себя медными сплавами. Медь — отличный выбор для электропроводки, потому что с ней легко работать, ее можно вытянуть в тонкую проволоку и она обладает высокой электропроводностью.
Медь в окружающей среде
Медь является очень распространенным веществом, которое естественным образом встречается в окружающей среде и распространяется в результате естественных процессов. Медь широко используется человеком.
Производство меди в мире продолжает расти. По сути, это означает, что все большее количество меди попадает в окружающую среду. Реки откладывают на своих берегах загрязненные медью шламы в результате сброса медьсодержащих сточных вод. Медь попадает в атмосферу в основном при сжигании ископаемого топлива. Медь в воздухе будет оставаться там в течение длительного периода времени, прежде чем осядет, когда начнется дождь. Затем он в первую очередь попадет в почву. В результате почвы могут содержать значительное количество меди после осаждения меди из воздуха.
Медь может попадать в окружающую среду как из природных, так и из антропогенных источников. Переносимая ветром пыль, гниющая растительность, лесные пожары и морские брызги являются примерами природных источников. Уже выявлено несколько видов деятельности человека, которые способствуют выбросу меди. Горнодобывающая промышленность, производство металлов, производство древесины и производство фосфорных удобрений являются некоторыми другими примерами.
Медь очень распространена в окружающей среде, потому что она выделяется как естественным путем, так и в результате деятельности человека. Медь часто обнаруживают вблизи шахт, промышленных объектов, свалок и мест захоронения отходов.
Примеры вопросов
Вопрос 1: Как можно использовать медь?
Ответ:
Медь в основном используется в электропроводке, кровле, сантехнике и промышленном оборудовании. Медь в чистом виде используется в большинстве этих приложений. Однако его можно легировать другими металлами для достижения более высоких уровней твердости. Медные провода использовались в производстве, распределении, передаче и электронных схемах электроэнергии. На самом деле электропроводка потребляет более половины всей добываемой меди.
Вопрос 2. Почему компания Copper не следует принципу Ауфбау?
Ответ:
Из-за относительно небольшой энергетической щели между 3d- и 4s-орбиталями, а также дополнительной стабильности, обеспечиваемой полностью заполненной d-орбиталью, электронная конфигурация меди не подчиняется принципу Ауфбау.
.
Вопрос 3. Что такое принцип Ауфбау?
Ответ:
Принцип Ауфбау определяет, как электроны заполняются на атомных орбиталях атома в его основном состоянии. Согласно этой теории, электроны заполняют атомные орбитали в порядке возрастания орбитального энергетического уровня. Согласно принципу Ауфбау, в первую очередь заполняются самые низкие энергетические уровни доступных атомных орбиталей, а затем более высокие энергетические уровни.
Вопрос 4. Как медь влияет на человека?
Ответ:
Длительное воздействие меди может вызвать воспаление носа, горла и глаз, а также головные боли, боли в животе, головокружение, рвоту и диарею. Чрезмерно высокое поглощение меди может вызвать повреждение печени и почек, а также смерть. Пока не установлено, является ли медь канцерогенной.
Вопрос 5. Является ли медь токсичной для человека?
Ответ:
Медь необходима для хорошего здоровья.
С другой стороны, более высокие дозы могут быть вредными. Медная пыль может вызывать головные боли, головокружение, тошноту и диарею, раздражая нос, рот и глаза.
3.5: Различия в физических и химических свойствах вещества
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47458
Цели обучения
Отделить физические свойства от химических.
Все вещества обладают физическими и химическими свойствами. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физическое свойство
Физическое свойство — это характеристика вещества, которую можно наблюдать или измерять без изменения идентичности вещества. Серебро — это блестящий металл, который очень хорошо проводит электричество. Из него можно формовать тонкие листы, это свойство называется пластичностью. Соль тусклая и ломкая и проводит электричество, когда она растворена в воде, что она делает довольно легко. К физическим свойствам вещества относятся цвет, твердость, ковкость, растворимость, электропроводность, плотность, температура плавления и температура кипения.
Для элементов цвет не сильно отличается от одного элемента к другому.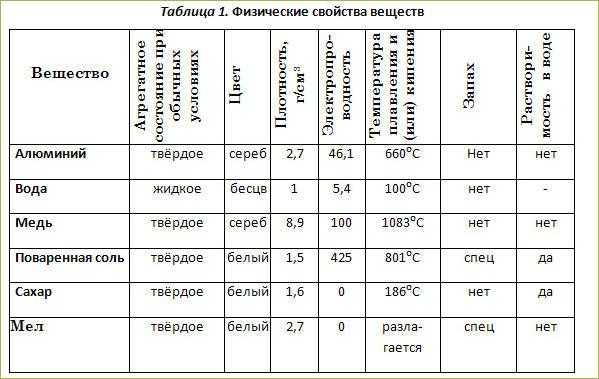 Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный. Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный. Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
| Вещество | Плотность при 25°C (г/см3) |
|---|---|
| кровь | 1. 035 035 |
| жировые отложения | 0,918 |
| цельное молоко | 1.030 |
| кукурузное масло | 0,922 |
| майонез | 0,910 |
| мед | 1.420 |
Твердость помогает определить, как можно использовать элемент (особенно металл). Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Рисунок \(\PageIndex{1}\): карандаш (слева) и кольцо с бриллиантом (справа). Оба являются формой углерода, но обладают очень разными физическими свойствами.
Точки плавления и кипения являются уникальными идентификаторами, особенно для соединений. Помимо получения некоторого представления об идентичности соединения, можно получить важную информацию о чистоте материала.
Химические свойства
Химические свойства вещества описывают его способность подвергаться некоторым химическим изменениям или реакциям в силу своего состава. Присутствующие элементы, электроны и связи придают материи потенциал для химических изменений. Довольно сложно определить химическое свойство, не используя слово «изменение». В конце концов, после изучения химии в течение некоторого времени, вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Рисунок \(\PageIndex{2}\): Сильная ржавчина на звеньях цепи возле моста Золотые Ворота в Сан-Франциско; он постоянно подвергался воздействию влаги и солевых брызг, что приводило к разрушению поверхности, растрескиванию и отслаиванию металла. (CC BY-SA 3.0; Marlith).
Химическим свойством железа является его способность соединяться с кислородом с образованием оксида железа, химическое название ржавчины (Рисунок \(\PageIndex{2}\)). Более общим термином для ржавчины и других подобных процессов является коррозия. Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
| Физические свойства | Химические свойства |
|---|---|
| Металлический галлий плавится при 30 o C. | Железный металл ржавеет. |
| Ртуть — очень плотная жидкость. | Зеленый банан при созревании становится желтым. |
| Золото блестит. | Горит сухой лист бумаги. |
Пример \(\PageIndex{1}\)
Какое из следующих химических свойств железа?
- Железо разъедает во влажном воздухе.

- Плотность = 7,874 г/см 3
- Железо в чистом виде мягкое.
- Железо плавится при 1808 К.
Раствор
«Железо разъедает во влажном воздухе» — единственное химическое свойство железа из списка.
Упражнение \(\PageIndex{1A}\)
Какое из перечисленных ниже физических свойств материи?
- коррозионная активность
- рН (кислотность)
- плотность
- воспламеняемость
- Ответить
- в
Упражнение \(\PageIndex{1B}\)
Какое из следующих свойств является химическим?
- воспламеняемость
- температура плавления
- точка кипения
- плотность
- Ответить
- и
Резюме
Физическое свойство – это характеристика вещества, которую можно наблюдать или измерять без изменения свойств вещества.
