Описание меди по химии: Электротехническая медь, основные характеристики
Содержание
Таблица характеристик меди
Медь входит в категорию металлов, встречающихся в природе в чистом самородном виде и в форме соединений. В промышленных масштабах ведется добыча медных руд – халькопирита CuFeS2, борнита Cu5FeS4 и халькозина Cu2S. Элемент медь относится к группе пластичных переходных металлов, отличается податливостью к литью и всем видам обработки. Широко применяется в машиностроении, электротехнике, приборостроении, радиоэлектронике.
Характеристики меди
Естественный цвет меди обладает золотисто-розовым оттенком, при взаимодействии с воздухом поверхность металла становится желто-красной. Характеризуется коррозийной стойкостью в сухих условиях, под воздействием влаги процесс окисления ускоряется.
Физико-химические свойства меди представлены в таблице.
|
Физические характеристики
| ||||
|
Параметр для анализа
|
Медь
| |||
|
Химическая формула
|
Cu
| |||
|
Нахождение в хим.
|
4 период, 11 группа, №29
| |||
|
ГОСТ
|
859-2014
| |||
|
Пояснение
|
Марки меди
| |||
|
Плотность меди, кг/м3
|
8920
| |||
|
Твердость по Бринеллю
|
45 (отожженная), 110 (нагартованная)
| |||
|
Температура литья, °С
|
1200
| |||
|
Температура плавления меди, °С
|
1083
| |||
|
Температура кипения, °С
|
2567
| |||
|
Температура рекристаллизации
|
200
| |||
|
Удельная теплоемкость, кДж/кг·K
|
37,5
| |||
|
Коэффициент теплопроводности при 100°С, кВт/(м·К)
|
39
| |||
|
Показатель температурного электрического сопротивления, T=20-100°С
|
4,3
| |||
|
Удельное сопротивление меди, Ом·мм²/м
|
0,026
| |||
|
Значение линейного теплового расширения, при t=20-200°С (10−6 К−1)
|
1,7
| |||
|
Показатель ударной вязкости, t = 20°С
|
630
| |||
|
Модуль упругости
|
120000
| |||
|
Параметр предела прочности
|
200
| |||
|
Значение предела текучести
|
70 (отожженная), 300 (нагартованная)
| |||
|
Величина относительного удлинения
|
50 (отожженная), 8 (нагартованная)
| |||
|
Коэффициент Пуассона
|
0,34
| |||
|
Химические свойства меди и соединений
| ||||
|
Осуществляемые реакции
|
Образуемое соединение
|
Особенности проведения
| ||
|
С простыми веществами:
С кислородом
С галогенами
С серой
С азотом
С кремнием
С углеродом
С водородом
|
оксиды меди CuО, Cu2О
галогениды CuCl2, CuBr2, 2CuI
сульфид меди CuS
—
—
—
—
|
Реагирует при нагреве
Реагирует при нагреве
Реагирует при нагреве
НЕ РЕАГИРУЕТ
НЕ РЕАГИРУЕТ
НЕ РЕАГИРУЕТ
НЕ РЕАГИРУЕТ
| ||
|
Со сложными соединениями:
С водой
С серной кислотой
С азотной кислотой
Со щелочами
С нитратом ртути
С оксидом азота
С солями железа (хлорид железа)
|
карбонат меди
сульфат меди, вода, оксид серы
нитрат меди, диоксид азота, вода
—
ртуть, нитрат меди
оксид меди, оксид азота (газ)
хлорид железа, хлорид меди
|
Окисление происходит в условиях влажности и при наличии оксида углерода
Взаимодействие происходит исключительно с концентрированным раствором при нагреве
В обычных условиях
НЕ РЕАГИРУЕТ
В обычных условиях
В обычных условиях
В обычных условиях
| ||
|
Реакции оксида меди:
С галогеноводородными кислотами
Растворение в азотной кислоте
Растворение в серной кислоте
С угарным газом
С водородом
С металлами большей активности (например, алюминием)
|
галогенид меди, вода
нитрат меди, оксид азота, вода
сульфат меди, оксид серы, вода
чистый металл, углекислый газ
чистое вещество, вода
чистое вещество, оксид алюминия
|
В обычных условиях
Концентрированная кислота
Концентрированная кислота
Окислительные свойства
Окислительные свойства
Окислительные свойства
| ||
|
Реакции гидроксида меди:
С кислотами
С раствором аммиака
Со щелочами
Разложение при нагреве
|
бромид меди, хлорид меди
гидроксид тетрааммиакат меди
комплексные соединения меди
оксид меди, вода
|
В обычных условиях
Легко реагирует, образуемое соединение обладает сине-фиолетовым оттенком
Реакция проводится исключительно с концентрированными растворами щелочей
| ||
|
Химические свойства солей меди
| ||||
|
Реакции
|
Образуемое вещество
|
Особенности проведения
| ||
|
Окисление:
азотной кислотой (на примере хлорида I)
кислородом (на примере хлорида I)
разложение нитрата II
разложение карбоната меди
|
нитрат меди, соляная кислота, оксид азота, вода
хлорид меди II, вода
оксид меди, оксид натрия, кислород
оксид меди, вода, углекислый газ
|
Реакция проходит при концентрированной кислоте
Требует соляной кислоты
Проходит при нагреве
Проходит при нагреве
| ||
|
Гидролиз солей элемента на примере сульфата и карбоната натрия
|
основной карбонат меди, сульфат натрия, углекислый газ
|
Выполняется по катиону слабого основания, аниону слабой кислоты
| ||
В основном состоянии атом меди подразумевает ядро с положительным зарядом, вокруг наблюдается движение 29 электронов, из них один – в наружном слое. Электронное строение схоже со структурой атомов щелочных металлов, но радиусы атомов и ионов меди существенно меньше. Этим объясняется более высокая плотность, вследствие чего металл характеризуется высокой температурой плавления. Молярная масса элемента совпадает с атомной, составляющей 63,54 г/моль.
Электронное строение схоже со структурой атомов щелочных металлов, но радиусы атомов и ионов меди существенно меньше. Этим объясняется более высокая плотность, вследствие чего металл характеризуется высокой температурой плавления. Молярная масса элемента совпадает с атомной, составляющей 63,54 г/моль.
Наиболее ценные для применения свойства меди:
- мягкость и пластичность, обуславливающие хорошую податливость в обработке и вытяжке;
- высокие показатели теплопроводности и электропроводимости;
- коррозийная устойчивость;
- невосприимчивость к ультрафиолетовому излучению, перепадам температур, химическим воздействиям;
- эстетичность поверхности.
Свариваемость металлопроката характеризуется составом меди. При высоком содержании в сплавах фосфорных, серных свинцовых примесей процесс сварки сопровождается трудностями. Подверженность металла окислению обуславливает образование хрупких швов и трещин. Сварку выполняют с использованием флюсовой либо газовой защиты и применением присадочных материалов с раскислителями.
Получение меди
В промышленных масштабах медь получают из руд – медного блеска и колчедана. Добыча чистого металла осуществляется пирометаллургическим и гидрометаллургическим способами. При пирометаллургической технологии применяются процессы обогащения с обжигом, плавки на штейн, конвертерной продувки. Гидрометаллургическая технология предусматривает выщелачивание металла с помощью слабой серной кислоты и последующим выделением из раствора чистой меди.
Востребованным сырьем в производстве выступает вторичный металл. Сплавы меди с оловом, цинком, алюминием, титаном, никелем присутствуют во многих бытовых и промышленных изделиях.
Источники лома меди:
- обмотка двигателей;
- ламповые телевизоры;
- компрессионные холодильники;
- кабели проводки;
- трансформаторы;
- вышедшие из эксплуатации автомобили, вагоны, суда.
Медные сплавы классифицируют на латунь, подразумевающую соединения меди с цинком, и бронзу, в составе которой присутствуют прочие химические элементы. В процессе переработки лома выполняется сортировка и очистка вещества от примесей.
В процессе переработки лома выполняется сортировка и очистка вещества от примесей.
Применение
Металл высоко востребован электротехнической отраслью, низкое удельное сопротивление обуславливает популярность медных силовых кабелей и комплектующих для трансформаторов. Показатели теплопроводности элемента позволяют применять его в производстве теплового оборудования – систем отопления, теплообменников, кондиционеров. Сплавы металла с золотом пользуются популярностью в ювелирном деле.
Экологичные свойства меди широко применяются в строительстве. Устойчивый к коррозии металл служит сырьем в производстве кровельных материалов, дверной фурнитуры, перил. Биологическая активность элемента объясняет использование меди в производстве минеральных удобрений. Вещество входит в состав медицинских препаратов, выступая компонентом антисептических глазных и противоожоговых растворов.
Медь. Описание, свойства, происхождение и применение металла
Самородная медь размером около 4 см
Медь
— минерал из класса самородных элементов.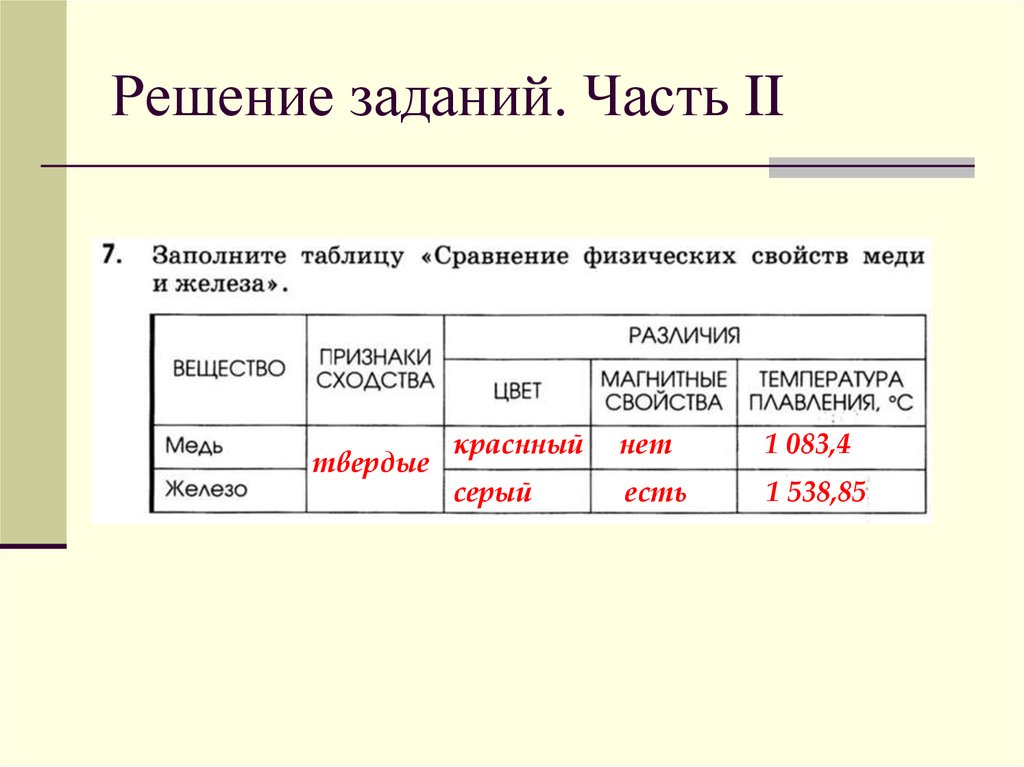 В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
- Структура
- Свойства
- Запасы и добыча
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
Смотрите так же:
Золото
— структура и физические свойства
Алюминий
— структура и физические свойства
СТРУКТУРА
Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура — кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками «медной зелени» (малахит), «медной сини» (азурит), фосфатов меди и других продуктов её вторичного изменения.
Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками «медной зелени» (малахит), «медной сини» (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА
Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Оксид меди
Когда медь нагревается на воздухе, она покрывается черным налетом из оксида меди . Его также легко получить путем сжигания гидроксикарбоната меди (II) (CuOH)2CO3 или нитрата меди (II) Cu(NO3)2. При нагревании CuO различными органическими веществами он окисляет их, превращая углерод в двуокись углерода, а водород в воду, тем самым восстанавливая медь в металле. Эта реакция используется при элементном анализе органических веществ для определения их содержания в углероде и водороде.
Эта реакция используется при элементном анализе органических веществ для определения их содержания в углероде и водороде.
Под слоем меди находится розовый оксид — оксид меди Cu2O. Один и тот же оксид получается при совместном сжигании эквивалентных количеств меди и окиси меди в порошкообразной форме: .
Оксид меди используется в приборе выпрямителей переменного тока, называемом купороксом. Для его производства медные пластины нагревают до 1020-1050 0С. Таким образом, двухслойная шкала, состоящая из окиси меди и окиси меди, образуется на одной поверхности. Оксид меди удаляется, в то время как пластины некоторое время содержатся в азотной кислоте.
Пластина промывается, высушивается и прокаливается при низкой температуре — и выпрямитель готов. Электроны могут проходить только от меди через окись меди. Электроны не могут проходить в обратном направлении. Это объясняется тем, что окись меди имеет иную проводимость. В оксидном слое меди, который непосредственно примыкает к меди, есть избыток электронов, а электрический ток находится за счет электронов, т. е. есть электропроводность. Во внешнем слое оксида меди наблюдается недостаток электронов, что соответствует появлению положительных зарядов. Таким образом, если положительный плюс источник тока применяется к меди, а отрицательный плюс источник тока — к окиси меди, то через систему не проходят никакие электроны. Электроны в этом положении полюсов движутся в направлении положительного электрода, а положительные заряды — в направлении отрицательного. Внутри азотного слоя находится тончайший слой без носителя электрического тока — барьерный слой. Когда медь соединена с отрицательным полюсом, а окись меди — с положительным, движение электронов и положительных зарядов меняется на противоположное и через систему протекает электрический ток. Вот как работает купороксовый выпрямитель.
е. есть электропроводность. Во внешнем слое оксида меди наблюдается недостаток электронов, что соответствует появлению положительных зарядов. Таким образом, если положительный плюс источник тока применяется к меди, а отрицательный плюс источник тока — к окиси меди, то через систему не проходят никакие электроны. Электроны в этом положении полюсов движутся в направлении положительного электрода, а положительные заряды — в направлении отрицательного. Внутри азотного слоя находится тончайший слой без носителя электрического тока — барьерный слой. Когда медь соединена с отрицательным полюсом, а окись меди — с положительным, движение электронов и положительных зарядов меняется на противоположное и через систему протекает электрический ток. Вот как работает купороксовый выпрямитель.
ЗАПАСЫ И ДОБЫЧА
Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет. Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет. Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
Сплавы
Далеко не всегда в промышленности применяется чистая медь. Чтобы изменить технические характеристики цветного металла к нему добавляются различные компоненты. В итоге получаются сплавы, которые имеют медную основу. Самые распространенные:
Самые распространенные:
- Бронза — изготавливается путем добавления олова.
- Латунь — производится из медной основы, к которой добавляется цинк.
Это далеко не все соединения, где медь — главный компонент.
Бронзовая статуэтка (Фото: Instagram / antik_kiev_ua)
ПРОИСХОЖДЕНИЕ
Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США). Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах. Наиболее известные месторождения самородной меди — Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
Наиболее известные месторождения самородной меди — Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
Сульфаты
Наибольшую практическую ценность имеет CuSO4*5h3O, называемый сульфат меди. Производится путем растворения меди в концентрированной серной кислоте. Поскольку медь является низкоактивным металлом и находится в диапазоне напряжений после водорода, водород не выделяется.
Сульфат меди используется в электролизном производстве меди, в сельском хозяйстве для борьбы с вредителями и болезнями растений, а также для извлечения других соединений меди.
Карбонаты для металлов подгруппы меди не являются характерными и редко используются на практике. Только базовый карбонат меди, который встречается естественным образом, имеет определенное значение для производства меди.
Характерным свойством двухзаряженных ионов меди является их способность соединять молекулы аммиака в комплексные ионы.
Ион меди можно открыть, постучав по раствору его солевого раствора аммиака. Появление интенсивной сине-голубой окраски связано с образованием сложного иона меди.
Появление интенсивной сине-голубой окраски связано с образованием сложного иона меди.
Медь окрашивает пламя в насыщенный зеленый цвет.
Проведенный качественный анализ дает основания полагать, что сплав содержит медь, цинк, кадмий, железо и свинец. Поэтому этот сплав — латунь.
ПРИМЕНЕНИЕ
Браслеты из меди
Из-за низкого удельного сопротивления, медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов. Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления. В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы. В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям. Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы. В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям. Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Медь (англ. Copper) — Cu
| Молекулярный вес | 63.55 г/моль |
| Происхождение названия | От греческого «Kyprium», то есть «кипрский металл», по названию острова Кипр |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
История открытия
Самые древние изделия из меди были найдены на территории современной Турции. Находились они в руинах поселения Чатал-Хююк. За каменным веком наступил медный век. Ученые в XX веке смогли доказать, что с помощью инструментов, изготовленных из меди, можно быстрее обрабатывать материалы.
Находились они в руинах поселения Чатал-Хююк. За каменным веком наступил медный век. Ученые в XX веке смогли доказать, что с помощью инструментов, изготовленных из меди, можно быстрее обрабатывать материалы.
Из меди изготавливались сплавы с оловом, которые называются бронзой. Их применяли для создания украшений, инструментов, оружия. Когда бронза получила большую популярность, наступил бронзовый век, который сменил медный.
Первые большие рудники были найдена на территории Кипра. Они разрабатывались около 3000 лет до н. э. В России самые старые рудники датируются 2000 лет до н. э.
Промышленная выплавка медных слитков была освоена в XIII–XIV веке. В Москве в XV веке основался Пушечный двор, который производил орудия, боеприпасы из бронзы.
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | медно-красный, тускнеющий в черный или зеленый на воздухе |
| Цвет черты | медно-красный |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 2,5-3 |
| Прочность | ковкий |
| Излом | зазубренный |
| Плотность (измеренная) | 8.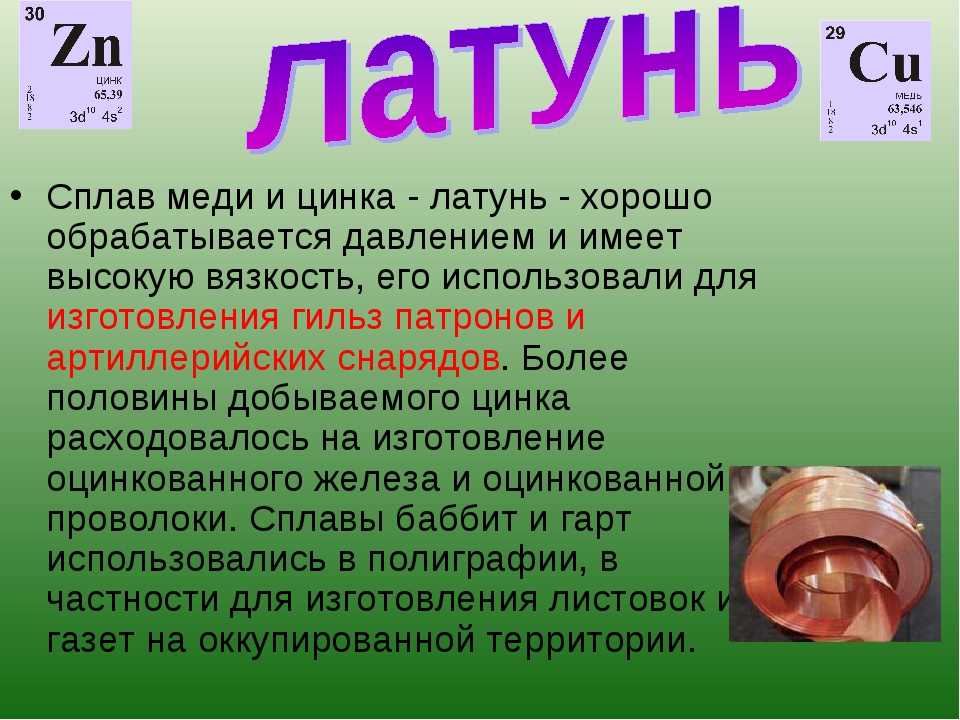 94 — 8.95 г/см3 94 — 8.95 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | диамагнетик |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) — гексоктаэдрический |
| Пространственная группа | Fm3m (F4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 3.615Å |
| Морфология | кубы, додекаэдры и тетрагексаэдры; редко октаэдры и сложные комбинации; нитевидные, древовидные |
| Двойникование | Двойники по {111} по шпинелевому закону |
Химия меди
Химия меди
История
Информация о
история меди
доступен в Медном
Development Association, Inc., где они указывают, что:
«В течение почти 5000 лет медь была единственным металлом, известным человеку.
Сегодня это один из наиболее часто используемых и повторно используемых наших современных
металлов. »
»
Люди впервые использовали медь около 10 000 лет назад.
Кулон, обнаруженный в Северном Ираке, как полагают, датируется
около 8700 г. до н.э. Доисторический человек, вероятно, использовал медь для оружия
изготовление. Древние египтяне, похоже, тоже ценили
коррозионная стойкость металла. Они использовали медные полосы и
гвозди в судостроении и медные трубы использовались для транспортировки
вода. Некоторые из этих артефактов сохранились до наших дней в хорошем состоянии.
Оценка общего производства меди в Египте за 1500 лет.
составляет 10 000 тонн.
Спустя годы появились медные сплавы. Бронзы (медно-оловянные сплавы)
появились сначала, а гораздо позже — латунь (медно-цинковая
сплавы). В «бронзовом веке» широко использовались медь и
бронза для оружия, монет, домашней утвари, мебели и др.
Предметы. Самый ранний известный пример использования латуни — римская монета.
отчеканены во время правления Августа 27 г. до н.э. — 14 г. н.э. Медь позже
сыграли важную роль в появлении электричества и сегодня
по-прежнему является одним из наших самых ценных материалов.
Использование соединений меди также восходит к периоду до 4000 г. до н.э.
Сульфат меди, например, был особенно важным соединением.
в ранние времена. Древние египтяне использовали его как морилку в своих
процесс окрашивания. Соединение также использовалось для изготовления мазей и
другие подобные препараты. Позже, лечебное использование медного купороса
возникла с его рецептом для легочных заболеваний. Медь
сульфат по-прежнему широко используется сегодня и не имеет вредных побочных эффектов.
последствия его 9Сообщалось об использовании 0011 предписанных .
Распространение
Медь является 25-м -м -м наиболее распространенным элементом Земли, но
один из менее распространенных переходных металлов первого ряда. Это происходит как
мягкий красноватый металл, который можно найти в виде больших валунов
массой в несколько сотен тонн или в виде сульфидных руд. Последние
сложные смеси меди, железа и серы в сочетании с
другие металлы, такие как мышьяк, цинк и серебро. Медь
Медь
концентрация в таких рудах обычно составляет 0,5-2%.
Самая распространенная руда — халькопирит, CuFeS 2 , латунь
желтая руда, на долю которой приходится примерно 50% мировой добычи
месторождения меди. Многочисленные другие медные руды разных цветов
и составы есть. Примеры малахит,
Cu 2 CO 3 (OH) 2 , ярко-зеленая руда,
и красный рудный куприт Cu 2 O.
Международный центр экологических и ядерных наук (ICENS)
имеет текущую программу картографирования геохимического состава Ямайки.
«Геохимический атлас Ямайки» был опубликован в 1919 г.95 и доступен на Amazon или ICENS.
Результаты, полученные для меди, показаны ниже (любезно предоставлено профессором Г. К. Лалором).
Медь встречается в биологических системах в составе
простетическая группа некоторых белков. Для примера меди
содержащие белки см. статью родом из Университета
Лидса, факультет биохимии и молекулярной биологии Института Скриппса.
Красный пигмент в
мягкоклювая птица Т (о) урако
содержит медно-порфириновый комплекс. Пигмент сильно водный
растворим в щелочных условиях и был
сообщили в 1952
что попытки зоозащитников помыть птицу привели к тому, что вода
приобретают красноватый оттенок.
T(o)uracos, как говорят, единственные птицы, обладающие настоящим красным и зеленым цветом.
Как правило, цвет, который вы воспринимаете при наблюдении за птицами, обусловлен отражениями.
благодаря структуре пера. Красные и зеленые пигменты (турацин и тураковердин)
найденные в перьях T(o)uraco, оба содержат медь.
Свойства меди
Отличный сайт для поиска свойств элементов,
в том числе медь по
Еще одна полезная ссылка на
Страницы геологического проекта
в унив. Невада, Рено.
Извлечение меди
Медь извлекают из руды двумя основными способами:
- Пирометаллургическим методом
- Гидрометаллургический метод
Пирометаллургический метод
Этот метод часто используется при добыче сульфидных руд.
Всего четыре основных этапа:
- Горнодобывающая и фрезерная промышленность
- Руда измельчается и измельчается в порошок
обычно содержащие менее 1% меди.
Минералы концентрируются в суспензию, которая составляет около 15%.
медь.
Минералы меди отделяют от бесполезного материала флотацией.
с использованием пенообразующих растворов. - Плавка
- Плавка медного концентрата и извлечение
нагреванием, потоком и добавлением кислорода. Сера, железо и другие
нежелательные элементы удаляются, и продукт называется
черновая медь. - Переработка
- Это последний этап процесса
получение высококачественной меди. Методы огневого и электрорафинирования
используются техники. Последний производит медь высокой чистоты.
пригодны для использования в электротехнике.
Гидрометаллургический метод — SX/EW
Экстракция растворителем/электровыделение является наиболее распространенным методом выщелачивания
процесс, используемый сегодня при восстановлении меди из химических
решения. Как следует из названия, метод включает в себя два основных
Как следует из названия, метод включает в себя два основных
этапы:
Экстракция растворителем – процесс выщелачивания ионов меди
или иным образом извлекаемые из необработанной руды с использованием химических
агенты.
Электролиз – электролиз раствора, содержащего ионы металлов
таким образом, что ионы Cu в нем осаждаются на катоде и
после этого удаляется в элементарной форме.
Процесс состоит из следующих этапов:
- Выбирается выщелачивающий раствор для использования в
вымывание ионов Cu из руды. Обычными реагентами являются слабые кислоты.
например Н 2 SO 4 , H 2 SO 4 +
Fe 2 (SO 4 ) 3 , хлорангидрид
решения напр. FeCl 2 , хлорид аммония и аммоний
солевые композиции. - При нанесении на руду выбранный выщелачиватель растворяет
ионы меди, образующие выщелачивающий продукт, называемый «беременным
выщелачивающий раствор». - Затем выбирается органический экстрагент для удаления ионов Cu из
водный раствор. Предпочтительные органические экстрагенты состоят из
Предпочтительные органические экстрагенты состоят из
гидроксифенилоксимы, имеющие основную химическую формулу: - C 6 H 3 (R)(OH) CNOHR*, R=
C 9 H 19 или C 12 H 25 и
R*= H, CH 3 или C 6 H 5
Структура 5-нонилсалицилальдоксима |
Примерами таких экстрагентов являются 5-нонилсалицилальдоксим и
смесь этого соединения и 2-гидрокси-5-нонилацетофенона
оксим. Коммерчески доступные реагенты обычно содержат 5-10%
оксима в 90-95% разбавитель нефти, такой как
керосин.
Перед смешиванием с выщелачивающим продуктом экстрагент
содержат мало или совсем не содержат меди и на данном этапе называются
«бесплодный органический экстрагент».
- Ионы меди переносятся из выщелачивающего раствора в
органический экстрагент при смешивании двух реагентов. Фаза
происходит разделение с образованием водной и органической фаз
называемые соответственно первой водной и первой органической фазами.
Первая водная фаза, «рафинат», является выщелачивателем.
лишен ионов меди, в то время как первой органической фазой является
«загруженный органический экстрагент», т.е. экстрагент с ионами меди
настоящее время. - Рафинат рециркулируется на площадку выщелачивания, в то время как
загруженный органический экстрагент смешивают с раствором электролита
называется «бедным электролитом» (т. е. не содержащим меди).
Типичными электролитами являются кислые растворы, такие как серная кислота,
H 2 SO 4 . Ионы меди, находившиеся в
органический экстрагент при этом растворяется в растворе электролита
чтобы получить медь, содержащую «богатый электролит». Здесь снова там
является фазовым разделением. Вторая органическая фаза – бесплодная.
органический экстрагент, а вторая водная фаза представляет собой «богатую
электролит». Бесплодный органический экстрагент затем рециркулируется для
повторное использование в применении к выщелачивающему продукту. - Завершающей стадией процесса является электролиз
кислый раствор ионов металлов. В результате растворенные ионы меди
В результате растворенные ионы меди
наносятся на катод, и элементарная медь удаляется.
Таким образом, процесс восстановления завершен.
A Примечание о примесях
Присутствие взвешенных загрязняющих веществ в системе SX/EW может
значительно снижает эффективность его работы. Такой
загрязняющие вещества могут попасть в систему из руды или
из окрестностей. Система подвержена загрязнению
от дождя, ветра и других сил окружающей среды с момента первого
защитная оболочка, в которой хранится выщелачивающий продукт, обычно
незакрытые и расположенные на открытом воздухе. Таким образом, твердые отходы в
в виде грязи, песка, каменной пыли, растительных остатков, минеральных остатков
и взвешенные вещества часто вводятся в систему в
ранних стадиях и сохраняется на последующих стадиях
процесс.
Воздействие этих загрязняющих веществ является значительным и
включают:
- увеличенное время разделения фаз на стадиях, когда органические и
водные растворители смешивают.
- отсутствие полного разделения фаз после экстракции,
это приводит к потерям дорогостоящего органического экстрагента, т.к.
его остается в водном растворе. - снижение КПД по току и снижение
чистота гальванического изделия из меди при электролизе
сцена.
В большинстве систем SX/EW этапы очистки были введены в
чтобы облегчить эту проблему. В
Патент США (номер 573341)
например, хотя бы часть
вторая органическая фаза фильтруется для удаления твердых примесей
перед повторным использованием при обработке выщелачивающего продукта. Переработанная органика
поэтому экстрагент содержит мало или совсем не содержит примесей, зависящих от
от того, была ли часть или вся вторая органическая фаза
отфильтровано. Установлено, что эта стадия фильтрации
значительно повышает эффективность работы, даже если
часть экстрагента подвергается обработке.
Использование меди и ее соединений
Медь на протяжении веков уступает по полезности только железу.
Металл и его соединения используются во всех сферах жизни от
электрооборудование для медицины и сельского хозяйства.
Использование металлической меди
Электротехническая промышленность является бенефициаром большинства мировых
выход меди. Металл используется в производстве электротехники.
устройства, такие как катоды и провода.
Другое применение включает:
— Кровля
-Посуда
-Монеты
-Слесарная работа
-Сантехника
-Змеевики для холодильников и кондиционеров
-Сплавы напр. бронза, латунь
Использование соединений меди
Соединения меди наиболее широко используются в сельском хозяйстве.
С момента открытия их токсичности для некоторых насекомых грибы
и водорослей эти соединения использовались в инсектицидах,
фунгицидов и предотвращения развития водорослей в питьевой воде
водохранилища. Поэтому они используются для борьбы с животными и
болезни растений. Удобрения также часто дополняются
Удобрения также часто дополняются
соединения меди, т.е. медный купорос, чтобы увеличить почву
плодородие и, таким образом, стимулировать рост урожая.
Соединения меди также используются в фотографии и в качестве красителей.
для стекла и фарфора.
Медь для хорошего здоровья
Медь является одним из многих микроэлементов, необходимых для хорошего здоровья. Это
входит в состав простетических групп многих белков и ферментов и
таким образом, имеет важное значение для их надлежащего функционирования. Поскольку тело может
не синтезируют медь, ее необходимо принимать с пищей. Орехи, семечки,
злаки, мясо (например, печень) и рыба являются хорошими источниками
медь.
Медь также нашла применение в медицине. Он использовался с раннего
раз при лечении ран груди и очистке воды. Это
Недавно было высказано предположение, что медь помогает предотвратить
воспаление, связанное с артритом и такими заболеваниями.
Продолжаются исследования лекарственных средств, содержащих медь, для лечения
этого и других условий.
Для получения дополнительной информации о важности меди для здоровья и
дефицит меди см.:
MotherNature и/или исследования витаминов
Продукты
Соединения меди
Медь представляет собой множество соединений, многие из которых
цветной. Двумя основными степенями окисления меди являются +1 и
+2, хотя известны некоторые комплексы +3. Соединения меди(I)
предположительно диамагнитны по своей природе и обычно бесцветны,
за исключением случаев, когда цвет является результатом переноса заряда или
анион. Ион +1 имеет тетраэдрическую или плоскоквадратную геометрию. В
твердые соединения, медь (I) часто находится в более стабильном состоянии при
умеренные температуры.
Ион меди(II) обычно находится в более стабильном состоянии в водной среде.
решения. Соединения этого иона, часто называемые соединениями меди,
обычно бывают цветными. На них влияет
Искажения Яна Теллера
и демонстрируют широкий спектр стереохимии с
преобладают четырех-, пяти- и шестикоординационные соединения. +2
+2
ион часто демонстрирует искаженную тетраэдрическую геометрию.
Галогениды меди
Известно, что все галогениды меди(I) существуют, хотя
фтор в чистом виде еще не получен. Медь
хлориды, бромиды и йодиды бесцветны, диамагнитны
соединения. Они кристаллизуются при обычных температурах с
структура цинковой обманки, в которой атомы Cu связаны тетраэдрически
до четырех галогенов. Соли хлорида и бромида меди (I)
получают кипячением кислого раствора ионов меди(II) в
избыток меди. При разбавлении белый CuCl или бледно-желтый
Производится CuBr. Добавление растворимого йодида в водную
раствор ионов меди(II) приводит к образованию
осадок йодида меди (I), который быстро разлагается до Cu (I)
и йод.
Галогениды меди(I) мало растворимы в воде и большая часть
медь в водном растворе находится в состоянии Cu(II). Даже так,
плохая растворимость соединений меди(I) увеличивается при
присоединение галогенид-ионов. В таблице ниже показаны некоторые свойства
галогениды меди(I).
| Формула | Цвет | МП | БП | Структура |
|---|---|---|---|---|
| CuCl | белый | 430 | 1359 | — |
| CuBr | белый | 483 | 1345 | — |
| CuI | белый | 588 | 1293 | Цинковая смесь |
Получено восстановлением CuX 2 -> CuX;
за исключением F, который не был получен в чистом виде.
| Формула | Цвет | МП | БП | м (БМ) | Структура |
|---|---|---|---|---|---|
| CuF 2 | белый | 950разложение | — | 1,5 | |
| CuCl 2 | коричневый | 632 | 993разложить | 1,75 | CdCl 2 |
| CuBr 2 | черный | 498 | — | 1,3 |
Все четыре галогенида меди (II) известны, хотя иодид меди
быстро разлагается на йодид меди и йод. желтый
желтый
хлорид меди (II) и почти черный бромид меди (II).
обычные галогениды. Эти соединения принимают структуру с
бесконечные параллельные полосы квадрата CuX 4 шт. медь
хлориды и бромиды хорошо растворимы в воде и в донорных
растворители, такие как ацетон, спирт и пиридин.
Галогениды меди(II) являются умеренными окислителями из-за
Пара Cu(I)/Cu(II). В воде, где потенциал в значительной степени
аквакомплексов не так много
разница между ними, но в неводных средах окисляющая
(галогенирование) мощность увеличивается в последовательности; CuF 2
<< CuCl 2 << CuBr 2 .
Могут быть получены прямой реакцией с соответствующими
галогены:
Cu + F 2 → CuF 2 ;
Cu + Cl 2 / 450°C → CuCl 2 ;
Cu + Br 2 → CuBr 2
В качестве альтернативы они могут быть получены из CuX 2 .aq путем
нагрев -> CuX 2
Оксиды меди
Оксиды меди(I) более стабильны, чем оксиды меди(II) при
высокие температуры. Оксид меди(I) встречается в самородном виде в виде красного
Оксид меди(I) встречается в самородном виде в виде красного
куприт. В лаборатории снижение
Решение Фелинга
с восстанавливающим сахаром, таким как глюкоза, дает красный осадок.
Тест достаточно чувствителен, чтобы даже 1 мг сахара произвел
характерный красный цвет соединения. Закись меди может
также может быть приготовлен в виде желтого порошка контролируемым восстановлением
щелочная соль меди(II) с гидразином. Термическое разложение
оксид меди (II) также дает оксид меди (I), поскольку последний имеет
большая термическая стабильность. Таким же способом можно приготовить
соединение из нитрата меди (II), карбоната и
гидроксид.
Оксид меди(II) встречается в природе в виде тенорита. Этот черный
Кристаллическое твердое вещество можно получить пиролизом
нитратные, гидроксидные или карбонатные соли. Он также образуется при
порошкообразную медь нагревают на воздухе или в кислороде. В таблице ниже показано
некоторые характеристики оксидов меди.
| Формула | Цвет | Степень окисления | МП |
|---|---|---|---|
| CuO | черный | Медь 2+ | 1026разложить |
| Медь 2 О | красный | Медь + | 1230 |
Окислительно-восстановительный анализ меди
Cu 2+ + e- → Cu + E=0,15 В
Cu + + e- → Cu E=0,52 В
Cu 2+ + 2e- → Cu E=0,34 В
При рассмотрении этих данных будет видно, что любой окислитель
достаточно силен, чтобы превратить Cu в Cu + , более чем достаточно силен, чтобы
преобразовать Cu + в Cu 2+ (0,52 по сравнению с 0,14 В). Нет, это не так
Нет, это не так
Поэтому ожидается, что любые стабильные соли Cu + будут существовать в
водный раствор.
Также может возникнуть диспропорция:
2Cu + → Cu 2+ + Cu E=0,37В или
К=10 6
Координационные комплексы
Реакция ЭДТА 4- с медью(II) дает комплекс
где ЭДТА оказалась пентадентатной, а НЕ гексадентатной, в отличие от
другие ионы M(II).
Cu(ЭДТА) 2-
Структура иона [Cu(ox) 2 ] 2- может быть описана
в виде плоского квадрата или в виде искривленного октаэдра, когда упаковка в
рассматривается кристаллическая решетка. В случае с натриевой солью
отдельные блоки параллельны в ячейке с медью
связаны с атомами кислорода, координированными с медью в
единицы, расположенные как сверху, так и снизу, тогда как в
калиевой соли, единицы не параллельны и при взгляде на три
ед. центральный находится почти под прямым углом к двум другим.
Здесь медь связана с одним из некоординированных атомов кислорода.
в единицах выше и ниже его.
Na+ и K+ соли [Cu(ox) 2 ] 2-
Cu(OH) 2 реагирует с NH 3 с образованием раствора
который растворяет целлюлозу. Это эксплуатируется в
промышленная подготовка района. Решения содержат
тетраммины и пентамины. С пиридином взаимодействуют только тетрамины.
сформированный например Cu(py) 4 SO 4 .
Широко изучена реакция меди(II) с аминокислотами.
Почти во всех случаях продукт содержит группы в транс
конфигурация, которая, как ожидается, будет более стабильной. В случае
глицина первым осаждаемым продуктом всегда является изомер цис-.
который при нагревании превращается в транс- транс-.
См.
Лабораторное руководство для C31L
Больше подробностей.
Аналитическое определение меди(II)
Полезный реагент для аналитического определения
ион меди(II) представляет собой натриевую соль N,N-диэтилдитиокарбамата.
В разбавленных спиртовых растворах наличие следовых количеств
Cu 2+ обозначается желтым цветом, который можно
измеряют спектрофотометром и определяют концентрацию
из сюжета Закона Бера. Комплекс
Cu(Et 2 dtc) 2 , который можно выделить как
коричневое твердое вещество.
Cu(Et 2 дтк) 2
Ссылки:
«Комплексы и переходные элементы первого ряда», Д. Николлс
«Основы неорганической химии», Ф.А. Коттон, Г. Уилкинсон и П.Л. Гаус
«Расширенная неорганическая химия», Ф. А. Коттон, Г. Уилкинсон, К. А. Мурильо и М. Бохманн
.
«Химия элементов», Гринвуд и Эрншоу
возвращаются к курсу CHEM2101 (C21J)
схема
Вернуться к химии, UWI-Мона,
Домашняя страница
Copyright © 2000-2020 Роберт Джон
Ланкашир, все права защищены.
Ланкашир
(при благодарной помощи Клиффа Райли и Джоди-Энн
Швабский),
Химический факультет Вест-Индского университета,
Кампус Моны, Кингстон 7, Ямайка.
Создано в июне 2000 года. Ссылки проверены и/или последние.
изменено 28 сентября 2020 г.
URL
http://wwwchem.uwimona.edu.jm/courses/copper.html
Последовательность химических реакций
Превращение меди: последовательность химических реакций
- Цели
- Реакции
- Процедура
Цели
- Укажите разнообразие веществ, частью которых может быть элемент:
металл —> синий раствор —> синее твердое вещество —> черное твердое вещество —> синий раствор (снова) —> металл (снова).
- Сохранение массы и кротов:
- Мы должны добыть столько меди, сколько начали.
- Одинаковое количество меди на каждой стадии: одинаковое количество молей.
- Опыт работы со стандартными химическими методами: фильтрация и количественные переносы.
Реакции
Cu(s) —> [Cu(H 2 O) 6 ] 2+ (водн. ) —> Cu(OH) 2 (s) —> CuO(s) —> [Cu(H 2 O) 6 ] 2+ (водн.) —> Cu(s)
) —> Cu(OH) 2 (s) —> CuO(s) —> [Cu(H 2 O) 6 ] 2+ (водн.) —> Cu(s)
- Металлическая медь «растворяется» в азотной кислоте (HNO 3 ). Фактически, ион нитрата окисляет металлическую медь до иона меди (II), в то время как сам превращается в газ NO 2 ; затем ион меди (II) связывается с шестью молекулами воды. Физическое изменение, которое вы должны наблюдать, это исчезновение металла медного цвета по мере того, как раствор становится синим (от [Cu(H 2 O) 6 ] 2+ , гексааквамедный ион) и выделяется коричневый газ (NO 2 ).
Cu (т) + 4 H 3 O + (водн.) + 2 NO 3 — (водн.) —> [Cu(H 2 O) 6 ] 2 19 2 (водн.) + 2 NO 2 (ж)
- Ион гидроксида (OH — ) связывается с ионом меди (II) даже сильнее, чем вода. В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди Cu(OH) 2 , синий осадок.

[Cu(H 2 O) 6 ] 2+ (водн.) + 2 OH — —> Cu(OH) 2 (т) + 6 H 2 O (л)
- При нагревании гидроксида меди образуется оксид меди CuO, твердое вещество черного цвета.
Cu(OH) 2 (т) —> CuO (т) + H 2 O (ж)
- Оксид меди растворяется в кислоте, регенерируя ион меди (II), который снова связывается с вода.
CuO (т) + 2 H 3 O + (водн.) + 3 H 2 O (ж) —> [Cu(H 2 O) 6 ] 2+ (водн.)
9007 Наконец, металл восстанавливает гидратированный ион меди (II) снова превращается в металлическую медь, в то время как сам он окисляется до ионов цинка (II). Мы видели эту реакцию раньше в лаборатории хлорида меди).
[Cu(H 2 O) 6 ] 2+ (водн.) + Zn (тв) —> Cu (тв) + Zn 2+ (водн.
) + 6 H 2 O ( тел.)
В то же время часть металлического цинка, находящегося в избытке, восстанавливает ионы гидроксония до H 2 .
Zn (т) + 2 H 3 O + (водн.) —> Zn 2+ (водн.) + H 2 (г) + 2 H 2 O (л)
4
94
Процедура
Я не буду подробно описывать процедуру шаг за шагом, но подчеркну некоторые аспекты безопасности и (выделено жирным шрифтом ) некоторые места, где наша процедура отличается от процедуры в лабораторном пакете.
- Преобразование Cu(s) в [Cu(H 2 O) 6 ] 2+ (водный)
- Возьмите кусок медной проволоки и взвесьте его с точностью до 0,01 г . Кусочки проволоки ближе к 0,50 г, чем к 0,35 г. Это нормально: используйте детали, которые мы предоставляем.
- Используйте примерно 4-5 мл концентрированного раствора HNO 3 .
- Будьте осторожны с азотной кислотой: как и другие сильные кислоты, она вызывает жжение при попадании на кожу и может повредить одежду; в отличие от большинства других кислот, он также окрашивает пораженный участок в желтый цвет.

- Если некоторое количество меди останется нерастворенным к моменту окончания производства газа, поставьте химический стакан на горячие плиты в вытяжных шкафах, чтобы ускорить реакцию.
- Важно выполнять этот шаг в вытяжном шкафу, поскольку коричневый газ NO 2 является раздражителем. Держите смеси в вытяжном шкафу до тех пор, пока не добавите 10 мл дистиллированной воды после полного растворения меди.
- Преобразование [Cu(H 2 O) 6 ] 2+ (водн.) в Cu(OH) 2 (s)
- Будьте осторожны при обращении с NaOH, так как это сильное основание, которое вызывает жжение при контакте с кожей. Добавьте по каплям раствор NaOH к раствору меди.
- После образования синего осадка периодически проверяйте кислотность раствора, погружая палочку для перемешивания в раствор и касаясь ею красной лакмусовой бумажки. Старайтесь не переносить синий осадок на лакмусовую бумагу: это приведет к некоторой потере меди и, возможно, к ложному синему цвету на лакмусовой бумаге.
 Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавленные 0019 — идут на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим, чтобы вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавленные 0019 — идут на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим, чтобы вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
- Преобразование Cu(OH) 2 (т) в CuO(т)
- Добавить воду в реакционную смесь, полученную на предыдущем этапе, и добавьте также один или два кипящих камня .
- Содержимое стакана нагреть, но не кипятить . Кипячение делает черный CuO настолько мелким, что этап фильтрации становится чрезмерно долгим. Нагревайте химический стакан до тех пор, пока весь синий Cu(OH) 2 не исчезнет и не заменится черным CuO.


 таблице Менделеева
таблице Менделеева