Описать физические свойства меди по плану: СРАВНИТЬ И ОПИСАТЬ СВОЙСТВА меди железа по плану: агрегатное состояние , цвет , блеск , запах ,
Содержание
Медь,цинк и их соединения
Дата урока:
Тема урока. Медь, цинк и их важнейшие соединения.
Цель урока. Сформировать знания учащихся о химических элементах: меди, цинке, об их основных свойствах, об их получении и практическом применении, на основе самостоятельного поиска материала.
Задачи урока:
Образовательные:
1) углубление знаний о положении меди, цинка, в периодической системе химических элементов, о строении их атомов, о физических и химических свойствах металлов, об их получении, о наиболее важных природных соединениях меди, цинка, об их сплавах, об их применении и практической значимости. Рассмотрение биологической роли металлов и их влияние на окружающую среду.
2) повторение характеристик изученных веществ, развитие умений составлять уравнения химических реакций, определять их тип;
Развивающие: развитие речи, внимания, памяти, познавательного интереса, потребности в приобретении и применении знаний.
Воспитательные: воспитание у учащихся культуры речи, поведения, манеры.
Тип урока. Комбинированный
Оборудование урока. Дидактический материал, медные стружки, цинковые гранулы
Виды работы учащихся:
1. Групповая и индивидуальная.
2. Ответы на теоретические вопросы.
3. Написание уравнений реакций
План урока:
Организационный момент
Актуализация знаний учащихся по теме общая характеристика d-элементов
Изучение нового материала
Закрепление знаний
Задание на дом
Ход урока
Урок начинаем с сообщения темы, которую учащиеся записывают в тетради. Уточняем цель урока, представляем, друг другу группы учащихся, которые будут “двигаться” по двум маршрутам.
Приступая к работе, учащиеся записывают в тетради название своего маршрута и каждого этапа следования.
1-ряд учащихся «Группа Cu»
2-ряд учащихся «Группа Zn»
Фронтальный опрос по теме «Общая характеристика d-элементов»
В связи с чем d-элементы так называются? (валентные электроны заполняют d-подуровень)
Почему d-элементы можно назвать переходными элементами? (располагаются между типичными металлами и типичными неметаллами)
Где располагаются d-элементы в ПСХЭ Д.И.Менделеева? (во всех побочных подгруппах)
d-элементы по химическим свойствам являются окислителями или восстановителями? (восстановители)
Назовите d-элементы (Cu, Zn, Cr, Fe, Mn и т.д.)
Изучение нового материала
Каждому участнику группы раздаются одинаковые задания, только по своей теме.
Задание 1 участнику (легкий уровень)
Описать элемент по расположению его в ПСХЭ по предложенному плану:
Название элемента и его обозначение
Порядковый номер
Атомная масса
Номер периода
Номер группы и подгруппа
Строение атома элемента (количество протонов, нейтронов, электронов)
Количество энергетических уровней
Электронная формула атома элемента
Описать нахождение элемента в природе
Задание 2 участнику (средний уровень)
Описать физические свойства элемента
Написать химические реакции, лежащие в основе получения элемента
Задание 3 участнику группы (сложный уровень)
Описать химические свойства элемента и его соединений
Составить кластер на применение элементов
Задание 1 (легкий уровень)
Описать элемент по расположению его в ПСХЭ
№
Характеристика
Cu
Zn
1
Название элемента и его обозначение
Медь Cu
Цинк Zn
2
Порядковый номер
29
30
3
Атомная масса
64
65
4
Номер периода
4
4
5
Номер группы и подгруппа
IB
IIB
6
Строение атома элемента (количество протонов, нейтронов, электронов)
6429Cu (29p+35n0)29e—
6530Zn (30p+35n0)30e—
7
Количество энергетических уровней
+29Cu )2 e—)8e—)18e—)1e—
+30Zn )2 e—)8e—)18e—)2e—
8
Электронная формула атома элемента
29Cu 1s22s22p63s23p63d104s1
30Zn 1s22s22p63s23p63d104s2
Нахождение в природе
Медь: в земной коре содержание меди составляет 0,01% по массе. Она встречается в виде самородков, но чаще в виде соединений. В настоящее время известно свыше 170 медьсодержащих минералов, из них только 10-15имеют практическое значение: халькопирит CuFeS2 (30% меди), халькозин – медный блеск Cu2S (79,8% меди), ковеллин CuS (64,4% меди), малахит CuCO3∙Cu(OH)2 (57,4% меди), азурит 2CuCO3∙Cu(OH)2 (55,5% меди), куприт Cu2O (81,8%).
Она встречается в виде самородков, но чаще в виде соединений. В настоящее время известно свыше 170 медьсодержащих минералов, из них только 10-15имеют практическое значение: халькопирит CuFeS2 (30% меди), халькозин – медный блеск Cu2S (79,8% меди), ковеллин CuS (64,4% меди), малахит CuCO3∙Cu(OH)2 (57,4% меди), азурит 2CuCO3∙Cu(OH)2 (55,5% меди), куприт Cu2O (81,8%).
Цинк: по содержанию в земной коре цинк занимает 23-е место среди других элементов, в земной коре содержание его по массе 0,01%. Обычно цинковые руды – полиметаллические. Они содержат также минералы меди, свинца, кадмия и других металлов. Важнейшие минералы: цинковая обманка ZnS, цинкит ZnO, цинковый шпат (галмей) ZnCO3 и др.
Задание 2 (средний уровень)
Описать физические свойства элемента
Медь – блестящий металл светло-розового цвета, тягучий, вязкий, легко прокатывается.
Tплавления= 10830С, ρ=8,9г/см3. Отличный проводник электрического тока (уступает только серебру)
Отличный проводник электрического тока (уступает только серебру)
Цинк – металл синевато-белого цвета с сильным металлическим блеском, металл средней твердости. ρ=7,13 г/см3,цинк легко плавится Tплавления= 419,40С и принадлежит к числу летучих металлов Ткипения=905,70С. Его теплопроводность 60% от теплопроводности серебра, а электрическая проводимость в 4 раза меньше.
Написать химические реакции, лежащие в основе получения элемента
Медь: Из сульфидных руд медь получают пирометаллургическим методом, а из кислородосодержащих – гидрометаллургическим.
2Cu2S + 3O2 = 2Cu2O + 2SO2
2Cu2O + Cu2S = 6Cu + SO2
Цинк: для получения металлического цинка из руд используются пирометаллургические и гидрометаллургические процессы.
2ZnS + 3O2 = 2ZnO + 2 SO2↑
ZnO + C = Zn + CO↑
Задание 3 (сложный уровень)
Описать химические свойства элемента и его соединений
Взаимодействие меди с простыми веществами
Cu + Cl2 = CuCl2
2Cu + O2 = 2CuO
Cu + S = CuS
Взаимодействие со сложными веществами
t
Cu + 2H2SO4(конц.
 ) = CuSO4 + SO2↑ + 2H2O
) = CuSO4 + SO2↑ + 2H2O
t
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
t
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Химические свойства соединений меди:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Взаимодействие цинка с простыми веществами
Zn + Cl2 = ZnCl2
2Zn + O2 = 2ZnO
Zn + S = ZnS
Взаимодействие со сложными веществами
Zn + H2O = ZnO + H2↑
Zn + 2HCl = ZnCl2 + H2↑
t
Zn + 2 NaOH(крист.
 ) = Na2ZnO2 + H2↑
) = Na2ZnO2 + H2↑Zn(OH)2 + 2 NaOH + 2 H2O = Na2[Zn(OH)4] + H2↑
тетрагидроксоцинкат
(II) натрия
Химические свойства соединений цинка
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2 NaOH = Na2[Zn(OH)4]
Составить кластер на применение элементов
Применение меди
Применение цинка
Закрепление материала
Каждая группа получает задания для закрепления темы противоположной группы. «Группа Cu» выполняет задания по теме «Цинк и его соединения», а «Группа Zn» выполняет задания по теме «Медь и его соединения»
Задания для закрепления для «Группы Cu»:
Выпишите формулы веществ в состав которых входит цинк:
CrO, ZnS, Na2CrO4, Na2ZnO2, (CuOH)2CO3, ZnCO3, Cu2S, Cr2O3, Cu2O, Cu(NO3)2, Fe(CrO2)2, Cr(OH)2, ZnCl2, CuFeS2, ZnO, H2CrO4, CrO3, Zn(OH)2, Cu(OH)2, CuO.
Задания для закрепления для «Группы Zn»:
Выпишите формулы веществ в состав которых входит медь:
CrO, ZnS, Na2CrO4, Na2ZnO2, (CuOH)2CO3, ZnCO3, Cu2S, Cr2O3, Cu2O, Cu(NO3)2, Fe(CrO2)2, Cr(OH)2, ZnCl2, CuFeS2, ZnO, H2CrO4, CrO3, Zn(OH)2, Cu(OH)2, CuO.
Домашнее задание: §6.2-6.3 упр.5,6 стр.174, упр.5,6 стр.180
Описать биологическое значение этих элементов
Физические свойства
Медь — золотисто-розовый
пластичный металл, на воздухе быстро
покрывается оксидной плёнкой, которая
придаёт ей характерный интенсивный
желтовато-красный оттенок. Тонкие плёнки
меди на просвет имеют зеленовато-голубой
цвет.
Наряду с осмием и
золотом, медь — один из трех металлов,
имеющих явную цветовую окраску, отличную
отсерой или серебристой у прочих
металлов. Этот цветовой оттенок
объясняется наличием электронных
переходов между заполненной третьей и
полупустой четвертой атомными орбиталями:
разница между ними соответствует длине
волны оранжевого света. Тот же механизм
отвечает за характерный цвет золота.
Медь образует
кубическую гранецентрированную решётку,
пространственная группа F m3m, a = 0,36150 нм,
Z = 4.
Медь обладает
высокой тепло-[4] и электропроводностью
(занимает второе место по электропроводности
после серебра). Удельная электропроводность
при 20 °C 55,5-58 МСм/м[5]. Медь имеет относительно
большой температурный коэффициент
сопротивления: 0,4 %/°С.
Имеет два стабильных
изотопа — 63Cu и 65Cu, и несколько радиоактивных
изотопов. Самый долгоживущий из них,
64Cu, имеет период полураспада 12,7 ч и два
варианта распада с различными продуктами.
Существует ряд
сплавов меди: латуни — с цинком, бронзы
— с оловом и другими элементами, мельхиор
— с никелем, баббиты — со свинцом и
другие.
Возможные степени
окисления
В соединениях
медь проявляет две степени окисления:
+1 и +2. Первая из них склонна к
диспропорционированию и устойчива
только в нерастворимых соединениях
(Cu2O, CuCl, CuI и т. п.) или комплексах (например
[Cu(Nh4)2]+. Её соединения бесцветны. Более
устойчива степень окисления +2, которая
даёт соли синего и сине-зелёного цвета.
В необычных условиях можно получить
соединения со степенью окисления +3 и
даже +5. Последняя встречается в солях
купраборанового аниона Cu(B11h21)23−,
полученных в 1994 году.
Простое вещество
Не изменяется на
воздухе в отсутствие влаги и диоксида
углерода. Является слабым восстановителем,
не реагирует с водой, разбавленной
соляной кислотой. Переводится в раствор
кислотами-неокислителями или гидратом
аммиака в присутствии кислорода, цианидом
калия.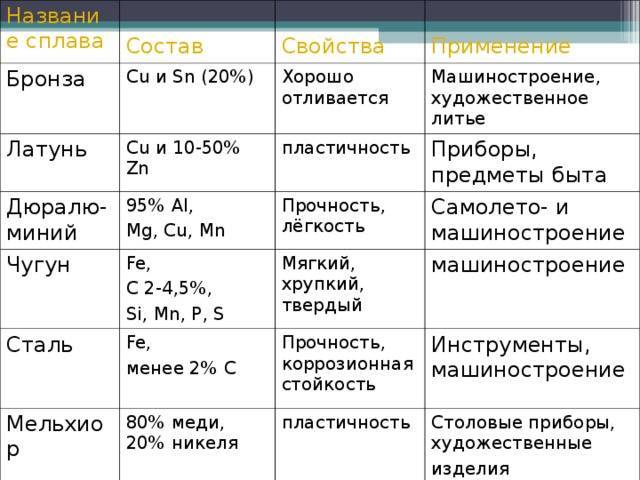 Окисляется концентрированными
Окисляется концентрированными
серной и азотной кислотами, «царской
водкой», кислородом, галогенами,
халькогенами, оксидами неметаллов.
Реагирует при нагревании с галогеноводородами.
На влажном воздухе
медь окисляется, образуя основный
карбонат меди(II):
Реагирует с
концентрированной холодной серной
кислотой:
С концентрированной
горячей серной кислотой:
С безводной серной
кислотой при 200 °C:
C разбавленной
серной кислотой при нагревании в
присутствии кислорода воздуха:
Реагирует с
концентрированной азотной кислотой:
С разбавленной
азотной кислотой:
С царской водкой:
C разбавленной
хлороводородной кислотой в присутствии
кислорода:
С газообразным
хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует
с концентрированной уксусной кислотой
в присутствии кислорода:
Медь растворяется
в концентрированном гидроксиде аммония,
с образованием аммиакатов:
Окисляется до
оксида меди(I) при недостатке кислорода
и 200 °C и до оксида меди(II), при избытке
кислорода и температурах порядка 400—500
°C:
С концентрированной
соляной кислотой и хлоратом калия:
Соединения меди(I)
Степени окисления
+1 соответствует оксид Cu2O красно-оранжевого
цвета. Соответствующий гидроксид CuOH
Соответствующий гидроксид CuOH
(жёлтого цвета) быстро разлагается с
образованием оксида. Гидроксид CuOH
проявляет основные свойства.
Многие соединения
меди +1 имеют белую окраску либо бесцветны.
Это объясняется тем, что в ионе Сu+ все
пять Зd-орбиталей заполнены парами
электронов.
Ионы меди(I) в водном
растворе неустойчивы и легко
диспропорционируют:
В то же время
медь(I) встречается в форме соединений,
которые не растворяются в воде, либо в
составе комплексов. Например,
дихлорокупрат(I)-ион [CuCl2]− устойчив. Его
можно получить, добавляя концентрированную
соляную кислоту к хлориду меди(I):
Свойства соединений
меди (I) похожи на свойства соединений
серебра (I). В частности, CuCl, CuBr и CuI
нерастворимы. Также существует
нестабильный сульфат меди(I)
Соединения меди(II)
Степень окисления
II — наиболее стабильная степень окисления
меди. Ей соответсвует чёрный оксид CuO и
голубой гидроксид Cu(OH)2, который при
стоянии легко отщепляет воду и при этом
чернеет:
Гидроксид меди
(II) носит преимущественно основный
характер и только в концентрированной
щелочи частично растворяется с
образованием синегогидроксокомплекса:
Соли меди(II)
образуются при растворении меди в
кислотах-окислителях (азотной,
концентрированной серной). Большинство
Большинство
солей в этой степени окисления имеют
синюю или зелёную окраску.
Медный купорос
Соединения меди(II)
обладают слабыми окислительными
свойствами, что используется в анализе
(например, использование реактива
Фелинга).
Карбонат меди(II)
имеет зелёную окраску, что является
причиной позеленения элементов зданий,
памятников и изделий из меди. Сульфат
меди(II) при гидратации даёт синие
кристаллы медного купороса CuSO4∙5h3O,
используется как фунгицид.
Оксид меди (II)
используются для получения оксида
иттрия бария меди (YBa2Cu3O7-δ), который
является основой для получения
сверхпроводников.
Соединения меди(III)
и меди(IV)
Степени окисления
III и IV являются малоустойчивыми степенями
окисления и представлены только
соединениями с кислородом, фтором или
в виде комплексов.
16
НАФТЕНАТ МЕДИ | CAMEO Chemicals
Добавить в MyChemicals
Страница для печати
Химический паспорт
Химические идентификаторы |
Опасности |
Рекомендации по ответу |
Физические свойства |
Нормативная информация |
Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора
включают общие идентификационные номера,
алмаз NFPA
Знаки опасности Министерства транспорта США и общий
описание хим. Информация в CAMEO Chemicals поступает
Информация в CAMEO Chemicals поступает
из множества
источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
|
|
|
|
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
никто |
| ||
NFPA 704
нет данных
Общее описание
Жидкость зеленого цвета с нефтяным запахом. Температура вспышки от 100 до 141°F. Менее плотный, чем вода, нерастворим в воде. Пары тяжелее воздуха.
Температура вспышки от 100 до 141°F. Менее плотный, чем вода, нерастворим в воде. Пары тяжелее воздуха.
Опасности
Что это за информация?
Опасные поля
включать
специальные предупреждения об опасности
воздух и вода
реакции, пожароопасность, опасность для здоровья, профиль реактивности и
подробности о
задания реактивных групп
и
потенциально несовместимые абсорбенты.
Информация в CAMEO Chemicals поступает из различных источников.
источники данных.
Предупреждения о реактивности
нет
Реакции с воздухом и водой
Огнеопасно. Нерастворим в воде.
Пожароопасность
Выдержка из Руководства ERG 128 [Горючие жидкости (не смешивающиеся с водой)]:
ЛЕГКО ОГНЕОПАСНО: Легко воспламеняется от тепла, искр или пламени. Пары могут образовывать взрывоопасные смеси с воздухом. Пары могут перемещаться к источнику воспламенения и вспыхивать обратно. Большинство паров тяжелее воздуха. Они будут распространяться по земле и собираться в низких или ограниченных пространствах (канализация, подвалы, резервуары и т. д.). Опасность взрыва паров в помещении, на открытом воздухе или в канализации. Вещества, обозначенные буквой (P), могут полимеризоваться со взрывом при нагревании или попадании в огонь. Слив в канализацию может создать опасность пожара или взрыва. Контейнеры могут взорваться при нагревании. Многие жидкости будут плавать на воде. Вещество можно транспортировать в горячем виде. Для гибридных автомобилей также следует обращаться к ERG Guide 147 (литий-ионные аккумуляторы) или ERG Guide 138 (натриевые аккумуляторы). Если речь идет о расплавленном алюминии, см. Руководство ERG 169.. (ЭРГ, 2020)
Они будут распространяться по земле и собираться в низких или ограниченных пространствах (канализация, подвалы, резервуары и т. д.). Опасность взрыва паров в помещении, на открытом воздухе или в канализации. Вещества, обозначенные буквой (P), могут полимеризоваться со взрывом при нагревании или попадании в огонь. Слив в канализацию может создать опасность пожара или взрыва. Контейнеры могут взорваться при нагревании. Многие жидкости будут плавать на воде. Вещество можно транспортировать в горячем виде. Для гибридных автомобилей также следует обращаться к ERG Guide 147 (литий-ионные аккумуляторы) или ERG Guide 138 (натриевые аккумуляторы). Если речь идет о расплавленном алюминии, см. Руководство ERG 169.. (ЭРГ, 2020)
Опасность для здоровья
Пары при вдыхании вызывают легкое раздражение глаз и легкое раздражение дыхательных путей. Проглатывание вызывает раздражение желудка. Аспирация вызывает сильное раздражение легких и быстро развивающийся отек легких; возбуждение центральной нервной системы с последующей депрессией. (USCG, 1999)
(USCG, 1999)
Профиль реакционной способности
Основные соли, такие как НАФТЕНАТ МЕДИ, обычно растворимы в воде. Полученные растворы содержат умеренные концентрации гидроксид-ионов и имеют рН более 7,0. Они реагируют как основания, чтобы нейтрализовать кислоты. Эти нейтрализации выделяют тепло, но меньше или намного меньше, чем при нейтрализации оснований в группе реакционной способности 10 (Основания) и нейтрализации аминов. Обычно они не реагируют ни как окислители, ни как восстановители, но такое поведение не невозможно.
Принадлежит к следующей реакционной группе (группам):
- Углеводороды, алифатические насыщенные
- Соли, основные
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по реагированию
Что это за информация?
Поля рекомендации ответа
включают расстояния изоляции и эвакуации, а также рекомендации по
пожаротушение, пожарное реагирование, защитная одежда и первая помощь.
информация в CAMEO Chemicals поступает из различных
источники данных.
Изоляция и эвакуация
Выдержка из Руководства ERG 128 [Горючие жидкости (не смешивающиеся с водой)]:
НЕМЕДЛЕННЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ: Изолируйте место разлива или утечки на расстоянии не менее 50 метров (150 футов) во всех направлениях.
КРУПНЫЙ РАЗЛИВ: Рассмотрите первоначальную эвакуацию по ветру на расстояние не менее 300 метров (1000 футов).
ПОЖАР: Если цистерна, железнодорожная цистерна или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях. (ЭРГ, 2020)
Пожаротушение
Выдержка из Руководства ERG 128 [Горючие жидкости (не смешивающиеся с водой)]:
ВНИМАНИЕ: Большинство этих продуктов имеют очень низкую температуру воспламенения. Использование распыления воды при тушении пожара может быть неэффективным. ВНИМАНИЕ: Для смесей, содержащих спирт или полярный растворитель, спиртостойкая пена может оказаться более эффективной.
ВНИМАНИЕ: Для смесей, содержащих спирт или полярный растворитель, спиртостойкая пена может оказаться более эффективной.
НЕБОЛЬШОЙ ПОЖАР: Сухие химикаты, CO2, распыление воды или обычная пена.
БОЛЬШОЙ ПОЖАР: Распыление воды, туман или обычная пена. Избегайте направления прямых или сплошных струй непосредственно на продукт. Если это можно сделать безопасно, уберите неповрежденные контейнеры из зоны вокруг огня.
ПОЖАР, ВКЛЮЧАЮЩИЙ РЕЗЕРВУАРЫ ИЛИ АВТОМОБИЛЬНЫЕ/ТРЕЙЛЕРНЫЕ НАГРУЗКИ: Тушить огонь с максимального расстояния или использовать беспилотные устройства основного потока или контрольные насадки. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Для нефтяной сырой нефти не распыляйте воду непосредственно в поврежденную цистерну. Это может привести к опасному закипанию. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. При массовом возгорании используйте беспилотные устройства основного потока или стволы-мониторы; если это невозможно, отойдите от зоны и дайте огню гореть. (ЭРГ, 2020)
При массовом возгорании используйте беспилотные устройства основного потока или стволы-мониторы; если это невозможно, отойдите от зоны и дайте огню гореть. (ЭРГ, 2020)
Непожарное реагирование
Выдержка из Руководства ERG 128 [Горючие жидкости (не смешивающиеся с водой)]:
УСТРАНИТЕ все источники воспламенения (не курить, факелы, искры или пламя) в непосредственной близости. Все оборудование, используемое при работе с продуктом, должно быть заземлено. Не прикасайтесь к рассыпанному материалу и не ходите по нему. Остановите утечку, если вы можете сделать это без риска. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства. Для уменьшения паров можно использовать пароподавляющую пену. Впитать или засыпать сухой землей, песком или другим негорючим материалом и переложить в контейнеры. Используйте чистые, искробезопасные инструменты для сбора абсорбированного материала.
БОЛЬШОЙ РАЗЛИВ: Оборудуйте дамбу далеко перед разливом жидкости для последующего удаления. Распыление воды может уменьшить испарение, но не может предотвратить возгорание в закрытых помещениях. (ЭРГ, 2020)
Распыление воды может уменьшить испарение, но не может предотвратить возгорание в закрытых помещениях. (ЭРГ, 2020)
Защитная одежда
Защитные очки или лицевой щиток; пластиковые перчатки (как для бензина) (USCG, 1999)
DuPont Tychem® Suit Fabrics
Информация отсутствует.
Первая помощь
ВДЫХАНИЕ: вывести пострадавшего на свежий воздух.
ГЛАЗА: промывать большим количеством воды в течение не менее 15 мин.
КОЖА: сотрите и промойте водой с мылом.
ПРОГЛАТЫВАНИЕ: НЕ вызывать рвоту; предохраняться от аспирации в легкие.
СПОСОБ: обеспечить постельный режим; дать кислород; Вызовите врача. (Геологическая служба США, 1999 г.)
Физические свойства
Что это за информация?
Поля физических свойств
включают в себя такие свойства, как давление пара и
температура кипения, а также пределы взрываемости и
пороги токсического воздействия
Информация в CAMEO Chemicals поступает из различных источников.
источники данных.
| Химическая формула: |
|
Температура вспышки:
100°F
(USCG, 1999)
Нижний предел взрываемости (НПВ):
0,8 %
(минеральные духи)
(USCG, 1999)
Верхний предел взрываемости (ВПВ):
5 %
(минеральные духи)
(USCG, 1999)
Температура самовоспламенения:
540°F
(USCG, 1999)
Температура плавления: данные отсутствуют
Давление пара: данные отсутствуют
Плотность пара (относительно воздуха): данные отсутствуют
Удельный вес:
от 0,93 до 1,05
при 77°F
(USCG, 1999)
Точка кипения:
от 310 до 395°F
при 760 мм рт.ст.
(USCG, 1999)
Молекулярный вес:
Смесь
(USCG, 1999)
Растворимость в воде: данные отсутствуют
Энергия/потенциал ионизации: данные отсутствуют
IDLH: данные отсутствуют
AEGL (рекомендательные уровни острого воздействия)
Информация об AEGL отсутствует.
ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.
PAC (критерии защитных действий)
Информация о PAC отсутствует.
Нормативная информация
Что это за информация?
Поля нормативной информации
включить информацию из
Сводный список III Агентства по охране окружающей среды США
списки,
Химический завод Агентства кибербезопасности и безопасности инфраструктуры США
антитеррористические стандарты,
и Управление по охране труда и здоровья США
Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами
(подробнее об этих
источники данных).
Сводный перечень списков EPA
| Нормативное наименование | Номер CAS/ 313 Код категории | EPCRA 302 EHS TPQ | EPCRA 304 EHS RQ | CERCLA RQ | ЭПКРА 313 ТРИ | RCRA Код | CAA 112(r) RMP TQ |
|---|---|---|---|---|---|---|---|
| Соединения меди | Н100 | и | 313 |
- & указывает, что этому общему или широкому классу не присвоено RQ, хотя этот класс является опасным веществом CERCLA.
 См. 50 Федерального реестра 13456 (4 апреля 1985 г.).
См. 50 Федерального реестра 13456 (4 апреля 1985 г.).
(Список списков Агентства по охране окружающей среды, 2022 г.)
Антитеррористические стандарты CISA Chemical Facility (CFATS)
Отсутствует нормативная информация.
Список стандартов OSHA по управлению безопасностью процессов (PSM)
Отсутствует нормативная информация.
Альтернативные химические названия
Что это за информация?
В этом разделе приводится список альтернативных названий этого химического вещества,
включая торговые названия и синонимы.
- ЦЕЛЛАВИТ
- НАФТЕНАТ МЕДИ
- КУНАП
- КУНАПСОЛ 5
- КУПРИНОЛ
- ЗЕЛЕНЫЙ КУПРИНОЛ
- ГОРИ 22
- К 204
- К 204 (АКСЕЛЕРАТОР)
- МЕДНАЯ СОЛЬ НАФТЕНОВОЙ КИСЛОТЫ
- НАФТЕКС CU
- СУШИЛКА КРАСКИ
- ПОКРАСКА
- САНПРЕСЕР ВОГ
- ШЕКЕЛАСТ
Пять основных применений меди – впереди всех
2022. 04.08
04.08
Как древнейший металл, известный человеку, медь была важным материалом, который помог сформировать и преобразовать многие цивилизации, от древних египтян, римлян до современных дневные культуры.
Можно даже сказать, что без меди общество не выжило бы. Это связано с тем, что металл обладает многими полезными свойствами (высокая пластичность, ковкость, тепло- и электропроводность, устойчивость к коррозии). Его антимикробные свойства также делают элемент меди жизненно важным питательным веществом в нашем рационе.
Сегодня это третий наиболее потребляемый металл на Земле после железной руды и алюминия. По данным Геологической службы США, каждый американец, родившийся в 2008 году, будет использовать 1309фунтов металла в течение своей жизни для нужд, образа жизни и здоровья.
Медь, по сути, является стержнем современного общества и вносит ценный вклад в различные отрасли промышленности. Ниже приведены 5 самых популярных применений меди на сегодняшний день:
- Строительство зданий
По данным USGS Mineral Commodity Summary, почти половина меди в мире попадает в здания, от небоскребов в центре города до домов в пригородах. Средний дом на одну семью сегодня содержит около 200 килограммов (или 439фунтов) металлической меди.
Средний дом на одну семью сегодня содержит около 200 килограммов (или 439фунтов) металлической меди.
Источник: USGS
Обладая физическими свойствами, с которыми могут сравниться немногие металлы, медь может использоваться в самых разных областях строительства, от отопления и водопровода до кровли и электропроводки.
Пластичность меди облегчает пайку, но она достаточно прочна, чтобы создавать соединения, необходимые для водопровода и электропроводки. Медь легкая и требует минимального ухода, а благодаря своей устойчивости к коррозии может прослужить несколько сотен лет.
Кабельный барабан. Источник Pixabay
Медь также имеет низкое тепловое расширение, что делает ее стабильной и устойчивой к износу при движении. Он относительно легкий по сравнению со свинцом и требует минимального ухода по сравнению с другими металлами.
Медь также является немагнитной и обладает хорошей устойчивостью к биообрастанию, поэтому обычно используется в строительной отрасли для изготовления труб и трубопроводов для распределения питьевой воды, систем отопления и охлаждения. Металлу легко придать сложную форму, и он используется в качестве облицовочного и гидроизоляционного материала для водосточных желобов, водосточных труб и облицовки.
Металлу легко придать сложную форму, и он используется в качестве облицовочного и гидроизоляционного материала для водосточных желобов, водосточных труб и облицовки.
Медь может подвергаться как горячей, так и холодной обработке, а соединения могут быть образованы пайкой или сваркой. Еще один большой плюс: медь противомикробна. Его устойчивость к бактериям, вирусам и микробам играет большую роль в его использовании в сантехнике и транспортировке воды.
Кроме того, медь является устойчивым металлом для использования в строительстве зданий, поскольку ее можно многократно перерабатывать без потери прочности или проводимости, а это означает, что она оказывает незначительное влияние на жизненный цикл.
- Электроника
Медь считается «золотым стандартом» для электропроводки. Его превосходная электропроводность по отношению к другим металлам и широкое распространение в качестве сырья делают его эффективным и экономичным выбором для производителей электроники.
Теплопроводность меди, которая на 60 % выше, чем у алюминия, также полезна для отвода тепла, выделяемого электронными компонентами. Чем больше тепла отводится от процессора, тем эффективнее он будет работать, с меньшей вероятностью повреждения других важных компонентов.
Таким образом, металл красного цвета встречается в электропроводке и печатных платах почти всех электронных продуктов, от мобильных телефонов, ноутбуков и телевизоров до систем наблюдения, электроинструментов и роботов-пылесосов.
Печатная плата. Источник: Pixabay
Большинство печатных плат для электронных продуктов изготавливаются путем ламинирования медного листа на гибкую пленку с последующим травлением большей части меди, оставляя тонкие линии сплошной меди, по которым проходит ток.
- Транспорт
От автомобилей с газовым двигателем и электромобилей до поездов и самолетов медь также является неотъемлемой частью наших ежедневных поездок на работу.
В автомобильной промышленности медь является важным компонентом тормозов, подшипников, соединителей, двигателей, радиаторов и электропроводки. Одно обычное транспортное средство может содержать до 50 фунтов меди: 40 фунтов для электрических и 10 фунтов для неэлектрических компонентов. Электромобили полагаются на электропроводность меди в батареях, системах электропроводки и зарядных станциях.
S источник: Pixabay
В железнодорожной промышленности медь используется для изготовления различных деталей поездов, включая двигатели, тормоза и органы управления, а также ее можно найти в электрических и сигнальных системах. Типичный дизель-электрический железнодорожный локомотив использует около 11 000 фунтов металла.
Самолетам нужна медь для охлаждения, гидравлики и навигации, а также для электрических систем. Около 2% (9000 фунтов) от общего веса реактивного самолета Боинг 747-200 составляет медь. В этот вес входит 632 000 футов медной проволоки.
Медные сплавы также являются стандартными материалами в судостроении, от болтов и заклепок до гребных винтов и труб конденсатора.
- Потребительские товары
Когда речь идет о потребительских товарах, влияние меди еще более разнообразно. Секторы здравоохранения, ювелирных изделий и искусства, среди многих других, уже давно являются его постоянными клиентами.
Мало того, что медь необходима для питания человека и необходима для роста и развития органов тела, она также обладает противомикробными свойствами, жизненно важными для применения в здравоохранении.
Исследования показали, что бактерии, вирусы и дрожжи не могут долго выживать на поверхности меди, так как металл мешает электрическому заряду клеточных мембран микробов. Данные Агентства по охране окружающей среды США показывают, что медь может убить 99,9% E.Coli . всего за два часа после воздействия.
Долговечность меди также делает ее идеальным ингредиентом для ювелирных изделий, которые обычно сплавляются с большим количеством металла, чтобы обеспечить определенную степень твердости, а также эстетическую привлекательность. Например, украшение из 18-каратного золота обычно содержит 75% золота, 15% серебра и 10% меди. В монетах также используется медь и ее сплавы для сохранения их долговечности.
Например, украшение из 18-каратного золота обычно содержит 75% золота, 15% серебра и 10% меди. В монетах также используется медь и ее сплавы для сохранения их долговечности.
Медь также играет важную роль в создании произведений искусства. Фактически, медный сплав использовался даже в самых старых музыкальных инструментах, насчитывающих более трех тысячелетий. Пигменты на основе меди также были важным компонентом древних красок, а сам металл часто использовался в качестве «холста», на котором рисовали художники эпохи Возрождения.
- Машиностроение
Так как медь и ее сплавы являются одними из самых универсальных инженерных материалов, они используются почти во всех промышленных машинах и оборудовании. К ним относятся системы медных труб, электродвигатели, испарители, конденсаторы, теплообменники, клапаны и емкости для хранения агрессивных сред. Коррозионно-стойкие медные сплавы являются критически важными материалами при изготовлении подводных установок, таких как опреснительные установки и морские нефтяные и газовые буровые платформы.
