Описать физико химические свойства материала м2 медь: Медь – свойства, применение, характеристики медных сплавов
Содержание
Физические и химические свойства меди, ее область применения
Содержание
- Интересное о меди
- Физические свойства
- Химические свойства
- Области применения меди
- 17 интересных фактов о меди
Медь в природе встречается в больших количествах и ее начали использовать еще в древние времена. Изучив свойства металла, из него начали делать полезные вещи для бытового употребления и охоты, а также украшения и другие нужные предметы.
Активное использование данного металла на протяжении многих лет обусловлено не только его особыми свойствами, но и простотой обработки. Медь, которая присутствует в руде в виде карбонатов и окислов, достаточно легко восстанавливается, что и научились делать наши древние предки.
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь.
Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла. Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет.
Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Физические свойства
Медь в чистом виде представляет собой металл, цвет которого может варьироваться от розового до красного оттенка.
Радиус ионов меди, имеющих положительный заряд, может принимать следующие значения:
- если координационный показатель соответствует 6-ти — до 0,091 нм;
- если данный показатель соответствует 2 — до 0,06 нм.
Радиус атома меди составляет 0,128 нм, также он характеризуется сродством к электрону, равном 1,8 эВ. При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
Медь — это переходный металл, показатель электроотрицательности которого составляет 1,9 единиц по шкале Полинга. Кроме этого, его степень окисления может принимать различные значения. При температурах, находящихся в интервале 20–100 градусов, его теплопроводность составляет 394 Вт/м*К. Электропроводность меди, которую превосходит лишь серебро, находится в интервале 55,5–58 МСм/м.
Так как медь в потенциальном ряду стоит правее водорода, она не может вытеснять этот элемент из воды и различных кислот. Ее кристаллическая решетка имеет кубический гранецентрированный тип, величина ее составляет 0,36150 нм. Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570. Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.
Из ее механических свойств и физических показателей стоит также отметить следующие:
- термическое линейное расширение — 0,00000017 единиц;
- предел прочности, которому медные изделия соответствуют при растяжении, составляет 22 кгс/мм2;
- твердость меди по шкале Бринелля соответствует значению 35 кгс/мм2;
- удельный вес 8,94 г/см3;
- модуль упругости составляет 132000 Мн/м2;
- значение относительного удлинения равно 60%.

Совершенно уникальными можно считать магнитные свойства данного металла, который является полностью диамагнитным. Именно эти свойства, наряду с физическими параметрами: удельным весом, удельной проводимостью и другими, в полной мере объясняют широкую востребованность данного металла при производстве изделий электротехнического назначения.
Похожими свойствами обладает алюминий, который также успешно используется при производстве различной электротехнической продукции: проводов, кабелей и др.
Основную часть характеристик, которыми обладает медь, практически невозможно изменить, за исключением предела прочности. Данное свойство можно улучшить практически в два раза (до 420–450 МН/м2), если осуществить такую технологическую операцию, как наклеп.
Химические свойства
Химические свойства меди определяются тем, какое положение она занимает в таблице Менделеева, где она имеет порядковый номер 29 и располагается в четвертом периоде. Что примечательно, она находится в одной группе с благородными металлами. Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.
Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.
В условиях невысокой влажности медь практически не проявляет химическую активность. Все меняется, если изделие поместить в условия, характеризующиеся высокой влажностью и повышенным содержанием углекислого газа.
В таких условиях начинается активное окисление меди: на ее поверхности формируется зеленоватая пленка, состоящая из CuCO3, Cu(OH)2 и различных сернистых соединений. Такая пленка, которая называется патиной, выполняет важную функцию защиты металла от дальнейшего разрушения.
Окисление начинает активно происходить и тогда, когда изделие подвергается нагреву. Если металл нагреть до температуры 375 градусов, то на его поверхности формируется оксид меди, если выше (375-1100 градусов) — то двухслойная окалина.
Медь достаточно легко реагирует с элементами, которые входят в группу галогенов. Если металл поместить в пары серы, то он воспламенится. Высокую степень родства он проявляет и к селену. Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Внимание заслуживает взаимодействие оксида меди с различными веществами. Так, при его взаимодействии с серной кислотой образуется сульфат и чистая медь, с бромоводородной и иодоводородной кислотой — бромид и иодид меди.
Иначе выглядят реакции оксида меди с щелочами, в результате которых образуется купрат. Получение меди, при котором металл восстанавливается до свободного состояния, осуществляют при помощи оксида углерода, аммиака, метана и других материалов.
Медь при взаимодействии с раствором солей железа переходит в раствор, при этом железо восстанавливается. Такая реакция используется для того, чтобы снять напыленный медный слой с различных изделий.
Одно- и двухвалентная медь способна создавать комплексные соединения, отличающиеся высокой устойчивостью. Такими соединениями являются двойные соли меди и аммиачные смеси. И те и другие нашли широкое применение в различных отраслях промышленности.
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции. Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами.
Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой. Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара.
Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран. Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло.
Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло.
Благодаря этому свойству она успешно используется в составе следующих систем:
- тепловые трубки;
- кулеры, использующиеся для охлаждения элементов персональных компьютеров;
- системы отопления и охлаждения воздуха;
- системы, обеспечивающие перераспределение тепла в различных устройствах (теплообменники).
Металлические конструкции, в которых использованы медные элементы, отличаются не только небольшим весом, но и исключительной декоративностью. Именно это послужило причиной их активного использования в архитектуре, а также для создания различных интерьерных элементов.
17 интересных фактов о меди
- Люди научились добывать и выплавлять медь примерно 5-6 тысяч лет назад.
- Она была первым металлом, который древние люди начали массово использовать (см. интересные факты о древних людях).
- Медный век продлился в разных землях примерно 1000-2000 лет, и закончился, когда люди научились выплавлять бронзу из смеси меди и олова.

- Оригинальное латинское название меди («cuprum») происходит от названия острова Кипр, одного из первых мест, где началась выплавка этого металла.
- До сих пор большая часть электрических кабелей во всём мире изготавливается именно из меди.
- Медные самородки встречаются намного чаще, чем железные, несмотря на то, что железо — один из самых распространённых металлов.
- Медь препятствует распространению бактерий по своей поверхности. Поэтому часто дверные ручки и тому подобные скобяные изделия делают из бронзы — она прочнее и при этом обладает схожими свойствами, так как меди в её составе много.
- Медные инструменты при ударе друг о друга не могут вызвать искру, в отличие от железных.
- Нередко медь добавляется в ювелирные сплавы, чтобы повысить их прочность. Само по себе золото — слишком мягкий металл (см. интересные факты о золоте).
- Средняя норма потребления меди для взрослого человека составляет порядка 0,9 миллиграмма.
- По производству и потреблению медь занимает третье место в мире, уступая лишь железу и алюминию.

- В Непале медь считается чем-то вроде священного металла. Местные жители верят, что она помогает бороться с болезнями, и часто пьют воду, в которую кидают медные монеты (см. интересные факты о Непале).
- Благодаря высокой коррозионной стойкости меди из неё стали изготавливать капсулы для захоронения токсичных и радиоактивных отходов.
- Медь — один из металлов, который активно перерабатывается и используется повторно. В среднем в мире перерабатывается около 80% всего объёма меди.
- В древнеегипетских развалинах археологи нашли медные водопроводные трубы, которым почти 5 тысяч лет. Они на момент находки были полностью работоспособны (см. интересные факты о Древнем Египте).
- Несмотря на то, что сама по себе медь экологически чиста, процесс её добычи изрядно загрязняет окружающую среду. Американское озеро Беркли-Пит, являющееся самым токсичным в мире, образовалось в закрытом карьере, где ранее добывали медь. Его воды настолько токсичны, что убивают неосторожных водоплавающих птиц, садящихся на него.

- Больше всего меди в человеческом организме содержится в печени.
Источники:
http://met-all.org/cvetmet-splavy/med/fizicheskie-i-himicheskie-svojstva-medi.html
http://стофактов.рф/17-интересных-фактов-о-меди/
Сталь 20 конструкционная углеродистая качественная
Сталь 20 конструкционная углеродистая качественная
- ГОСТы
- Стали
Сталь 20 относится к разряду обогащенных углеродом конструкционным сталям высокого уровня качества. На производства поставляется в нескольких вариациях – серебрянка, калиброванная, кованная или горячекатаная. Можно выделить пять типов данной разновидности стали по требованиям к ее механическим свойствам.
Типы стали по требованию к механическим свойствам:
- Первый тип представляет собой сталь всех используемых видов обработки, но без проведенных испытаний по растяжению и ударной вязкости.
- Второй тип – это образцы нормализованной стали всех типов обработки размеров в двадцать пять миллиметров, которые подвергаются испытаниям на растяжение и ударную вязкость.

- Третий тип представляет собой все те же образцы, на которых проводятся вышеупомянутые испытания. Единственное отличие – это их размер. В этом типе он составляет от двадцати шести до ста миллиметров.
- Четвертый тип представляет собой образцы из заготовок с размером — до сотни миллиметров, которые были обработаны термическим путем. Они также применяются для проведения испытаний над материалом.
- Пятый тип – это также образцы, которые изготовлены из отожженных или выскоопущенных сталей. Еще одно технологическое решение – это образцы из нагартованной стали.
Сталь 20 может быть при необходимости заменена схожими материалами марок 15 и 25.
Технологические свойства стали 20
Для начала процесса ковки достаточно разогреть сталь до +1280 градусов Цельсия, а завершаться процесс должен при температуре -750 градусов Цельсия, при том что охлаждение поковки производится воздушным способом. Сталь марки 20 относится с типу нефлокеночувствительных, а также она не склонна к отпускной способности. Возможность сваривания данного типа стали ничем не ограничена, за исключением тех деталей, которые подвергались химико-термической обработке.
Возможность сваривания данного типа стали ничем не ограничена, за исключением тех деталей, которые подвергались химико-термической обработке.
Сталь 20 зачастую используется в процессе производства тех деталей, которые работают со сравнительно небольшим нагружением. Это могут быть оси, пальцы или шестерни, а также и те детали, которые будут подвергаться цементированию для продления срока службы. Помимо всего, такой тип стали может быть использован в процессе изготовления особо тонких деталей, в большинстве своем работающих на истирание. Без термической обработки этот вид стали используется в производстве крюков подъемных кранов, а также прочих деталей, эксплуатация которых производится под некоторым давлением в диапазоне температур от -40 до +450 градусов Цельсия. Химико-термическая обработка наделяет сталь 20 всеми необходимыми свойствами для использования ее в качестве основы для деталей, главной особенностью которых является высокий уровень прочности поверхности.
Химический состав стали 20
Состав марки стали 20 очень разнообразен, ведь в нем представлен углерод, марганец, кремний, медь, мышьяк, никель, фосфор и сера. По сути своей данный тип стали представляет собой очень интересную смесь, в составе которой имеется феррит и перлит. В процессе термической обработки структуру материала можно изменить до пакетного мартенсита. Стоит отметить, что данные преобразования структуры приведут к тому, что прочность стали увеличиться, а ее пластичность, наоборот, уменьшиться. Если сталь 20 подвергнуть термической обработке, после этого она может быть использована в процессе изготовления особой продукции метизного типа.
| C | Si | Mn | S | P | Ni | Cr | Cu | As | Fe |
| 0,17 — 0,24 | 0,17 — 0,37 | 0,35 — 0,65 | до 0,04 | до 0,04 | до 0,25 | до 0,25 | до 0,25 | до 0,08 | ~98 |
Зарубежные аналоги стали 20
| США | 1020, 1023, 1024, G10200, G10230, h20200, M1020, M1023 |
| Германия | 1. 0402, 1.0405, 1.1151, C22, C22E, C22R, Ck22, Cm22, Cq22, St35, St45-8 0402, 1.0405, 1.1151, C22, C22E, C22R, Ck22, Cm22, Cq22, St35, St45-8 |
| Япония | S20C, S20CK, S22C, STB410, STKM12A, STKM12A-S, STKM13B, STKM13B-W |
| Франция | 1C22, 2C22, AF42, AF42C20, C20, C22, C22E, C25E, XC15, XC18, XC25 |
| Англия | 050A20, 055M15, 070M20, 070M26, 1449-22CS, 1449-22HS, 1C22, 22HS, 430, C22, C22E |
| Евросоюз | 1.1151, 2C22, C20E2C, C22, C22E |
| Италия | C18, C20, C21, C22, C22E, C22R, C25, C25E |
| Бельгия | C25-1, C25-2 |
| Испания | 1C22, C22, C25k, F.112, F.1120 |
| Китай | 20, 20G, 20R, 20Z |
| Швеция | 1450 |
| Болгария | 20, C22, C22E |
| Венгрия | A45.47, C22E |
| Польша | 20, K18 |
| Румыния | OLC20, OLC20X |
| Чехия | 12022, 12024 |
| Австралия | 1020, M1020 |
| Швейцария | Ck22 |
Юж. Корея Корея | SM20C, SM20CK, SM22C |
Физические свойства стали 20
| T | E 10— 5 | a 10 6 | l | r | C | R 10 9 |
| Град | МПа | 1/Град | Вт/(м·град) | кг/м3 | Дж/(кг·град) | Ом·м |
| 20 | 2,13 | 52 | 7859 | |||
| 100 | 2,03 | 11,60 | 50.6 | 7834 | 486 | 219 |
| 200 | 1,99 | 12,60 | 48. 6 6 | 7803 | 498 | 292 |
| 300 | 1,90 | 13,10 | 46.2 | 7770 | 514 | 381 |
| 400 | 1,82 | 13,60 | 42.8 | 7736 | 533 | 487 |
| 500 | 1,72 | 14,10 | 39.1 | 7699 | 555 | 601 |
| 600 | 1,60 | 14,60 | 35.8 | 7659 | 584 | 758 |
| 700 | 14,80 | 32 | 7617 | 636 | 925 | |
| 800 | 12,90 | 7624 | 703 | 1094 | ||
| 900 | 7600 | 703 | 1135 | |||
| 1000 | 695 |
Механические свойства стали 20 при температуре 20
0С
| Соответствие по ГОСТ | Вид поставки | σВ (МПа) | δ 5 (%) | ψ (%) | HB (не более) |
| 1050-74 | Сталь калиброванная: | ||||
| горячекатаная, кованая и серебрянка 2-й категории после нормализации | 410 | 25 | 55 | ||
| 5-й категории после нагартовки | 490 | 7 | 40 | ||
| 5-й категории после отжига или высокого отпуска | 390 | 21 | 50 | ||
| 10702-78 | Сталь калиброванная и калиброванная со специальной отделкой: | ||||
| после отпуска или отжига | 390-490 | 50 | 163 | ||
| после сфероидизирующего отжига | 340-440 | 50 | 163 | ||
| нагартованная без термообработки | 490 | 7 | 40 | 207 |
Механические свойства стали 20 при повышенных температурах
0С
| Температурные испытания, °С | σ0,2, МПа | σВ, МПа | δ5, % | ψ, % | KCU, Дж/см2 |
| 20 | 280 | 430 | 34 | 67 | 218 |
| 200 | 230 | 405 | 28 | 67 | 186 |
| 300 | 170 | 415 | 29 | 64 | 188 |
| 400 | 150 | 340 | 39 | 81 | 100 |
| 500 | 140 | 245 | 40 | 86 | 88 |
| 700 | 130 | 39 | 94 | ||
| 800 | 89 | 51 | 96 | ||
| 900 | 75 | 55 | 100 | ||
| 1000 | 47 | 63 | 100 | ||
| 1100 | 30 | 59 | 100 | ||
| 1200 | 20 | 64 | 100 |
Пределы выносливости стали 20
| σ-1, МПа | J-1, МПа | n | δ5, МПа | σ0,2,МПа | Термообработка, состояние стали |
| 206 | 1Е+7 | 500 | 320 | ||
| 245 | 520 | 310 | |||
| 225 | 490 | 280 | |||
| 205 | 127 | Нормализация 910 С, отпуск 620 С. | |||
| 193 | 420 | 280 | |||
| 255 | 451 | Цементация 930 С, закалка 810 С, отпуск 190 С. |
Механические свойства стали 20 после ХТО
| Сечение, мм | σ0,2, МПа | σВ, МПа | δ5, % | y , % | KCU, Дж/м 2 | HB | HRC |
| Цементация 920-950 °С, воздух. Закалка 800-820 °С, вода. Отпуск 180-200 °С, воздух. | |||||||
| 50 | 290-340 | 490-590 | 18 | 45 | 54 | 156 | 55-63 |
Технологические свойства стали 20
| Коррозионная стойкость | В среде H2S: скорость общей коррозии ≤ 0,5 мм/год; стойкость к водородному растрескиванию CLR ≤ 3 % CTR ≤ 6 %; стойкость к сульфидному коррозионному растрескиванию под напряжением ≥ 75 % от σ0,2.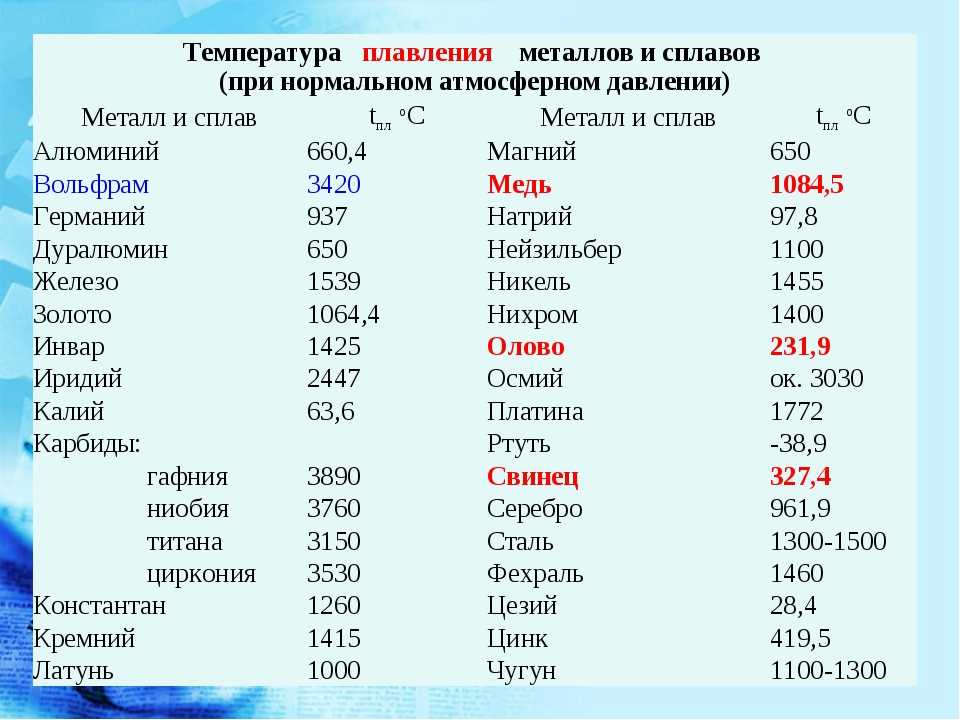 По ТУ 14-3-1971-97 металл труб должен выдерживать испытания на водородное растрескивание по стандарту NACE ТМ 02 84 (испытательная среда NACE TM 01 77). Предельные значения коэффициентов длины (CLR) и толщины трещин (CTR) не должны превышать соответственно 3 и 6%. Металл труб должен выдерживать испытания на стойкость к сульфидному растрескиванию под напряжением. Пороговое напряжение СКРН должно быть не менее 75% (254 МРа) от минимального гарантируемого предела текучести материала. Скорость общей коррозии металла труб не должна превышать 0,5 мм/год. По ТУ 14-3-1971-97 металл труб должен выдерживать испытания на водородное растрескивание по стандарту NACE ТМ 02 84 (испытательная среда NACE TM 01 77). Предельные значения коэффициентов длины (CLR) и толщины трещин (CTR) не должны превышать соответственно 3 и 6%. Металл труб должен выдерживать испытания на стойкость к сульфидному растрескиванию под напряжением. Пороговое напряжение СКРН должно быть не менее 75% (254 МРа) от минимального гарантируемого предела текучести материала. Скорость общей коррозии металла труб не должна превышать 0,5 мм/год. |
| Наплавка | Наплавка уплотнительных поверхностей деталей трубопроводной арматуры в соответствии с ОСТ 26-07-2028-81 производится ручной электродуговой наплавкой электродами типа Э-20Х13 с обмазкой УОНИ-13НЖ, НИИ-48, НИИ-48Ж-1 или проволокой СВ-12Х13 или СВ-20Х13. Подготовка поверхности под наплавку производится механической обработкой. Наплавка производится с предварительным и сопутствующим нагревом детали до 400-450 °C не менее чем в 3 слоя толщиной не менее 4 мм без учета припуска на механическую обработку. Термообработка после наплавки производится путем отпуска при 550-600 °C (выдержка 2-5 ч) на твердость НВ=301-350, при 600-650 °C (выдержка 2-5 ч) на твердость НВ=240-300, при 400-450 °C (выдержка 2-5 ч) на твердость НВ=351-400. Температура печи при загрузке деталей для отпуска должна быть не более 300 °C. Термообработка после наплавки производится путем отпуска при 550-600 °C (выдержка 2-5 ч) на твердость НВ=301-350, при 600-650 °C (выдержка 2-5 ч) на твердость НВ=240-300, при 400-450 °C (выдержка 2-5 ч) на твердость НВ=351-400. Температура печи при загрузке деталей для отпуска должна быть не более 300 °C. |
| Обрабатываемость резаньем | В горячекатанном состоянии при НВ 126-131 и sВ=450-490 МПа Kn тв.спл.=1,7 Kn б.ст.=1,6. |
| Свариваемость | Сваривается без ограничений, кроме деталей после химико-термической обработки. Способы сварки РДС, АДС под флюсом и газовой защитой, КТС. Для ручной дуговой сварки используются электроды МР-3 или УОНИ13/45А; для автоматической под флюсом — проволока Св-08А, Cв-08ГA или Св-10Г2 с флюсом АН-348А; для сварки в защитных газах Ar и CO2 — сварочная проволока Св-08Г2С. |
| Склонность к отпускной хрупкости | Не склонна. |
| Температура ковки | Начала — 1280 °C, конца — 750 °C. Охлаждение на воздухе. |
| Флокеночувствительность | не чувствительна. |
Ударная вязкость стали 20 KCU (Дж/см3) при низких температурах °С
| Соответствие по ГОСТ | Вид поставки | Сечение, мм | KCU при +20 | KCU при -40 | KCU при -60 |
| 19281-73 | Сортовой и фасонный прокат | от 5 до 10 | 64 | 39 | 34 |
| от 10 до 20 вкл. | 59 | 34 | 29 | ||
| от 20 до 100 вкл. | 59 | 34 | — |
Предел текучести стали 20
| Температура испытания, °C/s0,2 | |||||||
| 150 | 200 | 250 | 300 | 320 | 350 | 400 | 450 |
| ≥215 | ≥210 | ≥196 | ≥180 | ≥160 | ≥137 | ≥127 | |
Химический состав стали 20 по ТУ и ГОСТ
| НТД | C | S | P | Mn | Cr | Zn | V | Sn | Si | Sb | Pb | Ni | N | Mo | Fe | Cu | Bi | As | Al |
| ТУ 14-1-3987-85 | 0,17-0,24 | ≤0,025 | ≤0,030 | 0,35-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,30 | — | — | — | ≤0,30 | — | — | — |
| ТУ 14-1-5058-91 | 0,18-0,24 | ≤0,012 | ≤0,020 | 0,35-0,65 | ≤0,15 | ≤0,0040 | ≤0,040 | ≤0,005 | 0,17-0,37 | 0,00015-0,00045 | ≤0,0030 | ≤0,10 | ≤0,010 | — | — | ≤0,10 | 0,0002-0,00045 | ≤0,010 | — |
| ГОСТ 11017-80 | 0,17-0,24 | ≤0,035 | ≤0,035 | 0,35-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,30 | ≤0,006 | — | — | ≤0,30 | — | ≤0,080 | — |
| ГОСТ 19277-73, ГОСТ 21729-76 | 0,17-0,24 | ≤0,035 | ≤0,035 | 0,35-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,25 | — | — | — | ≤0,20 | — | — | — |
| ТУ 14-1-1529-2003 | 0,17-0,24 | ≤0,025 | ≤0,030 | 0,35-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,25 | — | — | Ост. | ≤0,30 | — | — | — |
| ТУ 14-3Р-251-2007, ТУ 14-3-251-74, ГОСТ 1050-88 | 0,17-0,24 | ≤0,040 | ≤0,035 | 0,35-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,30 | ≤0,006 | — | — | ≤0,30 | — | ≤0,080 | — |
| ТУ 14-3-808-78 | 0,17-0,24 | ≤0,040 | ≤0,035 | 0,35-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,25 | ≤0,006 | — | — | ≤0,25 | — | ≤0,080 | 0,02-0,08 |
| ТУ 14-3-1971-97 | 0,17-0,21 | ≤0,008 | ≤0,012 | 0,35-0,65 | ≤0,25 | — | ≤0,060 | — | 0,17-0,37 | — | — | ≤0,30 | — | — | — | ≤0,30 | — | — | 0,02-0,05 |
| ТУ 14-3-341-75 | 0,17-0,24 | ≤0,025 | ≤0,030 | 0,35-0,65 | ≤0,025 | — | — | — | 0,17-0,37 | — | — | ≤0,25 | — | — | — | ≤0,30 | — | — | — |
| ТУ 14-162-14-96 | 0,17-0,22 | ≤0,015 | ≤0,015 | 0,50-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,25 | — | — | — | ≤0,25 | — | — | 0,03-0,05 |
| ТУ 14-1-5185-93 | 0,18-0,24 | 0,002-0,015 | 0,005-0,015 | 0,35-0,65 | ≤0,15 | 0,0005-0,0040 | 0,002-0,100 | 0,0005-0,0040 | 0,17-0,37 | 0,0005-0,0030 | 0,0003-0,0040 | ≤0,15 | 0,002-0,012 | — | — | ≤0,15 | 0,0001-0,0030 | ≤0,010 | 0,002-0,009 |
ТУ 08. 002.0501.5348-92 002.0501.5348-92 | 0,17-0,24 | ≤0,020 | ≤0,035 | 0,35-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,30 | — | — | — | ≤0,30 | — | — | — |
| ТУ 14-159-1128-2008 | 0,17-0,24 | ≤0,025 | ≤0,030 | 0,35-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,30 | ≤0,006 | — | — | ≤0,30 | — | ≤0,080 | — |
| ТУ 14-161-148-94 | 0,17-0,24 | ≤0,013 | ≤0,018 | 0,35-0,65 | — | — | — | — | 0,17-0,37 | — | — | ≤0,25 | — | — | — | ≤0,25 | — | — | — |
TУ 1317-006. 1-593377520-2003 1-593377520-2003 | 0,17-0,24 | ≤0,015 | ≤0,017 | 0,35-0,65 | ≤0,40 | — | ≤0,050 | — | 0,17-0,37 | — | — | ≤0,25 | ≤0,008 | — | — | ≤0,25 | — | — | 0,02-0,05 |
| ТУ 1301-039-00212179-2010 | 0,17-0,24 | ≤0,025 | ≤0,030 | 0,35-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,25 | — | ≤0,15 | — | ≤0,30 | — | — | — |
| ТУ 14-3Р-55-2001, ТУ 14-3-460-2003 | 0,17-0,24 | ≤0,025 | ≤0,030 | 0,35-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,25 | — | — | — | ≤0,30 | — | — | — |
| ТУ 14-3Р-1128-2007 | 0,17-0,24 | ≤0,025 | ≤0,030 | 0,35-0,65 | ≤0,25 | — | — | — | 0,17-0,37 | — | — | ≤0,30 | ≤0,008 | — | — | ≤0,30 | — | — | — |
Обозначения используемые в таблицах
Механические свойства:
- sв — Предел кратковременной прочности, [МПа]
- sТ — Предел текучести, [МПа]
- s0,2 — Предел пропорциональности (допуск на остаточную деформацию — 0,2%), [МПа]
- d5 — Относительное удлинение при разрыве, [ % ]
- y — Относительное сужение, [ % ]
- KCU — Ударная вязкость, [ кДж / м2]
- HB — Твердость по Бринеллю, [МПа]
- HV — Твердость по Виккерсу, [МПа]
- HSh — Твердость по Шору, [МПа]
Физические свойства:
- T — Температура, при которой получены данные свойства, [Град]
- E — Модуль упругости первого рода, [МПа]
- a — Коэффициент температурного (линейного) расширения (диапазон 20o — T ) , [1/Град]
- l — Коэффициент теплопроводности (теплоемкость материала) , [Вт/(м·град)]
- r — Плотность материала , [кг/м3]
- C — Удельная теплоемкость материала (диапазон 20o — T ), [Дж/(кг·град)]
- R — Удельное электросопротивление, [Ом·м]
Имя:
Телефон или email для связи:
даю согласие на обработку персональных данных в соответствии с «Политикой конфиденциальности»
На нашем сайте мы используем cookie для сбора информации технического характера. В частности, для персонифицированной работы сайта мы обрабатываем IP-адрес региона вашего местоположения. | OK |
характеристики и расшифовка, применение и свойства стали
Стали
Стандарты
Всего сталей
| Страна | Стандарт | Описание | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Россия | ГОСТ 617-2006 | Трубы медные и латунные круглого сечения общего назначения. Технические условия Технические условия | ||||||||||
| Россия | ГОСТ 859-2014 | Медь. Марки | ||||||||||
| Россия | ГОСТ 1173-2006 | Фольга, ленты, листы и плиты медные. Технические условия | ||||||||||
| Россия | ГОСТ 16130-90 | Проволока и прутки из меди и сплавов на медной основе сварочные. Технические условия Технические условия | ||||||||||
Механические свойства стали М1
|
Прокат |
Временное сопротивление разрыву σ в, МПа |
Предел текучести для остаточной деформации,Sт, % |
Относительное удлинение при разрыве,d5, % |
|
Сплав мягкий |
200 — 250 |
90 — 150 |
60 |
|
Сплав твердый |
400 — 490 |
300 — 450 |
6 |
Свойства по стандарту
ГОСТ 617-2006
|
Сортамент |
Предел кратковременной прочности,Sв, МПа |
Предел текучести для остаточной деформации,Sт, % |
Относительное удлинение при разрыве,d5, % |
Тверость, НВ 10-1, МПа |
|
Трубы прессованные |
180 — 190 |
- |
32 |
- |
Свойства по стандарту
ГОСТ 1173-2006
|
Сортамент |
Предел кратковременной прочности,Sв, МПа |
Предел текучести для остаточной деформации,Sт, % |
Относительное удлинение при разрыве,d5, % |
Тверость, НВ 10-1, МПа |
|
Сплав мягкий холоднокатанный |
200 — 260 |
- |
42 |
55 |
|
Сплав твердый холоднокатанный |
290 |
- |
6 |
95 |
Свойства по стандарту
ГОСТ 16130-90
|
Сортамент |
Предел кратковременной прочности,Sв, МПа |
Предел текучести для остаточной деформации,Sт, % |
Относительное удлинение при разрыве,d5, % |
Тверость, НВ 10-1, МПа |
|
Проволока |
350 |
- |
- |
- |
×
Отмена
Удалить
×
Выбрать тариф
×
Подтверждение удаления
Отмена
Удалить
×
Выбор региона будет сброшен
Отмена
×
×
Оставить заявку
×
| Название | |||
Отмена
×
К сожалению, данная функция доступна только на платном тарифе
Выбрать тариф
нахождение в природе, физические и химические свойства.
 Медь и её сульфид, гидроксид и оксид
Медь и её сульфид, гидроксид и оксид
Этот химический элемент известен человеку давно и сегодня используется буквально повсеместно. Электрические провода, посуда, монеты, строительные материалы – в наши дни медь и сплавы на её основе применяются в самых разных отраслях промышленности. Начало применения Cu относят к «Бронзовому веку» (3 тыс. лет до н.э.). Уже тогда люди умели добывать этот розово-золотистый металл и даже получать медно-оловяные сплавы. Вместе с тем, нахождение в природе меди совсем невелико: если изучить состав земной коры нашей планеты, то элемента Cu в неё окажется всего около 0,01% (23 место).
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь.
Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла. Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет.
Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском.
 В такой руде меди может содержаться до 80%.
В такой руде меди может содержаться до 80%. - Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Технология производства
Чаще всего медь производят из медного колчедана или медного блеска. Эти сульфидные руды являются наиболее распространенными в природе. Производство металла реализуется с использованием двух технологий: пирометаллургической — 90% или гидрометаллургической — 10%.
Пирометаллургическая
Производство меди с использованием пирометаллургического способа предполагает следующие процессы:
- Обогащение. Руда обогащается путем флотации (обработка водой) или окислительного обжига. В первом случае на выходе получают сырье с содержанием нужного элемента 10–35%. Второй вариант применяется, когда в рудном концентрате много серы, но мало меди (до 8–25%).
 Если минерал содержит 25–35% нужно элемента, его сразу плавят без предварительного обжига.
Если минерал содержит 25–35% нужно элемента, его сразу плавят без предварительного обжига. - Плавка. В зависимости от вида сырья (кусковое или порошкообразное) выполняется плавка в шахтной либо в отражательной печи при +1450 0С.
- Продувка. Чтобы активировать окисление и феррум, выполняется продувка штейна сжатым воздухом. Окислы переводятся в шлак, а сера — в оксид. На выходе получается черновой металл с содержанием до 1,6–0,6% примесей. Для их снижения проводится огневое рафинирование. В результате доля сторонних включений уменьшается до 0,5%.
Гидрометаллургическая
Суть гидрометаллургического способа состоит в обработке сырья слабым раствором серной кислоты. Такая технология применяется для производства меди из бедных руд. Преимуществом этого варианта является возможность получения металла без совместного извлечения из минерала драгоценных элементов.
Физические свойства
Медь в чистом виде представляет собой металл, цвет которого может варьироваться от розового до красного оттенка.
Радиус ионов меди, имеющих положительный заряд, может принимать следующие значения:
- если координационный показатель соответствует 6-ти — до 0,091 нм;
- если данный показатель соответствует 2 — до 0,06 нм.
Радиус атома меди составляет 0,128 нм, также он характеризуется сродством к электрону, равном 1,8 эВ. При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
Медь — это переходный металл, показатель электроотрицательности которого составляет 1,9 единиц по шкале Полинга. Кроме этого, его степень окисления может принимать различные значения. При температурах, находящихся в интервале 20–100 градусов, его теплопроводность составляет 394 Вт/м*К. Электропроводность меди, которую превосходит лишь серебро, находится в интервале 55,5–58 МСм/м.
Так как медь в потенциальном ряду стоит правее водорода, она не может вытеснять этот элемент из воды и различных кислот. Ее кристаллическая решетка имеет кубический гранецентрированный тип, величина ее составляет 0,36150 нм. Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570. Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.
Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570. Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.
Из ее механических свойств и физических показателей стоит также отметить следующие:
- термическое линейное расширение — 0,00000017 единиц;
- предел прочности, которому медные изделия соответствуют при растяжении, составляет 22 кгс/мм2;
- твердость меди по шкале Бринелля соответствует значению 35 кгс/мм2;
- удельный вес 8,94 г/см3;
- модуль упругости составляет 132000 Мн/м2;
- значение относительного удлинения равно 60%.
Совершенно уникальными можно считать магнитные свойства данного металла, который является полностью диамагнитным. Именно эти свойства, наряду с физическими параметрами: удельным весом, удельной проводимостью и другими, в полной мере объясняют широкую востребованность данного металла при производстве изделий электротехнического назначения.
Похожими свойствами обладает алюминий, который также успешно используется при производстве различной электротехнической продукции: проводов, кабелей и др.
Основную часть характеристик, которыми обладает медь, практически невозможно изменить, за исключением предела прочности. Данное свойство можно улучшить практически в два раза (до 420–450 МН/м2), если осуществить такую технологическую операцию, как наклеп.
ГДЗ по химии для 8 класса Г.Е. Рудзитис
- ГДЗ
- 1 Класс Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Природоведение
- Основы здоровья
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- Математика
- Математика
- Математика
resheba. me
me
Химические свойства
Химические свойства меди определяются тем, какое положение она занимает в таблице Менделеева, где она имеет порядковый номер 29 и располагается в четвертом периоде. Что примечательно, она находится в одной группе с благородными металлами. Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.
В условиях невысокой влажности медь практически не проявляет химическую активность. Все меняется, если изделие поместить в условия, характеризующиеся высокой влажностью и повышенным содержанием углекислого газа.
В таких условиях начинается активное окисление меди: на ее поверхности формируется зеленоватая пленка, состоящая из CuCO3, Cu(OH)2 и различных сернистых соединений. Такая пленка, которая называется патиной, выполняет важную функцию защиты металла от дальнейшего разрушения.
Окисление начинает активно происходить и тогда, когда изделие подвергается нагреву. Если металл нагреть до температуры 375 градусов, то на его поверхности формируется оксид меди, если выше (375-1100 градусов) — то двухслойная окалина.
Медь достаточно легко реагирует с элементами, которые входят в группу галогенов. Если металл поместить в пары серы, то он воспламенится. Высокую степень родства он проявляет и к селену. Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Внимание заслуживает взаимодействие оксида меди с различными веществами. Так, при его взаимодействии с серной кислотой образуется сульфат и чистая медь, с бромоводородной и иодоводородной кислотой — бромид и иодид меди.
Иначе выглядят реакции оксида меди с щелочами, в результате которых образуется купрат. Получение меди, при котором металл восстанавливается до свободного состояния, осуществляют при помощи оксида углерода, аммиака, метана и других материалов.
Медь при взаимодействии с раствором солей железа переходит в раствор, при этом железо восстанавливается. Такая реакция используется для того, чтобы снять напыленный медный слой с различных изделий.
Одно- и двухвалентная медь способна создавать комплексные соединения, отличающиеся высокой устойчивостью. Такими соединениями являются двойные соли меди и аммиачные смеси. И те и другие нашли широкое применение в различных отраслях промышленности.
Такими соединениями являются двойные соли меди и аммиачные смеси. И те и другие нашли широкое применение в различных отраслях промышленности.
Медный прокат и его применение
Медный прокат широко востребован в разных сферах, включая электротехнику, машиностроение, строительство, радиоэлектронику, другие отрасли. Основными его видами являются:
- Прутки — длинные изделия, изготовленные в результате холодного деформирования или прессования.
- Листы — плоские заготовки сечением 0,2–25 мм, полученные путем холодного либо горячего катания.
- Шины — разновидность листового проката в виде длинных полос.
- Трубы — полые профили, изготовленные с использованием технологии прессования или холодного деформирования.
- Проволока — тонкие и длинные изделия, полученные в результате многократного волочения прутков.
В качестве сырья для производства проката используются слитки (заготовки) из сплава марок М1, М2 или М3. Они отличаются в основном долей примесей. Соответственно, часть чистой меди в их структуре занимает не менее 99,9%(М1), 99,7%(М2) либо 99,5%(М3).
Соответственно, часть чистой меди в их структуре занимает не менее 99,9%(М1), 99,7%(М2) либо 99,5%(М3).
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции. Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами.
Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой. Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара.
Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран. Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло.
Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло.
Благодаря этому свойству она успешно используется в составе следующих систем:
- тепловые трубки;
- кулеры, использующиеся для охлаждения элементов персональных компьютеров;
- системы отопления и охлаждения воздуха;
- системы, обеспечивающие перераспределение тепла в различных устройствах (теплообменники).
Металлические конструкции, в которых использованы медные элементы, отличаются не только небольшим весом, но и исключительной декоративностью. Именно это послужило причиной их активного использования в архитектуре, а также для создания различных интерьерных элементов.
Медь самородная формула свойства
Синонимы: Купрокупритом были названы тонкие смеси самородной меди и куприта (Вернадский, 1910). Витнеит—whitneyite (Гент, 1859) и дарвинит (Форбс, 1860) — мышьяковистая медь, образующая смеси с альгодонитом.
Группа
Происхождение названия
Латинское наименование меди cuprum происходит от названия острова Кипр, откуда в древности ввозили медь. Происхождение русского названия неясно.
Происхождение русского названия неясно.
Английское название минерала Медь — Copper
Медный самородок
Формула
Cu
Химический состав
Содержит иногда примеси Fe, Ag, Pb, Au, Hg, Bi, Sb, V, Ge3 (серебристая медь с 3—4% Ag, железистая—2,5% Fe и золотистая—2—3% Au). Примеси наблюдаются чаще в первичной самородной меди; вторичная медь обычно более чистая. Состав самородной меди из Шамлугского месторождения (Армения): Cu — 97,20 —97,46%, Fe — 0,25%; в меди из месторождений Алтая определено 98,3% Cu и более.
Кристаллографическая характеристика
Сингония. Кубическая.
Класс. Гексоктаэдрический.
Кристаллическая структура
Для кристаллической структуры характерна гранецентрированная решетка; по углам и в центрах граней элементарного куба расположены атомы меди. Это формальное выражение того, что в структуре меди имеется плотнейшая упаковка (так называемая кубическая плотнейшая упаковка) из атомов металла с радиусом 1,27 А и расстоянием между ближайшими атомами 2,54 А при выполнении пространства в 74,05%. Каждый атом Cu окружен 12 ему подобными (координационное число 12), располагающимися вокруг него по вершинам так называемого Архимедова кубооктаэдра.
Каждый атом Cu окружен 12 ему подобными (координационное число 12), располагающимися вокруг него по вершинам так называемого Архимедова кубооктаэдра.
Главные формы:а (100), d (110), о (111), l (530), е (210), h (410).
Форма нахождения в природе
Облик кристаллов. Облик кристаллов кубический, тетрагексаэдрический, додекаэдрический, реже — октаэдрический (возможно, псевдоморфозы по куприту). Грани часто шероховатые, с углублениями или возвышениями. Простые кристаллы редки.
Двойники.
Двойники срастания по (111) обычны, иногда полисинтетические, часто пластинчатые в направлении двойники оси или удлиненные паралелльны диагонали двойники плоскости. Обычно кристаллы (простые и двойники) неравномерно развиты: вытянуты, укорочены или деформированы. Характерны дендритовидные формы, представляющие собой однообразные срастания множества кристаллов (единообразно деформированных или правильных) по какому-либо одному направлению. Таковы, например, двойниковые по (111) кристаллы, вытянутые по оси симметрии 2-го порядка и сросшиеся параллельно граням ромбического додекаэдра) или срастания правильных двойниковых кристаллов, разветвляющиеся по направлению ребер и диагоналей октаэдрических граней, а также параллельные срастания кристаллов, вытянутых в направлении осей 4-го порядка. В сплошных выделениях самородной меди при травлении обнаруживаются признаки собирательной кристаллизации с развитием крупных зерен за счет более мелких зональных зерен неправильной формы.
Таковы, например, двойниковые по (111) кристаллы, вытянутые по оси симметрии 2-го порядка и сросшиеся параллельно граням ромбического додекаэдра) или срастания правильных двойниковых кристаллов, разветвляющиеся по направлению ребер и диагоналей октаэдрических граней, а также параллельные срастания кристаллов, вытянутых в направлении осей 4-го порядка. В сплошных выделениях самородной меди при травлении обнаруживаются признаки собирательной кристаллизации с развитием крупных зерен за счет более мелких зональных зерен неправильной формы.
Агрегаты. Искаженные кристаллы, в одиночных неправильных зернах, дендритовидные сростки, нитевидные, проволочные, моховидные образования, тонкие пластинки, конкреции, порошковатые скопления и сплошные массы весом до нескольких сотен тонн.
Дендриты
Физические свойства
Оптические
Цвет в свежем изломе светло-розовый, быстро переходящий в медно-красный, затем в коричневый; часто с желтой или пестрой побежалостью.
Черта медно-красная, блестящая.
Блеск металлический.
Отлив
Прозрачность. Непрозрачна. В тончайших пластинках просвечивает зеленым цветом.
Показатели преломления
Ng = , Nm = и Np =
Механические
Твердость 2,5-3.
Плотность 8,4—8,9
Спайность не наблюдается.
Излом занозистый, крючковатый.
Химические свойства
Легко растворяется в разбавленной HNO3 и в царской водке, в h3SO4— при нагревании, в НСl — с трудом. В водном растворе аммиака растворяется, окрашивая его в синий цвет. В полированных шлифах травится всеми основными реактивами. Внутреннее строение легко выявляется с помощью Nh5OH + Н2O2 или НСl+ CrO3 (50%-ный раствор).
Прочие свойства
Очень ковка и тягуча. Электропроводность очень высокая; существенно понижается от примесей.
Поведение при нагревании. Чистая медь плавится при 1083°. Теплопроводность несколько меньше, чем у серебра.
Искусственное получение минерала.

Может быть легко получена из расплавов или путем электролиза из растворов солей меди.
Структурные и каталитические свойства наноматериалов из силиката меди
Abstract
Наноразмерные силикаты меди с тремя различными структурными морфологиями (аморфная, нанотрубчатая и MEL) были получены с использованием различных методов синтеза. Физико-химические свойства силикатов меди были охарактеризованы методами XRD, FT-IR, SEM, HRTEM, N 2 -физисорбции, XPS и H 2 -TPR. Результаты показали, что условия приготовления влияют на восстановительные свойства и текстурные свойства наноразмерных силикатов меди. Методом гидротермального синтеза получен хризоколлоподобный CuSiO 3 нанотрубок, которые обладают большой площадью поверхности и объемом пор и легко восстанавливаются. Каталитические характеристики синтезированных наноструктур силиката меди были оценены в реакции дегидрирования метанола. Установлено, что активность дегидрирования зависит от структурных свойств силикатов меди. Наибольшую активность проявляют силикаты меди с морфологией нанотрубок. Каталитическая дегидрирующая активность силикатов меди также была связана с присутствием большего количества частиц Cu-O-Si, легкой восстановимостью и кислотными центрами Льюиса. CuSiO 9Образец нанотрубок 0005 3 также продемонстрировал хорошую стабильность в исследованных условиях реакции, дезактивация не была обнаружена в течение 48 часов.
Наибольшую активность проявляют силикаты меди с морфологией нанотрубок. Каталитическая дегидрирующая активность силикатов меди также была связана с присутствием большего количества частиц Cu-O-Si, легкой восстановимостью и кислотными центрами Льюиса. CuSiO 9Образец нанотрубок 0005 3 также продемонстрировал хорошую стабильность в исследованных условиях реакции, дезактивация не была обнаружена в течение 48 часов.
Введение
Дегидрирование метанола (CH 3 OH) является важной пробной реакцией, которую часто используют для исследования химического состава и характеристик поверхности катализаторов 1 . Реакция может протекать несколькими путями, приводя либо к образованию метилформиата (HCOOCH 3 ) и формальдегида (HCHO) или разложение CH 3 OH на CO x и H 2 . Интерес к последнему процессу связан с заметным прогрессом в исследованиях топливных элементов H 2 , которые имели место в последние десятилетия 2 . Крупномасштабное производство HCHO продолжается в связи с тем, что он широко используется в производстве пластмасс и смол 3 . Метилформиат также является высокореакционноспособным соединением из-за одновременного существования сложноэфирной группы и подвижного атома водорода альдегидной группы; это делает метилформиат перспективным промежуточным продуктом для промышленности органического синтеза 4 . Дегидрирование метанола до HCOOCH 3 можно проводить как в отсутствие кислорода (дегидрирование), так и в присутствии кислорода (окисление).
Крупномасштабное производство HCHO продолжается в связи с тем, что он широко используется в производстве пластмасс и смол 3 . Метилформиат также является высокореакционноспособным соединением из-за одновременного существования сложноэфирной группы и подвижного атома водорода альдегидной группы; это делает метилформиат перспективным промежуточным продуктом для промышленности органического синтеза 4 . Дегидрирование метанола до HCOOCH 3 можно проводить как в отсутствие кислорода (дегидрирование), так и в присутствии кислорода (окисление).
Прямое дегидрирование является промышленно предпочтительным процессом, поскольку оно дает газообразный водород и метилформиат. Однако получаемый выход составляет не более 40%, поскольку равновесная конверсия контролируется термодинамически. Среди катализаторов, исследованных для прямого дегидрирования, многие катализаторы обычно содержат медь в качестве активного металлического компонента 5 . В литературе существует множество отчетов об исследованиях, касающихся разработки стабильных гетерогенных катализаторов дегидрирования спирта с упором на нанесенный на металл SiO 2 , Al 2 O 3 и цеолиты 6 . Катализаторы на медном носителе показали впечатляющие результаты при дегидрировании метанола. Установлено, что эффективность медных катализаторов зависит от условий синтеза катализатора и физико-химических свойств, таких как размер частиц меди и удельная поверхность катализатора 9.0019 7 .
Катализаторы на медном носителе показали впечатляющие результаты при дегидрировании метанола. Установлено, что эффективность медных катализаторов зависит от условий синтеза катализатора и физико-химических свойств, таких как размер частиц меди и удельная поверхность катализатора 9.0019 7 .
Было обнаружено, что метанол селективно дегидрируется в метилформиат на глинистых катализаторах Cu/лапонит и Cu/Na(Mg 2,5 Si 4 O 10 F 2 ), в отличие от дегидратации метанола до диметилового эфира. преобладающая реакция над катализаторами Cu/сапонит и Cu/монтмориллонит 8 . Сообщалось также, что межслоевые ионы меди сохраняют начальную степень окисления даже в восстановительных условиях реакции9 . Низкая активность глинистых катализаторов, нанесенных на медь, связана с недоступностью меди для молекул метанола из-за ее расположения в межслоевом пространстве глины 10 . В литературе указано, что предварительная восстановительная обработка медных катализаторов (для превращения окисленной меди в частицы металла Cu) необходима для получения более высоких выходов метилформиата 11 . Напротив, некоторые авторы сообщают, что не только металлическая медь (Cu°), но и окисленные частицы меди (Cu 2+ и Cu + ) также способствует образованию метилформиата при дегидрировании метанола 12 . Таким образом, степень окисления Cu, которая отвечает за каталитическую эффективность в дегидрировании метанола, все еще остается дискуссионной.
Напротив, некоторые авторы сообщают, что не только металлическая медь (Cu°), но и окисленные частицы меди (Cu 2+ и Cu + ) также способствует образованию метилформиата при дегидрировании метанола 12 . Таким образом, степень окисления Cu, которая отвечает за каталитическую эффективность в дегидрировании метанола, все еще остается дискуссионной.
Силикаты металлов обычно существуют в различных формах, таких как цепи, листы, кольца и различные каркасные структуры 13,14,15,16 . Было обнаружено, что основной структурной единицей силикатов металлов является тетраэдрическая анионная группа с четырьмя отрицательными зарядами, которые связаны друг с другом 14 . Благодаря своим уникальным структурным и физико-химическим свойствам силикаты металлов использовались во многих областях, таких как катализ, разделение газов и т. д. 15,16,17 . Для удовлетворения промышленных требований катализаторы должны иметь большую и термически стабильную активную поверхность. Таким образом, наша цель состоит в том, чтобы разработать пористые наноструктурированные катализаторы из силиката меди и исследовать их перспективное применение в дегидрировании метанола. В последнее время нанокомпозиты CuO-SiO 2 широко изучались в связи с тем, что SiO 2 проявляет высокую термическую стабильность и не влияет на физическую природу CuO или природу любого другого оксида металла при использовании в качестве носителя 18 . Для исследования роли структурно-текстурных свойств наноматериалов из силикатов меди в селективности по отношению к метилформиату были синтезированы три различных наноструктурных силиката меди с различной структурой (аморфная, MEL-структура и нанотрубка). Была предпринята тщательная структурно-текстурная характеристика катализаторов для определения природы, а также роли активных центров, ответственных за дегидрирование метанола.
Таким образом, наша цель состоит в том, чтобы разработать пористые наноструктурированные катализаторы из силиката меди и исследовать их перспективное применение в дегидрировании метанола. В последнее время нанокомпозиты CuO-SiO 2 широко изучались в связи с тем, что SiO 2 проявляет высокую термическую стабильность и не влияет на физическую природу CuO или природу любого другого оксида металла при использовании в качестве носителя 18 . Для исследования роли структурно-текстурных свойств наноматериалов из силикатов меди в селективности по отношению к метилформиату были синтезированы три различных наноструктурных силиката меди с различной структурой (аморфная, MEL-структура и нанотрубка). Была предпринята тщательная структурно-текстурная характеристика катализаторов для определения природы, а также роли активных центров, ответственных за дегидрирование метанола.
Экспериментальная часть
Материалы
Все реагенты, использованные в этой работе, были получены от Aldrich, Великобритания. Они использовались в том виде, в каком они были получены.
Они использовались в том виде, в каком они были получены.
Синтез наноматериалов из силиката меди (CuSil)
Аморфный CuSil [CuSil-AMOR]
Золь-гель метод был адаптирован для синтеза CuSil-AMOR образца 19 . Рассчитанные количества тетраэтилортосиликата и тригидрата нитрата меди растворяли в этаноле и воде (соотношение 1:1) в круглодонной колбе и нагревали содержимое до 50 °С после добавления известного количества щавелевой кислоты. Перемешивание продолжали при продолжающемся нагревании для удаления растворителя из прозрачного раствора и позволяли образовать гель. Полученный гель сушили в обычной электрической печи при 120 °С в течение 12 часов. Собранный образец затем измельчали в порошок и прокаливали в муфельной печи в токе воздуха при 500 °С в течение 5 часов.
Нанотрубки CuSil [CuSil-NT]
Образец CuSil-NT был синтезирован с использованием гидротермального метода, описанного в литературе 20 . Известное количество тригидрата нитрата меди (0,5 г) растворяли в 5 мл смешанного растворителя (дистиллированный H 2 O и этанол в соотношении 1:4). К этому добавляли 5 мл 0,5 М раствора силиката натрия с получением светло-голубого осадка, выливали в сосуд высокого давления из нержавеющей стали с тефлоновым покрытием и содержимое подвергали гидротермической обработке при 200 °С в течение 48 часов. После охлаждения сосуда содержимое фильтровали и промывали дистиллированной H 2 О и этанол. Наконец, материал сушили при 100°С в течение 2 часов, а затем прокаливали при 500°С в течение 5 часов.
К этому добавляли 5 мл 0,5 М раствора силиката натрия с получением светло-голубого осадка, выливали в сосуд высокого давления из нержавеющей стали с тефлоновым покрытием и содержимое подвергали гидротермической обработке при 200 °С в течение 48 часов. После охлаждения сосуда содержимое фильтровали и промывали дистиллированной H 2 О и этанол. Наконец, материал сушили при 100°С в течение 2 часов, а затем прокаливали при 500°С в течение 5 часов.
MEL структурированный CuSil [CuSil-MEL]
Синтез материала CuSil-MEL осуществлялся гидротермальным методом 21 . Обычно стехиометрические количества (1 CuO: 90 SiO 2 : 9 TBA 2 O: 6,5 Na 2 O: 1055 H 2 O) нитрата меди, тетраэтилортосиликата и гидроксида натрия смешивали в смеси этанол-вода. растворителя и перемешивали в течение 30 мин. К этому раствору при постоянном перемешивании добавляли расчетное количество гидроксида тетрабутиламмония (ТВАОН). Температуру смеси доводили до 0 °С, помещая колбу на баню со льдом (выдерживали 1 ч), а затем колбу переносили на баню с горячей водой для поддержания температуры колбы на уровне 50°С в течение 3 больше часов для получения геля. Полученный гель запаивали в сосуд высокого давления из нержавеющей стали с тефлоновым покрытием и подвергали термической обработке при 180 °С в течение 7 дней. После гидротермальной обработки автоклав гасили холодной водой, образовавшийся продукт отделяли центрифугированием и промывали дистиллированной водой. Промытый материал сушили при 100°С в течение 12 ч, а затем прокаливали при 500°С в течение 5 ч в токе воздуха.
Полученный гель запаивали в сосуд высокого давления из нержавеющей стали с тефлоновым покрытием и подвергали термической обработке при 180 °С в течение 7 дней. После гидротермальной обработки автоклав гасили холодной водой, образовавшийся продукт отделяли центрифугированием и промывали дистиллированной водой. Промытый материал сушили при 100°С в течение 12 ч, а затем прокаливали при 500°С в течение 5 ч в токе воздуха.
Характеристика синтезированных наноматериалов CuSil
Элементный состав синтезированных материалов определяли с использованием ИСП-АЭС, прибор Optima 7300DV (Perkin-Elmer). Измерения порошковой рентгеновской дифракции материалов CuSil проводились с использованием дифрактометра Bruker D8 с усовершенствованной мишенью с излучением Cu Kα (λ = 1,5405 Å). Обнаружение кристаллических фаз, присутствующих в приготовленных материалах, осуществлялось путем сравнения рентгенограмм с файлами JCPDS. Спектры FT-IR свежих и адсорбированных пиридином материалов CuSil были получены с использованием спектрометра Bruker D70. Сканирующие электронные микроскопические изображения образцов были получены на приборе JEOL JSM840A. Образец порошка прикрепляли к алюминиевому блоку с помощью двустороннего углеродного скотча и получали изображения при различном увеличении. ПЭМ-изображения синтезированных материалов были получены с использованием просвечивающего электронного микроскопа JEOL 2010, 200 kV. Изотермы адсорбции-десорбции азота для всех материалов были получены с использованием автоматизированной газосорбционной установки NOVA 3200e (Quantachrome, США). Удельная поверхность (S BET ) материалов определяли по уравнению Брунауэра-Эммета-Теллера (BET). Картины распределения пор по размерам образцов были получены с использованием метода NLDFT. Данные рентгеновского фотоэлектронного спектра для всех образцов были получены с использованием прибора SPECS GmbH XPS, как описано в нашей предыдущей публикации 22 . Измерения водородно-температурного программного восстановления (H 2 -TPR) проводили с использованием прибора Quantachrome CHEMBET 3000, оснащенного детектором теплопроводности.
Сканирующие электронные микроскопические изображения образцов были получены на приборе JEOL JSM840A. Образец порошка прикрепляли к алюминиевому блоку с помощью двустороннего углеродного скотча и получали изображения при различном увеличении. ПЭМ-изображения синтезированных материалов были получены с использованием просвечивающего электронного микроскопа JEOL 2010, 200 kV. Изотермы адсорбции-десорбции азота для всех материалов были получены с использованием автоматизированной газосорбционной установки NOVA 3200e (Quantachrome, США). Удельная поверхность (S BET ) материалов определяли по уравнению Брунауэра-Эммета-Теллера (BET). Картины распределения пор по размерам образцов были получены с использованием метода NLDFT. Данные рентгеновского фотоэлектронного спектра для всех образцов были получены с использованием прибора SPECS GmbH XPS, как описано в нашей предыдущей публикации 22 . Измерения водородно-температурного программного восстановления (H 2 -TPR) проводили с использованием прибора Quantachrome CHEMBET 3000, оснащенного детектором теплопроводности.
Каталитическое дегидрирование метанола (CH
3 OH)
Каталитическую активность синтезированных образцов CuSil для бескислородного парофазного дегидрирования CH 3 OH определяли с использованием микрореактора с неподвижным слоем. В качестве реакционной смеси использовали газообразный гелий, насыщенный парами метанола до 10 об. %. Скорость подачи реакционной смеси составляла 15 л ч -1 . Катализатор загружали в реактор в объеме 2 см 3 . Время контакта реакционной смеси с катализатором составляло 0,4 с. Каталитические опыты проводили в интервале температур 250–500 °С. Катализатор выдерживали в течение 30 мин при каждой температуре для достижения стационарного состояния. Анализ состава реакционной смеси на входе и выходе из реактора проводили с помощью газовой хроматографии. Для разделения компонентов смеси использовали хроматографическую колонку типа Porapak T. Для определения стабильности образцов температуру реактора повышали до температуры реакции (температуры максимального выхода целевого продукта на данном катализаторе) в течение 2 ч. Время испытаний образцов при установившейся температуре составило 48 ч.
Время испытаний образцов при установившейся температуре составило 48 ч.
Результаты и обсуждение
Рентгенограммы прокаленных образцов CuSil представлены на рис. 1. Рентгенограмма образца CuSil-NT показывает широкие дифракционные пики, которые согласуются с рентгенограммой фазы гидрата силиката меди [CuSiO 3 ·xH 2 O, JCPDS № 00–003–1152]. Рентгенограмма образца CuSil-AMOR показывает широкое отражение с центром при 2θ = 22°, аналогичное аморфному кремнезему, показывая, что этот образец обладает структурой аморфного силиката меди. Напротив, CuSil-MEL является высококристаллическим и демонстрирует характерные отражения из-за наличия структуры MEL 9.0019 23 . Никаких дополнительных дифракционных пиков из-за оксидов меди в трех образцах не наблюдалось, что указывает на эффективность принятых методов синтеза для получения чистых наноразмерных материалов из силиката меди.
Рисунок 1
Рентгенограммы прокаленных образцов CuSil.
Изображение полного размера
В ИК-Фурье-спектре образца CuSil-NT (рис. 2) присутствуют две полосы при 3620 см −1 и 673 см −1 , которые можно отнести к колебаниям растяжения и изгиба. гидроксильных групп, присоединенных к атомам меди. Две полосы появились при 3450 см −1 и 1630 см −1 можно отнести к валентным и деформационным колебаниям адсорбированных молекул воды. Резкая полоса, наблюдаемая при 500 см -1 , обусловлена деформационными колебаниями Cu-O-Si, а наиболее интенсивная полоса при 1035 см -1 может быть приписана валентным колебаниям Si-O силикатных тетраэдров 24 . Остальные две полосы при 825 см −1 и 775 см −1 можно отнести к валентным колебаниям силикатных цепочек 24 . В спектре ИК-Фурье образца CuSil-MEL обнаружены полосы поглощения при 460, 550 и 790 см -1 , что может быть связано с наличием структуры MEL в синтезированном образце 25 . Полоса -1 при 460 см может быть отнесена к деформационным колебаниям связей O-Si-O, а полосы при 550 и 790 см -1 обусловлены симметричными валентными колебаниями тетраэдрической связи и колебаниями двойного кольца соответственно 26 .
Полоса -1 при 460 см может быть отнесена к деформационным колебаниям связей O-Si-O, а полосы при 550 и 790 см -1 обусловлены симметричными валентными колебаниями тетраэдрической связи и колебаниями двойного кольца соответственно 26 .
Рисунок 2
FTIR-спектры прокаленных образцов CuSil.
Изображение полного размера
Полоса, появившаяся на 1650 см −1 , обусловлена деформационными колебаниями H-OH молекул H 2 O, связанных со структурой MEL. В спектре FT-IR образца Cu-MEL также была обнаружена полоса при 3550 см -1 , которая обусловлена валентными колебаниями физически адсорбированных молекул H 2 O в структуре MEL. В спектре FT-IR образца CuSil-AMOR обнаружена полоса δ (-OH) при 670 см −1 и плечо от ν (Si-O) на 1042 см −1 , а также асимметричное валентное колебание Si-O от SiO 2 на 1100 см −1 7 920 2. Важно отметить, что характерное поглощение около 630 см −1 для CuO наблюдалось не во всех образцах, что свидетельствует об отсутствии частиц CuO в синтезированных образцах 28 .
Важно отметить, что характерное поглощение около 630 см −1 для CuO наблюдалось не во всех образцах, что свидетельствует об отсутствии частиц CuO в синтезированных образцах 28 .
СЭМ- и ТЭМ-изображения синтезированных образцов CuSil показаны на рис. 3. СЭМ-микрофотографии показывают, что три образца содержали кристаллиты с разным типом морфологии. Морфология образцов различна из-за того, что для синтеза образцов применялись три разные процедуры подготовки. Размер частиц можно точно рассчитать с помощью ПЭМ-анализа. Образец CuSil-AMOR содержал сферические и червеобразные частицы размером от 15 до 25 нм. На рисунке 3 показано, что образец CuSil-MEL состоит в основном из сферических частиц диаметром 25 нм, и некоторые частицы в этом образце были агрегированы в виде сфероидов, упакованных вместе случайным образом. Образец CuSil-NT состоит из большого количества накопленных нанотрубок, как показано на рис. 3. Большинство нанотрубок расположены горизонтально на поверхности образца, а диаметр всех нанотрубок имеет узкое распределение по размерам. Репрезентативное ПЭМ-изображение образца CuSil-NT показано на рисунке, на котором диаметр и длина составляют около 20 нм и 300 нм соответственно.
Репрезентативное ПЭМ-изображение образца CuSil-NT показано на рисунке, на котором диаметр и длина составляют около 20 нм и 300 нм соответственно.
Рисунок 3
СЭМ и ПЭМ изображения прокаленных образцов CuSil.
Изображение с полным размером
Изотермы адсорбции-десорбции N 2 и картины распределения пор по размерам (на вставке) прокаленных образцов CuSil представлены на рис. 4. Синтезированные материалы CuSil проявляют изотермы IV типа с h3- типа петель гистерезиса, что свидетельствует о том, что материалы обладают мезопористой структурой 29 . Небольшой наклон изотерм адсорбции-десорбции при низких относительных давлениях показывает, что эти образцы обладают относительно небольшим количеством пор микроразмера, за исключением того, что наклон относительно выше в случае образца CuSil-AMOR, что также четко наблюдается при размере пор BJH. закономерности распределения образцов. Основные текстурные характеристики синтезированных материалов представлены в таблице 1.
Рисунок 4
N 2 Изотермы адсорбции-десорбции и модели распределения пор по размерам (вставка) образцов CuSil.
Таблица 1 Текстурные свойства образцов CuSil.
Полноразмерная таблица
Образец CuSil-NT имел площадь поверхности по БЭТ и объем пор 365 м 2 г -1 и 0,592 см 3 г -1 соответственно. Этот образец продемонстрировал узкое распределение пор по размерам с центром в 3,2 нм, что ниже, чем у двух других образцов. Образец CuSil-MEL продемонстрировал большой объем пор, около 2,523 см 9 .0019 -3 г -1 и высокой удельной поверхностью 552 м 2 г -1 в основном из-за того, что этот образец обладал внутрикристаллическими мезопорами, что обуславливало высокую пористость.
Анализ XPS был выполнен для понимания электронного состояния элементов Cu, Si и O в термически обработанных образцах CuSil. Рентгеновские фотоэлектронные спектры материалов после деконволюции показаны на рис. 5. Ранее указывалось, что энергия связи (BE) для Cu 2p 3/2 уровень фотоэлектронного ядра в Cu + и Cu 2+ составляет 932,4 эВ и 933,5 эВ соответственно 30 . Также сообщалось, что материалы, которые содержали частицы Cu 2+ , демонстрируют сильные сателлитные XP-пики с BE на 6–10 эВ выше пиков основного уровня ядра, и эти сателлитные пики не появляются в материалах, содержащих Cu + разновидностей . 31 . Три образца CuSil продемонстрировали два XP-пика, соответствующие соединениям Cu; первый пик с Cu 2p 3/2 BE 933,2 эВ и второй на 935,4 эВ. Пик при 933,2 эВ соответствует частицам Cu 2+ . Пик при 935,4 эВ можно отнести к разновидностям Cu в сетке Cu-O-Si. Моссер и др. . 32 также наблюдал BE 935 эВ для частиц Cu в природных и синтетических минералах силиката меди.
Рентгеновские фотоэлектронные спектры материалов после деконволюции показаны на рис. 5. Ранее указывалось, что энергия связи (BE) для Cu 2p 3/2 уровень фотоэлектронного ядра в Cu + и Cu 2+ составляет 932,4 эВ и 933,5 эВ соответственно 30 . Также сообщалось, что материалы, которые содержали частицы Cu 2+ , демонстрируют сильные сателлитные XP-пики с BE на 6–10 эВ выше пиков основного уровня ядра, и эти сателлитные пики не появляются в материалах, содержащих Cu + разновидностей . 31 . Три образца CuSil продемонстрировали два XP-пика, соответствующие соединениям Cu; первый пик с Cu 2p 3/2 BE 933,2 эВ и второй на 935,4 эВ. Пик при 933,2 эВ соответствует частицам Cu 2+ . Пик при 935,4 эВ можно отнести к разновидностям Cu в сетке Cu-O-Si. Моссер и др. . 32 также наблюдал BE 935 эВ для частиц Cu в природных и синтетических минералах силиката меди. Был проведен количественный анализ частиц, соответствующих различным поверхностным частицам, и полученные результаты сведены в таблицу 2. Очевидно, что образцы CuSil-MEL и CuSil-NT содержали больше поверхностных частиц Cu-O-Si, чем образец CuSil-AMOR.
Был проведен количественный анализ частиц, соответствующих различным поверхностным частицам, и полученные результаты сведены в таблицу 2. Очевидно, что образцы CuSil-MEL и CuSil-NT содержали больше поверхностных частиц Cu-O-Si, чем образец CuSil-AMOR.
Рисунок 5
XP-спектры образцов CuSil после деконволюции.
Изображение полного размера
Таблица 2 Объемный и поверхностный элементный состав и кислотность образцов CuSil.
Полный размер таблицы
Наблюдаемые XP-спектры O 1s в образцах CuSil являются широкими, а деконволюция пиков дает два разных типа частиц O 1s с BE в диапазоне 529,8–530,7 эВ и 531,5– 532 эВ. Пик O 1s появился в диапазоне 5290,8–530,7 эВ может быть отнесено к кислороду в разновидностях Cu-Si-O, а пик в диапазоне 531,5–532 эВ согласуется с кислородом на уровне ядра в оксидах Cu и Si 33 . Пики Si 2p для трех образцов CuSil также включены в рисунок. Наблюдаемая энергия связи 102,9 эВ для Si 2p в образцах CuSil-NT и CuSil-MEL предполагает, что поверхностные частицы Si находятся в силикатной структуре, поскольку BE выше для SiO 2 (103,5 эВ) 34 . Однако образец CuSil-AMOR четко демонстрировал Si 2p пик при 103,5 эВ, соответствующий силикатным частицам, наблюдаемый сдвиг в энергии связи может быть связан с присутствием большего количества поверхностных частиц SiO 2 в этом образце.
Наблюдаемая энергия связи 102,9 эВ для Si 2p в образцах CuSil-NT и CuSil-MEL предполагает, что поверхностные частицы Si находятся в силикатной структуре, поскольку BE выше для SiO 2 (103,5 эВ) 34 . Однако образец CuSil-AMOR четко демонстрировал Si 2p пик при 103,5 эВ, соответствующий силикатным частицам, наблюдаемый сдвиг в энергии связи может быть связан с присутствием большего количества поверхностных частиц SiO 2 в этом образце.
Кислотные свойства образцов CuSil исследованы с помощью спектров FT-IR после адсорбции пиридина. ИК-спектры материалов CuSil, адсорбированных пиридином, представлены на рис. 6. Сообщалось, что две полосы при 1450 см -1 и 1610 см -1 , соответствующие молекулам пиридина, взаимодействовали с кислотными центрами Льюиса (L) и полосы 1545 см -1 и 1635 см -1 можно отнести к пиридину, взаимодействующему с бренстедовскими (B) кислотными центрами 35 . Полосы около 1490 см -1 представляют молекулы пиридина, связанные как с кислотными центрами L, так и с B 36 . Синтезированные образцы CuSil демонстрировали полосы, связанные как с кислотными центрами Льюиса, так и с кислотными центрами Бренстеда, и количественную оценку количества кислотных центров Льюиса и Бренстеда проводили с использованием описанной процедуры 37 . Результаты представлены в таблице 2. Видно, что образец CuSil-NT обладает более высоким количеством кислотных центров Льюиса и Бренстеда, чем два других образца CuSil. В основном это связано с тем, что материал CuSil-NT обладает большим количеством поверхностных силанольных групп и Cu 2+ видов, чем два других образца, которые связаны с кислотными центрами Бренстеда и Льюиса 38 .
Полосы около 1490 см -1 представляют молекулы пиридина, связанные как с кислотными центрами L, так и с B 36 . Синтезированные образцы CuSil демонстрировали полосы, связанные как с кислотными центрами Льюиса, так и с кислотными центрами Бренстеда, и количественную оценку количества кислотных центров Льюиса и Бренстеда проводили с использованием описанной процедуры 37 . Результаты представлены в таблице 2. Видно, что образец CuSil-NT обладает более высоким количеством кислотных центров Льюиса и Бренстеда, чем два других образца CuSil. В основном это связано с тем, что материал CuSil-NT обладает большим количеством поверхностных силанольных групп и Cu 2+ видов, чем два других образца, которые связаны с кислотными центрами Бренстеда и Льюиса 38 .
Рисунок 6
FTIR-спектры образцов CuSil после адсорбции пиридина.
Полноразмерное изображение
Картины H 2 -температурно-программируемого восстановления (H 2 -TPR) для трех прокаленных материалов CuSil представлены на рис.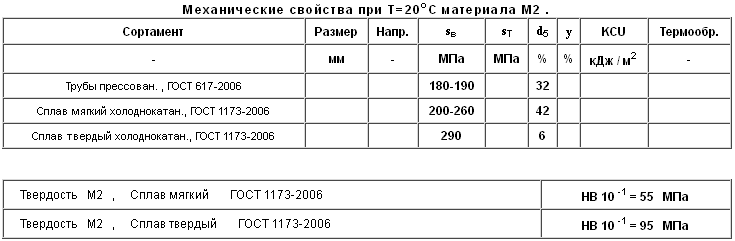 7. Картины H 2 -TPR для указанных материалов что три образца CuSil имеют один главный пик восстановления, который может быть отнесен к восстановлению Cu 2+ видов до металлической меди (Cu°). Однако температура пика восстановления варьировалась от 240 до 320 °C, при этом оба образца CuSil-AMOR CuSil-NT имеют самую низкую температуру пика восстановления, тогда как образец CuSil-MEL имеет пик температуры восстановления около 320 °C. Это наблюдение указывает на то, что образцы CuSil-AMOR и CuSil-NT легче восстанавливаются, чем образец CuSil-MEL. Наблюдения по результатам ТПВ H 2 показывают, что структура силиката меди влияет на способность к восстановлению соединений Cu.
7. Картины H 2 -TPR для указанных материалов что три образца CuSil имеют один главный пик восстановления, который может быть отнесен к восстановлению Cu 2+ видов до металлической меди (Cu°). Однако температура пика восстановления варьировалась от 240 до 320 °C, при этом оба образца CuSil-AMOR CuSil-NT имеют самую низкую температуру пика восстановления, тогда как образец CuSil-MEL имеет пик температуры восстановления около 320 °C. Это наблюдение указывает на то, что образцы CuSil-AMOR и CuSil-NT легче восстанавливаются, чем образец CuSil-MEL. Наблюдения по результатам ТПВ H 2 показывают, что структура силиката меди влияет на способность к восстановлению соединений Cu.
Рисунок 7
H 2 — TPR образцы CuSil.
Увеличить
Каталитическое дегидрирование метанола
Все катализаторы прошли испытания на дегидрирование метанола; метилформиат и диметиловый эфир наблюдались в качестве основных продуктов реакции, а также наблюдалось небольшое количество метана в исследуемых условиях реакции.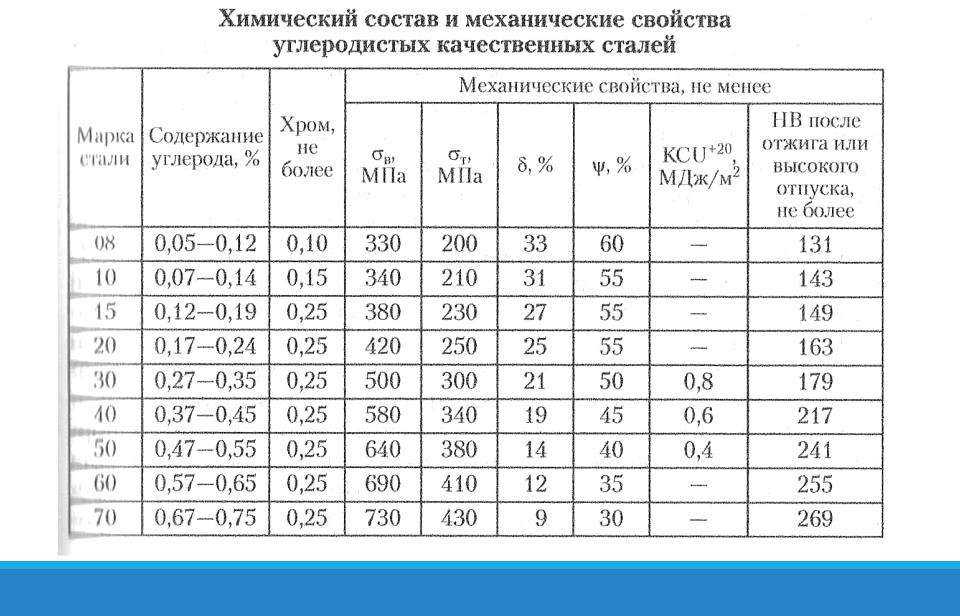 Все результаты, представленные в данной работе, были получены в стационарных условиях. Первоначально было изучено влияние температуры реакции на конверсию метанола и селективность по метилформиату на катализаторах CuSil (таблица 3) при GHSV 250 ч −1 . Необработанные образцы SiO 2 и CuO также тестировали для сравнения их каталитической активности с образцами CuSil. Было замечено, что чистые образцы SiO 2 и CuO проявляли низкую активность. Можно заметить, что SiO 2 и CuO высокоселективны по отношению к метилформиату, но конверсия метанола очень низкая, так как выходы не превышают 4%. Следовательно, активность катализатора просто связана с образованием структур силиката меди. Синтезированные образцы CuSil активны и селективны в отношении образования метилформиата.
Все результаты, представленные в данной работе, были получены в стационарных условиях. Первоначально было изучено влияние температуры реакции на конверсию метанола и селективность по метилформиату на катализаторах CuSil (таблица 3) при GHSV 250 ч −1 . Необработанные образцы SiO 2 и CuO также тестировали для сравнения их каталитической активности с образцами CuSil. Было замечено, что чистые образцы SiO 2 и CuO проявляли низкую активность. Можно заметить, что SiO 2 и CuO высокоселективны по отношению к метилформиату, но конверсия метанола очень низкая, так как выходы не превышают 4%. Следовательно, активность катализатора просто связана с образованием структур силиката меди. Синтезированные образцы CuSil активны и селективны в отношении образования метилформиата.
Таблица 3 Каталитическое дегидрирование метанола на исследованных образцах.
Полноразмерная таблица
Образец CuSil-NT показал более высокую активность по сравнению с образцами CuSil-MEL и CuSil-AMOR. Хотя конверсия метанола повышалась с повышением температуры реакции в образцах CuSil, а селективность по метилформиату снижалась с повышением температуры реакции. Возможно, это связано с тем, что при более высоких температурах реакции на поверхности катализатора может происходить термическое разложение или декарбонилирование метилформиата, а также возможно некаталитическое термическое разложение метанола при очень высоких температурах реакции [реакции ( 2) до (4)] 39 .
Хотя конверсия метанола повышалась с повышением температуры реакции в образцах CuSil, а селективность по метилформиату снижалась с повышением температуры реакции. Возможно, это связано с тем, что при более высоких температурах реакции на поверхности катализатора может происходить термическое разложение или декарбонилирование метилформиата, а также возможно некаталитическое термическое разложение метанола при очень высоких температурах реакции [реакции ( 2) до (4)] 39 .
На рис. 8 представлена температурная зависимость конверсии метанола и выхода метилформиата для образцов CuSil в широком диапазоне температур (250–500 °C). Все образцы были каталитически активны даже при низких температурах реакции (250 °С), а конверсия увеличивалась почти линейно с повышением температуры реакции. При низких температурах реакции (от 250 °С до 400 °С) наблюдались высокие уровни выхода метилформиата в основном за счет высокой селективности по продукту дегидрирования метилформиату. В результате повышения температуры (450 °С и 500 °С) происходит интенсификация реакций (2)–(4), что приводит к значительному падению выхода метилформиата. Наибольший выход метилформиата (57% при 400 °С) получен для образца CuSil-NT. Полученные результаты ясно указывают на необходимость присутствия активных центров меди, поскольку чистые оксиды не проявляют активности, а высокие температуры реакции отрицательно влияют на селективность и выход метилформиата.
Наибольший выход метилформиата (57% при 400 °С) получен для образца CuSil-NT. Полученные результаты ясно указывают на необходимость присутствия активных центров меди, поскольку чистые оксиды не проявляют активности, а высокие температуры реакции отрицательно влияют на селективность и выход метилформиата.
$$2{{\rm{CH}}}_{3}{\rm{OH}}\leftrightarrow {{\rm{HCOOCH}}}_{3}+{{\rm{H}}}_ {2}$$
(1)
$${{\rm{HCOOCH}}}_{3}\leftrightarrow 2{\rm{CO}}+2{{\rm{H}}}_{ 2}$$
(2)
$${{\rm{HCOOCH}}}_{3}\leftrightarrow {\rm{CO}}+{{\rm{CH}}}_{3}{ \rm{OH}}$$
(3)
$${{\rm{HCOOCH}}}_{3}\leftrightarrow {{\rm{CO}}}_{2}+{{\rm {CH}}}_{4}$$
(4)
Рисунок 8
Температурная зависимость ( A ) конверсии метанола ( B ) выход метилформиата по сравнению с образцами CuSil (GHSV = 250 ч -1 ).
Увеличить
Также исследовано влияние объемной часовой скорости газа (GHSV) на активность каталитического дегидрирования метанола для синтезированных образцов CuSil. На рисунке 9 представлена конверсия метанола, селективность по метилформиату, наблюдаемая при различных значениях GHSV в случае катализатора CuSil-NT при 300 °C. Ясно, что катализатор обеспечивает высокую конверсию метанола и низкую селективность по метилформиату при низких значениях GHSV; вероятно, деградация метилформиата происходит на поверхности катализатора из-за большого времени пребывания. Однако в продуктах реакции метана не обнаружено, так как при разложении метилформиата [реакции (2) и (3)] образуются СО и Н 2 . На основании наблюдаемых результатов и с целью получения высоких выходов метилформиата для других каталитических испытаний была выбрана GHSV 250 ч -1 .
На рисунке 9 представлена конверсия метанола, селективность по метилформиату, наблюдаемая при различных значениях GHSV в случае катализатора CuSil-NT при 300 °C. Ясно, что катализатор обеспечивает высокую конверсию метанола и низкую селективность по метилформиату при низких значениях GHSV; вероятно, деградация метилформиата происходит на поверхности катализатора из-за большого времени пребывания. Однако в продуктах реакции метана не обнаружено, так как при разложении метилформиата [реакции (2) и (3)] образуются СО и Н 2 . На основании наблюдаемых результатов и с целью получения высоких выходов метилформиата для других каталитических испытаний была выбрана GHSV 250 ч -1 .
Рисунок 9
Влияние GHSV на дегидрирование метанола на образце CuSil-NT.
Увеличить
Исследование кинетики реакции проводили, предполагая, что реакции (1) и (2) протекают на катализаторе CuSil-NT при низкой температуре реакции. Константы скорости реакций (1) и (2) определяли из полученных данных об активности, таких как конверсия метанола, селективность и выход метилформиата. Оценка кинетических параметров проводилась по методике Шелеповой 9.0215 и др. . 40 . Энергию активации и предэкспоненциальный множитель для синтезированных катализаторов определяли при двух различных температурах реакции (250 и 300 °С). Средняя ошибка не превышала 5% для всех катализаторов (таблица 4). Константы скорости при 250 ° C и 300 ° C для образца Cusil-NT составляют 6,5 × 10 3 M -1 S -1 и 1,5 × 10 3 M -1 S −1 соответственно. Для этого катализатора наблюдаемый предэкспоненциальный множитель и энергия активации равны 9.1 × 10 7 M −1 с −1 и 34,4 кДж моль −1 для дегидрирования метанола. Однако эти значения составляют около 5,6 × 10 8 с –1 и 52,4 кДж моль –1 для разложения метилформиата. Было замечено, что константа скорости k 1 увеличивалась с увеличением температуры реакции в случае трех образцов CuSil.
Оценка кинетических параметров проводилась по методике Шелеповой 9.0215 и др. . 40 . Энергию активации и предэкспоненциальный множитель для синтезированных катализаторов определяли при двух различных температурах реакции (250 и 300 °С). Средняя ошибка не превышала 5% для всех катализаторов (таблица 4). Константы скорости при 250 ° C и 300 ° C для образца Cusil-NT составляют 6,5 × 10 3 M -1 S -1 и 1,5 × 10 3 M -1 S −1 соответственно. Для этого катализатора наблюдаемый предэкспоненциальный множитель и энергия активации равны 9.1 × 10 7 M −1 с −1 и 34,4 кДж моль −1 для дегидрирования метанола. Однако эти значения составляют около 5,6 × 10 8 с –1 и 52,4 кДж моль –1 для разложения метилформиата. Было замечено, что константа скорости k 1 увеличивалась с увеличением температуры реакции в случае трех образцов CuSil.
Таблица 4 Исследования кинетики реакции над образцами CuSil.
Полноразмерный стол
Ранее сообщалось, что при нанесении меди на слабокислотный или амфотерный носитель наблюдались самые высокие выходы метилформиата. С другой стороны, когда медь была нанесена на основной носитель, как селективность по метилформиату, так и конверсия метанола снижались 5 . Также было замечено, что размер кристаллов меди не оказывает существенного влияния на характеристики каталитического дегидрирования в медно-кремнеземных катализаторах 41 . Однако наблюдаемые результаты указывают на то, что кристаллическая структура и морфология силикатов меди играют важную роль в реакции дегидрирования метанола.
Также известно, что восстановленные частицы меди, но не Cu 2+ , являются активными частицами для дегидрирования метанола 42 . Химическое состояние меди в синтезированных образцах CuSil, определенное методом РФЭС, показало, что образец CuSil-NT обладает большим количеством поверхностных частиц Cu со степенью окисления ниже 2 + . В случае CuSil-MEL и CuSil-AMOR кажется, что частицы меди взаимодействуют с поверхностными гидроксильными группами (поскольку результаты ИК-Фурье-спектроскопии показали полосы низкой интенсивности, обусловленные группами -ОН), таким образом, достигается стабилизация меди при более высокой степени окисления. Для исследования долговечности медно-силикатного катализатора был выбран наиболее активный образец CuSil-NT. На рис. 10 показано поведение образца во время потоковой передачи. Катализатор сохранял свою первоначальную активность даже после 48 часов реакции, что свидетельствовало о стабильности образца CuSil-NT. Повышенная каталитическая дегидрирующая активность катализатора CuSil-NT может быть связана с тем, что CuSil-NT обладает большим количеством поверхностных кислотных центров Льюиса и взаимодействующих частиц [Cu-O-Si], которые легко восстанавливаются.
В случае CuSil-MEL и CuSil-AMOR кажется, что частицы меди взаимодействуют с поверхностными гидроксильными группами (поскольку результаты ИК-Фурье-спектроскопии показали полосы низкой интенсивности, обусловленные группами -ОН), таким образом, достигается стабилизация меди при более высокой степени окисления. Для исследования долговечности медно-силикатного катализатора был выбран наиболее активный образец CuSil-NT. На рис. 10 показано поведение образца во время потоковой передачи. Катализатор сохранял свою первоначальную активность даже после 48 часов реакции, что свидетельствовало о стабильности образца CuSil-NT. Повышенная каталитическая дегидрирующая активность катализатора CuSil-NT может быть связана с тем, что CuSil-NT обладает большим количеством поверхностных кислотных центров Льюиса и взаимодействующих частиц [Cu-O-Si], которые легко восстанавливаются.
Рисунок 10
Время работы катализатора CuSil-NT [GHSV = 250 ч -1 , температура: 400 °C].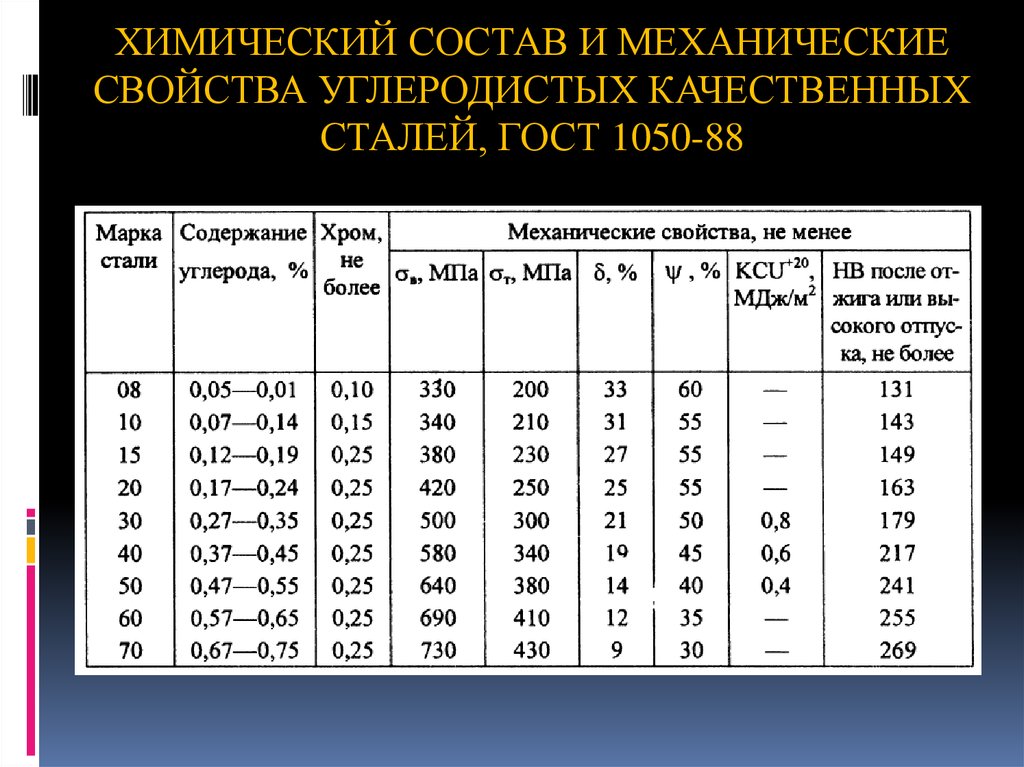
Увеличенное изображение
Выводы
Медно-силикатные материалы с аморфной, нанотрубчатой и MEL структурой были синтезированы путем адаптации различных методов синтеза. Тщательная характеристика синтезированных материалов была выполнена с использованием методов порошковой XRD, FT-IR, SEM, HRTEM, N 2 -физисорбции, XPS и H 2 -TPR. Синтезированный образец нанотрубок силиката меди обладал большой площадью поверхности, объемом пор и легкой восстановимостью по сравнению с двумя другими образцами. Каталитическую эффективность наноструктур силиката меди оценивали в процессе парофазного дегидрирования метанола. Установлено, что активность каталитического дегидрирования сильно зависит от структурных свойств силикатов меди. Повышенная каталитическая дегидрирующая активность катализатора CuSil-NT может быть связана с тем, что CuSil-NT обладает большим количеством поверхностных кислотных центров Льюиса и взаимодействующих частиц, которые легко восстанавливаются. Катализаторы на основе силиката меди также показали хорошую стабильность в условиях реакции без какой-либо значительной дезактивации катализатора.
Катализаторы на основе силиката меди также показали хорошую стабильность в условиях реакции без какой-либо значительной дезактивации катализатора.
Этика
В этой статье не представлены исследования с этическими соображениями.
Ссылки
Badlani, M. & Wachs, I. E. Метанол: «умная» молекула химического зонда. Катал. латыши. 75 , 137–149 (2001).
КАС
СтатьяGoogle ученый
Цзян Р. и др. . Дегидрирование метанола на Rh (111): исследование функционала плотности и микрокинетического моделирования. Дж. Мол. Катал. А: Хим. 344 , 99–110 (2011).
КАС
СтатьяGoogle ученый
Гейер Р., Джамбек Дж. Р. и Лоу К. Л. Производство, использование и судьба всех когда-либо произведенных пластмасс.
 науч. Доп. 3 , e1700782 (2017).
науч. Доп. 3 , e1700782 (2017).ОБЪЯВЛЕНИЯ
пабмед
ПабМед Центральный
Статья
КАСGoogle ученый
Су, С., Заза, П. и Ренкен, А. Каталитическое дегидрирование метанола до безводного формальдегида. Хим. англ. Технол. 17 , 34–40 (1994).
КАС
СтатьяGoogle ученый
Герреро-Руис, А., Родригес-Рамос, И. и Фиерро, Дж. Л. Г. Дегидрирование метанола в метилформиат на медных катализаторах на носителе. Заяв. Катал. 72 , 119–137 (1991).
КАС
СтатьяGoogle ученый
Мунник, П., де Йонг, П. Э. и де Йонг, К. П. Последние разработки в области синтеза катализаторов на носителе. Хим. Ред. 115 , 6687–6718 (2015).
КАС
пабмед
СтатьяGoogle ученый
«>Мацуда, Т., Його, К., Пантавонг, С. и Кикучи, Э. Каталитические свойства глин с медным обменом для дегидрирования метанола в метилформиат. Заяв. Катал. A: Ген. 126 , 177–186 (1995).
КАС
СтатьяGoogle ученый
Сасаки, К. и др. . Синтез наночастиц меди в межслоевом пространстве нанолистовых прозрачных пленок диоксида титана. Дж. Матер. хим. C 4 , 1476–1481 (2016).
КАС
СтатьяGoogle ученый
«>Guerreiro, E.D., Gorriz, O.F., Larsen, G. & Arrua, L.A. Катализаторы Cu/SiO 2 для дегидрирования метанола в метилформиат. Сравнительное исследование с использованием различных методов подготовки. Заявл. Катал. A: Ген. 204 , 33–48 (2000).
КАС
СтатьяGoogle ученый
Минюкова Т. П. и др. . Дегидрирование метанола на медьсодержащих катализаторах. Заяв. Катал. A: Ген. 237 , 171–180 (2002).
КАС
СтатьяGoogle ученый
Луазо, Т. и Ферей, Г. Кристаллические оксифторированные соединения с открытым каркасом: силикаты, фосфаты металлов, фториды металлов и металлоорганические каркасы (МОФ).
 J. Fluorine Chem. 128 , 413–422 (2007).
J. Fluorine Chem. 128 , 413–422 (2007).КАС
СтатьяGoogle ученый
Гуй, К.-Х. и др. . Сэндвич-силикат магния/восстановленный оксид графена нанокомпозит для усиленной адсорбции Pb 2+ и метиленового синего. Приложение ACS Матер. Интерфейсы 6 , 14653–14659 (2014 г.).
КАС
пабмед
СтатьяGoogle ученый
Хао, С.-М. и др. . Полые нанотрубки из силиката марганца с перестраиваемыми вторичными наноструктурами в качестве превосходных катализаторов типа Фентона для разложения красителей при температуре окружающей среды. Доп. Функц. Матер. 26 , 7334–7342 (2016).
КАС
СтатьяGoogle ученый
Хао, С.-М., Ю, М.-Ю., Чжан, Ю.-Дж., Абделькрим, Ю. и Ку, Дж.
 Иерархические мезопористые структуры силиката кобальта как высокоэффективные сульфатно-радикальные на основе передовых катализаторов окисления. Дж. Коллоид. интерф. науч. 545 , 128–137 (2019).
Иерархические мезопористые структуры силиката кобальта как высокоэффективные сульфатно-радикальные на основе передовых катализаторов окисления. Дж. Коллоид. интерф. науч. 545 , 128–137 (2019).ОБЪЯВЛЕНИЯ
КАС
СтатьяGoogle ученый
Чжу З.-С. и др. . Предварительное формирование обильных поверхностных гидроксильных групп кобальта на низкокристаллическом цветкообразном Co 3 (Si 2 O 5 ) 2 (OH) 2 для повышения характеристик каталитического разложения с критической нерадикальной реакцией. Заяв. Катал. Б: Окружающая среда. 261 , 118238 (2020).
Артикул
КАСGoogle ученый
Niu, X., Zhao, T., Yuan, F. & Zhu, Y. Получение полых сфер CuO@SiO 2 и их каталитические характеристики для окисления NO + CO и CO.
 науч. Респ. 5 , e9153 (2015).
науч. Респ. 5 , e9153 (2015).ОБЪЯВЛЕНИЯ
Статья
КАСGoogle ученый
Ламберт С., Селье К., Ферош Ф., Генье Э. М. и Хайнрихс Б. О структурной чувствительности дегидрирования 2-бутанола на Cu/SiO 2 когелевые ксерогелевые катализаторы. Катал. коммун. 8 , 2032–2036 (2007 г.).
КАС
СтатьяGoogle ученый
Wang, X., Zhuang, J., Chen, J., Zhou, K. & Li, Y. Термостабильные силикатные нанотрубки. Анжю. хим. Междунар. Эд. 43 , 2017–2020 (2004).
КАС
СтатьяGoogle ученый
Тан, X.-H., Ван, J.-Z. и Ли, Х.-Х. Синтез и характеристика наноразмерного силиката меди с меловой структурой. Шпилька. Сур. науч. Катал. 154 , 782–787 (2004).
Артикул
Google ученый
«>Прасадрао П. Р. Х., Кумар Р., Рамасвами А. В. и Ратнасами П. Синтез и характеристика кристаллического силиката ванадия со структурой MEL. Цеолиты 13 , 663–670 (1993).
Артикул
Google ученый
Шен, Л., Чжун, В., Ван, Х., Ду, К. и Ян, Ю. Дж. Получение и характеристика гибридов SMA(SAN)/диоксид кремния, полученных из жидкого стекла. Заяв. Полим. науч. 93 , 2289–2296 (2004).
КАС
СтатьяGoogle ученый
Ракше, Б. и Рамасвами, В. Синтез и характеристика молекулярных сит из силиката циркония типа MEL с использованием двух различных источников циркония.
 Шпилька. Сур. науч. Катал. 113 , 219–224 (1998).
Шпилька. Сур. науч. Катал. 113 , 219–224 (1998).КАС
СтатьяGoogle ученый
Шарма, П. и Чанг, В.-Дж. Синтез цеолита типа MEL различной морфологии для извлечения 1-бутанола из водного раствора. Опреснение 275 , 172–180 (2011).
КАС
СтатьяGoogle ученый
Toupance, T., Kermarec, M. & Louis, C. Размер металлических частиц в медных катализаторах на основе диоксида кремния. Влияние условий подготовки и предварительной термической обработки. J. Phys. хим. B 104 , 965–972 (2000).
КАС
СтатьяGoogle ученый
Донг Дж. П., Цзоу Дж. и Лонг Ю. Синтез и характеристика коллоидного TBAсиликалита-2. Микро. мезо. Матер. 57 , 9–19 (2003).
КАС
СтатьяGoogle ученый
«>Лю, Л., Чжан, Л. и Ху, К. Усиленная фентон-подобная деградация фармацевтических препаратов по сравнению с каркасными соединениями меди в микросферах мезопористого кремнезема, легированных медью. Хим. англ. J. 274 , 298–306 (2015).
Артикул
КАСGoogle ученый
Лопес-Суарес, Ф. и др. . Роль поверхностных и решеточных частиц меди в медьсодержащем (Mg/Sr)TiO 3 перовскитные катализаторы сжигания сажи. Заяв. Катал. Б Окружающая среда. 93 , 82–89 (2009).
Артикул
КАСGoogle ученый
«>Ким, К., Йи, Д.К. и Пайк, У. Наночастицы диоксида кремния, встроенные в CuO, для окисления вольфрама посредством гетерогенной реакции Фентона. Микроэлектрон. англ. 183–184 , 58–63 (2017).
Артикул
КАСGoogle ученый
Karmouch, R. & Ross, G.G. Супергидрофобные поверхности лопастей ветряных турбин, полученные путем простого осаждения наночастиц кремнезема, залитых эпоксидной смолой. Заяв. Серф. науч. 257 , 665–669 (2010).
ОБЪЯВЛЕНИЯ
КАС
СтатьяGoogle ученый
«>Basahel, S.N. и др. . Физико-химические и каталитические свойства мезопористых катализаторов CuOZrO 2 . Катализаторы 6 , e 57 (2016).
Артикул
КАСGoogle ученый
Нарасимхарао, К. и Али, Т. Т. Каталитический окислительный крекинг пропана на наноразмерном золоте на носителе Ce0,5Zr0,5O 2 Катализаторы. Катал. лат. 143 , 1074–1084 (2013).
КАС
СтатьяGoogle ученый
Арена, Ф. и др. . Твердофазные взаимодействия, центры адсорбции и функциональность катализаторов Cu-ZnO/ZrO 2 в реакции гидрирования CO 2 до CH 3 OH.
 Заяв. Катал. A: Ген. 350 , 16–23 (2008).
Заяв. Катал. A: Ген. 350 , 16–23 (2008).КАС
СтатьяGoogle ученый
Тоннер С.П., Тримм Д.Л., Уэйнрайт М.С. и Кант Н.В. Дегидрирование метанола в метилформиат на медных катализаторах. Индивидуальный инж. хим. Произв. Рез. Дев. 23 , 384–388 (1984).
КАС
СтатьяGoogle ученый
Шелепова Е.В., Ильина Л.Ю., Ведягин А.А. Кинетические исследования дегидрирования метанола. Часть I: медно-кремнеземные катализаторы. Реак. Кинет. мех. Кошка. 120 , 449–458 (2017).
КАС
СтатьяGoogle ученый
Фридман В., Давыдов А. А. Дегидрирование циклогексанола на медьсодержащих катализаторах: I. Влияние степени окисления меди на активность медных центров. J. Катал. 195 , 20–30 (2000).

КАС
СтатьяGoogle ученый
Сато, А. Г. и др. . Влияние фазы ZrO 2 на структуру и поведение нанесенных Cu катализаторов конверсии этанола. J. Катал. 307 , 1–17 (2013).
КАС
СтатьяGoogle ученый
Chen, L. F., Guo, P. J. & Qiao, M. H. Cu/SiO 2 Катализаторы, приготовленные методом испарения аммиака: Текстура, структура и каталитические характеристики при гидрировании диметилоксалата в этиленгликоль. J. Катал. 257 , 172–180 (2008).
КАС
Статья
Google ученый
Френкель М. Кислотность поверхности монтмориллонитов. Глины Шахтер глины. 22 , 435–441 (1974).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Нарасимхарао, К., Али, Т.Т., Бавакед, С. и Басахель, С. Влияние предшественника кремния на структурные и каталитические свойства наноразмерных силикатов магния. Заяв. Катал. A: Ген. 488 , 208–218 (2014).
КАС
Статья
Google ученый
Синг, К. С. В. и Уильямс, Р. Т. Физисорбционные петли гистерезиса и характеристика нанопористых материалов. Адсорб. науч. Технол. 22 , 773–782 (2004).
КАС
Статья
Google ученый
Моссер, К., Моссер, А., Ромео, М., Пети, С. и Декарро, А. Природные и синтетические филлосиликаты меди, изученные методом XPS. Глины Шахтер глины. 40 , 593–599 (1992).
ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый
Faqeeh, AJ, Ali, T.T., Basahel, S.N. & Narasimharao, K. Модифицированные наноразмерным самарием катализаторы Au-Ce0,5Zr0,5O 2 для окисления бензилового спирта. Мол. Катал. 456 , 10–21 (2018).
КАС
Статья
Google ученый
Скачать ссылки
Благодарности
Этот проект финансировался Департаментом научных исследований (DSR) Университета короля Абдулазиза, Джидда, в рамках гранта №. (Г-596-130-1439). Поэтому авторы благодарят DSR за техническую и финансовую поддержку.
Информация об авторе
Authors and Affiliations
Department of Chemistry, Faculty of Science, King Abdulaziz University, P. O. Box 80203, Jeddah, 21589, Kingdom of Saudi Arabia
Salem Bawaked & Katabathini Narasimharao
Authors
- Salem Bawaked
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Katabathini Narasimharao
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Contributions
S. B. провел все эксперименты, проанализировал данные и в основном отвечал за написание оригинального проекта статьи; К.Н. и С.Б. написание-обзор и редактирование; К.Н. задумал исследовательский проект и разработал эксперименты; К.Н. и С.Б. курировал и руководил исследовательским проектом.
B. провел все эксперименты, проанализировал данные и в основном отвечал за написание оригинального проекта статьи; К.Н. и С.Б. написание-обзор и редактирование; К.Н. задумал исследовательский проект и разработал эксперименты; К.Н. и С.Б. курировал и руководил исследовательским проектом.
Автор, ответственный за переписку
Катабатини Нарасимхарао.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате при условии, что вы укажете соответствующую ссылку на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения.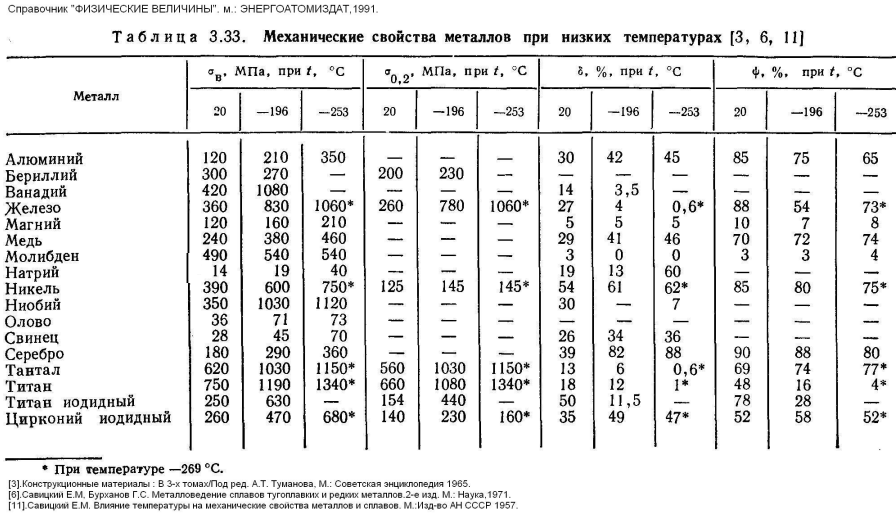 Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Эту статью цитирует
Сплав Ag–Pd, иммобилизованный на полугетерогенном носителе, как новая высокоэффективная искусственная нитроредуктаза: оптимизация схемы эксперимента и исследование кинетики
- Хамиде Агахосейни
- Сейед Джамал Табатабаи Резаи
- Али Рамазани
Письма о катализе (2021)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Термопласты — Физические свойства
Типичные свойства некоторых распространенных термопластов:
Для полной таблицы с теплопроводностью, удельной теплоемкостью и пределом максимальной температуры — поверните экран!
| Thermoplastic | Specific Gravity — SG — | Tensile Yield Strength — σ y — (10 3 psi) | Tensile Modulus — E — ( 10 3 psi ) | Coefficient of Linear Expansion — α — (10 -6 in/in o F) | Thermal Conductivity — k — (Btu in /ft 2 h o F) | Specific Heat — c — (Btu/lb o F) | Maximum Temperature Limit ( o F/ o C) |
|---|---|---|---|---|---|---|---|
| ABS | 1. 08 08 | 7.0 | 340 | 60 | 1.35 | 0.34 | 180/80 |
| PVC | 1.4 | 8.0 | 410 | 30 | 1.1 | 0.25 | 150/65 |
| CPVC | 1.54 | 8.0 | 420 | 35 | 1.0 | 0.20 | 210/100 |
| PE | 0.95 | 3.2 | 120 | 90 | 3.2 | 0.55 | 160/70 |
| PEX | 0.94 | 2,8 | . | 90 | 3.2 | 0.55 | 210/100 |
| PB | 0.92 | 4.2 | 55 | 72 | 1.5 | 0.45 | 210/100 |
| PVDF | 1.76 | 7.0 | 220 | 70 | 1.5 | 0.29 | 300/150 |
- 1 psi (lb/in 2 ) = 6894,8 Па (Н/м 2 )
- 1 (БТЕ/фунт o F) = 4186,8 (Дж/кг K) = 1 (ккал/кг 3 6 53 19 o 1 дюйм/(дюйм o F) = 1,8 м/(м o C)
- 1 БТЕ/(фунт м o F) = 4186,8 Дж/1 (ккг) /(кг o C)
- 1 ГПа = 10 9 Па
- 1 МПа = 10 6 9 Па 6
Предел текучести при растяжении —
σ y
Предел текучести при растяжении — это максимальное инженерное напряжение в фунтах на квадратный дюйм (или Па), при котором начинается постоянная неупругая деформация термопластичного материала.
Предел текучести
Предел текучести — это первая точка, в которой образец изнашивается, где площадь поперечного сечения образца начинает значительно сжиматься или где деформация может увеличиваться без увеличения напряжения.
Предельная прочность на растяжение —
σ u
Предел прочности при растяжении — это максимальное напряжение, которое термопластический материал может выдержать до разрушения, в зависимости от того, что происходит при более высоком уровне напряжения.
Total elongation at failure of some polymers:
| Polymer | Elongation | |
|---|---|---|
| ABS | 5 — 20 | |
| Acrylic | 2 — 7 | |
| Epoxy | 4 — 5 | |
| HDPE | 700 — 1000 | |
| Polyamid (Nylon) 6 | 30 — 100 | |
| Polyamid (Nylon) 6/6 | 15 — 300 | |
| Phenolic | 0. 4 — 0.8 4 — 0.8 | |
| Polyacetal | 25 | |
| Polycarbonate | 110 | |
| Polyprpylene.1101 | ПТФЭ | 250 — 350 |
Модуль упругости или модуль Юнга —
E
точка.
Характеристики термопласта
АБС-акрилонитрил-бутадиен-стирол
- прочный и жесткий
- устойчивый к различным основаниям и кислотам
- некоторые растворители и хлорированные углеводороды могут повредить материал
- Максимальная используемая температура 160 o F (71 O C)
- Обыкновенный привод — дренаж, отходы и вентиляционные силы — ПИСАНИ
- используется для горячей и холодной воды
- используются только компрессионные и ленточные соединения
ПЭ — полиэтилен
- гибкая труба
- используется для систем напорной воды — спринклер..
- not usable for hot water
PEX — Polyethylene Cross Linked
- flexible pipe
- used for pressurized water systems — sprinkler.
 .
.
PP — Polypropylene
- lightweight
- temperature up to 180 o F (82 o C)
- высокая устойчивость к кислотам, основаниям и многим растворителям
- может использоваться в лабораторном водопроводе
ПВХ — поливинилхлорид
- прочный и жесткий
- устойчивый к различным кислотам и основаниям
- может быть поврежден некоторыми растворителями и хлорированными углеводородами
- максимальная рабочая температура 140 o F (60 o C) водопроводные, газовые и дренажные системы
- нельзя использовать в системах горячего водоснабжения
ХПВХ – хлорированный поливинилхлорид
- аналог ПВХ, но предназначен для воды до 180 O F (82 O C)
PVDF — Поливинилиденно фторид
- Сильный и очень жесткий материал
- Устойчивые к износу, кислотам, основаниям, растворителям и большим
- USBEABLE
15151515151513 гг.
 F (138 o C)
F (138 o C) - для лабораторного водопровода
Конструкционные материалы — технологический дизайн
Автор: Katie Johnson [2015] , Helen Wu [2016], Ali Hassan 9 [2016]
Стюарды: Цзянь Гун и Фэнци Ю
Содержимое
|
Существует несколько свойств материала, которые могут повлиять на его пригодность для дизайна. Прежде чем выбрать материал, дизайнер должен знать о следующих свойствах. Обратите внимание, что эти свойства для различных распространенных материалов часто уже собраны и доступны в различных формах от производителей или в различных учебниках.
Прочность на растяжение
Прочность на растяжение или напряжение при растяжении материала — это максимальное напряжение, которое он может выдержать до разрушения. Испытательное напряжение или предел текучести аналогичны, но измеряют максимальное напряжение, которое материал может выдержать, прежде чем деформация станет постоянной. На рисунке 1 ниже показано, где предел прочности при растяжении (точка u) и предел текучести (точка y) лежат на кривой напряжения-деформации для материала. Существуют стандартные испытания на растяжение, которые измеряют прочность на растяжение; однако прочность является общим свойством материалов, которое часто уже приводится в таблицы (Towler et al., 2013).
Существуют стандартные испытания на растяжение, которые измеряют прочность на растяжение; однако прочность является общим свойством материалов, которое часто уже приводится в таблицы (Towler et al., 2013).
Рис. 1: Кривая напряжения-деформации для типичного пластичного материала (Инженерный архив)
В дополнение к таким соображениям, как давление процесса, часто существуют рекомендации, определяющие максимально допустимое напряжение. Один из таких наборов рекомендаций изложен ASME в Кодексе по котлам и сосудам под давлением (Towler et al., 2013). Это следует учитывать при проектировании сосудов под давлением. Существуют также уравнения, которые могут оценить эти значения. Максимальное давление, которое может выдержать цилиндрический сосуд, определяется следующими уравнениями, где t — толщина оболочки, p — давление, R — внутренний радиус сосуда, а S — допустимое растягивающее напряжение:
Таблицы S для различных металлов можно найти в Справочнике Перри (Ulrich, 1984).
Модуль упругости
Модуль упругости материала, иногда называемый его жесткостью, измеряет степень деформации материала при приложении к нему определенной нагрузки. Эта мера применяется, когда происходит упругая деформация, то есть когда вся деформация обратима и линейно пропорциональна напряжению (Callister et al., 2011). На рисунке 1 модуль упругости материала будет применяться между началом координат и точкой y. Это важно, поскольку измеряет сопротивление материала изгибу и короблению (Towler et al., 2013).
Пластичность
Пластичность измеряет степень деформации материала до разрушения (Towler et al., 2013). Уравнение пластичности выглядит следующим образом:
(Калистер и др., 2011).
Когда материал имеет очень низкую пластичность, он определяется как хрупкий. Например, на рисунке 1 выше точка f будет намного ближе к точке u для хрупкого материала, чем для пластичного материала. Хрупкие материалы претерпевают очень небольшую деформацию перед разрушением, а это означает, что в технологических процессах перед разрушением может быть очень небольшой нагрев.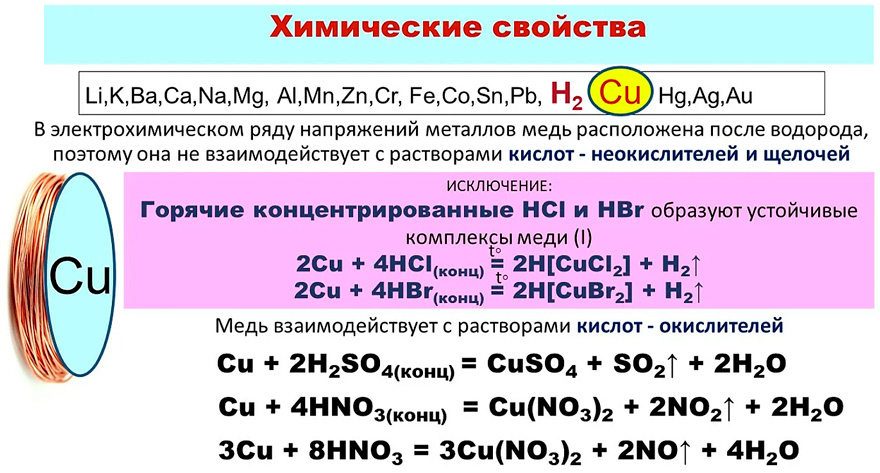 Некоторые материалы имеют точки вязко-хрупкого перехода при низкой температуре. Хотя эти материалы, как правило, обладают пластичными свойствами, при достаточно низких температурах они не деформируются и подвергаются хрупкому разрушению (Peters et al., 2003).
Некоторые материалы имеют точки вязко-хрупкого перехода при низкой температуре. Хотя эти материалы, как правило, обладают пластичными свойствами, при достаточно низких температурах они не деформируются и подвергаются хрупкому разрушению (Peters et al., 2003).
Твердость
Способность материала сопротивляться пластической деформации, такой как вмятины (Towler et al., 2013). Существует много простых и относительно недорогих тестов, таких как тесты на твердость по Роквеллу и тесты на твердость по Бринеллю, которые могут определить твердость материала. Полезно знать твердость материала, потому что ее можно использовать для прогнозирования других механических свойств, таких как предел прочности при растяжении, и часто ее легче определить (Callister et al., 2011). На рисунке 2 ниже показан пример корреляции между числом твердости по Бринеллю и пределом прочности при растяжении.
Рисунок 2: Прочность на растяжение в зависимости от твердости для различных материалов (VanAken, 2001)
Сопротивление усталости
Усталость – это разрушение материала, которое может произойти при циклической нагрузке на оборудование, например, в насосах. Это также может происходить при наличии циклов температуры или давления (Towler et al., 2013). При циклической нагрузке разрушение может произойти при более низких уровнях напряжения, чем нормальная прочность на растяжение. Усталостное разрушение, как правило, очень похоже на хрупкое разрушение с очень небольшой пластической деформацией (Callister et al., 2011).
Это также может происходить при наличии циклов температуры или давления (Towler et al., 2013). При циклической нагрузке разрушение может произойти при более низких уровнях напряжения, чем нормальная прочность на растяжение. Усталостное разрушение, как правило, очень похоже на хрупкое разрушение с очень небольшой пластической деформацией (Callister et al., 2011).
Другие соображения
При выборе материала необходимо учитывать множество других свойств. Например, ползучесть — это степень деформации материала, когда он находится под постоянным растягивающим напряжением в течение длительных периодов времени, и может быть особенно проблемой для металлов при высоких температурах. Другие соображения включают простоту изготовления, в том числе возможность сварки и гибкость, доступность и стоимость материала, теплопроводность (что особенно важно для такого оборудования, как теплообменники), электрическое сопротивление и магнитные свойства в определенных случаях (Towler et al., 2013).
Перед выбором материала для процесса необходимо собрать основную информацию, включая температуру, давление и используемые химические вещества. Свойства могут повлиять на выбор материалов.
Температура и давление процесса
В дополнение к знанию средней температуры, при которой протекает процесс, инженер должен знать максимальную и минимальную температуру, которая может возникнуть. При выборе материалов необходимо учитывать влияние температуры на свойства материала. Более высокие температуры обычно снижают предел прочности при растяжении и модуль упругости металлов (Towler et al., 2013).
Кроме того, очень низкие температуры могут вызвать хрупкое разрушение некоторых материалов. Следовательно, если минимальная температура процесса ниже минимально допустимой температуры для материала, необходимо выбрать другой материал (например, низкотемпературную углеродистую сталь). Обратите внимание, что ожидаемые, максимальные и минимальные условия окружающей среды следует учитывать в дополнение к внутренним условиям.
| Работа при высоких температурах | Работа при низких температурах | ||
|---|---|---|---|
| T макс. (F) | Сталь | T мин (F) | Сталь |
| 950 | Углеродистая сталь | -50 | Углеродистая сталь |
| 1300 | нержавеющая сталь 330 | -75 | Никелевая сталь (А203) |
| 1500 | Нержавеющая сталь (304 321 347 316) | -320 | Никелевая сталь (А325) |
| 2000 | Литая нержавеющая сталь, HC | -425 | Нержавеющая сталь (302 304 310 347) |
Точно так же максимальное и минимальное давление должны быть проверены в зависимости от свойств материала. Разные материалы имеют разные растягивающие напряжения, которые влияют на максимальное давление, которое можно использовать. Когда внутреннее давление меньше внешнего (т. е. процесс протекает в вакууме), следует либо использовать материалы с более высокими допускаемыми растягивающими напряжениями, либо увеличивать толщину.
Разные материалы имеют разные растягивающие напряжения, которые влияют на максимальное давление, которое можно использовать. Когда внутреннее давление меньше внешнего (т. е. процесс протекает в вакууме), следует либо использовать материалы с более высокими допускаемыми растягивающими напряжениями, либо увеличивать толщину.
Коррозия
Если в процессе используются определенные коррозионно-активные химические вещества, такие как кислород, для материалов должны быть предусмотрены специальные нормы. Кроме того, следует учитывать условия окружающей среды, такие как соль из близлежащего океана. Если ожидается коррозия, инженер должен учитывать это при выборе материала. Это может включать выбор материала, естественно устойчивого к коррозии, или нанесение покрытия на внутреннюю часть трубы оборудования. Эти покрытия могут быть изготовлены из краски или других органических покрытий, особенно для устойчивости к атмосферной коррозии (Towler et al., 2013). Для внутренней защиты материалы могут быть облицованы резиной, стеклом, нержавеющей сталью или различными полимерами (Ульрих, 19 лет). 84; Тертон и др., 2012).
84; Тертон и др., 2012).
Типы коррозии
Равномерная коррозия является наиболее распространенным типом коррозии и считается «общей тратой материала», при этом другие источники износа не учитываются. Благодаря природе этого типа коррозии скорость коррозии можно предсказать и определить экспериментально. Коррозионные испытания проводятся для прогнозирования скорости проникновения в дюймах в год и могут быть выражены следующим уравнением:
где w = потеря массы во времени t (lb), t = время (годы), A = площадь поверхности (ft 2 ), p = плотность материала (lb/ft 3 ). Приемлемые скорости коррозии для углеродистых и низколегированных сталей приведены в таблице 2. Для более дорогих материалов эти скорости коррозии следует сократить вдвое (Towler et al., 2013).
| Скорость коррозии | ||
|---|---|---|
| мкг | мм/год | |
| Вполне удовлетворительно | <0,01 | 0,25 |
| Использовать с осторожностью | <0,03 | 0,75 |
| Используйте только для коротких экспозиций | <0,6 | 1,5 |
| Совершенно неудовлетворительно | >0,06 | 1,5 |
Гальваническая коррозия вызывается контактом разнородных металлов в присутствии электропроводящего раствора. Это вызвано протеканием тока от более активного анодного металла к менее активному катодному металлу. См. Рисунок 3 для гальванического ряда различных металлов. Это увеличивает скорость коррозии, которая зависит от относительных открытых площадей двух металлов. Чтобы свести к минимуму эту скорость коррозии, мы должны максимизировать отношение площади катода к площади анода. Другой превентивной мерой является электрическая изоляция двух металлов в попытке разорвать проводящую цепь (Perry et al., 2008).
Другой превентивной мерой является электрическая изоляция двух металлов в попытке разорвать проводящую цепь (Perry et al., 2008).
Рисунок 3: Практическая гальваническая серия металлов и сплавов (Источник: www.ssina.com)
Точечная коррозия представляет собой сильно локализованную форму коррозии, приводящую к образованию полостей или ямок. Эта коррозия гораздо менее предсказуема и обычно возникает в металлах с неоднородным составом. Точечная коррозия может быть уменьшена с помощью обработки поверхности.
Эрозия-коррозия может возникнуть, если раствор, контактирующий с металлом, содержит взвешенные частицы или имеет высокую скорость. Чтобы учесть эти факторы и результирующую дополнительную эрозию, на поверхности должен использоваться более стойкий материал.
Межкристаллитная коррозия представляет собой селективную коррозию, происходящую на границах зерен или кристаллов металла или сплава. Несмотря на то, что фактическая потеря материала невелика, она может привести к выходу из строя оборудования, вызывая потерю прочности и пластичности. Эта коррозия очень характерна для сплавов и редко для чистых металлов. Это вызвано наличием примесей, существующих на границе зерен, которые накапливаются при термообработке.
Эта коррозия очень характерна для сплавов и редко для чистых металлов. Это вызвано наличием примесей, существующих на границе зерен, которые накапливаются при термообработке.
Коррозия под напряжением учитывает внутренние и внешние факторы стресса, которые могут вызвать преждевременное разрушение материала (Towler et al., 2013). Остаточные внутренние факторы стресса включают неравномерное охлаждение от высоких температур, структурные перестройки, связанные с изменением объема, и напряжения, вызванные заклепками и болтами (Perry et al. 2008). Внешние растягивающие напряжения на поверхности, наряду с внутренними напряжениями, могут вызвать это растрескивание под напряжением. Этого можно избежать при проектировании за счет выбора материалов, которые не подвержены коррозии в конкретной среде, и устранения высоких напряжений (Towler et al., 2013). Источник коррозии под напряжением часто возникает из-за развития напряжений во время изготовления и сварки и может привести к преждевременному выходу из строя в течение как короткого промежутка времени, как минут, так и лет.
Жидкометаллическая коррозия возникает, когда жидкие металлы проникают в трещины между зернами и границами сварки. Одним из примеров является воздействие ртути на алюминиевые сплавы, которое может привести к катастрофическому отказу оборудования (Perry et al., 2008).
Коррозия также может возникать в результате высокотемпературного окисления некоторых низколегированных сталей. Для этих материалов рабочие температуры должны быть ниже 480 C, чтобы предотвратить окисление и коррозию. Существуют способы предотвращения этого окисления, например, создание границы между раствором и материалом. Здесь хром эффективно противостоит окислению, создавая оксидную пленку между раствором и оборудованием. Сульфидация также вызывает беспокойство. Сера является обычным элементом, присутствующим на нефтеперерабатывающих и энергетических предприятиях. Однако сера очень агрессивна и может повредить оборудование, вызывая сильную коррозию.
Водородное охрупчивание происходит при повышенных температурах и представляет собой поглощение и реакцию водорода в металле, приводящую к образованию метана. Это приводит к потере пластичности и растрескиванию металла по мере обезуглероживания. Воздействие водорода важно учитывать при выборе сталей для использования в установках водородного риформинга. Легированные стали, как правило, обладают большей стойкостью, чем простые углеродистые стали, но при температурах ниже 500 °C можно использовать простую углеродистую сталь с ограниченным воздействием водорода. Принятые пределы использования углеродистых и низколегированных сталей показаны на кривых Нельсона (рис. 4) (Towler et al., 2013).
Это приводит к потере пластичности и растрескиванию металла по мере обезуглероживания. Воздействие водорода важно учитывать при выборе сталей для использования в установках водородного риформинга. Легированные стали, как правило, обладают большей стойкостью, чем простые углеродистые стали, но при температурах ниже 500 °C можно использовать простую углеродистую сталь с ограниченным воздействием водорода. Принятые пределы использования углеродистых и низколегированных сталей показаны на кривых Нельсона (рис. 4) (Towler et al., 2013).
Рисунок 4: Допустимые пределы использования углеродистых и низколегированных сталей при различных парциальных давлениях водорода (Источник: www.corrosionclinic.com) давление или уровень материала) постоянно переключается между высоким и низким уровнями. Цикличность создает дополнительную нагрузку на систему и должна учитываться при выборе материалов (Callister et al., 2011).
Металлы
Углеродистая и нержавеющая стали являются одними из самых распространенных металлов, используемых в строительстве. Углеродистая сталь представляет собой сплав углерода и железа. Углеродистая сталь, также известная как мягкая сталь, является одним из наиболее часто используемых конструкционных материалов. Его предпочитают, потому что он относительно дешев и широко доступен. Он также имеет хорошую прочность на растяжение и пластичность. Однако углеродистая сталь обычно не устойчива к коррозии, что может быть проблемой во многих средах. Когда ожидается коррозия, предпочтение отдается нержавеющей стали. Нержавеющая сталь, особенно с высоким содержанием хрома, более устойчива к коррозии (Towler et al., 2013). Нержавеющая сталь также является лучшим выбором для низких температур, так как она имеет минимальный рейтинг -425 F, в отличие от минимального рейтинга углеродистой стали -50 F. Нержавеющая сталь также является лучшим выбором, чем углеродистая сталь, при температурах выше 1000. Ожидается F (Biegler et al., 1997)
Углеродистая сталь представляет собой сплав углерода и железа. Углеродистая сталь, также известная как мягкая сталь, является одним из наиболее часто используемых конструкционных материалов. Его предпочитают, потому что он относительно дешев и широко доступен. Он также имеет хорошую прочность на растяжение и пластичность. Однако углеродистая сталь обычно не устойчива к коррозии, что может быть проблемой во многих средах. Когда ожидается коррозия, предпочтение отдается нержавеющей стали. Нержавеющая сталь, особенно с высоким содержанием хрома, более устойчива к коррозии (Towler et al., 2013). Нержавеющая сталь также является лучшим выбором для низких температур, так как она имеет минимальный рейтинг -425 F, в отличие от минимального рейтинга углеродистой стали -50 F. Нержавеющая сталь также является лучшим выбором, чем углеродистая сталь, при температурах выше 1000. Ожидается F (Biegler et al., 1997)
Другие варианты включают никель и сплавы, в том числе монель, сплав никеля и меди (Ulrich, 1984). Они также устойчивы к коррозии к серной и соляной кислотам и соленой воде. Никель-хромовые сплавы обладают хорошей химической стойкостью при высоких температурах (Turton et al., 2012). Медь и сплавы обладают коррозионной стойкостью и хорошей теплопроводностью. Таким образом, для теплообменного оборудования часто используют медь (Ulrich, 1984). Алюминий и его сплавы имеют более умеренную цену, чем медные металлы, они легкие и лучше выдерживают низкие температуры, чем углеродистая сталь, однако имеют меньшую прочность (Ульрих, 19 лет).84).
Они также устойчивы к коррозии к серной и соляной кислотам и соленой воде. Никель-хромовые сплавы обладают хорошей химической стойкостью при высоких температурах (Turton et al., 2012). Медь и сплавы обладают коррозионной стойкостью и хорошей теплопроводностью. Таким образом, для теплообменного оборудования часто используют медь (Ulrich, 1984). Алюминий и его сплавы имеют более умеренную цену, чем медные металлы, они легкие и лучше выдерживают низкие температуры, чем углеродистая сталь, однако имеют меньшую прочность (Ульрих, 19 лет).84).
| Материал | Прочность на растяжение (Н/мм 2 ) | Модуль упругости (кН/мм 2 ) | Твердость по Бринеллю | Удельный вес | Максимально допустимое напряжение (Н/мм 2 ) | Цена ($/кг) (2010 г.) | Относительная стоимость (2010 г.) |
|---|---|---|---|---|---|---|---|
| Мягкая (углеродистая) сталь | 430 | 210 | 100-200 | 7,9 | 0,02 | 0,82 | 1 |
| Нержавеющая сталь | >540 | 210 | 160 | 8. 0 0 | 0,14 | 2,55-3,79 | 2,0-3,0 |
| Медь | 200 | 110 | 30-100 | 8,9 | 0,046 | 8,44 | 22,8 |
| Никель | 500 | 210 | 80-150 | 8,9 | 0,069 | 21,74 | 39,2 |
| Монель | 650 | 170 | 120-250 | 8,8 | 0,13 | 17.11 | 16,4 |
| Титан | 500 | 110 | 150 | 4,5 | 0,069 | 7,39 | 6,8 |
Затраты на материалы
Оценка относительной стоимости (Таблица 3) определяется по заданному уравнению, составленному с учетом факторов, которые обычно определяют стоимость материалов. Это уравнение (Towler et al., 2013)
Где c — стоимость единицы массы ($/кг), ρ — плотность (кг/м3), а σ d — максимально допустимое напряжение (Н/мм2).
Этот рейтинг позволяет дизайнерам определить, какой материал будет самым дешевым в соответствии с требованиями, предъявляемыми к дизайну. В уравнение можно ввести дополнительные переменные в зависимости от конструктивных ограничений (например, максимальная номинальная температура). Таким образом, рейтинг несколько ограничен.
Материалы с более высоким максимально допустимым напряжением обычно дороже, но их можно использовать в меньших количествах (Towler et al., 2013).
Нержавеющая сталь
Из всех основных типов металлов, используемых в химическом проектировании, наиболее часто используемой и изучаемой является нержавеющая сталь. Нержавеющие стали хорошо известны своей устойчивостью к коррозии, что делает их широко применимыми в мире химической обработки, где трубы и резервуары из нержавеющей стали используются для содержания коррозионно-активных жидкостей. Нержавеющая сталь определяется как стальной сплав с содержанием хрома не менее 10,5% по массе. Как и сталь, нержавеющая сталь выпускается в различных формах, которые могут быть получены путем изменения ее микроструктуры, а затем изменены путем изменения химического состава сплава (то есть добавления или удаления его элементов). Эта гибкость нержавеющей стали позволяет использовать ее практически в любом приложении, в зависимости от требований конструкции. Однако, как правило, нержавеющая сталь используется, когда нужны инженерные свойства стали, но с дополнительным преимуществом предотвращения коррозии (Biegler et al., 19).97). Нержавеющие стали содержат минимально необходимый уровень хрома для образования пленки оксида хрома поверх стали в присутствии кислорода. Этот процесс блокирует коррозию от распространения во внутреннюю структуру стали. Без создания этой пассивной пленки нержавеющая сталь ржавела бы под воздействием кислорода и воды, как это происходит с углеродистой сталью. Однако есть и обратная сторона, поскольку дополнительное преимущество нержавеющей стали работает только в присутствии кислорода.
Как и сталь, нержавеющая сталь выпускается в различных формах, которые могут быть получены путем изменения ее микроструктуры, а затем изменены путем изменения химического состава сплава (то есть добавления или удаления его элементов). Эта гибкость нержавеющей стали позволяет использовать ее практически в любом приложении, в зависимости от требований конструкции. Однако, как правило, нержавеющая сталь используется, когда нужны инженерные свойства стали, но с дополнительным преимуществом предотвращения коррозии (Biegler et al., 19).97). Нержавеющие стали содержат минимально необходимый уровень хрома для образования пленки оксида хрома поверх стали в присутствии кислорода. Этот процесс блокирует коррозию от распространения во внутреннюю структуру стали. Без создания этой пассивной пленки нержавеющая сталь ржавела бы под воздействием кислорода и воды, как это происходит с углеродистой сталью. Однако есть и обратная сторона, поскольку дополнительное преимущество нержавеющей стали работает только в присутствии кислорода. Таким образом, нержавеющие стали не используются в средах с низким содержанием воздуха (SSIA).
Таким образом, нержавеющие стали не используются в средах с низким содержанием воздуха (SSIA).
Нержавеющие стали бывают трех основных типов в зависимости от их микроструктуры: ферритные, мартенситные и аустенитные. Ферритные нержавеющие стали имеют объемно-центрированную кубическую структуру. Они содержат широкий спектр хрома, от 13 до 20%, и не содержат никеля с максимальным содержанием углерода 0,1%. Ферритные нержавеющие стали обычно дешевле и, следовательно, имеют более низкий уровень содержания хрома. Это делает их менее устойчивыми к коррозии по сравнению с другими нержавеющими сталями, но благодаря своей структуре обладает лучшими техническими свойствами (Towler et al., 2013). Мартенситные нержавеющие стали изготавливаются путем нагревания и закалки аустенитных нержавеющих сталей для создания уникальной микроструктуры, которая в целом тверже, чем аустенитные нержавеющие стали. Эта твердость может предотвратить распад сварного шва, но также делает сталь очень хрупкой. Часто мартенситные нержавеющие стали закаляют, чтобы получить твердый и прочный материал. Содержание хрома составляет около 10-12% с содержанием никеля менее 2%. Из-за низкого содержания хрома и никеля мартенситные нержавеющие стали обладают относительно низкой коррозионной стойкостью (SSIA).
Содержание хрома составляет около 10-12% с содержанием никеля менее 2%. Из-за низкого содержания хрома и никеля мартенситные нержавеющие стали обладают относительно низкой коррозионной стойкостью (SSIA).
Аустенитные нержавеющие стали составляют более 70% нержавеющей стали, производимой во всем мире. Они отличаются гранецентрированной кубической структурой и использованием карбидов. Добавление никеля в сталь стабилизирует аустенитную структуру железа внутри. Таким образом, аустенитные нержавеющие стали содержат минимум 7 % никеля и 18–20 % хрома (Towler et al., 2013). Они популярны благодаря высокой коррозионной стойкости. Аустенитные нержавеющие стали не затвердевают при термической обработке, что делает их восприимчивыми к разрушению сварного шва. Скорее, они должны пройти сложный процесс мартенситной обработки (SSIA).
Существуют марки аустенитных нержавеющих сталей, соответствующие определенному химическому составу. Серия 200 аустенитных нержавеющих сталей, как правило, более «универсальна» и дешевле, поскольку они заменяют никель марганцем. Это делает их более круглыми, но менее устойчивыми к коррозии. Тип 201, например, может затвердевать при обработке холодом (SSIA).
Это делает их более круглыми, но менее устойчивыми к коррозии. Тип 201, например, может затвердевать при обработке холодом (SSIA).
| Спецификация № | Состав % | |||||||
|---|---|---|---|---|---|---|---|---|
| № AISI | С Макс. | Си Макс | Мн Макс | Ассортимент Кр | Диапазон никеля | Диапазон Мо | Ти | Нб |
| 304 | 0,08 | 2,00 | 17,5-20,0 | 8,0-11,0 | ||||
| 304л | 0,03 | 1,00 | 2,00 | 17,5-20,0 | 8,0-12,0 | |||
| 321 | 0,12 | 1,00 | 2,00 | 17,0-20,0 | 9,0-12,0 | 4x(С) | ||
| 347 | 0,08 | 1,00 | 2,00 | 17,0-20,0 | 9,0-13,0 | 10x(С) | ||
| 316 | 0,08 | 1,00 | 2,00 | 16,0-18,0 | 10,0-14,0 | 2,0-3,0 | ||
| 316л | 0,03 | 1,0 | 2. 0 0 | 16,0-18,0 | 10,0-14,0 | 2,0-3,0 | ||
| 309 | 0,20 | 22,0-24,0 | 12,0-15,0 | |||||
| 310 | 0,25 | 24,0-26,0 | 19.0-22.0 | |||||
Серия Тип 300 чаще используется в химических процессах из-за их превосходной коррозионной стойкости. Тип 304, или 18/8, известный своим содержанием 18% хрома и 8% никеля, использует минимальное количество хрома и никеля, чтобы сохранить стабильную аустенитную структуру. Это удерживает его цену на низком уровне, сохраняя при этом отличные свойства. Содержание углерода обычно достаточно низкое, чтобы предотвратить распад сварного шва, поэтому отсутствие потенциальной термической обработки не является проблемой. Тип 304L содержит даже меньше углерода, чем тип 304 (менее 0,03%), и обычно используется в тех местах, где может происходить отложение карбида для типа 304 (например, более толстые сварные секции). Для использования при высоких температурах существует тип 321, который является более термостойким и представляет собой стабилизированную версию типа 304. Типы 309а 310 может предотвратить окисление при высоких температурах из-за повышенного содержания хрома. Для еще большей коррозионной стойкости тип 316 лучше всего подходит для добавления молибдена, который может предотвратить коррозию от разбавленной серной кислоты (Towler et al., 2013).
Для использования при высоких температурах существует тип 321, который является более термостойким и представляет собой стабилизированную версию типа 304. Типы 309а 310 может предотвратить окисление при высоких температурах из-за повышенного содержания хрома. Для еще большей коррозионной стойкости тип 316 лучше всего подходит для добавления молибдена, который может предотвратить коррозию от разбавленной серной кислоты (Towler et al., 2013).
Никель, медь и монель
Никель сам по себе обладает уникальными преимуществами по сравнению с другими материалами. В отличие от нержавеющей стали, никель легко обрабатывается и не подвержен коррозионному растрескиванию. Это связано с низкой скоростью окисления никеля при комнатной температуре. Никель обычно используется в оборудовании, которое работает с едкими щелочами при температуре выше 70°С.0019 o C. Это связано с тем, что это предел, при котором могут работать углеродистые стали, поэтому никель выступает в качестве надежной замены (Towler et al. , 2013).
, 2013).
Никель обычно используется в технологическом оборудовании, поскольку он особенно хорош для поддержания чистоты продукта. Эти продукты могут варьироваться от продуктов питания до синтетических волокон. В химических процессах редко используется чистый никель, поскольку изготовление никелевого сплава является очень простым процессом и может значительно улучшить определенные свойства материала. Никель обладает полной растворимостью в твердом состоянии с медью, что упрощает формирование сплавов с медью (Ульрих, 1984).
Медь – это мягкий металл, с которым так же легко работать, как с никелем, и он встречается в изобилии. Его мягкая природа обеспечивает ему хорошую электрическую и тепловую проводимость. Медь также широко используется в пищевой промышленности, обычно в пивоварении. Передаточные трубы и трубы малого диаметра часто содержат медь из-за ее сильных свойств теплопередачи. Медь не реагирует с водой, но медленно реагирует с кислородом воздуха. В результате этой реакции образуется не ржавчина, а слой диоксида меди, защищающий медь от коррозии. Медь устойчива к едким щелочам, кроме аммиака, многим солям и органическим кислотам. Однако минеральные кислоты вредны для меди (Towler et al., 2013).
Медь устойчива к едким щелочам, кроме аммиака, многим солям и органическим кислотам. Однако минеральные кислоты вредны для меди (Towler et al., 2013).
Медь может образовывать множество сплавов. Основными из них являются латуни (легированные цинком) и бронзы (легированные оловом). Они почти одинаково устойчивы к коррозии металлов. В основном они используются в клапанах и других мелких фитингах, а также в трубах (Towler et al., 2013). С понижением температуры медные сплавы становятся более пластичными и прочными. Сплав с 70% меди, который содержит никель и другие упрочняющие элементы, называется «мельхиоровым» сплавом. Мельхиор легко изготавливается благодаря полной растворимости меди и никеля. Мельхиор устойчив к коррозии в морской воде и устойчив к макрообрастанию, поэтому его часто используют в морской технике (например, на опреснительных установках морской воды, морских нефтяных платформах и т. д.). Выбор подходящего сплава зависит от того, какие свойства от теплопроводности до предела прочности при растяжении (CDAI) хотелось бы получить в наибольшей степени.
| Сплав | Плотность г/см 3 | Теплопроводность Вт/(м·К) | Тепловое расширение мкм/(м·K) | Удельное электрическое сопротивление мкОм·см | Модуль упругости ГПа | Предел текучести МПа | Прочность на растяжение МПа |
|---|---|---|---|---|---|---|---|
| 90-10 | 8,9 | 40 | 17 | 19 | 135 | 105 | 275 |
| 70-30 | 8,95 | 29 | 16 | 34 | 152 | 125 | 360 |
| 66-30-2-2 | 8,86 | 25 | 15,5 | 50 | 156 | 170 | 435 |
Монель представляет собой никелевый сплав, состоящий в основном из никеля (~ 65 %) и меди с другими упрочняющими элементами, такими как железо. Монель прочнее чистого никеля и считается «однофазным сплавом» из-за совместимости никеля и меди. Это второй наиболее часто используемый сплав на химических предприятиях, и он стоит рядом с нержавеющей сталью с точки зрения его широкого применения. Он также имеет определенные преимущества в определенных ситуациях по сравнению с нержавеющими сталями, например, при работе с разбавленными минеральными кислотами и при работе в восстановительных условиях. Единственным его большим минусом является цена по сравнению со сталью (Towler et al., 2013). Монель очень трудно обрабатывать из-за упрочнения, что увеличивает стоимость его производства по сравнению со стоимостью материала (монель может быть до 10 раз дороже никеля и меди). Поэтому монель обычно используется в ситуациях, когда он имеет присущие ему преимущества и когда его стоимость перевешивается его преимуществами. Монель используется во многих тех же отраслях промышленности, что и мельхиоровые сплавы, включая судостроение и нефтепереработку.
Монель прочнее чистого никеля и считается «однофазным сплавом» из-за совместимости никеля и меди. Это второй наиболее часто используемый сплав на химических предприятиях, и он стоит рядом с нержавеющей сталью с точки зрения его широкого применения. Он также имеет определенные преимущества в определенных ситуациях по сравнению с нержавеющими сталями, например, при работе с разбавленными минеральными кислотами и при работе в восстановительных условиях. Единственным его большим минусом является цена по сравнению со сталью (Towler et al., 2013). Монель очень трудно обрабатывать из-за упрочнения, что увеличивает стоимость его производства по сравнению со стоимостью материала (монель может быть до 10 раз дороже никеля и меди). Поэтому монель обычно используется в ситуациях, когда он имеет присущие ему преимущества и когда его стоимость перевешивается его преимуществами. Монель используется во многих тех же отраслях промышленности, что и мельхиоровые сплавы, включая судостроение и нефтепереработку. Однако следует соблюдать осторожность и не помещать монель рядом со сталью в морской воде из-за возможности гальванической коррозии (Ульрих, 19 лет).84).
Однако следует соблюдать осторожность и не помещать монель рядом со сталью в морской воде из-за возможности гальванической коррозии (Ульрих, 19 лет).84).
Алюминиевые сплавы и титан
Чистый алюминий более устойчив к коррозии, чем его сплавы. Это происходит из-за образования тонкой оксидной пленки, похожей на нержавеющую сталь. Однако ему не хватает механической прочности, поэтому чистый алюминий редко используется. Наиболее распространены алюминиевые сплавы «Дуралюмин» или «Дурал» с небольшим процентным содержанием меди и магния (<5%). Эти сплавы устойчивы к коррозии и прочны. Они используются в текстильной и пищевой промышленности в местах, где мягкая сталь может вызвать загрязнение (Towler et al., 2013). Алюминий часто подходит для криогенных операций (Turton et al., 2012).
Титан все чаще используется в химической промышленности из-за его устойчивости к коррозии в морской воде и растрескиванию под воздействием хлора. Он не такой прочный, как нержавеющая сталь, но может выдерживать большую нагрузку, что может быть полезно в процессах жидкостного окисления. Его свойства теплопроводности делают его хорошей заменой мельхиора (Towler et al., 2013).
Его свойства теплопроводности делают его хорошей заменой мельхиора (Towler et al., 2013).
Пластмассы
Пластмассы все чаще используются там, где ожидается коррозия. Пластик также популярен, потому что он недорог. Однако они обладают низкой прочностью по сравнению с металлами (Ульрих, 19 лет).84). Пластмассы можно разделить на несколько категорий. Первый из них – это термопластичные материалы, которые размягчаются при повышении температуры. ПВХ относится к этой категории и является наиболее часто используемым термопластичным материалом на химических предприятиях. Вторая категория – термореактивные материалы, которые имеют более жесткую структуру за счет сшивки. Резина также часто используется для облицовки резервуаров и труб (Towler et al., 2013). В таблице 4 перечислены некоторые свойства распространенных пластиков.
93)
Неорганические неметаллы
Неорганические неметаллы включают стекло, керамические изделия, кирпич и цемент (Peters et al. , 2003). Керамика обычно прочнее других материалов, особенно при более высоких температурах, она гораздо более хрупкая (Ульрих, 1984). Стекло хорошо защищает от коррозии; керамогранит, как правило, устойчив к коррозии и обладает большей прочностью, но имеет плохую теплопроводность (Peters et al., 2003). Керамические материалы обладают поперечно-сшитой структурой, которая может быть кристаллической или частично кристаллической, и обладают широким диапазоном свойств различных типов.
, 2003). Керамика обычно прочнее других материалов, особенно при более высоких температурах, она гораздо более хрупкая (Ульрих, 1984). Стекло хорошо защищает от коррозии; керамогранит, как правило, устойчив к коррозии и обладает большей прочностью, но имеет плохую теплопроводность (Peters et al., 2003). Керамические материалы обладают поперечно-сшитой структурой, которая может быть кристаллической или частично кристаллической, и обладают широким диапазоном свойств различных типов.
Боросиликатное стекло, состоящее из диоксида кремния и триоксида бора, очень часто используется на химических предприятиях. Это стекло, также широко известное как «пирекс», более прочное и может выдерживать высокие рабочие температуры до 700°С. Что касается давления, то боросиликатное стекло не выдерживает высокого давления. Таким образом, меры предосторожности, которые следует учитывать при проектировании, — это защита оборудования с помощью внешнего экрана и возможность выпуска воздуха в атмосферу для сброса любого повышения давления. При этих ограничениях этот материал часто используется для мелкосерийного производства специальных химикатов. Он может использоваться для изготовления труб и фитингов различных размеров и обычно используется для изготовления дистилляционных колонн, абсорбционных колонн и теплообменников. Стекло также часто используется в качестве облицовки из-за его относительно химически инертных свойств. Например, стекло устойчиво к кислотам, солям и другим органическим веществам. Однако важно отметить, что стекло неустойчиво к щелочам и фтору.
При этих ограничениях этот материал часто используется для мелкосерийного производства специальных химикатов. Он может использоваться для изготовления труб и фитингов различных размеров и обычно используется для изготовления дистилляционных колонн, абсорбционных колонн и теплообменников. Стекло также часто используется в качестве облицовки из-за его относительно химически инертных свойств. Например, стекло устойчиво к кислотам, солям и другим органическим веществам. Однако важно отметить, что стекло неустойчиво к щелочам и фтору.
Керамогранит — это более качественная версия боросиликатного стекла, так как оно прочнее, но обладает такими же свойствами и областью применения, что и боросиликатное стекло. Часто используется для насадки дистилляционных и абсорбционных колонн.
Огнеупорные материалы химически и физически устойчивы при высоких температурах, что делает их хорошими конкурентами для изготовления пламенных нагревателей и котлов. Они состоят из кремнезема (SiO 2 ) и оксида алюминия (Al 2 O 3 ), и различные балансы этих двух соединений сильно влияют на характеристики материала. Образование эвтектической системы при 1545°С из 99,45% SiO 2 важно, чтобы состав не подвергался такому разрушению. Эвтектическая система описывает однородную твердую смесь, и в этот момент система будет плавиться как единое целое. Поэтому, чтобы оборудование не перекосилось и не расплавилось, состав огнеупоров должен быть выше или ниже 99,45% SiO 2 . Кварцевые кирпичи содержат >98% SiO 2 и используются в основном для изготовления печей. Кирпичи из глинозема содержат 60 % Al 2 O 3 и используются для специальных печей. Огнеупорный кирпич, состоящий из 50 % SiO 2 , 40 % Al 2 O 3 , баланса CaO и Fe 2 O 3 , также используется для общего строительства печей. Одним из свойств кремнезема является то, что он может расширяться при определенных температурах, и поэтому это необходимо учитывать при проектировании и эксплуатации процесса (Towler et al., 2013).
Образование эвтектической системы при 1545°С из 99,45% SiO 2 важно, чтобы состав не подвергался такому разрушению. Эвтектическая система описывает однородную твердую смесь, и в этот момент система будет плавиться как единое целое. Поэтому, чтобы оборудование не перекосилось и не расплавилось, состав огнеупоров должен быть выше или ниже 99,45% SiO 2 . Кварцевые кирпичи содержат >98% SiO 2 и используются в основном для изготовления печей. Кирпичи из глинозема содержат 60 % Al 2 O 3 и используются для специальных печей. Огнеупорный кирпич, состоящий из 50 % SiO 2 , 40 % Al 2 O 3 , баланса CaO и Fe 2 O 3 , также используется для общего строительства печей. Одним из свойств кремнезема является то, что он может расширяться при определенных температурах, и поэтому это необходимо учитывать при проектировании и эксплуатации процесса (Towler et al., 2013).
Как и у любого другого материала, у стекла есть свои преимущества и недостатки. Одним из преимуществ является то, что стекло устойчиво к большинству кислот. Одним заметным исключением является то, что он не устойчив к фтористоводородной и горячей концентрированной H9.0005 3 Заказ на покупку 4 . Еще одно преимущество заключается в том, что при использовании стеклянных трубок содержимое труб можно увидеть и наблюдать, если это необходимо или полезно для процесса. Основным недостатком использования стекла является его хрупкость. Стекло также подвержено воздействию горячих щелочных растворов и термическому удару. Можно принять меры по бронированию стекла, чтобы уменьшить вероятность поломки. Это можно сделать с помощью эпоксидно-полиэфирного стекловолокна. Использование преимуществ стекла с преимуществами других материалов также позволяет создавать отличные строительные материалы. Например, использование застекленной стали обеспечивает коррозионную стойкость за счет свойств стекла, но также обеспечивает прочность за счет свойств стали. Как упоминалось ранее, стеклянные облицовки также широко используются в промышленности.
Одним из преимуществ является то, что стекло устойчиво к большинству кислот. Одним заметным исключением является то, что он не устойчив к фтористоводородной и горячей концентрированной H9.0005 3 Заказ на покупку 4 . Еще одно преимущество заключается в том, что при использовании стеклянных трубок содержимое труб можно увидеть и наблюдать, если это необходимо или полезно для процесса. Основным недостатком использования стекла является его хрупкость. Стекло также подвержено воздействию горячих щелочных растворов и термическому удару. Можно принять меры по бронированию стекла, чтобы уменьшить вероятность поломки. Это можно сделать с помощью эпоксидно-полиэфирного стекловолокна. Использование преимуществ стекла с преимуществами других материалов также позволяет создавать отличные строительные материалы. Например, использование застекленной стали обеспечивает коррозионную стойкость за счет свойств стекла, но также обеспечивает прочность за счет свойств стали. Как упоминалось ранее, стеклянные облицовки также широко используются в промышленности. Стеклянные облицовки устойчивы к: всем концентрациям HCl до 120°C, разбавленной серной кислоте до температуры кипения, концентрированной серной кислоте до 230°C и всем концентрациям азотной кислоты до точки кипения (Perry et al., 2008).
Стеклянные облицовки устойчивы к: всем концентрациям HCl до 120°C, разбавленной серной кислоте до температуры кипения, концентрированной серной кислоте до 230°C и всем концентрациям азотной кислоты до точки кипения (Perry et al., 2008).
Пример 1
Пример задачи :
Хлорбензол получают путем взаимодействия жидкого бензола с газообразным хлором. Реакция протекает при 328К и 2,4 бар. Если оба сырья имеют температуру 293 К и атмосферное давление, какие материалы подходят для впускного трубопровода и реактора? (Адаптировано из Chemical Engineering Design (Towler et al., 2013)).
Как бензол, так и сухой хлор не вызывают коррозии, поэтому в качестве впускного трубопровода можно использовать углеродистую сталь. Обратите внимание, что если газообразный хлор на самом деле представляет собой влажный хлор, он становится очень коррозионным для большинства металлов, и, вероятно, следует использовать пластик. Хотя давление в реакторе выше атмосферного, оно значительно ниже максимально допустимого напряжения для всех распространенных материалов (Towler et al. , 2013). Однако побочным продуктом реактора является HCl, который вызывает коррозию. Вероятно, концентрация HCl будет недостаточно высока, чтобы вызвать коррозию материала, но это требует дальнейшего изучения. Если концентрация >50% либо в реакторе, либо позже в процессе, следует использовать другой материал, например пластик.
, 2013). Однако побочным продуктом реактора является HCl, который вызывает коррозию. Вероятно, концентрация HCl будет недостаточно высока, чтобы вызвать коррозию материала, но это требует дальнейшего изучения. Если концентрация >50% либо в реакторе, либо позже в процессе, следует использовать другой материал, например пластик.
Пример 2
При проектировании сосуда высокого давления необходимо учитывать коррозию. Толщина оборудования должна быть в состоянии справиться с износом в процессе эксплуатации предприятия. Как правило, толщина припуска на коррозию составляет около 1,5–5 мм (Towler et al., 2013).
Пример задачи :
Рассмотрим каталитический реактор с насадкой для реакции пропилена с пероксидом водорода с образованием оксида пропилена. Скорость подачи пропилена составляет 10 000 фунтов/ч при 60°C. Реактор изотермический и работает при давлении 500 psi. Катализатор имеет поверхностную плотность 0,25 узлов/нм 2 , площадь поверхности частиц 800 м 2 /г, плотность частиц 1 г/см 3 , диаметр 250 микрометров и доля пустот 0,4. Объем реактора 1,16 м 3 , диаметр 1 м, длина 2 м. На каждом конце слоя катализатора имеется запас по 0,5 м для внутренних устройств. Какова предполагаемая толщина стенки?
Объем реактора 1,16 м 3 , диаметр 1 м, длина 2 м. На каждом конце слоя катализатора имеется запас по 0,5 м для внутренних устройств. Какова предполагаемая толщина стенки?
Расчетное давление этого сосуда под давлением будет составлять 550 фунтов на квадратный дюйм при расчетной температуре 88 C. Из-за коррозионной среды перекиси водорода следует использовать нержавеющую сталь, а допуск на коррозию составляет 4 мм. Однако для определения необходимой толщины труб необходимо учитывать кольцевое напряжение и продольное напряжение.
Кольцевое напряжение можно рассчитать по уравнению
Pi = внутреннее давление, D = внутренний диаметр, S = максимально допустимое напряжение (найдено в литературных таблицах), E = эффективность сварного соединения (в зависимости от типа сварного шва). В этом примере окружное напряжение составляет 15,3 мм.
Продольное напряжение можно рассчитать по уравнению
Здесь продольное напряжение 7,5 мм
Кольцевое напряжение преобладает, так как оно больше расчетной толщины продольного напряжения, поэтому кольцевое напряжение, добавленное с допуском на коррозию = 15,3 мм + 4,00 мм = 19. 3 мм. Следовательно, толщина стенки должна быть 19,3 мм.
3 мм. Следовательно, толщина стенки должна быть 19,3 мм.
Пример 3
Пример задачи :
Химическая корпорация X (CCX) известна своим высокоэффективным и экономичным способом производства этилена. Из-за давления со стороны новых конкурентов на рынке группа исследований и разработок решает найти способы сократить расходы. Исследователь обнаруживает новый материал, который он называет Материалом Y. Его плотность составляет 16000 кг/м 3 с, а себестоимость производства составляет 2 доллара США за кг. Его максимально допустимое напряжение составляет 0,14 Н/мм 9 .0019 2 , который соответствует той марки нержавеющей стали, которую CCX использует для своих устаревших резервуаров для хранения. Стоит ли CCX использовать этот новый материал Y вместо покупки их обычного материала из нержавеющей стали для своих резервуаров для хранения? В настоящее время нержавеющая сталь закупается по цене 3,30 долл. США/кг, а ее плотность составляет 8000 кг/м 3 .
Не имея дополнительной информации, можно только провести начальное сравнение затрат. Вот для чего полезно уравнение рейтинга стоимости. Используя приведенное ниже уравнение (Towler et al., 2013):
Ввод информации из примера приводит к рейтингу стоимости 188 571 для нержавеющей стали и рейтингу стоимости 228 571 для материала Y. Материал Y примерно в 1,2 раза дороже нержавеющей стали при сравнении относительных рейтингов стоимости, несмотря на то, что материал Y ниже цена за килограмм. CCX должна придерживаться своей текущей марки нержавеющей стали для своих резервуаров для хранения.
Biegler LT, Grossmann IE, Westerberg AW. Систематические методы проектирования химических процессов. Река Аппер-Сэдл: Прентис-холл; 1997.
Каллистер В., Ретвиш Д. Материаловедение и инженерия. Уайли: Нью-Йорк, 2011.
Ассоциация развития меди Inc. Copper.org [Интернет]. Физические свойства медно-никелевых сплавов [2000]. Доступно по адресу: http://www. copper.org/applications/marine/cuni/properties/physical/
copper.org/applications/marine/cuni/properties/physical/
Сайт инженерного архива. Диаграмма напряжения-деформации. http://www.engineeringarchives.com/les_mom_stressstraindiagram.html.
Перри Р., Грин Д. Справочник инженера-химика Перри. 8-е изд. Нью-Йорк: Макгроу-Хилл; 2008.
Петерс М.С., Тиммерхаус К.Д. Проектирование и экономика предприятий для инженеров-химиков. 5-е изд. Нью-Йорк: Макгроу Хилл; 2003.
Промышленность нержавеющей стали Америки. Информационный центр нержавеющей стали [Интернет]. Связь между твердостью и прочностью [февраль 2013]. Доступна с:
http://www.ssina.com/overview/history.html
Таулер Г., Синнотт Р. Химическое проектирование: принципы, практика и экономика проектирования предприятий и процессов. 2-е изд. Бостон: Эльзевир; 2013.
Turton R, Bailie RC, Whiting WB, Shaewitz JA, Bhattacharyya D. Анализ, синтез и проектирование химических процессов. 4-е изд. Река Аппер-Сэдл: Прентис-Холл; 2012.
Ульрих, Г. Д. Руководство по проектированию и экономике процессов химического машиностроения. Уайли: Нью-Йорк, 1984.
Д. Руководство по проектированию и экономике процессов химического машиностроения. Уайли: Нью-Йорк, 1984.
VanAken D. Сайт промышленного отопления [Интернет]. Соотношение между твердостью и прочностью [обновлено 7 марта 2001 г .; цитируется 1 марта 2015 г.]. Доступно по адресу: http://www.industrialheating.com/articles/84495-engineering-concepts-relationship-between-hardness-and-strength?v=preview.
|
ПЕРЕХОДНЫЕ МЕТАЛЛЫ Док
Физические и химические свойства элементов из переходных металлов серии Все мои электронный документ
Используй свой Это БОЛЬШОЕ [ПОИСК
Субиндекс для этого GCSE / IGCSE TRANSITION 1. 2. 3. 4.
5.
6. Другие применения переходных металлов, их соединений и сплавов 7.
10.
Переходные металлы и использование в сверхпроводниках 11. См. GCSE / IGCSE / O Level множественный выбор QUIZ на переходе Продвинутые заметки по химии уровня A о 3D-блоке и переходных металлах Ключевые слова: Фактически 1 скандий и 10 1. Периодическая таблица
Основная структура периодической таблицы
Есть три важных химических характеристики
катализаторы .
валентности 90 163 (числовая степень объединения с другими элементами), дающая поднимаются до разных формул в сочетании с то же элемента.
температуры плавления по сравнению с другими металлами. Все эти четыре точки
НАВЕРХ СТРАНИЦЫ и
НАВЕРХ СТРАНИЦЫ и
3. Типичный
(3а) Немного общего
НАВЕРХ СТРАНИЦЫ и 4. Существует несколько важных химических
Переходные металлы имеют тенденцию образовывать более окрашенные
НАВЕРХ СТРАНИЦЫ и
4б. Немного
соль переходного металла ионизированный преципитативный
(1)
сульфат железа(II) +
или
хлорид железа(II) + Для (2) ион железа(III) Fe 3+ : хлорид железа (III) + натрий
ионное уравнение это… (3) сульфат меди(II) +
или
хлорид меди(II) + Для
2+ (водный) Обратите внимание, что медь
(4) сульфат цинка + натрий
Для этой реакции Zn(OH) 2(т) + 2OH (водн.) ==> Zn(OH) 4 ] 2 (водн.) кальциевая соль + гидроксид натрия соль алюминия + натрий
Есть подробнее Химическая Цветная природа многих
НАВЕРХ СТРАНИЦЫ и
5. Каталитические свойства 5а.
(в других + 2CO (г) ==> N 2(г) + 2CO 2(г) «гидрирование» в маргариновой промышленности. Катализирует присоединение водород в алкен углерод = двойная углеродная связь ( >C=C< + H 2 ==> >CHCH< ) Обратите внимание, что > и < просто указывают на другие связи из углерод.
5б. Некоторые соединения переходных металлов
==> вода + кислород
подготовка газообразного кислорода.
пентаоксид ванадия , V 2 O 5 ) используется в качестве катализатора для конверсии диоксида серы
==> 2SO 3(g) (через В 2 О 5 используемый химикат в промышленности.
НАВЕРХ СТРАНИЦЫ и
6. Введение в сплавы
СПЛАВ представляет собой смесь металла по крайней мере с одним иногда неметаллы) вместе, чтобы сделать сплавов , вы можете улучшить свойства металла чтобы лучше соответствовать конкретному цель. металлы скользят друг по другу при напряжении, поэтому металл жестче (см.
Металлическая конструкция для получения более подробной информации о свойствах металла и поведении сплава при стресс).  сплавов заключается в том, что вы можете создавать и пробовать самые разные композиции, пока не найдете ту, которая наилучшим образом соответствует требуемому назначение с точки зрения прочности на растяжение/сжатие, пластичности, электропроводность или коррозионная стойкость и т. д. Их сила и твердость делают их очень полезными в качестве конструкционные материалы . ЖЕЛЕЗО,
представляет собой сплав . Железо из В этом состоянии чугун Чугун твердый и может быть Однако, если все очень чистое железо слишком мягкое для любого Следовательно, сильный полезный Реальное значение сплавов например низкоуглеродистый строительство мостов, кузова автомобилей, железнодорожные пути и бесчисленное множество других объекты, которые должны иметь высокую прочность на растяжение. нержавеющая сталь По сравнению с самим железом столовые приборы из нержавеющей стали прочнее и не подвержены коррозии при контакте с пищей.  жидкости и вода для мытья посуды! сталь , не хрупкая, но более ковкая и коррозионностойкая чем чугун. Мягкая сталь используется для консервные банки, кузова автомобилей (но оцинковка и несколько углерод и обычно добавляются другие металлы . Есть огромные количество «рецептов» стали, которые могут быть изготовлены для конкретных целей с помощью изменение % углерода и добавление других металлов, например. титановая сталь для брони.
Помните! Если железо или сталь
ТИТАН
МЕДЬ,
НИКЕЛЬ
мельхиор ‘, ан привлекательный износостойкий «серебристый» металл для монет.
НИТИНИОЛ: Титан и никель являются основными компонентами «умных» сплавов Nitinol , которые очень
ЦИНК
стрессовые переломы ‘. Если
НАВЕРХ СТРАНИЦЫ и
7. Как насчет использования
Небольшая вставка для
Примечание по алюминию
LUMINIUM НЕ является переходным
Подробнее об КОРРОЗИЯ МЕТАЛЛА антикоррозийные свойства, алюминиевые сплавы используются в корпусе самолета строительная и прочая фурнитура, оконные и тепличные рамы, шасси Hi-Fi и т. д.
используется в радиаторах. также из-за его легкости, он используется в сочетании с медью (отлично электрический проводник) в воздушные линии электропередач (они не должны быть слишком тяжелыми при обледенении!).
Сталь или алюминий для
A ~50% смесь алюминия и
НАВЕРХ СТРАНИЦЫ и
8. НАЗАД К ПЕРЕХОДНЫМ МЕТАЛЛАМ Подробнее о чугуне и стали и примерах Железо можно изготовить
(2)
==> SiO 2 (3)
==> CaSiO 3 + CO 2 Реакции (1)(3) Расчетные количества Из-за высокого Экономика переработки
Различные стали для
==> M 2+ (водный) + 2e на минус М 2+ (водный) ==> М (с) Для серебра Любая проводка ( обычно Многие другие металлы имеют НАВЕРХ СТРАНИЦЫ и
9. Титан очень важно
Титан является переходным металлом Титановые сплавы Есть записка Используется в самолетах, в Является одним из основных Нитиноловые «умные» сплавы . Нитинол Титан добывается Рутил
После того, как оксид
TiCl 4 + Это примеры Комбинезон НАВЕРХ СТРАНИЦЫ и
10. Если вы охлаждаете Это называется
ПОЖАЛУЙСТА, ОБРАТИТЕ ВНИМАНИЕ, что эти ССЫЛКИ предназначены ТОЛЬКО для учащихся продвинутого уровня УРОВЕНЬ А ХИМИЯ НЕОРГАНИЧЕСКАЯ ХИМИЯ Часть 10 3d блок ПЕРЕХОДНЫЕ МЕТАЛЛЫ субиндекс: 10. [ПОИСК
Продвинутые заметки по химии уровня A о 3D-блоке и переходных металлах НАВЕРХ СТРАНИЦЫ и | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.5: Различия в физических и химических свойствах вещества
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47458
Цели обучения
Отделить физические свойства от химических.
Все вещества обладают физическими и химическими свойствами. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физическое свойство
Физическое свойство — это характеристика вещества, которую можно наблюдать или измерять без изменения идентичности вещества. Серебро — это блестящий металл, который очень хорошо проводит электричество. Из него можно формовать тонкие листы, это свойство называется пластичностью. Соль тусклая и ломкая и проводит электричество, когда она растворена в воде, что она делает довольно легко. К физическим свойствам вещества относятся цвет, твердость, ковкость, растворимость, электропроводность, плотность, температура плавления и температура кипения.
Из него можно формовать тонкие листы, это свойство называется пластичностью. Соль тусклая и ломкая и проводит электричество, когда она растворена в воде, что она делает довольно легко. К физическим свойствам вещества относятся цвет, твердость, ковкость, растворимость, электропроводность, плотность, температура плавления и температура кипения.
Для элементов цвет не сильно отличается от одного элемента к другому. Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный. Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
| Вещество | Плотность при 25°C (г/см3) |
|---|---|
| кровь | 1,035 |
| жировые отложения | 0,918 |
| цельное молоко | 1,030 |
| масло кукурузное | 0,922 |
| майонез | 0,910 |
| мед | 1,420 |
Твердость помогает определить, как можно использовать элемент (особенно металл). Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Рисунок \(\PageIndex{1}\): карандаш (слева) и кольцо с бриллиантом (справа). Оба являются формой углерода, но обладают очень разными физическими свойствами.
Точки плавления и кипения являются уникальными идентификаторами, особенно для соединений. Помимо получения некоторого представления об идентичности соединения, можно получить важную информацию о чистоте материала.
Химические свойства
Химические свойства вещества описывают его способность подвергаться некоторым химическим изменениям или реакциям в силу своего состава. Присутствующие элементы, электроны и связи придают материи потенциал для химических изменений. Довольно сложно определить химическое свойство, не используя слово «изменение». В конце концов, после изучения химии в течение некоторого времени, вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
В конце концов, после изучения химии в течение некоторого времени, вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Рисунок \(\PageIndex{2}\): Сильная ржавчина на звеньях цепи возле моста Золотые Ворота в Сан-Франциско; он постоянно подвергался воздействию влаги и солевых брызг, что приводило к разрушению поверхности, растрескиванию и отслаиванию металла. (CC BY-SA 3.0; Marlith).
Химическим свойством железа является его способность соединяться с кислородом с образованием оксида железа, химическое название ржавчины (Рисунок \(\PageIndex{2}\)). Более общим термином для ржавчины и других подобных процессов является коррозия. Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
| Физические свойства | Химические свойства |
|---|---|
| Металлический галлий плавится при 30 o C. | Железный металл ржавеет. |
| Ртуть — очень плотная жидкость. | Зеленый банан при созревании становится желтым. |
Золото блестит. | Горит сухой лист бумаги. |
Пример \(\PageIndex{1}\)
Какое из следующих химических свойств железа?
- Железо разъедает во влажном воздухе.
- Плотность = 7,874 г/см 3
- Железо в чистом виде мягкое.
- Железо плавится при 1808 К.
Раствор
«Железо разъедает во влажном воздухе» — единственное химическое свойство железа из списка.
Упражнение \(\PageIndex{1A}\)
Какое из перечисленных ниже физических свойств материи?
- коррозионная активность
- рН (кислотность)
- плотность
- воспламеняемость
- Ответить
- с
Упражнение \(\PageIndex{1B}\)
Какое из следующих свойств является химическим?
- воспламеняемость
- температура плавления
- точка кипения
- плотность
- Ответить
- и
Резюме
Физическое свойство – это характеристика вещества, которую можно наблюдать или измерять без изменения свойств вещества. Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СК-12
- Показать страницу TOC
- нет на странице
- Теги
- автор @ Генри Агнью
- автор@Marisa Alviar-Agnew
- химическое свойство
- физическое имущество
- источник@https://www.
 ck12.org/c/chemistry/
ck12.org/c/chemistry/
1.3: Свойства материи — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21693
↵
Цели обучения
- Отделить физические свойства и изменения от химических
Все вещества обладают физическими и химическими свойствами. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физические свойства могут быть экстенсивными или интенсивными. Экстенсивные свойства зависят от количества вещества и включают массу, вес и объем. Интенсивные свойства , напротив, не зависят от количества вещества; они включают цвет, температуру плавления, точку кипения, электрическую проводимость и физическое состояние при данной температуре. Например, элементарная сера представляет собой желтое кристаллическое твердое вещество, которое не проводит электричество и имеет температуру плавления 115,2 °C, независимо от того, какое количество исследуется (рис. \(\PageIndex{1}\)). Ученые обычно измеряют интенсивные свойства для определения идентичности вещества, в то время как экстенсивные свойства передают информацию о количестве вещества в образце.
Рисунок \(\PageIndex{1}\): Разница между экстенсивными и интенсивными свойствами материи. Поскольку они различаются по размеру, два образца серы имеют разные экстенсивные свойства, такие как масса и объем. Напротив, их интенсивные свойства, включая цвет, температуру плавления и электропроводность, идентичны.
Хотя масса и объем являются экстенсивными свойствами, их соотношение является важным интенсивным свойством, называемым плотностью (\(\rho\)). Плотность определяется как масса на единицу объема и обычно выражается в граммах на кубический сантиметр (г/см 3 ). По мере увеличения массы в данном объеме увеличивается и плотность. Например, свинец с его большей массой имеет гораздо большую плотность, чем тот же объем воздуха, точно так же, как кирпич имеет большую плотность, чем пенополистирол того же объема. При данной температуре и давлении плотность чистого вещества постоянна:
\[\begin{align*} \text{плотность} &={\text{масса} \over \text{объем}} \\[4pt] \rho &={m \over V} \label{Eq1} \end{выравнивание*} \]
Чистая вода, например, имеет плотность 0,998 г/см 3 при 25 °C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать» (рис. \(\PageIndex{2}\)).
Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать» (рис. \(\PageIndex{2}\)).
| Вещество | Плотность при 25 °C (г/см 3 ) | Вещество | Плотность при 25 °C (г/см 3 ) |
|---|---|---|---|
| кровь | 1.035 | кукурузное масло | 0,922 |
| жировые отложения | 0,918 | майонез | 0,910 |
| цельное молоко | 1. 030 030 | мед | 1.420 |
Рисунок \(\PageIndex{2}\): Вода и масло. Так как плотность масла меньше, чем у воды, оно всплывает на поверхность. (CC-BY SA 3.0; Виктор Блакус).
Физические свойства и изменения
Физические изменения — это изменения, при которых химические связи не разрываются и не образуются. Это означает, что те же типы соединений или элементов, которые были в начале изменения, остаются и в конце изменения. Поскольку конечные материалы такие же, как и начальные, свойства (такие как цвет, температура кипения и т. д.) также будут одинаковыми. Физические изменения связаны с перемещением молекул, но не с их изменением. Некоторые типы физических изменений включают в себя:
- Изменения состояния (переход из твердого состояния в жидкое или газообразное и наоборот)
- Разделение смеси
- Физическая деформация (порезы, вмятины, растяжения)
- Приготовление растворов (специальных видов смесей).

Когда кубик льда тает, его форма меняется, поскольку он приобретает способность течь. При этом его состав не меняется. Плавление является примером физического изменения (Рисунок \(\PageIndex{3}\)), поскольку меняются некоторые свойства материала, но не изменяется сущность материи. Физические изменения можно дополнительно классифицировать как обратимые и необратимые. Растаявший кубик льда можно снова заморозить, поэтому таяние является обратимым физическим изменением. Все физические изменения, связанные с изменением состояния, обратимы. Другие изменения состояния включают испарение (жидкость в газ), замерзание (жидкость в твердое) и конденсация (газ в жидкость). Растворение также является обратимым физическим изменением. Когда соль растворяется в воде, говорят, что соль перешла в водное состояние. Соль можно восстановить, выкипятив воду, оставив соль.
Рисунок \(\PageIndex{3}\): Таяние льда — это физическое изменение. Когда твердая вода (\(\ce{H_2O}\)) в виде льда превращается в жидкость (воду), она кажется измененной. Однако это изменение носит только физический характер, поскольку состав составляющих молекул остается тем же: 11.19.% водорода и 88,81% кислорода по массе.
Когда твердая вода (\(\ce{H_2O}\)) в виде льда превращается в жидкость (воду), она кажется измененной. Однако это изменение носит только физический характер, поскольку состав составляющих молекул остается тем же: 11.19.% водорода и 88,81% кислорода по массе.
Химические свойства и изменение
Химические изменения происходят при разрыве и/или образовании связей между молекулами или атомами. Это означает, что одно вещество с определенным набором свойств (таким как температура плавления, цвет, вкус и т. д.) превращается в другое вещество с другими свойствами. Химические изменения часто труднее обратить вспять, чем физические изменения.
Одним из хороших примеров химического изменения является сжигание бумаги. В отличие от процесса разрывания бумаги, процесс сжигания бумаги фактически приводит к образованию новых химических веществ (точнее, углекислого газа и воды). Другой пример химического изменения происходит при образовании воды. Каждая молекула содержит два атома водорода и один атом кислорода, химически связанные.
Другим примером химического изменения является то, что происходит, когда в вашей печи сжигается природный газ. На этот раз перед реакцией у нас есть молекула метана, \(\ce{CH_4}\), и две молекулы кислорода, \(\ce{O_2}\), а после реакции у нас есть две молекулы воды, \(\ce{H_2O}\) и одна молекула углекислого газа, \(\ce{CO_2}\). При этом изменился не только внешний вид, но и структура молекул. Новые вещества не обладают такими же химическими свойствами, как исходные. Следовательно, это химическое изменение.
Горение металлического магния также является химическим превращением (Магний + Кислород → Оксид магния):
\[\ce{2 Mg + O_2 \rightarrow 2 MgO } \nonumber \]
, как и ржавление железа (Железо + Кислород → Оксид железа/ Ржавчина):
\[\ce{4 Fe + 3O_2 \rightarrow 2 Fe_2O_3} \nonumber \]
Используя компоненты состава и свойства, мы имеем возможность отличить один образец вещества от другие.
Различные определения изменений: Различные определения изменений, YouTube(opens in new window) [youtu.







 В такой руде меди может содержаться до 80%.
В такой руде меди может содержаться до 80%. Если минерал содержит 25–35% нужно элемента, его сразу плавят без предварительного обжига.
Если минерал содержит 25–35% нужно элемента, его сразу плавят без предварительного обжига. науч. Доп. 3 , e1700782 (2017).
науч. Доп. 3 , e1700782 (2017). J. Fluorine Chem. 128 , 413–422 (2007).
J. Fluorine Chem. 128 , 413–422 (2007). Иерархические мезопористые структуры силиката кобальта как высокоэффективные сульфатно-радикальные на основе передовых катализаторов окисления. Дж. Коллоид. интерф. науч. 545 , 128–137 (2019).
Иерархические мезопористые структуры силиката кобальта как высокоэффективные сульфатно-радикальные на основе передовых катализаторов окисления. Дж. Коллоид. интерф. науч. 545 , 128–137 (2019). науч. Респ. 5 , e9153 (2015).
науч. Респ. 5 , e9153 (2015). Шпилька. Сур. науч. Катал. 113 , 219–224 (1998).
Шпилька. Сур. науч. Катал. 113 , 219–224 (1998). Заяв. Катал. A: Ген. 350 , 16–23 (2008).
Заяв. Катал. A: Ген. 350 , 16–23 (2008).
 .
. F (138 o C)
F (138 o C)  2 Пластмассы
2 Пластмассы , 2013)
, 2013)