Опишите физические свойства меди: а) меди; б) воды; в) соли.
Содержание
Вещества и их свойства — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. ВЕЩЕСТВА и их свойства
ЗАНЯТИЕ 1
ВЕЩЕСТВА
и их свойства
НИКИТИН СВЕТЛАНА ВЛАДИМИРОВАН
тело
•это физический (живой или неживой природы)
объект имеющий своё строение и свойства
•это то, из чего состоит физическое тело.
вещество
молекулы
атомы
• (новолат. molecula, уменьшительное от лат.
moles — масса) , наименьшая частица
вещества, обладающая его химическими
свойствами. молекулы
• (от др. -греч. ἄτομος — неделимый, неразрезаемый)
-греч. ἄτομος — неделимый, неразрезаемый)
— частица вещества микроскопических размеров и
массы, наименьшая часть химического элемента,
являющаяся носителем его свойств
3. вещества
природные
вещества
углекислый
газ, метан
простые
Образованы атомами одного
химического элемента, при
химических реакциях не могут
разлагаться с образованием
нескольких других веществ
Водород, кислород, сера
синтетические
Полипропилен,
полиэтилен
сложные
Образованы атомами разных
химических элементов при
химических реакциях могут
разлагаться с образованием
нескольких других веществ
Метан, вода, сульфат меди
4. Молекулы разных веществ
озон
кислород вода Н2О
О2
Простые вещества
Сложное
вещество
5. Физические свойства веществ
агрегатное состояние,
цвет,
запах,
блеск,
твёрдость,
пластичность,
хрупкость,
эластичность,
растворимость в воде,
плотность,
температуры кипения и плавления,
тепло – и электропроводность.
НИКИТИН СВЕТЛАНА ВЛАДИМИРОВАН
6. План описания физических свойств веществ
• 1. В каком агрегатном состоянии – газообразном, жидком или
твёрдом – находится вещество при данных условиях?
2. Какого цвета вещество? Имеет ли оно блеск?
3. Имеет ли вещество запах?
4. Проявляет ли вещество пластичность, хрупкость,
эластичность?
5. Растворяется ли вещество в воде?
6. Какова температура плавления и температура кипения
вещества? (См. справочники.)
7. Какова плотность вещества? (См. справочники.)
8. Обладает ли вещество тепло- и электропроводностью? (см.
справочники.)
http://rushim.ru/books/spravochniki/mishenko.pdf
http://chemister.ru/Database/Tables/mp.php
http://thermalinfo.ru/spravochniki-skachat/vargaftik-filippov-spravochnik-poteploprovodnosti-zhidkostej-i-gazov
7. 1. Выберите признаки для следующих веществ: МЕДЬ, ЖЕЛЕЗО, ГЛИНА. Мягкое, твердое, пластичное, ковкое, бесформенное, проводит
• Задания
1. Выберите признаки для следующих веществ: МЕДЬ,
ЖЕЛЕЗО, ГЛИНА. Мягкое, твердое, пластичное, ковкое,
Мягкое, твердое, пластичное, ковкое,
бесформенное, проводит ток, не проводит ток,
растворимо в воде, поддается обработке руками.
2. Опишите физические свойства уксусной кислоты,
сахара, соли, меди, алюминия стекло, полиэтилен,
железо по предложенному плану (информацию о данных
веществах
можно
брать
из
справочников).
веществ Агрегат
о
ное
состоян
ие
вода
Цвет,
блеск
Запах
Пластич
ность,
хрупкос
ть,
эластич
ность
Раствор
имость
Темпера Плотнос Тепло и
тура
ть
электро
плавлен
провод
ия ,
ность
кипения
явления
физические
Такие явления, при которых
данные вещества не
превращаются в другие, а
обычно изменяется их
агрегатное состояние или
форма (распространение
запаха, растворение)
Плавление стекла,
замерзание и испарение
воды
химические
Такие явления, в
результате которых из
данных веществ
образуются другие
Сгорание топлива,
гниение органических
веществ, ржавление
железа, скисание молока
Привести по три примера к каждому явлению
9.
 Химические свойства веществ или химические реакции
Химические свойства веществ или химические реакции
Изменение цветы
Выделение газа
Появление запаха
Образование осадка
Выделение тепла и света
10. Условия протекания химических реакций:
Соприкосновение веществ
Измельчение веществ
Нагревание веществ до определённой
температуры
Иногда присутствие веществ ускоряющих
протекание химической реакции
(катализатор) или замедления (ингибитор)
11. Экзо- и эндотермические химические реакции
• Экзотермическая реакция — химическая
реакция,
сопровождающаяся
выделением
теплоты.
+Q
Р-ция окисления
Эндотермическая реакция — химическая
реакция,
сопровождающаяся
поглощением
теплоты.
2h3 + O2 → 2 h3O – Q ( −483.6 кДж)
Р-ция соединения
• ru.wikipedia.org
• https://otvet.mail.ru/question/49165855
• https://yandex.ru/images/search?text=молек
ула%20воды%20фото&
English
Русский
Правила
Кристаллическая решетка — что это? Типы и свойства
Поможем понять и полюбить химию
Начать учиться
У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Важно!
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
прочность,
твердость,
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Лайфхак
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
небольшая твердость;
низкая прочность;
легкоплавкость;
летучесть;
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Тип решетки | Частицы в узлах решетки | Тип связи между частицами | Примеры веществ | Физические свойства веществ |
|---|---|---|---|---|
| Атомная | Атомы | Ковалентная связь | Твердые неметаллы: графит, кремний, бор, германий и другие. | При обычных условиях прочные и твердые, тугоплавкие, нерастворимые в воде, нелетучие. |
| Молекулярная | Молекулы | Силы притяжения между молекулами | Вещества, образующие маленькие молекулы (CO2, Cl2, H2O), благородные газы, органические вещества.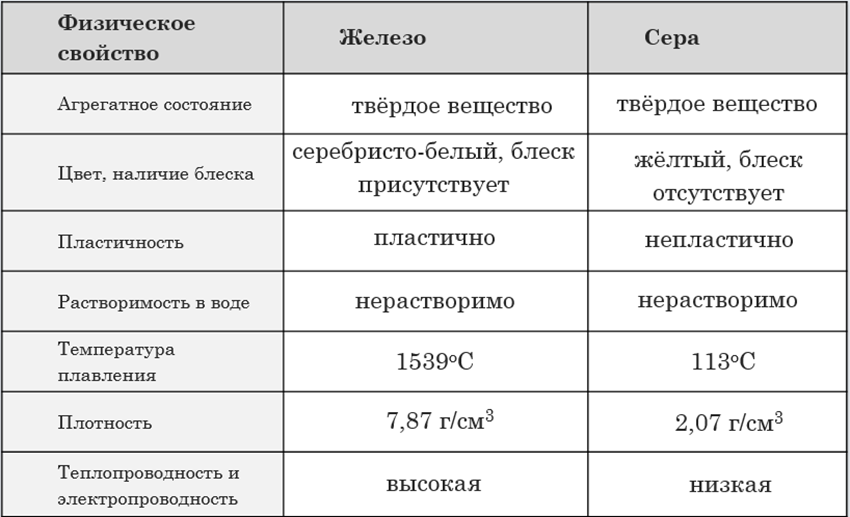 | При обычные условиях — газы или жидкости. Легкоплавкие, летучие, некоторые способны к возгонке. |
| Ионная | Ионы | Ионная связь | Соли, большая часть органических соединений, оксиды, щелочи. | Твердые, тугоплавкие, хрупкие, нелетучие, растворимы в воде, способны проводить электроток. |
| Металлическая | Атомы и ионы | Металлическая связь | Все металлы и сплавы. | Твердые (кроме ртути), ковкие, имеют блеск, отличаются теплопроводностью, электропроводностью. |
Строение и агрегатное состояние веществ
Выделяют три агрегатных состояния: твердое тело, жидкость и газ. Каждое из них предполагает определенное расположение частиц. Ниже мы расскажем подробнее, как связаны в химии кристаллическая решетка и агрегатное состояние вещества, а пока осветим общие закономерности.
Если частицы хаотично движутся, а расстояние между ними многократно превышает их собственные размеры — это газ. За счет большой удаленности друг от друга молекулы и атомы в таком веществе слабо взаимодействуют между собой.
Если частицы расположены все так же беспорядочно, но на небольшом расстоянии друг от друга — это жидкость. В жидком состоянии вещества его молекулы и атомы имеют более прочные связи, которые сложнее разорвать.
Если частицы собраны близко друг к другу и в определенном порядке — это твердое тело. В таком состоянии связи между ними наиболее прочны. Частицы могут двигаться только в пределах своего расположения и почти не перемещаются в пространстве.
Большинство веществ могут находиться и в твердом, и в жидком, и газообразном состоянии, а в зависимости от давления и температуры легко переходить из одного в другое. Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.
Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.
Как определить кристаллическую решетку
Как понятно из предыдущего материала, строение вещества, его состав и физические характеристики тесно связаны. Поэтому для определения вида кристаллической решетки можно руководствоваться теми данными, которые у нас есть. Как правило, известен состав вещества, а значит, мы можем сделать вывод о химических связях внутри его молекулы, что позволит в свою очередь предположить тип решетки.
Также можно провести быстрый анализ:
если это неметалл, который при комнатной температуре представляет собой твердое тело — скорее всего он имеет атомную решетку;
если в обычных условиях это жидкость или газ либо речь об органическом веществе — предполагаем молекулярную решетку;
если это соль либо щелочь — кристаллы имеют ионную решетку;
если это металл или сплав — решетка точно будет металлической.

Вопросы для самопроверки:
Назовите виды кристаллических решеток.
Чем отличается кристаллическая решетка от химической связи?
Назовите примеры веществ с металлической кристаллической решеткой, с ионной, атомной и молекулярной.
Выберите лишнее вещество: молекулярную кристаллическую решетку имеет вода, поваренная соль, аргон, криптон.
Какое строение вещества придает ему высокую электропроводность?
Какое строение кристалла может придать веществу способность к возгонке?
Яна Кононенко
К предыдущей статье
223.4K
Химическая связь
К следующей статье
Массовая доля
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Каковы физические и химические свойства меди, серебра и золота? — Найти 1 ответ и решение
Группа IB. Медь, серебро и золото
Медь, серебро и золото
Группа IB периодической таблицы содержит три химических элемента – медь Cu, серебро Ag и золото Au.
Атомы этих элементов имеют следующие конфигурации:
29Cu–1 s 22 s 22 p 63 s 23 p 9001 0 63 д 104 с 1[Ar]3d102 с 147Ag–1 s 22 s 22 p 63 s 23 p 63 d 104 s 24 9000 9 п 64 д 105 с 1[Кр]4 д 105 с 179Au–1 s 22 s 22 p 63 s 23 p 63 d 104 s 24 p 64 d 104 f 145 s 25 p 65 д 106 с 1[Xe]5 д 106 с 1
Содержание
Свойства элементов группы IB
Свойство
Медь
Серебро
Золото
Электронная конфигурация
[Ar] 3d102 s 1[Kr] 4 д 105 с 1[Xe] 5 d 106 s 1
Температура плавления, °С
124522003390
Температура кипения, °С
19624567560 0
Плотность, г/см3
8. 911.520.53
911.520.53
Энергия ионизации, кДж/моль
Электроотрицательность (шкала Полинга)
Стандартный потенциал (вольт),
M + + e– → M 0
Ковалентный радиус, Å
1,281.441,44
Ионный радиус, Å
0,961,661,37
Химические свойства меди
[Вверх] 90 003
Медь имеет две распространенные степени окисления: +1 и +2. Соединения меди преимущественно ионные и содержат Cu+ или Cu2+. Электронная конфигурация меди [Ar]3 d 104 s 1. Он теряет 4 s электронов, давая Cu+, и он также может потерять один из 3 d электронов, давая Cu2+.
Медь металл реагирует непосредственно с хлором и кислородом только при нагревании:
Сu + Cl2 CuCl2; 2Cu + O2 2CuO.
С разбавленными кислотами (кроме азотной) медь металлическая не реагирует.
Концентрированные серная и азотная кислоты реагируют с медью при нагревании:
Сu + 2h3SO4(конц. ) CuSO4 + SO2↑ + 2h3O;
) CuSO4 + SO2↑ + 2h3O;
3Cu + 8HNO3(дил) 3Cu(NO3)2 + 2NO↑ + 4h3O;
Cu + 4HNO3(конц.) Cu(NO3)2 + 2NO2↑ + 2h3O.
Степень окисления +1
При сильном нагревании CuO с медными опилками или медным порошком красный оксид меди(l), Cu2O, образует:
CuO + Cu Cu2O.
Черный сульфид меди(1), Cu2S, может быть получен простым нагреванием сульфида меди(11), CuS:
2CuS Cu2S + S.
Также можно получить путем нагревания необходимого количества меди и серы:
2Cu + S Cu2S.
Белый хлорид меди(I), CuCl, образуется при пропускании газообразного HCl над нагретой медью:
2Cu + 2HCl(g) 2CuCl + h3↑.
Иодид меди(l) может быть получен восстановлением Cu2+ с помощью I– по реакции:
2CuSO4 + 4KI → 2Cul↓ + l2 + 2K2SO4.
Иодид меди(l) нерастворим в воде. Единственными соединениями меди(l), которые можно получить в водном растворе, являются нерастворимые соединения, такие как Cul, поскольку Cu+ нестабилен в водном растворе; реагирует, давая Cu и Cu2+:
2CuCl → CuCl2 + Cu↓.
Степень окисления +2
При сильном нагревании меди на воздухе или в кислороде образуется черный оксид меди(II), CuO:
2Cu + O2 2CuO.
Может быть получен также нагреванием нитрата меди(II):
2Cu(NO3)2 2CuO + 4NO2↑ + O2↑.
Нитрат меди(II) может быть получен в виде синих гидратированных кристаллов Cu(NO3)2´6h3O путем выпаривания раствора, приготовленного путем растворения меди в азотной кислоте. Наиболее распространенная соль меди(II) – 9.0009 сульфат меди(II), CuSO4. Его можно получить реакцией CuO с разбавленной серной кислотой:
CuO + h3SO4 → CuSO4 + h3O.
Кристаллизуется из раствора в виде крупных голубых кристаллов гидрата CuSO4´5h3O. Четыре молекулы воды пентагидрата сульфата меди (II) связаны с Cu2+, а пятая связана водородной связью с ионом сульфата, а также с молекулами воды на ионе меди. Мы можем записать формулу как [Cu(h3O)4]SO4´h3O, чтобы лучше представить ее структуру. Белый CuSO4 образуется при сильном нагревании гидрата:
Белый CuSO4 образуется при сильном нагревании гидрата:
CuSO4´5h3O CuSO4 + 5h3O,
Называется безводным сульфатом меди(II). Его можно использовать для обнаружения небольших количеств воды в растворителях, таких как спирт и эфир; когда его добавляют к этим жидкостям, он становится синим, если присутствует вода, потому что образуется гидрат CuSO4´5h3O.
Сульфид меди(II) представляет собой черное твердое вещество, которое образуется при нагревании меди с избытком серы или при пропускании h3S в раствор соли Cu2+:
Cu + S CuS;
CuSO4 + h3S → CuS↓ + 2h3SO4.
Гидроксид меди(ll) образуется в виде бледно-голубого осадка при добавлении OH– к раствору соли Cu2+:
CuSO4 + 2KOH → Cu(OH)2 + K2SO4.
Этот осадок растворяется в водном растворе Nh4 , образуя темно-синий раствор иона тетрааминомеди(II), [Cu(Nh4)4]2+:
Cu(OH)2 + 4Nh5OH → [Cu(Nh4)4] (OH)2 + 4h3O,
, и в концентрированном растворе гидроксида натрия с получением темно-синего раствора иона тетрагидроксокупрата(II):
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4].
Если Cu(OH)2 нагревают, образуется черный CuO:
Cu(OH)2 CuO + h3O .
Ион Cu2+ образует стабильные хелаты с аминокислотами и этиленгликолем:
Химические свойства серебра
[Вверху]
Химически серебро малоактивно. Не растворяется в разбавленных кислотах, но растворяется в концентрированной азотной или серной кислоте:
Ag + 2h3SO4(конц.) Ag2SO4 + SO2↑ + 2h3O;
Ag + 2HNO3(конц.) AgNO3 + NO2↑ + h3O;
и не реагирует с кислородом или водой при обычных температурах.
Оксид серебра формируется в виде темно-коричневого осадка при добавлении OH– к раствору соли Ag+:
2AgNO3 + 2KOH → Ag2O↓ + 2KNO3 + h3O.
Растворяется в растворе гидроксида аммиака:
Ag2O + 4Nh5OH + h3O → 2[Ag(Nh4)2]OH + 4h3O.
Серебро образует нерастворимые в воде сульфид (черный цвет), хлорид (белый цвет), бромид (бело-желтый цвет) и йодид (желтый цвет):
AgNO3 + h3S → Ag2S↓ + 2HNO3;
AgNO3 + HCl → AgCl↓ + HNO3;
AgNO3 + HBr → AgBr↓ + HNO3;
AgNO3 + HI → AgI↓ + HNO3.
Хлорид, бромид и йодид серебра растворяют в растворе тиосульфата натрия:
AgCl( s ) + 2Na2S2O3 → Na3[Ag(S2O3)2]( aq ) + NaCl;
AgBr( с ) + 2Na2S2O3 → Na3[Ag(S2O3)2]( водный раствор ) + NaBr;
AgI( с ) + 2Na2S2O3 → Na3[Ag(S2O3)2]( водный раствор ) + NaI.
Ион Ag+ является окислителем и реагирует с формальдегидом (HCHO) или глюкозой (C6h22O6) (реакция серебряного зеркала):
HCHO + 2[Ag(Nh4)2]OH → HCOOH + 2Ag↓ + 4Nh4↑ + h3O ;
C6h22O6 + 2[Ag(Nh4)2]OH → C6h22O7 + 2Ag↓ + 4Nh4↑ + h3O.
Химические свойства золота
[Вверх]
Золото чрезвычайно неактивно и в соединениях имеет две распространенные степени окисления: +1 и +3.
Не подвержен воздействию воздуха, тепла, влаги и большинства растворителей. Однако растворяется в водном растворе, содержащем хлор и соляную кислоту:
Au + 3Cl + HCl → H[AuCl4].
Растворяется в некоторых окисляющих смесях, таких как цианид-ион с кислородом:
4Au + O2 + 8NaCN + 2h3O → 4Na[Au(CN)2] + 4NaOH,
и в царская водка (смесь соляной и азотные кислоты):
Au + HNO3 + 4HCl → H[AuCl4] + NO↑ + 2h3O.
Оксид и гидроксид золота (III) являются амфотерными соединениями:
Au(OH)3 + NaOH → Na[Au(OH)4];
Au(OH)3 + 4HNO3 → H[Au(NO3)4] + 3h3O.
Ион Au3+ является сильным окислителем, например:
3Na2[Sn(OH)4] + 2AuCl3 + 6h3O → 3Na[Sn(OH)6] + 2Au↓ +6HCl .
1.3 Физические и химические свойства – Химия
Цели обучения
К концу этого раздела вы сможете:
- Определять физические или химические свойства и изменения материи
- Определите свойства материи как экстенсивные или интенсивные
Характеристики, позволяющие отличать одно вещество от другого, называются свойствами. А физическое свойство характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. А физическое изменение — изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (тождества веществ, содержащихся в материи). Мы наблюдаем физические изменения, когда воск плавится, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 1). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. А физическое изменение — изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (тождества веществ, содержащихся в материи). Мы наблюдаем физические изменения, когда воск плавится, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 1). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Рисунок 1. (a) Воск претерпевает физические изменения при нагревании твердого воска и образует жидкий воск. (b) Конденсация пара внутри кастрюли представляет собой физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит a: модификация работы «95jb14»/Wikimedia Commons; кредит b: модификация работы mjneuby/Flickr)
(b) Конденсация пара внутри кастрюли представляет собой физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит a: модификация работы «95jb14»/Wikimedia Commons; кредит b: модификация работы mjneuby/Flickr)
Превращение одного типа материи в другой вид (или неспособность к изменению) является химическим свойством . Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. 2). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Рис. 2. (а) Одним из химических свойств железа является то, что оно ржавеет; б) одно из химических свойств хрома состоит в том, что он этого не делает. (кредит а: модификация работы Тони Хигетта; кредит б: модификация работы «Атома»/Wikimedia Commons)
Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, реакция меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 3).
Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, реакция меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 3).
Рисунок 3. (a) Медь и азотная кислота подвергаются химическому превращению с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза спички и кислород воздуха претерпевают химические изменения с образованием углекислого газа и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Потемнение банана в коричневом цвете — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
(c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Потемнение банана в коричневом цвете — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
Свойства материи попадают в одну из двух категорий. Если свойство зависит от количества присутствующей материи, то это экстенсивное свойство . Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца материи не зависит от количества присутствующей материи, то это интенсивное имущество . Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на вашу руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на вашу руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Опасный алмаз
Возможно, вы видели символ, показанный на рис. 4, на контейнерах с химическими веществами в лаборатории или на рабочем месте. Этот алмаз химической опасности, который иногда называют «огненным бриллиантом» или «алмазом опасности», предоставляет ценную информацию, которая кратко суммирует различные опасности, о которых следует помнить при работе с конкретным веществом.
Рис. 4. Алмаз опасности Национального агентства по противопожарной защите (NFPA) обобщает основные опасности химических веществ.
Система идентификации опасностей 704 Национального агентства противопожарной защиты (NFPA) была разработана NFPA для предоставления информации о безопасности определенных веществ. Система подробно описывает воспламеняемость, реакционную способность, опасность для здоровья и другие опасности. В общем ромбовидном символе верхний (красный) ромб указывает уровень пожароопасности (температурный диапазон температуры вспышки). Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Хотя многие элементы резко различаются по своим химическим и физическим свойствам, некоторые элементы обладают сходными свойствами. Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, тогда как другие являются плохими проводниками. Эти свойства можно использовать для разделения элементов на три класса: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы со сходными свойствами расположены близко друг к другу (рис. 4). Вы узнаете больше о периодической таблице, когда продолжите изучение химии.
Рисунок 4. Таблица Менделеева показывает, как элементы могут быть сгруппированы в соответствии с некоторыми сходными свойствами. Обратите внимание, что цвет фона обозначает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли он твердым, жидким или газообразным.
