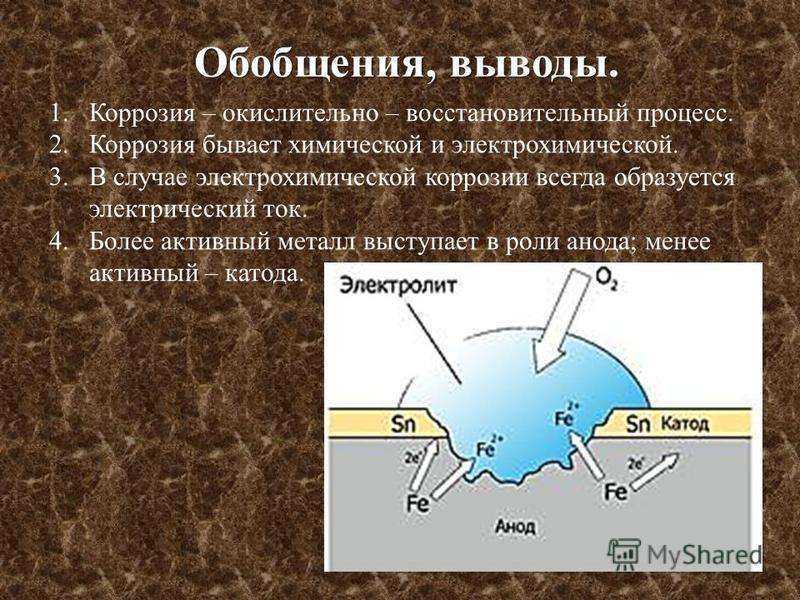
Признаки ржавления железа: Признаки химических реакций — урок. Химия, 8 класс.
Содержание
Признаки химических реакций | Образовательная социальная сеть
Урок-лабораторная работа в 8 классе
«Признаки химических реакций»
ХОД УРОКА:
В природе с момента ее зарожденья
Всегда с веществами идут превращенья.
Про эти природные измененья
Мы с вами сказали бы: “Это явленья!”
Явленья бывают различными,
Рассмотрим химические и физические.
Должны научиться мы их наблюдать,
А самое главное их различать!
ДЕМОНСТРАЦИОННЫЙ ЭКСПЕРИМЕНТ: ГОРЕНИЕ БУМАГИ И РЖАВЫЙ ГВОЗДЬ.
УЧИТЕЛЬ. Какие явления, происходящие с веществами, вам известны? Какие явления называются физическими? Приведите примеры физических явлений.
УЧЕНИК. Физическими явлениями называются изменения, при которых новые вещества не образуются. Переход воды в пар при нагревании, вытягивание кусочка меди в проволоку относятся к физическим явлениям.
УЧИТЕЛЬ. Какие изменения происходят с веществами при физических явлениях?
УЧЕНИК. При физических явлениях происходит изменение агрегатного состояния вещества, формы, размера тел. Физические явления — это явления: происходящие с веществами с сохранением их молекул, при которых данные вещества не превращаются в другие, а обычно изменяется только агрегатное состояние;
Физические явления — это явления: происходящие с веществами с сохранением их молекул, при которых данные вещества не превращаются в другие, а обычно изменяется только агрегатное состояние;
УЧИТЕЛЬ. Какие явления называются химическими? Приведите примеры химических явлений.
УЧЕНИК. Химическими называются явления, при которых исходные вещества (реагенты) превращаются в другие вещества (продукты реакции). К таким явлениям относятся: ржавление железа, скисание молока и множество других.
Химические явления — это явления, происходящие с веществами с разрушением молекул , в результате которых из одних веществ образуются другие.
А теперь попробуем применить полученные знания для выполнения следующего задания: укажите, о каких явлениях, физических или химических, идет речь в высказываниях поэтов:
• Унылая пора! Очей очарованье!
Приятна мне твоя прощальная краса –
Люблю я пышное природы увяданье,
В багрец и золото одетые леса!
А.С.Пушкин
• И трещат сухие сучья,
Разгораясь жарко,
Освещая тьму ночную
Далеко и ярко!
И. Суриков
Суриков
• В декабре, в декабре
Все деревья в серебре,
Нашу речку, словно в сказке,
За ночь вымостил мороз…
С.Я.Маршак
•…А если медь в печи нагреть,
То станет тяжелее медь
С окалиною вместе.
Не верите – так взвесьте…
Е.Ефимовский
• Что за звездочки резные
На пальто и на платке?
Все сквозные, вырезные,
А возьмешь – вода в руке?
Е.Благинина
При изучении химии нас конечно же будут интересовать явления химические. Ежеминутно в мире протекает миллионы химических реакций – в нашем желудке, когда мы едим, в выпекающемся пироге или в двигателе автомобиля. Но как определить происходит химическая реакция или нет?
При химических процессах происходит превращение одних веществ в другие, которые обладают новыми свойствами, которыми не обладали исходные вещества. Эти превращения сопровождаются яркими и наглядными изменениями. Эти наглядные изменения называются признаки.
На ваших столах имеются инструкции по выполнению лабораторной работы и необходимый набор реактивов. Перед выполнением опытов я напоминаю о необходимости соблюдения правил техники безопасности:
Перед выполнением опытов я напоминаю о необходимости соблюдения правил техники безопасности:
- При выполнении опытов следует соблюдать осторожность.
2) Не разбрызгивайте и не разливайте реактивы.
3) Работу выполняйте только над подносом.
4) Не направляйте пробирку на себя или на соседа.
5) Свое рабочее место оставляйте чистым.
Лабораторные опыты:
1) Взаимодействие мела с серной кислотой.
На кусочек мела капните 2-3 капли раствора серной кислоты. Что вы наблюдаете? Что является признаком данной реакции?
Давайте составим уравнение этого превращения.
CaCO3 + h3SO4 = CaSO4 + h3О + СO2↑
Почему дрожжевое тесто «пыхтит» в кастрюле? А когда его обминают, то появляется писк? Это тоже признак того, что протекает химическая реакция. При брожении дрожжей образуется углекислый газ, происходит образование нового вещества.
- Взаимодействие хлорида бария с сульфатом натрия.

В пробирку с хлоридом бария добавьте 2-3 капли раствора сульфата натрия. Что вы наблюдаете? Что является признаком данной реакции?
Давайте составим уравнение этого превращения.
BaCl2 + Na2SO4 = BaSO4 + 2 NaCl
- Взаимодействие FeCl3 c KCNS.
В пробирку с хлоридом железа (III) добавьте 2 капли роданида калия KCNS. Что вы наблюдаете? Что является признаком данной реакции?
Давайте составим уравнение этого превращения.
FeCl3 + 3KNCS = Fe(CNS)3 + 3KCl
- Взаимодействие гидроксида натрия с фенолфталеином.
В пробирку с гидроксидом натрия добавьте 2 капли фенолфталеина. Что вы наблюдаете? Что является признаком данной реакции?
ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ:
- Выделение газа
- Образование осадка
- Изменение окраски
- Появление запаха
- Выделение или поглощение энергии (в виде света или тепла).
ВИРТУАЛЬНАЯ ЛАБОРАТОРИЯ.
ДОМАШНЕЕ ЗАДАНИЕ:
- Физическое или химическое явление?
• кипение воды;
• образование на деревьях инея;
• скисание молока;
• ржавление гвоздя;
• таяние льда;
• горение бенгальских огней;
• гниение растений;
• приготовление сахарного сиропа;
• приготовление сахарной пудры из сахара;
• горение свечи;
- почернение медной пластинки при нагревании;
- измельчение сахара в ступке.

2) Физические явления — это явления:
А) происходящие с веществами в разные времена года;
Б) происходящие с веществами с разрушением молекул;
В) при которых данные вещества не превращаются в другие, а обычно изменяется только их агрегатное состояние;
Г) в результате которых из одних веществ образуются другие.
3) Признаком химических реакций не является:
А) появление запаха;
Б) изменение объёма;
В) изменение цвета;
Г) выделение света и тепла.
- В крепко заваренный свежий чай в стакане опустите кусочек лимона или несколько кристаллов лимонной кислоты. Что наблюдаете?
5) Немного лимонной кислоты на кончике чайной ложки растворите в воде, а затем добавьте в полученный раствор столько же пищевой (питьевой) соды. Что наблюдаете?
Лабораторная работа по химии
Ученика(цы) 8 класса
_________________________________________________________
ФИО
ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ
В природе с момента ее зарожденья
Всегда с веществами идут превращенья.
Про эти природные измененья
Мы с вами сказали бы: “Это явленья!”
Явленья бывают различными,
Рассмотрим химические и физические.
Должны научиться мы их наблюдать,
А самое главное их различать!
Физические явления — это явления, происходящие с веществами с сохранением их молекул, при которых данные вещества не превращаются в другие, а обычно изменяется только их агрегатное состояние.
Химические явления — это явления, в результате которых из одних веществ образуются другие.
ЗАДАНИЕ: укажите, о каких явлениях, физических или химических, идет речь в высказываниях поэтов:
• Унылая пора! Очей очарованье!
Приятна мне твоя прощальная краса –
Люблю я пышное природы увяданье,
В багрец и золото одетые леса! (А.С.Пушкин)
• И трещат сухие сучья,
Разгораясь жарко,
Освещая тьму ночную
Далеко и ярко! (И.Суриков)
• В декабре, в декабре
Все деревья в серебре,
Нашу речку, словно в сказке,
За ночь вымостил мороз. .. (С.Я.Маршак)
.. (С.Я.Маршак)
•…А если медь в печи нагреть,
То станет тяжелее медь
С окалиною вместе.
Не верите – так взвесьте… (Е.Ефимовский)
• Что за звездочки резные
На пальто и на платке?
Все сквозные, вырезные,
А возьмешь – вода в руке? (Е.Благинина)
При химических процессах происходит превращение одних веществ в другие, которые обладают новыми свойствами, которыми не обладали исходные вещества. Эти превращения сопровождаются яркими и наглядными изменениями. Эти наглядные изменения называются признаки химических реакций.
ПРИ ВЫПОЛНЕНИИ ЛАБОРАТОРНОЙ РАБОТЫ ПОМНИ О СЛЕДУЮЩИХ ПРАВИЛАХ:
- При выполнении опытов следует соблюдать осторожность.
2) Не разбрызгивайте и не разливайте реактивы.
3) Работу выполняйте только над подносом.
4) Не направляйте пробирку на себя или на соседа.
5) Свое рабочее место оставляйте чистым.
I. Взаимодействие мела с серной кислотой.
На кусочек мела капните 2-3 капли раствора серной кислоты. Что вы наблюдаете? Что является признаком данной реакции?
Уравнение реакции:
Признаком реакции является:_____________________________
II. Взаимодействие хлорида бария с сульфатом натрия.
В пробирку с хлоридом бария добавьте 2-3 капли раствора сульфата натрия. Что вы наблюдаете? Что является признаком данной реакции?
Уравнение реакции:
Признаком реакции является:_____________________________
III. Взаимодействие FeCl3 c KCNS.
В пробирку с хлоридом железа (III) добавьте 2 капли роданида калия KCNS. Что вы наблюдаете? Что является признаком данной реакции
Уравнение реакции:
Признаком реакции является:_____________________________
IV. Взаимодействие гидроксида натрия с фенолфталеином.
В пробирку с гидроксидом натрия добавьте 2 капли фенолфталеина. Что вы наблюдаете? Что является признаком данной реакции?
Признаком реакции является:_____________________________
ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ
1)
2)
3)
4)
5)
ДОМАШНЕЕ ЗАДАНИЕ:
- Физическое или химическое явление?
• кипение воды;
• образование на деревьях инея;
• скисание молока;
• ржавление гвоздя;
• таяние льда;
• горение бенгальских огней;
• гниение растений;
• приготовление сахарного сиропа;
• приготовление сахарной пудры из сахара;
• горение свечи;
- почернение медной пластинки при нагревании;
- измельчение сахара в ступке.

2) Физические явления — это явления:
А) происходящие с веществами в разные времена года;
Б) происходящие с веществами с разрушением молекул;
В) при которых данные вещества не превращаются в другие, а обычно изменяется только их агрегатное состояние;
Г) в результате которых из одних веществ образуются другие.
3) Признаком химических реакций не является:
А) появление запаха;
Б) изменение объёма;
В) изменение цвета;
Г) выделение света и тепла.
4) В крепко заваренный свежий чай в стакане опустите кусочек лимона или несколько кристаллов лимонной кислоты. Что наблюдаете?
5) Немного лимонной кислоты на кончике чайной ложки растворите в воде, а затем добавьте в полученный раствор столько же пищевой (питьевой) соды. Что наблюдаете?
Почему ржавеет гвоздь? | Наука и жизнь
Ржавый гвоздь, ржавый мост, ржавый забор, ржавый корабль. Почему всё железное ржавеет и что же такое ржавчина?
Алюминиевая руда — боксит — состоит из гидроксидов алюминия, оксидов железа и кремния. Внешне она совершенно не похожа на алюминий
Внешне она совершенно не похожа на алюминий
Фото Натальи Домриной.
Коррозия в сочетании с ошибками в конструкции привели к разрушению моста через реку Миссисипи в штате Миннесота (США) в августе 2007 года.
Даже к такому простому делу, как мытьё раковины, надо подходить с умом. Обширная питтинговая и язвенная коррозия кухонной мойки из нержавеющей стали вызвана неправильным подбором чистящих средств, которые содержат соединения хлора.
Коррозионное растрескивание нижней части корпуса стало причиной крушения самолёта «Боинг-737» компании «Элоу Эйрлайн» в апреле 1988 года.
‹
›
Открыть в полном размере
Давайте вспомним, откуда берётся железо или, например, алюминий. Правильно, их выплавляют из руды — железной, марганцевой, магниевой, алюминиевой и др. Металлы в рудах содержатся в основном в виде оксидов, гидроксидов, карбонатов, сульфидов, то есть в виде химических соединений с кислородом, водой, серой и пр.
В природе в металлическом, или свободном, состоянии в основном можно встретить лишь золото, платину, иногда серебро. Эти металлы устойчивы, то есть не стремятся (или слабо стремятся) образовывать химические соединения. Наверное, по этой причине они получили название благородных.
Эти металлы устойчивы, то есть не стремятся (или слабо стремятся) образовывать химические соединения. Наверное, по этой причине они получили название благородных.
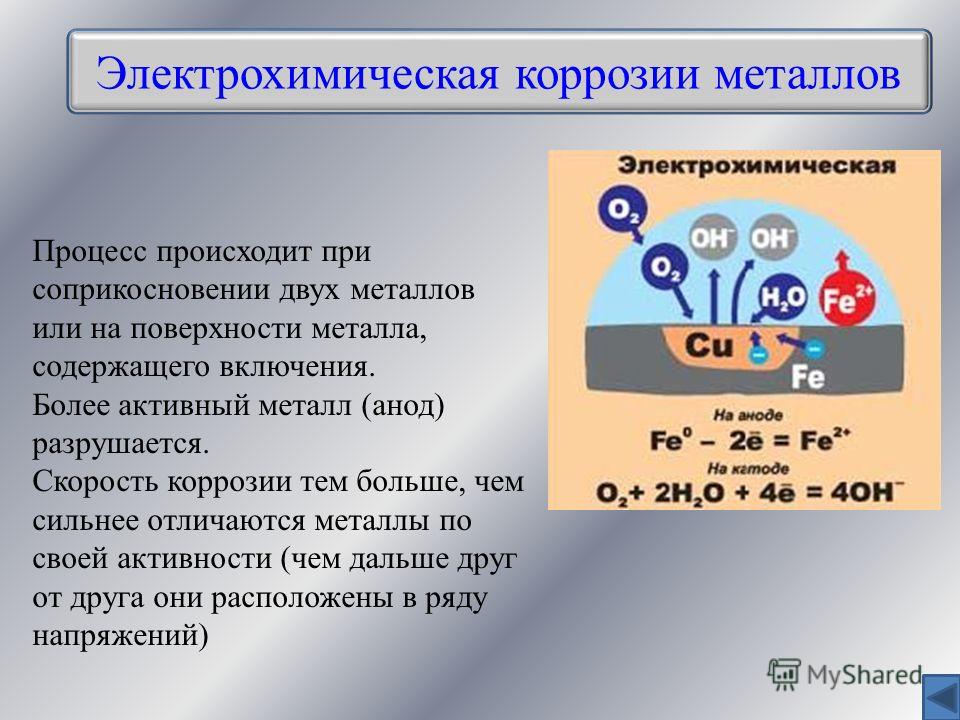
Что же до подавляющего большинства металлов, то, чтобы они находились в свободном состоянии, их надо восстановить из природных рудных соединений, то есть выплавить. Выходит, выплавляя металл, мы переводим его из устойчивого состояния в неустойчивое. Вот он и стремится вернуться в исходное состояние — окислиться. Это и есть коррозия — естественный для металлов процесс разрушения при взаимодействии с окружающей средой. Частный случай коррозии — ржавление — образование на железе гидроксида железа Fe(ОН)3. Этот процесс может протекать только в присутствии влаги (воды или водяных паров).
Но почему же тогда не рушатся в одночасье мосты, не рассыпаются мгновенно самолёты и автомобили? Да и кастрюльки со сковородками не превращаются на наших глазах в рыжий, чёрный или серый порошок. К счастью, реакции окисления металлов протекают не столь стремительно. Как и любой процесс, они идут с определённой скоростью, порою очень небольшой. Более того, есть много способов замедлить коррозию.
Как и любой процесс, они идут с определённой скоростью, порою очень небольшой. Более того, есть много способов замедлить коррозию.
Плечо друга
Вы замечали, что на нержавеющей стали не бывает ржавчины, хотя её основу составляет то же самое железо, которое при окислении (в присутствии воды или водяного пара) превращается в рыжий мохнатый гидроксид. Тут есть одна хитрость: нержавеющая сталь — это сплав железа с другими металлами. Введение в металлические сплавы элементов для придания им тех или иных свойств называется легированием.
Основной легирующий элемент, который добавляют к обычной (углеродистой) стали, чтобы получить нержавеющую, — хром. Этот металл тоже стремится окислиться, что он с успехом и делает гораздо охотнее и быстрее, чем само железо. При этом на поверхности нержавеющей стали быстро образуется плёнка из оксида хрома. В отличие от рыхлой ржавчины компактный тёмный оксид хрома не даёт агрессивным ионам окружающей среды проникать к поверхности металла, то есть оксид попросту прикрывает собой металл, и процесс коррозии прекращается. Такие оксидные плёнки называются защитными. В нержавеющих сталях хрома должно быть строго определённое количество, но не менее 13%. Кроме хрома в нержавеющие стали часто добавляют никель, молибден, ниобий и титан.
Такие оксидные плёнки называются защитными. В нержавеющих сталях хрома должно быть строго определённое количество, но не менее 13%. Кроме хрома в нержавеющие стали часто добавляют никель, молибден, ниобий и титан.
Благодаря защитным плёнкам многие металлы неплохо выдерживают воздействие различных сред. Возьмём, к примеру, алюминиевую кастрюльку, в какой кипятят молоко или варят манную кашу. Обычно такая кастрюлька не блестит, подобно хрому или нержавеющей стали, и имеет слегка белёсый цвет. Дело в том, что на алюминии, как и на других металлах, на воздухе всегда образуется белёсая оксидная плёнка (оксид алюминия), которая отлично защищает металл от коррозии. Такие плёнки называются пассивными, а металлы, на которых они самопроизвольно образуются, — пассивирующимися. Если же алюминиевую кастрюльку почистить металлической щёткой, налёт исчезнет и появится металлический блеск. Но очень быстро поверхность вновь покроется плёнкой оксида алюминия и станет белёсой.
Укрощение активных
Перевести металл в пассивное состояние можно принудительным образом. Например, железо помимо незащитных гидроксида железа или же низших оксидов (закиси и закиси-окиси) при определённых условиях образует высший оксид — окись железа (Fe2О3). Этот оксид неплохо защищает металл и его сплавы при высоких температурах на воздухе, он же (одна из его форм) «ответственен», как считают специалисты, за пассивное состояние железных сплавов во многих водных средах.
Например, железо помимо незащитных гидроксида железа или же низших оксидов (закиси и закиси-окиси) при определённых условиях образует высший оксид — окись железа (Fe2О3). Этот оксид неплохо защищает металл и его сплавы при высоких температурах на воздухе, он же (одна из его форм) «ответственен», как считают специалисты, за пассивное состояние железных сплавов во многих водных средах.
Устойчивость нержавеющей стали в крепкой серной кислоте связана именно с пассивированием стали в этой весьма агрессивной среде. Если же поместить нержавейку в слабый раствор серной кислоты, сталь начнёт корродировать. Парадокс объясняется просто: крепкая серная кислота обладает сильными окислительными свойствами, благодаря чему на поверхности нержавеющей стали образуется пассивирующая плёнка, а в слабой кислоте не образуется.
В случаях, когда агрессивная среда недостаточно «окислительная», используют специальные химические добавки, помогающие образованию на поверхности металла пассивной плёнки. Такие добавки называют ингибиторами или замедлителями коррозии.
Такие добавки называют ингибиторами или замедлителями коррозии.
Не все металлы способны образовывать пассивные плёнки, даже принудительно. В этом случае добавление в агрессивную среду ингибитора, напротив, удерживает металл в «восстановительных» условиях, в которых его окисление подавляется (оно энергетически невыгодно).
Жертвоприношение
Искусственно поддерживать металл в «восстановительных» условиях можно и иным способом, ведь не всегда есть возможность добавить ингибитор. Возьмём, к примеру, обычное оцинкованное ведро. Оно сделано из углеродистой стали, а сверху покрыто слоем цинка. Цинк — более активный металл, чем железо, значит, он охотнее вступает в химические реакции. Поэтому цинк не просто механически изолирует стальное ведро от окружающей среды, но и «принимает огонь на себя», то есть корродирует вместо железа.
Похожим способом нередко защищают днища кораблей. Только их не покрывают сплошным слоем цинка, марганца или алюминия — это было бы очень дорого да и сложно, а прикрепляют к днищу солидный кусок более активного металла (протектора). В итоге протектор разрушается, а днище корабля остаётся целым и невредимым.
В итоге протектор разрушается, а днище корабля остаётся целым и невредимым.
Для подземных коммуникаций «восстановительные» условия создают с помощью электрохимической защиты: накладывают на защищаемый металл отрицательный (катодный) потенциал от внешнего источника тока, так что на металле прекращается процесс окисления.
Однако зачем нужно столько разных сложных способов защиты металлов? Разве нельзя просто покрасить металл или нанести на него эмаль?
Во-первых, всё покрасить невозможно. А во-вторых… Возьмём для примера эмалированную кастрюлю или автомобиль. Если кастрюля, вырвавшись из рук, с грохотом упадёт на пол и отшибёт себе эмалированный бочок, то под отколовшейся эмалью будет зиять «чёрный глаз», края которого постепенно окрасятся в предательский рыжий цвет — скол покроется ржавчиной. Не лучшая судьба ждёт и автомобиль, если вдруг в его лаковом боку (а чаще на стыке с днищем) образуется небольшая дырочка в слое лака. Этот канал поступления к корпусу агрессивных агентов — воды, кислорода воздуха, сернистых соединений, соли — немедленно заработает, и корпус начнёт ржаветь. Вот и приходится владельцам автомобилей делать дополнительную антикоррозионную обработку.
Вот и приходится владельцам автомобилей делать дополнительную антикоррозионную обработку.
Невидимый злодей
Так, может, проблема коррозии металлов решена? Увы, не всё так просто. Любые коррозиестойкие сплавы устойчивы только в определённых средах и условиях, для которых они разработаны. Например, большинство нержавеющих сталей отлично выдерживают кислоты, щёлочи и очень «не любят» хлориды, в которых они часто подвергаются местным видам коррозии — язвенной, точечной и межкристаллитной. Это очень коварные коррозионные разрушения. Конструкция из красивого, блестящего металла без намёка на ржавление может однажды рухнуть или рассыпаться. Всё дело в мельчайших точечных, но очень глубоких поражениях. Или же в микротрещинах, не видимых глазом на поверхности, но пронизывающих буквально всю толщу металла. Не менее опасно для многих сплавов, не подверженных общей коррозии, так называемое коррозионное растрескивание, когда внезапно конструкцию пронизывает огромная трещина. Такое случается с металлами, испытывающими длительные механические нагрузки — в самолётах и вертолётах, в различных механизмах и строительных конструкциях.
Такое случается с металлами, испытывающими длительные механические нагрузки — в самолётах и вертолётах, в различных механизмах и строительных конструкциях.
Крушение поездов, падение самолётов, разрушение мостов, выбросы газа и разливы нефти из трубопроводов — причиной подобных катастроф нередко становится коррозия. Чтобы её укротить, предстоит ещё много узнать о сложнейших природных процессах, происходящих вокруг нас.
Примеры возникновения и течения химических реакций. Классификация химических реакций
Часть I
1. Химические явления, или химические реакции, — это
явления, при которых происходит превращения одних веществ в другие.
2. Образование новых веществ сопровождается появлением новых признаков или
свойств
, характеризующих эти вещества, что можно зафиксировать с помощью органов чувств, т.е. заметить
признаки
химических реакций.
3. Заполните таблицу «Признаки химических реакций».
4. Классификация реакций по признаку выделения или поглощения теплоты.
5. Условия течения химических реакций:
— соприкосновение реагирующих веществ;
— первоначальное нагревание для некоторых экзотермических реакций;
— постоянное нагревание для эндотермических реакций.
Часть II
1. В каком случае можно говорить, что протекает химическая реакция?
1) В пробирку с раствором щёлочи приливают индикатор фенолфталеин.
3) В пробирку с раствором щёлочи приливают индикатор метиловый оранжевый.
Ответ поясните.
Так как в этих случаях наблюдается изменение окраски раствора, в 1 – раствор станет малиновый, во 3 – жёлтый.
2. Прочитайте внимательно стихотворение.
Явил ряд признаков подряд
Нам, разлагаясь, бихромат:
Цвет, звук, огонь и даже газ
Заметить каждый мог из нас.
Чтоб превращенье началось,
Поджечь кристаллы нам пришлось.
Тепло наружу – это экзо,
Горенье – свет,
Тепло вовнутрь – это эндо –
Обратный тепловой эффект!
О каких признаках описанной реакции говорится в стихотворении?
Изменение окраски, образование газа, появление запаха.
Если на уроке вам не демонстрировали эту реакцию, найдите в Интернете видеофрагмент «Разложение бихромата аммония», просмотрите его и сделайте рисунок, навеянный этой замечательной реакцией.
3. Установите соответствие между признаком и химической реакцией.
4. При приготовлении раствора серной кислоты следует:
2) серную кислоту приливать к воде.
Ответ поясните.
Выделяется большое количество теплоты, вода может закипеть и выбросить брызги на лицо и руки работающего.
5. Верны ли следующие суждения?
А. Экзотермические реакции, как правило, идут при постоянном нагревании.
Б. Эндометрические реакции могут протекать без нагревания.
4) оба суждения неверны.
6. Чтобы увеличить скорость химической реакции между твёрдыми и газообразными веществами, нужно
измельчить твёрдое вещество.
7. Чтобы увеличить скорость химической реакции между твёрдыми растворимыми веществами, нужно
измельчить и растворить их в воде.
8. Укажите, что нужно сделать, чтобы ликвидировать возгорание:
1) твёрдых веществ и материалов – закрыть плотным материалом;
2) нефтепродуктов – использовать огнетушитель;
3) электроприборов – обесточить и накрыть плотным материалом.
В промышленности подбирают такие условия, чтобы осуществлялись нужные реакции, а вредные замедлялись.
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
В таблице 12 приведены основные типы химических реакций по числу участвующих в них частиц. Даны рисунки и уравнения часто описываемых в учебниках реакций разложения
, соединения
, замещения
и обмена
.
В верхней части таблицы представлены реакции разложения
воды и гидрокарбоната натрия. Изображён прибор для прохождения через воду постоянного электрического тока. Катод и анод представляют собой металлические пластинки, погружённые в воду и соединённые с источником электрического тока. В связи с тем, что чистая вода практически не проводит электрический ток, к ней добавляют небольшое количество соды (Nа 2 СО 3) или серной кислоты (Н 2 SО 4). При прохождении тока на обоих электродах происходит выделение пузырьков газа. В трубке, где собирается водород, объём оказывается вдвое большим, чем в трубке, где собирается кислород (о его наличии можно удостовериться с помощью тлеющей лучинки). Модельная схема демонстрирует реакцию разложения воды. Химические (ковалентные) связи между атомами в молекулах воды разрушаются, и из освобождающихся атомов образуются молекулы водорода и кислорода.
При прохождении тока на обоих электродах происходит выделение пузырьков газа. В трубке, где собирается водород, объём оказывается вдвое большим, чем в трубке, где собирается кислород (о его наличии можно удостовериться с помощью тлеющей лучинки). Модельная схема демонстрирует реакцию разложения воды. Химические (ковалентные) связи между атомами в молекулах воды разрушаются, и из освобождающихся атомов образуются молекулы водорода и кислорода.
Модельная схема реакции соединения
металлического железа и молекулярной серы S 8 показывает, что в результате перегруппировки атомов в процессе реакции образуется сульфид железа. При этом разрушаются химические связи в кристалле железа (металлическая связь) и молекуле серы (ковалентная связь), а освободившиеся атомы соединяются с образованием ионных связей в кристалл соли.
К другой реакции соединения относится гашение извести СаО водой с образованием гидроксида кальция. При этом жжёная (негашёная) известь начинает разогреваться и образуется рыхлый порошок гашёной извести.
К реакциям замещения
относят взаимодействие металла с кислотой или солью. При погружении достаточно активного металла в сильную (но не азотную) кислоту выделяются пузырьки водорода. Более активный металл вытесняет менее активный из раствора его соли.
Типичными реакциями обмена
является реакция нейтрализации и реакция между растворами двух солей. На рисунке показано получение осадка сульфата бария. За ходом реакции нейтрализации следят с помощью индикатора фенолфталеина (малиновая окраска исчезает).
Таблица 12
Типы химических реакций
ВОЗДУХ. КИСЛОРОД. ГОРЕНИЕ
Кислород является самым распространённым химическим элементом на Земле. Содержание его в земной коре и гидросфере представлено в таблице 2 «Распространённость химических элементов». На долю кислорода приходится примерно половина (47 %) массы литосферы. Он является преобладающим химическим элементом гидросферы. В земной коре кислород присутствует только в связанном виде (оксиды, соли). Гидросфера также представлена в основном связанным кислородом (часть молекулярного кислорода растворена в воде).
Гидросфера также представлена в основном связанным кислородом (часть молекулярного кислорода растворена в воде).
В атмосфере свободного кислорода содержится 20,9 % по объёму. Воздух – сложная смесь газов. Сухой воздух на 99,9 % состоит из азота (78,1 %), кислорода (20,9 %) и аргона (0,9 %). Содержание этих газов в воздухе практически постоянно. В состав сухого атмосферного воздуха также входят диоксид углерода, неон, гелий, метан, криптон, водород, оксид азота(I) (оксид диазота, гемиоксид азота – N 2 О), озон, диоксид серы, монооксид углерода, ксенон, оксид азота(IV) (диоксид азота – NО 2).
Состав воздуха определил французский химик Антуан Лоран Лавуазье в конце XVIII века (таблица 13). Он доказал содержание кислорода в воздухе, и назвал его «жизненный воздух». Для этого он нагревал на печи ртуть в стеклянной реторте, тонкая часть которой поводилась под стеклянный колпак, опущенный в водяную баню. Воздух под колпаком оказывался замкнутым. При нагревании ртуть соединялась с кислородом, превращаясь в оксид ртути красного цвета. «Воздух», оставшийся в стеклянном колпаке после нагревания ртути, не содержал кислорода. Мышь, помещённая под колпак, задыхалась. Прокалив оксид ртути, Лавуазье снова выделил из него кислород и вновь получил чистую ртуть.
«Воздух», оставшийся в стеклянном колпаке после нагревания ртути, не содержал кислорода. Мышь, помещённая под колпак, задыхалась. Прокалив оксид ртути, Лавуазье снова выделил из него кислород и вновь получил чистую ртуть.
Содержание кислорода в атмосфере стало заметно увеличиваться около 2 млрд. лет назад. В результате реакции фотосинтеза
поглощался некоторый объём углекислого газа и выделялся такой же объём кислорода. На рисунке таблицы схематически показано образование кислорода при фотосинтезе. В процессе фотосинтеза в листьях зелёных растений, содержащих хлорофилл
, при поглощении солнечной энергии происходит превращение воды и углекислого газа в углеводы
(сахара) и кислород
. Реакцию образования глюкозы и кислорода в зелёных растениях можно записать в следующем виде:
6Н 2 О + 6СО 2 = С 6 Н 12 О 6 + 6О 2 .
Образующаяся глюкоза превращается в нерастворимый в воде крахмал
, который накапливается в растениях.
Таблица 13
Воздух. Кислород. Горение
Кислород. Горение
Фотосинтез представляет собой сложный химический процесс, включающий несколько стадий: поглощение и транспортировку солнечной энергии, использование энергии солнечного света для инициирования фотохимических окислительно-восстановительных реакций, восстановление углекислого газа и образованием углеводов.
Солнечный свет – это электромагнитное излучение разных длин волн. В молекуле хлорофилла при поглощении видимого света (красного и фиолетового) происходят переходы электронов из одного энергетического состояния в другое. На фотосинтез расходуется только небольшая часть солнечной энергии (0,03 %), достигающей поверхности Земли.
Весь имеющийся на Земле диоксид углерода проходит через цикл фотосинтеза в среднем за 300 лет, кислород – за 2000 лет, вода океанов – за 2 млн. лет. В настоящее время в атмосфере установилось постоянное содержание кислорода. Он практически полностью расходуется на дыхание, горение и гниение органических веществ.
Кислород – одно из самых активных веществ. Процессы с участием кислорода называются реакциями окисления. К ним относят горение, дыхание, гниение и многие другие. На таблице показано горение нефти, которое идёт с выделением теплоты и света.
Реакции горения могут принести не только пользу, но и вред. Горение можно остановить, прекратив доступ воздуха (окислителя) к горящему предмету с помощью пены, песка или одеяла.
Пенные огнетушители наполняют концентрированным раствором питьевой соды. При её контакте с концентрированной серной кислотой, находящейся в стеклянной ампуле в верхней части огнетушителя, образуется пена углекислого газа. Для приведения в действие огнетушитель переворачивают и ударяют об пол металлическим штифтом. При этом ампула с серной кислотой разбивается и образующийся в результате реакции кислоты с гидрокарбонатом натрия углекислый газ вспенивает жидкость и выбрасывает её из огнетушителя сильной струёй. Пенистая жидкость и углекислый газ, обволакивая горящий предмет, оттесняют воздух и гасят пламя.
Похожая информация.
Проведению урока предшествует экскурсия в
историко-этнографический музей на открытом
воздухе “Тукай кырлай”, с посещением дома-музея
Г. Тукая.
Задачи обучения.
Сформировать знания о
признаках и условиях протекания химических
реакций, на этой основе усовершенствовать умение
отличать физические процессы от химических.
Задачи развития.
Совершенствовать умение
объяснять зависимость протекания химических
реакций от внешних условий.
Эксперимент.
Плавление парафина,
обугливание крахмала, горение лучины,
взаимодействие гидроксида натрия с соляной
кислотой в присутствии фенолфталеина,
взаимодействие сульфата меди (II) и гидроксида
натрия, взаимодействие растворов карбоната
натрия и соляной кислоты.
Планируемые результаты обучения.
Учащиеся
должны уметь на примерах конкретных химических
реакций указывать условия их возникновения и
дальнейшего протекания, а также признаки
реакций.
Планируемые результаты развития.
Учащиеся
должны уметь объяснять связь между условиями и
возможностью протекания химических реакций.
Урок начинается с прочтения учащимися стихов Г.
Тукая на татарском языке, критерием при подборе
стихов является отражение в них различных
явлений природы
В процессе демонстрации опытов (плавление
парафина, обугливание крахмала) выясняем
сущность происходящих явлений и составляем
таблицу.
Для закрепления знаний проводим беседу с
учащимися и отвечаем на вопросы.
Закружилась листва золотая
В розоватой воде на пруду.
Словно бабочек лёгкая стая с
Замираньем летит на звезду…
Вопросы учителя:
1. О каком явлении в жизни растений говорится в
стихах С. Есенина?
2. К физическим или химическим явлениям относится
листопад?
3. С чем связано изменение цвета листьев деревьев
осенью, какие явления физические или химические
происходят при этом?
4. Какой пигмент обуславливает зелёную окраску
листьев растений?
5. Какой процесс происходит в зеленых листьях
Какой процесс происходит в зеленых листьях
растений под действием солнечного света?
Сообщение ученика.
Фотосинтез – химическое
явление (на доске запись уравнения реакции
фотосинтеза).
Для развития умений учащихся по самоконтролю
знаний проводим тестированный контроль.
1. К химическим явлениям (в отличие от
физических) относятся:
- Сгорание бензина в двигателе автомобиля,
- скисание молока,
- таяние снега,
- образование инея на деревьях.
2. Какие из природных явлений сопровождаются
химическими реакциями?
- Выпадение дождя,
- извержение вулканов,
- гниение растительных остатков,
- ледоход на реке.
3. Какие из признаков характерны для химических
реакций?
- Образование осадка,
- изменение агрегатного состояния,
- выделение газа,
- измельчение вещества.
4. К физическим явлениям (в отличие от
химических) относятся:
- горение угля,
- приготовление порошка из куска мела,
- образование ржавчины,
- свечение вольфрамовой нити в лампочке.

Учитель.
Для чего нам необходимо знать
условия возникновения и условия протекания
химических реакций?
Ученик.
Для того, чтобы контролировать
протекание химических реакций, иногда
химическую реакцию необходимо прекратить,
например, при пожаре мы стремимся прекратить
реакцию горения.
Сообщение
ученика.
Лесной пожар – это неконтролируемое
горение растительности, стихийно
распространяющееся по лесной территории. Лесные
пожары ежегодно возникают в лесах Татарстана, а
также в других странах мира на обширных площадях
и нередко принимают характер стихийного
бедствия. Лесные пожары уничтожают лесной фонд
Татарстана, а также представляют опасность и для
населения. При этом возникает непосредственная
угроза уничтожения огнём населённых пунктов и
объектов народного хозяйства, расположенных
вблизи лесных массивов, а также сильное
задымление и загазованность территорий, даже
удалённых от кромки леса.
“Дым был столь обильным, что птицы не могли
парить, падали на землю»
Общая площадь лесов Республики Татарстан 1270,3
тыс. га, в том числе покрытая лесом – 1165,3 тыс. га,
га, в том числе покрытая лесом – 1165,3 тыс. га,
из них лесные культуры 281,1 тыс. га. Общий запас
древесины – 168,8 млн.м 3 . Средний прирост
древесины – 4,13 м 3 /га
Почти все лесные пожары в Татарстане происходят
из-за людской небрежности.
Пожароопасный сезон 2004 года в Татарстане начался
20 апреля. За это время в республике леса горели
более 40 раз, сообщили Intertat.ru в пресс-службе
Главного Управления природных ресурсов и охраны
окружающей среды. Примечательно, что из 41 случая
лесных пожаров 39 связаны с нарушениями
гражданами требований Правил пожарной
безопасности в лесах РФ.
Для закрепления и обобщения знаний учащиеся
отвечают на вопросы.
1. Каковы условия возникновения и прекращения
горения?
2. Какие средства тушения пожара нужно
использовать в следующих случаях:
а) загорелась одежда на человеке;
б) воспламенился бензин;
в) возник лесной пожар;
г) загорелась нефть на поверхности воды?
В заключительной части урока учитель подводит
итог урока, ученики получают домашние задание.
Рассмотрим, как на уроках химии в VII-VIII классах следует развивать знания об условиях возникновения и течения химической реакции.
На первых уроках достаточно, если учащиеся узнают, что при одних и тех же условиях одно вещество подвергается химическому превращению, а другое — нет (нагревание стеарина и сахара), что в одних условиях с веществом происходит только физическое изменение, а при других-и химическое (растворение и нагревание сахара).
После ознакомления с признаками химической реакции проводят первое обобщение знаний об условиях химического взаимодействия, организуемое так. Учащимся предлагается ответить на вопрос: Какие условия нужны для того, чтобы: а) сахар обуглился, б) магний загорелся, в) медная пластинка покрылась черным налетом? Во всех этих случаях они называют одно и то же условие — нагревание веществ. Обсуждая ответы, учитель отмечает, что для горения Магния и почернения медной пластинки недостаточно только нагревания, необходимо соприкосновение металлов с кислородом воздуха. Для подтверждения он показывает накаливание кусочка блестящей тонкой листовой меди, сложенного в виде конвертика с плотно прижатыми краями или скрученных друг с другом толстых медных проволок. После охлаждения оказывается, что медь с внешней стороны почернела, а с внутренней осталась блестящей, так как сюда не проникали молекулы кислорода.
Для подтверждения он показывает накаливание кусочка блестящей тонкой листовой меди, сложенного в виде конвертика с плотно прижатыми краями или скрученных друг с другом толстых медных проволок. После охлаждения оказывается, что медь с внешней стороны почернела, а с внутренней осталась блестящей, так как сюда не проникали молекулы кислорода.
Учитель демонстрирует в стеклянном цилиндре раствор сернокислой меди, на который предварительно сверху был осторожно налит разбавленный раствор гидроокиси аммония. Он обращает внимание на появление ярко-синей окраски только в средней части сосуда и говорит, что химическая реакция, начавшись в том месте, где жидкости соприкасаются друг с другом, может произойти во всем объеме только в том случае, если применить перемешивание. У учащихся создаются первые представления о таких условиях химического взаимодействия, как соприкосновение реагирующих веществ к их перемешивание.
В заключение отмечают, что важнейшие условия химической реакции: 1) наличие веществ, которые могут испытывать химические превращения, 2) соприкосновение и перемешивание веществ (если реакция идет между двумя веществами), 3) нагревание.
Для проверки и закрепления знаний используют следующие вопросы и задания:
- Назовите условия, необходимые для химических реакций. Приведите примеры. Какое значение имеет знание этих условий для практики?
- Какие условия были необходимы для того, чтобы: а) медь покрылась черным налетом, б)известковая вода помутнела?
- Какие условия для возникновения химической реакции мы создаем, когда зажигаем спиртовку или газовую горелку? Какие из этих условий мы нарушаем, когда гасим пламя?
При изучении следующей темы — «Первоначальные сведения о строении и составе веществ» — учитель обращает внимание на условия тех превращений, которые используются для формирования понятии о реакции разложения и реакции соединения. Подчеркивает, что для разложения окиси ртути и основной углекислой меди нужно постоянное нагревание, а для разложения воды-действие электрического тока. Соединение серы с железом начинается только при нагревании, а затем, поскольку при этой реакции выделяется теплота, дальнейшее нагревание смеси уже не нужно.
Учащиеся должны узнать, что не все реакции разложения идут с поглощением теплоты и не всякое соединение веществ сопровождается ее выделением. Учитель показывает опыт: нагревает пробирку с двухромовокислым аммонием только до начала реакции, которая продолжается и после прекращения нагревания. Разогревание вещества, выбрасывание из пробирки раскаленных частичек показывает, что реакция идет с выделением теплоты.
Затем приводится пример реакции соединения, про-исходящей с поглощением теплоты: соединение азота с кислородом идет при температуре выше 1200° С и требует постоянного нагревания.
Дальнейшее развитие и закрепление знаний об условиях химических реакций происходит в теме «Кислород. Воздух».
После изучения химических свойств кислорода учащимся предлагают вопросы:
- Какие условия необходимы для горения древесного угля; серы, фосфора и магния в кислороде и в воздухе? Почему эти вещества достаточно нагреть только до начала реакции?
- Для чего перед сжиганием стального пера в кислороде к кончику пера прикрепляют кусочек пробки? Происходит ли выделение теплоты при взаимодействии железа с кислородом? Почему вы так думаете?
- Какие условия горения и как мы создаем их, когда зажигаем газ на газовой плите?
Когда учащиеся изучат состав воздуха, им можно предложить следующие задания и вопросы:
- Сравните условия: а) образования красного порошка окиси ртути в опыте Лавуазье и б) разложения окиси ртути.
 В чем сходство и различие этих условий?
В чем сходство и различие этих условий? - Почему при слабом длительном нагревании ртути в закрытом сосуде с воздухом образование окиси ртути прекращается? Какое условие окисления ртути нарушается?
- В большую банку с воздухом поместили горящую свечу, затем банку закрыли пробкой. Свеча горела некоторое время, а затем погасла. Почему горение прекратилось? Какое условие взаимодействия веществ было нарушено?
В теме «Водород» полезно разобрать, почему в аппарате Киппа при закрывании крана реакция прекращается, какое условие течения реакции при этом нарушается.
В теме «Вода. Расхворы» рассматривают химические свойства воды, изучают реакцию воды с металлами. При этом ставят опыты, которые позволяют отметить, что различные металлы вступают в реакцию с водой при различных температурных условиях. В той же теме желательно сравнить условия разложения воды и ее синтеза, обратить внимание на то, что разложение воды происходит при непрерывном действии электрического тока, а для взрыва смеси водорода с кислородом в эвдиометре достаточно электрической искры. После этого перед учащимися следует поставить вопрос, какая из рассматриваемых реакций идет с выделением, а какая — с поглощением энергии.
После этого перед учащимися следует поставить вопрос, какая из рассматриваемых реакций идет с выделением, а какая — с поглощением энергии.
В VIII классе, когда изучают реакции обмена между двумя солями, солью и основанием, нужно обязательно показать, каковы важнейшие условия этих реакций: растворимость исходных веществ в воде и присутствие воды.
В конце изучения темы «Важнейшие классы неорганических соединений» учащиеся составляют таблицы, в которые включают ряд примеров изученных химических превращений растворимых и нерастворимых в воде неорганических веществ, а также сведения о типах и условиях этих превращений. Пример одной из таких таблиц приведен ниже.
При обсуждении содержания таблиц прежде всего подчеркивают, что между типом химического взаимодействия и условиями реакций нет вполне определенного соответствия: одни реакции замещения идут без нагревания, а другие (между окисью меди и водородом) — с нагреванием, то же можно сказать и о реакциях обмена. Все же некоторые связи между типами реакций, участием в них растворимых и нерастворимых веществ и условиями можно подметить.
Если в реакции замещения участвует растворимое в воде сложное вещество (кислота, соль), то реакция проводится в его растворе без нагревания. Если же сложное вещество нерастворимо в воде, то требуется нагревание.
Реакция обмена между ДВУМЯ солями, солью и основанием идет без нагревания только в том случае, если эти вещества растворимы. В реакции обмена между окислом и кислотой могут вступать и нерастворимые в воде окислы, но в этом случае нужно нагревание.
Развитие знаний об условиях возникновения и течения реакции продолжается в темах: «Углерод и его соединения», «Металлы», «Химия и ее значение в народном хозяйстве».
Изучая аллотропные видоизменения углерода, учитель знакомит учащихся с условиями получения искусственных алмазов.
Систематическое развитие знаний об условиях возникновения и течения химических реакций в VII и VIII классах позволяет поставить перед учащимися вопросы, выясняющие условия, необходимые для воспламенения веществ и продолжения горения. Демонстрируют опыты, например пламя спирта гасят, закрывая тигель крышкой, а пламя скипидара — погружая тигель в холодную воду.
Демонстрируют опыты, например пламя спирта гасят, закрывая тигель крышкой, а пламя скипидара — погружая тигель в холодную воду.
В теме «Металлы» большое внимание нужно уделить выяснению условий ржавления железа и способам предохранения его от ржавления * .
* (П. А. Глориозов, Е. П. Клещева, Л. А. Коробейникова. Т. 3. Савич. Методика преподавания химии о восьмилетней школе. М., «Просвещение», 1966.
)
Наконец, в теме «Химия и ее значение в народном хозяйстве», обсуждая роль химии в народном хозяйстве СССР и в охране природы, очень полезно еще раз указать на большое значение накопленных в науке знаний об условиях химических реакций и их успешное применение в настоящее время в различных областях народного хозяйства в быту.
A) Горение магния cool Плавление льда C) Оседание речного песка в воде
D) Смешивание порошков серы и железа E) кипение воды
2. Молярная масса железа равна
А) 26 г/моль cool 56 г/моль C) 52 г/моль D) 112 г/моль E) 56
3. В формуле 2Na2S число атомов натрия и серы равны
В формуле 2Na2S число атомов натрия и серы равны
А) 1 и 2 cool 4 и 1 C) 2 и 4 D) 4 и 2 E) 2 и 1
4. Формула оксида Mn (VII)
1. MnO2 cool Mn2O7 C) Mn2O3 D) MnO3 E) MnO
5. В схеме реакции P+O2 ? P2O5 нужно поставить коэффициенты
А) 4, 5, 2 cool 2, 1, 1 C) 2, 5, 2 D 5, 4, 2 E) 2, 4, 5
6. Уравнение реакции замещения это –
A) 4Na + O2 = 2 Na2O cool CaCO3 = CaO +CO2? C) Zn + CuS = ZnS +Cu
D) 2Mg + O2 = 2MgO E) 2h3 + O2 > 2 h3O
7. Железный гвоздь погруженный в раствор хлорида меди (II) покрывается красным налетом меди. Это пример реакции:
A) Обмена cool Разложение C) Замещение D) Соединение E) неn такой реакции
8. Символ химического элемента марганца
A) ?е cool Mg C) О D) Mn E) Mr
9. О химическом элементе, а не о простом веществе азоте идет речь в выражении
A) Азот является составной частью воздуха cool В состав азотной кислоты HNO3 входит азот
C) Формула азота N2 D) Жидкий азот иногда используется для замораживания продуктов
E) азот инертный газ
10. Для алюминия не характерно физическое свойство
Для алюминия не характерно физическое свойство
A) Электропроводность cool Теплопроводность C) Серебристо-белый цвет
D) Способность намагничиваться E) газ при обычных условиях
11. Признак, позволяющий назвать ржавление гвоздя химической реакцией – это:
A) Выделение тепла cool Выделение газа C) Изменение окраски
D) Появление запаха E) выпадение осадка
12. Сульфид железа – это сложное вещество, а не смесь потому что
A) Его можно разделить магнитом на железо и серу
cool Его можно разделить дистилляцией на железо и серу
C) Состоит из атомов разного химического элемента и его нельзя разделить физическими методами на железо и серу
D) Он нерастворим в воде E) газ при обычных условиях
13. 3.01 * 10 23 атомов железа составляют
A) 2 моль cool 3 моль C) 1 моль D) 0,5 моль E) 1,5 моль
14. 69 г натрия составляют
A) 3 моль cool 1 моль C) 6,3 моль D) 1,5 моль E) 0,5 моль
15.Фильтрованием можно разделить смесь:
A) медных и железных стружек cool сахара и воды C) мела и воды
D) воды и уксусной кислоты E) воды и бензина
16. Взаимодействие магния с кислородом относятся к реакциям:
Взаимодействие магния с кислородом относятся к реакциям:
A) разложения cool обмена C) соединения D) замещения E) неn такой реакции
17. К химическим явлениям относятся:
A) измельчение мрамора cool испарение воды C) таянье льда D) плавление меди E) сгорание угля
19.Чему равна валентность алюминия?
А) 1 cool 2 C)3 D) 4 E) 5
20.Единицы измерения молярной массы:
А) граммы cool грамм/ моль C) моль D) мелограмм E) нет единицы измерения
21. Молярная масса NaHCO3 равна:
А) 156 cool 156 г/ моль C) 84 г/ моль D) 84 E) 84 л
22.Укажите реакцию разложения:
А) 2h3 + O2 > 2 h3O cool 2Na +2h3O > 2NaOH + h3
C) C + O2 > CO2 D) 2Nh4 > N2 + 3h3
E) AgNO3 + HCl > AgCl +HNO3
23.Массовая доля кислорода в серной кислоте h3SO4 равна приблизительно:
А) 16% cool 33% C) 65% D) 2% E) 17%
25.В каком из данных рядов расположены только металлы?
А) K, Zn, Fe cool Si, Ca, Bi C)Al, C, Cr D) W, Os, В E) P, Au, Pb
26. Массовая доля серы в веществе SO2 равна:
Массовая доля серы в веществе SO2 равна:
А)32 % cool 64% C) 50% D) 80% E) 12%
27.Масса сульфида цинка, образовавшегося при нагревании 10 г серы с цинком, равна:
A) 12 г cool 30,31 г C) 25,6 г D) 10,5 г E) 32,4 г
28. Символ химического элемента криптона
A)Ca cool Kr C) K D) Cd E) C
29. Веществом является
A) Воздух B)медь C) Зеркало D) Гранит E) молоко
30. В списке физических свойств лишнее
A) Плотность cool горение C) Теплопроводность
D) Температура кипения E) температура плавления
Ржавление железа – объяснение, химическая реакция, предотвращение
Металл – это материал, который имеет глянцевый вид, когда он только что изготовлен, отполирован или разрушен, и достаточно хорошо проводит электричество и тепло. Металлы либо ковкие, либо пластичные (их можно ковать в тонкие листы) (можно вытягивать в проволоку). Металлы могут быть химическими элементами, такими как железо, сплавами, такими как нержавеющая сталь, или молекулярными соединениями, такими как полимерный нитрид серы.
Термин «металл» используется в астрофизике в более широком смысле для обозначения всех химических элементов в звезде, которые тяжелее гелия, а не только классических металлов. В этом смысле первые четыре «металла», которые накапливаются в ядрах звезд в результате нуклеосинтеза, — это углерод, азот, кислород и неон, которые все являются химически неметаллами. За время своего существования звезда сплавляет более легкие элементы, прежде всего водород и гелий, в более тяжелые атомы. В этом контексте металличность астрономического объекта относится к доле его массы, состоящей из более тяжелых химических элементов.
Ржавление железа
Ржавление – это явление образования красновато-коричневого налета на поверхности железа под действием влажного воздуха, красновато-коричневый налет называется ржавчиной. Проще говоря, ржавчина — это красно-коричневое хлопьевидное вещество, которое образуется, когда железный предмет подвергается воздействию влажного воздуха в течение длительного периода времени.
Ржавление — термин для этого явления.
Ржавление железа и стали является наиболее распространенным примером коррозии металлов. Ржавчина выхлопных систем и кузова автомобиля, водопроводных труб и многих видов конструкционных стальных конструкций — все это хорошо известные примеры. Совместное воздействие воздуха и воды на железо вызывает его ржавчину. Ржавчина не возникает в полностью сухом воздухе или в воздухе, полностью лишенном воды. Атмосферные условия и относительный вклад компонентов, регулирующих ржавчину, определяют особый состав ржавчины. Он в основном состоит из гидратированного оксида железа, поэтому химическая формула ржавчины Fe 9.0013 2 O 3 .xh 2 o. Следующий ответ может примерно охарактеризовать его формацию:
4FE + 3O 2 + 2xH 2 O → 2FE 2 O 3 . 2 O
Внешняя поверхность железа сначала ржавеет в присутствии влажного воздуха, и на поверхности осаждается слой гидратированного оксида железа (ржавчина). Этот слой нежный и пористый, и если он станет слишком толстым, то может отвалиться. Самые нижние слои железа подвергаются воздействию окружающей среды, вызывая их ржавчину. Железо в конечном итоге теряет свою прочность по мере продолжения процесса.
Этот слой нежный и пористый, и если он станет слишком толстым, то может отвалиться. Самые нижние слои железа подвергаются воздействию окружающей среды, вызывая их ржавчину. Железо в конечном итоге теряет свою прочность по мере продолжения процесса.
Что такое процесс ржавления железа?
Ржавление железа является реакцией окисления. Во время коррозии железо соединяется с кислородом воздуха в присутствии воды с образованием Fe 2 O 3 .xH 2 O, гидратированного оксида железа (III).
Этот гидратированный оксид железа (III) называют ржавчиной. В результате ржавчина представляет собой в значительной степени гидратированный оксид железа (III), Fe 2 O 3 .xH 2 O. Цвет ржавчины красновато-коричневый. Все мы замечали красновато-коричневую ржавчину на железных гвоздях, шурупах, трубах и перилах. Под воздействием влажного воздуха ржавеет не только железо, но и сталь. Сталь, с другой стороны, более устойчива к ржавчине, чем железо.
Ржавление железа является химическим изменением
Ржавчина образуется, когда железо (или сплав железа) подвергается воздействию кислорода в присутствии влаги. Эта реакция не мгновенна; скорее, это происходит в течение длительного периода времени. Оксиды железа образуются при соединении атомов кислорода с атомами железа. В результате ослабевают связи между атомами железа в объекте/структуре.
Степень окисления железа увеличивается в результате реакции ржавления, за которой следует потеря электронов. Ржавчина в основном состоит из двух типов оксидов железа, которые различаются степенью окисления атома железа. Это оксиды:
- Оксид железа (II) также известен как оксид железа. Это вещество имеет степень окисления +2 и химическую формулу FeO.
- Оксид железа (III), часто известный как оксид железа, представляет собой соединение, в котором атом железа имеет степень окисления +3. Fe2O3 — химическая формула этого вещества.

Железо является восстановителем, но кислород является отличным окислителем. При воздействии кислорода атом железа легко отдает электроны. Химическая реакция описывается следующим образом:
Fe → Fe 2+ + 2e –
В присутствии воды атом кислорода увеличивает степень окисления железа.
4Fe 2+ + O 2 → 4Fe 3+ + 2O 2-
Теперь катионы железа и молекулы воды вступают в следующие кислотно-основные реакции.
Fe 2+ + 2H 2 O ⇌ Fe(OH) 2 + 2H +
Fe 3+ + 3H 2 O ⇌ Fe(OH) 3 + 3H +
В результате прямой реакции между катионами железа и гидроксид-ионами также образуются гидроксиды железа.
O 2 + H 2 O + 4e – → 4OH –
Fe 2+ + 2OH – → Fe(OH) 2
Fe 3+ + 3OH – → Fe(OH) 3
Образующиеся гидроксиды железа обезвоживаются, образуя оксиды железа, образующие ржавчину. В этот процесс вовлечено множество химических процессов, некоторые из которых приведены ниже.
В этот процесс вовлечено множество химических процессов, некоторые из которых приведены ниже.
- Fe (OH) 2 ⇌ Feo + H 2 O
- 4FE (OH) 2 + O 2 + XH 2 O → 2FE 2 O 3 . X → 2FE 2 O 3 . X → 2FE 2 . +4)H 2 O
- Fe(OH) 3 ⇌ FeO(OH) + H 2 O
- FeO(OH) ⇌ Fe 2 O 3 1 O
+ 3 H
4
Все перечисленные выше химические реакции имеют одну общую черту: все они требуют присутствия воды и кислорода. В результате количество кислорода и воды, окружающих металл, может быть ограничено для предотвращения коррозии.
Условия, необходимые для коррозии железа:
Ржавлению железа способствуют многие факторы, в том числе количество влаги в воздухе и рН окружающей среды. Ниже приведены некоторые из этих элементов.
- Влажность: Наличие воды в окружающей среде ограничивает коррозию железа.
 Наиболее распространенной причиной ржавчины является воздействие дождя.
Наиболее распространенной причиной ржавчины является воздействие дождя. - Процесс ржавчины ускоряется, если рН среды вокруг металла низкий. Когда железо подвергается воздействию кислотных дождей, оно ржавеет быстрее. Коррозия железа замедляется за счет более высокого pH.
- Из-за наличия в воде различных солей железо быстрее ржавеет. Многие ионы в соленой воде ускоряют процесс ржавчины посредством электрохимических процессов.
- Примесь: По сравнению с железом, состоящим из различных металлов, чистое железо ржавеет медленнее.
Размер железного предмета также может влиять на скорость его коррозии. Например, огромный железный предмет, скорее всего, будет иметь незначительные дефекты из-за процесса плавки. Эти недостатки обеспечивают платформу для экологических атак на металл.
Эксперимент, доказывающий, что воздух и влага необходимы для образования ржавчины:
Процедура, подтверждающая, что для образования ржавчины необходимы влага и воздух.
- Чистые железные гвозди следует поместить в каждую из трех пробирок, обозначенных A, B и C.
- Наполните пробирку A водопроводной водой и закупорьте ее.
- Наполните пробирку B горячей дистиллированной водой, затем добавьте примерно 1 мл масла и закупорьте ее. Масло будет плавать на поверхности воды, препятствуя испарению воздуха.
- Наполните пробирку С безводным хлоридом кальция и закупорьте ее. Любая влага в воздухе будет поглощаться безводным хлоридом кальция.
- Подождите несколько дней, пока эти пробирки не осядут перед наблюдением.
Наблюдение: Железные гвозди ржавеют в пробирке А, но не в пробирках В и С, согласно результатам. Гвозди в пробирке А подверглись коррозии, потому что они подвергались воздействию как воздуха, так и воды. Ногти из пробирки B подвергаются воздействию только воды, но ногти из пробирки C подвергаются воздействию сухого воздуха.
Заключение: Этот эксперимент показывает, что для образования ржавчины необходимы как воздух (кислород), так и влага.
Какие повреждения вызывает ржавление железных предметов?
Ржавчина проницаема и мягка, и когда она соскальзывает с поверхности ржавого железного предмета, железо под ним ржавеет. В результате железная ржавчина — это постоянный процесс, который со временем разъедает железные предметы, делая их бесполезными. Ржавление железа со временем наносит значительный ущерб, поскольку оно используется для создания широкого спектра конструкций и товаров, включая мосты, решетки, перила, ворота и кузова автомобилей, автобусов, грузовиков и кораблей. Само собой разумеется, что у нас должен быть способ уберечь железо от ржавчины.
Предотвращение ржавления железа
Утрата железных предметов из-за ржавчины оказывает огромное экономическое влияние на страну, и этого следует избегать. Чтобы железные вещи не ржавели, используются различные методы. Чтобы не допустить проникновения воздуха и воды, большинство способов требуют покрытия железной части чем-либо. Ниже приведены некоторые из наиболее распространенных способов предохранения железа от ржавчины:
Ниже приведены некоторые из наиболее распространенных способов предохранения железа от ржавчины:
- Ржавление железа можно предотвратить путем покраски: Покрытие поверхности железа краской является наиболее популярным способом защиты от ржавчины. Когда краска наносится на поверхность железного предмета, она предотвращает контакт воздуха и влаги с предметом, предотвращая ржавление. Для предотвращения ржавчины оконные решетки, перила, железные мосты, стальная фурнитура, железнодорожные вагоны, кузова автомобилей, автобусов и грузовиков, среди прочего, регулярно окрашиваются.
- Ржавление железа можно предотвратить, нанеся на него смазку или масло: Когда смазку или масло наносят на поверхность железного предмета, воздух и влага не соприкасаются с ним, предотвращая коррозию. Железные и стальные инструменты и детали машин, например, натирают смазкой или маслом для предотвращения коррозии.
- Ржавление железа можно предотвратить с помощью гальванического покрытия: Гальваническое покрытие защищает от ржавчины изделия, подвергающиеся чрезмерному воздействию влаги, такие как кровельные листы и трубопроводы.
 Гальванизация — это метод нанесения тонкого слоя цинка на сталь и железо для предотвращения ржавчины. Оцинкованное железо – это железо, оцинкованное. Цинк более реакционноспособен, чем железо, поэтому в присутствии влаги он взаимодействует с кислородом, образуя невидимый слой оксида цинка, защищающий его от дальнейшего ржавления. Стоит отметить, что даже при нарушении цинкового покрытия на изделиях из оцинкованного железа они остаются без ржавчины. Поскольку цинк более реактивен, чем железо, это так.
Гальванизация — это метод нанесения тонкого слоя цинка на сталь и железо для предотвращения ржавчины. Оцинкованное железо – это железо, оцинкованное. Цинк более реакционноспособен, чем железо, поэтому в присутствии влаги он взаимодействует с кислородом, образуя невидимый слой оксида цинка, защищающий его от дальнейшего ржавления. Стоит отметить, что даже при нарушении цинкового покрытия на изделиях из оцинкованного железа они остаются без ржавчины. Поскольку цинк более реактивен, чем железо, это так. - Ржавчину железа можно предотвратить с помощью гальванического покрытия: Гальванопокрытие — еще один метод предотвращения коррозии предметов. В этой процедуре на железо наносятся некорродирующие металлы, включая олово, никель и хром. Этот прием не только предохраняет изделия от ржавчины, но и улучшает их внешний вид. Оснащение ванных комнат и элементы транспортных средств, такие как велосипедные рули, автомобильные бамперы и т. д., являются примерами хромированных изделий.
- Ржавление железа можно предотвратить, легируя его для получения нержавеющей стали: Нержавеющая сталь получается при сплаве железа с хромом и никелем. Нержавеющая сталь не подвержена ржавчине. Кухонная утварь из нержавеющей стали, ножницы и медицинское оборудование, например, не подвержены коррозии. С другой стороны, нержавеющая сталь слишком дорога, чтобы ее можно было использовать в больших количествах.
- Ржавление железа можно предотвратить лужением: Олово нетоксично, и его реакционная способность ниже, чем у железа. Пищевые банки консервированы, что означает, что на них есть тонкий слой олова. В результате, когда гальваническое тонкое покрытие металлического олова наносится на изделия из железа и стали, изделия из железа и стали защищены от ржавчины. Используются луженые коробки для тиффина, потому что они нетоксичны и не загрязняют пищу внутри.
- Ржавчину железа можно предотвратить с помощью эмали: Эмалирование представляет собой высокотемпературную процедуру, при которой порошковое стекло вплавляется в металлическую основу.
 Эмали можно использовать на различных поверхностях, в том числе на стекле и керамике.
Эмали можно использовать на различных поверхностях, в том числе на стекле и керамике.
Примеры задач
Вопрос 1: Как происходит процесс ржавления железа?
Ответ:
Ржавление железа является реакцией окисления. В присутствии воды металлическое железо взаимодействует с кислородом воздуха с образованием гидратированного оксида железа (III) Fe 9.0013 2 O 3 .xH 2 O. Этот гидратированный оксид железа (III) называют ржавчиной. В результате ржавчина представляет собой в значительной степени гидратированный оксид железа (III), Fe 2 O 3 .xH 2 O. Ржавчина красновато-коричневого оттенка
Вопрос 2: Как называется ржавление железа?
Ответ:
Ржавчина – это явление образования красновато-коричневого налета на поверхности железа под действием влажного воздуха, красновато-коричневый налет называется ржавчиной.
Вопрос 3. Как можно предотвратить ржавление железа?
ОТВЕТ:
Ржастчинг из железа можно предотвратить с помощью
- Применение краски
- Применение смазки или масла
- с помощью Galvanisation
- путем наборочной стали
- с помощью Allying
- .
- с помощью Allying
- .
- с помощью Allying
- .
- Использование эмали
Вопрос 4: Что такое ржавчина? Приведите уравнение образования ржавчины?
Ответ:
Когда железо находится на воздухе в течение длительного периода времени, оно окисляется и образует на поверхности красновато-коричневый оксид железа. Ржавчина — название этого красновато-коричневого материала.
ржавчина образуется через следующее уравнение:
4fe + 3o 2 + 2xh 2 O → 2fe 2 O 3 .
xh 2 O
Вопрос 5: How действительно. железные предметы?
Ответ:
Ржавчина проницаема и мягка, и когда она соскальзывает с поверхности ржавого железного предмета, железо под ним ржавеет. В результате железная ржавчина — это постоянный процесс, который со временем разъедает железные предметы, делая их бесполезными. Ржавление железа со временем наносит значительный ущерб, поскольку оно используется для создания широкого спектра конструкций и товаров, включая мосты, решетки, перила, ворота и кузова автомобилей, автобусов, грузовиков и кораблей. Само собой разумеется, что у нас должен быть способ уберечь железо от ржавчины.
Вопрос 6: Какие условия необходимы для образования ржавчины?
Ответ:
Ржавлению железа способствуют многие факторы, в том числе количество влаги в воздухе и рН окружающей среды. Ниже приведены некоторые из этих элементов.
- Влажность: Наличие воды в окружающей среде ограничивает коррозию железа. Наиболее распространенной причиной ржавчины является воздействие дождя.
- Процесс ржавчины ускоряется, если pH окружающей среды вокруг металла низкий. Когда железо подвергается воздействию кислотных дождей, оно ржавеет быстрее. Коррозия железа замедляется за счет более высокого pH.
- Из-за наличия в воде различных солей железо быстрее ржавеет. Многие ионы в соленой воде ускоряют процесс ржавчины посредством электрохимических процессов.
- Примесь: По сравнению с железом, состоящим из различных металлов, чистое железо ржавеет медленнее.
Вопрос 7: Каким образом ржавчина железа является химическим изменением?
Ответ:
Ржавчина состоит из оксида железа (Fe2O3). В результате ржавчина и железо не являются синонимами. Ржавчина — это не то же самое, что железо, на котором она образовалась.
Поскольку при ржавлении железа образуется новый компонент, называемый «оксидом железа», он представляет собой химическое изменение.
Что вызывает ржавчину? — Ignite Industrial Technologies
Вы наверняка видели ржавчину на старых автомобилях или зданиях и других металлических поверхностях и задавались вопросом, что это такое. Многие люди обычно думают, что ржавчина — это просто окисление, и на самом деле не знают, что ее вызывает. Итак, что вызывает ржавчину?
Что создает ржавчину?
Ржавчина – это оксид железа, продукт реакции между железом и кислородом в присутствии воды или влаги воздуха. Кислород реагирует с железом с образованием оксида железа, который также известен как ржавчина. Вода помогает кислороду реагировать с железом, обеспечивая источник влаги.
Ржавчина представляет собой серьезную проблему для многих отраслей промышленности, поскольку она может вызывать износ и разрушение металлических поверхностей. Его также может быть очень трудно удалить после того, как он сформировался. Ржавчина может вызвать серьезные проблемы для зданий, сооружений, автомобилей и других ценных металлических изделий.
Его также может быть очень трудно удалить после того, как он сформировался. Ржавчина может вызвать серьезные проблемы для зданий, сооружений, автомобилей и других ценных металлических изделий.
Прежде всего необходимо понять, что вызывает ржавчину, чтобы предотвратить ее образование. Промышленности и другим организациям, использующим металлические предметы, необходимо принимать меры для максимально возможной защиты своего имущества от ржавчины и других форм коррозии.
Процессы образования ржавчины
Ржавчина представляет собой оксид железа, который образуется, когда железо или сплав, содержащий железо, подвергается воздействию кислорода и влаги в течение длительного времени. Полученный красновато-коричневый цвет обусловлен образованием гидратированного оксида железа (III).
Ржавление — это электрохимический процесс, который начинается с переноса электронов от металла к кислороду. Это создает в металле дефицит электронов, который необходимо восполнить за счет потока электронов из более электроотрицательного вещества.
Для появления ржавчины должны присутствовать три вещи: железо, кислород и вода. Ржавчина образуется, когда эти три элемента объединяются и создают электрохимическую реакцию. железо + вода + кислород → гидратированный оксид железа (III). Именно гидратированная часть делает ржавчину коричневой, а не красной.
Факторы, влияющие на скорость коррозии
Когда дело доходит до коррозии, не все металлы одинаковы. Скорость коррозии зависит от различных факторов, которые можно обобщить следующим образом:
Тип металла
Некоторые металлы ржавеют легче, чем другие. Например, железо и сталь ржавеют быстрее, чем алюминий или нержавеющая сталь. Разница обусловлена электрохимическим потенциалом металла. Чистые металлы обычно более реакционноспособны и, следовательно, более подвержены ржавчине.
Сплавы из нержавеющей стали содержат не менее 10,5% хрома. Хром образует тонкий слой оксида на поверхности стали, который защищает ее от дальнейшего ржавления. Если ваши приборы ржавеют, это может быть связано с тем, что они изготовлены из менее устойчивого к коррозии стального сплава.
Если ваши приборы ржавеют, это может быть связано с тем, что они изготовлены из менее устойчивого к коррозии стального сплава.
Наличие влаги
Ржавчина не может образоваться без воды. Причина, по которой железные трубы часто ржавеют изнутри, заключается в том, что на металле конденсируется водяной пар. Присутствие влаги ускоряет процесс ржавчины, потому что она обеспечивает электролит, необходимый для протекания реакции.
Нелегированные металлы особенно подвержены коррозии во влажной среде. Вот почему вы часто видите, что оцинкованная сталь или кованое железо ржавеют быстрее, чем другие виды металла.
Присутствие кислорода
Ржавчина может образовываться только в присутствии кислорода. Если вы живете в сухом климате, ваши металлические поверхности могут меньше ржаветь. Это связано с тем, что для протекания реакции требуется кислород, и он более доступен во влажном воздухе.
Вам нужно помнить, что не только кислород содержится в воде или во влажных местах. Углекислый газ в воздухе также может обеспечить кислород, необходимый для образования ржавчины. В присутствии воды углекислый газ реагирует с образованием угольной кислоты. Этот электролит может ускорить процесс ржавчины и вызвать коррозию.
Углекислый газ в воздухе также может обеспечить кислород, необходимый для образования ржавчины. В присутствии воды углекислый газ реагирует с образованием угольной кислоты. Этот электролит может ускорить процесс ржавчины и вызвать коррозию.
Таким образом, даже если вы не живете во влажном климате, ваши металлические поверхности все равно могут заржаветь под воздействием углекислого газа и воды.
Присутствие других химических веществ
Ржавчина также может образовываться при наличии других химических веществ. Например, соль ускоряет процесс ржавчины, разъедая металл. Вот почему часто можно увидеть, как железные перила и заборы быстрее ржавеют у океана.
Кислоты также могут ускорить процесс ржавчины. Это связано с тем, что они разрушают оксидный слой, который образуется на поверхности металла, подвергая металл воздействию кислорода и воды, что ускоряет процесс коррозии.
Основания также могут способствовать коррозии. Это связано с тем, что они нейтрализуют кислоты, образующиеся на поверхности металла, подвергая его воздействию кислорода и воды. Поэтому, если вы живете в районе с высоким уровнем загрязнения, ваши металлические поверхности могут ржаветь с большей вероятностью.
Поэтому, если вы живете в районе с высоким уровнем загрязнения, ваши металлические поверхности могут ржаветь с большей вероятностью.
Температура
Температура также может влиять на скорость коррозии. В общем, чем выше температура, тем быстрее процесс ржавчины. Это связано с тем, что молекулы воды и кислорода более активны при более высоких температурах, и им легче проникать через поверхность металла и вступать в реакцию с железом.
Как предотвратить появление ржавчины
Предотвращение образования ржавчины — это бесконечная битва, потому что существует множество способов, при которых металл может подвергаться воздействию кислорода и влаги. Ниже приведены некоторые общие советы по предотвращению ржавчины:
- Содержите металл в чистоте и сухости. Всякий раз, когда металл становится влажным, вытрите его насухо как можно скорее, чтобы предотвратить образование ржавчины. Металлы, такие как автомобильные двигатели и шайбы промышленных деталей, следует очищать неукоснительно.

- Нанести антикоррозийное покрытие. Это может быть краска, порошковое покрытие, масло или воск. Главное, чтобы металл был полностью покрыт, чтобы кислород и влага не могли добраться до него.
- Храните металл в прохладном, сухом месте. Храните металл в помещении с контролируемым климатом, чтобы предотвратить образование ржавчины.
- Регулярно проверяйте на наличие ржавчины. Регулярно проверяйте металл на наличие признаков ржавчины и немедленно удаляйте его. Вы можете использовать обезжириватели после первоначальной очистки.
- Используйте нержавеющие крепежные детали. При соединении металла с другим металлом используйте крепеж из устойчивого к ржавчине материала, такого как нержавеющая сталь.
Вопросы по теме
Что вызывает ржавчину при намокании?
Перекись водорода, также известная как h3O2, вызывает ржавчину при намокании. Он делает это, окисляя металл, который затем создает ржавчину.
Как удалить ржавчину?
Да! Есть несколько способов удалить ржавчину, включая шлифование, использование химического средства для удаления ржавчины, использование качественного обезжиривателя или использование электролитического процесса с последующей перекраской металла.
Заключение
Ржавчина может быть дорогостоящим делом, которое часто остается незамеченным. Важно принять меры для предотвращения развития ржавчины и устранить ее на ранней стадии, когда она все же возникла. Убедитесь, что ваш дом или офис хорошо проветриваются, а все места, подверженные сырости, должным образом изолированы.
Что такое RUST… Большое количество технической информации, которая поможет вам принять правильное решение
Ржавчина встречается повсеместно и является обычным явлением.
Ржавчина – это общий термин для различных форм оксида железа.
Они образуются в результате химической реакции между железом и кислородом в присутствии воды. Кислород содержится в воздухе, которым мы дышим, а воду можно найти во влажном воздухе или в виде жидкостей, которые обычно находятся вокруг нас.
Ржавчина на самом деле Fe 2 O 3 , красноватая форма оксида железа. У железа есть еще один оксид Fe 3 O 4 , который иногда называют черным оксидом или черной ржавчиной. Красная ржавчина встречается в среде, богатой кислородом, а черная ржавчина — в среде с низким содержанием кислорода, например, под водой. Черный оксид является хорошей защитой для стали. Как и оксид алюминия, молекулы черного оксида имеют тот же размер, что и молекулы железа, поэтому черный оксид не растет и не отслаивается. Черная окись – это настоящее воронение из пистолета, окись, которую можно найти на некоторых сверлах. Черный оксид также наблюдается на железе и стали, прошедших горячую обработку.
Красная ржавчина встречается в среде, богатой кислородом, а черная ржавчина — в среде с низким содержанием кислорода, например, под водой. Черный оксид является хорошей защитой для стали. Как и оксид алюминия, молекулы черного оксида имеют тот же размер, что и молекулы железа, поэтому черный оксид не растет и не отслаивается. Черная окись – это настоящее воронение из пистолета, окись, которую можно найти на некоторых сверлах. Черный оксид также наблюдается на железе и стали, прошедших горячую обработку.
Ржавчина начинается с появления легкой пыли на незащищенном куске стали или ее сплава. По мере развития ржавчины частицы ржавчины начинают расти и, в случае красной ржавчины, начинают отслаиваться от основного металла. Ржавчина фактически удаляет железо, с которым реагируют кислород и вода, оставляя основной металл «изъеденным». точечная коррозия не заметна, если ржавчина достаточно легкая, и может быть нежелательной, если происходит сильное или сильное ржавление.
Ржавчина – это общеизвестная коррозия железа и его сплавов, таких как сталь или чугун. Другие металлы подвергаются аналогичной коррозии, хотя образующиеся при этом оксиды обычно не называют ржавчиной.
Другие металлы подвергаются аналогичной коррозии, хотя образующиеся при этом оксиды обычно не называют ржавчиной.
По прошествии достаточного количества времени кислород, вода и любая масса железа в конечном итоге полностью превращаются в ржавчину и в конечном итоге распадаются. Коррозия алюминия очень медленная, потому что образующийся оксид алюминия образует полузащитный барьер или покрытие, которое защищает оставшийся алюминий. Защитный барьер представляет собой процесс, известный как пассивация.
Многие материалы реагируют с кислородом с образованием химического соединения, представляющего собой комбинацию этого материала и кислорода. Когда железо соединяется с кислородом, оно образует оксид железа или ржавчину. Оксид железа представляет собой более крупную молекулу, чем железо, поэтому, если железо окисляется, оно часто вздувается и даже может отслаиваться. Это связано с тем, что для ржавчины требуется больше физического пространства, чем для исходного железа.
Ржавчина расширяется или вздувается, образуя трещины и пустоты, которые подвергают воздействию окружающей среды больше оголенного металла. Таким образом, ржавление железа может прогрессировать и ограничивается только разрушением всего твердого железа. Другие металлы окисляются, но оксиды некоторых других металлов не больше, чем сам металл, поэтому они не вздуваются и не отслаиваются. Например, алюминий не вздувается при окислении. Это помогает сделать оксид алюминия хорошим защитным покрытием, а не началом быстрой дегенерации.
Таким образом, ржавление железа может прогрессировать и ограничивается только разрушением всего твердого железа. Другие металлы окисляются, но оксиды некоторых других металлов не больше, чем сам металл, поэтому они не вздуваются и не отслаиваются. Например, алюминий не вздувается при окислении. Это помогает сделать оксид алюминия хорошим защитным покрытием, а не началом быстрой дегенерации.
Некоторые вещи заставляют сталь или железо ржаветь быстрее, чем другие. Вода вызывает ржавчину железа и стали. Разнородные металлы ржавеют быстрее, чем отдельные металлы из-за электрохимических реакций, поэтому сталь ржавеет быстрее, чем железо, а соединения разнородных металлов ржавеют очень быстро. Соленая вода вызывает ржавчину быстрее, чем вода, потому что соленая вода является лучшим проводником электричества. Как и большинство химических реакций, тепло также ускоряет ржавчину.
Условия, влияющие на ржавчину
Для начала и ускорения ржавчины необходимы кислород, вода и железо. Следовательно, удаление одного из этих элементов приведет к остановке реакции. Следующие источники воды будут усиливать эту реакцию и обсуждаются ниже.
Следовательно, удаление одного из этих элементов приведет к остановке реакции. Следующие источники воды будут усиливать эту реакцию и обсуждаются ниже.
Влажность: Количество воды в воздухе, которым мы дышим. Уровень влажности зависит от температуры и источника воды, такого как большой водоем. Мы можем найти наибольшее количество влаги в жаркие влажные дни. В эти дни ржавление может значительно ускориться по сравнению с холодными сухими зимними днями. Осушение может значительно уменьшить количество воды в горячем влажном воздухе.
Вода: Вода окружает нас повсюду, ее можно найти в воздухе, дожде и других источниках. увеличение количества воды вокруг железных деталей увеличит скорость их ржавчины.
Соленая вода: Соленая вода особенно агрессивна по отношению к железу или стали. Корабли, пристани, береговые линии и другие подобные места сильно страдают от ржавчины. Зимы на севере являются виновниками преждевременной ржавчины автомобилей из-за «посолки» дорог для сцепления с дорогой.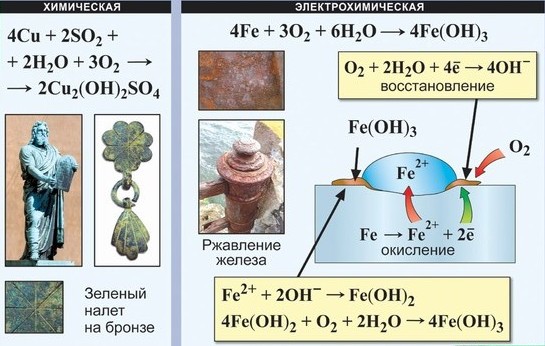
Как защитить металлы от ржавчины
Окраска: Окраска адекватно защищает металлы от коррозии. Ключ к покраске заключается в том, чтобы закрасить металл без загрязнений. Металл должен быть свободен от масел/смазок и ржавчины/нагара. даже если вы удалите все загрязнения, кроме всей ржавчины, ржавчина будет продолжать ржаветь под краской и преждевременно отслаиваться от лакокрасочного покрытия.
Средства для защиты от ржавчины: Средства для защиты от ржавчины не обеспечивают защиту красок. Это покрытие обеспечивает защиту от ржавчины, если покрытие не смыть, не оставить снаружи и т.п. Обычно используется в промежутках между процессами или в защищенных средах.
Ингибиторы ржавчины: Ингибиторы используются только в течение короткого времени, чтобы предотвратить быструю ржавчину деталей и легко удаляются.
Материалы с летучими ингибиторами коррозии: Пары ингибиторов коррозии Некоторые химические вещества выделяют пары, препятствующие попаданию влаги из воздуха на поверхность черных металлов, тем самым препятствуя образованию оксидов.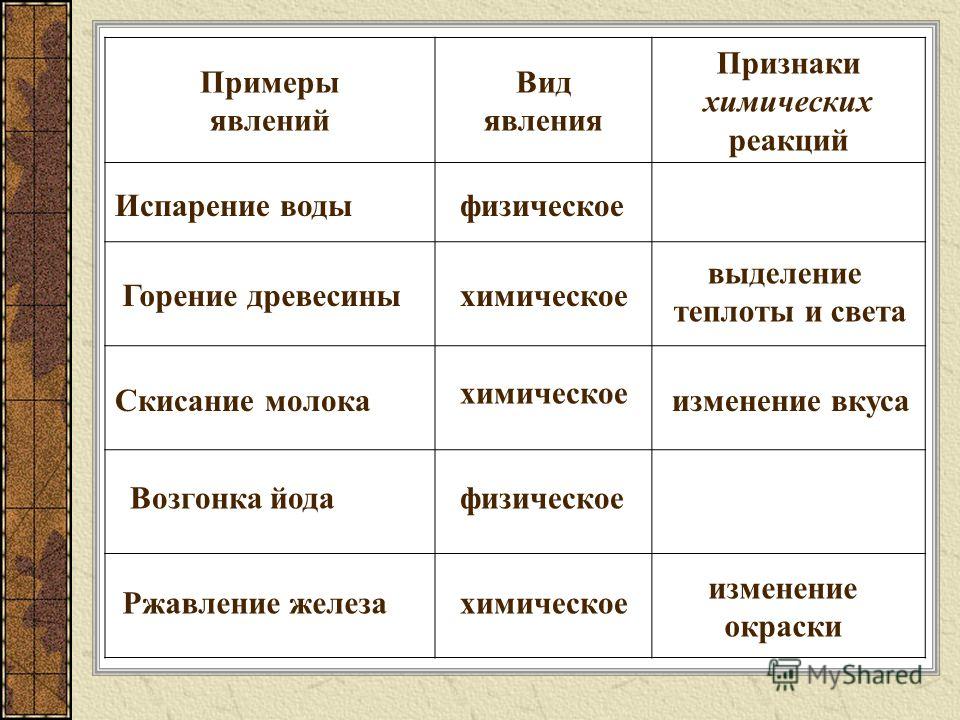 Обычно используется в закрытых контейнерах или обернутых предметах.
Обычно используется в закрытых контейнерах или обернутых предметах.
Катодная защита: Используется в автомобилях для замедления процесса коррозии. Работает по катодному и анодному принципам.
КАК УДАЛИТЬ РЖАВЧИНУ?
Нагрев: Нагрейте деталь сильным нагревом с помощью ацетиленовой горелки или аналогичного прибора. Это удалит большую часть ржавчины, и этому может помочь удар молотком.
Кислоты: В прошлом обычно использовались кислоты. Они хорошо работают, но опасны для сотрудников и вашего здоровья. Требует защитного снаряжения и техники безопасности. Кислоты необходимо несколько раз тщательно промыть чистой водой, чтобы удалить все кислоты. Утилизация может быть дорогостоящей и обязательной.
Электролитический: Использует электрический ток для запуска реакции анода и катода с оксидом железа. Удаление ржавчины может занять до недели. Также углы, острые кромки и т. д.



