Признаки ржавления железа: Признаки химических реакций — урок. Химия, 8 класс.
Содержание
8 класс. Химия. Предмет химии — Предмет химии
Комментарии преподавателя
Химические вещества и физические тела.
Химия – это наука о веществах, их свойствах и превращениях друг в друга.
Все, что нас окружает, – люди, животные, растения, горы, моря, предметы – имеет непосредственное отношение к химии. Окружающие нас предметы и объекты называют физическими телами. Тела состоят из множества различных веществ. К настоящему моменту известно около 15 миллионов веществ, и это далеко не предел!
Гвоздь – это тело, состоящее из вещества – железа. Кусок гранита – это тоже тело, состоящее из нескольких веществ – кварца, слюды и полевого шпата. Рис. 1.
Рис. 1. Гранит и составляющие его вещества
Одни и те же тела часто изготавливают из разных веществ. Например, проволока может быть медной, железной, алюминиевой. И наоборот, из одного и того же вещества могут быть изготовлены различные тела: из стекла сделаны разные виды посуды, вазы и т. д
д
Запомните! Каждое тело состоит из какого-либо вещества!
Свойства вещества
Физические свойства веществ
Каждое вещество характеризуется определенными свойствами.
Свойства вещества – это признаки, по которым вещества отличаются друг от друга или сходны между собой.
К физическим свойствам вещества относятся его
- плотность,
- агрегатное состояние,
- цвет,
- температуры плавления и кипения,
- электро- и теплопроводность.
- Одна из задач химии – это изучение веществ, их свойств и прогнозирование использования веществ в промышленности, сельском хозяйстве и медицине.
Например, вещество алюминий – это металл серебристо-белого цвета. Сравнительно легкий (его плотность составляет 2,7 г/см3), плавится при температуре 600 °С. Алюминий очень пластичен и обладает хорошей электропроводностью. Из-за легкости алюминий в виде сплавов используют в самолето- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта. Рис. 2.
Его также используют для изготовления электрических проводов и предметов быта. Рис. 2.
Рис. 2. Алюминий и изделия из него
Физические и химические явления
Физические явления
Кроме физических свойств, каждое вещество обладает способностью к превращению. Что же такое превращение веществ?
Представьте, что мы нагрели воду и она испарилась. Произошло ли при этом превращение вещества? Нет, испарение воды – это физическое явление. Водяной пар – это химическое вещество вода, только не в жидком, а газообразном агрегатном состоянии. Физические явления – это явления, при которых данные вещества не превращаются в другие, а только изменяется их агрегатное состояние или форма.
Химические явления или химические реакции
Возьмем другой пример – ржавление железа. Железо ржавеет при взаимодействии с водой и кислородом. Ржавчина – хрупкое вещество бурого цвета. Таким образом, происходит превращение веществ – железа, кислорода и воды – в ржавчину. Это явление относится к химическим. Химические явления иначе называют химическими реакциями.
Это явление относится к химическим. Химические явления иначе называют химическими реакциями.
Химические явления или химические реакции – это явления, при которых из данных веществ образуются другие.
Вещества, вступающие в химическую реакцию (в рассмотренном примере – это железо, кислород и вода), называют исходными веществами.
Вещества, получающиеся в результате реакции (в данном случае – ржавчина), называют продуктами реакции.
Вывод
При физическом явлении изменения вещества не происходит, а изменяется лишь его агрегатное состояние или форма. В результате химической реакции происходит превращение исходных веществ в продукты реакции. Рис. 3.
Рис. 3. Классификация явлений
Признаки химической реакции
О протекании химического превращения можно судить по следующим признакам:
- выпадение осадка,
- выделение газа,
- изменение цвета,
- выделение или поглощение тепла и другим.

Есть химические превращения, при которых не происходит проявления признаков реакции. Более того, ряд перечисленных признаков может соответствовать и физическим процессам. Стоит открыть, например, бутылку с газированным напитком, как из нее с шипением выделится углекислый газ, который был растворен в воде под большим давлением.
При охлаждении насыщенного раствора растворенное вещество часто выпадает в осадок. Такое явление называют кристаллизацией. Кристаллизация не сопровождается превращением вещества, т. е. относится к физическим явлениям.
Химия – это наука о веществах, химических реакциях и их применении.
Химические знания помогают бороться с различными болезнями человека, животных и растений. Изучая свойства веществ, составляющих неживую природу, люди учатся бережно и грамотно ее использовать.
Источники
http://www.youtube.com/watch?v=VoRjw1q7zSM
http://www. youtube.com/watch?t=3&v=ZbLr3ewOyNs
youtube.com/watch?t=3&v=ZbLr3ewOyNs
http://www.youtube.com/watch?t=140&v=f2Ay41WphVc
http://www.youtube.com/watch?t=8&v=esCELFm85Ro
источник презентации — http://ppt4web.ru/khimija/predmet-khimii-veshhestva.html
Конспект http://interneturok.ru/ru/school/chemistry/8-klass
Почему ржавеет гвоздь? | Наука и жизнь
Ржавый гвоздь, ржавый мост, ржавый забор, ржавый корабль. Почему всё железное ржавеет и что же такое ржавчина?
Алюминиевая руда — боксит — состоит из гидроксидов алюминия, оксидов железа и кремния. Внешне она совершенно не похожа на алюминий
Фото Натальи Домриной.
Коррозия в сочетании с ошибками в конструкции привели к разрушению моста через реку Миссисипи в штате Миннесота (США) в августе 2007 года.
Даже к такому простому делу, как мытьё раковины, надо подходить с умом. Обширная питтинговая и язвенная коррозия кухонной мойки из нержавеющей стали вызвана неправильным подбором чистящих средств, которые содержат соединения хлора.
Обширная питтинговая и язвенная коррозия кухонной мойки из нержавеющей стали вызвана неправильным подбором чистящих средств, которые содержат соединения хлора.
Коррозионное растрескивание нижней части корпуса стало причиной крушения самолёта «Боинг-737» компании «Элоу Эйрлайн» в апреле 1988 года.
‹
›
Открыть в полном размере
Давайте вспомним, откуда берётся железо или, например, алюминий. Правильно, их выплавляют из руды — железной, марганцевой, магниевой, алюминиевой и др. Металлы в рудах содержатся в основном в виде оксидов, гидроксидов, карбонатов, сульфидов, то есть в виде химических соединений с кислородом, водой, серой и пр.
В природе в металлическом, или свободном, состоянии в основном можно встретить лишь золото, платину, иногда серебро. Эти металлы устойчивы, то есть не стремятся (или слабо стремятся) образовывать химические соединения. Наверное, по этой причине они получили название благородных.
Что же до подавляющего большинства металлов, то, чтобы они находились в свободном состоянии, их надо восстановить из природных рудных соединений, то есть выплавить. Выходит, выплавляя металл, мы переводим его из устойчивого состояния в неустойчивое. Вот он и стремится вернуться в исходное состояние — окислиться. Это и есть коррозия — естественный для металлов процесс разрушения при взаимодействии с окружающей средой. Частный случай коррозии — ржавление — образование на железе гидроксида железа Fe(ОН)3. Этот процесс может протекать только в присутствии влаги (воды или водяных паров).
Выходит, выплавляя металл, мы переводим его из устойчивого состояния в неустойчивое. Вот он и стремится вернуться в исходное состояние — окислиться. Это и есть коррозия — естественный для металлов процесс разрушения при взаимодействии с окружающей средой. Частный случай коррозии — ржавление — образование на железе гидроксида железа Fe(ОН)3. Этот процесс может протекать только в присутствии влаги (воды или водяных паров).
Но почему же тогда не рушатся в одночасье мосты, не рассыпаются мгновенно самолёты и автомобили? Да и кастрюльки со сковородками не превращаются на наших глазах в рыжий, чёрный или серый порошок. К счастью, реакции окисления металлов протекают не столь стремительно. Как и любой процесс, они идут с определённой скоростью, порою очень небольшой. Более того, есть много способов замедлить коррозию.
Плечо друга
Вы замечали, что на нержавеющей стали не бывает ржавчины, хотя её основу составляет то же самое железо, которое при окислении (в присутствии воды или водяного пара) превращается в рыжий мохнатый гидроксид.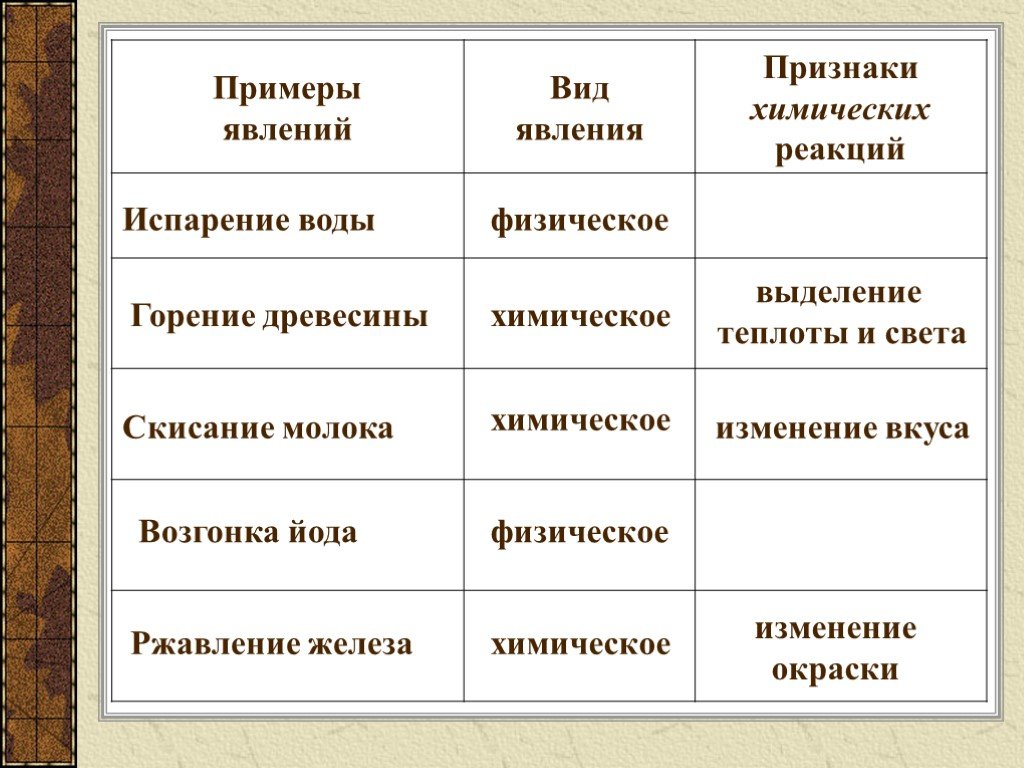 Тут есть одна хитрость: нержавеющая сталь — это сплав железа с другими металлами. Введение в металлические сплавы элементов для придания им тех или иных свойств называется легированием.
Тут есть одна хитрость: нержавеющая сталь — это сплав железа с другими металлами. Введение в металлические сплавы элементов для придания им тех или иных свойств называется легированием.
Основной легирующий элемент, который добавляют к обычной (углеродистой) стали, чтобы получить нержавеющую, — хром. Этот металл тоже стремится окислиться, что он с успехом и делает гораздо охотнее и быстрее, чем само железо. При этом на поверхности нержавеющей стали быстро образуется плёнка из оксида хрома. В отличие от рыхлой ржавчины компактный тёмный оксид хрома не даёт агрессивным ионам окружающей среды проникать к поверхности металла, то есть оксид попросту прикрывает собой металл, и процесс коррозии прекращается. Такие оксидные плёнки называются защитными. В нержавеющих сталях хрома должно быть строго определённое количество, но не менее 13%. Кроме хрома в нержавеющие стали часто добавляют никель, молибден, ниобий и титан.
Благодаря защитным плёнкам многие металлы неплохо выдерживают воздействие различных сред. Возьмём, к примеру, алюминиевую кастрюльку, в какой кипятят молоко или варят манную кашу. Обычно такая кастрюлька не блестит, подобно хрому или нержавеющей стали, и имеет слегка белёсый цвет. Дело в том, что на алюминии, как и на других металлах, на воздухе всегда образуется белёсая оксидная плёнка (оксид алюминия), которая отлично защищает металл от коррозии. Такие плёнки называются пассивными, а металлы, на которых они самопроизвольно образуются, — пассивирующимися. Если же алюминиевую кастрюльку почистить металлической щёткой, налёт исчезнет и появится металлический блеск. Но очень быстро поверхность вновь покроется плёнкой оксида алюминия и станет белёсой.
Возьмём, к примеру, алюминиевую кастрюльку, в какой кипятят молоко или варят манную кашу. Обычно такая кастрюлька не блестит, подобно хрому или нержавеющей стали, и имеет слегка белёсый цвет. Дело в том, что на алюминии, как и на других металлах, на воздухе всегда образуется белёсая оксидная плёнка (оксид алюминия), которая отлично защищает металл от коррозии. Такие плёнки называются пассивными, а металлы, на которых они самопроизвольно образуются, — пассивирующимися. Если же алюминиевую кастрюльку почистить металлической щёткой, налёт исчезнет и появится металлический блеск. Но очень быстро поверхность вновь покроется плёнкой оксида алюминия и станет белёсой.
Укрощение активных
Перевести металл в пассивное состояние можно принудительным образом. Например, железо помимо незащитных гидроксида железа или же низших оксидов (закиси и закиси-окиси) при определённых условиях образует высший оксид — окись железа (Fe2О3). Этот оксид неплохо защищает металл и его сплавы при высоких температурах на воздухе, он же (одна из его форм) «ответственен», как считают специалисты, за пассивное состояние железных сплавов во многих водных средах.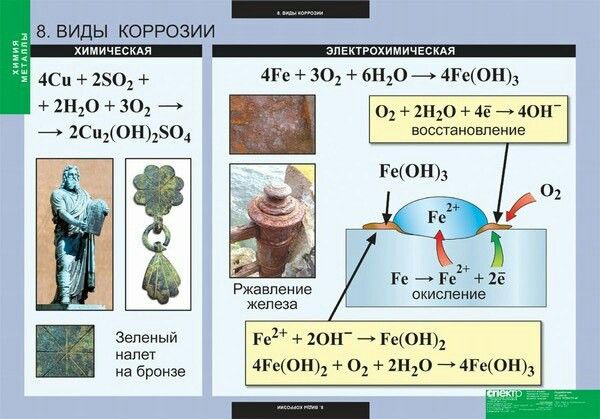
Устойчивость нержавеющей стали в крепкой серной кислоте связана именно с пассивированием стали в этой весьма агрессивной среде. Если же поместить нержавейку в слабый раствор серной кислоты, сталь начнёт корродировать. Парадокс объясняется просто: крепкая серная кислота обладает сильными окислительными свойствами, благодаря чему на поверхности нержавеющей стали образуется пассивирующая плёнка, а в слабой кислоте не образуется.
В случаях, когда агрессивная среда недостаточно «окислительная», используют специальные химические добавки, помогающие образованию на поверхности металла пассивной плёнки. Такие добавки называют ингибиторами или замедлителями коррозии.
Не все металлы способны образовывать пассивные плёнки, даже принудительно. В этом случае добавление в агрессивную среду ингибитора, напротив, удерживает металл в «восстановительных» условиях, в которых его окисление подавляется (оно энергетически невыгодно).
Жертвоприношение
Искусственно поддерживать металл в «восстановительных» условиях можно и иным способом, ведь не всегда есть возможность добавить ингибитор. Возьмём, к примеру, обычное оцинкованное ведро. Оно сделано из углеродистой стали, а сверху покрыто слоем цинка. Цинк — более активный металл, чем железо, значит, он охотнее вступает в химические реакции. Поэтому цинк не просто механически изолирует стальное ведро от окружающей среды, но и «принимает огонь на себя», то есть корродирует вместо железа.
Возьмём, к примеру, обычное оцинкованное ведро. Оно сделано из углеродистой стали, а сверху покрыто слоем цинка. Цинк — более активный металл, чем железо, значит, он охотнее вступает в химические реакции. Поэтому цинк не просто механически изолирует стальное ведро от окружающей среды, но и «принимает огонь на себя», то есть корродирует вместо железа.
Похожим способом нередко защищают днища кораблей. Только их не покрывают сплошным слоем цинка, марганца или алюминия — это было бы очень дорого да и сложно, а прикрепляют к днищу солидный кусок более активного металла (протектора). В итоге протектор разрушается, а днище корабля остаётся целым и невредимым.
Для подземных коммуникаций «восстановительные» условия создают с помощью электрохимической защиты: накладывают на защищаемый металл отрицательный (катодный) потенциал от внешнего источника тока, так что на металле прекращается процесс окисления.
Однако зачем нужно столько разных сложных способов защиты металлов? Разве нельзя просто покрасить металл или нанести на него эмаль?
Во-первых, всё покрасить невозможно. А во-вторых… Возьмём для примера эмалированную кастрюлю или автомобиль. Если кастрюля, вырвавшись из рук, с грохотом упадёт на пол и отшибёт себе эмалированный бочок, то под отколовшейся эмалью будет зиять «чёрный глаз», края которого постепенно окрасятся в предательский рыжий цвет — скол покроется ржавчиной. Не лучшая судьба ждёт и автомобиль, если вдруг в его лаковом боку (а чаще на стыке с днищем) образуется небольшая дырочка в слое лака. Этот канал поступления к корпусу агрессивных агентов — воды, кислорода воздуха, сернистых соединений, соли — немедленно заработает, и корпус начнёт ржаветь. Вот и приходится владельцам автомобилей делать дополнительную антикоррозионную обработку.
А во-вторых… Возьмём для примера эмалированную кастрюлю или автомобиль. Если кастрюля, вырвавшись из рук, с грохотом упадёт на пол и отшибёт себе эмалированный бочок, то под отколовшейся эмалью будет зиять «чёрный глаз», края которого постепенно окрасятся в предательский рыжий цвет — скол покроется ржавчиной. Не лучшая судьба ждёт и автомобиль, если вдруг в его лаковом боку (а чаще на стыке с днищем) образуется небольшая дырочка в слое лака. Этот канал поступления к корпусу агрессивных агентов — воды, кислорода воздуха, сернистых соединений, соли — немедленно заработает, и корпус начнёт ржаветь. Вот и приходится владельцам автомобилей делать дополнительную антикоррозионную обработку.
Невидимый злодей
Так, может, проблема коррозии металлов решена? Увы, не всё так просто. Любые коррозиестойкие сплавы устойчивы только в определённых средах и условиях, для которых они разработаны. Например, большинство нержавеющих сталей отлично выдерживают кислоты, щёлочи и очень «не любят» хлориды, в которых они часто подвергаются местным видам коррозии — язвенной, точечной и межкристаллитной. Это очень коварные коррозионные разрушения. Конструкция из красивого, блестящего металла без намёка на ржавление может однажды рухнуть или рассыпаться. Всё дело в мельчайших точечных, но очень глубоких поражениях. Или же в микротрещинах, не видимых глазом на поверхности, но пронизывающих буквально всю толщу металла. Не менее опасно для многих сплавов, не подверженных общей коррозии, так называемое коррозионное растрескивание, когда внезапно конструкцию пронизывает огромная трещина. Такое случается с металлами, испытывающими длительные механические нагрузки — в самолётах и вертолётах, в различных механизмах и строительных конструкциях.
Это очень коварные коррозионные разрушения. Конструкция из красивого, блестящего металла без намёка на ржавление может однажды рухнуть или рассыпаться. Всё дело в мельчайших точечных, но очень глубоких поражениях. Или же в микротрещинах, не видимых глазом на поверхности, но пронизывающих буквально всю толщу металла. Не менее опасно для многих сплавов, не подверженных общей коррозии, так называемое коррозионное растрескивание, когда внезапно конструкцию пронизывает огромная трещина. Такое случается с металлами, испытывающими длительные механические нагрузки — в самолётах и вертолётах, в различных механизмах и строительных конструкциях.
Крушение поездов, падение самолётов, разрушение мостов, выбросы газа и разливы нефти из трубопроводов — причиной подобных катастроф нередко становится коррозия. Чтобы её укротить, предстоит ещё много узнать о сложнейших природных процессах, происходящих вокруг нас.
Ржавление железа – объяснение, химическая реакция, предотвращение
Содержание
Какая химия стоит за ржавлением железа? Почему ржавление является нежелательным явлением? Факторы, влияющие на ржавление железаКак можно предотвратить ржавление?
Ржавление железа относится к образованию ржавчины , смеси оксидов железа, на поверхности железных предметов или конструкций. Эта ржавчина образуется в результате окислительно-восстановительной реакции между кислородом и железом в среде, содержащей воду (например, в воздухе с высоким уровнем влажности). Ржавление железа характеризуется образованием слоя красного хлопьевидного вещества, которое легко рассыпается в порошок.
Эта ржавчина образуется в результате окислительно-восстановительной реакции между кислородом и железом в среде, содержащей воду (например, в воздухе с высоким уровнем влажности). Ржавление железа характеризуется образованием слоя красного хлопьевидного вещества, которое легко рассыпается в порошок.
Ржавление железа
Это явление является прекрасным примером коррозии металлов, когда поверхности металлов разлагаются на более химически устойчивые оксиды. Однако термин «ржавление» обычно используется для обозначения коррозии предметов, изготовленных из железа или железных сплавов.
Какая химия стоит за ржавчиной железа?
Воздействие кислорода на железо (или сплав железа) в присутствии влаги приводит к образованию ржавчины. Эта реакция не мгновенна, она обычно протекает в течение значительно больших временных рамок. Атомы кислорода связываются с атомами железа, что приводит к образованию оксидов железа. Это ослабляет связи между атомами железа в объекте/структуре.
Реакция ржавления железа включает повышение степени окисления железа, сопровождающееся потерей электронов. Ржавчина в основном состоит из двух разных оксидов железа, которые различаются по степени окисления атома железа. Эти оксиды:
- Оксид железа(II) или оксид железа. Степень окисления железа в этом соединении равна +2, а его химическая формула — FeO.
- Оксид железа(III) или оксид железа, где атом железа имеет степень окисления +3. Химическая формула этого соединения Fe 2 О 3 .
Кислород является очень хорошим окислителем, тогда как железо является восстановителем. Поэтому атом железа легко отдает электроны при контакте с кислородом. Химическая реакция определяется как:
Fe → Fe 2+ + 2e –
Степень окисления железа еще больше повышается за счет атома кислорода в присутствии воды.
4Fe 2+ + O 2 → 4Fe 3+ + 2О 2-
Между катионами железа и молекулами воды происходят следующие кислотно-щелочные реакции.
Fe 2+ + 2H 2 O⇌ Fe(OH) 2 + 2H +
Fe 3+ + 3H 2 O ⇌ Fe(OH) 3 + 3H +
Гидроксиды железа также образуются в результате прямой реакции между катионами железа и гидроксид-ионами.
O 2 + H 2 O + 4e – → 4OH –
Fe 2+ + 2OH – → Fe(OH) 2
Fe 3+ + 3OH – → Fe(OH) 3
Полученные гидроксиды железа теперь подвергаются дегидратации с образованием оксидов железа, из которых состоит ржавчина. Этот процесс включает в себя множество химических реакций, некоторые из которых перечислены ниже.
- Fe(OH) 2 ⇌ FeO + H 2 O
- 4FE (OH) 2 + O 2 + XH 2 O → 2FE 2 O 3 .
 (X + 4) H 2 O
(X + 4) H 2 O - Fe(OH) 3 ⇌ FeO(OH) + H 2 O
- 2FeO(OH) ⇌ Fe 2 O 3 + H 2 O
Одно сходство между всеми перечисленными выше химическими реакциями заключается в том, что все они зависят от присутствия воды и кислорода. Следовательно, ржавлением железа можно управлять, ограничивая количество кислорода и воды, окружающих металл.
Почему ржавление нежелательно?
Ржавчина делает железо хрупким и хрупким, ухудшая его прочность, внешний вид и проницаемость. Ржавое железо не обладает желаемыми свойствами железа. Ржавление железа может привести к повреждению автомобилей, перил, решеток и многих других железных конструкций.
Обрушение Серебряного моста в 1967 году и моста через реку Мианус в 1983 году связано с коррозией стальных/железных компонентов моста. Многие здания из железобетона также подвергаются структурным разрушениям в течение длительных периодов времени из-за ржавчины.
Ржавое железо может быть рассадником бактерий, вызывающих столбняк. Порезы от этих предметов, которые прокалывают кожу, могут быть опасны.
Поскольку ржавление происходит ускоренными темпами во влажных условиях, ему подвержены внутренние поверхности водопроводных труб и резервуаров. Это приводит к тому, что по трубам течет коричневая или черная вода, содержащая небезопасное количество оксидов железа.
Факторы, влияющие на ржавление железа
Многие факторы ускоряют ржавление железа, например, содержание влаги в окружающей среде и pH окружающей среды. Некоторые из этих факторов перечислены ниже.
- Влага: Коррозия железа ограничивается наличием воды в окружающей среде. Воздействие дождей является наиболее распространенной причиной ржавчины.
- Кислота: если pH среды, окружающей металл, низкий, процесс ржавчины ускоряется. Ржавление железа ускоряется, когда оно подвергается воздействию кислотных дождей. Более высокий pH препятствует коррозии железа.

- Соль: Железо быстрее ржавеет в море из-за присутствия различных солей. Соленая вода содержит много ионов, которые ускоряют процесс ржавчины посредством электрохимических реакций.
- Примесь: Чистое железо ржавеет медленнее по сравнению с железом, содержащим смесь металлов.
Размер железного предмета также может влиять на скорость процесса ржавления. Например, большой железный предмет, вероятно, будет иметь небольшие дефекты в результате процесса плавки. Эти недостатки являются платформой для атак на металл из окружающей среды.
Как предотвратить ржавление?
Железо и его сплавы широко применяются в строительстве многих конструкций, во многих машинах и предметах. Поэтому предотвращение коррозии железа очень важно. Некоторые профилактические методы перечислены ниже.
Сплавы, стойкие к коррозии
Некоторые сплавы железа устойчивы к ржавчине. Примеры включают нержавеющую сталь (со слоем оксида хрома (III)) и атмосферостойкую сталь.
Сталь
COR-TEN ржавеет относительно медленнее по сравнению с обычной сталью. В этом сплаве ржавчина образует защитный слой на поверхности сплава, предотвращая дальнейшую коррозию.
Гальванизация
- Гальванизация – это процесс нанесения защитного слоя цинка на металл. Это очень распространенный метод предотвращения коррозии железа.
- Это можно сделать путем погружения защищаемого металла в горячий расплавленный цинк или с помощью гальванического покрытия.
- Цинк — относительно дешевый металл, который легко прилипает к стали. Он также обеспечивает катодную защиту поверхности железа, выступая в качестве анода. Из-за этого корродирует слой цинка вместо железа.
- Недостатки гальванизации заключаются в том, что она обеспечивает защиту от коррозии только на ограниченный период времени, так как в процессе съедается слой цинка. Он не очень эффективен в зонах с высокой коррозией (где вместо него можно использовать кадмиевое покрытие).

Катодная защита
- Обеспечение металлов электрическим зарядом может помочь подавить электрохимические реакции, которые приводят к ржавчине.
- Это можно сделать, превратив железо/сталь в катод, прикрепив к нему расходуемый анод.
- Этот жертвенный анод должен иметь электродный потенциал более отрицательный, чем у железа.
- В качестве расходуемых анодов обычно используются магний, цинк и алюминий. Как только они подверглись коррозии, их необходимо заменить, чтобы защитить железо/сталь.
Покрытия
Многие типы покрытий могут быть нанесены на поверхность открытого металла для предотвращения коррозии. Типичными примерами покрытий, предотвращающих коррозию, являются краски, восковые ленты и лаки.
Предметы меньшего размера покрыты водовытесняющими маслами, которые предотвращают ржавление предмета. Многие промышленные машины и инструменты из железа покрыты слоем смазки, которая смазывает металл, уменьшая трение и одновременно предотвращая ржавление.
Чтобы узнать больше о ржавчине железа и других связанных понятиях, таких как коррозия металлов, зарегистрируйтесь в BYJU’S и загрузите мобильное приложение на свой смартфон.
Часто задаваемые вопросы – Часто задаваемые вопросы
Q1
Что такое физические и химические изменения?
Химический переход является результатом химической реакции, а физическое изменение происходит там, где изменяется структура вещества, но не химическая идентичность. Примеры химических превращений включают огонь, жарку, ржавление и гниение. Примеры физических изменений — кипеть и замерзать.
Q2
Что определяет химическое изменение?
Химические реакции, требующие перегруппировки атомов одного или нескольких соединений и изменения их химических свойств или структуры, приводящие к образованию по крайней мере одного нового вещества: железная ржавчина представляет собой химическое изменение.
Q3
Является ли плавление цинка химическим изменением?
Химическая реакция представляет собой механизм, при котором одно или несколько соединений превращаются в одно или несколько других соединений. Химическая реакция не зарегистрирована. Однако, если смесь поглощает энергию в виде тепла, цинк может химически реагировать с серой с образованием соединения сульфида цинка (ZnS).
Химическая реакция не зарегистрирована. Однако, если смесь поглощает энергию в виде тепла, цинк может химически реагировать с серой с образованием соединения сульфида цинка (ZnS).
Q4
Какой процесс является химическим изменением?
Материальные модификации возникают, когда вещество становится новым материалом, что называется химическим синтезом или, аналогично, химическим разложением на два или три отдельных соединения, объединенных с другим. Эти механизмы называются химическими реакциями, и они обычно необратимы или не являются дополнительными химическими реакциями.
Q5
Каково значение химических изменений?
Химические процессы позволяют понять свойства материи. Мы можем узнать его химические свойства, наблюдая за тем, как образец взаимодействует с другим веществом. Эти свойства можно использовать для классификации неизвестного образца или для предсказания того, как различные виды материи могут реагировать друг с другом.
Понимание трех ранних стадий образования ржавчины
- Автор: Admin
- •
- 19 января 2018 г.
Ржавчина представляет собой одну из самых серьезных угроз для железа и стали. К сожалению, это также представляет собой естественный процесс, который трудно полностью предотвратить. Если ее не остановить, ржавчина будет расти все сильнее и сильнее, пока в конце концов она не проест материал насквозь. Это может оставить такие вещи, как инструменты и автомобили, в опасно ослабленном состоянии.
К счастью, вы можете защитить свои инвестиции, удалив Rust Professional. Тем не менее, если вы не будете действовать достаточно быстро, они могут мало чем вам помочь. Если вы хотите улучшить свое понимание разрушительного воздействия ржавчины, читайте дальше. В этой статье будут описаны три ранних стадии образования ржавчины, а также тактика ремонта, используемая на каждой стадии.
1. Ступень 0
Нулевая ступень представляет собой идеальную базовую линию, на которой отсутствует ржавчина. Это означает, что вы вообще не сможете увидеть ржавчину. Также на поверхности металла не должно быть следов травления или питтинга. Если поверхность будет окрашена, краска не будет пузыриться или трескаться.
Это означает, что вы вообще не сможете увидеть ржавчину. Также на поверхности металла не должно быть следов травления или питтинга. Если поверхность будет окрашена, краска не будет пузыриться или трескаться.
На стадии 0 ремонт не требуется, так как ржавчины нет. Тем не менее, вы все равно можете принять меры, чтобы свести к минимуму вероятность образования ржавчины, следя за тем, чтобы поверхность оставалась как можно более чистой. Обязательно вытрите потенциально агрессивные вещества, такие как вода и дорожная соль. Вы должны удалить жир, грязь и растворители, чтобы они не способствовали разрушению каких-либо защитных покрытий.
2. Этап 1
Здесь вы начнете замечать на поверхности металла отложения цвета ржавчины. Такие отложения также могут быть черного или белого цвета. При окрашивании поверхность может пузыриться или трескаться. Однако в этот момент основной металл остается относительно неповрежденным. Другими словами, точечная коррозия или травление не могут привести к потере гладкости поверхности.
Ржавчина 1-й стадии представляет собой поверхностную проблему, но она быстро обострится, если не принять должных мер. Ремонт ржавчины на стадии 1 включает в себя тщательное удаление коррозии с использованием абразивного вещества, такого как наждачная бумага, обнажая голый металл, который находится под ним. Если речь идет о окрашенной поверхности, ремонтник затем наносит слой грунтовки, дает ему высохнуть и окрашивает участок в соответствующий цвет.
3. Стадия 2
На стадии 2 ржавчина усиливается и начинает образовываться вещество, известное как накипь. Окалина относится к участкам ржавчины, которые прогрессировали до такой степени, что они начали проникать в поверхность металла. Этот процесс оставляет после себя осколки ржавого металла, то есть окалину. Образование накипи приводит к тому, что нижележащий металл покрывается ямками и травится, что придает ему шероховатую текстуру.
Профессионал начинает борьбу со второй стадией ржавчины, удаляя все имеющиеся накипи.
