Процесс ржавления железа: Процесс коррозии железа. Химическая коррозия, электрохимическая коррозия, элетрокоррозия
Содержание
Ржавчина
Ржавчина — продукт взаимодействия внешней окислительной атмосферы с железом. Процесс ее образования называется ржавлением ( коррозия ). Термин «ржавчина» присущ только продуктам коррозии железа и его сплавов. Любые другие металлы могут корродировать, но не ржаветь!
Ржавчина — это гидратированная окись железа (гидроксид железа). Химическая формула ржавчины — Fe2O3•H2О (иногда пишут просто Fe2O3). На поверхности образуется в виде шероховатого налета, который имеет рыхлую структуру. Цвет ржавчины — от оранжевого до красно-коричневого.
Железо при рН среды > 5,5 образует труднорастворимый гидрат закиси железа, имеющий белый цвет:
Fe2+mH2O + 2OH— = mH2O + Fe(OH)2↓
При взаимодействии гидрата закиси железа с растворенным кислородом в воде, образуются еще более труднорастворимое соединение — гидрат окиси железа (бурый цвет):
2Fe(OH)2 + 1/2 O2 + H2О = 2Fe(OH)3↓
Вторичные продукты коррозии (Fe(OH)2 и Fe(OH)3) могут и дальше превращаться, с образованием гидратированных окислов FeO•Fe2O3•nH2О — ржавчины. FeO — нестабильное соединение, поэтому в формуле ржавчины его часто просто не записывают.
FeO — нестабильное соединение, поэтому в формуле ржавчины его часто просто не записывают.
2e + 2H+ — H2;
4e +O2 + 4H+ — 2H2O;
2e + Fe(OH)2 + 2H+ — Fe + 2H2O;
2e + Fe2+ — Fe;
2e + Fe(OH)3— + 3H+ — Fe + 3H2O;
e + Fe(OH)3 + H+ — Fe(OH)2 + h3O;
e + Fe(OH)3 + 3H+ — Fe2+ + 3H2O;
Fe(OH)3- + H+ — Fe(OH)2 + H2O;
e + Fe(OH)3 — Fe(OH)3-;
Fe3+ + 3H2O — Fe(OH)3 + 3H+;
Fe2+ + 2H2O — Fe(OH)2 + 2H+;
e + Fe3+ — Fe2+;
Fe2+ + H2O — FeOH + H+;
FeOH+ + H2O > Fe(OH)2 + H+;
Fe(OH)2 + H2O — Fe(OH)3- + H+;
Fe3+ + H2O — FeOH2+ + H+;
FeOH2+ + H2O — Fe(OH)3 + H+;
FeOH2+ + H+ — Fe2+ + H2O;
e + FeOH2+ + 2H+ — Fe2+ +2H2O;
e + Fe(OH)3 + H+ — Fe(OH)2 + H2O;
e + Fe(OH)3 + 2H+ — FeOH+ + 2H2O;
e + Fe(OH)3 + 3H+ — Fe2+ + 3H2O.
Ржавчина может существовать в двух формах: магнитной (γ- Fe2O3) и немагнитной (α-Fe2O3). Гидратированная окись железа в α форме (гематит) -более стабильное соединение. Раствор, насыщенный ржавчиной, почти нейтральный. γ- Fe2O3 обычно между гидратированными оксидами Fe2O3 и FeO образует черный промежуточный слой. Поэтому можно сказать, что ржавчина состоит из трех слоев оксидов железа разной степени окисления.
Процесс ржавления металла начинается только при наличии в воздухе влаги. При попадании на поверхность изделия из железа капли воды, спустя некоторое время, можно заметить изменение ее цвета. Капля становится мутной и постепенно окрашивается в бурый цвет. Это свидетельствует о появлении, в месте контакта воды с поверхностью, продуктов коррозии железа.
Если ржавчина уже образовалась — остановить процесс коррозии крайне трудно и не всегда удается. Лучше его предупреждать и заранее защищать металл!
Процесс коррозии железа.
 Химическая коррозия, электрохимическая коррозия, элетрокоррозия
Химическая коррозия, электрохимическая коррозия, элетрокоррозия
Процесс коррозии железа чаще всего сводится к его окислению кислородом воздуха или кислотами, содержащимися в растворах, и превращению его в оксиды. Коррозия металлов (ржавление) вызывается окислительно-восстановительными реакциями, протекающими на границе металла и окружающей среды. В зависимости от механизма возникновения, различают такие виды коррозии железа, как: химическая, электрохимическая и электрическая.
Процесс химической коррозии железа
Окислительно-восстановительные реакции в данном случае проходят через переход электронов на окислитель. В процессе коррозии такого типа кислород воздуха взаимодействует с поверхностью железа. При этом образуется оксидная пленка, которая называется ржавчиной:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
В отличие от плотно прилегающих оксидных пленок, которые образуются в процессе коррозии на щелочных металлах, алюминии, цинке, рыхлая оксидная пленка на железе свободно пропускает к поверхности металла кислород воздуха, а также другие газы и пары воды. Это способствует дальнейшей коррозии железа.
Это способствует дальнейшей коррозии железа.
Процесс электрохимической коррозии
Этот вид коррозии проходит в среде, которая проводит электрический ток. Металл в грунте подвергается, преимущественно, электрохимической коррозии. Процесс коррозии такого типа – это результат химических реакций с участием компонентов окружающей среды. Также электрохимическая коррозия возникает в случае контакта металлов, находящихся в ряду напряжений на некотором расстоянии друг от друга, в результате чего возникает гальваническая пара катод-анод.
Атмосферный и грунтовый процесс коррозии выражается схемой:
Fe + O2 + H2O → Fe2O3 · xH2O
В результате образуется ржавчина различной расцветки, что обусловлено тем, что образуются различные окислы железа. Какое именно вещество образуется в процессе коррозии железа, зависит от давления кислорода, влажности воздуха, температуры, длительности процесса, состава железного сплава, состояния поверхности изделия и т. д. Скорость разрушения разных металлов различна.
д. Скорость разрушения разных металлов различна.
Процесс коррозии металла в растворах электролитов – это результат работы большого количества микроскопических гальванических элементов, у которых в качестве катода выступают примеси в металле, а в качестве анода – сам металл. В результате чего возникают микроскопические гальванические элементы.
Также атомы железа на разных участках имеют различную способность отдавать электроны (окисляться). Участки металла, на котором протекает этот процесс, выступают в роли анода. Остальные участки – катодные, на которых происходят процессы восстановления воды и кислорода:
H2O + 2e– = 2OH– + H2↑
O2 + 2H2O + 4e– = 4OH–
Результат – из ионов железа (II) и гидроксид-ионов образуется гидроксид железа (II). Далее идет его окисление до гидроксида железа (III) – основного компонента ржавчины:
Fe2+ + 2OH– = Fe(OH)2
Fe(OH)2 + O2 + H2O → Fe2O3 · xH2O
Для того чтобы гальванический элемент работал, необходимо наличие двух металлов различной химической активности и среды, которая проводит электрический ток, – электролита.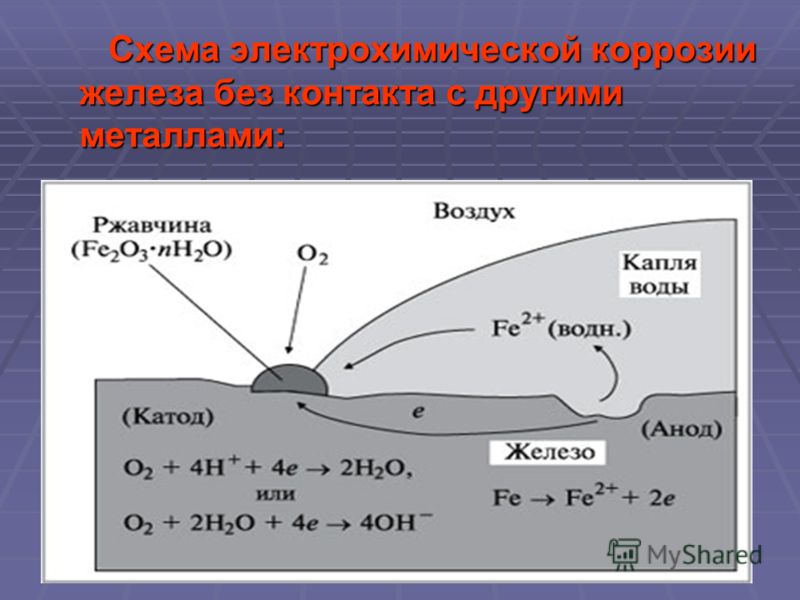 При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
Процесс электрической коррозии
Такой вид разрушения металлических подземных конструкций, кабелей и сооружений могут вызывать блуждающие токи, исходящие от трамваев, метро, электрических железных дорог и различных электроустановок с постоянным током.
Ток с металлических конструкций выходит в грунт в виде положительных ионов металла – происходит электролиз металла. Участок выхода токов – это анодные зоны. Именно в них и протекают активные процессы электрической коррозии железа. Блуждающие токи могут достигать 300 А и действовать в радиусе нескольких десятков километров.
Блуждающими токами, исходящими от источников переменного тока, вызывается слабая коррозия подземных стальных конструкций, и сильная – конструкций из цветных металлов. Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Как записать сбалансированную химическую реакцию для ржавления железа
Обновлено 26 апреля 2018 г.
Автор Chris Deziel
Ржавчина — это факт жизни на Земле, а также, по крайней мере, на одной другой планете Солнечной системы: Марсе. Красноватый оттенок этой планеты во многом обусловлен наличием оксида железа или ржавчины на ее поверхности. Ржавчина является результатом соединения железа с кислородом в процессе, называемом окислением, и наличие ржавчины на Марсе предполагает, что в прошлом на планете могло быть больше молекулярного кислорода, хотя углекислый газ, который является основным компонентом Марса «Настоящая атмосфера, также может поставлять кислород. Помимо газообразного кислорода для образования ржавчины нужна вода, потому что это двухэтапный процесс. Это указывает на то, что вода на Марсе могла быть в изобилии давным-давно.
TL;DR (слишком длинный; не читал)
Для образования ржавчины требуется железо, вода и кислород. Хотя это сложный процесс, химическое уравнение простое: 4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3 .
Хотя это сложный процесс, химическое уравнение простое: 4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3 .
Первый шаг: Окисление твердого железа
Общеизвестно, что ржавчина возникает, когда вы оставляете воду на металлическом инструменте или подвергаете его воздействию влажного воздуха. Это потому, что первый шаг в процессе ржавчины включает растворение твердого железа в растворе. Формула для этого:
Fe(s) → Fe 2+ (водн.) + 2e —
Электроны, образовавшиеся в результате этой реакции, объединяются с ионами водорода в воде, а также с растворенным кислородом, образуя воду:
4e — + 4H + (водн.) + O 2 (водн.) → 2H 2 O(l)
В этих двух реакциях образуются вода и ионы железа(II), но не ржавчина. Чтобы это образовалось, должна произойти другая реакция.
Второй этап: образование гидратированного оксида железа (ржавчины)
Потребление ионов водорода, происходящее при растворении железа, оставляет в воде преобладающее количество ионов гидроксида (OH — ). Ионы железа(II) реагируют с ними с образованием грин раста:
Ионы железа(II) реагируют с ними с образованием грин раста:
Fe 2+ (водн.) + 2OH — (водн.) → Fe(OH) 2 (тв)
То есть т конец истории. Ионы железа (II) также соединяются с водородом и кислородом в воде с образованием ионов железа (III):
4Fe 2+ (водн.) + 4H + (водн.) + O 2 (водн.) → 4Fe 3+ (водн.) + 2H 2 O(л)
Эти ионы железа ответственны за образование красноватого осадка, который постепенно въедает дырки в автомобильные кузова и металлические кровли по всему миру. Они объединяются с дополнительными ионами гидроксида с образованием гидроксида железа (III):
Fe 3+ (водн.) + 3OH — (водн.) → Fe(OH) 3
Это соединение дегидратируется, превращаясь в Fe 2 О 3 .H 2 O — химическая формула ржавчины.
Написание сбалансированного уравнения
Если вы хотите составить сбалансированное уравнение для всего процесса, вам нужно знать только исходные реагенты и продукты реакции. Реагентами являются железо (Fe), кислород (O 2 ) и вода (H 2 O), а продуктом является гидроксид железа (III) Fe(OH) 3 , поэтому Fe + O 2 + H 2 O → Fe(OH) 3 . В сбалансированном уравнении одинаковое количество атомов кислорода, водорода и железа должно фигурировать в обеих частях уравнения. Сбалансируйте количество атомов водорода, умножив количество молекул воды на 6 и количество молекул гидроксида на 4. Затем вам нужно умножить количество O 2 молекул на 3 и количество ионов Fe на 4. Результат:
4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3
900 Бесплатные тексты
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53959
Когда-то трактор был очень полезным сельскохозяйственным оборудованием. Но тракторы старели, вероятно, много ломались, и в конечном итоге было трудно найти запчасти для них. Фермеры купили новые, более эффективные тракторы со всеми новейшими гаджетами. Рынок старых тракторов невелик, поэтому они часто стоят припаркованными в стороне от непогоды и тихонько оставляют ржаветь.
Но тракторы старели, вероятно, много ломались, и в конечном итоге было трудно найти запчасти для них. Фермеры купили новые, более эффективные тракторы со всеми новейшими гаджетами. Рынок старых тракторов невелик, поэтому они часто стоят припаркованными в стороне от непогоды и тихонько оставляют ржаветь.
Коррозия
Ржавчина представляет собой комбинацию нескольких различных оксидов железа. Приведенные ниже уравнения показывают этапы одного из многих процессов образования ржавчины. 9+} \left( aq \right) \end{align*}\nonumber \]
Железо сначала окисляется кислородом до ионов железа (II). На втором этапе ионы железа (II) дополнительно окисляются и объединяются с водой и газообразным кислородом с образованием гидратированной формы оксида железа (III), известной как ржавчина. Ржавление является одним из многих примеров коррозии. Коррозия — это разрушение металлов в результате окислительно-восстановительных процессов. Коррозия наносит огромный ущерб зданиям, мостам, кораблям, автомобилям и другим объектам. Подсчитано, что коррозия обходится экономике США более чем в 100 миллиардов долларов в год. Большое количество времени и усилий тратится на то, чтобы попытаться ограничить или предотвратить коррозию.
Подсчитано, что коррозия обходится экономике США более чем в 100 миллиардов долларов в год. Большое количество времени и усилий тратится на то, чтобы попытаться ограничить или предотвратить коррозию.
Коррозионная стойкость
Некоторые металлы, такие как золото и платина, плохо поддаются коррозии, потому что они очень устойчивы к окислению обычными веществами. Некоторые другие металлы начинают окисляться, но дополнительно защищаются от дополнительной коррозии налетом, образующимся на поверхности. Алюминий реагирует с кислородом с образованием оксида алюминия, который остается плотно упакованным на поверхности. Оксид алюминия предотвращает коррозию внутренней части алюминия. Не вся коррозия является результатом реакции с кислородом. Медь подвергается коррозии в результате реакции с углекислым газом с образованием карбоната меди (II). Это характерное зеленое соединение также называется патиной и предотвращает дальнейшую коррозию меди под ним (см. Статую Свободы на рисунке ниже).
Рисунок \(\PageIndex{1}\): Статуя Свободы.
И наоборот, оксиды железа, образующиеся при коррозии железа, образуют слой, который легко отслаивается, а не остается плотным на поверхности. Это позволяет железу полностью разъедать до тех пор, пока железный объект не будет разрушен.
Одним из способов предотвращения коррозии является защита поверхности металла. Покрытие поверхности металлического предмета краской или маслом предотвратит коррозию, не позволяя кислороду контактировать с ним. К сожалению, царапины на краске или стирание масла позволят начать коррозию. Чувствительные к коррозии металлы также могут быть покрыты другим металлом, устойчивым к коррозии. «Жестяная банка» на самом деле сделана из железа, покрытого тонким слоем олова, который защищает железо.
Коррозию также можно контролировать, соединив защищаемый объект с другим объектом, сделанным из металла, который еще легче подвергается коррозии. Когда железный гвоздь оборачивают полоской цинка и подвергают воздействию воды, цинк (будучи более активным металлом, чем железо) окисляется, а железо остается неповрежденным.
