Процесс ржавления железа: Коррозия металлов и её виды — урок. Химия, 11 класс.
Содержание
Ржавчина на металле: вред, виды коррозии
Мы — продавцы металлопроката — как никто сталкивается с этим наваждением — ржавиной. И мы точно знаем вред от коррозии. В этой статье мы скажем несколько слов об этой проблеме, ее проявлениях, ее масштабах.
Ущерб, ущерб…
Все видели эти оранжево-бурые или желтоватые пятна ржавчины на металлических деталях. Экономический ущерб от коррозии металлов огромен. В США и Германии подсчитанный ущерб от коррозии и затраты на борьбу с ней составляют примерно 3 % ВВП. При этом потери металла, в том числе из-за выхода из строя конструкций, изделий, оборудования, составляют до 20 % от общего объема производства стали в год. По России точные данные о потерях от коррозии не подсчитаны.
Доподлинно известно, что именно проржавевшие металлоконструкции стали причиной обрушения нескольких мостов в Соединенных Штатах, в том числе с многочисленными человеческими жертвами. Крайне неприятен и экологический вред: утечка газа, нефти при разрушении трубопроводов приводит к загрязнению окружающей среды.
Виды коррозии и ее причины
Перед тем как говорить о ржавчине на железе, кратко рассмотрим другие ее типы.
Коррозии подвержены не только металлы, но и неметаллические изделия. В этом случае коррозию еще называют «старением». Старению подвержены пластмассы, резины и другие вещества. Для бетона и железобетона существует термин «усталость». Происходит их разрушение или ухудшение эксплуатационных характеристик из-за химического и физического воздействия окружающей среды. Корродируют и металлические сплавы — медь, алюминий, цинк: в процессе их коррозии на поверхности изделий образуется оксидная пленка, плотно прилегающая к поверхности, что значительно замедляет дальнейшее разрушение металла (а патина на меди еще и придает ей особый шарм). Драгоценные металлы являются таковыми не только из-за своей красоты, ценимой ювелирами, но и за счет стойкости к коррозии. Золото и серебро до сих пор используется для покрытия особо чувствительных электронных контактов а платина применяется в космической отрасли.
Корродировать металл может в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия). Коррозия заметно ускоряется с повышением температуры.
Типы ржавчины
В большей степени коррозии подвержено железо. С точки зрения химии ржавчина — это окислительный процесс (как и горение). Элементы возникающие при окислении в кислородной среде называются Оксиды. Можно выделить 4 основных типа.
1. Желтая ржавчина — химическая формула FeO(OH)h3O (оксид железа двухвалетный). Возникает во влажной, недонасыщенной кислородом среде. Часто встречается под водой. В природе существует в виде минерала вюстита, при этом являясь монооксидом (те содержит 1 атом кислорода).
2. Коричневая ржавчина — Fe2O3 (двойной оксид железа): растет без воды и встречается редко.
3. Черная ржавчина — Fe3O4 (оксид железа четырех валентый). Образуется при малом содержании кислорода и без воды поэтому стабильна и распространяется очень медленно. Этот оксид является ферромагнетиком (при определенных условиях обладает намагниченностью в отсутствие внешнего магнитного поля), поэтому потенциально применим для создания сверх-проводников.
Этот оксид является ферромагнетиком (при определенных условиях обладает намагниченностью в отсутствие внешнего магнитного поля), поэтому потенциально применим для создания сверх-проводников.
4. Красная ржавчина — химическая формула Fe2O3•h3O (оксид железа трехвалентный). Возникает под воздействием кислорода и воды, самый частый тип, процесс протекает равномерно и затрагивает всю поверхность. В отличии от всех вышеперечисленных не столь опасных для железа видов окисления этот в своей толще образует гидроксид железа, который, начиная отслаиваться, открывает для разрушения все новые слои металла. Реакция может продолжатся до полного разрушения конструкции. Применяется при выплавке чугуна и как краситель в пищевой промышленности. Встречается в природе в естественном виде под названием гематид.
Несколько видов ржавления могут протекать одновременно, не особо мешая друг другу.
Химическая и электрохимическая коррозия
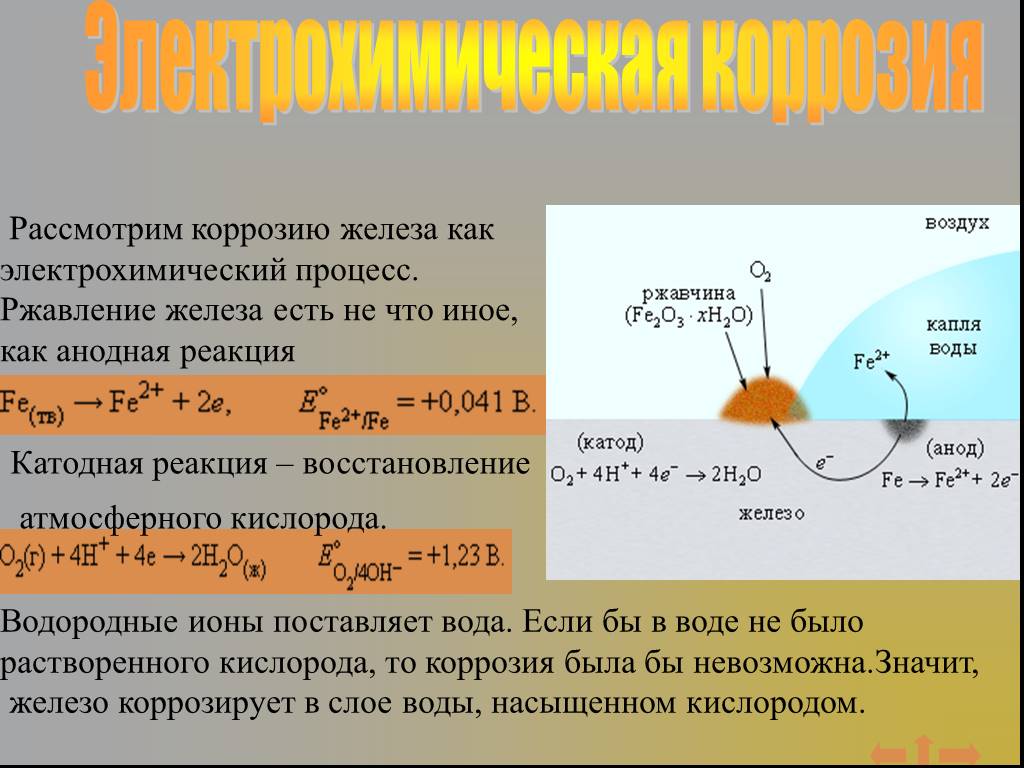
Железо ржавеет, если в нем есть добавки и примеси (например, углерод) и при этом контактирует с водой и кислородом. Если же в воде растворена соль (хлорида натрия и калия), реакция становится электрохимической и процесс ржавления ускоряется. Массовое применение этих солей как в бытовой химии так и для борьбы с льдом и снегом делают электрохимическую коррозию очень распространенным и опасным явлением: потери в США от использования солей в зимний период составляют 2,5 млрд. долларов. При одновременном воздействии воды и кислорода образуется гидроксид железа, который, в отличие от оксида, отслаивается от металла и никак его не защищает. Реакция продолжается либо до полного разрушения железа, либо пока в системе не закончится вода или кислород.
Если же в воде растворена соль (хлорида натрия и калия), реакция становится электрохимической и процесс ржавления ускоряется. Массовое применение этих солей как в бытовой химии так и для борьбы с льдом и снегом делают электрохимическую коррозию очень распространенным и опасным явлением: потери в США от использования солей в зимний период составляют 2,5 млрд. долларов. При одновременном воздействии воды и кислорода образуется гидроксид железа, который, в отличие от оксида, отслаивается от металла и никак его не защищает. Реакция продолжается либо до полного разрушения железа, либо пока в системе не закончится вода или кислород.
Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла. В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге). Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Во второй части статьи мы расскажем, как вы можете защитить свои металлоконструкции от этой напасти или победить ее, если она уже атакует.
Ржавчина | защитные составы для металла
Главная Обустройство и ремонт Обустройство и ремонт — 2 — Защитные составы для металла
Ржавчина — продукт коррозии металла, вполне закономерного процесса, который протекает под воздействием кислорода и влаги. Если металл не защищать, то при обычных условиях он начнет окисляться, что, в свою очередь, запустит процесс ржавления.
По типу коррозия бывает сплошной, точечной, сквозной, послойной, подповерхностной, пятнами и язвами. Видов этого разрушения немало, а вот способов борьбы с ним пока изобрели не так много. Конструкционный метод предполагает максимально возможное изолирование материала от воздействия воды и воздуха. Для этого в базовых, несущих определенную нагрузку узлах и основаниях стараются применять нержавеющие и цветные металлы, легированные или кортеновские стали. Последние, по сути, уже заржавевший материал, поверхность которого принудительно окислили и получили защитное покрытие, предотвращающее доступ влаги внутрь (ржавление металла в этом случае остановлено).
Последние, по сути, уже заржавевший материал, поверхность которого принудительно окислили и получили защитное покрытие, предотвращающее доступ влаги внутрь (ржавление металла в этом случае остановлено).
Активный способ защиты металла предполагает либо распространенное сегодня анодирование (электрохимический процесс), либо нанесение двойного электрического слоя. К активным методам защиты относят также холодное цинкование и газотермическое напыление. Все эти способы доступны исключительно в промышленных условиях, для бытовых нужд подойдет пассивный метод.
Технология пассивной защиты — это применение лакокрасочных составов различного назначения — нанесенные на металл, они перекрывают доступ кислорода и влаги к его поврехности. О них и поговорим.
КРАСОЧНАЯ ОБОРОНА
Решать проблему ржавления железа нужно поэтапно. Перед тем как начинать какие-либо действия, необходимо определиться, надо ли удалять темный налет (и насколько это возможно) и какой вид защитного состава подойдет в каждом конкретном случае.
Лакокрасочные материалы (ЛКМ) в зависимости от свй пленкообразующей способности (а именно она и будет препятствовать окислению металла) подразделяют на три категории:
1. Составы, которые создают барьер на пути кислорода и влаги путем механической изоляции поверхности. Чаще всего в этой роли выступает краска или грунт-краска, определенные виды которых можно наносить прямо на ржавчину. Эффективность такой защиты целиком зависит от степени адгезии краски с поверхностью — ведь даже минимальная оставшаяся трещина (царапина) позволит кислороду вновь добраться до металла, и тогда уже появится подпленочная коррозия, бороться с которой гораздо сложнее, — увы, вовремя обнаружить ее удается далеко не всегда. Различают промежуточные (чаще всего это грунты) и основные барьерные составы.
2. Лакокрасочные составы, обеспечивающие пассивацию металла. За счет химического взаимодействия его поверхности и компонентов краски металл переходит в неактивное состояние . В результате коррозия замедляется или вовсе прекращается. Эффект пассивации дают краски и грунты, в составе которых содержатся фосфорная кислота или ингибирующие пигменты.
В результате коррозия замедляется или вовсе прекращается. Эффект пассивации дают краски и грунты, в составе которых содержатся фосфорная кислота или ингибирующие пигменты.
3. ЛКМ, обеспечивающие протекторную защиту. Эти эмали и краски обязательно содержат в своей формуле порошки других металлов: цинка, алюминия, магния. Процессу окисления в этом случае будут подвергаться порошки донорских металлов, а основание останется неповрежденным коррозией.
Непосредственно окраску металла производят в соответствии с выбранной системой защиты. Но перед этим необходимо подготовить поверхность.
Типы составов для ржавых поверхностей:
1 — растворитель ржавчины
2 — краска-эмаль по ржавчине
3 — праймер (грунт) для обработки поверхности
4 — молотковая краска
5 — защитная краска с порошком металлов (желтая)
НАЙТИ И ОБЕЗВРЕДИТЬ
Металлические поверхности перед нанесением краски желательно очистить от пятен ржавчины. Чаще всего такой обработке подвергают язвенную ржавчину, точечную, в виде пятен. Очистить поверхность можно химическим и механическим способом. Для механической обработки используют пескоструйный, дробеструйный инструмент либо специальные металлические щетки или наждачную бумагу. Последний способ в быту наиболее популярен, а вот первые два требуют наличия дорогостоящего оборудования и площадей промышленного масштаба.
Чаще всего такой обработке подвергают язвенную ржавчину, точечную, в виде пятен. Очистить поверхность можно химическим и механическим способом. Для механической обработки используют пескоструйный, дробеструйный инструмент либо специальные металлические щетки или наждачную бумагу. Последний способ в быту наиболее популярен, а вот первые два требуют наличия дорогостоящего оборудования и площадей промышленного масштаба.
Также в зависимости от степени загрязнения поверхностей (средняя или высокая) применяют химический метод очистки: с помощью преобразователя ржавчины — это состав, который содержит ортофосфорную кислоту (она превращает ржавчину в стабильные фосфаты железа) либо танин (он образует танат железа, прочно сцепляющийся сос талью). Если необходимо обработать предметы и устройства, которые большую часть года находятся на открытом воздухе (садовые скамейки, бочки, трубы, ограждение крыльца, ворота, стальные и оцинкованные крыши), применяют преобразователи ржавчины со специальными свойствами. Применение такого грунта позволит одновременно очистить, защитить и окрасить поверхности, например, при ремонте кровли или металлического забора.
Применение такого грунта позволит одновременно очистить, защитить и окрасить поверхности, например, при ремонте кровли или металлического забора.
В процессе нанесения преобразвателя металл сразу же реагирует — меняет цвет. Так как все подобные составы содержат очень сильную кислоту, при работе с этими средствами необходимо соблюдать меры предосторожности, пользоваться защитной одеждой, перчатками, маской.
Удаление ржавчины:
1 — зачищаем поврежденную поверхность щеткой
2 — обезжириваем и наносим грунтовку
3 — покрываем защитной краской
В ИЗОЛЯЦИИ
После механического и химического удаления ржавчины приступают непосредственно к нанесению защитных составов. Здесь трубется соблюсти одно важное условие. Финишный слой должен обладать достаточной толщиной, износостойкостью, долговечностью, не разрушаться под воздействием погодных условий. Создать достаточно толстое покрытие даже в несколько слоев, используя один лакокрасочный состав, сложно. Большинство из них имеет максимально допустимую толщину нанесения, превышение которой снизит качество самого покрытия. Поэтому желательно непосредственно под защитную краску использовать подготовительную грунтовку, алкидную, полиуретановую или акриловую. Последняя оптимальна для работ внутри помещений, так как обладает меньшей токсичностью. Она подойдет для грунтования лестничных ограждений, решеток каминов и окон, конструкций люстр, зеркал, металлических дверных ручек.
Создать достаточно толстое покрытие даже в несколько слоев, используя один лакокрасочный состав, сложно. Большинство из них имеет максимально допустимую толщину нанесения, превышение которой снизит качество самого покрытия. Поэтому желательно непосредственно под защитную краску использовать подготовительную грунтовку, алкидную, полиуретановую или акриловую. Последняя оптимальна для работ внутри помещений, так как обладает меньшей токсичностью. Она подойдет для грунтования лестничных ограждений, решеток каминов и окон, конструкций люстр, зеркал, металлических дверных ручек.
Для наружных работ предпочтительны полиуретановые либо эпоксидные грунты, так как они обладают повышенной атмосферо-и износостойкостью и способны проникать внутрь поверхности, например, в случае если требуется произвести ремонт ветхих материалов. Составы на основе эпоксидной смолы, как правило, менее прихотливы к подготовке поверхности.
ТРИ В ОДНОМ
В отличие от акриловых грунты на основе алкидной смолы образуют более стойкое к воздействию воды покрытие, обладают прочностью и хорошей укрывистостью. Остановимся на них подробнее. Как правило, это так называемые составы «3 в 1» — одновременно преобразующие ржавчину, защищающие металл как грунт и окрашивающие в нужный цвет, что сокращает процесс обработки металла. Есть эмали, которые не содержат преобразователь ржавчины, но за счет наличия определенных компонентов упрочняют поверхности как грунт и образуют плотное покрытие даже в один слой.
Остановимся на них подробнее. Как правило, это так называемые составы «3 в 1» — одновременно преобразующие ржавчину, защищающие металл как грунт и окрашивающие в нужный цвет, что сокращает процесс обработки металла. Есть эмали, которые не содержат преобразователь ржавчины, но за счет наличия определенных компонентов упрочняют поверхности как грунт и образуют плотное покрытие даже в один слой.
Алкидыне эмали подходят как для внутреннего применения, так и для наружного, но поскольку они довольно токсичны, при работах внутри дома требуется хорошее проветривание. Выбирая алкидную грунт-эмаль, стоит обратить внимание, для каких металлов она подходит: одни составы предназначены для черных, другие для цветных металлов.
Особое место среди грунт-эмалей занимает молотковая краска, ее еще называют кузнечной. Прочная молотковая эмаль предназначена для окрашивания изделий художественной ковки — деталей заборов, ворот, лестниц, каминов, мателлической мебели, любых других декоративных элементов из цветных металлов. Покрытие этим составом предметы вполне выдержат зимовку в нащих широтах, при этом поверхности можно не грунтовать — продукт содержит преобразователь ржавчины, грунт и цветную эмаль. Но это не главное достоинство кузнечной краски. В процессе ее нанесения на поверхности образуется красивый декоративный рисунок — раковины, структуры, неровности. Даже цвета молотковых составов необычны: серебристо-серый, изумрудно-зеленый, светло-синий. Наиболее известные и распространенные предложения по молотковым краскам у HAMMERITE.
Покрытие этим составом предметы вполне выдержат зимовку в нащих широтах, при этом поверхности можно не грунтовать — продукт содержит преобразователь ржавчины, грунт и цветную эмаль. Но это не главное достоинство кузнечной краски. В процессе ее нанесения на поверхности образуется красивый декоративный рисунок — раковины, структуры, неровности. Даже цвета молотковых составов необычны: серебристо-серый, изумрудно-зеленый, светло-синий. Наиболее известные и распространенные предложения по молотковым краскам у HAMMERITE.
КИСТИ В РУКИ
Рассматривая составы, защищающие от коррозии, невозможно обойти вниманием специальные краски по металлу. Как правило, их наносят прямо на ржавчину, но есть и такие, которым требуется предварительное грунтование. Если речь идет о предметах из металла, которые постоянно контактируют с водой (например, кованый мостик в декоративном пруду) или находятся на улице при любой погоде (как дачная кованая мебель), применяют краску на акрилполимерной основе. Эти толстослойные составы наносят без предварительной грунтовки. А когда требуется окрасить радиатор отопления, температура нагревания которого бывает достаточно высокой, используют специальные термостойкие эмали. Они различаются в зависимости от величины температуры, которую краска может выдержать без потери своих декоративных качеств (например, до 126, 160, 210 °С сухого тепла). Термостойкие эмали чаще всего поставляют в белом цвете с возможностью дальнейшей колеровки.
Эти толстослойные составы наносят без предварительной грунтовки. А когда требуется окрасить радиатор отопления, температура нагревания которого бывает достаточно высокой, используют специальные термостойкие эмали. Они различаются в зависимости от величины температуры, которую краска может выдержать без потери своих декоративных качеств (например, до 126, 160, 210 °С сухого тепла). Термостойкие эмали чаще всего поставляют в белом цвете с возможностью дальнейшей колеровки.
Защита металла от ржавчины — дело непростое. Главное — вовремя заметить и как можно раньше начать борьбу с окислением и дальнейшим разрушением металла. Если все сделано правильно, а составы подобраны с учетом характеристик поверхности, ржавчина вряд ли снова поселится на ваших любимых качелях или садовых фонариках, лестнице, зеркале в доме.
ПОЛЕЗНО ЗНАТЬ
- Если требуется значительная стойкость покрытия, предпочтительно использовать высоконаполненные двухкомпонентные ЛКМ с уменьшенным содержани растворителя.
 Расход этих составов небольшой, слой можно получить толще, а защиту прочнее.
Расход этих составов небольшой, слой можно получить толще, а защиту прочнее. - На рынке есть составы, которые разрешается наносить прямо на ранее окрашенные поверхности — по латексным, масляным, алкидным краскам.
- Для восстановления поврежденных металлических поверхностей применяют специальный порошковый цементирующий грунт на алкидной основе. С его помощью можно сделать «заплатку на металле или заполнить трещину.
- Для окрашивания перил или изгородей выпускают специальную глянцевую краску, создающую на поверхности слой, похожий на чеканку. Составы называют «краска с эффектом чеканки».
- Чтобы получить особо прочное финишное покрытие по металлу, надежно защищающее от коррозии, помимо других составов желательно использовать прозрачный лак на основе акриловой эмульсии. Такой лак не только способствует долговечности верхнего слоя, но и препятствует появлению царапин.
22.5: Коррозия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53959
Когда-то трактор был очень полезным сельскохозяйственным оборудованием. Но тракторы старели, вероятно, много ломались, и в конечном итоге было трудно найти запчасти для них. Фермеры купили новые, более эффективные тракторы со всеми новейшими гаджетами. Рынок старых тракторов невелик, поэтому они часто стоят припаркованными в стороне от непогоды и тихонько оставляют ржаветь. 9+} \left( aq \right) \end{align*}\nonumber \]
Но тракторы старели, вероятно, много ломались, и в конечном итоге было трудно найти запчасти для них. Фермеры купили новые, более эффективные тракторы со всеми новейшими гаджетами. Рынок старых тракторов невелик, поэтому они часто стоят припаркованными в стороне от непогоды и тихонько оставляют ржаветь. 9+} \left( aq \right) \end{align*}\nonumber \]
Сначала железо окисляется кислородом до ионов железа (II). На втором этапе ионы железа (II) дополнительно окисляются и объединяются с водой и газообразным кислородом с образованием гидратированной формы оксида железа (III), известной как ржавчина. Ржавление является одним из многих примеров коррозии. Коррозия — это разрушение металлов в результате окислительно-восстановительных процессов. Коррозия наносит огромный ущерб зданиям, мостам, кораблям, автомобилям и другим объектам. Подсчитано, что коррозия обходится экономике США более чем в 100 миллиардов долларов в год. Большое количество времени и усилий тратится на то, чтобы попытаться ограничить или предотвратить коррозию.
Стойкость к коррозии
Некоторые металлы, такие как золото и платина, плохо поддаются коррозии, потому что они очень устойчивы к окислению обычными веществами. Некоторые другие металлы начинают окисляться, но дополнительно защищаются от дополнительной коррозии налетом, образующимся на поверхности. Алюминий реагирует с кислородом с образованием оксида алюминия, который остается плотно упакованным на поверхности. Оксид алюминия предотвращает коррозию внутренней части алюминия. Не вся коррозия является результатом реакции с кислородом. Медь подвергается коррозии в результате реакции с углекислым газом с образованием карбоната меди (II). Это характерное зеленое соединение также называется патиной и предотвращает дальнейшую коррозию меди под ним (см. Статую Свободы на рисунке ниже).
Рисунок \(\PageIndex{1}\): Статуя Свободы.
И наоборот, оксиды железа, образующиеся при коррозии железа, образуют слой, который легко отслаивается, а не остается плотным на поверхности. Это позволяет железу полностью разъедать до тех пор, пока железный объект не будет разрушен.
Это позволяет железу полностью разъедать до тех пор, пока железный объект не будет разрушен.
Одним из способов предотвращения коррозии является защита поверхности металла. Покрытие поверхности металлического предмета краской или маслом предотвратит коррозию, не позволяя кислороду контактировать с ним. К сожалению, царапины на краске или стирание масла позволят начать коррозию. Чувствительные к коррозии металлы также могут быть покрыты другим металлом, устойчивым к коррозии. «Жестяная банка» на самом деле сделана из железа, покрытого тонким слоем олова, который защищает железо.
Коррозию также можно контролировать, соединив защищаемый объект с другим объектом, изготовленным из металла, который еще легче подвергается коррозии. Когда железный гвоздь оборачивают полоской цинка и подвергают воздействию воды, цинк (будучи более активным металлом, чем железо) окисляется, а железо остается неповрежденным. Этот метод, называемый катодной защитой, обычно используется для предотвращения коррозии корпусов стальных кораблей. Блоки из цинка прикреплены к нижней части корпуса (см. рисунок ниже). Цинковые блоки преимущественно подвергаются коррозии, сохраняя корпус целым. Цинковые блоки необходимо периодически заменять, чтобы поддерживать защиту железа.
Блоки из цинка прикреплены к нижней части корпуса (см. рисунок ниже). Цинковые блоки преимущественно подвергаются коррозии, сохраняя корпус целым. Цинковые блоки необходимо периодически заменять, чтобы поддерживать защиту железа.
Рисунок \(\PageIndex{2}\): Маленькие блоки цинка прикреплены к стальному корпусу этого корабля.
Резюме
- Коррозия – это разрушение металлов в результате окислительно-восстановительных процессов.
- Приведены примеры коррозии.
Эта страница под названием 22.5: Corrosion распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, отредактированного в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд CK-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
Ржавление железа – объяснение, химическая реакция, предотвращение
Металл — это материал, который имеет глянцевый вид, когда он только что изготовлен, отполирован или разбит, и достаточно хорошо проводит электричество и тепло. Металлы либо ковкие, либо пластичные (их можно ковать в тонкие листы) (можно вытягивать в проволоку). Металлы могут быть химическими элементами, такими как железо, сплавами, такими как нержавеющая сталь, или молекулярными соединениями, такими как полимерный нитрид серы.
Термин «металл» используется в астрофизике в более широком смысле для обозначения всех химических элементов в звезде, которые тяжелее гелия, а не только классических металлов. В этом смысле первые четыре «металла», которые накапливаются в ядрах звезд посредством нуклеосинтеза, — это углерод, азот, кислород и неон, которые все являются химически неметаллами. За время своего существования звезда сплавляет более легкие элементы, прежде всего водород и гелий, в более тяжелые атомы. В этом контексте металличность астрономического объекта относится к доле его массы, состоящей из более тяжелых химических элементов.
За время своего существования звезда сплавляет более легкие элементы, прежде всего водород и гелий, в более тяжелые атомы. В этом контексте металличность астрономического объекта относится к доле его массы, состоящей из более тяжелых химических элементов.
Ржавление железа
Ржавление — это явление образования красновато-коричневого налета на поверхности железа под действием влажного воздуха, красновато-коричневый налет называется ржавчиной. Проще говоря, ржавчина — это красно-коричневое хлопьевидное вещество, которое образуется, когда железный предмет подвергается воздействию влажного воздуха в течение длительного периода времени. Ржавление — термин для этого явления.
Ржавление железа и стали является наиболее распространенным примером коррозии металлов. Ржавчина выхлопных систем и кузова автомобиля, водопроводных труб и многих видов конструкционных стальных конструкций — все это хорошо известные примеры. Совместное воздействие воздуха и воды на железо вызывает его ржавчину. Ржавчина не возникает в полностью сухом воздухе или в воздухе, полностью лишенном воды. Атмосферные условия и относительный вклад компонентов, регулирующих ржавчину, определяют особый состав ржавчины. Он в основном состоит из гидратированного оксида железа, поэтому химическая формула ржавчины Fe 9.0134 2 O 3 .xH 2 O .Примерно охарактеризовать его образование можно следующим откликом: 2 O 3 .xH 2 O
Ржавчина не возникает в полностью сухом воздухе или в воздухе, полностью лишенном воды. Атмосферные условия и относительный вклад компонентов, регулирующих ржавчину, определяют особый состав ржавчины. Он в основном состоит из гидратированного оксида железа, поэтому химическая формула ржавчины Fe 9.0134 2 O 3 .xH 2 O .Примерно охарактеризовать его образование можно следующим откликом: 2 O 3 .xH 2 O
Внешняя поверхность железа ржавеет сначала в присутствии влажного воздуха, и на поверхности осаждается слой гидратированного оксида железа (ржавчины). Этот слой нежный и пористый, и если он станет слишком толстым, то может отвалиться. Самые нижние слои железа подвергаются воздействию окружающей среды, вызывая их ржавчину. Железо в конечном итоге теряет свою прочность по мере продолжения процесса.
Что такое процесс ржавления железа?
Ржавление железа является реакцией окисления.
Во время коррозии железо соединяется с кислородом воздуха в присутствии воды с образованием Fe 2 O 3 .xH 2 O, гидратированного оксида железа (III).
Этот гидратированный оксид железа (III) называют ржавчиной. В результате ржавчина представляет собой в значительной степени гидратированный оксид железа (III), Fe 2 O 3 .xH 2 O. Цвет ржавчины красновато-коричневый. Все мы замечали красновато-коричневую ржавчину на железных гвоздях, шурупах, трубах и перилах. Под воздействием влажного воздуха ржавеет не только железо, но и сталь. Сталь, с другой стороны, более устойчива к ржавчине, чем железо.
Ржавление железа является химическим изменением
Ржавчина образуется, когда железо (или сплав железа) подвергается воздействию кислорода в присутствии влаги. Эта реакция не мгновенна; скорее, это происходит в течение длительного периода времени. Оксиды железа образуются при соединении атомов кислорода с атомами железа. В результате ослабевают связи между атомами железа в объекте/структуре.
В результате ослабевают связи между атомами железа в объекте/структуре.
Степень окисления железа увеличивается в результате реакции ржавления, за которой следует потеря электронов. Ржавчина в основном состоит из двух типов оксидов железа, которые различаются степенью окисления атома железа. Это оксиды:
- Оксид железа (II) также известен как оксид железа. Это вещество имеет степень окисления +2 и химическую формулу FeO.
- Оксид железа (III), часто известный как оксид железа, представляет собой соединение, в котором атом железа имеет степень окисления +3. Fe2O3 — химическая формула этого вещества.
Железо является восстановителем, но кислород является отличным окислителем. При воздействии кислорода атом железа легко отдает электроны. Химическая реакция описывается следующим образом:
Fe → Fe 2+ + 2e –
В присутствии воды атом кислорода увеличивает степень окисления железа.
4Fe 2+ + O 2 → 4Fe 3+ + 2O 2-
Катионы железа и молекулы воды теперь подвергаются следующим кислотно- базовые реакции.
Fe 2+ + 2H 2 O ⇌ Fe(OH) 2 + 2H +
Fe 3+ + 3H 2 O ⇌ Fe(OH) 3 + 3H +
В результате прямой реакции между катионами железа и гидроксид-ионами также образуются гидроксиды железа.
O 2 + H 2 O + 4e – → 4OH –
Fe 2+ 901 98 + 2OH – → Fe(OH) 2
Fe 3+ + 3OH – → Fe(OH) 3 90 024
Образовавшиеся гидроксиды железа обезвоживаются, образуя оксиды железа, образующие ржавчину. В этот процесс вовлечено множество химических процессов, некоторые из которых приведены ниже.
- Fe(OH) 2 ⇌ FeO + H 2 O
- 4Fe(OH) 2 + O 2 + xH 2 9013 5 O → 2Fe 2 O 3 .
 (x+4)H 2 O
(x+4)H 2 O - Fe(OH) 3 ⇌ FeO(OH) + H 2 O
90 003 FeO(OH) ⇌ Fe 2 O 3 + H 2 O\
Все перечисленные химические реакции имеют одну общую черту: все они требуют присутствия воды и кислорода. В результате количество кислорода и воды, окружающих металл, может быть ограничено для предотвращения коррозии.
Условия, необходимые для коррозии железа:
Ржавчине железа способствуют многие факторы, в том числе количество влаги в воздухе и рН окружающей среды. Ниже приведены некоторые из этих элементов.
- Влажность: Наличие воды в окружающей среде ограничивает коррозию железа. Наиболее распространенной причиной ржавчины является воздействие дождя.
- Процесс ржавчины ускоряется, если pH среды вокруг металла низкий. Когда железо подвергается воздействию кислотных дождей, оно ржавеет быстрее. Коррозия железа замедляется за счет более высокого pH.

- Из-за наличия в воде различных солей железо быстрее ржавеет. Многие ионы в соленой воде ускоряют процесс ржавчины посредством электрохимических процессов.
- Примесь: По сравнению с железом, состоящим из различных металлов, чистое железо ржавеет медленнее.
Размер железного предмета также может влиять на скорость его коррозии. Например, огромный железный предмет, скорее всего, будет иметь незначительные дефекты из-за процесса плавки. Эти недостатки обеспечивают платформу для экологических атак на металл.
Эксперимент, подтверждающий, что воздух и влага необходимы для образования ржавчины:
Процедура, подтверждающая, что для образования ржавчины необходимы влага и воздух.
- Чистые железные гвозди должны быть помещены в каждую из трех пробирок, обозначенных A, B и C.
- Наполните пробирку A водопроводной водой и закупорьте ее.
- Наполните пробирку B горячей дистиллированной водой, затем добавьте примерно 1 мл масла и закупорьте ее.
 Масло будет плавать на поверхности воды, препятствуя испарению воздуха.
Масло будет плавать на поверхности воды, препятствуя испарению воздуха. - Наполните пробирку С безводным хлоридом кальция и закупорьте ее. Любая влага в воздухе будет поглощаться безводным хлоридом кальция.
- Подождите несколько дней, пока эти пробирки отстоятся перед наблюдением.
Наблюдение: Железные гвозди ржавеют в пробирке А, но не в пробирках В и С, согласно результатам. Гвозди в пробирке А подверглись коррозии, потому что они подвергались воздействию как воздуха, так и воды. Ногти из пробирки B подвергаются воздействию только воды, но ногти из пробирки C подвергаются воздействию сухого воздуха.
Заключение: Этот эксперимент показывает, что для образования ржавчины необходимы воздух (кислород) и влага.
Какие повреждения вызывает ржавление железных предметов?
Ржавчина проницаема и мягка, и когда она соскальзывает с поверхности ржавого железного предмета, железо под ним ржавеет.
В результате железная ржавчина — это постоянный процесс, который со временем разъедает железные предметы, делая их бесполезными. Ржавление железа со временем наносит значительный ущерб, поскольку оно используется для создания широкого спектра конструкций и товаров, включая мосты, решетки, перила, ворота и кузова автомобилей, автобусов, грузовиков и кораблей. Само собой разумеется, что у нас должен быть способ уберечь железо от ржавчины.
Предотвращение ржавления железа
Утрата железных предметов из-за ржавчины оказывает огромное экономическое влияние на страну, и этого следует избегать. Чтобы железные вещи не ржавели, используются различные методы. Чтобы не допустить проникновения воздуха и воды, большинство способов требуют покрытия железной части чем-либо. Ниже приведены некоторые из наиболее распространенных способов предохранения железа от ржавчины:
- Ржавление железа можно предотвратить путем покраски: Покрытие поверхности железа краской является наиболее популярным способом защиты от ржавчины.
 Когда краска наносится на поверхность железного предмета, она предотвращает контакт воздуха и влаги с предметом, предотвращая ржавление. Для предотвращения ржавчины оконные решетки, перила, железные мосты, стальная фурнитура, железнодорожные вагоны, кузова автомобилей, автобусов и грузовиков, среди прочего, регулярно окрашиваются.
Когда краска наносится на поверхность железного предмета, она предотвращает контакт воздуха и влаги с предметом, предотвращая ржавление. Для предотвращения ржавчины оконные решетки, перила, железные мосты, стальная фурнитура, железнодорожные вагоны, кузова автомобилей, автобусов и грузовиков, среди прочего, регулярно окрашиваются. - Ржавление железа можно предотвратить, нанеся на него смазку или масло: Когда смазку или масло наносят на поверхность железного предмета, воздух и влага не соприкасаются с ним, предотвращая коррозию. Железные и стальные инструменты и детали машин, например, натирают смазкой или маслом для предотвращения коррозии.
- Ржавчину железа можно предотвратить с помощью гальванического покрытия: Гальваническое покрытие защищает от коррозии изделия, подвергающиеся чрезмерному воздействию влаги, такие как кровельные листы и трубопроводы. Гальванизация — это метод нанесения тонкого слоя цинка на сталь и железо для предотвращения ржавчины.
 Оцинкованное железо – это железо, оцинкованное. Цинк более реакционноспособен, чем железо, поэтому в присутствии влаги он взаимодействует с кислородом, образуя невидимый слой оксида цинка, защищающий его от дальнейшего ржавления. Стоит отметить, что даже при нарушении цинкового покрытия на изделиях из оцинкованного железа они остаются без ржавчины. Поскольку цинк более реактивен, чем железо, это так.
Оцинкованное железо – это железо, оцинкованное. Цинк более реакционноспособен, чем железо, поэтому в присутствии влаги он взаимодействует с кислородом, образуя невидимый слой оксида цинка, защищающий его от дальнейшего ржавления. Стоит отметить, что даже при нарушении цинкового покрытия на изделиях из оцинкованного железа они остаются без ржавчины. Поскольку цинк более реактивен, чем железо, это так. - Ржавчину железа можно предотвратить с помощью гальванического покрытия: Гальваническое покрытие — еще один метод защиты предметов от ржавчины. В этой процедуре на железо наносятся некорродирующие металлы, включая олово, никель и хром. Этот прием не только предохраняет изделия от ржавчины, но и улучшает их внешний вид. Оснащение ванных комнат и элементы транспортных средств, такие как велосипедные рули, автомобильные бамперы и т. д., являются примерами хромированных изделий.
- Ржавление железа можно предотвратить, легируя его для получения нержавеющей стали: Нержавеющая сталь получается при сплаве железа с хромом и никелем.
 Нержавеющая сталь не подвержена ржавчине. Кухонная утварь из нержавеющей стали, ножницы и медицинское оборудование, например, не подвержены коррозии. С другой стороны, нержавеющая сталь слишком дорога, чтобы ее можно было использовать в больших количествах.
Нержавеющая сталь не подвержена ржавчине. Кухонная утварь из нержавеющей стали, ножницы и медицинское оборудование, например, не подвержены коррозии. С другой стороны, нержавеющая сталь слишком дорога, чтобы ее можно было использовать в больших количествах. - Ржавление железа можно предотвратить лужением: Олово нетоксично, и его реакционная способность ниже, чем у железа. Пищевые банки консервированы, что означает, что на них есть тонкий слой олова. В результате, когда гальваническое тонкое покрытие металлического олова наносится на изделия из железа и стали, изделия из железа и стали защищены от ржавчины. Используются луженые коробки для тиффина, потому что они нетоксичны и не загрязняют пищу внутри.
- Ржавчину железа можно предотвратить с помощью эмали: Эмалирование — это высокотемпературная процедура, при которой порошковое стекло вплавляется в металлическую основу. Эмали можно использовать на различных поверхностях, в том числе на стекле и керамике.

Примеры задач
Вопрос 1: Как происходит процесс ржавления железа?
Ответ:
Ржавление железа является реакцией окисления. В присутствии воды металлическое железо взаимодействует с кислородом воздуха с образованием гидратированного оксида железа (III) Fe 9.0134 2 O 3 .xH 2 O. Этот гидратированный оксид железа (III) называют ржавчиной. В результате ржавчина представляет собой в значительной степени гидратированный оксид железа (III), Fe 2 O 3 .xH 2 O. Ржавчина красновато-коричневого оттенка
Вопрос 2: Как называется ржавление железа?
Ответ:
Ржавчина – это явление образования красновато-коричневого налета на поверхности железа под действием влажного воздуха, красновато-коричневый налет называется ржавчиной.
Вопрос 3. Как можно предотвратить ржавление железа?
Как можно предотвратить ржавление железа?
Ответ:
Ржавление железа можно предотвратить с помощью
- нанесения краски
- нанесения смазки или масла
- гальванизации
9 0003 Гальванопокрытие
- Использование легирующего железа для изготовления нержавеющей стали
- Лужение
- Использование эмали
Вопрос 4: Что такое ржавчина? Приведите уравнение образования ржавчины?
Ответ:
Когда железо находится на воздухе в течение длительного периода времени, оно окисляется и образует на поверхности красновато-коричневый оксид железа. Ржавчина — название этого красновато-коричневого материала.
Ржавчина образуется по следующему уравнению:
4Fe + 3O 2 +2xH 2 O → 2Fe 2 O 3 .xH 2 901 35 O
Вопрос 5: Как ржавчина повреждает железные предметы?
Ответ:
Ржавчина проницаема и мягка, и когда она соскальзывает с поверхности ржавого железного предмета, железо под ним ржавеет.
В результате железная ржавчина — это постоянный процесс, который со временем разъедает железные предметы, делая их бесполезными. Ржавление железа со временем наносит значительный ущерб, поскольку оно используется для создания широкого спектра конструкций и товаров, включая мосты, решетки, перила, ворота и кузова автомобилей, автобусов, грузовиков и кораблей. Само собой разумеется, что у нас должен быть способ уберечь железо от ржавчины.
Вопрос 6: Какие условия необходимы для образования ржавчины?
Ответ:
Ржавлению железа способствуют многие факторы, в том числе количество влаги в воздухе и рН окружающей среды. Ниже приведены некоторые из этих элементов.
- Влажность: Наличие воды в окружающей среде ограничивает коррозию железа. Наиболее распространенной причиной ржавчины является воздействие дождя.
- Процесс ржавчины ускоряется, если pH среды вокруг металла низкий.

