Ржавчина это вещество: Ржавчина — что это?
Содержание
Ржавчина
Ржавчина — продукт взаимодействия внешней окислительной атмосферы с железом. Процесс ее образования называется ржавлением ( коррозия ). Термин «ржавчина» присущ только продуктам коррозии железа и его сплавов. Любые другие металлы могут корродировать, но не ржаветь!
Ржавчина — это гидратированная окись железа (гидроксид железа). Химическая формула ржавчины — Fe2O3•H2О (иногда пишут просто Fe2O3). На поверхности образуется в виде шероховатого налета, который имеет рыхлую структуру. Цвет ржавчины — от оранжевого до красно-коричневого.
Железо при рН среды > 5,5 образует труднорастворимый гидрат закиси железа, имеющий белый цвет:
Fe2+mH2O + 2OH— = mH2O + Fe(OH)2↓
При взаимодействии гидрата закиси железа с растворенным кислородом в воде, образуются еще более труднорастворимое соединение — гидрат окиси железа (бурый цвет):
2Fe(OH)2 + 1/2 O2 + H2О = 2Fe(OH)3↓
Вторичные продукты коррозии (Fe(OH)2 и Fe(OH)3) могут и дальше превращаться, с образованием гидратированных окислов FeO•Fe2O3•nH2О — ржавчины. FeO — нестабильное соединение, поэтому в формуле ржавчины его часто просто не записывают.
FeO — нестабильное соединение, поэтому в формуле ржавчины его часто просто не записывают.
2e + 2H+ — H2;
4e +O2 + 4H+ — 2H2O;
2e + Fe(OH)2 + 2H+ — Fe + 2H2O;
2e + Fe2+ — Fe;
2e + Fe(OH)3— + 3H+ — Fe + 3H2O;
e + Fe(OH)3 + H+ — Fe(OH)2 + h3O;
e + Fe(OH)3 + 3H+ — Fe2+ + 3H2O;
Fe(OH)3- + H+ — Fe(OH)2 + H2O;
e + Fe(OH)3 — Fe(OH)3-;
Fe3+ + 3H2O — Fe(OH)3 + 3H+;
Fe2+ + 2H2O — Fe(OH)2 + 2H+;
e + Fe3+ — Fe2+;
Fe2+ + H2O — FeOH + H+;
FeOH+ + H2O > Fe(OH)2 + H+;
Fe(OH)2 + H2O — Fe(OH)3- + H+;
Fe3+ + H2O — FeOH2+ + H+;
FeOH2+ + H2O — Fe(OH)3 + H+;
FeOH2+ + H+ — Fe2+ + H2O;
e + FeOH2+ + 2H+ — Fe2+ +2H2O;
e + Fe(OH)3 + H+ — Fe(OH)2 + H2O;
e + Fe(OH)3 + 2H+ — FeOH+ + 2H2O;
e + Fe(OH)3 + 3H+ — Fe2+ + 3H2O.
Ржавчина может существовать в двух формах: магнитной (γ- Fe2O3) и немагнитной (α-Fe2O3). Гидратированная окись железа в α форме (гематит) -более стабильное соединение. Раствор, насыщенный ржавчиной, почти нейтральный. γ- Fe2O3 обычно между гидратированными оксидами Fe2O3 и FeO образует черный промежуточный слой. Поэтому можно сказать, что ржавчина состоит из трех слоев оксидов железа разной степени окисления.
Процесс ржавления металла начинается только при наличии в воздухе влаги. При попадании на поверхность изделия из железа капли воды, спустя некоторое время, можно заметить изменение ее цвета. Капля становится мутной и постепенно окрашивается в бурый цвет. Это свидетельствует о появлении, в месте контакта воды с поверхностью, продуктов коррозии железа.
Если ржавчина уже образовалась — остановить процесс коррозии крайне трудно и не всегда удается. Лучше его предупреждать и заранее защищать металл!
Ржавчина — что это?
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Свинаренко М. П. 1
П. 1
1 Муниципальное бюджетное общеобразовательное учреждение « Головчинская средняя общеобразовательная школа с углубленным изучением отдельных предметов», МБОУ «Головчинская СОШ с УИОП»
Левченко З.Н. 1
1Муниципальное бюджетное общеобразовательное учреждение « Головчинская средняя общеобразовательная школа с углубленным изучением отдельных предметов», МБОУ «Головчинская СОШ с УИОП»
Автор работы награжден дипломом победителя III степени
Диплом школьникаСвидетельство руководителя
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
ВВЕДЕНИЕ
Выбрать тему для научной работы для меня было не сложно, так как меня всегда интересовали различные явления, которые происходят вокруг меня. Так, например, почему новый блестящий велосипед со временем, тускнеет и становится не таким уж и новым. Меня заинтересовало, почему так происходит? Ведь в настоящее время изобретено много средств, с помощью которых можно очистить от ржавчины железные предметы. Но что же можно сделать, чтобы оно не ржавело как можно дольше?
Но что же можно сделать, чтобы оно не ржавело как можно дольше?
Цель работы:
1.Выяснить какие предметы подвержены коррозии.
2. В каких условиях образуется ржавчина.
3.Выяснить методы защиты от ржавчины.
Объект исследования: ржавчина
Предмет исследования: железные предметы
Для достижения поставленной цели необходимо решить следующие задачи:
Узнать, что такое ржавчина и причины ее появления.
Путем опыта получить в домашних условиях ржавчину на разных предметах (гвозди, нить, и пластик).
С помощью опыта попытаться удалить ржавчину
Проанализировать и сравнить результаты наблюдения данных и сделать выводы.
Методы исследования:
1.Изучение литературы (теоретический материал).
2.Наблюдение (проведение опытов).
3.Анализ полученных данных.
4.Обобщение.
Гипотеза исследования: если железо ржавеет, то есть разлагается, значит, это необходимое явление для всего живого в природе.
1.Теоретическая часть.
Металлы составляют одну из основ цивилизации на планете Земля. Их широкое внедрение в промышленное строительство и транспорт произошло на рубеже XVIII-XIXвв. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Начало практического использования человеком железа относят к IX веку до нашей эры. Именно в этот период человечество перешло из бронзового века в век железный.
В XXI веке высокие темпы развития промышленности, предъявляют высокие требования к надежной эксплуатации технологического оборудования и строительных конструкций. Особое место в комплексе мероприятий по обеспечению бесперебойной эксплуатации оборудования отводится надежной защите его от коррозии и применению в связи с этим высококачественных химически стойких материалов.
Защита от коррозии является одной из важнейших проблем, имеющей большое значение для народного хозяйства.
Ржавчина. Причины появления.
Из «Большого толкового словаря русского языка » я узнал, что ржавчина –это красно-бурый налёт на поверхности железа, образующийся вследствие окисления его под действием воздуха и влаги.
Это значит, что при отсутствии в воздухе влаги и воды вообще, отсутствует растворенный в воде кислород и ржавчина не образуется.
Если железо, содержащее какие-либо добавки и примеси (например, чугун), находится в контакте с водой, кислородом или другим сильным окислителем и/или кислотой, то оно начинает ржаветь. Вода становится красноватой, и ржавчина плавает в воде в виде мелких частиц. Когда капля испарится, остается ржавчина, образуя красноватый слой на поверхности железа.
Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций.
Чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода.
В воздухе содержится кислород, который необходим нам для жизни. В воздухе же содержится и вода. Только её очень мало, поэтому мы в воздухе её не ощущаем. На железо, особенно в присутствии воды, кислород оказывает действие, в результате которого образуется ржавчина.
Так как железные предметы всегда находятся в воздухе, то на них действует кислород и вода, поэтому железные предметы ржавеют (покрываются ржавчиной).
Методы предотвращения появления ржавчины:
1.Металлические предметы смазывают специальными жирными смазками. Тогда всё, что соприкасается с ними, тоже оказывается смазанным. Кроме того, масла и смазки со временем стираются и испаряются. Железо опять остаётся незащищённым. Смазывать надо регулярно.
2.Изделия из железа покрывают слоем краски, лака, пластмассы. Это удобно для сохранения больших предметов. Красить каждый гвоздик, тонкую спицу, ключ, т.е. мелкие предметы – неудобно
3.Детали, железные листы и др. покрывают металлами (никель, олово, медь) и сплавами, которые не ржавеют. Этот способ используется как для бытовых предметов, так и промышленных. Например, консервные банки изготовлены из железа, покрытого оловом, ложки и вилки покрывают слоем нержавеющей стали. Металлы более прочны, долго не стираются, не пачкаются. Данный способ самый эффективный и, как показывает практика, самый распространённый в промышленности.
Я провел анкетирование учащихся 3 классов. «Ржавчина полезна или вредна?» и выяснил, что 3 человека из 47 считают ржавчину полезной, а 44 – вредной. Как же на самом деле? (Приложение 1)
2. Практическая часть
Для того чтобы изучить образования ржавчины я провел следующие опыты:
ОПЫТ 1. (Приложение №2)
Цель опыта:
Выяснить может ли вода сделать все предметы ржавыми.
Понадобится: 5 стаканов,3 железных гвоздя, наждачная бумага,1 кусок верёвки, 1 зубец от пластиковой вилки
Ход опыта
1. Обезжирю и удалю ржавчину с железных гвоздей наждачной бумагой.
2. Положу в три стакана по железному гвоздю, в четвёртый положу верёвку, а в последний -зубец от пластиковой вилки.
3. В один стакан с гвоздём не буду наливать воду, в двух других уровень воды должен быть под ободок. Один из стаканов с водой закрою, другие оставлю открытыми.
4. Наполню также стаканы с верёвкой пластиком под ободок водой.
5 Оставлю стаканы стоять от одной до трёх недель, и всё это время буду проверять, не образовалась ли где-нибудь ржавчина.
|
Стакан с нитью
|
Стакан с пластиком
|
Стакан с водой гвоздём накрытый
|
Стакан с водой и гвоздём открытый
|
Стакан с гвоздём без воды
| |
|
Через день
|
Изменений нет
|
Изменений нет
|
Изменений нет
|
Изменений нет
|
Изменений нет
|
|
Через 2 дня
|
Изменений нет
|
Изменений нет
|
Вода помутнела
|
Вода помутнела
|
Изменений нет
|
|
Через 1 неделю
|
Изменений нет
|
Изменений нет
|
Выпал осадок, гвоздь стал ржавым
|
Выпал большой осадок , гвоздь стал ржавым
|
Изменений нет
|
|
Через 3 недели
|
Изменений нет
|
Изменений нет
|
—
|
Осадка стало больше
|
Изменений нет
|
Вывод:
Железо вступает в контакт с кислородом, создавая с помощью химической реакции новое вещество, которое известно как ржавчина. При контакте с водой или даже при повышенной влажности процесс ржавления ускоряет.
При контакте с водой или даже при повышенной влажности процесс ржавления ускоряет.
И поскольку вода может поглощать больше кислорода из воздуха в открытом стакане, гвоздь в ней ржавеет быстрее, чем в соответствующей запечатанном стакане. Верёвка и пластик не содержат железа (или других металлов) и, следовательно, не ржавеют.
ОПЫТ 2. (Приложение № 3)
Цель опыта: выяснить, в какой среде можно избавиться от ржавчины или приостановить процесс ржавления.
Для этого возьму 5 стаканов с водой из водопровода. В первый добавлю уксус, во второй – соду, в третий – соль, в четвертый – просто воду, в пятый — кока-колу. В каждый стакан опущу ржавые железные гвозди.
|
уксус
|
сода
|
соль
|
вода
|
Кока-кола
| |
|
Через 2 дня
|
Нет изменений
|
Нет изменений
|
Вода помутнела, выпал осадок
|
Вода помутнела
|
Кока-кола стала более темной.
|
|
Через 1 неделю
|
Ржавчина с гвоздя сошла.
|
Нет изменений
|
Осадка стало больше
|
Выпал осадок
|
Ржавчины на гвозде нет
|
Вывод:
-Приостановить процесс ржавления можно в щелочной среде, т.к. добавление соды к воде, ослабило коррозию металла.
Таким образом щелочная среда благоприятна для предохранения железа от ржавчины.
-Избавиться от ржавчины можно в кислой среде, т. к добавления уксусной кислоты и кока-колы привело к исчезновению налета ржавчины.
-Водопроводная вода + соль — благоприятная среда для быстрого возникновения ржавчины.
3. Заключение
В целях предотвращения проблемы появления ржавчины на железных предметах, за ними следует правильно ухаживать. Но для эффективной борьбы с проблемой появления ржавчины следует применять комплексный подход. При этом необходимо защищать железо изначально, сделать все, чтобы удалить все условия, в которых может появиться ржавчина. Чтобы обеспечить более качественное удаления ржавчины, необходимо использовать сразу несколько способов. Чтобы предотвратить ее повторное появление, на поверхность следует нанести специальное защитное покрытие.
Изучая и рассматривая литературу, я узнал, что железо не причисляют к «благородным» металлам. Но благодаря свойству ржаветь железо и есть самый «благородный» металл, самый настоящий из всех. Если бы железо, подобно серебру и золоту, не ржавело, то есть не окислялось, то мы не существовали бы, и ни одно растение не зеленело бы на Земле. Все краски, какими обладает наша Земля, все цвета, которыми блещет рубин, зависят от присутствия в нем окисленного железа.
Растворенная в воде ржавчина составляет часть пищи растений и придает им зеленый цвет. Из-за недостатка ионов железа растения бледнеют. Та же «ржавчина» (ионы железа) снабжает нашу кровь и придает ей красный цвет.
Благодаря ржавчине на Земле есть жизнь. Благодаря ржавчине почва имеет определенный цвет. Именно благодаря ржавчине железо — самый лучший металл в мире.
Английский писатель, художник, литературный критик и поэт Джон Рёскин сказал: «Железо есть дыхание жизни, которым оно одаряет всех».
Исходя из выше сказанного, я могу утверждать, что, несмотря на все потери и ущерб, которые наносит ржавчина деятельности человека, без нее мы не смогли бы существовать. Значит, моя гипотеза нашла свое подтверждение: если железо ржавеет, то есть разлагается, значит, это необходимое явление для всего живого в природе. Но это не говорит о том, что человек должен бесконечно добывать из недр земли все её богатства и расточительно их использовать. Мы должны научиться беречь природу и её богатства, она не прощает ошибок.
Мы должны научиться беречь природу и её богатства, она не прощает ошибок.
На уроке окружающего мира я познакомил одноклассников с результатами моего исследования, чтобы показать пользу ржавчины.
Список литературы:
1. . С.И. Ожегов, Н.Ю. Шведова «Толковый словарь русского языка», 2000
2.101 эксперимент с водой «Ранок» , 2012
3. Интернет – сайт «Википедия»
4. Савина Л. А. Я познаю мир. АСТ», 1999
Приложение №1
Приложение №2
ОПЫТ 1.
День 1
Через 2дня
Через 1 неделю
Приложение №3
ОПЫТ 2.
День 1
Через 2 дня
Через неделю
Просмотров работы: 212
Что вызывает ржавчину в металлах
Ржавчина — слишком распространенное явление. Будь то старые ворота или автомобиль на свалке, мы все регулярно видим ржавчину и знаем, что это результат плохого ухода за металлическим предметом. Его можно найти на самых разных металлических поверхностях, от кузовов автомобилей до металлических инструментов, и, если его не остановить, он может вызвать структурные повреждения и эстетические проблемы. Вы когда-нибудь задумывались, почему это происходит? Что вызывает ржавчину металла в первую очередь?
Будь то старые ворота или автомобиль на свалке, мы все регулярно видим ржавчину и знаем, что это результат плохого ухода за металлическим предметом. Его можно найти на самых разных металлических поверхностях, от кузовов автомобилей до металлических инструментов, и, если его не остановить, он может вызвать структурные повреждения и эстетические проблемы. Вы когда-нибудь задумывались, почему это происходит? Что вызывает ржавчину металла в первую очередь?
Понимание того, как действует ржавчина, необходимо для сохранения долговечности и ценности ваших металлических конструкций, таких как мосты и лодки. На химическом уровне ржавчина возникает, когда металл подвергается воздействию влаги и кислорода. Химическая реакция, вызывающая ржавчину, представляет собой форму коррозии, которая медленно разъедает ржавую металлическую поверхность, со временем приводя к:
- Слабости
- Обесцвечивание
- Износ
В этом блоге мы рассмотрим причины и последствия появления ржавчины на металле, а также меры по предотвращению образования ржавчины, которые следует предпринять для ее предотвращения.
Что вызывает ржавчину на металле?
Ржавчина — это вид коррозии, возникающий на металлических поверхностях при взаимодействии железа с кислородом и водой. Химическая реакция, вызывающая ржавчину, называется окислением. Процесс окисления разъедает металл и создает видимую ржавчину на поверхности металла. Когда металл подвергается воздействию любого типа влаги — даже влажности воздуха — атомы железа в металле реагируют с молекулами кислорода в воздухе с образованием оксида железа, также известного как ржавчина.
Химическая реакция может быть представлена следующим уравнением:
железо + кислород + вода = оксид железа (ржавчина)
Ржавчина может возникнуть на любом железосодержащем металле, включая сталь, железо и чугун. Скорость образования ржавчины на металлических поверхностях зависит от уровня влажности, количества присутствующего кислорода, а также от типа металла.
Срок службы металла без покрытия, подверженного ржавчине, значительно короче, чем у металла, покрытого составом для холодного цинкования с высоким содержанием цинка производства ZRC. При отсутствии лечения ржавчина может полностью разъесть металл, превратив его в порошок сухого оксида. Результатом химической реакции в процессе окисления не стоит рисковать!
При отсутствии лечения ржавчина может полностью разъесть металл, превратив его в порошок сухого оксида. Результатом химической реакции в процессе окисления не стоит рисковать!
Заказать ZRC Состав для холодного цинкования для предотвращения ржавчины
Состав для холодного цинкования или состав с высоким содержанием цинка имеет характеристики краски, но не является краской. Самая большая разница заключается в процентном содержании цинка в антикоррозионном покрытии. Видите ли, менее благородный металл разъедает более благородный. Соединения, богатые цинком, можно наносить на сталь распылением или кистью (как краску). Цинк, будучи менее благородным, чем сталь, при коррозии образует гидроксикарбонатную соль, которая связывается с существующим цинком в пленочном покрытии, поддерживая гальваническую защиту. Это создает передовую самовосстанавливающуюся пленку, которая обеспечивает защиту металлической поверхности под покрытием. Поскольку процентное содержание цинка в ZRC очень велико, а частицы не инкапсулированы, защита от коррозии является гальванической, как при горячем цинковании.
Состав для холодного цинкования представляет собой продукт, имитирующий свойства горячего цинкования погружением. Разница в том, что горячее цинкование необходимо применять в контролируемых условиях, например, на заводе-изготовителе. Составы для холодного цинкования можно наносить на месте прямо из баллончика, как и краску.
Варианты нанесения для защиты от ржавчины
После нанесения и высыхания компаунды для холодного цинкования ZRC® обеспечивают соответствие высоким отраслевым стандартам защиты от коррозии независимо от того, наносятся они распылением или кистью. У нас есть ряд различных продуктов, каждый из которых специально разработан для определенных случаев использования. Наш блог «Выбор правильного цинкового покрытия ZRC для предотвращения коррозии» содержит все, что вам нужно знать, чтобы выбрать правильный продукт ZRC. Помимо выбора конкретного продукта ZRC, у вас есть два варианта применения:
Предотвращение ржавчины при нанесении кистью:
Наша краска для холодного цинкования была оригинальным продуктом ZRC и до сих пор является отраслевым стандартом. Он эквивалентен по функциям, но превосходит по удобству горячее цинкование. Наши эксперты рекомендуют нанесение кистью, когда вы выполняете крупномасштабный проект, например двутавровые стальные балки. Если предстоит большая работа, рекомендуем жидкую краску. Это потому, что вы получите больше покрытия из галлона краски для холодного цинкования, чем из баллончика.
Он эквивалентен по функциям, но превосходит по удобству горячее цинкование. Наши эксперты рекомендуют нанесение кистью, когда вы выполняете крупномасштабный проект, например двутавровые стальные балки. Если предстоит большая работа, рекомендуем жидкую краску. Это потому, что вы получите больше покрытия из галлона краски для холодного цинкования, чем из баллончика.
Предотвращение ржавчины распылением:
Спрей для холодного цинкования можно наносить в виде аэрозоля или с помощью компрессора или методом безвоздушного распыления. Состав ZRC для холодного цинкования в аэрозоле обеспечивает такие же превосходные характеристики, как и состав для нанесения кистью. ZRC просто добавляет пропелленты и другие ингредиенты, поэтому он легко и равномерно распыляется из аэрозольного баллончика. Метод аэрозольного нанесения ZRC Worldwide отличается низким содержанием летучих органических соединений и обеспечивает постоянную толщину сухой пленки, которой нет в недорогих решениях. После нанесения и высыхания покрытия с высоким содержанием цинка должны соответствовать отраслевым стандартам защиты от коррозии. Это верно как при распылении, так и при нанесении кистью. Они выполняют то же самое после применения!
Это верно как при распылении, так и при нанесении кистью. Они выполняют то же самое после применения!
Этот вариант приложения пользуется спросом по ряду различных причин. Допустим, вам нужно подняться по лестнице, чтобы нанести продукт. Что бы вы предпочли: ведро краски на 5 галлонов или баллончик на 12 унций? Поместить аэрозольный баллончик на пояс с инструментами, безусловно, является более простым способом нанесения. Это лишь одна из причин, по которой люди выбирают спрей для холодного цинкования.
Цинк в действии
Предотвращение ржавчины имеет решающее значение для любого типа коммерческого металла, так как неконтролируемая коррозия в конечном итоге приведет к значительному повреждению структурной целостности металла и со временем нарушит его целостность. Составы для холодного цинкования — это покрытия, используемые для создания защитного барьера от ржавчины и коррозии на металлических поверхностях, таких как мосты, вышки сотовой связи, лодки и другие морские сооружения. Эти соединения содержат частицы цинка, взвешенные в жидком носителе, в данном случае в краске. При нанесении на металлическую поверхность частицы цинка прилипают к поверхности и образуют защитный слой, который действует как «жертвенный анод».
Эти соединения содержат частицы цинка, взвешенные в жидком носителе, в данном случае в краске. При нанесении на металлическую поверхность частицы цинка прилипают к поверхности и образуют защитный слой, который действует как «жертвенный анод».
Жертвенный анод представляет собой металл, который более реактивен, чем металл, который он защищает. В случае составов для холодного цинкования эту роль берет на себя цинк, который подвергается коррозии вместо металлической поверхности ваших ворот, моста или другой металлической конструкции. Когда эти частицы цинка подвергаются коррозии, они создают пассивный слой на поверхности металла, который предотвращает дальнейшую коррозию и защищает вашу сталь от коррозии. Результат? Надежное решение для защиты металлических поверхностей от ржавчины и коррозии.
Используйте продукты ZRC для борьбы с коррозией до того, как вы покроете металл ржавчиной
Существует множество продуктов, удовлетворяющих различные потребности в области защиты от коррозии. Подражание лестно, но доказательство в краске. ZRC Worldwide создала технологию цинкования в качестве альтернативы горячему погружению для борьбы с коррозией и уже почти 70 лет является мировым лидером в этой области.
Подражание лестно, но доказательство в краске. ZRC Worldwide создала технологию цинкования в качестве альтернативы горячему погружению для борьбы с коррозией и уже почти 70 лет является мировым лидером в этой области.
Использование продукта ZRC обеспечивает прочную связь между цинком и защищаемым металлом. Будь то ретушь существующего проекта или выполнение полномасштабной работы с нуля, наша команда гарантирует, что вы получите правильный продукт и правильный метод нанесения для ваших нужд.
Формула ржавчины — Введение, химическая формула и уравнения
- Формула
- Формула ржавчины
Важным аспектом использования металлического железа является возможность ржавчины или коррозии. Ржавчина представляет собой гидратированную форму соединения, известного как оксид железа (III). Ржавчина — это общий термин, обозначающий ряд оксидов железа (красных оксидов). Процесс образуется при реакции железа с кислородом в присутствии влаги воздуха или воды.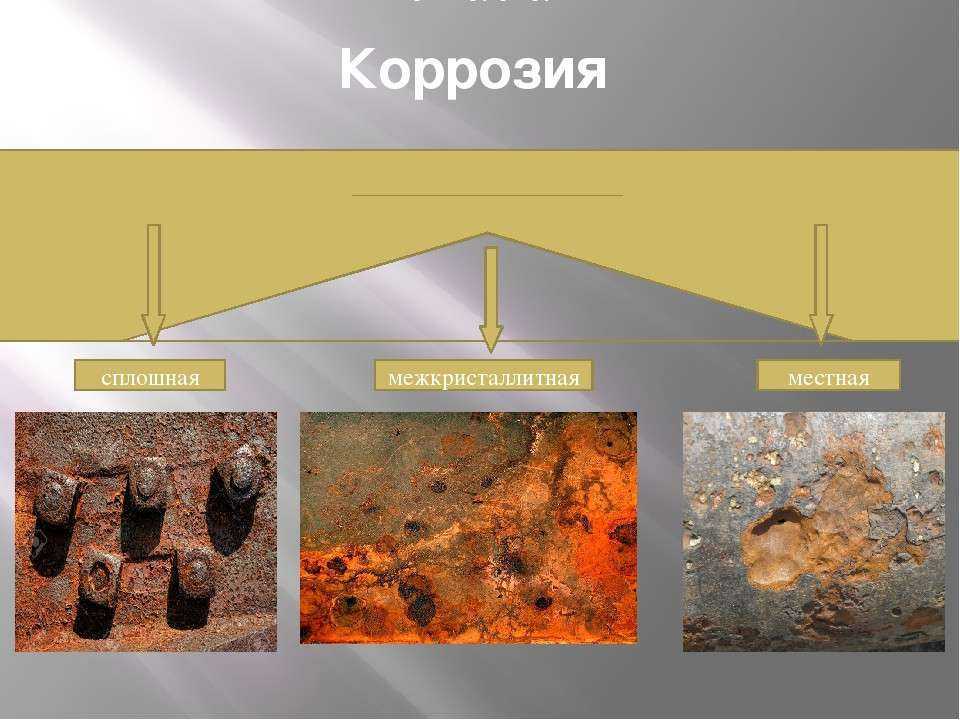 Формула ржавчины примерно Fe 2 O 3 x H 2 O однако точное количество воды в формуле может варьироваться. Однако не существует физического процесса получения железа из ржавчины.
Формула ржавчины примерно Fe 2 O 3 x H 2 O однако точное количество воды в формуле может варьироваться. Однако не существует физического процесса получения железа из ржавчины.
Какова химическая формула ржавчины?
Химическая формула соединения определяется как символическое представление состава соединения. Химическая формула ржавчины: Fe 2 O 3 , широко известная как оксид железа или оксид железа.
Конечный продукт представляет собой серию химических реакций, упрощенных ниже, как- Ржавление формулы железа просто 4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3 .
Для процесса ржавчины необходимы кислород и вода. Процесс обычно ускоряется такими действиями, как контакт с менее активными металлами, кислотами, напряжениями в железе и наличием самой ржавчины.
Что такое уравнение для коррозии?
Ржавление железа включает усиление окисления железа, сопровождающееся потерей электронов. Ржавчина состоит в основном из двух разных оксидов железа. Они различаются по степени окисления атома железа: оксид железа (II) или оксид железа со степенью окисления +2 и оксид железа (III) или оксид железа со степенью окисления +3.
Ржавчина состоит в основном из двух разных оксидов железа. Они различаются по степени окисления атома железа: оксид железа (II) или оксид железа со степенью окисления +2 и оксид железа (III) или оксид железа со степенью окисления +3.
Ржавление железа по формуле представляет собой серию химических реакций, которые заключаются в следующем:
Fe(OH) 2 ⇌ FeO + H 2 O
4Fe (ОН) 2 + O 2 + xH 2 O → 2Fe 2 O 3 .(x+4)H 2 O
Fe(OH) 9007 1 3 ⇌ FeO(OH) + H 2 O
FeO(OH) ⇌ Fe 2 O 3 + H 2 O
Ряд уравнений коррозии приводит к красновато-коричневому отложению, называемому ржавчиной, которое образуется на куске железа под воздействием влажного воздуха в течение некоторого времени.

 Ржавчина с гвоздя сходит
Ржавчина с гвоздя сходит