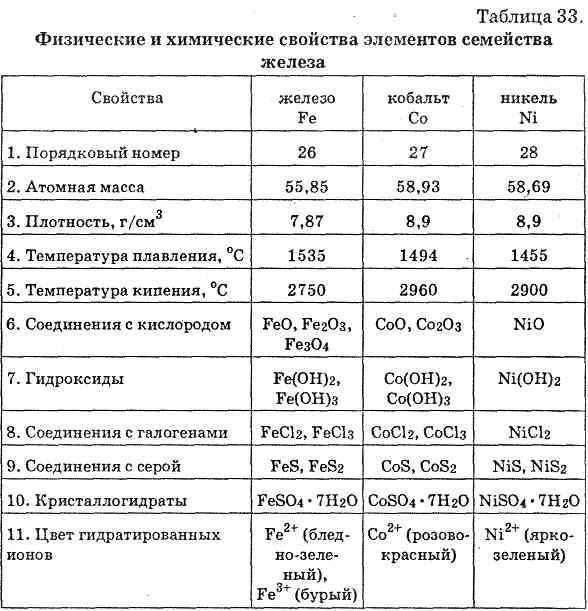
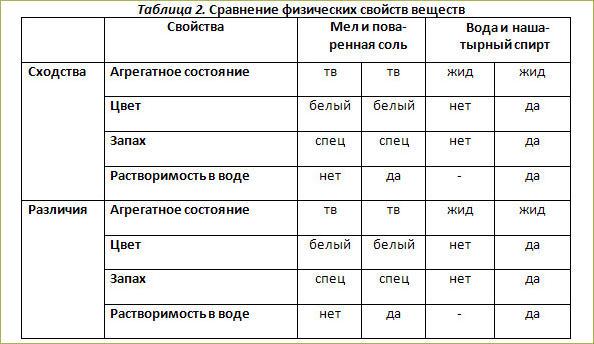
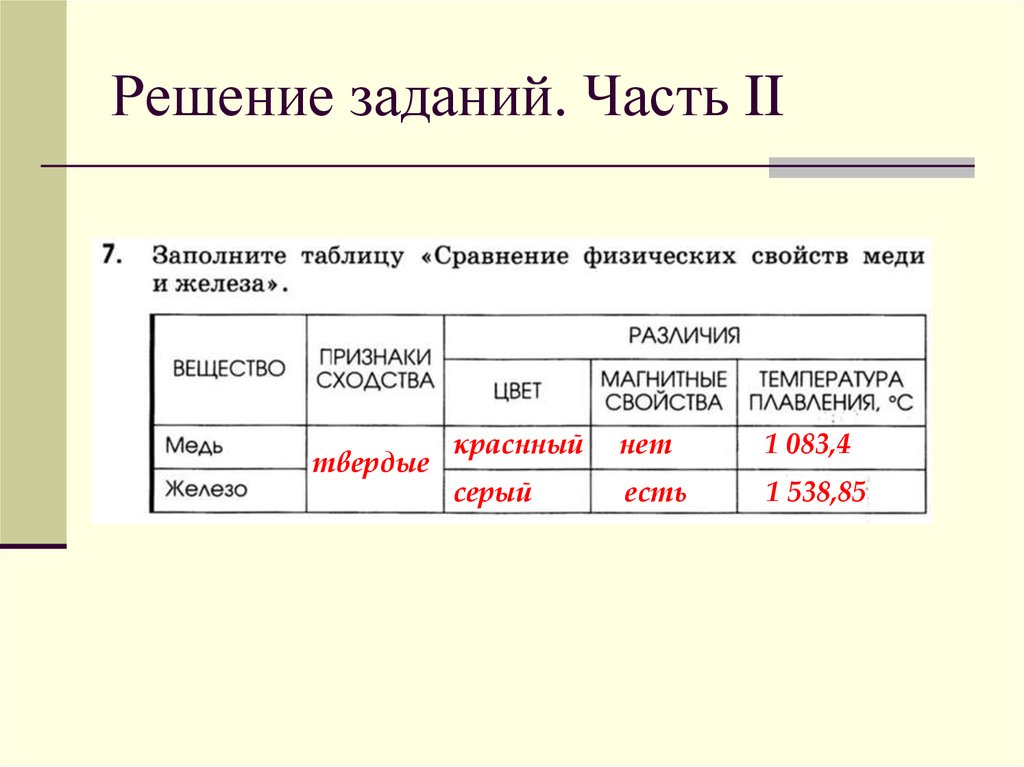
Сравнить и описать свойства меди и железа по плану: агрегатное состояние , цвет , блеск , запах , твёрдость , пластичность , хрупкость , эластичность , растворимость в воде , температура плавления и пло…
Содержание
Гинкго билоба — описание, применение и полезные свойства
Уникальный состав
Несмотря на реликтовое происхождение, полностью изучить и описать воздействие экстракта гинкго пока не удалось. Сейчас известны следующие вещества, содержащиеся в листьях дерева:
-
конденсированные танины; -
терпеновые трилактоны: гинкголиды, билобалиды – уникальные компоненты, которые есть только в гинкго билоба; -
бензойная кислота и ее производные; -
гидрогинкголовая, шикимовая, хинная, линоленовая кислоты; -
аминокислоты; -
полисахариды; -
жирные и эфирные масла; -
воск; -
стерины; -
карданолы; -
полипренолы; -
проантоцианиды; -
алкалоиды; -
биофлавоноиды: кемпферол, кверцетин, изорамнетин, гинкгетин, билобетин, мирицетин, катехины; -
супероксиддисмутаза; -
фосфор, селен, титан, магний, железо, калий, кальций, марганец, медь; -
тимин.
В оболочке семян содержатся пропионовая, валерьяновая, гинкголовая кислоты.
Гинкго широко используется в традиционной китайской медицине. В Европе входит в десятку самых популярных пищевых добавок. А в Германии относится к лекарственным средствам.
Фармакологические свойства
Наибольшее распространение экстракт растения получил благодаря своим вазоактивным фармакологическим эффектам – то есть влиянию на кровеносные сосуды. Компоненты в его составе могут угнетать активность фермента фосфодиэстеразы. В результате в гладкомышечных клетках накапливается циклический гуанозинмонофосфат, снижается концентрация ионов кальция в цитоплазме. За счет этого мышечные стенки сосудов расслабляются, снижается их тонус, улучшается кровоток, в том числе почечный и церебральный. Нормализация кровообращения используется при решении проблем с потенцией.
Биологически активные компоненты гинкго изменяют реологические свойства кровеносной системы, уменьшают риск возникновения тромбозов. Уменьшаются адгезивные свойства тромбоцитов, эритроцитов, высвобождение медиаторов, что тоже не дает повышаться тонусу артерий.
Уменьшаются адгезивные свойства тромбоцитов, эритроцитов, высвобождение медиаторов, что тоже не дает повышаться тонусу артерий.
Велико антиоксидантное влияние экстракта. Флавоноидные гликозиды связываются с ионами металлов (железа, марганца, меди и других), снижая количество свободных радикалов за счет образования комплексных соединений. Они же предотвращают биологическое разрушение адреналина и аскорбиновой кислоты. Обладают антиоксидантным эффектом и терпеноиды, медь, селен, калий, фосфор, которые тоже есть в составе листьев. Биофлавониды обладают кумулятивным эффектом, потому оказывают продолжительное воздействие.
Билобалид способствует нормализации кровотока. Он улучшает насыщение клеток кислородом, что необходимо лечении сосудистой недостаточности.
В неврологии БАД используются для защиты клеток от повреждения под действием патогенных факторов. Вещества направленно действуют на нервы, сокращая риск гибели нейронов.
Препараты на основе экстракта гинкго способствуют нормализации углеводного обмена, влияют на метаболические свойства норадреналина, дофамина, серотонина. Этим объясняется ноотропный и антидепрессивный эффект. Нейропротекторные свойства получили распространение в геронтологии.
Нефропротекторное действие используется в нефрологии. Биологически активные компоненты способствуют поддержанию нормального состояния клеточных структур. Уменьшается протеинурия, выраженность ряда других канальцевых расстройств. За счет улучшения почечного кровотока проявляются мочегонные свойства растения.
Экстракт гинкго способствует:
-
стимуляции расширения кровеносных сосудов, снижению давления, сокращению риска возникновения инсультов; -
уменьшению вероятности развития тромбозов; -
снижению уровня холестерина; -
повышению скорости клубочковой фильтрации, уменьшению протеинурии, увеличению реабсорбции воды и натрия; -
предупреждению возрастных изменений головного мозга, вызываемых повреждением нейронов; -
стимуляции синтеза адреналина, подавлению симптомов депрессии; -
сдерживанию развития раковых метастазов; -
задержке роста пневмококков, стафилококков, кишечной палочки; -
ослаблению последствий церебральной ишемии; -
активизации поглощения глюкозы в определенных отделах мозга, за счет чего происходит улучшение координации движений; -
предупреждению закупорки бронхов при астматических или аллергических приступах; -
борьбе с возрастными нарушениями сна; -
активации умственной деятельности, улучшение памяти, в том числе в пожилом возрасте; -
сглаживанию последствий табачной или алкогольной интоксикации; -
купированию основных симптомы венозной недостаточности, повышению венозного тонуса, уменьшение проявлений гипоксии; -
улучшению потенции; -
снятию симптомов геморроя; -
восстановлению структуры соединительной ткани, борьбе со старением кожи; -
облегчению головных болей, имеющих сосудистое происхождение; -
замедлению процессов снижения зрения; -
выравниванию цвета кожи, осветление старческих пигментных пятен.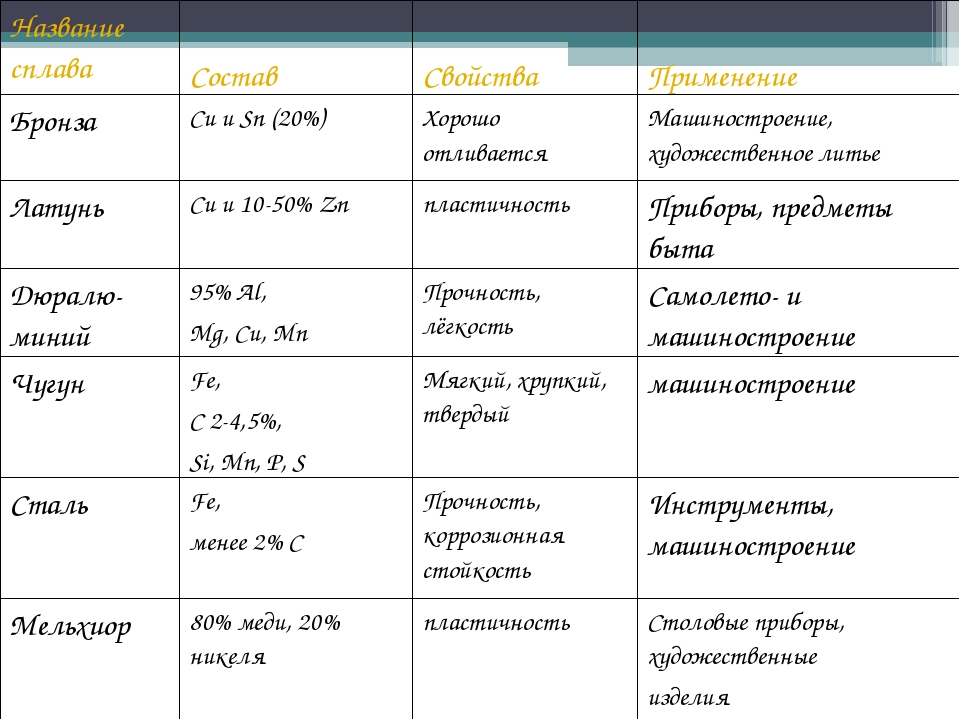
Препарат на основе листьев и плодов растения широко применяется для решения комплекса проблем, связанных с возрастными изменениями организма, при лечении депрессивных состояний, для устранения последствий нарушений кровообращения.
Гинкго – спасение для жителей крупных городов любого возраста. За счет улучшения тока крови в мозге улучшается память, логическое мышление, восприятие, повышается настроение и общий тонус.
Нельзя недооценивать косметологические свойства активных компонентов. Они нормализуют влажность кожи, замедляя процессы образования морщин, повышая упругость и выравнивая цвет дермы. Расширение сосудов приводит к сокращению отеков. Все тоже улучшение кровообращения влияет и на здоровье волос. Они начинают быстрее расти, меньше выпадать.
Показания к применению, противопоказания
Перечень состояний, при которых может применяться гинкго, постоянно изменяется, благодаря открытию его новых свойств. Сейчас таблетки с экстрактом назначаются при:
Сейчас таблетки с экстрактом назначаются при:
-
нарушении кровообращения конечностей; -
ухудшении состояния сосудов; -
проблемах с потенцией; -
возрастном изменении гормонального фона; -
нарушениях в работе нервной системы; -
мигренях; -
головокружениях; -
возрастных нарушениях когнитивной сферы; -
снижении слуха; -
заболеваниях глаз; -
нарушениях углеводного обмена; -
аллергиях; -
астмах; -
токсическом шоке; -
депрессиях; -
выпадении волос; -
витилиго.
Побочные эффекты при приеме возникают редко. Они обуславливаются слишком долгим приемом препаратов, вызывающим переизбыток биологически активных веществ в организме, а также сопутствующими заболеваниями и лекарствами, принимаемыми для их лечения.
Возможны такие реакции как:
-
головные боли; -
шум в ушах; -
тошнота; -
диарея; -
рвота; -
снижение аппетита; -
повышенное слюноотделение; -
учащенное сердцебиение; -
необоснованное чувство тревоги.
При возникновении симптомов необходимо проконсультироваться с врачом для коррекции лечебного плана.
Противопоказаниями к приему препаратов с гинкго являются:
-
возраст моложе 12 лет; -
повышенная склонность к аллергическим реакциям; -
склонность к кровотечениям; -
заболевания желудочно-кишечного тракта; -
беременность; -
кормление грудью; -
острые нарушения мозгового кровообращения; -
артериальная гипотензия; -
инфаркт миокарда.
Так как содержание активных веществ в экстракте растения очень велико, применение гинкго должен контролировать врач.
Свойства золота — физические и химические
Золото, так же как серебро и шесть металлов платиновой группы, относится к благородным, или драгоценным металлам.
Первое определение (благородные металлы) отражает свойство золота крайне неохотно вступать в соединения с неметаллическими элементами, в частности с кислородом. С большинством кислот золото также не реагирует. У неблагородных металлов (меди, железа и так далее) взаимодействие с кислородом вызывает окисление — изменения структуры и внешнего вида. Золото в обычных условиях не реагирует с какими-либо природными веществами, и поэтому абсолютно не меняет внешний вид с течением времени.
Второе определение (драгоценные металлы) относится к сочетанию редкости, долговечности и красоты. Именно это позволило золоту с начала истории человечества и до 19 века оставаться самым дорогим металлом.
Физические свойства золота
Золото — элемент 11 группы Периодической системы химических элементов. Из известных 37 изотопов золота, в природе встречается только один стабильный изотоп – 197Au с атомным весом 197, атомным номером 79. Остальные изотопы, получаемые в атомных реакторах, нестабильны и обладают максимальным периодом полураспада в 186 дней (195Au).
В 1947 году в результате эксперимента в ядерном реакторе была осуществлена древняя мечта человечества, которую сделали своей главной целью средневековые алхимики – превращение ртути в золото. Американские физики Ингрем, Гесс и Гайдн получили 35 мг настоящего золота из ртути. Впоследствии было несколько попыток спекуляции на тему промышленного производства искусственного золота. Однако уже тогда ученые однозначно заявляли о том, что получение золота таким образом настолько дорогостоящий процесс, что он не имеет никакого экономического смысла. В итоге, кусочек искусственного золота выставлен в Музее науки и промышленности (Museum of Science and Industry) в Чикаго, и ситуация остается прежней – получать золото искусственным путем нецелесообразно.
Золото представляет собой металл желтого цвета, очень тяжелый, но при этом мягкий и пластичный.
Золото единственный металл, который в чистом виде обладает желтым цветом. Цвет золота яркий, теплый и приятный. Благодаря цвету, люди с самой древности связывали золото с солнцем.
Плотность золота составляет 19,32 г/см3 , то есть золото — очень тяжелый металл. Тяжелее его только платина, иридий, осмий и рений. Кубик золота со стороной всего 3,7 см весит 1 кг. Один кубический метр золота весит 19 320 кг, такой же объём железа будет весить почти в три раза меньше – 7 874 кг.
Температура плавления золота составляет 1064,43 °С, температура кипения — 2947°С. Золото в расплавленном состоянии имеет бледно-зеленый цвет. При нагревании выше температуры плавления начинает улетучиваться.
Золото очень мягкий металл, твердость по шкале Мооса 2,5-3,0. Сталь обладает твердостью 4,0-4,5, поэтому чистое золото можно разрезать ножом. В сплавах твердость золота значительно увеличивается, поэтому мы часто можем видеть в исторических фильмах или книгах, как раньше золото пробовали «на зуб». Действительно, выпускавшиеся ранее золотые монеты состояли почти из чистого золота и на них можно было оставить след при надкусывании. На поддельных монетах, в которых содержание золота было меньше, оставить зубами след не возможно.
В сплавах твердость золота значительно увеличивается, поэтому мы часто можем видеть в исторических фильмах или книгах, как раньше золото пробовали «на зуб». Действительно, выпускавшиеся ранее золотые монеты состояли почти из чистого золота и на них можно было оставить след при надкусывании. На поддельных монетах, в которых содержание золота было меньше, оставить зубами след не возможно.
Золото является наиболее ковким металлом. Его можно не нагревая расковать в полупрозрачные листочки, толщиной примерно от 1 до 0,1 мкм (толщина человеческого волоса от 80 до 110 мкм), которые при этом сохранят цвет и все свойства золота. Это так называемое «сусальное» золото, которым покрывают купола церквей и предметы интерьера. Из одного грамма золота получается лист площадью примерно в 0,5 м2. Таким образом, золотом можно декорировать значительные площади и практически любые материалы. При этом, стоимость самого золота будет относительно невелика и большая часть затрат уйдет на оплату работы мастера и сопутствующих материалов.
Золото очень пластичный и тягучий металл, который позволяет придавать ему любую форму, растягивать и сжимать, сгибать не ломая. К примеру, из одного грамма золота получают 100 метров проволоки диаметром 0,025 мм, которую используют в электронной промышленности для создания электрических цепей в микросхемах.
Также, широкое применение золота в производстве микроэлектроники обеспечивается его низким сопротивлением электричеству, хорошей теплопроводностью и устойчивостью к окислению.
Золото прекрасно отражает инфракрасный свет. Это свойство используют в системах остекления высотных зданий, покрывая стекла тончайшим золотым напылением, не позволяющим инфракрасным лучам проникнуть внутрь и тем самым снижая расходы на охлаждение здания. Золотым напылением покрыты визоры шлемов космонавтов. Золото в комбинации со специальным пластиком полностью защищает глаза космонавтов от агрессивных инфракрасных и ультрафиолетовых излучений, пропуская при этом видимую часть света.
Золото прекрасно поддается различным видам обработки, полировке, пайке, легко образует сплавы с другими металлами. Все эти свойства обусловили широкое применение золота для изготовления ювелирных изделий с самых древних времен.
Химические свойства золота
Химический символ золота — Au, происходит от латинского слова «aurum» — «сияющая заря».
Золото является одним из самых инертных веществ. В обычных условиях оно не реагирует с какими-либо природными веществами. Исключение составляет лишь ртуть, с которой золото при взаимодействии образует амальгаму.
Золото не растворяется в кислотах и щелочах. Исключение составляет царская водка (смесь концентрированных азотных и соляных кислот). Алхимики иллюстрировали растворение золота царской водкой изображением льва, пожирающего солнце.
Также, золото растворяется в жидком броме и в водных растворах цианидов при доступе кислорода. Медленно растворяется при взаимодействии с хлорной и бромной водой, растворе йода в йодистом калии (спиртовой раствор йода обычная вещь в бытовых аптечках).
При нагревании реакционность золота значительно возрастает. К примеру, его можно растворить в горячей концентрированной селеновой кислоте, серной кислоте при добавлении окислителя. При нагреве идет взаимодействие с галогенами и их соединениями, а также с некоторыми другими веществами.
Все соединения золота непрочны и оно достаточно легко восстанавливается до чистого металла. К примеру, соединение ртути с золотом (амальгаму) достаточно просто нагреть до температуры 750-800 °С.
В обычных бытовых условиях мало что химически может повлиять на золотые украшения, однако не следует допускать их взаимодействия с веществами, содержащими ртуть, хлор, йод.
ЮВЕЛИРНЫЕ МЕТАЛЛЫ — КАТАЛОГ | ЮВЕЛИРНЫЕ МЕТАЛЛЫ — СПРАВОЧНИК
Всё о золоте | Все о серебре | Все о платине | Все о палладии
Золотые сплавы и их цвета | Пробы для золота | Таблица физико-химических свойств драгоценных металлов | Как проверить золото на подлинность? | Как проверить платину? | Где в природе встречается золото | Основные золотые месторождения и их виды
Поделитесь статьей с друзьями
Работы дизайнеров из каталога ЮВЕЛИРУМ
Свойства металлов Научный урок
Для большинства людей металл — это другое слово, обозначающее железо, сталь или подобное твердое блестящее вещество.
Но соответствует ли это определение истинным свойствам металлов?
Да… и нет.
Прежде чем мы объясним, вы должны знать, что большинство элементов в таблице Менделеева — это металлы.
Металлы находятся в центре и слева в таблице Менделеева. Их можно дополнительно классифицировать как щелочные металлы, щелочноземельные металлы, переходные металлы и основные металлы.
Урок науки о металлах
Свойства металлов
Элемент — это вещество, состоящее из одного вида атомов; его нельзя разделить на более простые части. Например, элемент гелий (вспомните воздушные шары) состоит исключительно из атомов гелия.
Элементы обычно классифицируются как металлы или неметаллы (хотя некоторые элементы имеют характеристики обоих; они называются металлоиды ).
Три свойства металлов:
- Блеск: Металлы блестят при резке, царапании или полировке.

- Пластичность: Металлы прочные, но податливые, что означает, что их можно легко согнуть или придать им форму. На протяжении веков кузнецы могли придавать металлическим предметам форму, нагревая металл и отбивая его молотком. Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичны , что означает, что их можно вытягивать для изготовления проволоки.
- Проводимость: Металлы являются отличными проводниками электричества и тепла. Поскольку они также пластичны, они идеально подходят для электропроводки. (Вы можете проверить это с помощью некоторых предметов домашнего обихода. Продолжайте читать, чтобы узнать, как!)
Дополнительные свойства металлов
Высокая температура плавления : Большинство металлов имеют высокие температуры плавления, и все, кроме ртути, твердые при комнатной температуре.
Звонкий : Металлы часто издают звенящий звук при ударе.
Реактивность : Некоторые металлы претерпевают химическое изменение (реакцию) сами по себе или с другими элементами и выделяют энергию. Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они содержатся. Наиболее реакционноспособными металлами являются калий и натрий. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Другие металлы вообще не реагируют с другими металлами. Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и электропроводки.
Пять групп металлов:
Благородные металлы встречаются в виде чистых металлов, потому что они нереакционноспособны и не соединяются с другими элементами с образованием соединений. Поскольку они настолько нереактивны, они не подвержены коррозии. Это делает их идеальными для ювелирных изделий и монет.
Благородные металлы включают медь, палладий, серебро, платину и золото.
Щелочные металлы очень реакционноспособны. Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было резать ножом. Калий и натрий — два щелочных металла.
Щелочноземельные металлы встречаются в соединениях со многими различными минералами. Они менее реакционноспособны, чем щелочные металлы, а также более твердые и имеют более высокие температуры плавления. В эту группу входят кальций, магний и барий.
Переходные металлы — это то, о чем мы обычно думаем, когда думаем о металлах. Они твердые и блестящие, прочные и легко поддаются формовке. Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Бедные металлы довольно мягкие, и большинство из них не используются сами по себе.
Однако они становятся очень полезными при добавлении к другим веществам. К бедным металлам относятся алюминий, галлий, олово, таллий, сурьма и висмут.
Сплавы: сильные комбинации
Свойства этих различных металлов можно комбинировать, смешивая два или более из них вместе. Полученное вещество называется сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковородки, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Другие сплавы, такие как латунь (медь и цинк) и бронза (медь и олово), легко поддаются обработке и выглядят красиво. Бронза также часто используется в судостроении, потому что она устойчива к коррозии в морской воде.
Титан намного легче и менее плотный, чем сталь, но такой же прочный; и хотя он тяжелее алюминия, он вдвое прочнее. Он также очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Золото как чистый металл настолько мягкое, что его всегда смешивают с другим металлом (обычно серебром, медью или цинком), когда из него делают украшения. Чистота золота измеряется в карат. Самое чистое, что вы можете получить в ювелирных изделиях, составляет 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное в ювелирных изделиях, представляет собой сплав золота и платины или палладия.
Металл из руды
Руды – это горные породы или минералы, из которых можно извлечь ценное вещество – обычно металл. Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и бокситы (алюминий). Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Существует несколько процессов переработки железа из руды. Более старый процесс заключается в сжигании железной руды с использованием древесного угля (углерода) и кислорода, подаваемого с помощью мехов. Углерод и кислород, включая кислород в руде, соединяются и выходят из железа. Однако железо не нагревается настолько, чтобы полностью расплавиться, и содержит силикаты, оставшиеся от руды. Его можно нагреть и выковать, чтобы сформировать кованое железо .
В более современном процессе используется доменная печь для нагрева железной руды, известняка и кокса (угольный продукт, а не безалкогольный напиток). В результате реакции железо отделяется от кислорода в руде. Этот «чугун» необходимо дополнительно смешать для создания кованого железа. Его также можно использовать для другой важной цели: при нагревании с углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Принимая во внимание процесс, неудивительно, что железо не использовалось примерно до 1500 г. до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а сплав бронзы, как полагают, был открыт шумерами около 3500 г. до н.э. Но алюминий, один из самых важных металлов в современном использовании, не был открыт до 1825 года нашей эры и не использовался до 20-го века!
Коррозия: обработка и предотвращение
Видели ли вы когда-нибудь кусок серебра, который потерял свой блеск, или железо с красноватой ржавчиной на нем или даже отверстия в нем, вызванные коррозией? Это происходит, когда кислород (обычно из воздуха) реагирует с металлом. Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более подвержены такому химическому разрушению или коррозии .
Когда кислород реагирует с металлом, он образует оксид на поверхности металла. Для некоторых металлов, таких как алюминий, это хорошо. Оксид обеспечивает защитный слой, который предотвращает дальнейшую коррозию металла.
Оксид обеспечивает защитный слой, который предотвращает дальнейшую коррозию металла.
Железо и сталь, с другой стороны, имеют серьезные проблемы, если они не обработаны для предотвращения коррозии. Красноватый оксидный слой, который образуется на железе или стали при взаимодействии с кислородом, называется ржавчиной . Слой ржавчины постоянно отслаивается, подвергая коррозию большую часть металла, пока металл не будет проеден насквозь.
Одним из распространенных способов защиты железа является покрытие его специальной краской, которая предотвращает реакцию кислорода с металлом под краской. Другим методом является гальванизация : в этом процессе сталь покрывается цинком. Кислород, молекулы воды и углекислый газ в воздухе реагируют с цинком, образуя слой карбоната цинка, защищающий от коррозии. Осмотрите свой дом, двор и гараж на предмет коррозии, а также оцинковки и других средств защиты металла от ржавчины.
Технология: фейерверк и химия
Если вы посмотрите фейерверк на Четвертое июля, вы увидите красивые сочетания цветов и искр.
Как работает этот удивительный пиротехнический дисплей? Короткий ответ: химия. Более длинный включает в себя повторение свойств металлов.
Одним из ключевых ингредиентов петард, наземных и воздушных фейерверков (которые взрываются в небе) является черный порох , изобретенный китайцами около 1000 лет назад. Это смесь нитрата калия (селитры), древесного угля и серы в соотношении 75:15:10. Черный порох используется для запуска антенн, а также вызывает взрывы, необходимые для создания специальных эффектов, таких как шум или цветной свет.
В бенгальских огнях черный порох смешивается с металлическим порошком и другими химическими соединениями в форме, которая будет медленно гореть сверху донизу. В простых ракетах для фейерверков черный порох находится в трубке вокруг взрывателя. Когда горит, порох создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем вызывая взрыв соединений внутри него в воздухе.
Более сложные снаряды для фейерверков запускаются из миномета, трубки с черным порохом, который при поджигании вызывает реакцию отрыва. Затем взрыватель снаряда фейерверка загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда приводит к разрыву зарядов спецэффектов.
Затем взрыватель снаряда фейерверка загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда приводит к разрыву зарядов спецэффектов.
Яркая, красочная часть фейерверка вызвана «возбужденными» электронами в атомах различных соединений металлов и солей. Эти соединения находятся в маленьких шариках, называемых звездами , и сделаны из того же соединения, что и бенгальский огонь.
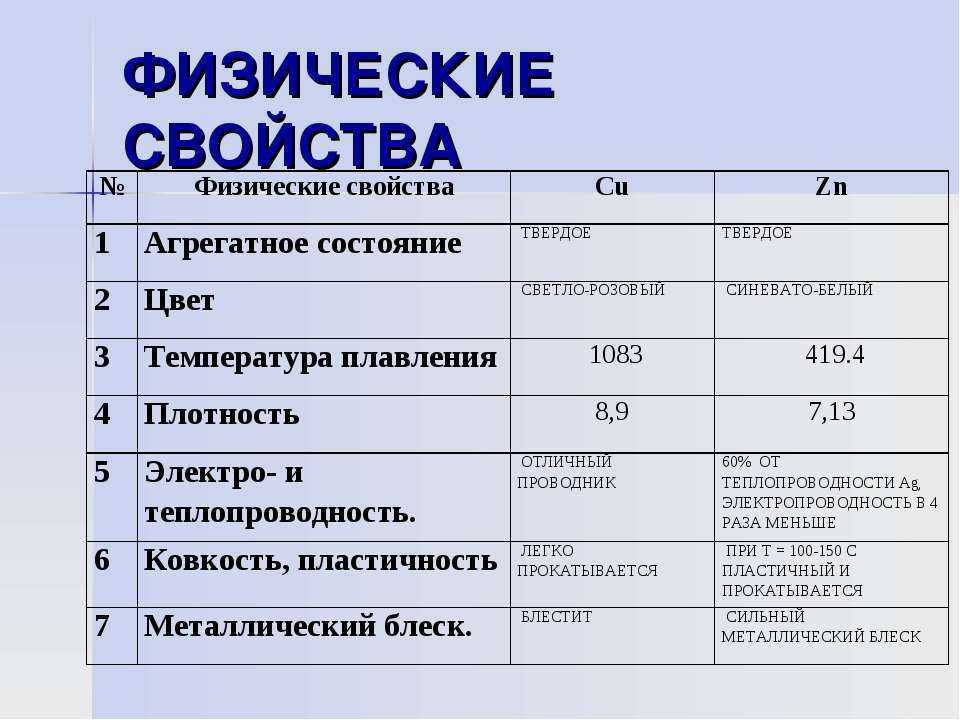
Металлы как красители
Различные металлы горят разными цветами; например, если зажечь соединение меди, его пламя будет сине-зеленого цвета. Кальций горит красным, а калий — фиолетовым. В фейерверках металлы объединяются для создания разных цветов.
Когда звездные соединения внутри фейерверка нагреваются, возбужденные атомы выделяют световую энергию. Этот свет делится на две категории: накаливания и люминесценции. Лампа накаливания — это свет, создаваемый теплом: в фейерверках химически активные металлы, такие как алюминий и магний, вызывают вспышку очень яркого света, когда они нагреваются — иногда при температуре более 5000 ° F!
Менее реакционноспособные соединения не так сильно нагреваются, что приводит к более тусклым искрам. Люминесценция , с другой стороны, производится из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они прыгают обратно на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Люминесценция , с другой стороны, производится из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они прыгают обратно на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Хлорид бария — химическое соединение, придающее фейерверкам люминесцентный зеленый цвет, а хлорид меди — синий. Для любого типа света важно использовать чистые ингредиенты, так как следы других соединений затемняют цвет.
Дальнейшее чтение по металлам:
- Спинническая проволочная скульптура
- Проекты химии науки о ярмарке
- Physics Science Project научиться описывать и сравнивать физические свойства переходных металлов.
Элементы переходных металлов можно найти в домене d-блока периодической таблицы. Они представляют собой разнообразный набор металлов, и у них есть много важных применений.
 Переходные металлы можно сравнить с элементами постпереходных металлов, потому что они твердые, блестящие и хорошо проводят тепло и электричество.
Переходные металлы можно сравнить с элементами постпереходных металлов, потому что они твердые, блестящие и хорошо проводят тепло и электричество.Различные области применения элементов из переходных металлов можно понять, если мы потратим некоторое время на изучение физических свойств отдельных переходных металлов и того, как физические свойства изменяются в блоке элементов из переходных металлов.
Определение: переходный металл
Переходный металл — это элемент, атомы которого имеют неполную d-подоболочку или который может давать катионы с неполной d-подоболочкой.
Рассмотрим сначала значения атомной массы элементов переходного металла четвертого периода. На следующем рисунке показано, что значения атомной массы обычно увеличиваются по мере перехода от скандия в левой части к меди в правой части. Никель является исключением из этой тенденции, поскольку его значение атомной массы меньше, чем значение атомной массы кобальта.
Пример 1: Выбор исключений из трендов атомной массы в свойствах переходных металлов в четвертом периоде
Тенденция увеличения атомной массы наблюдается по периодам периодической таблицы слева направо.
 Какой переходный металл четвертого периода является исключением из этой тенденции?
Какой переходный металл четвертого периода является исключением из этой тенденции?- Марганец
- Никель
- Хром
- Скандий
- Железо
Ответ
Элементы в периодической таблице упорядочены по возрастанию атомного номера. Таким образом, по мере прохождения периода 4 атомный номер увеличивается, что означает увеличение количества протонов в ядрах различных атомов. По мере того, как число протонов в ядре атома увеличивается, увеличивается и число нейтронов, вызывающих общее увеличение атомной массы по мере того, как мы перемещаемся от левой части периодической таблицы к правой.
Эта тенденция наблюдается в переходных металлах периода четыре; однако никель с относительной атомной массой 58,7 является исключением, поскольку предшествующий элемент кобальт имеет атомную массу 58,9. Следовательно, правильный ответ — ответ B.
Мы также можем рассмотреть, как меняются атомные радиусы при переходе от скандия к меди.
 Значения атомного радиуса систематически не увеличиваются и не уменьшаются по мере продвижения по ряду переходных металлов четвертого периода. Связь между значениями атомных радиусов и атомными номерами довольно сложна и может быть объяснена только в том случае, если мы рассмотрим электронные конфигурации этих элементов. На следующем рисунке используется комбинация сокращенных обозначений и односторонних стрелок, чтобы показать, как конфигурация электронов изменяется в металлических элементах с периодом четыре.
Значения атомного радиуса систематически не увеличиваются и не уменьшаются по мере продвижения по ряду переходных металлов четвертого периода. Связь между значениями атомных радиусов и атомными номерами довольно сложна и может быть объяснена только в том случае, если мы рассмотрим электронные конфигурации этих элементов. На следующем рисунке используется комбинация сокращенных обозначений и односторонних стрелок, чтобы показать, как конфигурация электронов изменяется в металлических элементах с периодом четыре.Element Electronic Configuration 4s 3d 3d 3d 3d 3d Sc [Ar]sd43 ↑↓ ↑ Ti [Ar]sd43 ↑↓ ↑ ↑ V [Ar]sd43 ↑↓ ↑ ↑ ↑ Cr [Ar]sd43 ↑ ↑ ↑ ↑ ↑ ↑ Mn [Ar]sd43 ↑↓ ↑ ↑ ↑ ↑ ↑ Fe [Ar]sd43 ↑↓ ↑↓ ↑ ↑ ↑ ↑ Co [Ar]sd43 ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ Ni [Ar]sd43 ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ Cu [Ar]sd43 ↑ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↓ Вначале радиус начинает уменьшаться по мере увеличения заряда ядра.
 Заряд ядра увеличивается из-за увеличения числа протонов в ядре атома. Дополнительные электроны продолжают заполнять 3d-орбиталь и притягиваются ближе к ядру.
Заряд ядра увеличивается из-за увеличения числа протонов в ядре атома. Дополнительные электроны продолжают заполнять 3d-орбиталь и притягиваются ближе к ядру.Однако по мере того, как мы переходим к хрому, увеличение числа электронов на 3d-орбитали создает достаточное отталкивание между электронами, чтобы остановить уменьшение атомных радиусов, а значения атомных радиусов остаются практически постоянными от хрома до меди.
Плотность связана с массой объекта и его объемом, и при движении слева направо по периоду 4 масса атома увеличивается. С точки зрения атомного радиуса, как мы уже говорили, радиус уменьшается, но неравномерно. В сочетании эти две общие тенденции создают тенденцию к увеличению плотности по мере продвижения по периоду 4, как это видно на графике ниже.
Здесь стоит отметить, что переходные металлы обычно имеют более высокую плотность, чем металлы s-блока того же периода. Калий и кальций являются металлами четвертого периода, но не переходными металлами.
 Калий и кальций имеют значения плотности всего 0,89 г/см 3 и 1,54 г/см 3 .
Калий и кальций имеют значения плотности всего 0,89 г/см 3 и 1,54 г/см 3 .Пример 2. Сравнение плотностей ванадия и меди
Какое из следующих утверждений о сравнении двух элементов d-блока верно?
- Ванадий плотнее меди, но имеет меньший атомный радиус.
- Ванадий менее плотный, чем медь, но имеет больший атомный радиус.
- Ванадий плотнее меди и имеет больший атомный радиус.
- Ванадий менее плотный, чем медь, и имеет меньший атомный радиус.
Ответ
Хотя тенденции в физических свойствах переходных металлов в период 4 не всегда очевидны или полностью совпадают для всех различных элементов, можно увидеть тонкие различия.
Например, при переходе от скандия к меди плотность различных металлов увеличивается; однако в то же время атомный радиус уменьшается в размерах, отчасти из-за увеличения заряда ядра.
Объединив эти две тенденции, мы можем определить ответ B как правильный ответ, поскольку ванадий менее плотный, чем медь, у которой атомный радиус больше.

По-видимому, не существует какой-либо четкой общей тенденции или закономерности между точками плавления и атомными номерами для элементов переходных металлов периода четыре. Это можно увидеть на следующем рисунке.
Однако одно окончательное утверждение, которое мы можем сделать, относится к металлам s-блока периода 4. Калий имеет температуру плавления 336,5 К, а кальций имеет температуру плавления 1 115 К, поэтому переходные металлы периода 4 имеют более высокие температуры плавления, чем соответствующие металлы s-блока. Металлическая связь связана с температурой плавления, что указывает на то, что переходные металлы периода 4 имеют более прочные металлические связи, чем калий и кальций.
Пример 3: Сравнение температур плавления переходных металлов и металлов s-блока
Элемент s-блока кальций имеет физические свойства, отличные от соседних переходных металлов того же периода.
- Заполните следующее: Температура плавления кальция выше, чем у хрома.

- выше
- ниже
- Какое из следующих утверждений объясняет эту разницу в температуре плавления?
- Кальций имеет более низкую температуру плавления, так как у него меньше электронов и поэтому между спаренными электронами существует меньшее внутреннее отталкивание.
- Хром имеет более низкую температуру плавления из-за более слабой металлической связи из-за экранирования ядра 3d-электронами.
- Кальций имеет более высокую температуру плавления, так как его большая плотность приводит к более прочной металлической связи.
- Хром имеет более высокую температуру плавления, поскольку электроны с 3d-орбитали могут делокализоваться и способствовать более прочной металлической связи.
Ответ
Часть 1
Во-первых, путем припоминания фактов или использования источника данных мы можем определить, что точка плавления кальция ниже, чем точка плавления хрома. Следовательно, ответ на первую часть этого вопроса — Б.

Причина такой низкой температуры плавления описана во второй части.
Часть 2
При переходе от блока s периода 4 к блоку d мы начинаем заполнять 3d-орбиталь. Когда эти орбитали начинают заполняться, становится доступным больше электронов для участия в металлических связях, и взаимодействия этих электронов создают более сильную силу притяжения между ионами переходных металлов и морем делокализованных электронов.
Более прочная металлическая связь связана с более высокой температурой плавления. Мы ожидаем, что хром будет иметь более высокую температуру плавления, чем кальций, потому что он содержит 3d-орбитальные электроны, которые могут сделать металлическую связь более прочной. Это объяснение кратко изложено в варианте D, правильном ответе.
Мы можем классифицировать переходные металлы с точки зрения их магнитных свойств. Одни металлы парамагнитны, другие диамагнитны. Атом, ион или молекула считаются парамагнитными, если они содержат атомы с неспаренными электронами.
 Эти неспаренные электроны обладают магнитным дипольным моментом и действуют как крошечные магниты, потому что притягиваются к приложенным извне магнитным полям. Величина магнитного момента в парамагнитном веществе имеет тенденцию быть больше, если вещество имеет большее количество неспаренных электронов.
Эти неспаренные электроны обладают магнитным дипольным моментом и действуют как крошечные магниты, потому что притягиваются к приложенным извне магнитным полям. Величина магнитного момента в парамагнитном веществе имеет тенденцию быть больше, если вещество имеет большее количество неспаренных электронов.Диамагнетик не имеет общего магнитного момента, потому что все его орбитали заполнены спаренными электронами. Диамагнетики почти всегда отталкивают приложенные извне магнитные поля.
Электронная конфигурация атомов, ионов и молекул обычно может использоваться для определения того, являются ли вещества диамагнитными или парамагнитными. На примере ванадия атомы ванадия имеют электронную конфигурацию [Ar]ds34. Член 3d показывает, что ванадий имеет по крайней мере один неспаренный электрон, и этот факт можно использовать для определения того, что ванадий является парамагнитным материалом.
Элементы и сплавы никеля, железа и кобальта проявляют довольно интересный тип магнетизма, известный как ферромагнетизм.
 Ферромагнетизм — это основной механизм, с помощью которого определенные материалы образуют постоянные магниты. Элементы и сплавы никеля, железа и кобальта проявляют ферромагнетизм из-за своей необычной структуры.
Ферромагнетизм — это основной механизм, с помощью которого определенные материалы образуют постоянные магниты. Элементы и сплавы никеля, железа и кобальта проявляют ферромагнетизм из-за своей необычной структуры.Пример 4: Идентификация ферромагнитных ионов
Что из следующего является ферромагнитным?
- Fe2+
- V3+
- Mn2+
- Cu2+
- Ti2+
Ответ
Ферромагнетизм относится к способности элемента образовывать постоянный магнит. Это свойство не часто встречается в элементах периодической таблицы. Элементы и сплавы железа, никеля и кобальта могут быть ферромагнитными. Сплавы некоторых редкоземельных металлов также могут быть ферромагнитными. Железо указано как вариант А. Мы можем использовать эти утверждения, чтобы определить, что вариант А является правильным ответом на этот вопрос.
Переходные металлы периода 4 имеют совершенно разные взаимодействия с другими веществами и очень разную химическую активность.
 Медь имеет удивительно низкую скорость реакции с большинством газообразных молекул, в то время как железо имеет тенденцию ржаветь, когда его оставляют на открытом воздухе, где оно может взаимодействовать с молекулами кислорода и воды в воздухе. Другие металлы, такие как скандий, могут бурно реагировать с водой, если они разделены на мелкие частицы. Металлический скандий имеет тенденцию образовывать гидроксид-ионы (ОН), поскольку он замещает атомы водорода в молекулах воды:
Медь имеет удивительно низкую скорость реакции с большинством газообразных молекул, в то время как железо имеет тенденцию ржаветь, когда его оставляют на открытом воздухе, где оно может взаимодействовать с молекулами кислорода и воды в воздухе. Другие металлы, такие как скандий, могут бурно реагировать с водой, если они разделены на мелкие частицы. Металлический скандий имеет тенденцию образовывать гидроксид-ионы (ОН), поскольку он замещает атомы водорода в молекулах воды:
2Sc()+6HO()2Sc(OH)()+3H()slaqg232Использование переходных металлов более подробно обсуждается в другом объяснении, но, тем не менее, здесь важно отметить, что многие переходные металлы используются в промышленности из-за их каталитической активности.
Мелкоизмельченный металлический никель используется в качестве катализатора для производства маргарина посредством процессов гидрогенизации. Разделенное железо используется в качестве катализатора для улучшения процесса Габера-Боша, который представляет собой процесс искусственной фиксации азота и основной промышленный процесс производства аммиака.
Реакция: образование аммиака в процессе Габера–Боша
N()+3H()2NH()223gggFe/MocatalystC,atm∘ соединение переходного металла, которое можно использовать в качестве катализатора для увеличения производства серной кислоты в контактном процессе:
2SO()+O()2SO()HSO()+SO()HSO()HSO()+HO()2HSO()223243227227224ggglgllllVOC25∘Наконец, диоксид марганца можно использовать для катализа разложения водорода. перекись:
перекись водородавода+кислород2HO()2HO()+O()MnOMnO222222llgХимия, объясняющая каталитическую активность элементов переходных металлов и соединений элементов переходных металлов, сложна. Однако большую часть каталитической активности можно объяснить наличием 4s- и 3d-электронов и тем фактом, что они позволяют реакциям протекать по различным химическим путям. Альтернативные пути могут включать, например, образование промежуточных комплексных ионов или образование комплексов молекул реагентов, которые адсорбируются на поверхности катализатора.
Переходные элементы обычно образуют красочные соединения.
 Цвета возникают в результате поглощения определенных длин волн белого света переходным металлом и его соединением. Это поглощение приводит к тому, что только некоторые длины волн белого света проходят через раствор.
Цвета возникают в результате поглощения определенных длин волн белого света переходным металлом и его соединением. Это поглощение приводит к тому, что только некоторые длины волн белого света проходят через раствор.При растворении кристаллов гидратированного сульфата меди(II) в воде образуется комплексный ион [Cu(HO)]262+. Этот ион имеет тенденцию поглощать как красные, так и оранжевые длины волн, как видно на диаграмме ниже.
Цветовой круг ниже показывает отношение между длинами волн света, поглощаемого различными катионами, и соответствующим цветом, который они воспринимают человеческим глазом. Когда красный и оранжевый свет поглощаются, человеческий глаз наблюдает противоположные цвета на колесе, и поэтому раствор кажется синим. Энергия света поглощается электронами в ионах с частично заполненными d-орбиталями.
Ключевые моменты
- Атомная масса переходных металлов 4-го периода увеличивается от группы 3 к группе 11, за исключением никеля.
- Атомный радиус переходных металлов 4-го периода сначала уменьшается, а затем остается практически постоянным от хрома до меди.