Свойства меди свойства железа: Сходство и различия меди и железа
Содержание
Занятие 6. В. Лечебные свойства минералов: медь, железо, алюминий, натрий, калий, магний, кобальт.
- Опубликовано: 21.02.2020 07:30
Медь любят все – и животные и растения. При недостатке меди в почве растения заболевают, листья быстро увядают, появляются плесневые грибы. Введение медный удобрений (медный купорос) излечивает растения. Много меди в какао, миндале, пшеничных отрубях, горохе. Наиболее богаты медью грибы шампиньоны, чайный куст. Медь содержится в организме животных. Морские животные конденсируют медь из морской воды. У устриц высокое содержание меди, в их крови меди в двести раз больше, чем у человека. У человека «депо» меди – печень. В больших дозах медь является ядом. От паров меди заболевают литейщики, прокатчики, работники сельского хозяйства. Больше всего меди содержится в сердце, печени, мозге и почках, однако в небольших количествах, она есть во всем организме. Организм использует медь в процессе обмена веществ. Медь входит в состав многих ферментов и поэтому необходима для поддержания в здоровом состоянии сердца, костей, нервов, мозга и эритроцитов. Медь помогает извлекать энергию из белков, углеводов и жиров и производить простагландины – вещества, похожие на гормоны. Простагландины же, в свою очередь, регулируют артериальное давление, ритм сердцебиения и способствуют быстрейшему заживлению ран. Медь является частью ферментов, которые охраняют клетки от окисления. Поэтому медь помогает организму бороться с раком, сердечными заболеваниями и старением. Она необходима и для укрепления костей. Нехватка меди в организме может привести к сердечным заболеваниям, повышенному давлению, деформации костей, депрессии, утомлению, слабости, анемии, диарее, сколиозу, затрудненному дыханию, заражению инфекциями и заболеваниям крови и, кроме того, нанести вред кровеносным сосудам и коже. Медь содержать отдельные крупы, зерновой хлеб, орехи, субпродукты, листовые овощи, домашняя птица, горох и бобы. В обычной медицине медь практически не применяется, хотя было отмечено, что рабочие медных производств не заболевали холерой.
Медь входит в состав многих ферментов и поэтому необходима для поддержания в здоровом состоянии сердца, костей, нервов, мозга и эритроцитов. Медь помогает извлекать энергию из белков, углеводов и жиров и производить простагландины – вещества, похожие на гормоны. Простагландины же, в свою очередь, регулируют артериальное давление, ритм сердцебиения и способствуют быстрейшему заживлению ран. Медь является частью ферментов, которые охраняют клетки от окисления. Поэтому медь помогает организму бороться с раком, сердечными заболеваниями и старением. Она необходима и для укрепления костей. Нехватка меди в организме может привести к сердечным заболеваниям, повышенному давлению, деформации костей, депрессии, утомлению, слабости, анемии, диарее, сколиозу, затрудненному дыханию, заражению инфекциями и заболеваниям крови и, кроме того, нанести вред кровеносным сосудам и коже. Медь содержать отдельные крупы, зерновой хлеб, орехи, субпродукты, листовые овощи, домашняя птица, горох и бобы. В обычной медицине медь практически не применяется, хотя было отмечено, что рабочие медных производств не заболевали холерой.
Железо. Больше всего железа в болотистых водах. Их даже используют при анемиях. Например, приписывают «Полюстрово». Без окислов железа невозможна жизнь растений, любого живого организма, но в растениях железо не накапливается. Больше других содержит железо мхи, сине-зеленые водоросли. Железо ежедневно выводится из организма, поэтому и должно поступать с пище ежедневно. При анемии, особенно у беременных, — возьмите антоновское яблоко и воткните в него сильно заржавевшие гвозди. Оставьте на сутки, после чего гвозди выньте, а яблоко съешьте. Съедать по 2 яблока в течение 2 недель. Официальная медицина также использует железо в качестве лекарственного средства. Препараты железа назначаются внутрь при снижении гемоглобина в крови – это соли железа (сульфат, лактат, карбонат, хлорид, восстановленное железо) и гематоген. Гематоген эффективно действует на детей со склонностью к кровотечениям, к простудам, а также для профилактики анемии – он подходит и взрослым, и детям.
Алюминий – вовсе не простой элемент. Металл, распространенность в земной коре высокая – 8%. Алюмосиликаты (соединение кремния и алюминия) – полевые шпаты – называют краеугольными камнями земной коры. Особенно богаты алюминием тропические почвы и месторождения глины. Некоторые растения – концентраторы – накапливают более 10 % алюминия. Богаты алюминием плауны, лишайники, чаи, молочай, багульник, рододендрон. В живом организме алюминий содержится во всех клетках, всех тканях и органах, и больше всего в мозге. Квасцы – белый порошок растворяют в воде и используют для примочек, полоскания, глазных капель. Еще одна форма выпуска – кровоостанавливающий карандаш, который применяют при мелких порезах и ссадинах после бритья. Квасцы жженые используют для присыпок при потливости ног.
Натрий – это типичный металл, но в малых количествах он необходим все живым организмам. Натрий – очень активный элемент и в химических реакциях, и живом организме. Он активно вступает в различные соединения, в организме проникает внутрь клетки, обеспечивая водно-солевой обмен. Его нарушения относятся к числу из самых тяжелых. Большинство народов поклонялись соли как символу самой жизни, вечности и постоянства, благополучия и мира. Поваренную соль добывают разными способами: подземным – каменную соль, открытым – озерную соль, выпариванием на солнце из морской воды – бассейновую соль. Во всех случаях соль непременно содержит примеси. Для человека полезна соль, содержащая микроэлементы. Наиболее полезная соль – морская, благодаря тому, что у нее наиболее естественное сочетание химических элементов, близких по составу к биологическим жидкостям человека. В числе прочего, она обладает антитоксическими свойствами. Обычно человек получает достаточное количество соли с пищей, но при больших потерях натрия с потом (у рабочих горячих цехов) наблюдаются колики, судороги, нарушение кровообращения, слабость, снижение давления, может быть обморок. Для питья рабочим дается соленая вода.
Он активно вступает в различные соединения, в организме проникает внутрь клетки, обеспечивая водно-солевой обмен. Его нарушения относятся к числу из самых тяжелых. Большинство народов поклонялись соли как символу самой жизни, вечности и постоянства, благополучия и мира. Поваренную соль добывают разными способами: подземным – каменную соль, открытым – озерную соль, выпариванием на солнце из морской воды – бассейновую соль. Во всех случаях соль непременно содержит примеси. Для человека полезна соль, содержащая микроэлементы. Наиболее полезная соль – морская, благодаря тому, что у нее наиболее естественное сочетание химических элементов, близких по составу к биологическим жидкостям человека. В числе прочего, она обладает антитоксическими свойствами. Обычно человек получает достаточное количество соли с пищей, но при больших потерях натрия с потом (у рабочих горячих цехов) наблюдаются колики, судороги, нарушение кровообращения, слабость, снижение давления, может быть обморок. Для питья рабочим дается соленая вода. В медицине применяется хлористый натрий в виде раствора для внутривенного введения и гипертонический раствор для очищения ран.
В медицине применяется хлористый натрий в виде раствора для внутривенного введения и гипертонический раствор для очищения ран.
Калий необходим для питания растений, при его недостатке рост приостанавливается, растения поражаются грибками, не происходит образования семян и рано опадают листья. В молодых листьях накапливается калий, а затем он заменяется на кальций. В большом количестве калий содержится в зеленых листьях салата, шпината, бананах, апельсинах, петрушке, цветной капусте, сливе. В организме человека калий является необходимым элементом, находится во всех клетках и участвует во всех видах обмена. В медицине применяют препараты калия – в виде солей и других соединений. Чаще других используется панангин.
Магний. В земной коре 1,8% магния, он образует 191 минерал. Особенно много магния в морской воде; если его количество в воде увеличивается, вода становится жесткой. В растительном мире магний играет важную роль – входит в состав хлорофилла. Без магния не может быть ни зеленых растений, ни питающихся ими животных. Особенно много магния содержат зеленые водоросли. В организме человека магний входит в состав всех клеток и тканой, поступает в организм с водой, солью, растительной пищей (листья). Магний относится к группе костных элементов. Он контролирует работу митохондрий – главных энергетических станций организма. Он, как невидимый кочегар, пережигает все ненужное и следит за работой электростанции, но стоит ему отлучиться – и работа всего организма сорвана. При стрессе повышается потребность в энергии и магнии. У детей-искусственников возникает дефицит магния в крови, могут быть судороги. Несмотря на то что его в коровьем молоке в 4 раза больше, чем в женском, усвоение идет труднее. Обеднение крови магнием у детей отмечено и при рахите. В медицине применяются сульфаты магния или английская соль в качестве слабительного и в виде инъекций при гипертонической болезни, судорогах. Изучается как средство для лечения предраковых заболеваний кожи и предупреждения развития злокачественных новообразований.
Без магния не может быть ни зеленых растений, ни питающихся ими животных. Особенно много магния содержат зеленые водоросли. В организме человека магний входит в состав всех клеток и тканой, поступает в организм с водой, солью, растительной пищей (листья). Магний относится к группе костных элементов. Он контролирует работу митохондрий – главных энергетических станций организма. Он, как невидимый кочегар, пережигает все ненужное и следит за работой электростанции, но стоит ему отлучиться – и работа всего организма сорвана. При стрессе повышается потребность в энергии и магнии. У детей-искусственников возникает дефицит магния в крови, могут быть судороги. Несмотря на то что его в коровьем молоке в 4 раза больше, чем в женском, усвоение идет труднее. Обеднение крови магнием у детей отмечено и при рахите. В медицине применяются сульфаты магния или английская соль в качестве слабительного и в виде инъекций при гипертонической болезни, судорогах. Изучается как средство для лечения предраковых заболеваний кожи и предупреждения развития злокачественных новообразований.
Кобальт не распространен в природе широко, им богаты почвы влажных тропиков. Кобальт обнаружен во всех растениях, особенно его много в красном перце, щавеле, редьке, зеленом луке, свекле. Он найден в организме морских и наземных животных и человека. Обнаружен в печени, крови, поджелудочной железе, почках, мозге и других органов. Кобальт входит в состав витамина В12 и необходим каждому организму, это важный биоэлемент. Кобальт содержится в витамине В12 и используется для лечения тяжелых анемий, невралгий, остеоартрозов и остеопорозов.
Хром, железо и медь, подготовка к ЕГЭ по химии
Хром
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим
разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.
Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные,
У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные,
+6 — кислотные.
В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит
Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из
его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3 + Cr
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 —
происходит пассивирование. Реагирует с неметаллами при нагревании.
Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3
Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑
Cr + H2SO4(разб.) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III),
реагирует с кислотами, кислотными оксидами.
CrO + O2 = Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами,
кислотными оксидами.
Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Cr(OH)2 + SO3 = CrSO4 + H2O
Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).
К ним относятся оксид хрома (III) гидроксид хрома (III).
Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + Ba(OH)2 → (t°) Ba(CrO2)2 + H2O (прокаливание, хромит бария)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr+3)
Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в
растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают
Хроматы окрашивают
раствор в желтый цвет, а дихроматы — в оранжевый цвет.
Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» :)
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит
Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается
бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- Реакции с солями
- Восстановительные свойства
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t
Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов
FeO*Fe2O3)
При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
Fe + Cl2 = (t) FeCl3
Fe + P = (t) FeP
Fe + C = (t) Fe3C
Fe + Si = (t) FeSi
Железо активнее водорода, способно вытеснить его из кислот.
Fe + HCl = FeCl2 + H2↑
На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными
серной и азотной кислотами.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.
Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Железо способно восстанавливать соединения железа +3 до +2.
Fe + Fe2O3 = (t) FeO
Fe + FeCl3 = (t) FeCl2
Соединения железа (II) проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа (II)
распадается на соответствующий оксид и воду.
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + HCl = FeCl2 + H2O
Fe(OH)2 = (t) FeO + H2O
При хранении на открытом воздухе соли железа (II) приобретают коричневый цвет из-за окисления до железа +3.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] —
гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании
легко распадается на воду и соответствующий оксид.
Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6].
В результате реакции образуется берлинская лазурь (прусский синий).
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко
красного цвета.
FeCl3 + KCNS = Fe(CNS)3 + KCl
И еще одна качественная реакция на ионы Fe3+ — взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными
окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3
в щелочи.
Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O
Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит
Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди
более активными металлами, например — железом.
CuSO4 + Fe = Cu + FeSO4
Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С оксидами неметаллов
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)
Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной
С разбавленной серной не реагирует, с разбавленной азотной
— реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
Соединения меди (I) можно получить путем восстановления соединений меди (II).
CuCl2 + Cu = CuCl
CuO + Cu = Cu2O
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2O + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди (I) окисляется кислородом до оксида меди (II).
Cu2O + O2 = (t) CuO
Оксид меди (I) вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2.
Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
CuO + H2SO4 = CuSO4 + H2O
CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
CuO + CO = Cu + CO2
CuO + C = Cu + CO
CuO + H2 = Cu + H2O
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.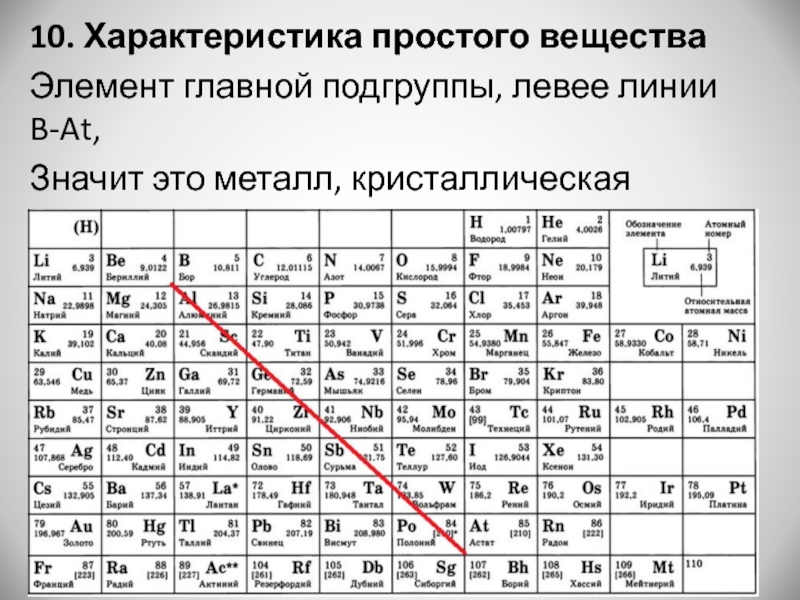
CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства.
В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди (II) — (CuOH)2CO3)
Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
CuSO4 + Na2CO3 + H2O = (CuOH)2CO3 + Na2SO4 + CO2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Железо и медь — Сравнение — Свойства
В этой статье проводится сравнение основных тепловых и атомных свойств железа и меди, двух сопоставимых химических элементов из периодической таблицы. Он также содержит основные описания и применения обоих элементов. Железо против меди.
Железо против меди.
Сравните железо с другим элементом
Сравните медь с другим элементом
Железо и медь – об элементах
Железо
Железо — металл первого переходного ряда. По массе это самый распространенный элемент на Земле, образующий большую часть внешнего и внутреннего ядра Земли. Это четвертый по распространенности элемент в земной коре. Его изобилие на скалистых планетах, таких как Земля, связано с его обильным образованием в результате синтеза звезд большой массы.
Медь
Медь — мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов, таких как стерлинговое серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морского оборудования и монет, и константан, используемый в тензодатчиках и термопарах.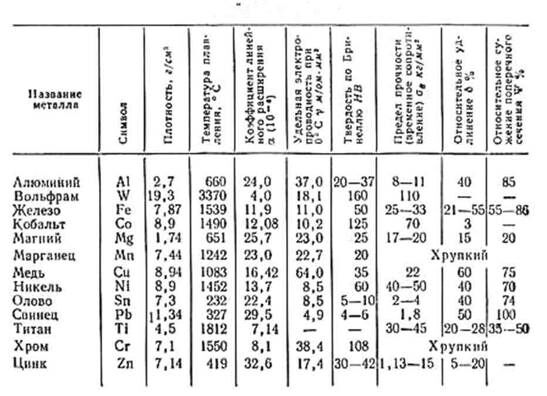 для измерения температуры.
для измерения температуры.
Источник: www.luciteria.com
Железо и медь – Применение
Железо
Железо используется во многих отраслях, таких как электроника, производство, автомобилестроение, строительство и строительство. Железо является наиболее широко используемым из всех металлов, на его долю приходится более 90% мирового производства металлов. Его низкая стоимость и высокая прочность часто делают его предпочтительным материалом для противостояния нагрузкам или передачи сил, например, для изготовления машин и станков, рельсов, автомобилей, корпусов кораблей, бетонных арматурных стержней и несущих конструкций зданий. . Поскольку чистое железо довольно мягкое, его чаще всего комбинируют с легирующими элементами для изготовления стали. Стали представляют собой сплавы железа с углеродом, которые могут содержать заметные концентрации других легирующих элементов. Добавление небольшого количества неметаллического углерода к железу меняет его большую пластичность на большую прочность. Из-за своей очень высокой прочности, но все же значительной ударной вязкости, а также способности сильно изменяться при термической обработке сталь является одним из наиболее полезных и распространенных сплавов железа в современном использовании. Существуют тысячи сплавов с различным составом и/или термической обработкой. Механические свойства чувствительны к содержанию углерода, которое обычно составляет менее 1,0 мас.%.
Из-за своей очень высокой прочности, но все же значительной ударной вязкости, а также способности сильно изменяться при термической обработке сталь является одним из наиболее полезных и распространенных сплавов железа в современном использовании. Существуют тысячи сплавов с различным составом и/или термической обработкой. Механические свойства чувствительны к содержанию углерода, которое обычно составляет менее 1,0 мас.%.
Медь
Исторически сложилось так, что сплав меди с другим металлом, например оловом, для получения бронзы впервые начали практиковать примерно через 4000 лет после открытия плавки меди и примерно через 2000 лет после того, как «природная бронза» стала широко использоваться. Древняя цивилизация находится в бронзовом веке либо путем производства бронзы путем выплавки собственной меди и сплавления с оловом, мышьяком или другими металлами. Основными областями применения меди являются электрические провода (60%), кровля и водопровод (20%), а также промышленное оборудование (15%). Медь используется в основном в чистом виде, но когда требуется большая твердость, ее вводят в такие сплавы, как латунь и бронза (5% от общего использования). Медь и сплавы на ее основе, включая латуни (Cu-Zn) и бронзы (Cu-Sn), широко используются в различных промышленных и общественных целях. Некоторые из распространенных применений латунных сплавов включают бижутерию, замки, петли, шестерни, подшипники, гильзы для боеприпасов, автомобильные радиаторы, музыкальные инструменты, электронную упаковку и монеты. Бронза или бронзоподобные сплавы и смеси использовались для изготовления монет в течение более длительного периода. до сих пор широко используется для пружин, подшипников, втулок, направляющих подшипников автомобильных трансмиссий и аналогичных фитингов, и особенно распространен в подшипниках небольших электродвигателей. Латунь и бронза являются распространенными конструкционными материалами в современной архитектуре и в основном используются для кровли и облицовки фасадов из-за их внешнего вида.
Медь используется в основном в чистом виде, но когда требуется большая твердость, ее вводят в такие сплавы, как латунь и бронза (5% от общего использования). Медь и сплавы на ее основе, включая латуни (Cu-Zn) и бронзы (Cu-Sn), широко используются в различных промышленных и общественных целях. Некоторые из распространенных применений латунных сплавов включают бижутерию, замки, петли, шестерни, подшипники, гильзы для боеприпасов, автомобильные радиаторы, музыкальные инструменты, электронную упаковку и монеты. Бронза или бронзоподобные сплавы и смеси использовались для изготовления монет в течение более длительного периода. до сих пор широко используется для пружин, подшипников, втулок, направляющих подшипников автомобильных трансмиссий и аналогичных фитингов, и особенно распространен в подшипниках небольших электродвигателей. Латунь и бронза являются распространенными конструкционными материалами в современной архитектуре и в основном используются для кровли и облицовки фасадов из-за их внешнего вида.
Железо и медь – сравнение в таблице
| Элемент | Железо | Медь |
| Плотность | 7,874 г/см3 | 8,92 г/см3 |
| Предел прочности при растяжении | 540 МПа | 210 МПа |
| Предел текучести | 50 МПа | 33 МПа |
| Модуль упругости Юнга | 211 ГПа | 120 ГПа |
| Шкала Мооса | 4,5 | 3 |
| Твердость по Бринеллю | 490 МПа | 250 МПа |
| Твердость по Виккерсу | 608 МПа | 350 МПа |
| Точка плавления | 1538 °С | 1084,62 °С |
| Точка кипения | 2861 °С | 2562 °С |
| Теплопроводность | 80,2 Вт/мК | 401 Вт/мК |
| Коэффициент теплового расширения | 11,8 мкм/мК | 16,5 мкм/мК |
| Удельная теплоемкость | 0,44 Дж/г К | 0,38 Дж/г К |
| Теплота плавления | 13,8 кДж/моль | 13,05 кДж/моль |
| Теплота испарения | 349,6 кДж/моль | 300,3 кДж/моль |
Сравнение элементов периодической таблицы | Сравните железо и медь
Сравните железо и медь
Сравните железо и медь на основе их свойств, атрибутов и фактов из периодической таблицы. Сравните элементы по более чем 90 свойствам. Все элементы подобных категорий обнаруживают много сходств и различий в своих химических, атомных, физических свойствах и использовании. Эти сходства и различия следует знать, изучая элементы таблицы Менделеева. Вы можете изучить подробное сравнение между железом и медью с наиболее надежной информацией об их свойствах, атрибутах, фактах, использовании и т. д. Вы можете сравнить Fe и Cu более чем по 90 такие свойства, как электроотрицательность, степень окисления, атомные оболочки, орбитальная структура, электросродство, физические состояния, электрическая проводимость и многое другое.
Сравните элементы по более чем 90 свойствам. Все элементы подобных категорий обнаруживают много сходств и различий в своих химических, атомных, физических свойствах и использовании. Эти сходства и различия следует знать, изучая элементы таблицы Менделеева. Вы можете изучить подробное сравнение между железом и медью с наиболее надежной информацией об их свойствах, атрибутах, фактах, использовании и т. д. Вы можете сравнить Fe и Cu более чем по 90 такие свойства, как электроотрицательность, степень окисления, атомные оболочки, орбитальная структура, электросродство, физические состояния, электрическая проводимость и многое другое.
26 Fe Iron
Swap Copper vs Iron
Periodic Table Element Comparison
29 Cu Copper
Facts
| Name | Iron | Copper | |||
| Atomic Number | 26 | 29 | |||
| Атомный символ | Fe | Cu | |||
| Atomic Weight | 55. 845 845 | 63.546 | |||
| Phase at STP | Solid | Solid | |||
| Color | Gray | Copper | |||
| Metallic Classification | Переходный металл | Переходный металл | |||
| Группа в периодической таблице | группа 8 | группа 11 | |||
| Название группы | iron family | copper family | |||
| Period in Periodic Table | period 4 | period 4 | |||
| Block in Periodic Table | d -block | d -block | |||
| Electronic Configuration | [Ar] 3d6 4s2 | [Ar] 3d10 4s1 | |||
| Структура электронной оболочки (электронов на оболочку) | 2, 8, 14, 2 | 2, 8, 18, 50 1 | 2 90 Точка плавления0052 | 1811 K | 1357.77 K |
| Boiling Point | 3134 K | 3200 K | |||
| CAS Number | CAS7439-89-6 | CAS7440-50-8 | |||
| Neighborhood Elements | Соседние Элементы Железа | Соседние Элементы Меди |
История
| История | Элемент Железо был открыт Неизвестно в 500 году до н. -7 %) -7 %)
Crystal Structure and Atomic Structure
Atomic and Orbital Properties
ARGETALES 4.SRELES 4.SIRLERIS 4. ARIT ARCETALE ARISTALE ARISTALIE 9001. стабильные природные изотопы.
Chemical Properties: Ionization Energies and electron affinity
Physical Properties
Thermal Properties — Enthalpies and thermodynamics
Нормативно-правовое регулирование и здоровье – Параметры и рекомендации по охране здоровья и безопасности
Сравнить с другими элементами
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 0052
0052 546
546
 5 kJ/mol
5 kJ/mol 874 g/cm3
874 g/cm3 K
K 77 K
77 K 0052
0052