Свойства меди свойства железа: Сходство и различия меди и железа
Содержание
Занятие 6. В. Лечебные свойства минералов: медь, железо, алюминий, натрий, калий, магний, кобальт.
- Опубликовано: 21.02.2020 07:30
Медь любят все – и животные и растения. При недостатке меди в почве растения заболевают, листья быстро увядают, появляются плесневые грибы. Введение медный удобрений (медный купорос) излечивает растения. Много меди в какао, миндале, пшеничных отрубях, горохе. Наиболее богаты медью грибы шампиньоны, чайный куст. Медь содержится в организме животных. Морские животные конденсируют медь из морской воды. У устриц высокое содержание меди, в их крови меди в двести раз больше, чем у человека. У человека «депо» меди – печень. В больших дозах медь является ядом. От паров меди заболевают литейщики, прокатчики, работники сельского хозяйства. Больше всего меди содержится в сердце, печени, мозге и почках, однако в небольших количествах, она есть во всем организме. Организм использует медь в процессе обмена веществ. Медь входит в состав многих ферментов и поэтому необходима для поддержания в здоровом состоянии сердца, костей, нервов, мозга и эритроцитов. Медь помогает извлекать энергию из белков, углеводов и жиров и производить простагландины – вещества, похожие на гормоны. Простагландины же, в свою очередь, регулируют артериальное давление, ритм сердцебиения и способствуют быстрейшему заживлению ран. Медь является частью ферментов, которые охраняют клетки от окисления. Поэтому медь помогает организму бороться с раком, сердечными заболеваниями и старением. Она необходима и для укрепления костей. Нехватка меди в организме может привести к сердечным заболеваниям, повышенному давлению, деформации костей, депрессии, утомлению, слабости, анемии, диарее, сколиозу, затрудненному дыханию, заражению инфекциями и заболеваниям крови и, кроме того, нанести вред кровеносным сосудам и коже. Медь содержать отдельные крупы, зерновой хлеб, орехи, субпродукты, листовые овощи, домашняя птица, горох и бобы. В обычной медицине медь практически не применяется, хотя было отмечено, что рабочие медных производств не заболевали холерой.
Медь входит в состав многих ферментов и поэтому необходима для поддержания в здоровом состоянии сердца, костей, нервов, мозга и эритроцитов. Медь помогает извлекать энергию из белков, углеводов и жиров и производить простагландины – вещества, похожие на гормоны. Простагландины же, в свою очередь, регулируют артериальное давление, ритм сердцебиения и способствуют быстрейшему заживлению ран. Медь является частью ферментов, которые охраняют клетки от окисления. Поэтому медь помогает организму бороться с раком, сердечными заболеваниями и старением. Она необходима и для укрепления костей. Нехватка меди в организме может привести к сердечным заболеваниям, повышенному давлению, деформации костей, депрессии, утомлению, слабости, анемии, диарее, сколиозу, затрудненному дыханию, заражению инфекциями и заболеваниям крови и, кроме того, нанести вред кровеносным сосудам и коже. Медь содержать отдельные крупы, зерновой хлеб, орехи, субпродукты, листовые овощи, домашняя птица, горох и бобы. В обычной медицине медь практически не применяется, хотя было отмечено, что рабочие медных производств не заболевали холерой.
Железо. Больше всего железа в болотистых водах. Их даже используют при анемиях. Например, приписывают «Полюстрово». Без окислов железа невозможна жизнь растений, любого живого организма, но в растениях железо не накапливается. Больше других содержит железо мхи, сине-зеленые водоросли. Железо ежедневно выводится из организма, поэтому и должно поступать с пище ежедневно. При анемии, особенно у беременных, — возьмите антоновское яблоко и воткните в него сильно заржавевшие гвозди. Оставьте на сутки, после чего гвозди выньте, а яблоко съешьте. Съедать по 2 яблока в течение 2 недель. Официальная медицина также использует железо в качестве лекарственного средства. Препараты железа назначаются внутрь при снижении гемоглобина в крови – это соли железа (сульфат, лактат, карбонат, хлорид, восстановленное железо) и гематоген. Гематоген эффективно действует на детей со склонностью к кровотечениям, к простудам, а также для профилактики анемии – он подходит и взрослым, и детям.
Алюминий – вовсе не простой элемент. Металл, распространенность в земной коре высокая – 8%. Алюмосиликаты (соединение кремния и алюминия) – полевые шпаты – называют краеугольными камнями земной коры. Особенно богаты алюминием тропические почвы и месторождения глины. Некоторые растения – концентраторы – накапливают более 10 % алюминия. Богаты алюминием плауны, лишайники, чаи, молочай, багульник, рододендрон. В живом организме алюминий содержится во всех клетках, всех тканях и органах, и больше всего в мозге. Квасцы – белый порошок растворяют в воде и используют для примочек, полоскания, глазных капель. Еще одна форма выпуска – кровоостанавливающий карандаш, который применяют при мелких порезах и ссадинах после бритья. Квасцы жженые используют для присыпок при потливости ног.
Натрий – это типичный металл, но в малых количествах он необходим все живым организмам. Натрий – очень активный элемент и в химических реакциях, и живом организме. Он активно вступает в различные соединения, в организме проникает внутрь клетки, обеспечивая водно-солевой обмен. Его нарушения относятся к числу из самых тяжелых. Большинство народов поклонялись соли как символу самой жизни, вечности и постоянства, благополучия и мира. Поваренную соль добывают разными способами: подземным – каменную соль, открытым – озерную соль, выпариванием на солнце из морской воды – бассейновую соль. Во всех случаях соль непременно содержит примеси. Для человека полезна соль, содержащая микроэлементы. Наиболее полезная соль – морская, благодаря тому, что у нее наиболее естественное сочетание химических элементов, близких по составу к биологическим жидкостям человека. В числе прочего, она обладает антитоксическими свойствами. Обычно человек получает достаточное количество соли с пищей, но при больших потерях натрия с потом (у рабочих горячих цехов) наблюдаются колики, судороги, нарушение кровообращения, слабость, снижение давления, может быть обморок. Для питья рабочим дается соленая вода.
Он активно вступает в различные соединения, в организме проникает внутрь клетки, обеспечивая водно-солевой обмен. Его нарушения относятся к числу из самых тяжелых. Большинство народов поклонялись соли как символу самой жизни, вечности и постоянства, благополучия и мира. Поваренную соль добывают разными способами: подземным – каменную соль, открытым – озерную соль, выпариванием на солнце из морской воды – бассейновую соль. Во всех случаях соль непременно содержит примеси. Для человека полезна соль, содержащая микроэлементы. Наиболее полезная соль – морская, благодаря тому, что у нее наиболее естественное сочетание химических элементов, близких по составу к биологическим жидкостям человека. В числе прочего, она обладает антитоксическими свойствами. Обычно человек получает достаточное количество соли с пищей, но при больших потерях натрия с потом (у рабочих горячих цехов) наблюдаются колики, судороги, нарушение кровообращения, слабость, снижение давления, может быть обморок. Для питья рабочим дается соленая вода. В медицине применяется хлористый натрий в виде раствора для внутривенного введения и гипертонический раствор для очищения ран.
В медицине применяется хлористый натрий в виде раствора для внутривенного введения и гипертонический раствор для очищения ран.
Калий необходим для питания растений, при его недостатке рост приостанавливается, растения поражаются грибками, не происходит образования семян и рано опадают листья. В молодых листьях накапливается калий, а затем он заменяется на кальций. В большом количестве калий содержится в зеленых листьях салата, шпината, бананах, апельсинах, петрушке, цветной капусте, сливе. В организме человека калий является необходимым элементом, находится во всех клетках и участвует во всех видах обмена. В медицине применяют препараты калия – в виде солей и других соединений. Чаще других используется панангин.
Магний. В земной коре 1,8% магния, он образует 191 минерал. Особенно много магния в морской воде; если его количество в воде увеличивается, вода становится жесткой. В растительном мире магний играет важную роль – входит в состав хлорофилла. Без магния не может быть ни зеленых растений, ни питающихся ими животных. Особенно много магния содержат зеленые водоросли. В организме человека магний входит в состав всех клеток и тканой, поступает в организм с водой, солью, растительной пищей (листья). Магний относится к группе костных элементов. Он контролирует работу митохондрий – главных энергетических станций организма. Он, как невидимый кочегар, пережигает все ненужное и следит за работой электростанции, но стоит ему отлучиться – и работа всего организма сорвана. При стрессе повышается потребность в энергии и магнии. У детей-искусственников возникает дефицит магния в крови, могут быть судороги. Несмотря на то что его в коровьем молоке в 4 раза больше, чем в женском, усвоение идет труднее. Обеднение крови магнием у детей отмечено и при рахите. В медицине применяются сульфаты магния или английская соль в качестве слабительного и в виде инъекций при гипертонической болезни, судорогах. Изучается как средство для лечения предраковых заболеваний кожи и предупреждения развития злокачественных новообразований.
Без магния не может быть ни зеленых растений, ни питающихся ими животных. Особенно много магния содержат зеленые водоросли. В организме человека магний входит в состав всех клеток и тканой, поступает в организм с водой, солью, растительной пищей (листья). Магний относится к группе костных элементов. Он контролирует работу митохондрий – главных энергетических станций организма. Он, как невидимый кочегар, пережигает все ненужное и следит за работой электростанции, но стоит ему отлучиться – и работа всего организма сорвана. При стрессе повышается потребность в энергии и магнии. У детей-искусственников возникает дефицит магния в крови, могут быть судороги. Несмотря на то что его в коровьем молоке в 4 раза больше, чем в женском, усвоение идет труднее. Обеднение крови магнием у детей отмечено и при рахите. В медицине применяются сульфаты магния или английская соль в качестве слабительного и в виде инъекций при гипертонической болезни, судорогах. Изучается как средство для лечения предраковых заболеваний кожи и предупреждения развития злокачественных новообразований.
Кобальт не распространен в природе широко, им богаты почвы влажных тропиков. Кобальт обнаружен во всех растениях, особенно его много в красном перце, щавеле, редьке, зеленом луке, свекле. Он найден в организме морских и наземных животных и человека. Обнаружен в печени, крови, поджелудочной железе, почках, мозге и других органов. Кобальт входит в состав витамина В12 и необходим каждому организму, это важный биоэлемент. Кобальт содержится в витамине В12 и используется для лечения тяжелых анемий, невралгий, остеоартрозов и остеопорозов.
Хром, железо и медь, подготовка к ЕГЭ по химии
Хром
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим
разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.
Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные,
У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные,
+6 — кислотные.
В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит
Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из
его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3 + Cr
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 —
происходит пассивирование. Реагирует с неметаллами при нагревании.
Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3
Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑
Cr + H2SO4(разб.) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III),
реагирует с кислотами, кислотными оксидами.
CrO + O2 = Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами,
кислотными оксидами.
Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Cr(OH)2 + SO3 = CrSO4 + H2O
Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).
К ним относятся оксид хрома (III) гидроксид хрома (III).
Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + Ba(OH)2 → (t°) Ba(CrO2)2 + H2O (прокаливание, хромит бария)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr+3)
Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в
растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают
Хроматы окрашивают
раствор в желтый цвет, а дихроматы — в оранжевый цвет.
Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» :)
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит
Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается
бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- Реакции с солями
- Восстановительные свойства
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t
Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов
FeO*Fe2O3)
При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
Fe + Cl2 = (t) FeCl3
Fe + P = (t) FeP
Fe + C = (t) Fe3C
Fe + Si = (t) FeSi
Железо активнее водорода, способно вытеснить его из кислот.
Fe + HCl = FeCl2 + H2↑
На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными
серной и азотной кислотами.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.
Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Железо способно восстанавливать соединения железа +3 до +2.
Fe + Fe2O3 = (t) FeO
Fe + FeCl3 = (t) FeCl2
Соединения железа (II) проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа (II)
распадается на соответствующий оксид и воду.
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + HCl = FeCl2 + H2O
Fe(OH)2 = (t) FeO + H2O
При хранении на открытом воздухе соли железа (II) приобретают коричневый цвет из-за окисления до железа +3.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] —
гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании
легко распадается на воду и соответствующий оксид.
Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6].
В результате реакции образуется берлинская лазурь (прусский синий).
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко
красного цвета.
FeCl3 + KCNS = Fe(CNS)3 + KCl
И еще одна качественная реакция на ионы Fe3+ — взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными
окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3
в щелочи.
Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O
Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит
Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди
более активными металлами, например — железом.
CuSO4 + Fe = Cu + FeSO4
Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С оксидами неметаллов
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)
Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной
С разбавленной серной не реагирует, с разбавленной азотной
— реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
Соединения меди (I) можно получить путем восстановления соединений меди (II).
CuCl2 + Cu = CuCl
CuO + Cu = Cu2O
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2O + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди (I) окисляется кислородом до оксида меди (II).
Cu2O + O2 = (t) CuO
Оксид меди (I) вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2.
Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
CuO + H2SO4 = CuSO4 + H2O
CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
CuO + CO = Cu + CO2
CuO + C = Cu + CO
CuO + H2 = Cu + H2O
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.
CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства.
В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди (II) — (CuOH)2CO3)
Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
CuSO4 + Na2CO3 + H2O = (CuOH)2CO3 + Na2SO4 + CO2
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Сравнение элементов периодической таблицы | Сравните железо и медь
Сравните железо и медь
Сравните железо и медь на основе их свойств, атрибутов и фактов из периодической таблицы. Сравните элементы по более чем 90 свойствам. Все элементы подобных категорий обнаруживают много сходств и различий в своих химических, атомных, физических свойствах и использовании. Эти сходства и различия следует знать, изучая элементы таблицы Менделеева. Вы можете изучить подробное сравнение между железом и медью с наиболее надежной информацией об их свойствах, атрибутах, фактах, использовании и т. д. Вы можете сравнить Fe и Cu более чем по 90 такие свойства, как электроотрицательность, степень окисления, атомные оболочки, орбитальная структура, электросродство, физические состояния, электрическая проводимость и многое другое.
Все элементы подобных категорий обнаруживают много сходств и различий в своих химических, атомных, физических свойствах и использовании. Эти сходства и различия следует знать, изучая элементы таблицы Менделеева. Вы можете изучить подробное сравнение между железом и медью с наиболее надежной информацией об их свойствах, атрибутах, фактах, использовании и т. д. Вы можете сравнить Fe и Cu более чем по 90 такие свойства, как электроотрицательность, степень окисления, атомные оболочки, орбитальная структура, электросродство, физические состояния, электрическая проводимость и многое другое.
26 Fe Iron
Swap Copper vs Iron
Periodic Table Element Comparison
29 Cu Copper
Facts
| Name | Iron | Copper |
| Atomic Number | 26 | 29 |
| Атомный символ | Fe | Cu |
| Atomic Weight | 55.845 | 63. 546 546 |
| Phase at STP | Solid | Solid |
| Color | Gray | Copper |
| Metallic Classification | Переходный металл | Переходный металл |
| Группа в периодической таблице | группа 8 | группа 11 |
| Название группы | iron family | copper family |
| Period in Periodic Table | period 4 | period 4 |
| Block in Periodic Table | d -block | d -block |
| Electronic Configuration | [Ar] 3d6 4s2 | [Ar] 3d10 4s1 |
| Структура электронной оболочки (количество электронов на оболочку) | 2, 8, 14, 2 | 2, 8, 18, 1 Точка плавления 2 | 1811 K | 1357.77 K |
| Boiling Point | 3134 K | 3200 K |
| CAS Number | CAS7439-89-6 | CAS7440-50-8 |
| Neighborhood Elements | Соседние Элементы Железа | Соседние Элементы Меди |
История
| История | Элемент Железо был открыт Неизвестно в 500 году до н. -7 %) -7 %)
Crystal Structure and Atomic Structure
Atomic and Orbital Properties
ISOTOPES и ядер 9003. Altable. стабильные природные изотопы.
Chemical Properties: Ionization Energies and electron affinity
Physical Properties
Thermal Properties — Enthalpies and thermodynamics
Нормативно-правовое регулирование и здоровье — Параметры и рекомендации по охране здоровья и безопасности
Сравнить с другими элементами
Распространенные типы металлов, их свойства и использованиеМеталл — это материал, хорошо проводящий электричество и тепло. Металл имеет блестящий вид, когда он только что создан, отполирован или разбит. Металлы можно вытягивать в проволоку или сбивать молотком в тонкие листы (ковкие) (пластичные). Металлы имеют высокую температуру плавления и менее склонны к распаду при воздействии экстремальных температур. Металлы также более прочные, прочные и твердые, чем их пластиковые аналоги. Доступны тысячи различных типов металлов, каждый из которых был произведен для определенной цели. Мы составили информативное руководство, которое поможет вам узнать о некоторых из самых популярных металлов и о том, как они используются. Подробнее: различные типы металлов и их классификации Содержание
Различные типы металлов, которые сегодня распространены в промышленности, включают сталь, углеродистую сталь, легированную сталь, нержавеющую сталь, железо, чугун, чугун, кованое железо, алюминий, медь, латунь, бронзу, кобальт, Магний, никель, свинец, олово, цинк, титан, вольфрам, кремний, серебро и золото. Сталь: Сталь представляет собой химический сплав, состоящий из железа и углерода, улучшающий прочность и устойчивость материала к излому. Подробнее: Понимание порошковой металлургии Углеродистая сталь: Углеродистая сталь определяется как сталь, свойства которой в основном определяются содержанием углерода и содержат не более 0,5 процента кремния и 1,5 процента марганца. Хотя некоторые другие элементы могут быть добавлены в очень небольших количествах, именно основная сталь содержит углерод и железо. Углеродистая сталь подразделяется на три категории: низкоуглеродистая, среднеуглеродистая и высокоуглеродистая сталь. Больше углерода означает, что продукт тверже и прочнее, тогда как меньше углерода означает, что продукт дешевле и мягче. Легированная сталь:Легированная сталь — это сталь, в которую помимо углерода добавлены элементы в количестве, достаточном для придания специфических для металла свойств. Марганец, ванадий, хром, никель и вольфрам являются одними из легирующих элементов. Обычно это делается для улучшения прочности, твердости, ударной вязкости, сопротивления истиранию и износу материала, а также его электрических и магнитных свойств. Это очень распространенный металл, поскольку его производство все еще очень недорого. Из этой стали изготавливают трубы, особенно для энергетических применений. Подробнее: Разница между металлами и неметаллами Нержавеющая сталь: Этот тип металла определяется как сталь, устойчивая к окислению и коррозии в агрессивных средах при непосредственной термообработке и полировке. Она также известна как нержавеющая сталь, потому что она содержит не менее 11% хрома, который предотвращает ржавление железа, а также обеспечивает термостойкость. Железо:Железо — это химический элемент, обозначенный символом Fe. Он принадлежит к первому переходному ряду периодической таблицы и группе 8. Несмотря на то, что это был очень старый металл в «железном веке», он все еще имеет множество современных применений. Железо является наиболее широко используемым и наименее дорогим металлом на планете. Чугун, чугун и кованое железо — это три типа железа, которые можно найти. Подробнее: Знакомство с процессами промышленной обработки металлов Чугун: Это вид железа, который используется в качестве сырья для производства других черных металлов, включая чугун, кованое железо и сталь. Чугун:Чугун получают путем плавки чугуна, кокса и известняка в вагранке. Это основной источник железа и углерода. Чугун имеет процент углерода в диапазоне от 1,7 процента до 4,5 процента. Также присутствуют небольшое количество кремния, марганца, фосфора и серы. Его нельзя использовать в секциях, чувствительных к ударам, потому что это хрупкий материал. Чугун обладает прекрасными литейными качествами, а также большой прочностью, износостойкостью и приемлемой стоимостью. Кованое железо: В отличие от чугуна, эти типы металлов представляют собой сплавы железа с очень низким процентным содержанием углерода, примерно 0,08 процента. Подпишитесь на нашу рассылку новостейПодробнее: Кованое железо Алюминий: Алюминий — это металл с атомным номером 13 и символом Al. Это легкий голубовато-белый металл с удельным весом 2,7 и температурой плавления 658 градусов по Цельсию. Плотность металла составляет около одной трети плотности стали, что делает его менее плотным, чем другие популярные металлы. Этот металл в чистом виде был бы слабым и кашеобразным для большинства применений, но при смешивании с незначительным количеством других сплавов он становится прочным и жестким. Подробнее: Термическая обработка алюминия и алюминиевых сплавов Медь:Медь — это химический элемент с атомным номером 29 и символом Cu. Это красновато-коричневый металл, мягкий, ковкий и пластичный. Он имеет удельный вес 8,9 и температуру плавления 1083°C. Медь не находится в чистом виде под землей. Обладает отличной электропроводностью. Литье, ковка, прокатка и проволока — все это варианты металла. Он широко используется в производстве электрических проводов и проводов, а также электроприборов и оборудования, гальванопластики и гальваники, чеканки монет и домашней утвари. Подробнее: Термическая обработка меди и медных сплавов Латунь: Латунь — это наиболее широко используемый сплав меди и цинка в современном мире. Бронза: Бронза — это термин, используемый для описания сплавов меди и олова. От 75 до 95 процентов меди и от 5 до 25 процентов олова являются наиболее полезными пропорциями. Эти металлы довольно твердые, обладают высокой стойкостью к поверхностному износу, легко поддаются формованию или прокатке в проволоку, стержни и листы. Бронзы превосходят латуни, потому что они имеют лучшую коррозионную стойкость. Бронза также более плавится, а это означает, что ее легче расплавить и, следовательно, легче отлить. Трубная арматура, насосы, шестерни, корабли и лопасти турбин изготавливаются из алюминиевых бронз, которые отливаются или куются. Подробнее: Разница между цветными и черными металлами Кобальт:Химический элемент кобальт имеет символ Co и атомный номер 27. Его физические свойства идентичны свойствам железа с добавлением никеля. Кобальт — прочный, блестящий металл серебристо-серого цвета, получаемый методом восстановительной плавки. Кобальт можно найти в растениях и животных, а также в воздухе, воде, почве и горных породах. Переносимая ветром пыль или дождевая вода также могут смыть богатую кобальтом почву и камни, что позволит им проникнуть в другие места обитания. Его содержат многие сплавы, в том числе используемые для создания деталей авиационных двигателей, газовых турбин, быстрорежущей стали. Периодическая таблица металлов:Магний: Магний, обычно известный как Mg, представляет собой химический элемент с атомным номером 12 и символом Mg. Это глянцевое серое твердое вещество с множеством общих физических и химических свойств. Подробнее: Различные типы цветных металлов и их применение Кремний: Кремний имеет символ Si и атомный номер 14 и является химическим элементом. Это голубовато-серый металл, твердый, хрупкий и твердый. Только кислород превосходит кремний как второй по распространенности элемент в земной коре. Он имеет температуру плавления 1414 градусов по Цельсию и температуру кипения 3265 градусов по Цельсию. Из-за использования хорошо зарекомендовавших себя процедур обработки он стоит недорого. Его можно найти в плитах динамо и трансформаторов, блоках двигателей, головках цилиндров, а также при изготовлении станков и в других местах. Серебро:Серебро имеет атомный номер 47 и обозначается символом Ag. Это мягкий, белый, глянцевый переходный металл с самой высокой электропроводностью и теплопроводностью среди всех переходных металлов. Это свободная самородная форма самородного серебра, которая в чистом виде встречается в земной коре. Это золотой сплав с добавлением нескольких других металлов. Серебро традиционно считалось ценным металлом, и многие инвестиционные монеты сделаны из него. Серебро используется в солнечных батареях, очистке воды, ювелирных изделиях, дорогой столовой посуде и посуде, а также в наличных деньгах. Из его смесей также изготавливают фото- и рентгеновскую пленку. Золото: Золото является переходным металлом, что означает, что оно находится в той же колонке, что и серебро и медь в периодической таблице. Его атомный номер 79, и он представлен символом Au. В чистом виде золото представляет собой ослепительный, светло-оранжево-желтого оттенка, плотный, мягкий, ковкий и пластичный металл. Никель:Эти типы металлов имеют свой химический элемент с атомным номером 28 и символом Ni. Это серебристо-белый металл, который можно отполировать до блеска. Он имеет удельный вес 8,85 и температуру плавления 1452°C. Кроме того, он почти такой же твердый, как мягкая сталь. Он обладает довольно гибкими свойствами, когда в нем мало углерода. Он менее пластичен, чем мягкая сталь, однако при низком содержании магния пластичность резко улучшается. Он обычно используется в качестве декоративного и антикоррозионного покрытия для других металлов, таких как сталь, медь, латунь и т. д. Подробнее: Понимание процесса обработки и станка Свинец: Свинец — это химический элемент с атомным номером 82 и символом Pb. Олово: Химический символ олова — Sn, а его атомный номер — 50. Олово — серебристый металл с легким желтым оттенком. Олово достаточно мягкое, чтобы резать его с небольшим усилием, а полоску олова можно легко согнуть вручную. Это блестящий белый металл, мягкий, ковкий и пластичный. Металл можно очень просто раскатать в очень тонкий лист. Олово обычно используется для изготовления тонкого припоя для основных сплавов, в качестве защитного покрытия для железных и стальных листов, а также для производства оловянной фольги для влагонепроницаемой упаковки. Цинк:Цинк — это химический элемент с символом Zn и атомным номером 30. Когда окисление не происходит, цинк представляет собой хрупкий металл серебристо-коричневого цвета. Цинк имеет удельный вес 7,1 и температуру плавления 420°С. Эти типы металлов используются для покрытия стальных листов при производстве оцинкованного железа из-за их высокой устойчивости к воздушной коррозии. Цинк скатывается в листы и используется, среди прочего, в качестве кровельного покрытия и влагонепроницаемой, неагрессивной облицовки контейнеров. Другие известные применения цинка включают изготовление латуни и литье под давлением на основе цинка. Титан: Этот тип металла также имеет символ Ti и атомный номер 22. Титан — красивый переходный металл с серебристым оттенком, низкой плотностью, большой прочностью и коррозионной стойкостью, который можно найти в природе. Это легкий, высокопрочный металл с низкой коррозией, который используется в качестве сплава в деталях высокоскоростной авиации. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 0021
0021 40004 -й натуральные натуральные.
40004 -й натуральные натуральные. 83 Pauling Scale
83 Pauling Scale 5 kJ/mol
5 kJ/mol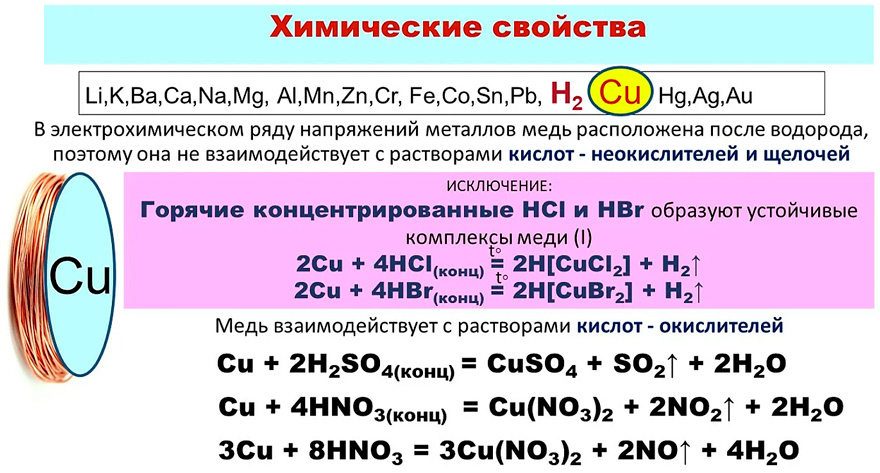 874 g/cm3
874 g/cm3 0021
0021 77 K
77 K 0021
0021 0005
0005 Коричневое железо:
Коричневое железо: Он сделан в основном из железа и углерода с большим содержанием углерода до 2%. Сталь является наиболее часто используемым материалом в мире для инфраструктуры и промышленности. Все, от швейных иголок до нефтяных танкеров, делается из него. Сталь используется в конструкциях, инструментах, автомобилях, машинах, электрическом оборудовании и оружии из-за ее высокой прочности на растяжение и низкой стоимости.
Он сделан в основном из железа и углерода с большим содержанием углерода до 2%. Сталь является наиболее часто используемым материалом в мире для инфраструктуры и промышленности. Все, от швейных иголок до нефтяных танкеров, делается из него. Сталь используется в конструкциях, инструментах, автомобилях, машинах, электрическом оборудовании и оружии из-за ее высокой прочности на растяжение и низкой стоимости. Из-за высокого содержания углерода, который помогает лезвию сохранять остроту, эта сталь обычно используется в производстве ножей.
Из-за высокого содержания углерода, который помогает лезвию сохранять остроту, эта сталь обычно используется в производстве ножей. Углерод, азот, кремний, сера, титан, медь и другие элементы содержатся в различных разновидностях нержавеющей стали. Кухонные инструменты, ножи, столы, посуда и все остальное, что соприкасается с едой, сделано из нержавеющей стали. Они также использовали в двигателях и машинах детали, подвергающиеся высоким нагрузкам, такие как стержни, листы и проволока.
Углерод, азот, кремний, сера, титан, медь и другие элементы содержатся в различных разновидностях нержавеющей стали. Кухонные инструменты, ножи, столы, посуда и все остальное, что соприкасается с едой, сделано из нержавеющей стали. Они также использовали в двигателях и машинах детали, подвергающиеся высоким нагрузкам, такие как стержни, листы и проволока. Плавка необработанных железных руд в доменной печи производит эти утюги. Вместе с кремнеземом и другими заполнителями чугун имеет очень высокое содержание углерода — 3,8–4,7%. В результате он чрезвычайно хрупок и имеет лишь несколько применений в качестве материала. Это железо обычно находится в электродуговой печи, которая используется для производства стали.
Плавка необработанных железных руд в доменной печи производит эти утюги. Вместе с кремнеземом и другими заполнителями чугун имеет очень высокое содержание углерода — 3,8–4,7%. В результате он чрезвычайно хрупок и имеет лишь несколько применений в качестве материала. Это железо обычно находится в электродуговой печи, которая используется для производства стали. Кованое железо обладает различными механическими свойствами, включая ударную вязкость, пластичность и коррозионную стойкость. Кроме того, они легко свариваются, но их труднее сваривать электрическим током. Небольшие количества силикатного шлака отлиты в нити из этих металлов, которые представляют собой металлы высокой чистоты. Для кузнечных работ, таких как ковка, присутствие шлака может быть выгодным. Ограждения, садовая мебель и ворота — это лишь некоторые из вещей, сделанных из них.
Кованое железо обладает различными механическими свойствами, включая ударную вязкость, пластичность и коррозионную стойкость. Кроме того, они легко свариваются, но их труднее сваривать электрическим током. Небольшие количества силикатного шлака отлиты в нити из этих металлов, которые представляют собой металлы высокой чистоты. Для кузнечных работ, таких как ковка, присутствие шлака может быть выгодным. Ограждения, садовая мебель и ворота — это лишь некоторые из вещей, сделанных из них. В результате его можно было штамповать, формовать, вытягивать, точить, отливать, выковывать и, наконец, отливать под давлением. Он обладает высокой электропроводностью, что является важным качеством для воздушных кабелей. Из этого материала также изготавливают детали для самолетов и автомобилей.
В результате его можно было штамповать, формовать, вытягивать, точить, отливать, выковывать и, наконец, отливать под давлением. Он обладает высокой электропроводностью, что является важным качеством для воздушных кабелей. Из этого материала также изготавливают детали для самолетов и автомобилей.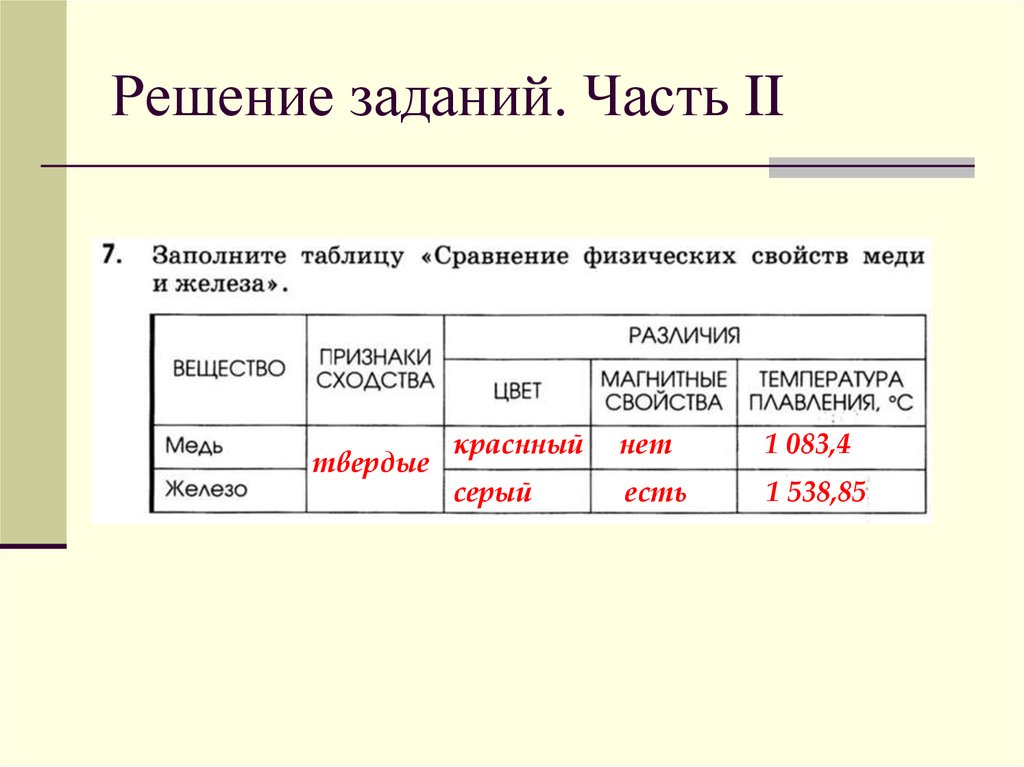 Доступны различные сорта латуни, в зависимости от соотношения меди и цинка. Качества латуни можно резко изменить, введя небольшое количество других элементов, которые могут быть механическими, электрическими или химическими. Латунь более прочна, чем медь, хотя имеет меньшую тепло- и электропроводность. Они чрезвычайно устойчивы к воздушной коррозии и просты в пайке. Могут быть обнаружены замки, шестерни, приводы, клапаны и другие часто используемые предметы.
Доступны различные сорта латуни, в зависимости от соотношения меди и цинка. Качества латуни можно резко изменить, введя небольшое количество других элементов, которые могут быть механическими, электрическими или химическими. Латунь более прочна, чем медь, хотя имеет меньшую тепло- и электропроводность. Они чрезвычайно устойчивы к воздушной коррозии и просты в пайке. Могут быть обнаружены замки, шестерни, приводы, клапаны и другие часто используемые предметы.
 Это самый легкий металл, предел прочности литого металла на разрыв 910 кг/см2. Эти виды металлов прочнее алюминия и легко поддаются механической обработке. Они также допускают полировку под буферным кругом. Из-за его низкой плотности 1,74 его предпочитают, когда приоритетом является потеря веса. Из этих металлов изготавливают листы, проволоку, прутки, трубы и другие изделия.
Это самый легкий металл, предел прочности литого металла на разрыв 910 кг/см2. Эти виды металлов прочнее алюминия и легко поддаются механической обработке. Они также допускают полировку под буферным кругом. Из-за его низкой плотности 1,74 его предпочитают, когда приоритетом является потеря веса. Из этих металлов изготавливают листы, проволоку, прутки, трубы и другие изделия.
 Золото — один из древнейших металлов, известных человечеству, он был открыт египтянами. Он также исторически служил символом процветания и красоты. Золото — редкий материал, который на протяжении всей истории использовался для изготовления монет, ювелирных изделий и других произведений искусства.
Золото — один из древнейших металлов, известных человечеству, он был открыт египтянами. Он также исторически служил символом процветания и красоты. Золото — редкий материал, который на протяжении всей истории использовался для изготовления монет, ювелирных изделий и других произведений искусства. Он тяжелее большинства обычных материалов и имеет более высокую плотность. Эти металлы более мягкие и пластичные, а также имеют более низкую температуру плавления. Он имеет удельный вес 1,36 и температуру плавления 326°C. Это голубовато-серый металл с удельным весом 1,36. Поскольку это мягкий металл, его легко резать лезвием. Также не хватает стойкости. Свинец обычно используется для изготовления припоев, а также для покрытия резервуаров с кислотой, цистерн и водопроводных труб, а также для покрытия электрических кабелей.
Он тяжелее большинства обычных материалов и имеет более высокую плотность. Эти металлы более мягкие и пластичные, а также имеют более низкую температуру плавления. Он имеет удельный вес 1,36 и температуру плавления 326°C. Это голубовато-серый металл с удельным весом 1,36. Поскольку это мягкий металл, его легко резать лезвием. Также не хватает стойкости. Свинец обычно используется для изготовления припоев, а также для покрытия резервуаров с кислотой, цистерн и водопроводных труб, а также для покрытия электрических кабелей.
