Температура плавления алюминия и меди: Температура плавления алюминия в интернет-магазине ООО «Фурниту»
Содержание
Приготовление алюминиевых лигатур :: Технология металлов
Лигатура алюминий—кремний применяется для приготовления алюминиево-кремниевых сплавов АЛ2, АЛЗ, АЛ4, АЛ5, АЛ9 и др. Она содержит 10—12% кремния и остальное— алюминий. Температура плавления этой лигатуры около620-—640° С.
В расплавленный алюминий, нагретый до 850—900°, вводится небольшими порциями (в виде кусков размером 20—30 мм) подогретый до 100—200° С кремний. В целях ускорения растворения кремния производится постоянное погружение его в жидкий расплав с помощью графитовой мешалки.
По окончании растворения последней присадки кремния сплав тщательно размешивается и при температуре 700—720° разливается по изложницам.
Лигатура алюминий — медь, содержащая 50% меди, имеет температуру плавления около 575° С. Она может бытьприготовлена двумя способами.
Первый способ состоит в том, что расплавляют алюминий и в него .вводят медь в твердом виде. Этот способ требует перегрева алюминия до 700—750° С. Но он очень удобен тем, что дляприготовления лигатуры по этому способу не требуется особых печей, так как плавку можно вести в обычной тигельной печи. Этот способ широко применяется на практике.
Этот способ требует перегрева алюминия до 700—750° С. Но он очень удобен тем, что дляприготовления лигатуры по этому способу не требуется особых печей, так как плавку можно вести в обычной тигельной печи. Этот способ широко применяется на практике.
В расплавленный и перегретый до 750° алюминий при перемешивании вводится медь в виде кусков размером 100 Х100 мм подогретых до 400—600°. После растворения всей навески меди расплав размешивается, снимается шлак, температура снижается до 720—730°, затем производится рафинирование и разливка.
Второй способ заключается в расплавлении меди и введении в нее твердого алюминия. В этом случае для расплавления меди требуется такая печь, где можно получить высокую температуру-
В нагретый до красного каления графитовый тигель загружают медь. По ее расплавлении постепенно, небольшими порциями добавляют чушковый алюминий, погружая его в глубь ванны и помешивая при этом расплав. Благодаря этому получается нужное растворение алюминия и ускоряется процесс плавки.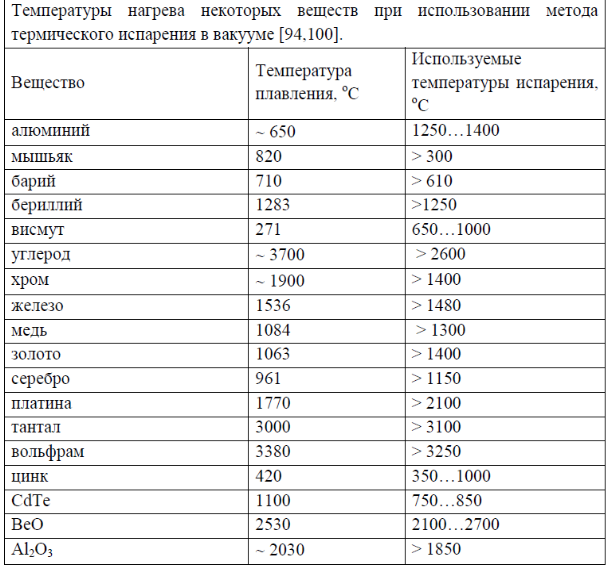
После растворения всего алюминия сплав охлаждается до720°, затем производится рафинирование иразливка.
Лигатура алюминий — марганец, содержащая 10% марганца, имеет температуру плавления около 780° С.
Порядок плавки лигатуры в печи с графитовым тиглем следующий. Перед началом плавки тигель тщательно очищается и подогревается докрасна. Алюминий загружается в тигель в количестве 1/3части навески. По расплавлении его добавляется остальной алюминий, причем одна чушка алюминия остается для введения в готовую лигатуру с целью понижения температуры перед заливкой.
Температура алюминия доводится до 850—900° С, и начинается введение в него марганца небольшими порциями. Марганец должен быть предварительно измельчен на кусочки диаметром 15—20 мм. Во время расплавления алюминия эти мелкие кусочки марганца подогреваются на противнях.
Перегрев расплавленного алюминия, а также измельчение марганца делается с целью более быстрого растворения последнего.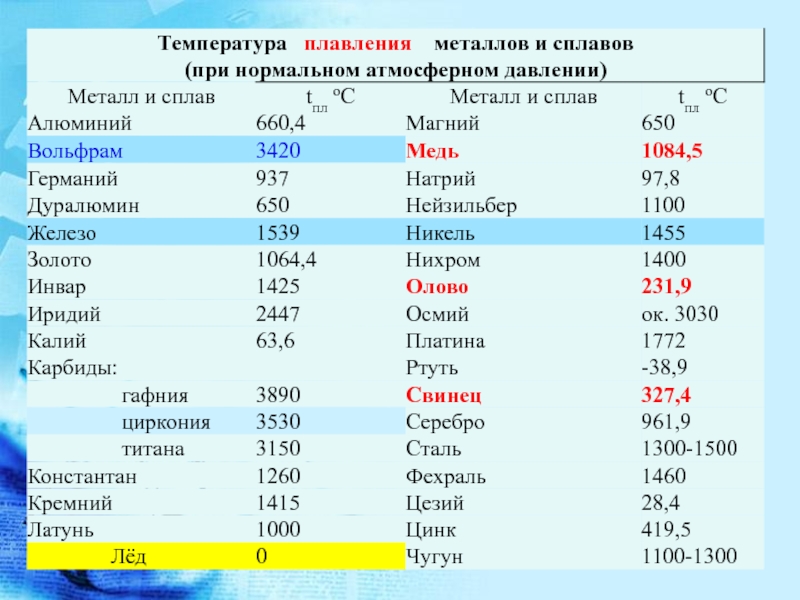 При введении в расплавленный алюминий мелких кусочков марганца сплав тщательно перемешивается. Перемешивание сплава желательно производить не железными мешалками, а графитовыми. После перемешивания при каждой загрузке сплав выдерживается при температуре 850—900° С в течение 10—12 мин. для полного растворения введенной порции марганца. Оставшаяся чушка алюминия после присадки и полного растворения всей навески марганца вводится в сплав. Температура сплава несколько понижается ипроизводятся рафинирование и разливка его в изложницы. Изложницы должны быть предварительно подогреты до 100—150° С.
При введении в расплавленный алюминий мелких кусочков марганца сплав тщательно перемешивается. Перемешивание сплава желательно производить не железными мешалками, а графитовыми. После перемешивания при каждой загрузке сплав выдерживается при температуре 850—900° С в течение 10—12 мин. для полного растворения введенной порции марганца. Оставшаяся чушка алюминия после присадки и полного растворения всей навески марганца вводится в сплав. Температура сплава несколько понижается ипроизводятся рафинирование и разливка его в изложницы. Изложницы должны быть предварительно подогреты до 100—150° С.
Лигатура алюминий—бериллий содержит 3—4% бериллия; температура плавления этой лигатуры около 880° С.
В целях форсирования процесса плавки указанную лигатуру рекомендуется приготовлять в высокочастотных печах емкостью 20—60 кГ.
Вначале расплавляется алюминий и перегревается до 1200— 1300° С, затем с помощью графитового «колокольчика» вводится бериллий в виде мелких кусочков (размером не более 10— 20 мм) отдельными порциями, завернутыми в алюминиевую фольгу. Для ускорения растворения расплав тщательно перемешивается графитовой мешалкой. После полного растворения бериллия температура расплава снижается до 800—830° С, снимается шлак, сплав рафинируется, и производится разливка лигатуры.
Для ускорения растворения расплав тщательно перемешивается графитовой мешалкой. После полного растворения бериллия температура расплава снижается до 800—830° С, снимается шлак, сплав рафинируется, и производится разливка лигатуры.
Лигатура алюминий—никель содержит 10—20% никеля. Для приготовления ее плавится 3/4 всей навески алюминия. Температуру алюминия доводят до 850—900° С, после чегоприсаживают небольшими порциями никель в виде катодных плиток размером 50 X 50 X 5 мм. Расплавление никеля проверяют графитовой мешалкой; когда на дне тигля не обнаруживают твердых частей никеля, добавляют оставшуюся часть алюминия для понижения температуры сплава, рафинируют сплав и производят разливку.
Лигатура алюминий—магний содержит 10—12% магния.
Для приготовления этой лигатуры применяют магний всех марок и алюминий марок А0 или А1.
Поверхность расплавленного алюминия покрывают слоем карналлита в количестве 4 — 5% от веса шихты. При температуре 690—710° С с помощью «колоколов» или специальных клещей вводят магний, подогретый до температуры 100—150° С. Разливают эту лигатуру при температуре 680—690° С вметаллические изложницы, предварительно окрашенные и подогретые.
При температуре 690—710° С с помощью «колоколов» или специальных клещей вводят магний, подогретый до температуры 100—150° С. Разливают эту лигатуру при температуре 680—690° С вметаллические изложницы, предварительно окрашенные и подогретые.
Источник:
Белоусов Н.Н. Плавка и разливка сплавов цветных металлов. Машгиз 1961 г.
Сварочный провод — паяем алюминий и медь обычной горелкой.
Всем привет! Обычно цветные металлы сваривают в аргоновой среде, при этом дуга обеспечивает температуру для плавления алюминиевого прутка(не менее 660 °C), а аргон препятствует попаданию кислорода в рабочую зону, чтобы избежать окисления поверхностей, иначе прочного соединения не получится. Но можно использовать низкотемпературный сплав, в который уже добавлен флюс, нейтрализующий окисление. Температура плавления данного прутка всего 360 °C, так что можно работать с обычной портативной горелкой, при этом шов получается довольно прочным. Тестирование под катом.
Характеристики.
На странице продавца только указана температура плавления 360 °C и что не нужно использовать дополнительный флюс.
Но вообще он напоминает Castolin 192FBK, у которого температура плавления на 80 градусов выше, так что приведу в пример еще и его характеристики:
Диаметр: 2,0 мм, длина: 500 мм
Мягкий припой ISO 3677: ~B-Zn98Al 381-400
Примерный состав (вес %): 2,4 Al – остальное Zn
Температура плавления ºС: 430-440
Рабочая температура ºС: 440
Прочность на разрыв (МПа): До 100 (Al)
Плотность (г/cм3): 7,0
Распаковка и внешний вид.
Белый пакет
Внутри зип-пакет с проволокой и инструкцией
Диаметр 2 мм, длина 3 метра. Немного жестче, чем алюминиевый пруток такого же диаметра.
Сделан в виде трубки, в центре которой можно разглядеть флюс. При многократном сгибании лопается вдоль.
Инструкция простая — греть поверхность и натирать припоем.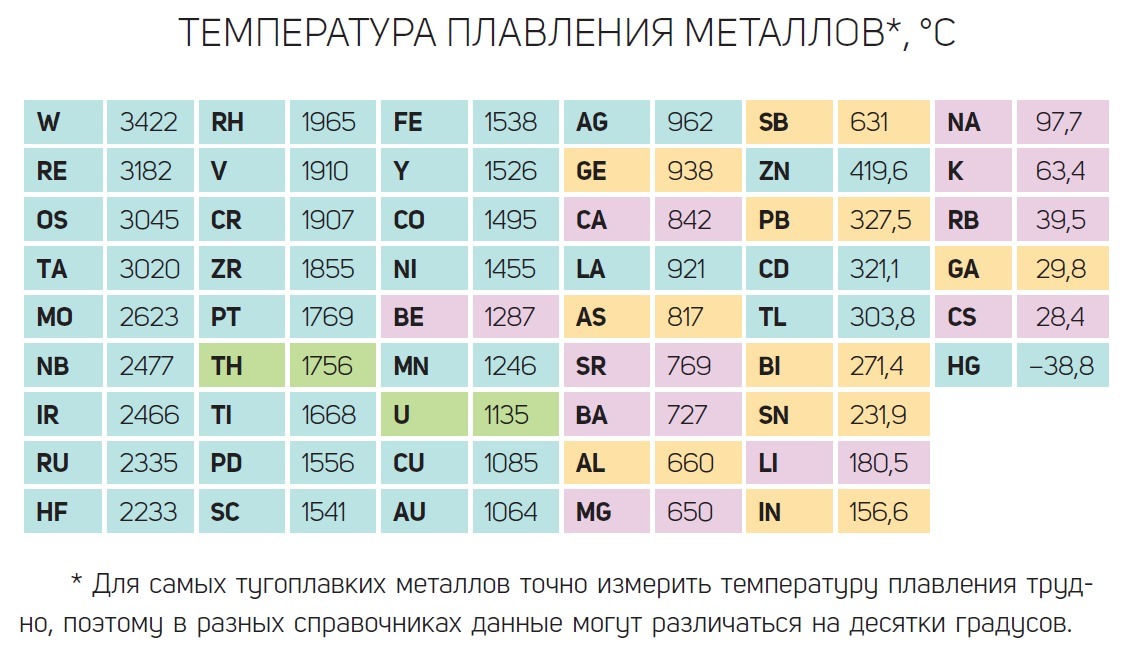
Переходим к практике.
Для начала проверил температуру плавления. При 360 ºС размягчается, но не очень текуч, а вот при 400 плавится как олово, так что температура плавления действительно ниже, чем у Castolin 192FBK.
Далее возьмем алюминиевую трубку, отпилим кусок и попробуем частично запаять
И что-то идет не так. Припой собирается в шарики и скатывается по поверхности. Я встречал множество гневных отзывов от людей, получившись подобный результат, мол проще оплавить деталь, чем запаять щель в ней.
Но нужно понимать, что флюс хоть и защищает от окисления, но не снимает многолетнюю оксидную пленку, так что обязательно необходимо зачистить поверхность, после чего процесс идет как по маслу
Из-за флюса поверхность мутнеет.
Немного потер щеткой. Довольно неплохо, при желании можно снять лишнее.
Деталь хорошо прогрелась, та что припой протек и с внутренней стороны стыка.
Тестируем. При нормальной сварке разрыв не должен происходить по шву, так и получилось
При нормальной сварке разрыв не должен происходить по шву, так и получилось
Крупнее справа
И слева. Тут видно, что трубка начала рваться над швом.
Помимо алюминия можно паять и медь. У нее теплопроводность выше, так что процесс идет гораздо быстрее.
Вид немного портит мутная пленка, но она легко убирается
Снизу так же хорошо протекло
Но соединение получается не такое прочное, как при работе с алюминием. Не без труда, но трубку удалось оторвать, при чем можно разглядеть, что сорвало верхний слой, как будто припой въелся на десятую миллиметра. Даже подумал, что трубка с медным напылением, но потер поверхность щеткой и она снова приобрела медный блеск.
Итоги.
Заказал данный лот просто из интереса, но опыт получился занятным.
Температура плавления практически вдвое ниже температуры плавления алюминия, так что для работы хватит температуры обычной газовой горелки и риск оплавить деталь сводится к минимуму.
Шов получается довольно прочным, так что это неплохая альтернатива аргоновой сварке, особенно если нет других вариантов, а результат нужен вот прям сейчас.
Так же припой хорошо обволакивает поверхность, что позволяет легко устранять порывы трубок из цветных металлов и радиаторов в автомобилях, холодильном оборудовании. Правда у меня нет возможности проверить это под большим давлением, но 8 Атмосфер медная трубка из обзора выдержала. Запаивал торец и пропиленную щель сбоку.
При желании можно использовать его для надежной спайки толстых медных или алюминиевых проводников.
Но с крупными деталями может быть проблема. Во время прогрева места спайки, тепло будет отводиться на остальную часть корпуса, что заметно замедляет процесс и можно перегреть узлы, которые не должны перегреваться — втулки, сальники, прокладки.
Так же стоит упомянуть, что есть лоты с более низкой стоимостью, но в интернетах пишут, что «это обман и лучше данного образца в мире нет». Тем не менее я заказал еще пару в другом месте за $5, но что-то они не трекаются, может не получу их, но если доедут, сделаю небольшое сравнение — возможно и не стоит переплачивать.
Тем не менее я заказал еще пару в другом месте за $5, но что-то они не трекаются, может не получу их, но если доедут, сделаю небольшое сравнение — возможно и не стоит переплачивать.
Я не сварщик, так что извиняюсь если кого-то заденет моя терминология, старался объяснять «на пальцах» и просто хотел поделиться, вдруг кто-то как и я до некоторого времени не знал о существовании такого припоя )
Как всегда, приветствуется конструктивная критика в комментариях. Всем добра =)
Точка плавления алюминия
Нравится это? Поделиться!
Температура плавления алюминия составляет 660,37 градусов по Цельсию и 1220,666 градусов по Фаренгейту. Читайте дальше, чтобы узнать больше о температуре плавления алюминия и некоторых удивительных фактах о металлическом алюминии.
Алюминий — легкий и пластичный металл, известный своей устойчивостью к коррозии. Именно из-за этого важного свойства алюминий в основном используется в кухонной посуде, упаковке, промышленных приложениях, строительных работах и транспортных системах. В аэрокосмической отрасли конструкционные детали, в основном изготовленные из алюминия, используются из-за их относительно небольшого веса и высокой прочности.
В аэрокосмической отрасли конструкционные детали, в основном изготовленные из алюминия, используются из-за их относительно небольшого веса и высокой прочности.
Обзор алюминия
Имея атомный номер 13 и атомный вес 26,98, алюминий обозначается символом «Al». В современной периодической таблице вы найдете его в группе № 13 и периоде № 3. Цвет алюминия серебристо-белый или тускло-серый из-за быстрого окисления после воздействия воздуха. Химически он нетоксичен и не обладает магнитными свойствами. Что касается встречаемости, то алюминий занимает третье место среди наиболее распространенных химических элементов в земной коре (первое место занимает кислород, а второе — кремний). По научным данным, алюминий составляет 7,5 – 8,1 процента от общей массы твердой поверхности земли.
Температура плавления
Температура плавления алюминия выше по сравнению с другими обычно встречающимися металлами, такими как железо, медь, латунь, магний, цинк и т. д. Температура плавления алюминия составляет 660,37 °C ( или 1220,666 °F, 933,52 K) . В то время как температура плавления оксида алюминия или глинозема сравнительно выше, чем у его чистой металлической формы, около 2000 ° C (или 3600 ° F). Именно по этой причине извлечение алюминия из глинозема осуществляется в электролизере методом электролиза.
В то время как температура плавления оксида алюминия или глинозема сравнительно выше, чем у его чистой металлической формы, около 2000 ° C (или 3600 ° F). Именно по этой причине извлечение алюминия из глинозема осуществляется в электролизере методом электролиза.
Говоря о температуре кипения алюминия, она составляет 2467,0 °C (или 4472,6 °F, 2740,15 K) . Обратите внимание, что эти температуры плавления и кипения могут немного отличаться от одних данных к другим. Этот легкий металл примечателен своей способностью к вторичной переработке. Его можно повторно использовать другими способами без каких-либо потерь. Важным этапом в процессе переработки является плавление алюминия. Первичный алюминий называется так, когда металл используется впервые, а его переработанная форма называется вторичным алюминием.
Несмотря на то, что хорошо сказано, что алюминий устойчив к коррозии, по своей природе он химически очень реактивен. Это видно из того факта, что алюминий практически не встречается в свободном доступе. Скорее всего, существует около 270 минералов, одним из ингредиентов которых является алюминий. Основной рудой алюминия являются бокситы (смесь Al 2 O 3 · x H 2 O и Fe 2 O 3 · x H 9 0023 2 О), из которых этот металл производится в массовом масштабе. Коммерческое извлечение алюминия из бокситов осуществляется по процессу Байера. Кроме бокситов, криолит (Na 3 AlF 6 ) — важный минерал алюминия.
Скорее всего, существует около 270 минералов, одним из ингредиентов которых является алюминий. Основной рудой алюминия являются бокситы (смесь Al 2 O 3 · x H 2 O и Fe 2 O 3 · x H 9 0023 2 О), из которых этот металл производится в массовом масштабе. Коммерческое извлечение алюминия из бокситов осуществляется по процессу Байера. Кроме бокситов, криолит (Na 3 AlF 6 ) — важный минерал алюминия.
Факты об алюминии
Будучи одним из самых распространенных металлов в земной коре, с алюминием связаны некоторые интересные факты. Для справки ниже приведены некоторые факты об алюминии.
- Заслуга открытия алюминия принадлежит Гансу Христиану Эрстеду, датскому физику и химику, который впервые получил алюминий в нечистом виде в 1825 году.
- Название «алюминий» происходит от латинского слова «горькая соль».0027 Алюмен . И первоначальное название было «алюминий», которое позже стало популярным как алюминий.

- Плотность металлического алюминия составляет 2,70 грамма на кубический сантиметр, поэтому он тонет в воде. Но алюминий легче других металлов.
- Алюминий является основным компонентом почвы, в которой он встречается в виде гидроксида алюминия (нерастворимое соединение). Оксидная форма алюминия используется для изготовления синтетических драгоценных камней, таких как рубины и сапфиры.
- Воздействие алюминия в избыточных количествах (особенно в ионном состоянии) опасно, приводя к нервным расстройствам, деменции, респираторным расстройствам и другим медицинским осложнениям.
Алюминий после окисления очень стабилен (в отличие от железа), что делает его отличным металлом для различных применений. Тонкий оксидированный слой, присутствующий на внешней поверхности, обеспечивает устойчивость к воде, кислоте и другим химически активным веществам. Благодаря своим характерным свойствам алюминий является вторым наиболее широко используемым металлом после железа.
Без категорий
Получайте обновления прямо в папку «Входящие»
Подпишитесь, чтобы получать последние и лучшие статьи с нашего сайта автоматически каждую неделю (плюс-минус)… прямо в папку «Входящие».
Обновления блога
Адрес электронной почты
*
Алюминий | Использование, свойства и соединения
алюминий
Посмотреть все СМИ
- Ключевые люди:
- Ганс Кристиан Эрстед
Эмиль Ратенау
Фридрих Вёлер
Чарльз Мартин Холл
- Похожие темы:
- химический элемент
обработка алюминия
элемент группы бора
См. все связанные материалы →
алюминий (Al) , также пишется как алюминий , химический элемент, легкий серебристо-белый металл основной группы 13 (IIIa, или группы бора) периодической таблицы. Алюминий является самым распространенным металлическим элементом в земной коре и наиболее широко используемым цветным металлом. В силу своей химической активности А. никогда не встречается в природе в металлическом виде, но его соединения в большей или меньшей степени присутствуют почти во всех горных породах, растительности и животных. Алюминий сосредоточен во внешних 16 км (10 милях) земной коры, из которых он составляет около 8 процентов по весу; его превосходят по количеству только кислород и кремний. Название алюминия происходит от латинского слова 9.0099 квасцы , используется для описания калиевых квасцов или сульфата алюминия-калия, KAl(SO 4 ) 2 ∙12H 2 O.
В силу своей химической активности А. никогда не встречается в природе в металлическом виде, но его соединения в большей или меньшей степени присутствуют почти во всех горных породах, растительности и животных. Алюминий сосредоточен во внешних 16 км (10 милях) земной коры, из которых он составляет около 8 процентов по весу; его превосходят по количеству только кислород и кремний. Название алюминия происходит от латинского слова 9.0099 квасцы , используется для описания калиевых квасцов или сульфата алюминия-калия, KAl(SO 4 ) 2 ∙12H 2 O.
| атомный номер | 13 |
|---|---|
| атомный вес | 26,9815384 |
| температура плавления | 660 °C (1220 °F) |
| температура кипения | |
| удельный вес | 2,70 (при 20 °C [68 °F]) |
| валентность | 3 |
| электронная конфигурация | 1 с 90 155 2 2 с 2 2 р 6 3 s 2 3 p 1 |
Возникновение и история
Алюминий встречается в основных изверженных породах ly в виде алюмосиликатов в полевых шпатах, полевых шпатах и слюдах; в полученной из них почве в виде глины; и при дальнейшем выветривании в виде бокситов и богатых железом латеритов. Бокситы, смесь гидратированных оксидов алюминия, являются основной алюминиевой рудой. Кристаллический оксид алюминия (наждак, корунд), встречающийся в некоторых магматических породах, добывается как природный абразив или в виде его более тонких разновидностей, таких как рубины и сапфиры. Алюминий присутствует в других драгоценных камнях, таких как топаз, гранат и хризоберилл. Из многих других алюминиевых минералов алунит и криолит имеют некоторое коммерческое значение.
Бокситы, смесь гидратированных оксидов алюминия, являются основной алюминиевой рудой. Кристаллический оксид алюминия (наждак, корунд), встречающийся в некоторых магматических породах, добывается как природный абразив или в виде его более тонких разновидностей, таких как рубины и сапфиры. Алюминий присутствует в других драгоценных камнях, таких как топаз, гранат и хризоберилл. Из многих других алюминиевых минералов алунит и криолит имеют некоторое коммерческое значение.
Викторина по Британике
Факты, которые вы должны знать: Викторина по периодической таблице
До 5000 г. до н.э. люди в Месопотамии изготавливали прекрасную керамику из глины, состоящей в основном из соединений алюминия, а почти 4000 лет назад египтяне и вавилоняне использовали соединения алюминия в различных химических веществах и лекарствах. Плиний ссылается на квасцы, теперь известные как квасцы, соединение алюминия, широко используемое в древнем и средневековом мире для закрепления красителей в текстиле.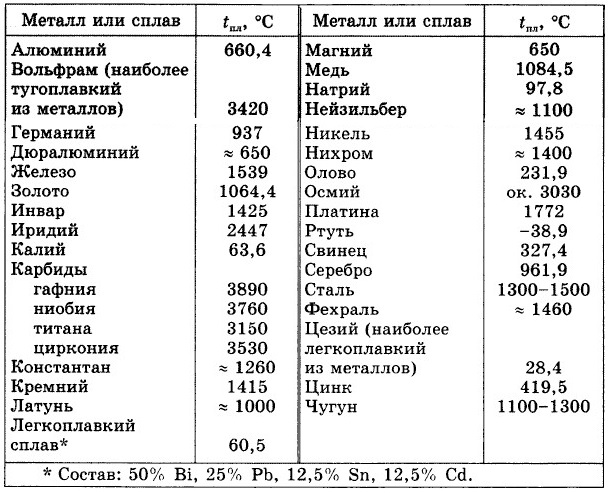 Во второй половине 18 века такие химики, как Антуан Лавуазье, признали глинозем потенциальным источником металла.
Во второй половине 18 века такие химики, как Антуан Лавуазье, признали глинозем потенциальным источником металла.
Сырой алюминий был выделен (1825 г.) датским физиком Гансом Христианом Эрстедом путем восстановления хлорида алюминия амальгамой калия. Британский химик сэр Хамфри Дэви приготовил (1809 г.) сплав железа с алюминием путем электролиза плавленого оксида алюминия (оксида алюминия) и уже назвал этот элемент алюминием; слово позже было изменено на алюминий в Англии и некоторых других европейских странах. Немецкий химик Фридрих Вёлер, используя металлический калий в качестве восстановителя, получил алюминиевый порошок (1827 г.) и небольшие глобулы металла (1845 г.), по которым он смог определить некоторые его свойства.
Новый металл был представлен публике (1855 г.) на Парижской выставке примерно в то же время, когда он стал доступен (в небольших количествах за большие деньги) путем восстановления натрием расплавленного хлорида алюминия в процессе Девиля. Когда электроэнергия стала относительно обильной и дешевой, почти одновременно Шарль Мартин Холл в Соединенных Штатах и Поль-Луи-Туссен Эру во Франции открыли (1886 г. ) современный метод промышленного производства алюминия: электролиз очищенного оксида алюминия (Al 9).0023 2 O 3 ), растворенный в расплавленном криолите (Na 3 AlF 6 ). В 1960-е годы алюминий вышел на первое место, опередив медь, в мировом производстве цветных металлов. Для получения более подробной информации о добыче, переработке и производстве алюминия, см. обработка алюминия.
) современный метод промышленного производства алюминия: электролиз очищенного оксида алюминия (Al 9).0023 2 O 3 ), растворенный в расплавленном криолите (Na 3 AlF 6 ). В 1960-е годы алюминий вышел на первое место, опередив медь, в мировом производстве цветных металлов. Для получения более подробной информации о добыче, переработке и производстве алюминия, см. обработка алюминия.
Применение и свойства
Алюминий добавляют в небольших количествах к некоторым металлам для улучшения их свойств для конкретных целей, например, в алюминиевых бронзах и большинстве сплавов на основе магния; или, для сплавов на основе алюминия, к алюминию добавляются умеренные количества других металлов и кремния. Металл и его сплавы широко используются в авиастроении, строительных материалах, потребительских товарах длительного пользования (холодильники, кондиционеры, кухонная утварь), электрических проводниках, химическом и пищевом оборудовании.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться
Чистый алюминий (99,996%) довольно мягкий и непрочный; технический алюминий (чистота от 99 до 99,6%) с небольшими количествами кремния и железа отличается твердостью и прочностью. Ковкий и очень податливый алюминий можно вытягивать в проволоку или сворачивать в тонкую фольгу. Плотность металла составляет всего около одной трети плотности железа или меди. Несмотря на свою химическую активность, алюминий обладает высокой коррозионной стойкостью, так как на воздухе на его поверхности образуется прочная оксидная пленка.
Алюминий является отличным проводником тепла и электричества. Его теплопроводность примерно вдвое меньше, чем у меди; его электропроводность, около двух третей. Он кристаллизуется в гранецентрированной кубической структуре. Весь природный алюминий представляет собой стабильный изотоп алюминия-27. Металлический алюминий, его оксид и гидроксид нетоксичны.
Алюминий медленно подвергается воздействию большинства разбавленных кислот и быстро растворяется в концентрированной соляной кислоте. Однако концентрированную азотную кислоту можно перевозить в алюминиевых цистернах, поскольку она делает металл пассивным. Даже очень чистый алюминий подвергается энергичному воздействию щелочей, таких как гидроксид натрия и калия, с образованием водорода и иона алюмината. Из-за большого сродства к кислороду мелкодисперсный алюминий при возгорании сгорает в монооксиде или диоксиде углерода с образованием оксида и карбида алюминия, но при температурах до красного каления алюминий инертен к сере.
Алюминий может быть обнаружен в концентрациях до одной части на миллион с помощью эмиссионной спектроскопии. Алюминий может быть количественно проанализирован как оксид (формула Al 2 O 3 ) или как производное азоторганического соединения 8-гидроксихинолина. Производное имеет молекулярную формулу Al(C 9 H 6 ON) 3 .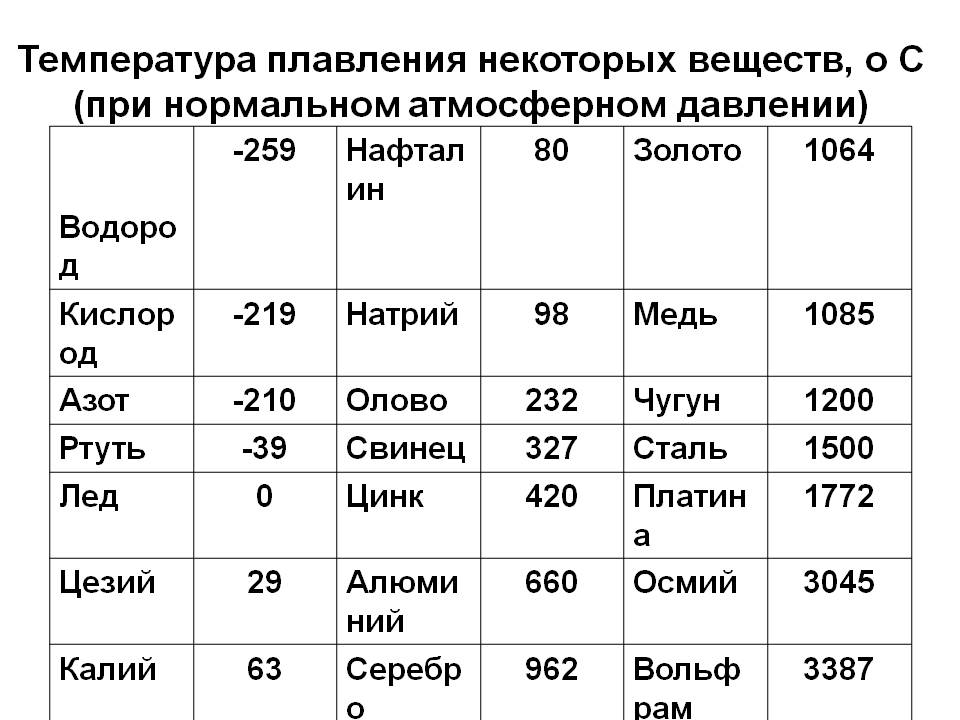
Соединения
Обычно алюминий является трехвалентным. Однако при повышенных температурах было получено несколько газообразных одновалентных и двухвалентных соединений (AlCl, Al 2 O, AlO). В алюминии конфигурация трех внешних электронов такова, что в некоторых соединениях (например, в кристаллическом фториде алюминия [AlF 3 ] и хлориде алюминия [AlCl 3 ]) голый ион Al 3+ образован потеря этих электронов, как известно, происходит. Однако энергия, необходимая для образования иона Al 3+ , очень велика, и в большинстве случаев атому алюминия энергетически выгоднее образовывать ковалентные соединения путем sp 2 гибридизация, как это делает бор. Ион Al 3+ может быть стабилизирован гидратацией, а октаэдрический ион [Al(H 2 O) 6 ] 3+ встречается как в водном растворе, так и в некоторых солях.
Ряд соединений алюминия имеет важное промышленное применение. Глинозем, встречающийся в природе в виде корунда, также производится в промышленных масштабах в больших количествах для использования в производстве металлического алюминия, а также в производстве изоляторов, свечей зажигания и различных других изделий. При нагревании оксид алюминия образует пористую структуру, которая позволяет ему поглощать водяной пар. Эта форма оксида алюминия, известная как активированный оксид алюминия, используется для сушки газов и некоторых жидкостей. Он также служит носителем для катализаторов различных химических реакций.
Глинозем, встречающийся в природе в виде корунда, также производится в промышленных масштабах в больших количествах для использования в производстве металлического алюминия, а также в производстве изоляторов, свечей зажигания и различных других изделий. При нагревании оксид алюминия образует пористую структуру, которая позволяет ему поглощать водяной пар. Эта форма оксида алюминия, известная как активированный оксид алюминия, используется для сушки газов и некоторых жидкостей. Он также служит носителем для катализаторов различных химических реакций.
Анодный оксид алюминия (ААО), обычно получаемый электрохимическим окислением алюминия, представляет собой наноструктурированный материал на основе алюминия с очень уникальной структурой. AAO содержит цилиндрические поры, которые можно использовать для различных целей. Это термически и механически стабильное соединение, а также оптически прозрачное и электрическое изолятор. Размер пор и толщину AAO можно легко адаптировать для определенных приложений, в том числе в качестве шаблона для синтеза материалов в нанотрубки и наностержни.
Другим важным соединением является сульфат алюминия, бесцветная соль, полученная действием серной кислоты на гидратированный оксид алюминия. Коммерческая форма представляет собой гидратированное кристаллическое твердое вещество с химической формулой Al 2 (SO 4 ) 3 . Он широко используется в производстве бумаги в качестве связующего для красителей и в качестве поверхностного наполнителя. Сульфат алюминия соединяется с сульфатами одновалентных металлов с образованием гидратированных двойных сульфатов, называемых квасцами. Квасцы, двойные соли формулы MAl(SO 4 ) 2 ·12H 2 O (где M представляет собой однозарядный катион, такой как K + ), также содержат ион Al 3+ ; М может быть катионом натрия, калия, рубидия, цезия, аммония или таллия, а алюминий может быть заменен множеством других ионов М 3+ , например галлия, индия, титана, ванадия, хрома, марганца. , железо или кобальт. Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
Реакция газообразного хлора с расплавленным металлическим алюминием дает хлорид алюминия; последний является наиболее часто используемым катализатором в реакциях Фриделя-Крафтса, т. Е. Синтетических органических реакциях, связанных с получением самых разных соединений, включая ароматические кетоны, антрохинон и его производные. Гидратированный хлорид алюминия, широко известный как хлоргидрат алюминия, AlCl 3 ∙H 2 O, используется в качестве местного антиперспиранта или дезодоранта для тела, который сужает поры. Это одна из нескольких солей алюминия, используемых в косметической промышленности.
Гидроксид алюминия, Al(OH) 3 , используется для водонепроницаемости тканей и для производства ряда других соединений алюминия, включая соли, называемые алюминатами, которые содержат группу AlO − 2 .
