Типы электродов: Виды сварочных электродов. Какие марки применять в конкретном случае
Содержание
Различные типы электродов, используемые в орбитальной TIG-сварке
Вольфрамовые электроды классифицируются на основе химического состава. Более подробную информацию см. в стандарте ISO 6848 (ANSI/AWS A5.12-92).
Электрод состоит либо из чистого вольфрама, либо из вольфрама с добавлением сплавов или оксидов.
Сводная таблица всех типов вольфрамовых электродов, используемых в орбитальной tig-сварке:
Электрод из чистого вольфрама (зеленого цвета)
Используется при ограниченной плотности тока, главным образом с переменным током для сварки алюминиевых сплавов, на краю образуется аккуратный шарик, обеспечивая стабильность дуги.
Чистый вольфрам не рекомендуется для сварки постоянным током из-за среднего качества зажигания и стабильности дуги. Также этот тип электрода может привести к попаданию вольфрама в сварочную ванну.
Преимущества
Основное преимущество – низкая стоимость
Вольфрамовый электрод с цирконием (белого цвета 0,7-0,9% и коричневый от 0,15-0,50%)
Речь идет о стандартном электроде для сварки алюминия с использованием переменного тока.
Преимущества
Качество зажигания и стабильность дуги, допустима высокая плотность тока, снижение риска попадания вольфрама в сварку.
Вольфрамовый электрод с торием (желтого цвета 1%, красного цвета 2% и фиолетового цвета 3%)
Самый известный и распространенный электрод в мире ручной TIG-сварки.
Допускается работа с очень высокой плотностью тока, лучший уровень испускания электронов, умеренная температура электрода, минимизация рисков засорения сварки включениями вольфрама (неиспускаемый элемент).
Вольфрам с торием используется главным образом с постоянным током. Переменный ток используется редко, поскольку в этом случае сложно поддерживать правильность формы шарика на конце электрода.
Недостатки
Торий имеет очень низкий уровень радиоактивных оксидов, поэтому его используют все реже и реже (из соображений гигиены и безопасности). Необходимость защиты при заточке электрода.
Вольфрамовый электрод с церием (серого цвета 1,8-2,2%)
Этот тип электрода появился в США в начале 80-х годов и обогнал модель с торием благодаря нерадиоактивным оксидам.
Он выдерживает такую же плотность тока, как и вольфрамовый, имеет продолжительный срок службы и, самое главное, обеспечивает отличное зажигание и превосходную стабильность.
Преимущества
Универсальный: работает и с постоянным, и с переменным током, активно используется для всех вариантов автоматизированной TIG-сварки.
Вольфрамовый электрод с лантаном (черного цвета 0,8-1,2%, золотистого цвета 1,3-1,7%, синего цвета 1,8-2,2%)
Этот тип электрода очень похож на ториевый.
Преимущества
Универсальный: работает и с постоянным, и с переменным током, активно используется для всех вариантов автоматизированной TIG-сварки. Не имеет рисков радиоактивности
Недостатки
Его характеристики менее совершенны, чем у тория.
Вольфрамовый электрод с церием и лантаном (розового цвета)
Сегодня широко используются вольфрамовые электроды с церием или лантаном, или же с ними обоими без риска радиоактивного воздействия. Они настолько же эффективны, как вольфрамовые электроды с торием.
Преимущества
Упрощенное зажигание и большой срок службы. Это отличный компромисс!
Классификация электродов:
Вас интересуют технологии орбитальной сварки? Предлагаем скачать наш справочник, чтобы правильно выбрать электрод для орбитальной сварки!
Сварочные электроды | Электроды от Электродгруп | Производство электродов МР, УОНИ, ОЗС, АНО,
При осуществлении сварочных работ одним из главных условий качественного результата является внимательный выбор соответствующей продукции, в частности – сварочных электродов. Они классифицируются по различным признакам.
В зависимости от покрытия, электроды можно разделить на 4 основные группы – рутиловые, основные, кислые и целлюлозные (подробнее о каждой разновидности читайте в статье Покрытие электродов). Также электроды подразделяются в зависимости от длины и диаметра, материала изготовления, характеристикам шва и другим показателям. Как правило, на выбор той или иной разновидности во многом влияет классификация электродов согласно ГОСТ.
Как правило, на выбор той или иной разновидности во многом влияет классификация электродов согласно ГОСТ.
Типы электродов для сварки согласно ГОСТ
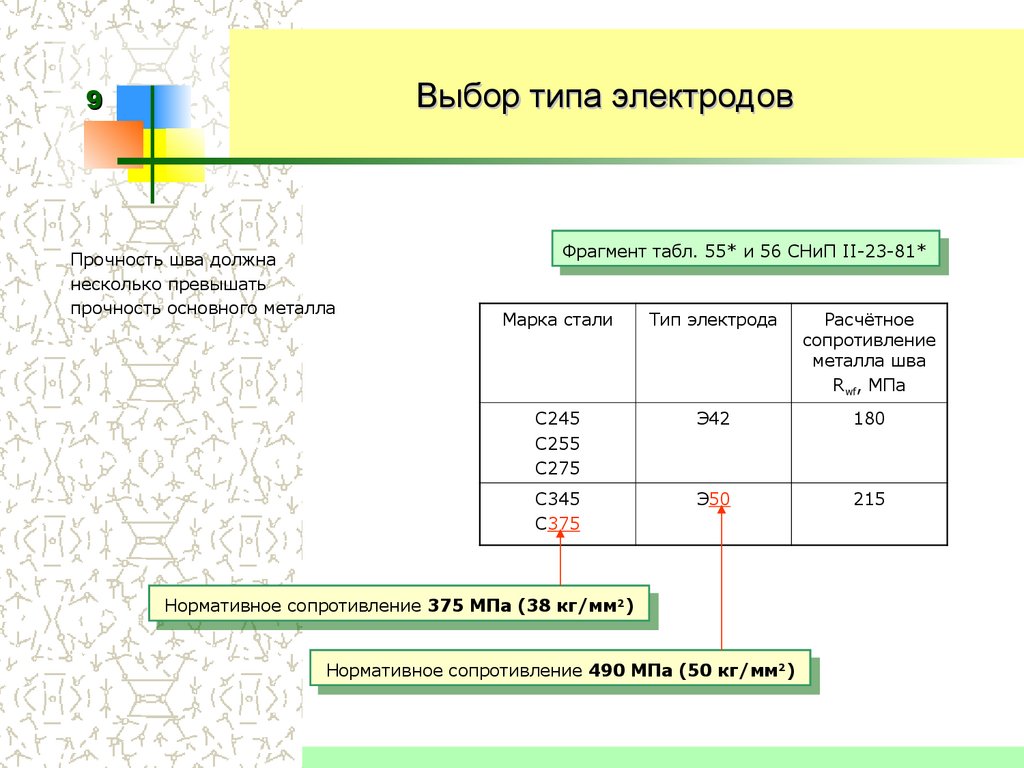
По ГОСТу разделение и типизация электродов осуществляется в зависимости от номинального напряжения, рода и полярности тока. К примеру, широко используемый в практике электрод э50а расшифровывается следующим образом: э – электрод; 50 — минимальное гарантируемое временное сопротивление разрыву, установленное ГОСТом; а – улучшенный тип электрода. Внутри каждого типа электродов возможны существенные технологические различия в зависимости от марки.
Электроды типа э42
Электроды э42 применяются для сварки углеродистых и низколегированных конструкционных сталей. При использовании этого типа, к примеру, самой распространенной маркой электродов по типу э42 является АНО-6 , формируется ровный и прочный шов с хорошо отделяемой шлаковой коркой.
Электроды типа э42а
Электроды 42а, как можно выяснить из названия, являются улучшенным вариантом типа э42, применяемым в тех рабочих ситуациях, когда предъявляются более высокие требования к условиям сварки, обусловленные структурой и составом металла. К электродам типа э42а относятся УОНИ 13/45 и другие марки электродов этого типа применяются для сварки конструкций, подвергающихся агрессивным внешним воздействиям – высокому давлению, отрицательным температурам и др.
Электроды типа э46
Электроды, относящиеся к типу э46, как правило, имеют рутиловое покрытие. Свойства этих марок электродов обеспечивают минимальное разбрызгивание во время сварки, благодаря чему в результате работы формируется ровное и аккуратное соединение. К электродам типа э46 относятся МР-3, МР-3С, ОЗС-4, ОЗС-6, ОЗС-12, АНО-4, АНО-21 и многие другие.
Электроды типа э50а
Марки электродов типа э50а, например, УОНИ 13/55, или японские LB-52U характеризуются широким диапазоном применения. Они также могут использоваться для обеспечения соединения, стойкого к агрессивным средам, воздействию низких температур и давления.
Они также могут использоваться для обеспечения соединения, стойкого к агрессивным средам, воздействию низких температур и давления.
Электроды других типов
Все типы электродов представлены в многочисленных марках, каждая из которых характеризуется своими особенностями и преимуществами. Чтобы подобрать оптимальную разновидность, необходимо внимательно ознакомиться с её характеристиками.
Газовый электрод, электрод из металлической соли и т. д.
Наука > Химия > Электрохимия > Типы электродов
В этой статье мы изучим различные типы электродов, их представление, написание клеточных реакций и нахождение ЭДС. клетки.
Есть
четыре типа электродов
- Газовые электроды
- Электроды на основе малорастворимых солей металлов
- Металло-ионные электроды
- Редокс-электроды
Газовые электроды:
Газовый электрод состоит из газа (например, h3, Cl2, O2), находящегося в контакте с раствором, содержащим ионы, образующиеся из газа, напр. Н+, Cl-, ОН-. Потенциал газового электрода зависит от концентрации его ионов в растворе и давления газа.
Н+, Cl-, ОН-. Потенциал газового электрода зависит от концентрации его ионов в растворе и давления газа.
Газовый электрод состоит из газа, барботируемого вокруг инертной металлической проволоки (платинированный платиновый электрод), погруженной в раствор, содержащий ионы, с которыми газ необратим. Платина используется в качестве проводника и для адсорбции газа. например Стандартный водородный электрод.
Примеры газовых электродов:
Стандартный водородный электрод (SHE):
SHE is
представлен как
Pt| H 2(г) (1 атм.)| H + (водный)
(1 м)
Половинка
клеточные реакции:
H 2(g) → 2H + (водн.) + 2e –
(окисление) (L.H.S.)
2H + (водн.) + 2e – → H 2(г)
(уменьшение) (правая сторона)
Потенциалу электрода произвольно присваивается нуль. Этот
электрод катионный электрод.
Электрод для газообразного хлора:
Этот
электрод — анионный электрод. Хлоргазовый электрод представлен
как,
Pt| Cl 2(г) (1 атм.)| Cl – (водный)
(1 м)
Половинка
клеточные реакции:
2Cl – (водн.) → Cl 2(г) + 2e –
(окисление) (Л.В.С.)
Cl 2(г) + 2e – → 2Cl – (водн.)
(восстановление) (R.H.S.)
Кислородный электрод:
Кислородный газ
электрод представлен как,
Pt | O 2(г) (1 атм)| ОН – (водный)
(1M)
Половинка
реакция клетки
4OH – → 2H 2 O+ O 2(g) + 4e –
(окисление) (Л.В.С.)
2H 2 O + O 2(g) + 4e – →
4OH – (восстановление) (R.H.S.)
Электрод на основе малорастворимой соли металла:
Реверсивный
анионный электрод также называют металл-умеренно растворимой солью металла.
электрод. В этом электроде металл, малорастворимая соль металла в
равновесие с раствором, содержащим тот же анион, что и труднорастворимый
соль. например Каломельный электрод.
Металлоионные электроды:
В этом случае металлическая полоса находится в контакте с раствором водорастворимого солевого катиона того же металла.
напр. Zn (с) |
Zn ++ (водный)
В
в электрохимической ячейке электрод с более высоким потенциалом окисления подвергается
окисления и действует как анод или отрицательный электрод и электрод, имеющий
меньший потенциал окисления подвергается восстановлению и действует как катод или
положительный электрод.
Примеры электродов металл-ионы металла:
Zn (s) | Zn ++ (водный)
Zn (s) → Zn ++ (водн.) +
2e – (Окисление)
Zn ++ (водн. ) + 2e – → Zn (s)
) + 2e – → Zn (s)
(Сокращение)
Cu (s) | Cu ++ (водн.)
Cu (тв.) → Cu ++ (водн.) +
2e – (Окисление)
Cu ++ (водн.) + 2e – → Cu (s)
(Уменьшение)
Окислительно-восстановительный электрод:
В этих
электродов инертный металл типа Pt погружают в раствор, содержащий ионы
активный металл в двух различных степенях окисления.
Пл | Fe 2+ , Fe 3+
Fe 2+ → Fe 3+
e – (Окисление)
Fe +++ + e –
→ Fe ++ (восстановление)
Pt | Сн 2+ , Сн 4+
Sn 2+ → Sn 4+ +
2e – (Окисление)
Sn 4+ + 2e – →
Sn 2+ (Редукция)
Запись клеточной реакции и нахождение Э. Д.С. ячейки:
Д.С. ячейки:
Окислительно-восстановительный потенциал:
Потенциал, возникающий благодаря способности ионов терять или приобретать электроны, образуя более высокую или более низкую стабильную степень окисления, называется окислительно-восстановительным потенциалом.
Редокс
потенциал зависит от соотношения концентраций двух типов ионов.
Пт | Fe 2+ (водн.) (1M), Fe 3+ (водн.) (1M) E 2 ox =
– 0,771 В
Представление ячеек, содержащих стандарт и эталон
электроды:
А ячейка
состоит из контакта цинкового стержня с 1-молярным раствором иона цинка и насыщенного
каломельный электрод.
Zn (с) | Zn 2+ (1M) || KCl (водный) (насыщенный) |
Hg 2 Cl 2(s) |Hg (л) , тел +
Ячейка состоит из SHE и насыщенного каломельного электрода
Pt | H 2(г) (1 атм)| H + (водный)
(1М) || KCl (водн.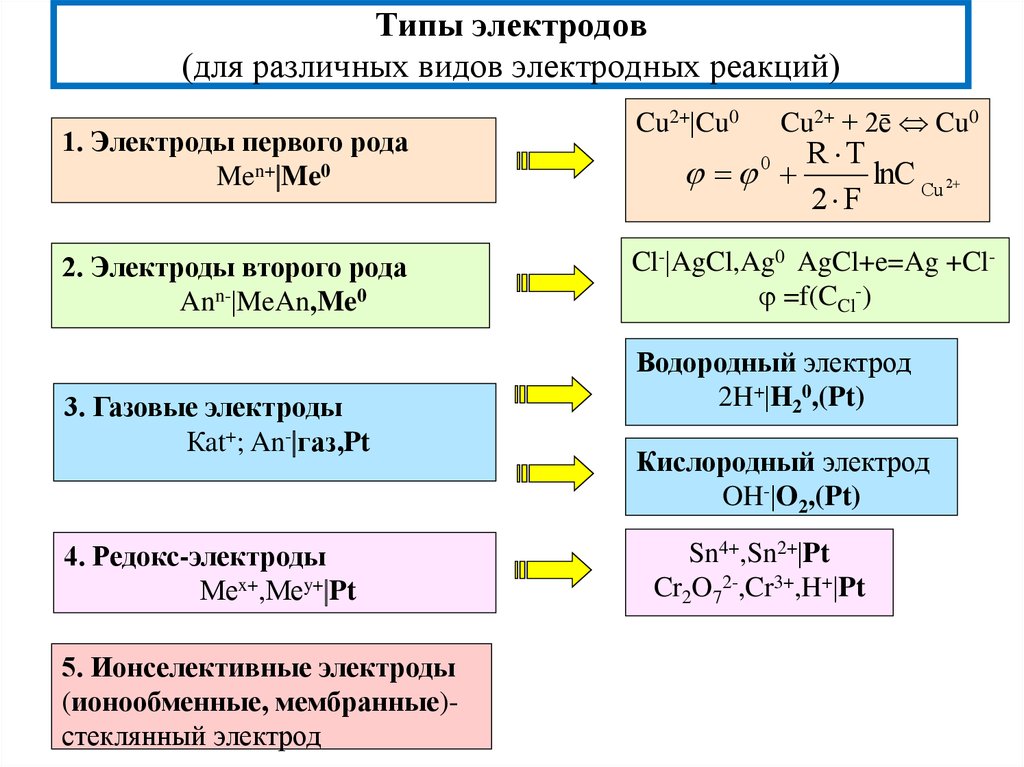 ) (насыщенный)|Hg 2 Cl 2(тв) | рт.ст. (л)
) (насыщенный)|Hg 2 Cl 2(тв) | рт.ст. (л)
,Pt +
Реакции ячеек:
Шаги для записи реакции ячейки гальванического элемента:
- Представьте данный гальванический элемент со стандартным соглашением.
- Электрод в левой части изображения показывает, что он является анодом и на этом электроде происходит окисление. Напишите для него реакцию полуклеточного окисления полуклеточную реакцию.
- Электрод в правой части изображения показывает, что он является катодом и на этом электроде происходит восстановление. Напишите для него полуклеточную реакцию восстановления полуклеточной реакции.
- Баланс выше двух реакций для электронов для реакции окисления и восстановления.
- Добавьте две реакции и получите чистую (общую) клеточную реакцию.
Шаг
– 1: Представьте ячейку условно:
Pb (s) | Pb 2+ (водн. ) (1M)
) (1M)
|| Ag + (водн.) (1M)| Ag (s) +
Шаг
– 2: Напишите реакцию полуэлемента слева: Pb(s) находится в левой части изображения.
что это анод, и окисление происходит на Pb(s) электроде.
Pb (т) → Pb 2+ (водн.)
+ 2e – (Окисление) … (1)
Шаг
– 3: Напишите реакцию правой половины ячейки: Ag (s) находится в правой части представления
показывает, что это катод и восстановление происходит при Ag (с)
электрод.
Ag + (водный) + e –
→ Ag (s) (Сокращение) … (2)
Шаг
– 4: Сбалансируйте электроны двух вышеуказанных реакций половинной ячейки:
Умножьте уравнение (2) на 2, чтобы сбалансировать электроны.
2Ag + (водный) + 2e –
→ 2Ag (s) (Сокращение) … (2)
Шаг
– 5: Складывая уравнения (1) и (3), получаем
общая реакция.
Pb (т) + Ag + (водн.)
→ Pb 2+ (водн.) + Ag (s)
Действия по нахождению ЭДС. гальванического элемента:
- Представление данного гальванического элемента в соответствии со стандартными условными обозначениями.
- Электрод в левой части изображения показывает, что он является анодом и на этом электроде происходит окисление.
- Электрод в правой части изображения показывает, что он является катодом и на этом электроде происходит восстановление.
- Получите стандартные значения потенциала окисления из электродвижущего ряда для материала катода и анода.
- Используйте следующую формулу для расчета Э.Д.С. клетки.
E o Ячейка = E o (вол/катод)
– E o (вол/анод)
ИЛИ
E o Ячейка = E o (вол/катод) +
E или (красный/анод)
Чтобы найти э. д.с. Daniel Cell:
д.с. Daniel Cell:
Шаг
– 1: представить ячейку условно
Шаг
– 2: Определите анод и катод: Pb(s) является
в левой части изображения видно, что это анод и окисление
происходит на Pb(s) электроде. Ag(s) находится на правой стороне
изображении видно, что это катод и восстановление происходит при
Ag(s) электрод.
Шаг
– 3: Получить значения потенциала окисления или
восстановительный потенциал для электродов из электрохимической серии
E o (ox/Zn) = 0,76 В и EE o (ox/Cu)
=-0,34 В
Шаг
– 4: рассчитать ЭДС ячейки:
E o Cell = E o (вол/катод)
– E (окс/анод)
E o Ячейка = E o (ox/Zn)
– E o (ox/Cu)
E o Ячейка
= 0,76 – (- 0,34)
E o Ячейка =
0,76 +0,34
E O Cell = 1,1 В
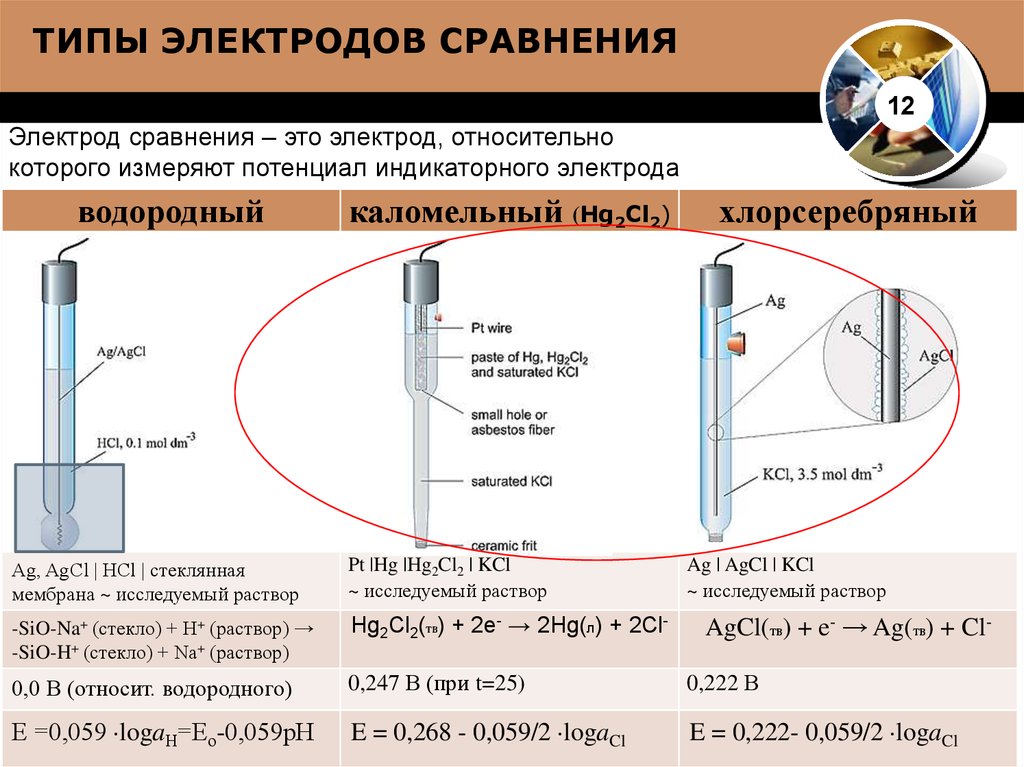
Предыдущая тема: Справочные электроды
Следующая тема: Теория Nersnt of Electrode Потенциал
Следующая Отделение:
Sciemy> Chemistry> Electrchem9
. Типы электродов
Типы электродов
Сколько типов электродов у нас есть?
15 января 2021 г. 15 января 2021 г.
| 10:06
Электрод является жизненно важным компонентом электрохимических элементов. Это точка, в которой ток входит и выходит из электролита. Точка, в которой ток покидает электроды, называется катодом. Точка, куда входит ток, называется анодом. Эти электроды доступны в различных типах, например:
Газовые электроды:
Газовый электрод включает различные газы, такие как h3, Cl2 и O2, в контакте с раствором, содержащим ионы, получаемые из газа, такого как H+, Cl-, OH -. Потенциал газового электрода зависит от интенсивности его ионов в растворе и силы газа. Газовый электрод барботирует газ вокруг инертной металлической проволоки, включенной в раствор, содержащий ионы, с которыми газ постоянен.
Электрод на основе малорастворимой соли металла:
Электрод на основе малорастворимой соли металла также известен как обратимый анионный электрод. В электроде этого типа металл и труднорастворимая соль металла находятся в равных пропорциях с раствором, содержащим тот же анион, что и труднорастворимая соль.
В электроде этого типа металл и труднорастворимая соль металла находятся в равных пропорциях с раствором, содержащим тот же анион, что и труднорастворимая соль.
Электроды металл-металл-ион:
В этом случае кусок металла помещают в раствор водорастворимого катиона, несущего соль соответствующего металла. В электрохимической ячейке электрод с более высоким окислительным потенциалом подвергается окислению и служит анодом/отрицательным электродом. Электрод с более низким потенциалом окисления испытывает потери и действует как катод/положительный электрод.
Каломельный электрод:
Исходный электрод, содержащий молекулы ртути и хлорида ртути. Он изготовлен из жидкой элементарной ртути и твердой пасты Hg2Cl2, соединенной со стержнем, покрытым насыщенным раствором KCl. Необходимо использовать насыщенный раствор, так как это обеспечивает действие хлорида калия и минимальное напряжение, более похожее на стандартный водородный электрод, т. е. СВЭ. Этот насыщенный раствор позволяет осуществить перенос ионов хлора.
Серебряно-хлоридный электрод:
Электрод этого типа прессует соль в растворе, который связывается с результатом электрода. Этот электрод содержит твердое серебро и осажденную соль AgCl. Это обычно используемый электрод сравнения, потому что он разумен и не очень токсичен. Электрод из хлорида серебра-серебра изготавливается с использованием нити из твердого серебра и путем кодирования его в AgCl. Затем его помещают в пробирку с раствором AgCl и KCl. Это позволяет ионам образовываться по мере движения электронов в систему электродов и из нее.
pH-электрод:
Пожалуй, самый полезный и надежный способ определения pH — использование стеклянного электрода. рН-электрод зависит от ионного обмена в гидратированных слоях, построенных снаружи стеклянного электрода. Стекло состоит из силикатной сетки, в которой ионы металла координированы с частицей кислорода, и именно ионы металла взаимодействуют с H+. Стеклянный электрод действует как батарея, напряжение которой зависит от движения H+ в растворе, в котором он находится.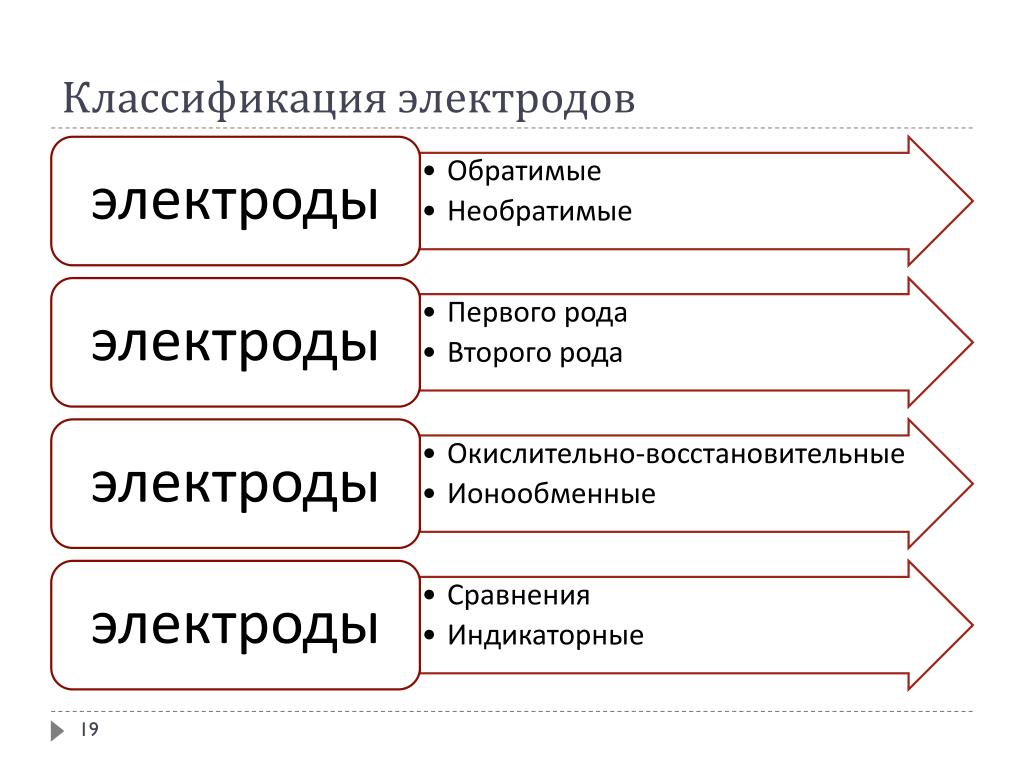
Ионоселективные электроды:
Ионоселективный электрод реагирует на действие селективного иона. Предположим, что некоторые из атомов несвободны и сохраняются в виде компактной структуры или необъяснимого осадка. В этом случае эти электроды обеспечат гораздо более низкие показания, чем метод, который идентифицирует все присутствующие ионы. Обычно используются ионоселективные электроды K+, Ca2+ и NO-3. Возможно, что электрод является ионоселективным, но он не будет ионоселективным.
Газочувствительные электроды:
Они обычно используются для определения интенсивности газа путем его взаимодействия с тонким слоем, окружающим ион-чувствительный электрод, обычно pH-электрод. Диоксид серы, диоксид углерода и аммиак можно измерить по их растворению в тонком слое, окружающем pH-электрод и содержащем результирующий pH покрытия.
Кислородный электрод Кларка:
Этот электрод состоит из платинового катода и серебряного анода, включенных в один и тот же раствор насыщенного хлорида калия и изолированных от исследуемого раствора кислородно-пористой пленкой.