В виде чего встречается латунь в природе: ЛАТУНЬ • Большая российская энциклопедия
Медь — металл красного цвета.
Плотность 8,93 г/см3, температура
плавления 1083°С, температура кипения
2310°С. В чистом виде хорошо куется и
обладает высокой тягучестью.
В природе встречается как в самородках,
так и в составе различных руд.
Самородная медь легко обрабатывается,
а изготовленные из нее детали имеют
привлекательный вид, что способствовало
использованию меди человеком намного
раньше других металлов для изготовления
различных орудий труда и предметов
домашнего обихода.
В настоящее время медь добывают из руд.
Медные руды содержат большое количество
различных примесей, поэтому их сначала
обогащают методом флотации, а затем уже
получают в чистом виде.
Качество меди определяется ее примесями,
которые довольно разнообразны и
непостоянны. Наиболее опасными примесями
меди считаются висмут и свинец. Они не
растворяются в меди и образуют
легкоплавкие эвтектики (структура,
определяемая одновременным
затвердеванием двух фаз металла).
По существующей маркировке Государственного
комитета СССР по стандартам наивысшая
марка меди нулевая (МО) может содержать
не более 0,1 % примесей. В низших по качеству
марках общее количество примесей доходит
до 1 %.
144
На поверхности чистой меди в сухой среде
образуется очень тонкая пленка окислов,
которая является хорошей защитой от
окисления более глубоких ее слоев.
Во влажной среде или в присутствии
двуокиси углерода на поверхности
меди появляется зеленоватый налет —
карбонат меди, который очень ядовит для
организма. С повышением температуры
окисление меди усиливается.
Растворяется медь легко в серной и
азотной кислотах, аммиаке и других
растворителях.
Медь обладает высокой тепло- и
электропроводностью, поэтому около
половины всей добываемой меди идет на
изготовление электрических проводов.
Из меди также изготовляют заводскую
аппаратуру, котлы, чаны и др.
Широкое применение в машиностроении,
аппаратурной технике и других отраслях
народного хозяйства нашли сплавы, в
состав которых в различных пропорциях
входит медь. Среди этих сплавов наиболее
важными являются латунь, бронза,
нейзильбер и др.
Латунь — технический сплав меди с
цинком. Государственный комитет СССР
по стандартам маркирует сорта латуни
буквой «Л» с последующей цифрой,
означающей процентное содержание меди
в сплаве, например Л-90—латунь, содержащая
90 % меди и 10 % цинка. В практике эта латунь
известна под названием «Томпак». По
свойствам сплав близок к меди, но имеет
желтоватый оттенок.
Латунь Л-68 содержит 68 % меди и 32 % цинка.
В практике она называется патронной,
или гильзовой, латунью. Отличается
повышенной прочностью и твердостью
по сравнению с чистой медью.
Технические латуни имеют хорошую
пластичность, легко прокатываются
до тончайших листов при обычной
температуре, но с рекристаллизационными
отжигами на некоторых промежутках.
Промежуточный отжиг необходим для
предупреждения коррозийного
растрескивания, так как со временем в
изделиях из латуни, содержащей участки
напряжения, происходит самопроизвольное
растрескивание. Промежуточный отжиг
снимает участки напряжения.
Отжиг проводят в муфельных печах при
температуре не более 250…300 °С. При более
высоких температурах отжиг не только
не предупреждает от образования трещин,
а даже способствует их появлению, что
объясняется присутствием некоторого
количества свинца. Только чистую, не
содержащую свинца, латунь можно
подвергать отжигу при более высоких
температурах.
Бронза — сплав меди с алюминием,
кремнием, бериллием или другими
элементами. Соответственно присутствующему
элементу бронза называется алюминиевой,
кремнистой, бериллиевой и др.
Перечисленные виды бронзы сравнительно
новые и отличаются от наиболее давних
оловянистых более высоким коэффициентом
145
усадки и более высокими показателями
механических и химических свойств.
Кроме того, бериллиевая бронза по
сравнению с другими видами имеет высокую
твердость и упругость.
Нейзильбер — сплав меди с цинком,
никелем и др. Содержит около 50 % меди,
18…22 % цинка и 13,5… 16,5 % никеля.
Сплав серебристого цвета. Температура
плавления 1000…1200°С, твердость по Бринеллю
80 кг/см2. Обладает хорошими
механическими и антикоррозийными
свойствами. В полости рта нейзильбер
покрывается тонкой окиспой пленкой,
которая предохраняет изделие от
более глубоких разрушений.
В ортопедической практике используется
для изготовления временных
челюстно-лицевых и ортодонтических
аппаратов, а также репонирующих
приспособлений.
Раньше из нейзильбера изготовляли
штампованные каппы. После внедрения
в практику акриловых пластмасс применение
штампованных металлических капп
резко сократилось.
До внедрения в стоматологическую
практику нержавеющей стали были сделаны
попытки изготовления из нейзильбера
несъемных конструкций протезов
(коронок, мостовидных протезов и др. ).
).
Соединение отдельных частей таких
протезов осуществлялось при помощи
серебряного припоя.
Для зубопротезных целей медь в чистом
виде не применяется, но широко используется
в различных сплавах. Она входит в состав
сплавов золота, платины и припоев.
Некоторые сплавы меди нашли применение
для изготовления временных ортодонтических
и челюстно-лицевых аппаратов, колец для
получения слепков при изготовлении
трехчетвертных коронок. В челюстно-лицевой
ортопедии и ортодонтии в качестве
лигатур применяют латунную проволоку.
Из сплавов меди изготавливают также
некоторые инструменты и мелкое
оборудование—молотки, кюветы и др.
\ Алюминий — металл серебристо-белого
цвета. По распространенности в природе
занимает первое место среди металлов.
‘Он входит в состав глин, полевых шпатов,
слюды и других минералов.
Впервые алюминий получен Валером в 1827
г. Первый алюминиевый завод в СССР
был построен в 1932 г. , однако уже в 1935 г.
, однако уже в 1935 г.
СССР по производству алюминия занимал
третье место в мире.
Главное достоинство алюминия —его
легкость. Он почти в 3 раза легче меди
и железа. Плотность 2,72 г/см3,
температура плавления 658 °С, температура
кипения 1800 °С, коэффициент расширения
при нагревании 0,0000225. Обладает хорошей
электро- и теплопроводностью,
пластичностью.
Алюминий маркируется по чистоте. Алюминий
высшей марки (АОО) содержит до 0,3% примесей,
низшей—до 3,5 %. Постоянными примесями
алюминия являются железо и кремний.
146
При обычной температуре на воздухе
алюминий быстро покрывается тонким
слоем окисной пленки (А1г0з), которая в
дальнейшем предохраняет его от
коррозии. Чем чище алюминий, тем выше
его антикоррозийные свойства.
Алюминий легко растворяется в разбавленной
азотной, серной. и соляной кислотах.
Весьма неустойчив к растворам поваренной
соли,
Легкость и хорошая антикоррозийная
стойкость металла способствовали
его широкому применению. В настоящее
В настоящее
время алюминий получил широкое
распространение для алитирования —
покрытия поверхности стальных и
чугунных изделий алюминием с целью
защиты этих изделий от окисления при
нагревании.
Стальные изделия, подвергшиеся
алитированию, не окисляются на воздухе
даже при нагревании до 900 °С.
По электропроводности алюминий уступает
меди, но его большое преимущество в
легкости способствовало тому, что
алюминий постепенно вытесняет медь как
материал для изготовления электрических
проводов.
Сплавы алюминия нашли широкое применение
в авиационной и автомобильной
промышленности, а также в других отраслях
народного хозяйства, особенно в быту.
Среди сплавов, содержащих алюминий,
получили распространение сложные
сплавы, наиболее важными из которых
являются дюралюминий (дюраль), силумин,
магнолий, уранит и др.
В стоматологической практике алюминий
используется в виде алюминиевой проволоки
диаметром 1,5—2 мм для изготовления
проволочных шин типа шин Тигерштедта
и других видов. Из алюминиевой бронзы
Из алюминиевой бронзы
(сплава алюминия и меди) изготовляют
несъемные каппы и лигатурную проволоку.
Были сделаны попытки применения сплавов
алюминия—ура-ния и магналия (80 ч. алюминия
и 20 ч. магния) для изготовления базисов
пластинчатых протезов. Однако ввиду
сложности технического характера,
плохой пайки и сварки отдельных частей
протезов, что затрудняло укрепление
искусственных зубов на базисной пластинке
*, мягкости алюминия и его сплавов,
приводящей к деформации базисов, а
также вследствие того, что алюминий
разлагается под влиянием слюны и
оказывает вредное влияние на организм,
алюминий и его сплавы как базисный
материал не нашли применения в
стоматологической практике.
Дюралюминий, или дюраль (от фр.
(1иг—твердый), содержит около 94 %
алюминия, 4 % меди, 1 % магния, 1 % марганца
и не-
* Пайка и сварка
алюминиевых сплавов образует швы,
которые по прочности уступают
основному металлу. Более надежное
соединение алюминиевых частей на
заклепках.
147
которое количество железа и кремния.
Кремний и железо являются неизбежными
спутниками сплава вследствие применения
недостаточно чистого алюминия.
Марганец вводится для повышения
антикоррозийных свойств. Основным
достоинством сплава является то, что
при плотности, близкой к плотности
алюминия, он имеет высокую прочность
и твердость. Твердость дюраля по Бринеллю
1200 гк/см2 (почти равна твердости
мягкой стали), температура плавления
605 °С.
Дюраль широко используется в авиационной
промышленности, судостроении и других
отраслях народного хозяйства. До
внедрения акриловых пластмасс в
стоматологическую практику широко
применялся для изготовления капп и
других ортопедических и че-люстно-лицевых
аппаратов. В настоящее время в зубопротезной
технике применяется редко, в основном
для изготовления временных аппаратов
и некоторого оборудования (кюветы,
кюветные рамки и др.).
Пайка дюралюминиевых деталей недостаточно
прочная и осуществляется при помощи
олова. СОзХ
СОзХ
ХСаСОз), а также некоторые другие
соединения, в том числе сульфаты и
хлориды.
Первоначально магний получали путем
электролиза хлористого магния, а
несколько позже стали получать путем
электролиза карналлита. Известный
электролитический способ получения
магния основан на восстановлении окиси
магния (М§0) при температуре около 2000
°С.
Магний—один из самых легких металлов,
используемых в промышленности. Его
плотность 1,74 г/см3, твердость по
Бринеллю 30 кг/см2, температура
плавления 650 °С, температура кипения
1126°С .Обладает пластичностью только в
нагретом состоянии. В химическом
отношении очень неустойчив. Хорошо
растворя-
148
ется в кислотах. При нагревании в
присутствии кислорода воздуха легко
воспламеняется и горит ярко-белым
пламенем, что используется в
фототехнике. На воздухе мало применяется,
так как покрывается тонким слоем
окиси, которая защищает его от дальнейшего
окисления. -48Ю2НгО) и асбест (СаО-ЗМ§0-45Ю2). В
-48Ю2НгО) и асбест (СаО-ЗМ§0-45Ю2). В
зубопротезной технике тальком
посыпают гипсовые модели для предупреждения
прилипания воска во время проведения
модели-ровочных работ. Он входит в состав
некоторых термопластических и
эвгенолоксицинковых слепочных материалов.
Асбест применяется при пайке
мостовидных и других конструкций
протезов и аппаратов, если пайка
осуществляется вне модели. Кроме того,
он используется как термоустойчивая
прокладка в обогревательных приборах,
литейных печах и др.
Свинец — металл голубовато-белого
цвета. В природе находится в виде
различных соединений, наиболее важным
из которых является свинцовый блеск
(РЬ5).
Чистый свинец тяжелый, но очень мягкий
металл. Его плотность 11,34 г/см3,
температура плавления 327,3 °С, температура
кипения 1555 °С. Обладает плохой
электропроводностью.
На воздухе быстро покрывается тонким
слоем окиси, которая-предохраняет от
окисления более глубокие его слои.
Хорошо растворяется в азотной и
уксусной кислоте, а также щелочах,
образуя при этом токсичные соединения.
Свинец широко используется в аккумуляторной
промышленности и для изготовления
боеприпасов. Он входит также в состав
некоторых красителей.
В соединении с другими материалами
используется для изготовления
подшипников и прокладок в некоторых
аппаратах, в том числе в паровых
стерилизаторах и вулканизаторах.
Входит в состав легкоплавких сплавов
типа меллот-металл, из которых изготовляют
штампы и контрштампы для коронок и
других деталей. На свинцовых прокладках
(плитках) производится
149
обивка гильз перед штамповкой коронок.
Обивка гильз из золото-платиновых
сплавов на свинцовых подкладках
нежелательна.
Цинк — металл синевато-белого цвета.
Содержание в земной коре составляет до
0,02 %. Добывают цинк из рудных соединений,
главным образом, цинковой обманки и
гамлея.
• Для обогащения содержания цинка руды
вначале подвергают обжигу в многоподовых
печах. Из обогащенных руд получают цинк
электролитическим или дистилляционным
способом.
Плавится цинк при температуре 419 °С, при
температуре 913 °С превращается в пар,
твердость по Бринеллю 350 кг/см2.
Легко разрывается при растяжении.
При обычной температуре хрупок, а при
температуре 100 °С хорошо гнется и
прокатывается в листы.
На воздухе покрывается тонким слоем
окиси, которая предохраняет его от
дальнейшего окисления.
Цинк при взаимодействии с кислотами и
щелочами вступает в химическое
взаимодействие, вследствие чего
образуются соли цинка. При взаимодействии
с водой на поверхности цинка образуется
тонкая пленка гидроокиси цинка, которая
предохраняет от дальнейшего
взаимодействия цинка с водой.
Широко используется цинк для изготовления
оцинкованной стали, используемой как
кровельный материал, в полиграфической
промышленности и для изготовления
гальванических элементов. Олово — металл серебристо-белого
Олово — металл серебристо-белого
цвета. Редко встречается в природе в
самородках, чаще в оловянных рудах—оловянный
камень. Содержание его в земной коре
невелико, около 0,008 %.
Олово легко выплавляется из руд и потому
применяется человеком с давних пор
в основном в виде сплава с медью —
бронзы. В настоящее время чистое олово
получают путем электролиза оловянных
руд.
Плотность чистого олова 7,28 г/см3,
температура плавления 231,9 °С, температура
кипения 2270 °С, твердость по Бринеллю
30— 50 кг/см2. Легко прокатывается
в тонкие листы — оловянную фольгу
или станиоль. Хорошо проводит тепло, но
обладает малой электропроводностью.
Отрицательным свойством олова является
большая его усадка при переходе из
расплавленного в твердое состояние.
При температуре ниже 13,2 °С белое олово
превращается в серое, имеющее другую
кристаллическую решетку и другие
свойства. Чем ниже температура, тем
скорость превращения белого олова
150
в серое увеличивается. После нагрева
После нагрева
олова до температуры выше 161 °С олово
приобретает третью модификацию с
ромбической решеткой, обладает
большой хрупкостью и легко растирается
в порошок.
При обычных условиях олово не окисляется,
а нагретое до температуры плавления
переходит в двуокись олова. Хорошо
растворяется в концентрированной
соляной и азотной кислотах, с водой не
реагирует.
Олово широко применяется для покрытия
медных и металлических деталей —
лужения, а также для соединения
металлических деталей — паяния.
В зубопротезной технике олово используется
для временной, контактной, пайки стальных
мостовидных протезов. Оно входит в
состав легкоплавких сплавов, применяемых
для штамповки коронок, металлических
базисов протезов и других деталей. \1
Кадмий — металл белого цвета. По
свойствам и цвету напоминает цинк,
содержится вместе с цинком в составе
цинковых руд, но в меньших количествах.
Добывают кадмий из отходов цинкового
производства.
Плотность 8,65 г/см3, температура
плавления 321 °С, температура кипения
778 °С, твердость по Бринеллю 60 кг/см2,
легко режется ножом, хорошо куется.
Хорошо растворяется в соляной и серной
кислотах. Во влажной среде покрывается
серой окисной пленкой.
Кадмий широко используется в электротехнике.
Добавка его к меди значительно повышает
срок службы медных проводов. Введение
кадмия в типографские сплавы способствует
уменьшению их износа.
В зубопротезной технике применяется в
составе легкоплавких сплавов типа
мелот-металл, припоев для пайки золотых
и стальных частей. В составе припоев он
значительно понижает температуру
плавления и повышает диффузию его в
спаиваемый металл.
Введение кадмия в состав сплава (припоя)
представляет некоторые трудности.
Как металл, имеющий низкую температуру
кипения, он быстро превращается в
пар и улетучивается еще до расплава
других компонентов сплава. Висмут—элемент, относящийся к
Висмут—элемент, относящийся к
группе металлоидов, но имеющий резко
выраженные свойства металлов. В природе
встречается в виде соединений —
висмутовая охра, висмутовый блеск, в
соста-
151
ве никелевых и кобальтовых руд, значительно
реже находится в
свободном состоянии. Содержание висмута
в земной коре весьма невелико (0,00001 %).
Добыча висмута осуществляется путем
плавления обогащенных висмутовых руд
в специальных печах в присутствии угля
и известняка.
В свободном состоянии имеет красновато-белый
цвет с блестящей поверхностью.
Плотность 9,8 г/м3, температура
плавления 271,3°С; температура кипения
1420 °С. Обладает большой твердостью (по
Бринеллю 350 кг/см2) и усадкой 3,3 %.
Хрупкий, хорошо растворяется в азотной
и серной кислотах. При обычной температуре
на воздухе не окисляется.
Соли висмута широко используются в
медицинской практике. В стоматологической
В стоматологической
технике применяются в составе легкоплавких
сплавов, в том числе сплавов типа
мелот-металл, применяемых для понижения
температуры плавления и повышения
твердости сплава.
Содержание
2. Медные сплавы. Материаловедение: конспект лекций [litres]
2. Медные сплавы
Медь относится к числу металлов, известных с глубокой древности. Раннему знакомству человека с медью способствовало то, что она встречается в природе в свободном состоянии в виде самородков, которые иногда достигают значительных размеров. В настоящее время медь широко используется в электромашиностроении, при строительстве линий электропередач, для изготовления оборудования телеграфной и телефонной связи, радио—и телевизионной аппаратуры. Из меди изготовляют провода, кабели, шины и другие токопроводящие изделия. Медь обладает высокой электропроводностью и теплопроводностью, прочностью вязкостью и коррозионной стойкостью. Физические свойства ее обусловлены структурой. Она имеет кубическую гра—нецентрированную пространственную решетку. Ее температура плавления – +1083 °C, кипения – +2360 °C. Средний предел прочности зависит от вида обработки и составляет от 220 до 420 МПа (22–45 кгс/мм 2), относительное удлинение – 4—60 %, твердость – 35—130 НВ, плотность – 8,94 г/см 3. Обладая замечательными свойствами, медь в то же время как конструкционный материал не удовлетворяет требованиям машиностроения, поэтому ее легируют, т. е. вводят в сплавы такие металлы, как цинк, олово, алюминий, никель и другие, за счет чего улучшаются ее механические и технологические свойства. В чистом виде медь применяется ограниченно, более широко – ее сплавы. По химическому составу медные сплавы подразделяют на латуни, бронзы и медноникелевые, по технологическому назначению – на деформируемые, используемые для производства полуфабрикатов (проволоки, листа, полос, профиля), и литейные, применяемые для литья деталей.
Ее температура плавления – +1083 °C, кипения – +2360 °C. Средний предел прочности зависит от вида обработки и составляет от 220 до 420 МПа (22–45 кгс/мм 2), относительное удлинение – 4—60 %, твердость – 35—130 НВ, плотность – 8,94 г/см 3. Обладая замечательными свойствами, медь в то же время как конструкционный материал не удовлетворяет требованиям машиностроения, поэтому ее легируют, т. е. вводят в сплавы такие металлы, как цинк, олово, алюминий, никель и другие, за счет чего улучшаются ее механические и технологические свойства. В чистом виде медь применяется ограниченно, более широко – ее сплавы. По химическому составу медные сплавы подразделяют на латуни, бронзы и медноникелевые, по технологическому назначению – на деформируемые, используемые для производства полуфабрикатов (проволоки, листа, полос, профиля), и литейные, применяемые для литья деталей.
Латуни – сплавы меди с цинком и другими компонентами. Латуни, содержащие, кроме цинка, другие легирующие элементы, называются сложными, или специальными, и именуются по вводимым, кроме цинка, легирующим компонентам. Например: томпак Л90 – это латунь, содержащая 90 % меди, остальное – цинк; латунь алюминиевая ЛА77–2 – 77 % меди, 2 % алюминия, остальное – цинк и т. д. По сравнению с медью латуни обладают большой прочностью, коррозионной стойкостью и упругостью. Они обрабатываются литьем, давлением и резанием. Из них изготовляют полуфабрикаты (листы, ленты, полосы, трубы конденсаторов и теплообменников, проволоку, штамповки, запорную арматуру – краны, вентили, медали и значки, художественные изделия, музыкальные инструменты, сильфоны, подшипники).
Например: томпак Л90 – это латунь, содержащая 90 % меди, остальное – цинк; латунь алюминиевая ЛА77–2 – 77 % меди, 2 % алюминия, остальное – цинк и т. д. По сравнению с медью латуни обладают большой прочностью, коррозионной стойкостью и упругостью. Они обрабатываются литьем, давлением и резанием. Из них изготовляют полуфабрикаты (листы, ленты, полосы, трубы конденсаторов и теплообменников, проволоку, штамповки, запорную арматуру – краны, вентили, медали и значки, художественные изделия, музыкальные инструменты, сильфоны, подшипники).
Бронзы – сплавы на основе меди, в которых в качестве добавок используются олово, алюминий, бериллий, кремний, свинец, хром и другие элементы. Бронзы подразделяются на безоловянные (БрА9Мц2Л и др.), оловянные (БрО3ц12С5 и др.), алюминиевые (БрА5, БрА7 и др.), кремниевые (БрКН1–3, БрКМц3–1), марганцевые (БрМц5), бериллиевые бронзы (БрБ2, БрБНТ1,7 и др.). Бронзы используются для производства запорной арматуры (краны, вентили), различных деталей, работающих в воде, масле, паре, слабоагрессивных средах, морской воде.
Данный текст является ознакомительным фрагментом.
Медь и сплавы
Медь и сплавы
Довольно часто домашние слесари отдают предпочтение меди (удельный вес 9,0 г/см2), поскольку ее мягкость и пластичность позволяют добиваться точности и высокого качества при изготовлении всевозможных деталей и изделий.Чистая (красная) медь – прекрасный
ЛЕКЦИЯ № 5. Сплавы
ЛЕКЦИЯ № 5. Сплавы
1. Строение металлов
Металлы и их сплавы – основной материал в машиностроении. Они обладают многими ценными свойствами, обусловленными в основном их внутренним строением. Мягкий и пластичный металл или сплав можно сделать твердым, хрупким, и наоборот.
3.
 Алюминиевые сплавы
Алюминиевые сплавы
3. Алюминиевые сплавы
Название «алюминий» происходит от латинского слова alumen – так за 500 лет до н. э. называли алюминиевые квасцы, которые использовались для протравливания при крашении тканей и дубления кож.По распространенности в природе алюминий занимает третье
4. Титановые сплавы
4. Титановые сплавы
Титан – металл серебристо—белого цвета. Это один из наиболее распространенных в природе элементов. Среди других элементов по распространенности в земной коре (0,61 %) он занимает десятое место. Титан легок (плотность его 4,5 г/см 3), тугоплавок
5. Цинковые сплавы
5. Цинковые сплавы
Сплав цинка с медью – латунь – был известен еще древним грекам и египтянам. Но выплавка цинка в промышленных масштабах началась лишь в XVII в.Цинк – металл светло—серо—голубоватого цвета, хрупкий при комнатной температуре и при 200 °C, при нагревании до
«Медные яблоки солнца»[22]
«Медные яблоки солнца»[22]
Планы компании «Рио-Тинто цинк» начать карьерную добычу медной руды в Сноудонском национальном заповеднике вызвали множество протестов (New Scientist, 12, 1970, p. 317). Однако нам, по-видимому, предстоит все чаще сталкиваться с подобными явлениями по мере
317). Однако нам, по-видимому, предстоит все чаще сталкиваться с подобными явлениями по мере
Огонь, вода и медные трубки
Огонь, вода и медные трубки
Потери на трение при движении судна по воде возрастают пропорционально кубу скорости, а когда подводная часть судна обрастает ракушками, становятся еще больше. Дедал размышляет над тем, какую экономию принесло бы устранение этого трения.
Сплавы золота
Сплавы золота
Для изготовления ювелирных и других изделий далеко не всегда используют чистые металлы. Происходит это из-за высокой стоимости драгоценных металлов, недостаточной твердостью их и износоустойчивости, поэтому на практике чаще всего употребляют сплавы,
7.4. Сплавы меди, имитирующие золотые и серебряные сплавы
7. 4. Сплавы меди, имитирующие золотые и серебряные сплавы
4. Сплавы меди, имитирующие золотые и серебряные сплавы
С целью удешевления художественных изделий при производстве недорогих украшений широко используются томпак, латунь, мельхиор, нейзильбер; при изготовлении художественных изделий – бронзы.Сплавы меди с цинком,
10. Серебро и его сплавы
10. Серебро и его сплавы
Серебро – химический элемент, металл. Атомный номер 47, атомный вес 107,8. Плотность 10,5 г/см3. Кристаллическая решетка – гранецентрированная кубическая (ГЦК). Температура плавления 963 °C, кипения 2865 °C. Твердость по Бринеллю 16,7.Серебро – металл белого
11. Золото и его сплавы
11. Золото и его сплавы
Золото – химический элемент, металл. Атомный номер 79, атомный вес 196,97, плотность 19,32 г/см3. Кристаллическая решетка – кубическая гранецентрировапная (ГЦК). Температура плавления 1063 °C, кипения 2970 °C. Твердость по Бринеллю – 18,5.Золото – металл желтого
Твердость по Бринеллю – 18,5.Золото – металл желтого
11.1. Двухкомпонентные сплавы золота
11.1. Двухкомпонентные сплавы золота
В ювелирной промышленности иногда применяют двухкомпонентные сплавы: золото – медь и золото – серебро.
Рис. 11.1. Диаграмма состояния Сu – Аu.Золото и медь обладают неограниченной растворимостью в жидком, а при высоких температурах и в
11.2. Многокомпонентные сплавы золота
11.2. Многокомпонентные сплавы золота
В ювелирной промышленности для изготовления золотых изделий используют в большинстве случаев сплавы системы золото – серебро – медь, которые могут содержать добавки других металлов: никеля, палладия, цинка, платины. Химический
11.6. Золотые сплавы для припоев
11.6. Золотые сплавы для припоев
При изготовлении ювелирных и художественных изделий из сплавов золота используется пайка.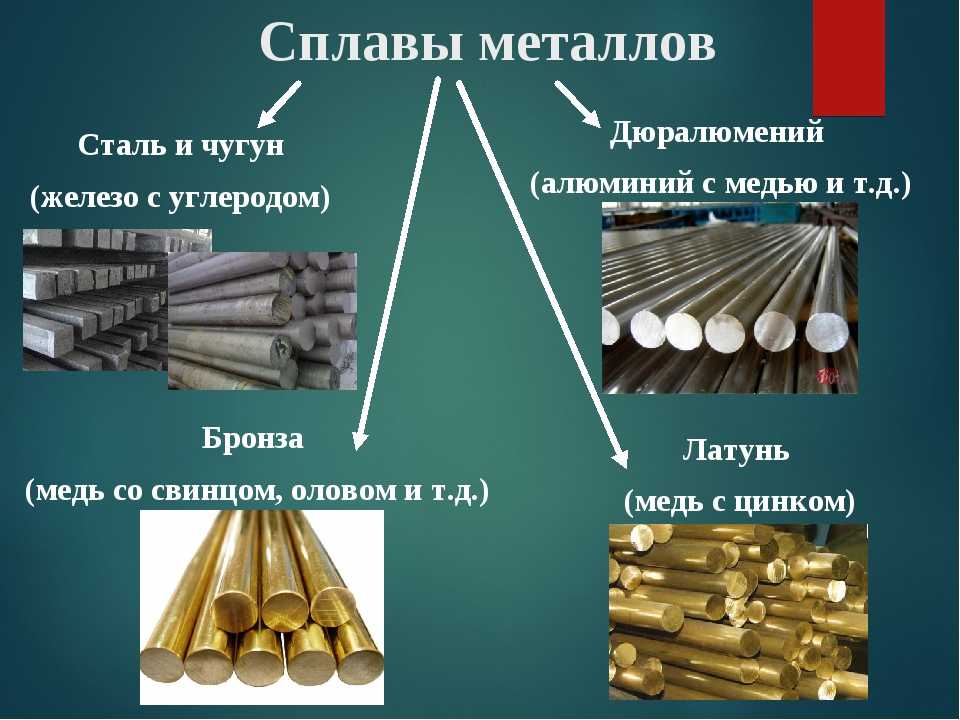 Состав и интервал температур плавки ювелирных припоев для пайки сплавов золота приведен в табл. 11.9. Маркировка золотых припоев осуществляется так
Состав и интервал температур плавки ювелирных припоев для пайки сплавов золота приведен в табл. 11.9. Маркировка золотых припоев осуществляется так
46. Магний и его сплавы
46. Магний и его сплавы
Магний является химически активным металлом: образующаяся на воздухе оксидная пленка МдО в силу более высокой плотности, чем у самого магния, растрескивается и не имеет защитных свойств; порошок и стружка магния легко воспламеняются; горячий и
47. Титан и его сплавы
47. Титан и его сплавы
Титан и сплавы на его основе обладают высокой коррозионной стойкостью и удельной прочностью. Недостатки титана: его активное взаимодействие с атмосферными газами, склонность к водородной хрупкости.Азот, углерод, кислород и водород, упрочняя титан,
Откуда берутся разные металлы?
Блог
позднее сообщение | индекс | предыдущая запись
Вторник, 12 апреля 2022 г.
Это может быть не то, что вы ожидаете от компании по переработке металла, но знание того, откуда берется металл, является ключевой частью понимания того, почему жизненно важно перерабатывать. С точки зрения усилий, необходимых для получения материалов, мы можем лучше понять, почему поиск энергоэффективных источников так важен.
В этом руководстве мы покажем вам, откуда берутся определенные металлы и как они могут быть переработаны (вы можете узнать об этом, нажав на ссылки в этой статье).
Как металлы встречаются в природе?
Большинство чистых металлов происходят из земной коры. Они находятся в рудах, которые представляют собой твердый материал, из которого можно брать минералы и металлы. Почти треть массы планеты составляет элемент железа, и большую его часть можно найти в ядре планеты. 14 % — магний, 1,5 % — никель и 1,4 % — алюминий, всего 49% планеты. Драгоценные металлы, такие как золото, серебро, платина и палладий, существуют только в следовых (крошечных) количествах.
Огромные горнодобывающие работы, конечно же, необходимы для извлечения из земли большинства металлических руд. Концентрация минералов в горной породе часто довольно низкая, а это означает, что для получения металлов необходимо проводить огромные земляные работы. Например, большая часть меди содержится в сульфидных рудах, содержащих всего 0,25% меди.
Какая страна производит больше всего металла?
Австралия и Бразилия в настоящее время входят в число крупнейших мировых производителей железной руды. Австралия составляет половину мирового экспорта железной руды, а Бразилия экспортировала около 23% от общего объема мирового экспорта железа в 2020 году. , производящая 400 миллионов метрических тонн железной руды в 2020 году. Вы можете найти последнюю статистику по этому вопросу здесь.
Безусловно, на рынок металла и металлолома влияют мировые события. Например, ASM рассмотрела, как коронавирус повлиял на рынок металлолома.
Как создаются металлы?
Чистые формы металла, как мы объясняем, происходят из земли. Металлы часто делятся на черные и цветные категории. Черные металлы содержат железо, например, мягкая сталь, углеродистая сталь и чугун, цветные металлы не содержат железа, такие как медь, алюминий, олово и свинец.
Металлы часто делятся на черные и цветные категории. Черные металлы содержат железо, например, мягкая сталь, углеродистая сталь и чугун, цветные металлы не содержат железа, такие как медь, алюминий, олово и свинец.
Чтобы создать металлы из руд, их нужно «извлечь» и очистить. Процесс добычи может включать
- Измельчение руды в порошок
- Нагрев руды при экстремально высоких температурах
- Использование воды или химической ванны для «всплывания» чистых металлов наверх
- Фильтрация примесей
- Применение электрического тока для разрыва прочных химических связей
Переработка руды переводит металлы из их оксидов (или других соединений) в чистую форму, которая нам нужна. Вот некоторые из наиболее распространенных металлов и процесс их извлечения/очистки*:
Алюминий
Наиболее распространенной рудой, используемой для производства алюминия, является боксит, глиноподобное вещество. Как и в случае с железом, получение алюминия означает избавление от кислорода и минералов в руде.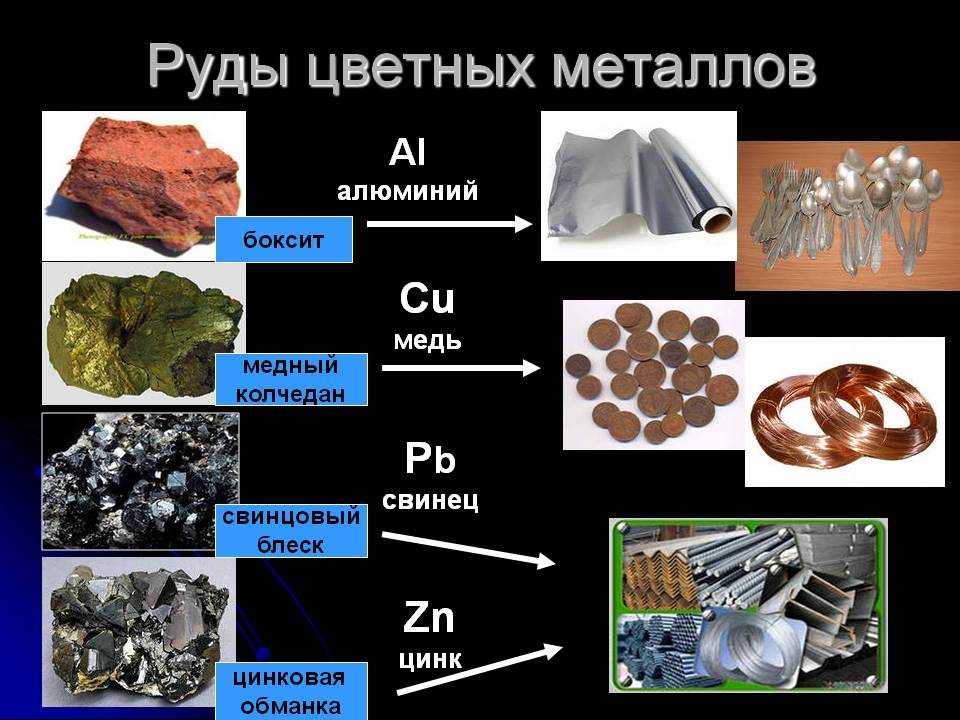 Боксит измельчают, затем используют электролиз для его разделения на алюминий и кислород, после чего чистый алюминий отливают в блоки, известные как слитки, которые можно обрабатывать или формировать или использовать в качестве сырья для изготовления алюминиевых сплавов.
Боксит измельчают, затем используют электролиз для его разделения на алюминий и кислород, после чего чистый алюминий отливают в блоки, известные как слитки, которые можно обрабатывать или формировать или использовать в качестве сырья для изготовления алюминиевых сплавов.
Цинк
Цинк можно получить с помощью процесса, называемого пенной флотацией, который также используется для обработки медных и свинцовых руд. Этот процесс включает измельчение цинковой руды до мелкого порошка, смешивание ее с водой, сосновым маслом и флотационными химикатами, а затем перемешивание смеси, чтобы «всплыть» цинк на поверхность. Однако для извлечения цинка при температуре до 1204°С применяется также плавка.
Свинец
Свинцовые руды могут быть добыты глубоко под землей и известны как сульфид свинца, поскольку сера составляет значительную часть минерала. Его измельчают и смешивают с водой, а для отделения от отходов используют флотацию, как цинк. Этот свинцовый концентрат необходимо нагреть, чтобы удалить больше серы. Диоксид серы является важным побочным продуктом процесса очистки свинца, который улавливается и превращается в серную кислоту. Расплавленный свинец около 9Чистота 5-99%, но коммерческий свинец должен иметь чистоту 99-99,999%, поэтому его дополнительно очищают нагреванием для удаления остаточной меди.
Диоксид серы является важным побочным продуктом процесса очистки свинца, который улавливается и превращается в серную кислоту. Расплавленный свинец около 9Чистота 5-99%, но коммерческий свинец должен иметь чистоту 99-99,999%, поэтому его дополнительно очищают нагреванием для удаления остаточной меди.
Медь
Обычно медные руды содержат только 4% меди. На каждом этапе рафинирования медь постепенно становится более концентрированной. Руда дробится на очень мелкие кусочки и смешивается с водой, которая закачивается в резервуары и смешивается с воздухом и маслянистыми химикатами, которые помогают отделить частицы меди от любых других минералов. Оставшаяся руда затем нагревается в огромной печи, называемой плавильной печью, которая сжигает часть оставшихся примесей и оставляет материал, называемый медным штейном, который состоит не менее чем на 50% из меди. Иногда медный штейн нагревают с кремнеземом и воздухом, чтобы удалить больше отходов, оставляя очень очищенный материал, называемый черновой медью, который может быть более 9чистота 7%.
Латунь
Латунь – это металл, состоящий в основном из меди и цинка, который производится человеком. Это означает, что, в отличие от других металлов, перечисленных выше, он не извлекается из руды, а производится из комбинации других металлов. Медь является основным компонентом, а латунь обычно классифицируют как медный сплав. Для изготовления латуни медь и цинк нагревают в печи до расплавления, затем заливают в трубы и трубки для затвердевания. Иногда его также можно свернуть в листы, в зависимости от его конечного использования.
*Это упрощенные версии процесса извлечения и очистки, так как для получения самых чистых металлов может потребоваться несколько раундов.
Что такое сплав?
Свойства чистых металлов можно изменить/улучшить, смешивая их с другими металлами для получения сплавов. Например, смешивая медь с оловом, можно получить бронзу, которая намного тверже чистой меди. Сталь – это железо, смешанное с небольшим количеством углерода. Легированные металлы используются для самых разных целей, включая легкосплавные диски для автомобилей.
Можно ли перерабатывать металлы?
Короткий ответ — да, но разные типы металлов имеют разные методы и могут быть переработаны чаще и т. д., поэтому лучше всего прочитать о процессе переработки металла. Наш справочник ASM «Мир вторичной переработки металлов» поможет вам.
Переработка металлолома ASM
Компания ASM Metal Recycling скупает широкий ассортимент лома черных и цветных металлов, избавляя вас от ненужных металлов, пригодных для вторичной переработки, и предлагая вам конкурентоспособную цену на ваши материалы в отрасли
- Переработка металлов
позднее сообщение | индекс | предыдущий пост
6.7A: Сплавы замещения — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 2594
Когда расплавленный металл смешивается с другим веществом, существует два механизма, которые могут вызвать образование сплава: (1) атомный обмен или (2) межузельный механизм . Относительный размер каждого элемента в смеси играет основную роль в определении того, какой механизм будет реализован.
Относительный размер каждого элемента в смеси играет основную роль в определении того, какой механизм будет реализован.
Когда атомы относительно схожи по размеру, обычно применяется метод обмена атомами, при котором некоторые из атомов, составляющих металлические кристаллы, замещаются атомами другой составляющей. это называется замещающий сплав . Примеры сплавов замещения включают бронзу и латунь, в которых некоторые атомы меди замещены либо атомами олова, либо атомами цинка.
Рисунок \(\PageIndex{1}\): Различные атомные механизмы образования сплавов, демонстрирующие структуры чистого металла, замещения и внедрения. (CCO; Hbf878 через Википедию)
Почему возникают сплавы замещения: связь
Связь между двумя металлами лучше всего описывается как комбинация металлического «обмена электронами» и ковалентной связи, одна не может возникнуть без другой и доли одного к другим изменениям в зависимости от вовлеченных составляющих. Металлы разделяют свои электроны по всей своей структуре, этот поток электронов является причиной многих характеристик, связанных с металлами, включая их способность действовать как проводники. Различное количество и сила ковалентных связей могут меняться в зависимости от различных конкретных металлов и того, как они смешиваются. Ковалентная связь отвечает за кристаллическую структуру, а также за температуру плавления и различные другие физические свойства.
Различное количество и сила ковалентных связей могут меняться в зависимости от различных конкретных металлов и того, как они смешиваются. Ковалентная связь отвечает за кристаллическую структуру, а также за температуру плавления и различные другие физические свойства.
Рисунок \(\PageIndex{2}\): Примеры металлических сплавов замещения. В зависимости от конкретного типа сплава замещения они могут иметь несколько кристаллических структур. Две из возможных структур включают Face Center Cubic (слева) и Cubic Center Cubic (справа). Структура металлического сплава не ограничивается этими двумя структурами, но вместе они составляют большую часть обычных сплавов.
По мере увеличения сходства электронной структуры металлов, входящих в состав сплава, снижаются металлические характеристики сплава. Чистые металлы полезны, но их применение часто ограничивается свойствами каждого отдельного металла. Сплавы допускают смеси металлов, обладающие повышенной стойкостью к окислению, повышенной прочностью, электропроводностью и температурой плавления; Практически любым свойством можно управлять, регулируя концентрацию сплава. Примером может служить латунная дверная фурнитура, она прочная и устойчива к коррозии лучше, чем чистый цинк или медь, два основных металла, из которых состоит латунный сплав. Комбинация также имеет низкую температуру плавления, что позволяет легко отливать ее во множество различных форм и размеров. (1) Есть много других аспектов сплавов замещения, которые можно было бы изучить более подробно, но основная концепция заключается в том, что каждый отдельный металл в сплаве придают конечному продукту его химические и физические свойства.
Примером может служить латунная дверная фурнитура, она прочная и устойчива к коррозии лучше, чем чистый цинк или медь, два основных металла, из которых состоит латунный сплав. Комбинация также имеет низкую температуру плавления, что позволяет легко отливать ее во множество различных форм и размеров. (1) Есть много других аспектов сплавов замещения, которые можно было бы изучить более подробно, но основная концепция заключается в том, что каждый отдельный металл в сплаве придают конечному продукту его химические и физические свойства.
Сплавы замещения сыграли важную роль в развитии человеческого общества и культуры, какими мы их знаем сегодня. Сам бронзовый век назван в честь сплава замещения, состоящего из олова в металлическом растворе меди. Древние бронзы очень загрязнены или даже неправильно маркированы, содержат большое количество цинка и мышьяка, а также множество примесей. Эти многочисленные замещающие сплавы позволили создать более прочные инструменты и оружие, они позволили повысить производительность как в мастерской, так и на поле боя. Потребность в сырье, таком как олово и медь, для производства бронзы также стимулировала рост торговли, поскольку их руды редко встречаются вместе. Нынешнее химическое понимание сплавов замещения не было бы таким глубоким, если бы не полезность сплавов для человека.
Потребность в сырье, таком как олово и медь, для производства бронзы также стимулировала рост торговли, поскольку их руды редко встречаются вместе. Нынешнее химическое понимание сплавов замещения не было бы таким глубоким, если бы не полезность сплавов для человека.
Резюме
Сплав представляет собой смесь металлов, которая имеет объемные металлические свойства, отличные от свойств составляющих ее элементов. Сплавы могут быть образованы путем замены одного атома металла на другой такого же размера в решетке (сплавы замещения), путем вставки меньших атомов в отверстия в решетке металла (сплавы внедрения) или комбинацией того и другого. Хотя элементный состав большинства сплавов может варьироваться в широких пределах, некоторые металлы соединяются только в фиксированных пропорциях, образуя интерметаллические соединения.0003
Ссылки
- Смоллман Р.Э., Нган А.Х.В. и Смоллман Р.Э. (2007). Металлургия и современные материалы . Амстердам: Баттерворт Хайнеманн.

- Ван, Ф.Э.. (2005). Теория склеивания металлов и сплавов . Амстердам: Эльзевир.
- Дикинсон, ОТПК (1994). Эгейский бронзовый век . Кембриджская мировая археология. Кембридж: Издательство Кембриджского университета.
Проблемы
- Встречаются ли сплавы замещающих металлов в природе на поверхности земли?
- Какие две характеристики металла необходимы для образования сплава замещения?
- Могут ли кислород или азот быть частью кристаллической структуры сплава замещения?
Растворы
- Нет, окислительная природа земной атмосферы, а также потребность в специфических и концентрированных металлах не позволяют им встречаться в природе.
- Похожие радиусы и аналогичная электроотрицательность.
- Только металлические элементы могут образовывать необходимые металлические связи, позволяющие образовывать сплавы.
6.
