Микроэлементы: Кальций, калий, селен, магний, цинк, железо, кобальт, йод. Купрум цинк
Медь (Cu, Cuprum) - влияние на организм, польза и вред, описание
История меди
Медь называют одним из первых металлов, которые человек освоил в древности и пользуется им до сегодняшнего дня. Добыча меди была доступной, потому что руду необходимо было плавить при сравнительно невысокой температуре. Первой рудой, из которой стали добывать медь, была малахитовая руда (calorizator). Каменный век в истории человечества сменился именно медным, когда предметы быта, орудия труда и оружие из меди получили самое широкое распространение.
Общая характеристика меди
Медь является элементом XI группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 29 и атомную массу 63,546. Принятое обозначение – Cu (от латинского Cuprum).

Нахождение в природе
Медь достаточно широко представлена в земной коре, в осадочных породах, в водах морских и пресных водоёмах, в сланцах. Распространена как в виде соединений, так и в самостоятельном варианте.
Физические и химические свойства
Медь является пластичным, так называемым переходным металлом, имеет золотисто-розовый цвет. При контакте с воздухом на поверхности меди образуется оксидная плёнка, придающая металлу желтовато-красный оттенок. Известны основные сплавы меди – с цинком (латунь), с оловом (бронза), с никелем (мельхиор).
Суточная потребность в меди
Потребность в меди у взрослого человека составляет 2 мг в день (около 0,035 мг/ 1 кг веса).
Продукты питания богатые медью
Медь – один из самых важных микроэлементов для организма, поэтому продукты питания, богатые медью, должны быть в рационе каждого. Это:
Признаки нехватки меди
Признаками недостаточного количества меди в организме служат: анемия и ухудшение дыхания, потеря аппетита, расстройства желудка, нервозность, депрессивные состояния, быстрая утомляемость, нарушения пигментации кожи и волос, ломкость и выпадение волос, сыпи на кожных покровах, частые инфекции. Возможны внутренние кровотечения.
Признаки избытка меди
Переизбыток меди характеризуется бессонницей, нарушениями мозговой активности, эпилепсией, проблемами с менструальным циклом.
Взаимодействия с другими
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента.
Применение меди в жизни
Медь имеет огромное значение в народном хозяйстве, её основное применение – электротехника, но металл широко используется для чеканки монет, часто – в произведениях искусства. Медь также используется в медицине, архитектуре и строительстве.
Полезные свойства меди и его влияние на организм
Требуется для превращения железа организма в гемоглобин. Делает возможным использование аминокислоты тирозин, позволяя ей проявлять свое действие как фактору пигментации волос и кожи. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь также участвует в процессах роста и размножения. Принимает участие в образовании коллагена и эластина и синтезе эндорфинов – гормонов «счастья».
Автор: Виктория Н. (специально для Calorizator.ru)Копирование данной статьи целиком или частично запрещено.
www.calorizator.ru
Кальций, калий, селен, магний, цинк, железо, кобальт, йод
Калий
Соли калия необходимы для нормального функционирования всех наших мягких тканей: сосудов, капилляров, мышц, а особенно мышцы сердечной, клеток мозга, печени, почек, желез внутренней секреции и других органов. Калий входит в состав внтриколеточных жидкостей (50% всех солей в организме — соли калия).
Соли калия способствуют выведению из организма лишней воды, помогают ликвидировать отекк, задержку выделения мочи, необходимы для лечения водянки (асцита).
Калий — противосклеротическое средство, т.к. мешает солям натрия накапливаться в сосудах и клетках Конкуренция в организме солей натрия и калия постоянна..
Если у вас появились боли в мышцах, припухлости в тканях при ушибах, укусах и синяки в результате разрывов капилляров — вам всегда поможет калий, который легко ввести в организм путем втирания в мышечную ткань яблочного уксуса (он хорошо впитывается безо всякого давления). Можно добавить к яблочному уксусу мед. Любое воспаление и отек не забывайте смазывать медом или яблочным уксусом..
Чтобы ежедневно поддерживать нормальный уровень калия в крови, советую ежедневно в период между приемами пищи пить маленькими глоточками такой квасок — на 1 ст кипяченой воды добавьте по 1 ч ложке меда и яблочного уксуса .
Источник калия: шпинат, огурцы, морковь, лук, петрушка, спаржа, хрен, одуванчик, чеснок, черная смородина, бананы, капуста, редис, помидоры, курага, изюм, фасоль, бобы, ржаной хлеб, овсянка.
Кальций.
Соли кальция — основной строительный материал для костей, зубов, ногтей; они также необходимы и дя мышц, участвуют в процессах кроветворения, обмена веществ, способствуют уменьшению проницаемости сосудов, препятсвуя проникновени микроорганизмовв кровь и повышая споротивляемость оранизма к токсинам и инфекциям. Кальций благотворно влияет на нервную систему, оказывает противовоспалительное действие.
Кальций всегда в союзе с фосфором. Соли кальция и фосфора не могут усваиватся друг без друга. Отвечает за их равновесие в крови витамин D.
Если организму не достает кальция, то он начинает красть его из костей и зубов.
Продукты, содержащие одноврменно кальций и фосфор — яблоки, зеленый горошек, цельные зерна пшеницы, свежие огруцы, все виды капусты, особенно цветная (ее надо есть сырой), сельдерей, салат, редис, творог, белые сыры.
Щавелевая кислота препятсвует усвоению кальция, она вступает с ним в реакцию, создавая труднорастворимые соли (оксалаты), которые организм не может использовать. Много щавелевой кислоты содержится в шпинате, щавеле, ревене. Эти продукты ни в коем случае нельзя подвергать тепловой обработке.
Селен.
Долгое время селен считался ядом. Действиетнльо, в определнных дозах (чуть больше или чуть меньше) он является ядом. Для здоровья необходимо получать всего лишь 0,00001 г селена.
Селен — антиокислитель. Он повышает нашу сопротивляемость неблагоприятным условиям среды, вирусам, защищая нас тем самым от различных заболеваний. Он необходим для работы сердечной мышцы и кровеносные сосуды.
От избытка селена люди теряют волосы и ногти — такая болезнь называется селеноз.
В любом растении имеются следы селена. Оптимальное количество селена содержится в пивнх дрожжах и чесноке.
Магний.
Магний участвует во всех иммунных процессах как противотоксичный, противострессовый, противоаллергический, противоанафилактический, проивовоспалительный фактор
Витамин В6 действует только в присутствии магния.
Недостаток магния может вызвать у человека страхи, нервозность, нетерпение, бессонницу, головную боль, постоянное чувство усталости, неконтролируемое раздражение.
Магний играет роль в процессе сретывания крови, в создании эстрогенов (женского гормона), а также в работе кишечника, желчного пузыря, простаты.
При недостаткке магния, организм крадет его из костей.
Источники магния: орехи, зелень, овсяные хлопья, горошек, шоколад, какао, кукуруза.
Цинк.
Цинк необходим для формирования костей, способствует лечению трудно заживающих ран у больных диабетом или людей с нарушением кровообращения. Витамин А действует только в присутствии цинка. Цинк ускоряет заживление ран. Витамин С и цинк — хорошее средство против катаров и многих вирусных заболеваий. Цинк оказывает противовирусное и антитоксическое действие. Юношеские угри можно вылечить с помощью цинка.
Мужчинам требуется больше цинка, чем женщинам.
Источник: отруби, проросшие зерна пшеницы, хлеб грубого помола.
Железо.
Железо участвует в процессах кроветворения, в создании гемоглобина.
Женщины чаще страдают от недостака железа, чем мужчины. Они теряют его во время кормления грудью, менструации, беременности.
При недостатке железа развивается анемия, неестественная бледность кожи, общее ухудшение самочувствия, ломкость волос и ногтей, частые головные боли, раздражительность, поверхностное и учащенное дыхание. Часто желудочно-кишечные заболевания, запоры, трещины в уголках рта.
Усталость — первый признак недостатка железа!
Железом богаты хлеб из муки грубого помола, черный хлеб, крупы, зелень, салатные овощи, капуста.
Лук повышает усвоение железа.
Крапива любых сортов — один из лучших источников микроэлементов. Соберите крапиву, тщательно промойте, пропустите через соковыжималку. Принимайте по 3 ст ложки сока в день. Предупреждаю — сок невкусен, но очень полезен. Можно пить его с медом. Сок хорошо сохраняется нескольок дней в холодильнике.
Медь
Народная медицина использует медные пластинки для лечения многих заболеваний. Известно, что рабочие медных рудников не страдают от радикулита, гипертонии, злокачественных опухолей.
Медь играет важную роль в поддержании нормального состава крови. Медь необходима для усвоения железа.
Медь участвует в создании миелина — оболочки нервных волокон.
При пользе, которую получает наш организм от меди, следует помнить, что медь токсична. Соединения меди с серой ядовиты. Избыток меди способен вызвать нарушение функции дыхательных путей, анемию. И в тоже время, медь необходима человеку для избежания этих заболеваний.
Суточная потребность в меди колеблется от 1 до 3 мг. Слишко ммало или слишком много — одинаково плохо.
В диете медь предпочитает быть рядом с молибденом. Оба этих элемента составляют комплекс, к которому потом присоединится белок.
Напомню, что варенье, сваренное в медных тазах, теряет витамин C полностью.
В процессе производства швейцарского сыра его помещают в медную кадку, чтобы образовались характерные дыры в процессе окисления. Витамин С при этом теряется.
Печень и почки, крабы, креветки, омары, лангусты, орехи, листовые овощи, горох, фасоль, мука грубого помола и хлеб из нее, содержат медь и молибден в требуемых количествах. Однако не следует переедать более нормы (100 г в день). Есть эти продукты лучше по раздельности, а не вместе. Тогда не будет неприятностей от передозировки меди.
Йод
Йод необходим для синтеза гормона щитовидной железы — тироксина, а также для создания фагоцитов — патрульных клеток в крови, которые должны уничтожать мусор и чужеродные тела. Фагоциты захватывают и перваривают микроорганизмы, неполноценные клетки.
Недостаток йода способствует развитию базедовой болезни (зоба).
Употребление в пищу сои вызывает увеличение щитовидной железы, повышает потребность в йоде.
Поэтому при употреблении сои надо вместе с ней вводить в рацион морскую соль, океаническю рыбу, репчатый и зеленый лук.
Детям и подросткам йода требуется больше, чем взрослым.
Йод применятеся при атеросклерозе, лечении сифилиса в третичном периоде, воспалительных процессах дыхательных путей, хронических отравлениях ртутью и свинцом, для предупреждения и лечения зоба. Йодид калия назначают при мастопатиях молочной железы и других новообразованиях в железах внутренней секреции.
Основные источники: морская рыба, морскеи водоросли, морская капуста, салат, репа, капуста, чеснок, спаржа, морковь, картофель, томаты, фасоль, виноград, щавель.
Йод и кобальт — взаимоисключающие элементы!
Кобальт
Без кобальта невозможно создать здоровые кровяные тельца. Кобальт необходим для нормальной деятельности поджелудочной железы. Кобальт регулирует обменные процессы, особенно содержание адреналина в крови. Он является составной частью витамина B12, холина, инозитола, ПБКА.
Кобальт и марганец и медь предупреждают раннюю седину в волосах и улучшают из состояние.
Кобальт увеличивает синтез нуклеиновых кислот, участвует в общем восстановлении организма после тяжелых заболеваний.
Основные источники: кислое молоко, почки, яйца, пшеница, гречка, какао, кукуруза.
Фтор
Фтор входит в состав костной ткани. Недостаток фтора вызывает кариес. Избыток фтора вызывает остеохондроз, изменение цвета и формы зубов, костные наросты.
Любители чая должны знать, что количество фтора в готовом напитке зависит от его крепости, длительности настоя и длительности кипячения. Кипятить воду нужно один раз и быстро, иначе соли переходят в тяжелоусвояемые комлексы.
Настаивать чай нужно не более 5-6 мин.
К тому же в слишком крепком чае содержится много ксантина — это яд для гемоглобина.
Мышьяк
Мышьяк с давних пор известен и как яд и как лекарство.
Некоторые формы аллергии обусловлены недостаком мышьяка.
Заботиться об этом микроэлементе специально не нужно, он находится во всех продуктах растительного и животного происхождения, исключая рафинированный сахар.
Самый богатый источник мышьяка — съедобные моллюски, некоторые виды морских рыб. Поэтому не переедайте, т.к. вместе с обилием продуктов можно получить и нежелательное количество мышьяка.
Литий
В свое время литием лечили подагру и экзему. Литий обладет психотропными свойствами. Его применяют при депрессии, ипохондрии, агрессивности и наркомании. Литий способен предупреждать склероз, болезни сердца, в какой-то степени диабет и гипертонию.
Литий содержится в некоторых минеральных водах, морской и каменной соли.Больше всего лития в растениях семейства розовых, гвоздичных, пасленовых, к которым относятся помидоры и картофель.
Хром
Считается, что норма хрома для взрослого человека — 150 мг в сутки.
Хром усиливает процессы обмена углеводистых соединений.
Избыток хрома в пыли вызывает заболевание астмой.
Отличные источники хрома: пивные дрожжи, печень.
Беременным женщинам и кормящим матерям, больным диабетом, людям старше 45 лет, а также после перломов следует пополнять диету хромом. Ежедневно прнимайте 12-16 таблеток или 3 ст ложки порошка пивных дрожжей. Пивные дрожжи предварительно запарить кипятком и настоять 15-30 мин до употребления.
Марганец
Необходим для правильного развития клеток, хорошего усвоения витамина В1, железа и меди, которые необходимы для кроветворения.
Марганец помогает смягчить токсические свойства многих соединений.
Много марганца в клюкве, каштанах, перце.
Кремний
Способствует росту — он помогает строить кости.
Кремний является составной частью соединительной ткани. При его недостатке кожа теряет эластичность, волосы и ногти ломаются, ухудшается настроение и самочувствие.
Хорошо действует кремний и на капилляры, уменьшая их проницаемость и предупреждая появление хрупкости.
Кремний в большом количестве содержится в хвоще — 60%, примерно по 0,25% содержат этого элемента пикульник, горец птичий, пырей, крапивы, мать-и-амчеха.
Для получения кремния пьют настой из этих трав.
Хвощ, пикульник, крапива — по 50 г , горец птичий — 100 г. Ст ложку смеси залить 2 ст воды, кипятить на слабом огне, пока не выкипит половина содержимого. Пить настой 2 раза в день по полстакана.
Кремний есть также в отрубях, овсянке, черном хлебе., помидорах, луке, репе, семенах подсолнуха, сельдерее.
Ванадий
Стимулирует движение фагоцитов — клеток, поглощающих болезетворные микробы и все лишнее — тем самым, стимулируя иммунитет.
Источники: неочищенный рис, редис, морковь, рожь, свекла, вишня, земляника, гречиха, салат, ячмень, сырой картофель.
Если вы хотите быстро и эффективно восполнить запас микроэлементов в организме, под руководством одного из лучших в Екатеринбурге врача-диетолога, а заодно избавиться от токсинов…подробнее здесь
Особое оздаравливающее питание основанное на овощах, рыбе, свежевыжатых соках, травяных чаях, зеленых коктейлях и смузи насытит ваш организм нужными микроэлементами и витаминами. Поможет избавиться от шлаков и лишних килограммов. А йога, массаж и баня помогут обрести душевный покой, упокоят ум, избавят от неприятных ощещений в спине.
www.turbaza66.ru
Химические свойства переходных металлов (меди, цинка, хрома, железа).
Химические свойства меди
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Д.И.Менделеева. Электронная конфигурация атома меди в основном состоянии записывается виде 1s22s22p63s23p63d104s1 вместо предполагаемой формулы 1s22s22p63s23p63d94s2. Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2. Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(Nh4)2]Cl и [Cu(Nh4)2]OH. Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
Взаимодействие с простыми веществами
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400оС образуется сульфид меди (I):
При недостатке серы и проведении реакции при температуре более 400оС образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
с галогенами
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
Cu + Br2 = CuBr2
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Взаимодействие со сложными веществами
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4h3O
— с концентрированной азотной кислотой
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 оС может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4
Cu + 2FeCl3 = CuCl2 + 2FeCl2
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
2Cu + h3O + СО2 + О2 = (CuOН)2СO3
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d104s2. Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
2Zn + h3O + O2 + CO2 → Zn2(OH)2CO3
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Zn + h3SO4 (20%) → ZnSO4 + h3↑
Zn + 2HCl → ZnCl2 + h3↑
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900oC (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Zn + h3O = ZnO + h3↑
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Zn + 2h3SO4 = ZnSO4 + SO2↑ + 2h3O
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2h3O
3Zn + 8HNO3(40%) = 3Zn(NO3)2 + 2NO↑ + 4h3O
4Zn +10HNO3(20%) = 4Zn(NO3)2 + N2O↑ + 5h3O
5Zn + 12HNO3(6%) = 5Zn(NO3)2 + N2↑ + 6h3O
4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + Nh5NO3 + 3h3O
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3↑
Zn + Ba(OH)2 + 2h3O = Ba[Zn(OH)4] + h3↑
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
4Zn + NaNO3 + 7NaOH + 6h3O → 4Na2[Zn(OH)4] + Nh4↑
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Zn + 4Nh4·h3O → [Zn(Nh4)4](OH)2 + h3↑ + 2h3O
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Zn + CuCl2 = Cu + ZnCl2
Zn + FeSO4 = Fe + ZnSO4
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
с кислородом
Раскаленный до температуры более 600 oС порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
4Cr + 3O2 =ot=> 2Cr2O3
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 oC соответственно):
2Cr + 3F2 =ot=> 2CrF3
2Cr + 3Cl2 =ot=> 2CrCl3
С бромом же хром реагирует при температуре красного каления (850-900 oC):
2Cr + 3Br2 =ot=> 2CrBr3
с азотом
С азотом металлический хром взаимодействует при температурах более 1000 oС:
2Cr + N2 =ot=> 2CrN
с серой
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
Cr + S =ot=> CrS
2Cr + 3S =ot=> Cr2S3
С водородом хром не реагирует.
Взаимодействие со сложными веществами
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
2Cr + 3h3O =ot=> Cr2O3 + 3h3↑
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
Cr + 6HNO3(конц.) =to=> Cr(NO3)3 + 3NO2↑ + 3h3O
2Cr + 6h3SO4(конц) =to=> Cr2(SO4)3 + 3SO2↑ + 6h3O
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
10Cr + 36HNO3(разб) = 10Cr(NO3)3 + 3N2↑ + 18h3O
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять h3 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
Cr + 2HCl = CrCl2 + h3↑
Cr + h3SO4(разб.) = CrSO4 + h3↑
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» h3FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Взаимодействие с простыми веществами
С кислородом
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
3Fe + 2O2 =to=> Fe3O4
С серой
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Fe + S =to=> FeS
Либо же при избытке серы дисульфид железа:
Fe + 2S =to=> FeS2
С галогенами
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =to=> 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =to=> 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =to=> 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Fe + I2 =to=> FeI2 – йодид железа (ll)
| Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ: 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl 2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6h3O Fe2O3 + 6HI = 2FeI2 + I2 + 3h3O |
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
Взаимодействие со сложными веществами
Взаимодействие с кислотами
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме h3SO4 (конц.) и HNO3 любой концентрации):
Fe + h3SO4 (разб.) = FeSO4 + h3↑
Fe + 2HCl = FeCl2 + h3↑
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
Взаимодействие с кислотами-окислителями
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
Fe + 6h3SO4 = ot=> Fe2(SO4)3 + 3SO2 + 6h3O
Fe + 6HNO3 =ot=> Fe(NO3)3 + 3NO2 + 3h3O
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
Коррозия (ржавление) железа
На влажном воздухе железо весьма быстро подвергается ржавлению:
4Fe + 6h3O + 3O2 = 4Fe(OH)3
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 оС). т.е.:
scienceforyou.ru
Химия d-элементов (медь, серебро, цинк, хром, марганец, железо) – HIMI4KA

Медь находится в четвертом периоде, группе IБ. Ее электронная формула 29Cu 1s22s22p63s23p63d104s1, наиболее устойчивые степени окисления +2 и +1. Медь в промышленности получают пирометаллургическим методом, что можно описать следующим уравнением:
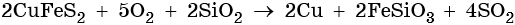
Полученную медь называют черновой (содержание меди 95–98%). Затем медь подвергают электролитическому рафинированию для получения меди высокой чистоты. Металл малой активности, в ряду напряжений металлов медь расположена после водорода. Ее химические свойства:
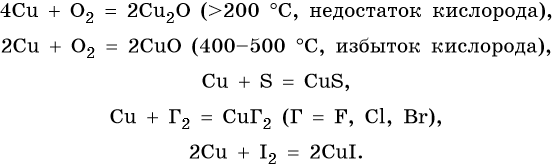
Йодид меди (II) не существует. Попытки получить его реакциями обмена приводят к иодиду меди (I) и йоду, например:
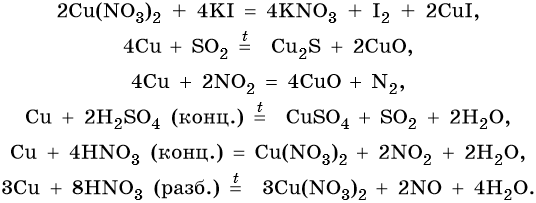
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому с разбавленной соляной кислотой она не реагирует. Однако с концентрированной соляной кислотой она взаимодействует с образованием дихлоркупрата (I) водорода:
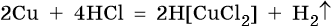
Кроме того, медь способна взаимодействовать с соляной кислотой в присутствии кислорода воздуха:
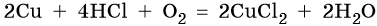
Медь образует оксиды состава Cu2O, CuO. Первый проявляет основные, а второй амфотерные с преобладанием основных свойства. Оба оксида легко восстанавливаются до меди под действием различных восстановителей:
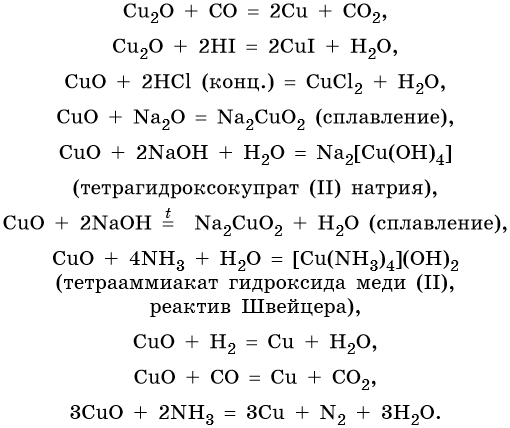
Гидроксид меди (II) Cu(OH)2 разлагается при нагревании, проявляет амфотерные свойства с преобладанием основных:
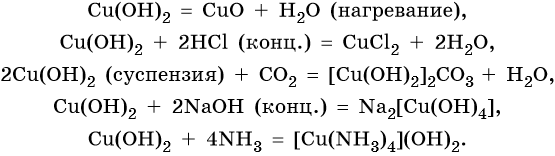
Серебро находится в пятом периоде, группе IБ. Его электронная формула 1s22s22p63s23p63d104s24p64d105s1. В промышленности серебро получают комплексной переработкой полиметаллических руд. Химические реакции, характерные для серебра:
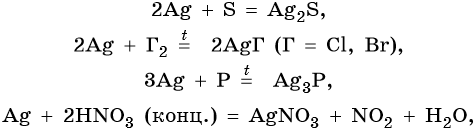
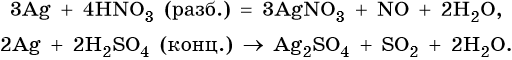
Оксид серебра Ag2O — термически нестабильный, типичный основный оксид. Его химические свойства:
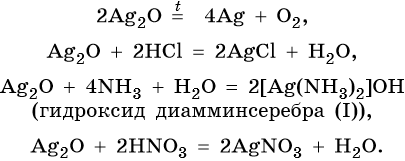
Цинк находится в четвертом периоде, группе IIБ. Его электронная формула 30Zn 1s22s22p63s23p63d104s2. В промышленности цинк получают либо электролизом водного раствора его сульфата, либо пирометаллургическим методом: сернистые руды подвергают обжигу с последующим восстановлением оксида цинка коксом:
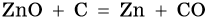
Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2. Характерные для цинка химические реакции:
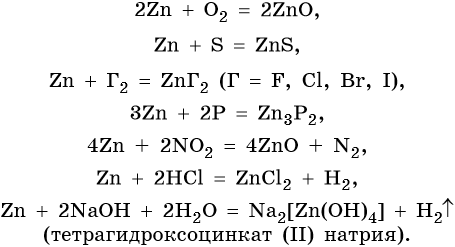
Особенностью цинка являются его реакции с серной и азотной кислотами различной концентрации. При этом в зависимости от концентрации кислот образуются различные продукты реакции:
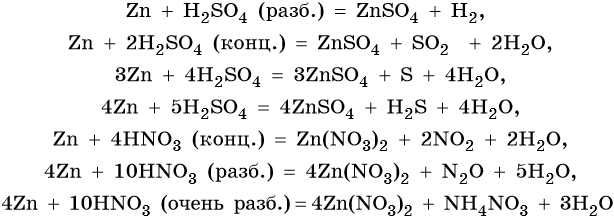
Оксид и гидроксид цинка являются амфотерными. Их характерные реакции:
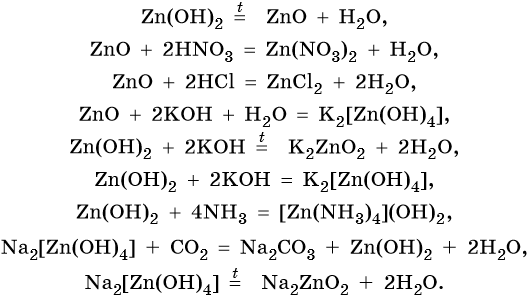
Хром расположен в четвертом периоде, группе VIБ. Его электронная формула 24Cr 1s22s22p63s23p63d54s1. Металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. В промышленности чистый хром получают восстановлением оксида хрома методом алюминотермии:
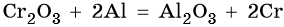
Его характерные химические реакции:
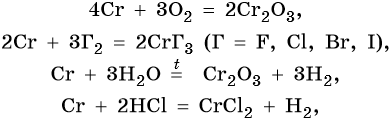
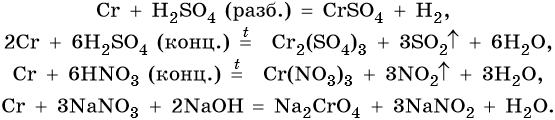
Хром образует ряд оксидов: CrO — основный оксид, Cr2O3 — амфотерный оксид, CrO3 — кислотный оксид, следовательно, рост степени окисления сопровождается усилением кислотных свойств. Все оксиды хрома вступают в окислительно-восстановительные реакции.
Ниже приведены характерные для этих соединений химические реакции:
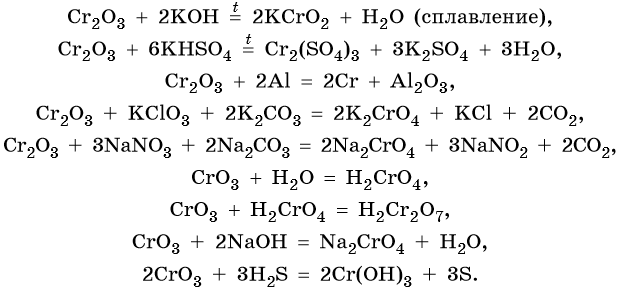
Гидроксид хрома (III) проявляет амфотерные свойства, вступает в окислительно-восстановительные реакции:
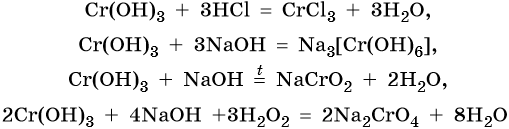
Марганец расположен в четвертом периоде, группе VIIБ, Периодической системы Д.И. Менделеева. Его электронная формула 1s22s22p63s23p63d54s2. Характерные степени окисления марганца +2, +4, +6 и +7. В чистом виде марганец получают термическим восстановлением оксидов или галогенидов водородом, натрием, магнием, алюминием, углеродом или кремнием (метод кремнийтермии):
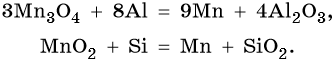
Особо чистый марганец получают электролизом водного раствора сульфата марганца (II).
Химические свойства марганца:
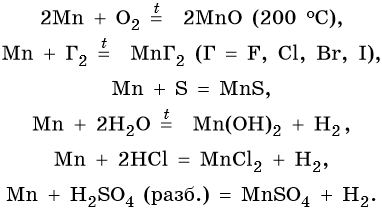
Марганец образует пять оксидов: MnO, Mn2O3, MnO2, MnO3, Mn2O7. MnO проявляет основные свойства. Mn2O3 при взаимодействии с разбавленными растворами кислот диспропорционирует, а при нагревании с концентрированными растворами кислот выделяет кислород:
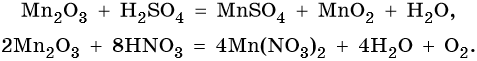
MnO2 не взаимодействует ни со щелочами, ни с разбавленными растворами кислот. С концентрированными кислотами при нагревании реагирует так же, как и Mn2O3:
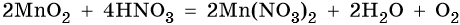
Mn2O7 — единственный среди оксидов марганца, который является жидкостью при нормальных условиях. Кислотный оксид. Разлагается уже при температуре 55 °С, при ударе может взорваться.
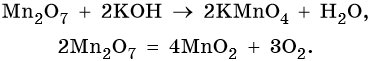
Железо находится в четвертом периоде, группе VIIIБ. Его электронная формула 26Fe 1s22s22p63s23p63d64s2. Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6. Они являются сильными окислителями. Химически чистое железо получают разложением его пентакарбонила:
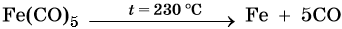
Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах. Упрощенно этот процесс можно описать уравнением:
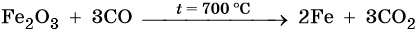
Характерные для железа химические реакции:
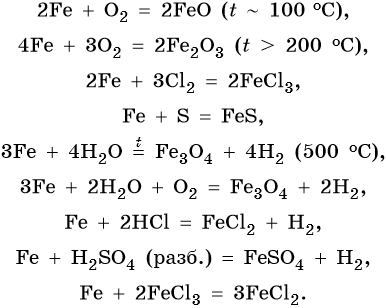
FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции:
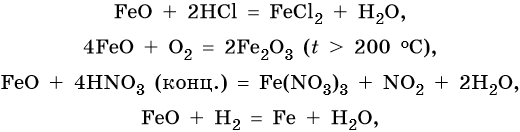
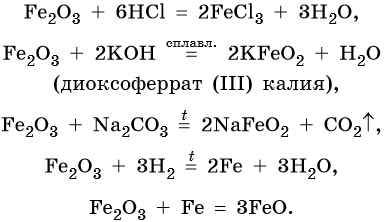
Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут также, как и у входящих индивидуально в его состав оксидов:
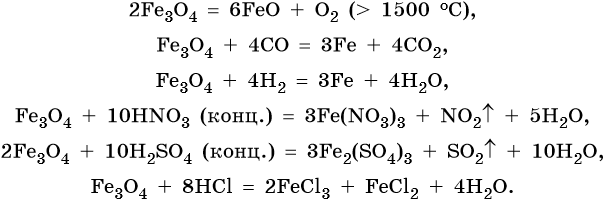
Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
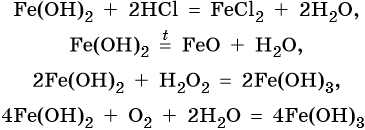
Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
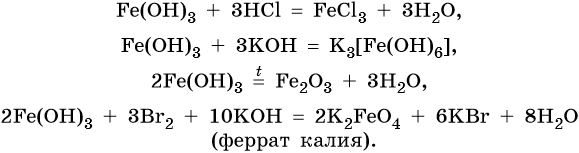
Йодид железа (III) не существует. Попытки получить его обменными реакциями приводят к йодиду железа (II) и йоду:
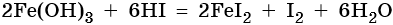
himi4ka.ru












